土壤盐渍化不仅会导致土壤板结,肥力下降,还会影响作物根系发育,不利于作物吸收养分,造成作物产量和品质下降[1],已成为影响作物产量、危害土壤生产力的全球性问题之一[2]。2023年中央一号文件《中共中央、国务院关于做好2023年全面推进乡村振兴重点工作的意见》指出,要“持续推动由主要治理盐碱地适应作物向更多选育耐盐碱植物适应盐碱地转变”,因此通过生物学手段增强作物耐盐能力是充分利用盐碱地等耕地后备资源的重要途径。脯氨酸是一种重要的渗透调节物质,植物在盐胁迫条件下可通过合成脯氨酸促进细胞渗透平衡,因此脯氨酸积累量是植物受盐胁迫伤害程度的重要指示因子之一[3]。除此之外,植物还能通过招募根际益生菌缓解盐胁迫,相较通过周期较长的育种手段培育耐盐作物品种,通过根际微生物提高作物的耐盐能力更为快速有效[4-5]。
植物根际是根系自身生命活动和代谢对土壤影响最直接、最强烈的区域[6],根际微生物与土壤微生物显著不同,土壤中仅有7%的微生物种类能够在根际周围富集[7]。在长期共存和进化过程中,植物和根际微生物形成了特定的互作关系[8]。在农业生产上,利用根际微生物开发的菌剂和生物有机肥在促进作物生长发育和改善土壤环境中均取得了良好的效果[9]。相较于添加其他来源的微生物,从根际原位分离植物匹配的益生菌定殖能力更强,更能满足植物不同的功能需求。
研究表明,作物根际微生物群落组成不仅受土壤环境条件的影响[10],还会受到作物基因型影响[11],因此筛选作物匹配的根际益生菌资源有助于提高益生菌作用效果。本研究基于耐盐水稻根际微生物组学分析结果,指导筛选根际核心功能菌株,成功从耐盐水稻根际分离出两株核心菌株普氏假单胞菌P34和大安金黄杆菌C18,盆栽试验证明菌株作为直接接种剂或种子包衣剂均能显著提高水稻耐盐能力。本研究将为开发盐碱地专用的种子包衣剂和微生物肥料提供优选菌株。
1 材料与方法 1.1 供试材料以实验室典型水稻耐盐品种“湖南籼”和盐敏感品种“南粳46”为供试材料。供试土壤采用连云港市农业科学院(34°61′ N,119°2′ E)稻田的盐碱土。需要灭菌的土壤用自封袋将土壤进行封装后,委托生物公司进行γ射线(50 kGy)灭菌,作为灭菌土使用。
1.2 试验设计盆栽试验于江苏省南京市南京农业大学资源与环境科学学院温室进行,实验周期为28 d,实验设置灭菌土和自然土两个处理,每种土壤设置两个盐胁迫浓度(4.5 g·kg–1和6.5 g·kg–1)。将表面灭菌的水稻种子置于培养基(1/2 Murashig-Skoog(MS)培养基+3 g·L–1植物凝胶(Phytagel plantcell))中催芽7 d。选取长势一致的水稻幼苗移栽至装有不同土壤的培养瓶中,每个培养瓶口用封口膜封闭,以保持培养体系与外界无微生物交换。所有培养瓶置于室温培养,适当浇水保持土壤水分(浇水在超净台进行)。21 d后测定水稻植株的各项生理生化指标,将经过胁迫处理的水稻植株从土壤中连根取出,用去离子水冲洗干净,测量植株的株高和根长并记录,同时对植株进行扫描拍照。
采用茚三酮显色法测定叶片中脯氨酸的含量[12],称取不同处理的叶片各0.5 g进行测定,以甲苯为空白对照,在分光光度计(722N,INESA,上海)520 nm波长处测其吸光值,每处理测量4个生物学重复。
1.3 水稻根际土壤采集、DNA提取及高通量测序取出水稻植株及根系连带土壤,小心剥离根系连带的大块土壤,直至根系周围剩余约1 mm左右、紧紧附着于根系的土壤;将水稻根系完整剪下,置于装有30 mL灭菌磷酸盐(PBS-S)缓冲液(1 L︰6.33 g NaH2PO4·H2O,16.5 g Na2HPO4·7H2O,200 μL SilwetL-77)的50 mL离心管中,置于摇床振荡(180 r·min–1,室温)20 min,过100 μm尼龙细胞过滤器,过滤去除细小植物根系,将滤液以3 500 g离心15 min,弃去上层清液后,用1 mL PBS-S缓冲液重悬沉淀,转移至灭菌的2 mL离心管中,在10 000 g下离心10 min,去除上清液,沉淀即为根际土壤。用QIAGEN DNeasy PowerSoil Kit试剂盒提取DNA。采用引物799F(5’-AACMGGATTAGATACCCKG-3’)和1193R(5’-ACGTCATCCCCACCTTCC-3’)对16S rRNA基因V5~V7区域进行扩增子测序,测序使用Illumina Miseq PE 2000平台。PCR扩增及扩增子测序由苏州金唯智生物科技有限公司(GENEWIZ,江苏苏州)完成。
1.4 水稻根际菌种资源库构建通过宏培养组学方法,将耐盐品种湖南籼的根际土壤样品用10 mmol·L–1的MgCl2溶液进行极限稀释,选择最佳稀释梯度为10–6和10–7的悬浊液在96孔板中培养,培养基为胰蛋白胨大豆肉汤(Tryptic Soy Broth,TSB)培养基(胰蛋白胨15 g,大豆蛋白胨5 g,氯化钠5 g,琼脂粉20 g,121℃灭菌20 min,pH 7.2)。室温静置培养14 d后,选取微生物生长比例为30%~50%的96孔板,在无菌环境下从生长微生物的菌孔中吸取菌液,首先用引物799F和1193R对16S rRNA基因的可变区V5~V7进行聚合酶链式反应扩增,用琼脂凝胶电泳验证PCR结果,并用AMPure XP试剂盒(Beckman Coulter,美国)进行纯化;将纯化后的DNA稀释至10 ng·μL–1作为模板,用Illumina测序平台兼容引物进行第二步PCR,每个样品取200 ng进行文库构建,并在HiSeq 2500平台(Illumina Inc.,美国)进行测序。同时进行菌种保存,从与PCR对应的菌孔中吸取80 μL菌液加入含有80 μL 40%甘油的PCR管中,轻轻吹吸混匀,写好标记置于–80℃冰箱进行菌种保存,以此获得水稻根系菌种资源库[13]。
1.5 水稻发芽胁迫临界盐浓度确定选取饱满的、大小一致的南粳46种子进行表面消毒,将消毒后的水稻种子置于含有不同盐浓度(0、40、80、120、160、200、240 mmol·L–1)的无菌湿润滤纸的培养皿内,置于25℃光照培养箱内发芽,昼夜比为16 h/8 h。培养3 d后,统计不同盐浓度下水稻发芽势(发芽势/%=(发芽第3天正常发芽的种子数/供试种子数)×100)。培养7 d后,统计不同盐浓度下水稻的发芽率(发芽率/%=(发芽第7天的正常发芽种子数/供试种子数)×100)。根据种子发芽势和发芽率随盐度变化特征明确水稻发芽胁迫临界盐浓度。
1.6 盐胁迫下促进水稻生长的根际微生物筛选发芽试验:将表面消毒后的南粳46水稻种子分别置于含有发芽胁迫临界盐浓度的无菌湿润滤纸的培养皿中。选取水稻根际菌种资源库中全部鉴定为黄杆菌科(Flavobacteriaceae)和假单胞菌科(Pseudomonadaceae)的细菌于TSB液体培养基中培养至OD600=1.0,每个处理水稻种子正上方滴加相应菌液100 μL,同时以不加盐不加菌处理和加盐不加菌处理分别作为对照。培养皿置于25℃光照培养箱中避光发芽,第3天和7天分别统计种子的发芽势和发芽率,筛选出能在高盐浓度胁迫下促进水稻发芽的根际促生菌。
水培试验:南粳46水稻种子经过表面消毒和催芽后,选取发芽状态一致的南粳46种子移栽至含有1 L霍格兰(Hoagland)营养液(磷酸二氢氨0.115 g,七水合硫酸镁0.242 g,硝酸钾0.605 g,四水合硝酸钙1.359 g,二水合氯化钙0.181 g,铁盐(乙二胺四乙酸二钠30.78 mg,七水合硫酸亚铁27.75 mg),硼酸7.2 mg,二水合氯化铜0.2 mg,四水合氯化锰4.5 mg,氯化锌0.6 mg,一水合钼酸铵0.098 mg,蒸馏水定容至1 000 mL,pH 6.0)的水培盒中,每三天更换一次营养液,培养至三叶一心进行水培试验。选取发芽试验中效果较好的菌株于TSB液体培养基中培养至OD600=1.0,将菌液离心后用等体积的无菌Hoagland营养液进行菌体重悬,获得菌悬液。选取长势一致的水稻幼苗于菌悬液中浸根24 h(对照处理仅用Hoagland营养液浸根),移栽至含有发芽胁迫临界盐浓度的Hoagland营养液中进行盐胁迫处理,每处理6个重复,每3天更换一次营养液,培养1周后拍照并检测各项指标。
1.7 菌株促生耐盐效果验证盆栽试验:选取长势一致的南粳46水稻幼苗,移栽至含盐量为4.5 g·kg–1和6.5 g·kg–1的灭菌盐土内,无菌环境培养一周后,取两种促生菌的菌悬液均匀浇灌至水稻根系周围,接种浓度为108 CFU·g–1土。以不加盐的自然土壤作为无盐胁迫对照,以不接菌的灭菌盐土作为盐胁迫对照,对照组浇入相同体积的无菌水。培养钵置于30℃和16 h/8 h光照培养条件下培养,4周后测定水稻植株的各项生理生化指标。
种子包衣试验:按照成膜剂:菌粉:显色剂为1︰1︰2的比例混合制成种衣剂,设置有效活菌数分别为每粒104 CFU、105 CFU和106 CFU的包衣菌剂浓度,将包裹好的南粳46种子置于阴凉处风干30 min成膜后,栽种至含有5 g·kg–1 NaCl浓度的灭菌盐土中,分别以未包衣的种子和仅包衣但不添加菌粉的种子作为对照。培养钵置于30℃和16 h /8 h光照培养条件下培养4周后测定水稻植株的各项生理生化指标。
1.8 数据处理使用Excel 2021和GraphPad Prism 8对数据进行统计和绘图,用SPSS 22.0软件单因素方差分析(ANOVA)样本之间的差异,用邓肯(Duncan)检验比较处理间的差异,P < 0.05为差异显著。
高通量测序数据的处理使用USEARCH 10.0和VSEARCH 2.13.6软件进行分析。主要步骤包括使用VSEARCH中“fastq_mergepairs”指令对双端测序(Paired-end)结果进行拼接,然后切除引物(-fastq_filter)并去冗余(-derep_fulllength);之后通过“usearch-unoise3”指令使用ASV(Amplicon Sequence Variants)非聚类去噪法对经过筛选的高质量序列进行聚类并计数,调整ASV前缀格式(format ASV prefix);利用指令“cluster_otus”对经过简化的序列去除单个序列和嵌合体后,利用指令“makeudb_ sintax”构建基于RDP的数据库,并利用“sintax”和“otutab”指令得到ASV表格及分类信息,并以此ASV表格及分类信息用作后续的分析。微生物群落差异分析采用R包edgeR实现,显著性检验采用多元方差分析(Adonis),可视化采用R包ggplot2实现。细菌群落共现网络分析首先选用相对丰度高于0.1%的细菌科,再通过R语言igraph程序包进行相关性分析,选择斯皮尔曼等级相关系数(Spearman)|r| > 0.8和P < 0.05的关系,最后基于Gephi软件绘制相关性网络图。
2 结果 2.1 根际微生物提高水稻耐盐胁迫的生理特征随着土壤中NaCl浓度提高,水稻株高和根长逐渐降低,脯氨酸含量逐渐升高(图 1)。在4.5 g·kg–1盐浓度时,自然土壤中水稻的生长状况均显著优于灭菌土壤,湖南籼和南粳46在自然土壤中的株高分别较灭菌土壤高4.40 cm和4.53 cm,根长分别长5.47 cm和5.97 cm,脯氨酸含量分别低29.91%和22.78%;在6.5 g·kg–1盐浓度时,自然土壤中湖南籼的生长状况显著优于灭菌土壤,自然土壤中湖南籼的株高和根长分别较灭菌土壤增加4.70 cm和5.23 cm,脯氨酸含量降低32.69%;而南粳46在两种土壤中仅根长有显著差异,自然土壤中南粳46的根长较灭菌土壤增加4.6 cm,而株高和脯氨酸含量无显著差异。根据以上结果推测,湖南籼在自然土壤中耐盐能力显著提高可能是其根际招募了能提高其耐盐能力的土壤微生物,而南粳46受盐胁迫程度的关键脯氨酸含量指标差异较小,表明根际微生物对提高南粳46耐盐能力的作用有限,因此有望通过比较湖南籼和南粳46的根际微生物群落特征挖掘提高水稻耐盐性的根际关键功能细菌。
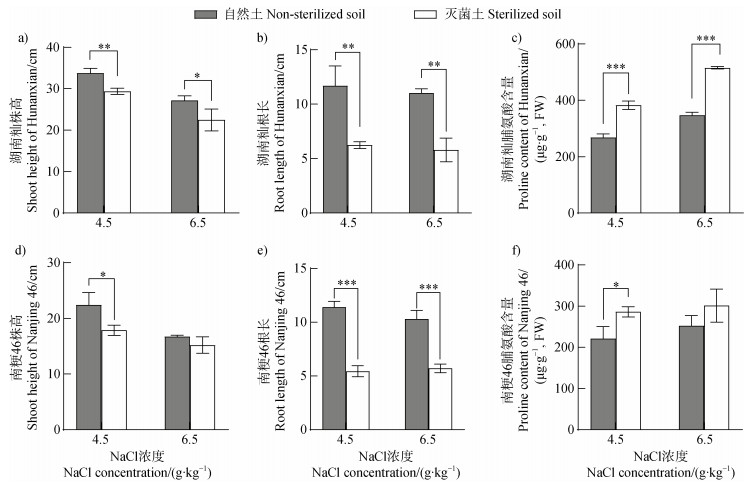
|
注:事后比较采用邓肯法;*:显著性水平P = 0.05;**:显著性水平P = 0.01;***:显著性水平P = 0.001。下同。 Note: Duncan method was used for post-hoc comparison; *: significance level P = 0.05;**: significance level P = 0.01;***: significance level P = 0.001. The same as below. 图 1 水稻在不同盐浓度自然土和灭菌土中的生长表型(a. 湖南籼株高;b. 湖南籼根长;c. 湖南籼脯氨酸含量;d. 南粳46株高;e. 南粳46根长;f. 南粳46脯氨酸含量) Fig. 1 Growth phenotypes of rice in non-sterilized and sterilized soils under different salt concentrations (a. Shoot height of Hunanxian; b. Root length of Hunanxian; c. Proline content of Hunanxian; d. Shoot height of Nanjing 46;e. Root length of Nanjing 46;f. Proline content of Nanjing 46) |
为了获得耐盐水稻品种根际特异性富集的细菌类群,本研究通过差异组分分析比较耐盐和盐敏感品种根际细菌群落组成差异。与盐敏感品种相比,耐盐水稻品种在4.5 g·kg–1盐浓度土壤中显著富集的根际类群共10个,包括黄单胞菌科(Xanthomonadaceae)、噬几丁质菌科(Chitinophagaceae)、除硫单胞菌科(Desulfuromonadaceae)、草酸杆菌科(Oxalobacteraceae)、火色杆菌科(Flammeovirgaceae)、噬纤维细菌科(Cytophagaceae)、噬菌弧菌科(Bacteriovoracaceae)、毛螺菌科(Lachnospiraceae)、螺旋体科(Spirochaetaceae)、黄杆菌科(Flavobacteriaceae)(图 2a);在6.5 g·kg–1NaCl盐浓度土壤中显著富集的根际类群共6个,包括盐单胞菌科(Halomonadaceae)、着色菌科(Chromatiaceae)、Kordiimonadaceae、鱼立克次体科(Piscirickettsiaceae)、长杆菌科(Prolixibacteraceae)、黄杆菌科(Flavobacteriaceae);其中黄杆菌科是湖南籼根际共同富集的特异性细菌类群。
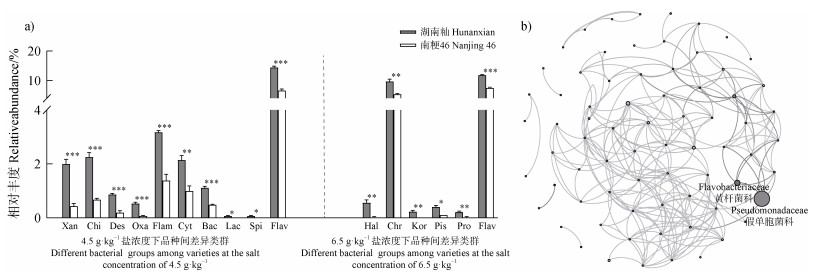
|
注:Xan、Chi、Des、Oxa、Flam、Cyt、Bac、Lac、Spi、Flav、Hal、Chr、Kor、Pis和Pro分别代表黄单胞菌科、噬几丁质菌科、除硫单胞菌科、草酸杆菌科、火色杆菌科、噬纤维细菌科、噬菌弧菌科、毛螺菌科、螺旋体科、黄杆菌科、盐单胞菌科、着色菌科、Kordiimonadaceae、鱼立克次体科和长杆菌科。 Note: Xan, Chi, Des, Oxa, Flam, Cyt, Bac, Lac, Spi, Flav, Hal, Chr, Kor, Pis and Pro represent Xanthomonadaceae, Chitinophagaceae, Desulfuromonadaceae, Oxalobacteraceae, Flammeovirgaceae, Cytophagacea, Bacteriovoracaceae, Lachnospiraceae, Spirochaetaceae, Flavobacteriaceae, Halomonadaceae, Chromatiaceae, Kordiimonadaceae, Piscirickettsiaceae and Prolixibacteraceae, respectively. 图 2 水稻根际细菌群落差异类群和共现网络分析(a. 差异细菌类群在湖南籼和南粳46根际富集的相对丰度;b. 水稻根际微生物组分类学的网络分析) Fig. 2 Compositional variation and co-occurrence network analyses of the rhizosphere bacterial communities of rice (a. Relative abundance of different bacterial groups enriched in the rhizosphere of Hunanxian and Nanjing 46;b. Co-occurrence network analysis of rice rhizosphere microbiome) |
为了获得水稻根际与黄杆菌科相关性较强的类群,本研究进一步对水稻根际微生物群落进行共现网络分析(图 2b),发现与黄杆菌科呈正相关的共有6个类群,分别为肠杆菌科(Enterobacteriaceae)、生丝微菌科(Hyphomicrobiaceae)、毛螺菌科(Lachnospiraceae)、螺旋体科(Spirochaetaceae)、噬菌弧菌科(Bacteriovoracaceae)、假单胞菌科(Pseudomonadaceae),它们在湖南籼根际细菌群落中的相对丰度分别为0.08%、0.53%、0.04%、0.04%、0.95%、48.44%,与黄杆菌科相对丰度均呈显著正相关(P < 0.05),相关性系数分别为0.985、0.850、0.939、0.939、0.970、0.985,其中假单胞菌科在湖南籼根际相对丰度最高,且与黄杆菌科的相关系数最高。根据以上结果,确定黄杆菌科和假单胞菌科为湖南籼根际显著富集的特异性细菌类群。
2.3 提高水稻耐盐能力的根际核心菌株筛选与鉴定盐分浓度较低时,水稻种子发芽情况良好。随着盐分浓度升高,水稻种子的发芽势和发芽率呈现下降趋势。当盐浓度达到160 mmol·L–1时发芽势和发芽率明显降低,并且在更高盐分浓度下(200 mmol·L–1和240 mmol·L–1),水稻种子发芽受到严重抑制,发芽势和发芽率接近于零(图 3)。根据以上结果确定水稻发芽的盐胁迫临界浓度为160 mmol·L–1。
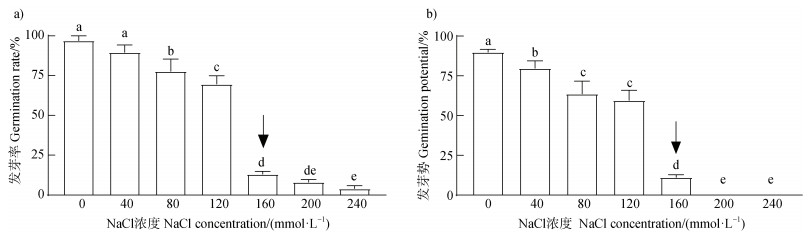
|
注:不同小写字母表示显著性差异(Duncan-test,P < 0.05)。下同。 Note: Different letters represent significant differences (Duncan-test, P < 0.05). The same as below. 图 3 不同盐浓度对水稻发芽率(a)和发芽势(b)的影响 Fig. 3 Effects of different salt concentrations on the seed germination rate (a) and germination potential (b) of rice |
从水稻根际细菌资源库中筛选出20株黄杆菌科和13株假单胞菌科的菌株,在160 mmol·L–1盐分浓度下探究菌株对盐敏感水稻品种(南粳46)发芽和生长的影响。结果表明,与不接种菌株相比,有7株菌能显著提高南粳46的发芽率,发芽率可提高约1.33倍,黄杆菌科中效果最好的菌株是C18,假单胞菌科中效果最好的菌株为P34(图 4a)。进一步分析7株优异菌对水稻生长的影响,发现接种菌株均能显著提高水稻耐盐能力并促进水稻生长(图 4b),其中C18和P34两株菌的效果最佳,接种C18和P34的水稻株高分别较不接菌对照增加了7.27 cm和5.50 cm(图 4c),脯氨酸含量分别降低了59.54%和69.22%(图 4d)。
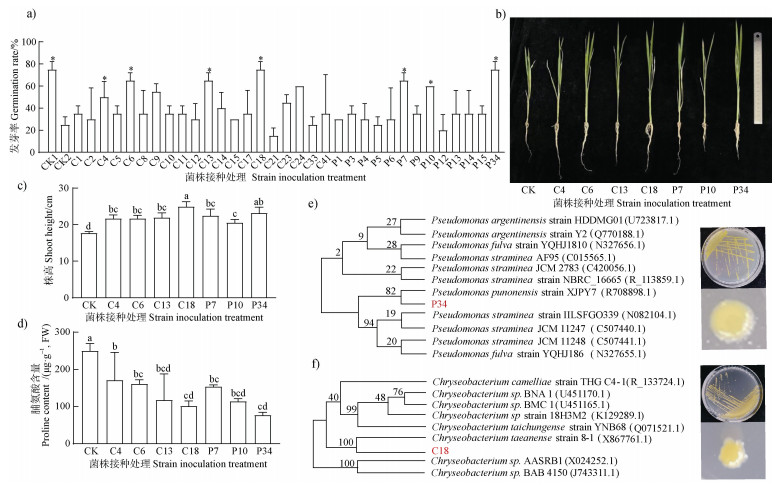
|
注:横坐标中CX表示水稻根际细菌资源库中鉴定为黄杆菌科的不同菌株,PX表示鉴定为假单胞菌科的不同菌株。CK1表示不加盐不加菌的处理,CK2表示加盐不加菌的处理;*表示发芽率显著高于CK2的接菌处理(Duncan-test,P < 0.05)。 Note: In the horizontal coordinate, CX represents the bacterial strains classified as Flavobacteriaceae, and PX represents the bacterial strains classified as Pseudomonadaceae among all of the isolated bacterial strains in the rice rhizosphere. CK1 represents the treatment that does not add salt and bacteria, CK2 represents the treatment that adds salt without bacteria; *indicated that the germination rate was significantly higher than that of CK2 inoculation (Duncan-test, P < 0.05). 图 4 盐胁迫下根际黄杆菌和假单胞菌对水稻生长的影响及高效菌株鉴定(a. 发芽率;b. 水稻幼苗形态;c. 株高;d. 脯氨酸含量;e. 菌株P34 16S rRNA序列系统发育树;f. 菌株C18 16S rRNA序列系统发育树) Fig. 4 Effects of rhizosphere Flavobacteriaceae and Pseudomonadaceae strains on rice growth under salt stress and identification of the efficient strains (a. Germination rate; b. Plant morphology of rice seedling; c. Shoot height; d. Proline content; e. Phylogenetic tree of 16S rRNA sequences of strains P34;f. Phylogenetic tree of 16S rRNA sequences of strains C18) |
菌株P34在28℃ TSB固体培养基培养48 h,菌落呈淡黄色不透明,表面粗糙,有隆起,边缘不规则。菌株C18在28℃ TSB固体培养基中培养72 h,菌落呈金黄色透明,表面光滑,平整,边缘规则。将菌株P34和C18的16S rRNA基因序列与NCBI(美国国家生物技术信息中心)数据库比对分析并构建系统发育树,确定菌株P34为普氏假单胞菌(P. punonensis)(图 4e),菌株C18为大安金黄杆菌(C. taeanense)(图 4f)。
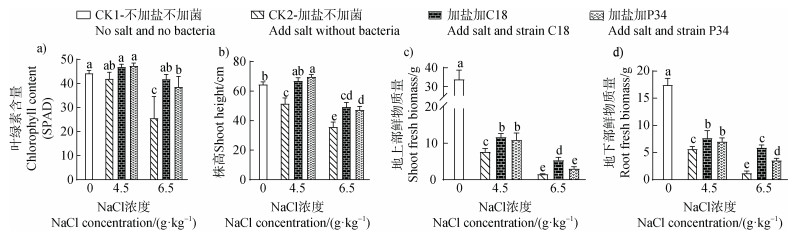
2.4 功能菌株提高水稻耐盐能力的效果评价接种C18和P34菌株能显著提高盐敏感水稻的叶绿素含量、株高和鲜物质量(图 5)。在4.5 g·kg–1盐浓度时,与不接菌的盐土相比,接种C18菌株后水稻叶绿素含量、株高、地上部鲜物质量及地下部鲜物质量分别显著增加11.64%、29.96%、52.36%和35.93%,接种P34菌株后分别显著增加12.87%、35.23%、41.77%和24.59%。在6.5 g·kg–1盐浓度时,与不接菌的盐土相比,接种C18菌株后水稻叶绿素含量、株高、地上部鲜物质量及地下部鲜物质量分别显著增加63.16%、37.98%、248.1%和374.8%;接种P34菌株后分别显著增加50.49%、32.29%、99.78%和187.1%。外源接种C18和P34菌株均能显著提高水稻耐盐能力,并且盐浓度越高,菌株的作用效果越明显。
|
图 5 不同浓度盐胁迫下接种促生菌对水稻生长的影响(a. 叶绿素含量;b. 株高;c. 地上部鲜物质量;d. 地下部鲜物质量) Fig. 5 Effects of growth-promoting bacteria on rice growth under different levels of salt stress (a. Chlorophyll content; b. Shoot height; c. Shoot fresh biomass; d. Root fresh biomass) |
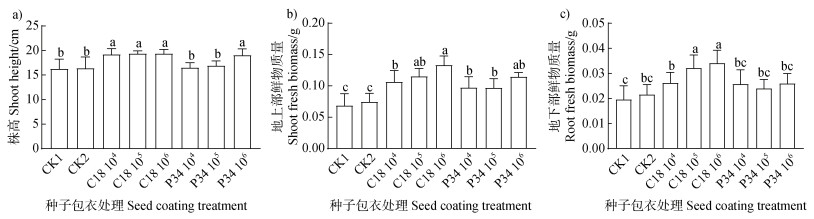
未包衣和不添加菌种的包衣处理中水稻各项指标均最低且无显著差异,表明种子包衣所用的成膜剂和显色剂对水稻耐盐性无影响。添加C18和P34菌株进行种子包衣后对水稻株高和鲜物质量均有明显的促进作用。与不添加菌种的包衣水稻相比,添加每粒104 CFU、105 CFU、106 CFU浓度的C18菌株种子包衣分别使水稻株高增加8.59%、18.19%和17.99%;地上部鲜物质量分别增加23.29%、54.56%和78.79%;地下部鲜物质量分别增加10.76%、48.75%和57.69%。添加每粒104 CFU、105 CFU、106 CFU浓度的P34菌株种子包衣分别使水稻株高增加0.61%、3.15%和16.26%;地上部鲜物质量分别增加30.34%、30.27%和53.72%;地下部鲜物质量分别增加19.23%、11.06%和20.15%(图 6)。以上结果表明,用C18和P34菌株制成的种子包衣能促进水稻在盐胁迫下生长,包衣的活菌数越多,作用效果越好。
|
注:C18 104、C18 105、C18 106表示菌株C18有效活菌数分别为每粒104 CFU、105 CFU和106 CFU;P34 104、P34 105、P34 106表示菌株P34有效活菌数分别为每粒104 CFU、105 CFU和106 CFU;CK1表示未包衣的处理,CK2表示包衣不加菌粉的处理。 Note: C18 104, C18 105 and C18 106 indicated that the effective viable count of strain C18 was 104 CFU per grain, 105 CFU per grain and 106 CFU per grain, respectively; P34 104, P34 105 and P34 106 indicated that the effective viable count of strain P34 was 104 CFU per grain, 105 CFU per grain and 106 CFU per grain, respectively. CK1 represents the treatment without coating, CK2 represents the treatment of coating without adding bacteria. 图 6 盐胁迫下种子包衣对水稻生长的影响(a. 株高;b. 地上部鲜物质量;c. 地下部鲜物质量) Fig. 6 Effects of seed coating on rice growth under salt stress (a. Shoot height; b. Shoot fresh biomass; c. Root fresh biomass) |
盐分胁迫不仅会抑制植物生长发育,还会造成渗透胁迫和干扰营养离子平衡[14-15]。植物脯氨酸的合成和积累是一个受非生物胁迫影响的生理生化过程,许多植物在遭受盐胁迫时均会积累高水平的脯氨酸,因此有学者把脯氨酸在盐胁迫下的积累作为作物耐盐胁迫的重要生理指标[16]。Sarkar等[17]研究证明接种肠杆菌P23菌株能显著提高水稻耐盐能力,降低水稻脯氨酸含量,促进水稻在盐胁迫下的生长。土壤微生物组是作物根际微生物组的“种子库(Seed bank)”,直接决定了根际微生物组成[18],本研究中自然土壤种植的水稻脯氨酸含量低于灭菌土壤(图 1c和图 1f),表明土壤中存在关键微生物能在水稻根际高效定殖并提高水稻的耐盐胁迫能力。
增强植物耐盐胁迫能力的根际促生菌(HT-PGPR,Halotorlerant plant growth promoting rhizobacteria)能够通过合成次级代谢产物或调节植物响应盐胁迫的相关信号通路增强植物耐盐胁迫的能力。本研究分离的普氏假单胞菌P34和大安金黄杆菌C18具有提高水稻耐盐胁迫的能力。假单胞菌属是一类常见的根际促生细菌,具有较强的根部定殖能力,并且能产生有益的酶和代谢物,帮助植物抵抗非生物胁迫[19]。近年来,已有很多研究证实了假单胞菌在促进植物耐盐方面的作用,Kang等[20]以及Singh等[21]在水稻和玉米等作物上的研究均证明了假单胞菌在盐胁迫下对植物生长的促进作用。根际恶臭假单胞菌KT2440能减轻盐胁迫对柑橘的伤害,降低柑橘植株内脯氨酸、脱落酸和水杨酸含量[22]。还有一些内生假单胞菌OFT5和OFT2能通过表达1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylate,ACC)活性,降低番茄幼苗中乙烯合成,恢复幼苗的生长,从而改善番茄的生长、光合性能和离子平衡,对盐胁迫下番茄植株生长和生理活性具有良好的改善作用[23]。金黄杆菌属也是植物根际微生物群落的重要成员,已有大量的研究证明了金黄杆菌属的菌株在抑制植物病原真菌方面的作用[24],但在增强植物耐盐胁迫方面的报道较少。有研究发现金黄杆菌SUK具有ACC脱氨酶活性,在盐胁迫条件下,接种菌株SUK能显著提高小麦植株的株高、干鲜物质量、叶绿素含量,并降低脯氨酸水平[25]。除此之外,还有大量的研究表明固氮螺菌属、芽孢杆菌属、伯克氏菌属、肠杆菌属、微杆菌属、根瘤菌和克雷伯氏杆菌属等类群的部分菌株也能够增强植物耐盐胁迫能力[26-27]。由此可见,作物根际广泛分布着各类能够提高作物耐盐能力的益生菌,但可能具有高度的宿主特异性[28],因此需要筛选作物匹配的关键类群并开发其作用潜力。本研究发现在根际环境中假单胞菌科(Pseudomonadaceae)与黄杆菌科(Flavobacteriaceae)的相关性最高(图 2b),说明这两个类群能够在根际环境中稳定共生,但是本研究最终获得的两株功能微生物C18和P34之间的互作关系尚不明确,未来尚需探究能否通过多菌合作来进一步增强水稻的耐盐胁迫能力。
微生物肥料能够改良土壤性状,增强作物抗逆性,提高农产品的品质和产量,在农业生产中发挥重要作用。利用耐盐根际促生菌开发的生物有机肥能够增强盐胁迫下一些作物如玉米、棉花、苜蓿、甘蓝等的生长[29-31],但是对于盐碱地专用的作物增产微生物肥料研究仍比较缺乏。种子包衣是目前一种增加作物产量、促进农业增产增收的新兴技术,虽然发展不足百年,但是已经在世界范围内得到广泛应用[32]。大量的研究证明种子包衣能够有效防止病虫害、促进幼苗生长、增加农作物产量[33],然而利用功能菌种进行种子包衣的研究仍处于起步阶段。本研究中获得的两株根际促生菌C18和P34通过直接添加和制成种子包衣两种途径,均能显著提高水稻的耐盐胁迫能力(图 5和图 6),具备开发成为盐碱地专用的种子包衣及微生物肥料的潜力,未来将通过田间试验验证两株菌在农田开放环境条件下的应用效果。
4 结论根际微生物在提高水稻耐盐能力方面具有重要作用。黄杆菌科(Flavobacteriaceae)和假单胞菌科(Pseudomonadaceae)是耐盐水稻根际细菌群落中的关键类群,从耐盐水稻根际原位分离的普氏假单胞菌P34和大安金黄杆菌C18能显著提高水稻的耐盐胁迫能力,可开发为盐碱地水稻栽培的专用菌剂。
| [1] |
Xie X F, Pu L J, Shen H Y, et al. Dynamics and prediction of soil salinization parameters under the amelioration of heavy coastal saline-alkali land (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(6): 1504-1516. [解雪峰, 濮励杰, 沈洪运, 等. 滨海重度盐碱地改良土壤盐渍化动态特征及预测[J]. 土壤学报, 2022, 59(6): 1504-1516.]
(  0) 0) |
| [2] |
Yang J S, Yao R J, Wang X P, et al. Research on salt-affected soils in China: history, status quo and prospect (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(1): 10-27. [杨劲松, 姚荣江, 王相平, 等. 中国盐渍土研究: 历程、现状与展望[J]. 土壤学报, 2022, 59(1): 10-27.]
(  0) 0) |
| [3] |
García-Caparrós P, Llanderal A, Hegarat E, et al. Effects of exogenous application of osmotic adjustment substances on growth, pigment concentration, and physiological parameters of Dracaena sanderiana sander under different levels of salinity[J]. Agronomy, 2020, 10(1): 125. DOI:10.3390/agronomy10010125
(  0) 0) |
| [4] |
Trivedi P, Batista B D, Bazany K E, et al. Plant-microbiome interactions under a changing world: responses, consequences and perspectives[J]. New Phytologist, 2022, 234(6): 1951-1959. DOI:10.1111/nph.18016
(  0) 0) |
| [5] |
Liu Y P, Xun W B, Chen L, et al. Rhizosphere microbes enhance plant salt tolerance: Toward crop production in saline soil[J]. Computational and Structural Biotechnology Journal, 2022, 20: 6543-6551. DOI:10.1016/j.csbj.2022.11.046
(  0) 0) |
| [6] |
Liu J W, Li X Z, Yao M J. Research progress on assembly of plant rhizosphere microbial community (In Chinese)[J]. Acta Microbiologica Sinica, 2021, 61(2): 231-248. [刘京伟, 李香真, 姚敏杰. 植物根际微生物群落构建的研究进展[J]. 微生物学报, 2021, 61(2): 231-248.]
(  0) 0) |
| [7] |
Müller D B, Vogel C, Bai Y, et al. The plant microbiota: Systems-level insights and perspectives[J]. Annual Review of Genetics, 2016, 50: 211-234. DOI:10.1146/annurev-genet-120215-034952
(  0) 0) |
| [8] |
Trivedi P, Leach J E, Tringe S G, et al. Plant-microbiome interactions: From community assembly to plant health[J]. Nature Reviews Microbiology, 2020, 18(11): 607-621. DOI:10.1038/s41579-020-0412-1
(  0) 0) |
| [9] |
Si H L, Ji L D, Li L, et al. Effects of long-term application of bioorganic fertilizer on soil nutrients and biological characteristics of saline alkali land in Ningxia (In Chinese)[J]. Soils, 2022, 54(6): 1124-1131. [司海丽, 纪立东, 李磊, 等. 生物有机肥对宁夏盐碱地土壤养分和生物学特性的影响[J]. 土壤, 2022, 54(6): 1124-1131.]
(  0) 0) |
| [10] |
Ren Y, Xun W B, Yan H, et al. Functional compensation dominates the assembly of plant rhizospheric bacterial community[J]. Soil Biology & Biochemistry, 2020, 150: 107968.
(  0) 0) |
| [11] |
Xun W B, Shao J H, Shen Q R, et al. Rhizosphere microbiome: Functional compensatory assembly for plant fitness[J]. Computational and Structural Biotechnology Journal, 2021, 19: 5487-5493. DOI:10.1016/j.csbj.2021.09.035
(  0) 0) |
| [12] |
Li H S. Principles and techniques of plant physiological biochemical experiment[M]. Beijing: Higher Education Press, 2000.[李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.]
(  0) 0) |
| [13] |
Zhang J Y, Liu Y X, Guo X X, et al. High-throughput cultivation and identification of bacteria from the plant root microbiota[J]. Nature Protocols, 2021, 16(2): 988-1012. DOI:10.1038/s41596-020-00444-7
(  0) 0) |
| [14] |
Wang D M, Jia Y, Cui J Z. Advances in research on effects of salt stress on plant and adaptive mechanism of the plant to salinity (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2009, 25(4): 124-128. [王东明, 贾媛, 崔继哲. 盐胁迫对植物的影响及植物盐适应性研究进展[J]. 中国农学通报, 2009, 25(4): 124-128.]
(  0) 0) |
| [15] |
Liu C Q, Yang J S, Chen D M, et al. Responses to salt stress of crops different in salt tolerance (In Chinese)[J]. Acta Pedologica Sinica, 2005, 42(6): 993-998. DOI:10.3321/j.issn:0564-3929.2005.06.017 [刘春卿, 杨劲松, 陈德明, 等. 不同耐盐性作物对盐胁迫的响应研究[J]. 土壤学报, 2005, 42(6): 993-998.]
(  0) 0) |
| [16] |
Zhu H, Zu Y G, Wang W J, et al. Effect of proline on plant growth under different stress conditions (In Chinese)[J]. Journal of Northeast Forestry University, 2009, 37(4): 86-89. [朱虹, 祖元刚, 王文杰, 等. 逆境胁迫条件下脯氨酸对植物生长的影响[J]. 东北林业大学学报, 2009, 37(4): 86-89.]
(  0) 0) |
| [17] |
Sarkar A, Ghosh P K, Pramanik K, et al. A halotolerant Enterobacter sp. displaying ACC deaminase activity promotes rice seedling growth under salt stress[J]. Research in Microbiology, 2018, 169(1): 20-32. DOI:10.1016/j.resmic.2017.08.005
(  0) 0) |
| [18] |
Lundberg D S, Lebeis S L, Paredes S H, et al. Defining the core Arabidopsis thaliana root microbiome[J]. Nature, 2012, 488(7409): 86-90. DOI:10.1038/nature11237
(  0) 0) |
| [19] |
Vessey J K. Plant growth promoting rhizobacteria as biofertilizers[J]. Plant and Soil, 2003, 255(2): 571-586. DOI:10.1023/A:1026037216893
(  0) 0) |
| [20] |
Kang S M, Radhakrishnan R, Khan A L, et al. Gibberellin secreting rhizobacterium, Pseudomonas putida H-2-3 modulates the hormonal and stress physiology of soybean to improve the plant growth under saline and drought conditions[J]. Plant Physiology Biochemistry, 2014, 84: 115-124. DOI:10.1016/j.plaphy.2014.09.001
(  0) 0) |
| [21] |
Singh S, Singh U B, Trivedi M, et al. Seed biopriming with salt-tolerant endophytic Pseudomonas geniculata-modulated biochemical responses provide ecological fitness in maize(Zea mays L.)grown in saline sodic soil[J]. International Journal of Environmental Research and Public Health, 2020, 17(1): 253.
(  0) 0) |
| [22] |
Vives-Peris V, Gomez-Cadenas A, Perez-Clemente R M. Salt stress alleviation in citrus plants by plant growth-promoting rhizobacteria Pseudomonas putida and Novosphingobium sp[J]. Plant Cell Reports, 2018, 37(11): 1557-1569. DOI:10.1007/s00299-018-2328-z
(  0) 0) |
| [23] |
Win K T, Tanaka F, Okazaki K, et al. The ACC deaminase expressing endophyte Pseudomonas spp. enhances NaCl stress tolerance by reducing stress-related ethylene production, resulting in improved growth, photosynthetic performance, and ionic balance in tomato plants[J]. Plant Physiology and Biochemmistry, 2018, 127: 599-607.
(  0) 0) |
| [24] |
Park M S, Jung S R, Lee K H, et al. Chryseobacterium soldanellicola sp. nov. and Chryseobacterium taeanense sp. nov. isolated from roots of sand-dune plants[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56: 433-438.
(  0) 0) |
| [25] |
Bhise K K, Bhagwat P K, Dandge P B. Synergistic effect of Chryseobacterium gleum sp SUK with ACC deaminase activity in alleviation of salt stress and plant growth promotion in Triticum aestivum L[J]. 3 Biotech, 2017, 7(2): 105.
(  0) 0) |
| [26] |
Abbas R, Rasul S, Aslam K, et al. Halotolerant PGPR: A hope for cultivation of saline soils[J]. Journal of King Saud University Science, 2019, 31: 1195-1201.
(  0) 0) |
| [27] |
Sunita K, Mishra I, Mishra J, et al. Secondary metabolites from halotolerant plant growth promoting rhizobacteria for ameliorating salinity stress in plants[J]. Frontiers in Microbiology, 2020, 11: 567768.
(  0) 0) |
| [28] |
Wippel K, Tao K, Niu Y L, et al. Host preference and invasiveness of commensal bacteria in the Lotus and Arabidopsis root microbiota[J]. Nature Microbiology, 2021, 6(9): 1150-1162.
(  0) 0) |
| [29] |
Chen X J, Liu K M, Xuan M G, et al. Screening and identification of plant growth-promoting rhizobacteria to enhance salt stress tolerance of crops and their effects in field experiment (In Chinese)[J]. Journal of Nanjing Agricultural University, 2020, 43(3): 452-459. [陈小娟, 刘铠鸣, 宣明刚, 等. 增强作物耐盐胁迫能力的根际促生菌筛选、鉴定及田间应用效果[J]. 南京农业大学学报, 2020, 43(3): 452-459.]
(  0) 0) |
| [30] |
Yu Y N, Wu H Y, Wang P X, et al. Biological effect of Trichoderma-enriched biofertilizers on cabbage cultivation in coastal saline soil (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(4): 1112-1124. [于亚楠, 邬海燕, 王盼星, 等. 木霉生物有机肥应用于海滨盐土甘蓝种植的生物效应[J]. 土壤学报, 2022, 59(4): 1112-1124.]
(  0) 0) |
| [31] |
Liang H B, Zhao L, Zhou Y P, et al. Effects of rhizosphere growth-promoting bacteria on soil improvement, crop yield and quality in saline-alkali land-A meta-analysis (In Chinese)[J]. Soils, 2022, 54(6): 1257-1264. [梁洪榜, 赵丽, 周云鹏, 等. 盐碱地应用根际促生菌对土壤改良、作物产量与品质的影响——基于Meta分析[J]. 土壤, 2022, 54(6): 1257-1264.]
(  0) 0) |
| [32] |
Cui H W, Ma W G. Advances in seed coating agents and coating methods (In Chinese)[J]. Seed, 2015, 34(1): 48-53. [崔华威, 马文广. 种子包衣剂及包衣方法研究进展[J]. 种子, 2015, 34(1): 48-53.]
(  0) 0) |
| [33] |
Zhao L L, Nie L S, Zhu Q K, et al. Seed coating and its application in China (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2009, 25(23): 126-131. [赵磊磊, 聂立水, 朱清科, 等. 种子包衣及其在中国的应用研究[J]. 中国农学通报, 2009, 25(23): 126-131.]
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


