2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
土壤有机碳(SOC)是陆地生态系统中最大的碳库,在全球碳循环中发挥决定性作用[1]。土壤有机碳矿化过程受到温度和降水的直接调控,气候变化引起的水热条件增加将导致土壤碳库稳定性发生改变[2]。由于对有机碳稳定机制的认识不足,地球系统模型对土壤碳周转率的估计是实际值的6倍以上[3-5]。因为它们过分强调有机碳库的变化,忽略了微生物过程在碳循环中的重要作用[6]。此外,气候模拟试验也发现了有机碳对水热增加的多种响应模式[7-9]。据报道,植物的碳输入与微生物分解的碳输出之间的平衡[10],以及土壤矿物稳定微生物残体的能力决定了有机碳对水热增加响应的多样性[6]。因此,关注微生物残体碳而不仅仅是总有机碳含量对水热增加的响应,对于更好地预测全球气候变化背景下土壤碳动态具有重要意义[6]。
土壤微生物不仅可以分解和矿化有机质[11],而且可以通过合成代谢利用植物残体并形成微生物残体以稳定土壤中的碳[12]。有研究表明,微生物残体碳占土壤有机碳总量的50%~80%[12-13],并且与土壤矿物表面紧密结合,是矿物结合态有机碳(MAOC)的重要组成部分,被认为对气候变化响应不明显[14]。然而不少研究表明,水热增加将通过降低土壤pH、增强地表侵蚀和土壤淋溶作用对土壤活性矿物产生显著的影响[15-17],这将削弱土壤活性矿物对微生物残体的保护效果,使更多的微生物残体暴露在被降解的风险中[18]。因此,微生物残体碳可能不像以往认为的那样在水热增加下相对稳定。例如,水热条件增加20年后,青藏高原高寒草地的土壤反而损失了更多的微生物残体碳[19]。因此,将土壤活性矿物和微生物残体碳的变化纳入有机碳对水热增加响应的研究中,有利于更好理解气候变化条件下土壤碳库变化及其调控机制[6]。
土壤有机碳库的变化取决于微生物对有机碳分解与积累的双重作用。水热条件增加将显著提高植物碳输入和土壤微生物活性[10,20]。当土壤中氮素养分充足时,更高的碳利用效率(CUE)将促使微生物将生产更多的微生物残体,促进有机质积累[21]。而当土壤中氮素养分缺乏时,更高的植物生物量将加剧植物与微生物的养分竞争,进一步提高微生物的养分限制[22]。微生物残体C/N较土壤C/N更低[23],是土壤中重要的氮库[24]。大量高C/N的植物碳输入促使微生物分解更多的微生物残体获得氮素养分以满足自身生命活动需要,诱发强烈的正激发效应[24],这将造成微生物残体碳与总有机碳含量的显著下降[10,25]。因此,需要更全面地了解水热增加对植物与微生物的影响,尤其是微生物作为土壤有机碳分解者和生产者的双重角色,如何调节有机碳组分的变化并进一步影响土壤有机碳库。
长期土壤移置试验被认为是模拟自然条件下水热增加的直观且有效的方法[26]。为研究土壤有机碳对水热增加的响应机制,自2005年以来,将黑土剖面从中国北方(寒温带)迁移到中国中部(暖温带)和中国南方(中亚热带)。提出以下假设:1)水热增加会提高微生物与植物生长活性,加剧植物与微生物的氮竞争,微生物会降解更多的微生物残体,土壤有机碳的损失将以微生物残体碳为主;2)由于矿物保护限制了微生物对微生物残体的利用,水热增加引起的土壤活性矿物的变化会显著影响微生物残体碳的损失速率。因此,我们预测水热增加将通过降低微生物残体碳含量促进土壤有机碳流失,而且这种模式将随着水热条件的增加而增强。
1 材料与方法 1.1 试验设计2005年10月,在中国黑龙江省海伦农田生态系统国家野外科学观测研究站采集9组0~100 cm土壤剖面。为保证土壤剖面的完整性,分5层(20 cm每层)采集土壤。根据联合国粮农组织(FAO)土壤分类标准,采集的土壤为黑软土(Mollisols)。其中,3组留在海伦站,其他6组分别往南移置到河南封丘、江西鹰潭两个农田生态系统国家野外科学观测研究站,全面模拟年均温与降雨量等气候条件同时增加的状况。海伦站为寒温带季风气候(N 47°27′,E 126°55′),年均温5.1 ℃,年降水量529 mm;封丘站(N 35°03′,E 114°23′)为暖温带季风气候,年均温13.6 ℃,年降水量604 mm;鹰潭站(N 28°15′,E 116°55′)为亚热带季风气候,年均温17.3 ℃,年降水量1 783 mm。
在每个试验站各设立9个水泥池(1.4 m长× 1.2 m宽×1 m深),内壁覆盖尼龙防水布,底部铺设3 cm厚度的河沙,按采样地剖面的土层顺序将土壤依次填入水泥池中。2006年春季开始种植玉米。在土壤移置8年后,于2013年8—9月玉米收获后采集了9份黑土土壤样品(3处土壤,3个重复)进行研究。用不锈钢土钻(2 cm)按“5点采样法”采集每个区块0~20 cm表土,除去土样中的石块和残留的根系后,均匀混合,装入密封袋中4℃保存带回实验室,–20 ℃低温保存。在两周内对土壤中酶活性、矿物保护作用进行了分析。
1.2 土壤物理化学性质测定土壤有机碳(SOC)含量采用重铬酸钾法测定;全氮(TN)含量采用半微量凯氏法测定;pH采用酸度计测定(土水比为1︰2.5);黏粒(Clay)含量使用Miller和Schaetzl[27]描述的方法进行测量:将0.5 g土样放入一个25 mL的锥形瓶中,加入8 mL 50 g·L–1的六偏磷酸钠。2 h后,将所有样品置于30 kHz的超声波环境中水浴15 min。随后,将土壤悬浮液转移到装有900 mL蒸馏水的烧杯中,用激光衍射粒度分析仪(Mastersizer 2000,Malvern Instruments Ltd)进行测量。根据美国农业部土壤分类法,将小于0.002 mm的颗粒归类为土壤黏粒。
1.3 植株性质测定玉米收获后采集整株植物地上部分,70℃的烘箱烘干至恒重,称重作为植株生物量数据。磨碎后一部分利用元素分析仪(vario EL cube,Elementar Analysensysteme GmbH)通过高温燃烧法测定碳含量,一部分经浓硫酸消煮后用流动分析仪测定氮含量,计算地上部植株碳氮比。
1.4 土壤酶活性与矿物测定采用微孔板荧光法测定参与土壤碳、氮循环的三种胞外酶活性:α-1,4-葡萄糖苷酶(α-GC)、β-1,4-葡萄糖苷酶(β-GC)、N-乙酰-β-D-氨基葡萄糖苷酶(NAG)[28]。土壤使用上海通蔚生物科技有限公司生产的试剂盒(微量法)处理。在96孔微孔板上设置空白孔、标准孔、待测样品孔,每个土样进行4次重复测定,使用酶标仪(Varioskan LUX,Thermo,USA)在450 nm波长处进行荧光测定。
采用酸性草酸铵溶液提取土样中的无定型铁铝氧化物(如FeO与AlO)[29],使用焦磷酸钠溶液提取结合态的铁铝(如FeP和AlP)[30],使用氯化铵–乙醇溶液提取交换态钙离子(Caexe)[31]。提取后,使用电感耦合等离子体质谱仪(ICP–MS)(NexION 350x,ICP–MS Spectrometer,PerkinElmer,USA)对提取的上清液进行定量分析得到土壤活性矿物的质量分数。
1.5 土壤微生物残体碳测定土壤中的氨基糖通过水解、纯化、衍生化后使用气相色谱法进行测定(Agilent 6890,Agilent Technologies,USA)[32]。具体操作步骤如下:将0.5 g土壤置于加盖锥形瓶中,加入10 mL 6 mol·L–1的盐酸溶液,在烘箱中105℃水解8 h。拿出水解瓶,涡旋振荡均匀后静置过夜。取0.5 mL上清液至玻璃试管中,加入100 μL 1 mg·mL–1的肌醇溶液(内标1),涡旋后N2水浴(40~45℃)吹干。氮吹结束后向玻璃试管中加入0.5 mL去离子水,溶解析出物,涡旋后继续N2水浴(40~45℃)吹干。在试管中加入100 μL 1 mg·mL–1的N-甲基葡萄糖胺溶液(内标2),N2水浴(40~45℃)吹干。在吹干的样品中加入300 μL的衍生试剂(吡啶–甲醇溶液v/v=4︰1),加盖密封,涡旋30 s混匀后在75~80℃水浴加热30 min,加热期间振荡7次。冷却到室温后,加入1 mL乙酸酐,加盖密封,涡旋30 s混匀后在75~80℃水浴加热25 min,加热期间振荡5次。冷却后,加入2 mL二氯甲烷萃取氨基糖的衍生物。随后通过如下步骤洗去衍生化残留的过量乙酸酐:在衍生物中加入1 mL 1 mol·L–1的盐酸溶液,涡旋30 s,静置分层后,去除上层无机相。再按照相同方式用1 mL去离子水对有机相进行提取,此步骤重复5次,在最后一次提取中,尽可能移除上层无机相。下层溶液在45℃下N2水浴吹干,加入400 μL的乙酸乙酯–正己烷(v/v=1︰1)完全溶解,通过气相色谱仪对衍生化产物进行分离和检测。
1.6 数据处理与统计分析土壤微生物残体碳的定量公式如下:
| $ {\text{FNC}} = \left( {\frac{{{\text{GluN}}}}{{179.17}} - \frac{{2 \times {\text{MurA}}}}{{251.23}}} \right) \times 179.17 \times 9 $ | (1) |
| $ {\text{BNC}} = {\text{MurA}} \times 45 $ | (2) |
| $ {\text{MNC}} = {\text{FNC}} + {\text{BNC}} $ | (3) |
式中,FNC(Fungi necromass carbon)为真菌残体碳(mg·g–1 soil);BNC(Bacterial necromass carbon)为细菌残体碳(mg·g–1 soil);MNC(Microbial necromass carbon)为微生物残体碳(mg·g–1 soil);GluN为氨基葡萄糖,其分子量为179.17;MurA为胞壁酸,其分子量为251.23;9和45分别为FNC与BNC的转换系数[13]。
采用R(v 4.0.1;http://www.r-project.org/)与SPSS Amos(SPSS Inc.,Chicago,IL,USA)进行数据分析。数据正态分布与方差齐性检验后,使用单因素方差分析(one-way ANOVA)与HSD检验法分别比较土壤移置8年后海伦、封丘、鹰潭土壤中有机碳和微生物残体碳含量的差异(P < 0.05)。为了探究水热增加后单位有机碳降低下微生物残体碳减少程度,即微生物残体碳的损失速率,通过差值法将土壤有机碳和微生物残体碳含量在封丘与海伦、鹰潭和海伦之间进行两两差值,得到封丘与鹰潭两地的ΔMNC/ΔSOC[21],并利用独立样本t检验(t-test)比较二者的差异(P < 0.05)。利用斯皮尔曼相关性分析研究生物、非生物因素与微生物残体碳损失速率的相关性。将相关性分析显著的生物、非生物因子与微生物残体碳损失速率进行随机森林分析。最后,使用随机森林中显著的水热增加、矿物保护、植物、酶活性变量与微生物残体碳损失速率进行结构方程模型(SEM)分析。对于包含多个变量的参数,使用主成分分析中的第一个主成分来表示相应的变量。使用方差分解分析(VPA)研究水热增加与矿物保护变化对微生物残体碳损失速率空间变异性的贡献。
2 结果 2.1 水热增加对土壤理化性质和植株生物量的影响水热增加显著降低了土壤pH、全氮、无定型态铁铝氧化物(FeO+AlO)、结合态铁铝(FeP+AlP)与交换态钙离子(Caexe)的含量,但显著提高了水解酶活性(α-葡萄糖苷酶,β-葡萄糖苷酶和N-乙酰-β-D-氨基葡萄糖苷酶),并提高了植物生物量与地上部植株C/N(P < 0.05)(表 1、表 2)。
|
|
表 1 试验区气候特征及土壤理化性质 Table 1 Climate and soil physicochemical properties at three sites |
|
|
表 2 试验区微生物酶活性与植株性质 Table 2 Microbially enzyme activities and plant properties of three sites |
水热增加显著降低了土壤有机碳与微生物残体含量(P < 0.05)(图 1a、图 1b)。具体而言,土壤移置试验进行8年后,往南移置显著降低了有机碳含量,并且移置到鹰潭的土壤中有机碳含量较封丘更低,微生物残体含量也保持着相同的变化规律。此外,微生物残体对有机碳的贡献也随着水热条件的增加而显著降低。为定量表征微生物残体碳损失速率,进一步计算水热增加下单位土壤有机碳变化下微生物残体碳的变化:ΔMNC/ΔSOC。图 1d可见,微生物残体碳损失速效率随着水热条件的增加而显著增加,在鹰潭达到了82.6% ± 2.37%。这表明,水热条件变化通过减少微生物残体碳促进了土壤碳流失。
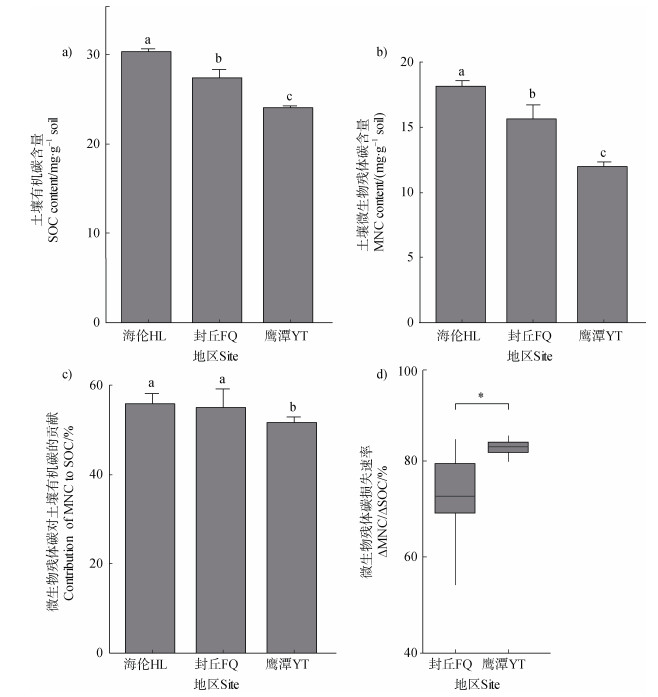
|
注:图a和b土壤有机碳与微生物残体碳含量在三个试验区的差异;图c微生物残体碳对土壤有机碳的贡献在三个试验区的差异;图d微生物残体碳损失速率在封丘和鹰潭的差异。SOC,土壤有机碳;MNC,微生物残体碳,ΔMNC/ΔSOC,微生物残体碳损失速率。*表示封丘和鹰潭间微生物残体碳损失速率在0.05水平具有显著性差异(P < 0.05)。下同。 Note:Fig. a and b Differences of soil organic carbon and microbial necromass carbon content in three sites;Fig. c Differences of the contribution of microbial necromass carbon to soil organic carbon in three sites;Fig. d Differences of the change in microbial necromass C per unit decrease in soil organic carbon between Fengqiu and Yingtan. SOC,soil organic carbon;MNC,microbial necromass carbon,ΔMNC/ΔSOC,the change in microbial necromass C per unit decrease in soil organic carbon. * represent a significant diffierence in ΔMNC/ΔSOC between Fengqiu and Yingtan at the 0.05 level(P < 0.05). The same below. 图 1 水热增加对土壤有机碳的影响 Fig. 1 Effects of increasing hydrothermal on soil organic carbon |
为研究微生物残体碳损失速率与生物、非生物因素的关系,使用试验区各指标的差值数据与ΔMNC/ΔSOC进行了相关性分析。结果显示,微生物残体碳损失速率与多种生物变量密切相关,随α-1,4-葡萄糖苷酶、β-N-乙酰氨基葡萄糖苷酶、植被生物量、地上部植株C/N的增加而显著提高(P < 0.05)。此外,微生物残体碳损失速率随土壤理化变量的变化而变化:与年均温、年降水量呈正相关关系,与土壤全氮无显著关系,而更高的土壤pH、无定型态铁铝氧化物、结合态铁铝、交换态钙离子含量将降低微生物残体碳损失速率(P < 0.05)(表 3)。
|
|
表 3 微生物残体碳损失速率与生物、非生物因素的相关性分析(斯皮尔曼相关性分析) Table 3 Correlation analysis between ΔMNC/ΔSOC and biotic and abiotic factors(Spearman's correlations) |
使用相关性分析显著的变量构建了随机森林回归模型。年均温、无定型态铁铝氧化物、结合态铁铝、地上部植株C/N、交换态钙离子显著地调控了微生物残体碳损失速率(P < 0.01),其次是植被生物量、α-1,4-葡萄糖苷酶与NAG酶活性(P < 0.05),而pH则不显著(P > 0.05)(图 2a)。将随机森林筛选的变量划分为四类,并对不同类别的变量使用主成分分析中的第一个主成分进行表征:水热变化(年均温和年降水量;PCA累积量= 99.6%)、矿物保护(FeO+AlO,FeP+AlP和Caexe;PCA累积量77.4%)、酶活性(α-GC和NAG活性;PCA累积量72.9%)
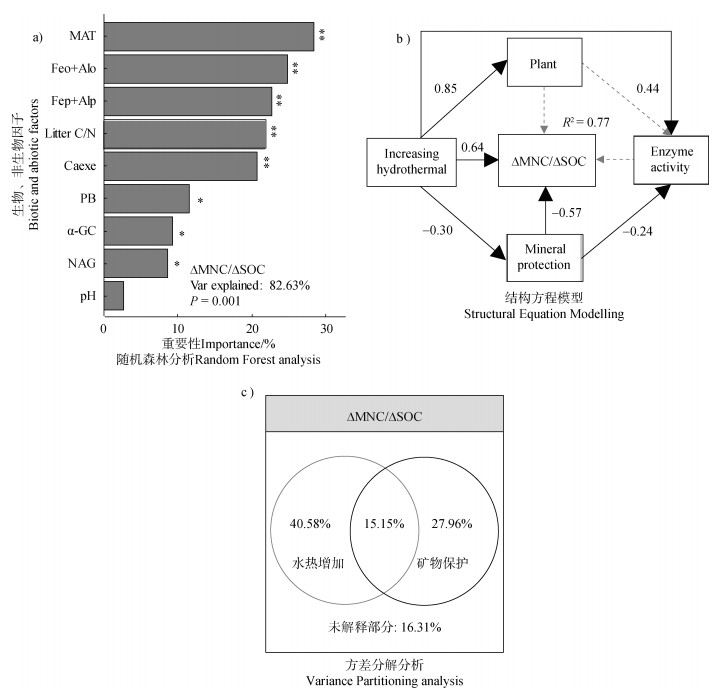
|
注:图a生物、非生物因子与微生物残体碳损失速率的随机森林分析,Var explained表示模型对ΔMNC/ΔSOC变化的解释能力,**表示当前变量在0.01水平对微生物残体碳损失速率具有显著影响,*表示当前变量在0.05水平对微生物残体碳损失速率具有显著影响;图b水热增加、植株性质、矿物保护、微生物酶活性与微生物残体碳损失速率的结构方程模型:χ2/df= 0.55,P = 0.69,bootstrap P = 0.74,GFI = 0.99,RMSEA = 0.003;图c水热增加与矿物保护对微生物残体碳损失速率的VPA分析。 Note:Fig. a The random forest analysis of biotic,abiotic and ΔMNC/ΔSOC,** represent the variable has a significant effect on ΔMNC/ΔSOC at the 0.01 level(P < 0.01),and * represent the variable has a significant effect on ΔMNC/ΔSOC at the 0.05 level(P < 0.05),“Var explained” represents the explained amount of the model to ΔMNC/ΔSOC;Fig. b Structural equation modelling(SEM)of the increasing hydrothermal,plant,mineral protection and enzyme activity with ΔMNC/ΔSOC,χ2/df= 0.55,P = 0.69,bootstrap P = 0.74,GFI = 0.99,RMSEA = 0.003;Fig. c The variance partitioning analysis of increasing hydrothermal,mineral protection and ΔMNC/ΔSOC. 图 2 微生物残体碳损失速率的决定性因素 Fig. 2 Dominant factors that regulate ΔMNC/ΔSOC |
和植株性质(植株生物量和地上部植株C/N;PCA累积量74.2%),随后使用它们构建结构方程模型。结果显示,微生物残体碳损失速率随着水热条件的增加而提高,随矿物保护的增加而下降,二者的直接效应为0.64和–0.57;水热条件增加还可以通过降低矿物保护来间接调控微生物残体碳损失速率,其间接效应为0.17(P < 0.05)(图 2b)。此外,植株性质和酶活性与微生物残体碳损失速率无显著关系。方差分解分析的结果揭示了水热增加和矿物保护在调节移置试验中微生物残体碳损失速率的重要作用。水热增加和矿物保护对微生物残体碳损失速率的空间变异贡献率达83.7%(图 2c)。这也验证了随机森林和SEM的结果:水热条件和矿物保护是调控微生物残体碳损失速率的决定性因素。
3 讨论东北黑土是富含有机质的肥沃土壤,可维持作物高产,支持农业生产。了解土壤有机碳对水热增加的响应,对于在全球气候变化的背景下保护土壤具有重要意义[6]。借助土壤置换平台,本研究发现土壤有机碳在8年的水热增加后,植物与微生物活性提高,土壤有机碳含量显著降低,而损失的土壤有机碳大部分为微生物残体碳。此外,微生物残体碳的损失速率随水热增加的幅度显著提高(封丘52.2%~84.5%;鹰潭76.0%~90.3%),表明水热增加通过降低微生物残体碳含量促进了土壤有机碳损失。此外,本研究还发现水热增加不但直接调控微生物残体碳损失速率,还可以通过削弱矿物保护间接产生影响。这些结果表明,水热增加和矿物保护是调控微生物残体碳损失率的主导因素。
土壤微生物对微生物残体的利用程度决定了微生物残体碳损失速率[33]。水热增加将对土壤微生物活性及原有的物质和能量循环过程产生显著影响[34]。土壤移置提高了微生物活性,表现在微生物水解酶活性呈现鹰潭大于封丘大于海伦的规律(表 2)。水热增加显著提高了植物生物量和地上部植株C/N,这将加剧植物与微生物对氮素养分的竞争。然而,水热增加带来的更强的淋溶作用导致封丘与鹰潭土壤氮含量显著低于原位土壤[35]。这可能进一步加剧了微生物氮限制,从而降低了微生物的碳利用效率[36]。一方面,降低了微生物对植物残体的“体内周转”与转化的生物合成效率,抑制了土壤微生物残体的积累,降低了微生物过程对土壤微生物残体碳库的补充[11,37]。另一方面,微生物为了代谢C/N更高的植物源碳,将降解难以利用的含氮有机质,以获得其中的氮元素满足自身所需[38],这表现在土壤氮的分解酶活性随水热增加而显著提高(表 2)。微生物残体由于较低的C/N(7︰1),是一种更有效的氮源,可以满足微生物对氮的需求[23]。因此,水热增加将促使微生物通过氮挖掘作用分解更多的微生物残体来获取氮,提高了微生物残体碳在损失有机碳中的占比[39]。
矿物保护是限制微生物获取和利用微生物残体碳的重要手段,是微生物残体在土壤中长期积累储存的主要原因[14,40]。研究表明,微生物残体与金属离子(钙、铁、铝等)的络合强度、与黏粒的结合能力是影响其稳定性的主要因素[41]。本研究发现,水热增加削弱了土壤矿物对微生物残体的保护能力,使更多的微生物残体直接暴露在微生物的分解作用下,提高了微生物残体碳损失速率(表 1,图 2b)。水热增加通过下面几个原因降低了土壤矿物对微生物残体的保护能力。首先,在pH > 6的中性或钙质土壤中,交换态钙离子可以作为阳离子桥,将矿物表面与微生物残体特定官能团(例如,芳香族与酚类)连接起来,促进微生物残体的吸附[42-43]。铁铝氧化物能够以配体交换或共沉淀等方式将微生物残体转化为矿物结合态有机碳,而钙能够以三元络合物的形式促进这一过程,而水热增加则通过抑制微生物残体与铁/铝氧化物的共沉淀来削弱矿物保护微生物残体的能力(表 1、表 2)[44]。相较于无定形铁铝氧化物,水热增加对土壤络合态铁铝氧化物的调控能力更强,而这进一步造成了微生物残体碳的损失(表 1)。可能是因为活性铁、铝矿物具有较高的表面活性,其表面的结合位点一方面可以通过吸附作用与胞壁酸或者氨基糖内部的酸性基团如羧基相结合,另一方面还可以通过改变酶分子的构象抑制酶的降解能力,直接减少微生物残体的分解[45]。此外,微生物残体还可以通过与黏土矿物相结合在土壤中稳定[38,46-47]。植物碳输入,如有机酸,可以通过破坏矿物–有机碳关联来提高微生物的碳有效性[48]。本研究还观察到植物生物量与土壤矿物呈负相关关系(表 2),这表明,水热增加将导致植物根系向土壤中分泌更多的有机酸,降低土壤pH,破坏金属氧化物与黏土矿物对微生物残体的保护[47,49],将更多的微生物残体释放到土壤中,提高微生物残体碳的速失速率。
4 结论总体而言,基于土壤移置试验,发现水热增加通过促进微生物残体降解促进了土壤有机碳损失,强调了微生物残体碳在土壤碳库稳定中发挥的决定性作用。此外,水热增加以直接或间接的方式调控了微生物残体碳的损失速率,具体表现为提高土壤N限制使微生物分解更多的微生物残体和削弱矿物对微生物残体的保护能力。土壤矿物所提供的物理化学保护在维持微生物残体碳与土壤碳库长期稳定方面的关键作用,且其作用随着水热增加而减弱。
| [1] |
Schmidt M W I, Torn M S, Abiven S, et al. Persistence of soil organic matter as an ecosystem property[J]. Nature, 2011, 478: 49-56. DOI:10.1038/nature10386
(  0) 0) |
| [2] |
Bradford M A, Wieder W R, Bonan G B, et al. Managing uncertainty in soil carbon feedbacks to climate change[J]. Nature Climate Change, 2016, 6: 751-758. DOI:10.1038/nclimate3071
(  0) 0) |
| [3] |
Chen L Y, Liu L, Mao C, et al. Nitrogen availability regulates topsoil carbon dynamics after permafrost thaw by altering microbial metabolic efficiency[J]. Nature Communications, 2018, 9: 3951. DOI:10.1038/s41467-018-06232-y
(  0) 0) |
| [4] |
He Y, Trumbore S E, Torn M S, et al. Radiocarbon constraints imply reduced carbon uptake by soils during the 21st century[J]. Science, 2016, 353: 1419-1424. DOI:10.1126/science.aad4273
(  0) 0) |
| [5] |
Shi Z, Allison S D, He Y J, et al. The age distribution of global soil carbon inferred from radiocarbon measurements[J]. Nature Geoscience, 2020, 13: 555-559. DOI:10.1038/s41561-020-0596-z
(  0) 0) |
| [6] |
He M, Fang K, Chen L, et al. Depth-dependent drivers of soil microbial necromass carbon across Tibetan alpine grasslands[J]. Global Change Biology, 2022, 28: 936-949. DOI:10.1111/gcb.15969
(  0) 0) |
| [7] |
Xue K, Yuan M M, Shi Z J, et al. Tundra soil carbon is vulnerable to rapid microbial decomposition under climate warming[J]. Nature Climate Change, 2016, 6: 595-600. DOI:10.1038/nclimate2940
(  0) 0) |
| [8] |
Chen Y, Han M G, Yuan X, et al. Warming has a minor effect on surface soil organic carbon in alpine meadow ecosystems on the Qinghai-Tibetan Plateau[J]. Global Change Biology, 2022, 28: 1618-1629. DOI:10.1111/gcb.15984
(  0) 0) |
| [9] |
Yuan X, Chen Y, Qin W K, et al. Plant and microbial regulations of soil carbon dynamics under warming in two alpine swamp meadow ecosystems on the Tibetan Plateau[J]. Science of the Total Environment, 2021, 790: 148072. DOI:10.1016/j.scitotenv.2021.148072
(  0) 0) |
| [10] |
Wang X X, Dong S K, Gao Q Z, et al. Effects of short-term and long-term warming on soil nutrients, microbial biomass and enzyme activities in an alpine meadow on the Qinghai-Tibet Plateau of China[J]. Soil Biology & Biochemistry, 2014, 76: 140-142.
(  0) 0) |
| [11] |
Kong Y L, Qin H, Zhu C Q, et al. Research progress on the mechanism by which soil microorganisms affect soil health[J]. Acta Pedologica Sinica, DOI: 10.11766/trxb202301200448.[孔亚丽, 秦华, 朱春权, 等. 土壤微生物影响土壤健康的作用机制研究进展[J]. 土壤学报, DOI: 10.11766/trxb202301200448.]
(  0) 0) |
| [12] |
Zhang B, Chen Q, Ding X L, et al. Research progress on accumulation, turnover and stabilization of microbial residues in soil (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(6): 1479-1491. [张彬, 陈奇, 丁雪丽, 等. 微生物残体在土壤中的积累转化过程与稳定机理研究进展[J]. 土壤学报, 2022, 59(6): 1479-1491.]
(  0) 0) |
| [13] |
Liang C, Amelung W, Lehmann J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology, 2019, 25: 3578-3590. DOI:10.1111/gcb.14781
(  0) 0) |
| [14] |
Lavallee J M, Soong J L, Cotrufo M F. Conceptualizing soil organic matter into particulate and mineral-associated forms to address global change in the 21st century[J]. Global Change Biology, 2020, 26: 261-273. DOI:10.1111/gcb.14859
(  0) 0) |
| [15] |
Slessarev E, Lin Y, Bingham N, et al. Water balance creates a threshold in soil pH at the global scale[J]. Nature, 2016, 540: 567-569. DOI:10.1038/nature20139
(  0) 0) |
| [16] |
Campo J. Warming to increase cropland carbon sink[J]. Nature Climate Change, 2023, 13: 121-122.
(  0) 0) |
| [17] |
Qafoku N P, Sumner M E. Adsorption and desorption of indifferent ions in variable charge subsoils: The possible effect of particle interactions on the counter‐ion charge density[J]. Soil Science Society of America Journal, 2002, 66(4): 1231-1239. DOI:10.2136/sssaj2002.1231
(  0) 0) |
| [18] |
Ma T, Zhu S, Wang Z, et al. Divergent accumulation of microbial necromass and plant lignin components in grassland soils[J]. Nature Communications, 2018, 9: 3480. DOI:10.1038/s41467-018-05891-1
(  0) 0) |
| [19] |
Chen Y, Han M, Yuan X, et al. Long-term warming reduces surface soil organic carbon by reducing mineral-associated carbon rather than "free" particulate carbon[J]. Soil Biology & Biochemistry, 2023, 177: 108905.
(  0) 0) |
| [20] |
Ni H, Jing X, Xiao X, et al. Microbial metabolism and necromass mediated fertilization effect on soil organic carbon after long-term community incubation in different climates[J]. The ISME Journal, 2021, 15: 2561-2573. DOI:10.1038/s41396-021-00950-w
(  0) 0) |
| [21] |
Zhou R, Liu Y, Dungait J A J, et al. Microbial necromass in cropland soils: A global meta-analysis of management effects[J]. Global Change Biology, 2023, 29: 1998-2014. DOI:10.1111/gcb.16613
(  0) 0) |
| [22] |
Yin L, Dijkstra F A, Wang P, et al. Rhizosphere priming effects on soil carbon and nitrogen dynamics among tree species with and without intraspecific competition[J]. New Phytologist, 2018, 218(3): 1036-1048. DOI:10.1111/nph.15074
(  0) 0) |
| [23] |
Donhauser J, Qi W, Bergk-Pinto B, et al. High temperatures enhance the microbial genetic potential to recycle C and N from necromass in high-mountain soils[J]. Global Change Biology, 2021, 27: 1365-1386. DOI:10.1111/gcb.15492
(  0) 0) |
| [24] |
Cui J, Zhu Z, Xu X, et al. Carbon and nitrogen recycling from microbial necromass to cope with C: N stoichiometric imbalance by priming[J]. Soil Biology & Biochemistry, 2020, 142: 107720.
(  0) 0) |
| [25] |
Chen X, Lin J, Wang P, et al. Resistant soil carbon is more vulnerable to priming effect than active soil carbon[J]. Soil Biology & Biochemistry, 2022, 168: 108619.
(  0) 0) |
| [26] |
Rinnan R, Michelsen A, Bååth E, et al. Fifteen years of climate change manipulations alter soil microbial communities in a subarctic heath ecosystem[J]. Global Change Biology, 2007, 13: 28-39. DOI:10.1111/j.1365-2486.2006.01263.x
(  0) 0) |
| [27] |
Miller B A, Schaetzl R J. Precision of soil particle size analysis using laser diffractometry[J]. Soil Science Society of America Journal, 2012, 76: 1719-1727. DOI:10.2136/sssaj2011.0303
(  0) 0) |
| [28] |
Zhu E, Cao Z, Jia J, et al. Inactive and inefficient: Warming and drought effect on microbial carbon processing in alpine grassland at depth[J]. Global Change Biology, 2021, 27: 2241-2253. DOI:10.1111/gcb.15541
(  0) 0) |
| [29] |
Lalonde K, Mucci A, Ouellet A, et al. Preservation of organic matter in sediments promoted by iron[J]. Nature, 2012, 483(7388): 198-200. DOI:10.1038/nature10855
(  0) 0) |
| [30] |
Gentsch N, Wild B, Mikutta R, et al. Temperature response of permafrost soil carbon is attenuated by mineral protection[J]. Global Change Biology, 2018, 24: 3401-3415. DOI:10.1111/gcb.14316
(  0) 0) |
| [31] |
Gruba P, Mulder J. Tree species affect cation exchange capacity(CEC)and cation binding properties of organic matter in acid forest soils[J]. Science of the Total Environment, 2015, 511: 655-662. DOI:10.1016/j.scitotenv.2015.01.013
(  0) 0) |
| [32] |
Amelung W, Zhang X, Flach K W, et al. Amino sugars in native grassland soils along a climosequence in North America[J]. Soil Science Society of America Journal, 1999, 63(1): 86-92. DOI:10.2136/sssaj1999.03615995006300010014x
(  0) 0) |
| [33] |
Shao P, Lynch L, Xie H, et al. Tradeoffs among microbial life history strategies influence the fate of microbial residues in subtropical forest soils[J]. Soil Biology and Biochemistry, 2021, 153: 108112. DOI:10.1016/j.soilbio.2020.108112
(  0) 0) |
| [34] |
Huang R, Crowther T W, Sui Y, et al. High stability and metabolic capacity of bacterial community promote the rapid reduction of easily decomposing carbon in soil[J]. Communications Biology, 2021, 4: 1-12. DOI:10.1038/s42003-020-01566-0
(  0) 0) |
| [35] |
Zhang J, Yu Z, Li Y, et al. Co–elevation of CO2 and temperature enhances nitrogen mineralization in the rhizosphere of rice[J]. Biology Fertility of Soils, 2022. DOI:10.1007/s00374-022-01667-4
(  0) 0) |
| [36] |
Bai T, Wang P, Qiu Y, et al. Nitrogen availability mediates soil carbon cycling response to climate warming: A meta‐analysis[J]. Global Change Biology, 2023, 29: 2608-2626. DOI:10.1111/gcb.16627
(  0) 0) |
| [37] |
Liao C, Men X, Wang C, et al. Nitrogen availability and mineral particles contributed fungal necromass to the newly formed stable carbon pool in the alpine areas of Southwest China[J]. Soil Biology & Biochemistry, 2022, 173: 108788.
(  0) 0) |
| [38] |
Angst G, Mueller K E, Nierop K G J, et al. Plant-or microbial-derived? A review on the molecular composition of stabilized soil organic matter[J]. Soil Biology & Biochemistry, 2021, 156: 108189.
(  0) 0) |
| [39] |
Chen R, Senbayram M, Blagodatsky S, et al. Soil C and N availability determine the priming effect: microbial N mining and stoichiometric decomposition theories[J]. Global Change Biology, 2014, 20(7): 2356-2367. DOI:10.1111/gcb.12475
(  0) 0) |
| [40] |
Wang S, Redmile-Gordon M, Shahbaz M, et al. Microbial formation and stabilisation of soil organic carbon is regulated by carbon substrate identity and mineral composition[J]. Geoderma, 2022, 414: 115762. DOI:10.1016/j.geoderma.2022.115762
(  0) 0) |
| [41] |
Zhang X, Amelung W, Yuan Y, et al. Amino sugar signature of particle size fractions in soils of the native prairie as affected by climate[J]. Soil Science, 1998, 163: 220-229. DOI:10.1097/00010694-199803000-00007
(  0) 0) |
| [42] |
Singh M, Sarkar B, Sarkar S, et al. Stabilization of soil organic carbon as influenced by clay mineralogy[J]. Advances in Agronomy, 2018, 148: 33-84.
(  0) 0) |
| [43] |
Pasut C, Tang F H M, Maggi F. A mechanistic analysis of wetland biogeochemistry in response to temperature, vegetation, and nutrient input changes[J]. Journal of Geophysical Research: Biogeosciences, 2020, 125(4): e2019JG005437. DOI:10.1029/2019JG005437
(  0) 0) |
| [44] |
Hemingway J D, Rothman D H, Grant K E, et al. Mineral protection regulates long-term global preservation of natural organic carbon[J]. Nature, 2019, 570(7760): 228-231. DOI:10.1038/s41586-019-1280-6
(  0) 0) |
| [45] |
Zimmerman A R, Ahn M Y. Organo-mineral–enzyme interaction and soil enzyme activity[M]//Shukla G, Varma A. Soil enzymology. Berlin, Heidelberg: Springer, 2010: 271-292.
(  0) 0) |
| [46] |
Huang W, Kuzyakov Y, Niu S, et al. Drivers of microbially and plant-derived carbon in topsoil and subsoil[J]. Global Change Biology, 2023, 29: 6188-6200. DOI:10.1111/gcb.16951
(  0) 0) |
| [47] |
Pronk G J, Heister K, Kögel-Knabner I. Amino sugars reflect microbial residues as affected by clay mineral composition of artificial soils[J]. Organic Geochemistry, 2015, 83/84: 109-113. DOI:10.1016/j.orggeochem.2015.03.007
(  0) 0) |
| [48] |
Keiluweit M, Bougoure J J, Nico P S, et al. Mineral protection of soil carbon counteracted by root exudates[J]. Nature Climate Change, 2015, 5: 588-595. DOI:10.1038/nclimate2580
(  0) 0) |
| [49] |
Griepentrog M, Bodé S, Boeckx P, et al. Nitrogen deposition promotes the production of new fungal residues but retards the decomposition of old residues in forest soil fractions[J]. Global Change Biology, 2014, 20: 327-340. DOI:10.1111/gcb.12374
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


