2. 山西亚高山草地生态系统教育部野外科学观测研究站, 山西宁武 036700
2. Field Scientific Observation and Research Station of the Ministry of Education of Shanxi Subalpine Grassland Ecosystem, Ningwu, Shanxi 036700, China
2022年我国煤炭产量约为44.5亿吨,其中山西煤炭产量超13亿吨,占全国产量近三分之一,在为国家提供充足煤炭能源的同时,也产生了约2 052 km2的煤炭采空区(废弃矿井)[1]。煤矿的露天开采会对陆地生态系统造成严重干扰,通过开挖移除地表覆盖层,剥离的土壤和煤矸石混合形成矸石山,影响土壤环境和植物群落,进而破坏微生物的生存环境[2-4]。矸石山裸露的土壤极易受到风蚀和水蚀作用并发生自燃,因此矸石山修复成为矿区生态修复的重难点问题,其中植被修复是矿区矸石山修复的主要修复方式之一[5]。植物由于生长条件、地表覆盖、根际渗出物的化学成分和根际周转率的不同,可能影响土壤中微生物组成和多样性[6]。作为植物与土壤相互作用的微域环境,植物根际通过分泌有机碳和抗菌物质等吸引有益微生物的富集,微生物能够促进凋落物和土壤有机质的分解从而介导植物-土壤生态系统的物质循环[7-8]。因此,探究植被类型对微生物群落及生态系统功能的影响,对矿区生态修复具有重要意义。
环境干扰能够改变土壤生物地球化学循环过程,进而影响土壤微生物组[9-10]。对黄土高原煤矿沉陷区土壤微生物多样性影响的研究表明,移植树木显著改变煤矿沉陷区土壤微生物多样性和群落结构[11]。榆树/杨树植物修复10年后煤矸石复垦区土壤生态功能研究发现,植物修复也显著改变土壤微生物结构和功能[12]。然而上述研究多集中于非根际土壤,大多数植物-土壤-微生物的相互作用发生在距离根际1 mm的根际土壤中[13]。此外,促进植物生长的根际细菌在陆地生态系统恢复中发挥重大作用,比如通过促进固氮、矿物质降解,增强植物矿物质吸收等方法定植植物根部并促进植物生长[14]。高寒露天采煤扰动区植物根际微生物群落结构与功能演替机制研究表明,植物根际土壤中的优势菌主要为采取r策略的变形菌[15]。然而,关于黄土高原半干旱区煤矸石复垦区植物修复对根际土壤微生物的影响尚不清楚。
本研究利用16S rRNA高通量测序技术,探究山西大同晋华宫煤矿复垦区不同复垦植被下根际土壤细菌群落结构和多样性。由于不同植被凋落物和根际分泌物的不同,从而影响土壤环境和微生物群落。据此,本研究主要目标是分析不同类型的复垦植被对于土壤理化性质和根际土壤微生物的影响,明确不同复垦植被类型对土壤理化性质、土壤肥力、酶活性及根际土壤细菌群落的影响,为半干旱区煤矿复垦区生态修复过程中的植被选择提供科学依据。
1 材料与方法 1.1 研究区概况晋华宫煤矿位于大同煤田东北端,为低山丘陵区,植被稀少,多为黄土覆盖。坐标113°6′~113°14′N,40°4′~40°10′E,海拔1 200~1 400 m。矿区地处晋西北地区,为温带大陆性季风气候,年平均降雨量400 mm左右,冬季受寒流影响,气候寒冷干燥。晋华宫煤矿矸石山复垦区于2005年完成复垦,并种植侧柏、樟子松、油松、云杉和桧柏用以生态修复。
1.2 样品采集与分析于2021年7月在侧柏、樟子松、油松、云杉和桧柏五种植被类型各设置3个重复样地,每个样地中选取3株植被,用土钻在距离树干30 cm处5~20 cm范围内钻取土壤与根的混合样品,挑出细根后先甩掉附着在根上的松散土壤,再将根部放入无菌袋中低温保存。将根部样品带回实验室后转移至PBS溶液中(130 mmol·L-1 NaCl,7 mmol·L-1 Na2HPO4,3 mmol·L-1 KH2PO4,pH 7.4),使用摇床室温振荡后,用消毒镊子挑除根系,最后离心收集根际土壤[16-17]。将收集到的土壤直接用于土壤酶活性和土壤微生物测定,使用自然风干、研磨和筛分后的土壤测定土壤理化性质。
1.3 土壤理化性质和酶活性的测定土壤容重(SBD)使用环刀法测定;土壤pH使用玻璃电极pH计(STARTER300,Ohaus,美国)测定,土水比1︰2.5;全碳(TC)、全氮(TN)、全硫(TS)使用元素分析仪(Vario MACRO cube,Elmenter,德国)测定[18]。土壤酶活性的测定使用生工生物工程(上海)股份有限公司的试剂盒测定,按照试剂盒说明书进行操作。其中,土壤碱性蛋白酶(S-ALPT)采用福林酚比色法测定;土壤碱性磷酸酶(S-AKP/ALP)采用磷酸苯二钠比色法测定;土壤脲酶(S-UE)采用靛酚比色法;土壤脱氢酶(S-DHA)采用2,3,5-三苯基四唑氯化物比色法(TTC法)[19]。
1.4 土壤DNA提取与高通量测序根际土壤微生物高通量测序在美格基因科技有限公司(广东)完成,方法为:采用Advanced Soil DNA Kit土壤试剂盒提取DNA,以DNA为模板,使用带barcode的特异引物及TaKaRa Premix Taq®Version2.0(TaKaRa BioTechnology Co.Dalian,China)进行PCR扩增,细菌16S rRNA基因V4-V5区采用引物(515F:5’-GTGCCAGCMGCCGCGGT AA-3’;806R:5’-CCGTCAATTCMTTTRAGTTT)。使用Illumina Nova 6000平台进行PE250测序,测序结果经fastp(V0.14.1)质控后,利用usearch- fastq-mergepairs(V10)进行拼接。OTU采用Uparse软件聚类,比对Silva 16S rRNA数据库(v132)完成注释。
1.5 数据处理与分析使用单因素方差分析不同植被类型下土壤理化性质、根际土壤酶活性、细菌α多样性和优势菌门差异性,使用非度量多维尺度分析(NMDS)根际土壤细菌群落β多样性。使用冗余分析(RDA)确定影响根际土壤细菌群落的关键环境因子,并对优势菌门与环境因子之间进行Mantel test分析。使用偏最小二乘路径分析模型分析植被-土壤-细菌群落的相互作用。通过主成分分析(PCA)计算各特征值的贡献率,根据累进贡献率确定各主成分评价值(ai),并确定各主成分的评价值(Zi),从而计算综合主成分评价值,即综合肥力指标(integrated fertility index,IFI)[20-21],公式如下:
| $ {\text{IFI}} = \sum {{a_i}Z\mathop /\limits_i } \sum {{a_i}} $ |
统计学分析与绘图使用R 4.1.3的ggcor、vegan、ggplot2、factoextra包完成[22-23]。
2 结果 2.1 不同植被类型对煤矿区复垦土壤性质与酶活性的影响不同植被类型下土壤理化性质见表 1,樟子松林土壤容重(1.36 g∙mL-1)显著低于其他植被样地,5种复垦植被根际土壤pH均偏碱性,云杉林和樟子松pH最低(P < 0.05)。桧柏林全碳、全氮和全硫含量显著高于其他样地,分别为29.91、1.38、1.82 g∙kg-1。侧柏林和油松林全氮和全硫含量显著低于其他样地,且侧柏林全碳含量亦低于其他植被(P < 0.05)。
|
|
表 1 不同植被恢复情景煤矿区土壤性质与酶活性 Table 1 Soil properties and enzyme activity in coal mining areas under different vegetation restoration scenarios |
根际土壤酶活性在不同植被样地中表现出差异性(表 1),油松林根际土壤碱性蛋白酶活性为0.271 μmol∙d-1∙g-1,显著高于其他样地,桧柏林显著最低(P < 0.05)。云杉林具有显著高的碱性磷酸酶和脲酶活性(P < 0.05),分别为20 947 μmol∙d-1∙g-1、933.5 mg∙d-1∙g-1。桧柏表现出最低的碱性蛋白酶活性(0.051 mg∙d-1∙g-1),侧柏表现出最低的脲酶活性(355.5 mg∙d-1∙g-1)。土壤脱氢酶在不同复垦植被根际土壤间差异不显著(P > 0.05)。
2.2 不同植被类型对煤矿区复垦土壤根际细菌多样性的影响不同植被复垦类型根际土壤细菌的α多样性存在显著差异(P < 0.05;图 1a)。樟子松林和云杉林Chao1指数显著高于其他样地,分别为3 624、3 588,说明樟子松林和云杉林有较高的菌群丰富度,侧柏林Chao1指数(2 894)显著低于其他样地(P < 0.05);Observerd OTUs在五个不同复垦样地的根际土壤中差异显著,其中樟子松林Observerd OTUs指数(3 627)显著高于其他四个样地,其次为云杉林根际土壤,侧柏林的Observerd OTUs指数最小(P < 0.05)。Observerd OTUs指数结果与Chao1指数结果基本一致,均表现出樟子松林根际土壤菌群丰富度最高,其次为云杉林,侧柏林菌群丰度最低。
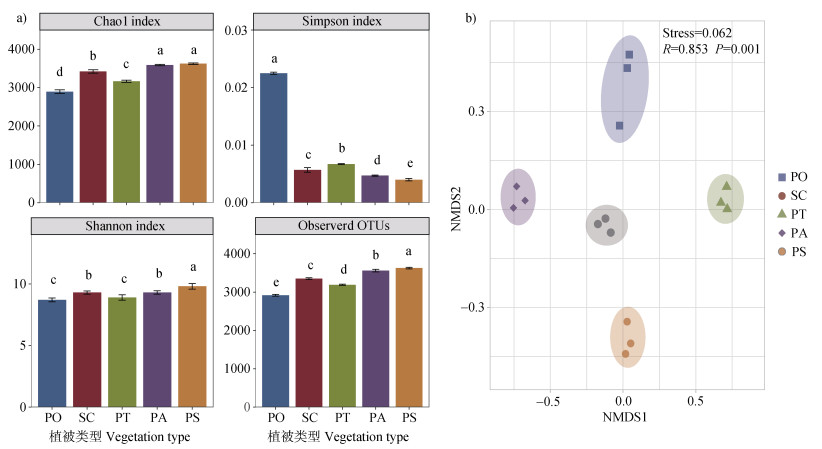
|
注:不同小写字母表示样地间差异显著性(P < 0.05,n = 3)。下同。 Note: Different lowercase letters indicate significant differences between samples(P < 0.05, n = 3). The same below. 图 1 不同植被类型下根际土壤细菌群落α多样性(a)和NMDS分析(b) Fig. 1 Alpha diversity(a)and NMDS analysis(b)of rhizosphere soil bacteria in different regeneration scenarios |
樟子松林的Shannon指数(9.89)显著高于其他复垦样地,说明樟子松林有最高的群落多样性,其次为云杉林和桧柏林,侧柏林和油松林的Shannon指数最低(P < 0.05);Simpson指数在不同植被复垦样地中具有显著性的差异,其中侧柏林最高,樟子松林最低(P < 0.05)。Simpson指数越低,群落多样性越高,因此Simpson指数结果与Shannon指数结果一致,均表现出樟子松林具有最高的群落多样性,其次为云杉林,侧柏林群落多样性最低。综上,樟子松林根际土壤细菌多样性和丰度显著高于其他样地。
基于Bray-Curtis相似性系数对不同植被复垦类型根际土壤中细菌群落进行非度量多维尺度(NMDS)分析,结果如图 1b所示。NMDS图谱显示每个植被复垦类型的3次重复基本聚在一起,说明本研究细菌群落结构样本重复性较好,且胁迫系数(Stress)较小(0.062)。单因素方差分析表明不同复垦植被根际土壤细菌群落之间存在显著差异(r = 0.853,P = 0.001)。
2.3 不同植被类型对煤矿区复垦土壤细菌群落组成的影响根据分类学分析结果,5个样地中所选取的15个样本得到的12 345个OTU共分为33个门(Phyla),不同植被复垦类型根际土壤中主要的细菌群落组成相似,但相对丰度却有较大的差异。图 2反映不同植被类型根际土壤相对丰度前10的细菌门水平构成为:变形菌门、酸杆菌门、放线菌门、拟杆菌门、芽单胞菌门、绿弯菌门、浮霉菌门、疣微菌门、蓝藻菌门和未分类部分,其中变形菌门、酸杆菌们、放线菌门、拟杆菌门优势菌门,各相对丰度约为22.78%~28.78%、11.75%~25.29%、9.78%~25.68%、10.24%~15.81%,总的相对丰度达到69.46%~82.01%。
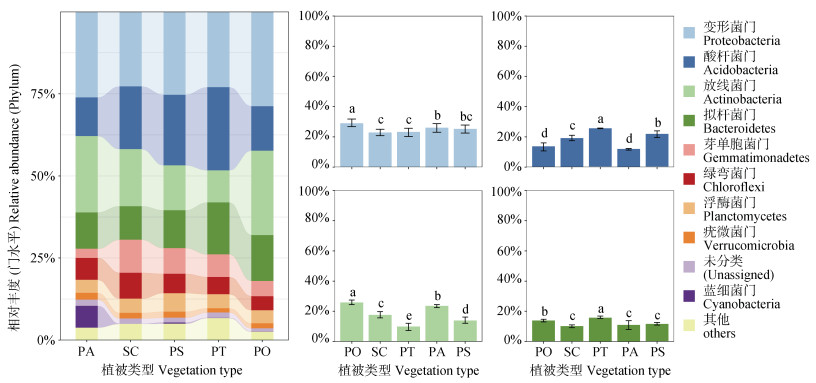
|
图 2 不同植被类型门水平相对丰度前10的细菌群落组成 Fig. 2 Bacterial community composition of the top 10 phylum level relative abundance in different regeneration scenarios |
不同植被类型根际土壤中优势菌门的相对丰度存在差异(图 2)。侧柏林根际土壤中变形菌门相对丰度显著高于其他样地(P < 0.05),其次为云杉林,桧柏林根际土壤和油松林根际土壤的变形菌门相对丰度之间无显著差异(P > 0.05),但均显著低于其他样地(P < 0.05);油松林根际土壤酸杆菌门显著高于其他样地,其次为樟子松林,云杉林根际土壤酸杆菌门相对丰度最低(P < 0.05);放线菌门在不同植被复垦样地之间存在显著性差异,其中侧柏林根际土壤放线菌门相对丰度显著高于其他复垦样地,其次为云杉林,油松林根际土壤放线菌门最低(P < 0.05);油松林根际土壤拟杆菌门相对丰度显著最高,其次为侧柏林,桧柏林,云杉林和樟子松林之间差异不显著(P > 0.05),但显著低于其他两个样地(P < 0.05)。
不同植被类型根际土壤相对丰度前10的细菌属水平组成为:RB41、链霉菌属(Streptomyces)、MND1、Ferruginibacter、贪噬菌属(Variovorax)、鞘氨醇单胞菌属(Sphingomonas)、Steroidobacter、苔藓杆菌属(Bryobacter)、Haliangium、类诺卡氏属(Nocardioides)(图 3)。不同植被类型根际土壤中优势菌属的相对丰度存在差异,其中RB41、Ferruginibacter、MND1、Haliangium在油松根际土壤中占有优势,贪噬菌属(Variovorax)、类诺卡氏属(Nocardioides)在云杉根际土壤中占有优势,链霉菌属(Streptomyces)、Steroidobacter在侧柏根际土壤中占有优势,在桧柏和樟子松根际土壤中占优的分别为鞘氨醇单胞菌属(Sphingomonas)和苔藓杆菌属(Bryobacter)。
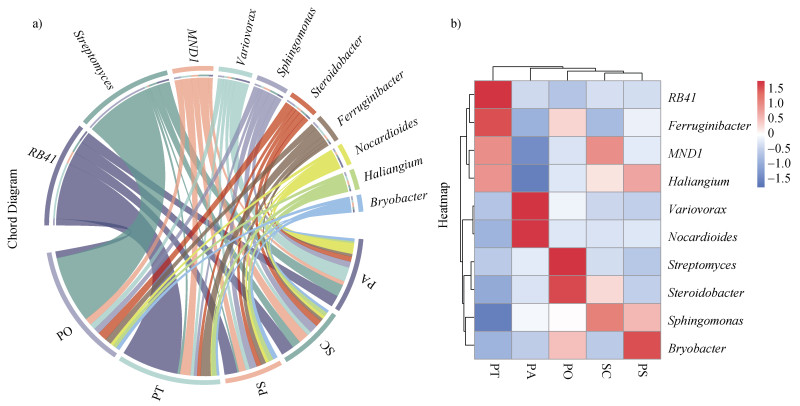
|
图 3 优势属与样地关系(a)和不同植被类型细菌群落优势属热图(b) Fig. 3 Relationships between dominant genera and sample sites(a)and Heat map of dominant genera of bacterial communities in different vegetation types(b) |
晋华宫煤矿复垦区5个不同植被复垦类型的根际微生物群落与土壤环境因子的冗余分析(RDA)表明:第一主成分轴和第二主成分轴分别能够解释根际土壤微生物组成和生境因子关系变异的78.89%和10.35%(图 4a)。不同复垦植被根际土壤微生物较分散,相同复垦植被根际土壤微生物较集中,这与NMDS分析结果相一致。通过对每个环境因子的Monte Carlo显著性检验显示:全硫、碱性蛋白酶对土壤细菌组成具有极显著影响(P < 0.01),土壤容重具有显著影响(P < 0.05)。
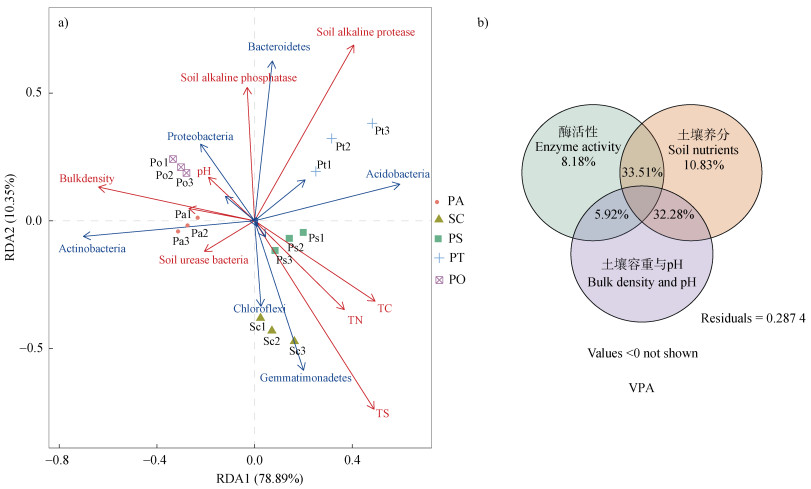
|
图 4 微生物与环境因子的RDA分析排序(a)和VPA分析(b) Fig. 4 Ranking chart of RDA analysis(a)and VPA analysis(b)of microbial and environmental factors |
冗余分析中箭头长度和夹角表明:芽单胞菌门、绿弯菌门与全碳、全氮、全硫呈正相关,拟杆菌门、变形菌门与之相反,拟杆菌门、变形菌门与碱性蛋白酶、碱性磷酸酶、pH呈正相关;酸杆菌门与碱性蛋白酶、全碳呈正相关,放线菌门与之相反,放线菌门与脲酶、土壤容重、土壤脱氢酶、pH呈正相关。
进一步方差分解分析(VPA)结果表明,根际土壤酶环境因子、土壤养分环境因子和土壤容重与pH因子分别从不同维度影响了不同复垦植被根际土壤的微生物群落(图 4b)。在复垦植被根际土壤微生物群落构建过程中,土壤酶环境因子、土壤养分因子和土壤容重与pH因子总共可以解释71.26%的微生物群落变异,其中土壤酶环境因子和土壤理化因子共解释33.51%,土壤容重与pH因子和土壤养分因子共解释32.28%。
以植物类型、土壤理化、土壤酶活性和细菌多样性与组成构建偏最小二乘路径分析模型(图 5a),模型结果表明,植被对土壤理化、土壤酶活性、细菌群落具有积极影响,土壤理化也对细菌群落具有积极影响,而土壤酶活性对土壤理化和细菌群落具有负影响。结果说明植被能够直接影响细菌群落,也能通过影响土壤理化和土壤酶活性间接影响细菌群落。
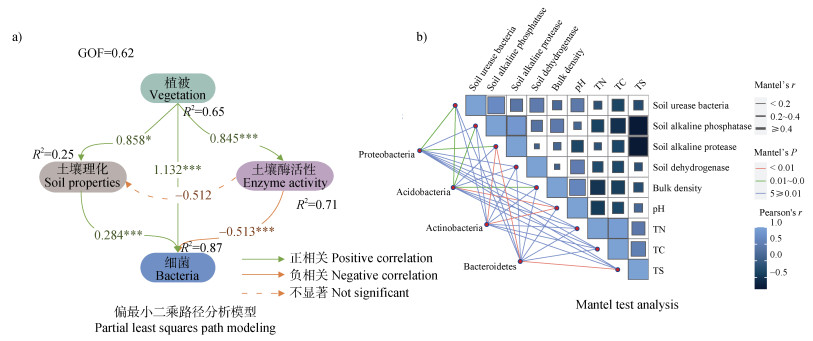
|
注:a)图线上数字为标准化的路径系数,显著路径表示为:*P < 0.05;**P < 0.01;***P < 0.001。 Note: Numbers on lines are standardized path coefficients. The significant paths are reported as follows: *P < 0.05;**P < 0.01;***P < 0.001. 图 5 植被、土壤和细菌相互作用的偏最小二乘分析模型(a)和优势门与环境因子的Mantel test分析(b) Fig. 5 Partial least squares path modeling for the interaction between vegetation, soil, and bacteria(a)and Mantel test analysis of dominant phylum and environmental factors(b) |
由Mantel检验(图 5b)可知,变形菌门与脲酶、碱性蛋白酶显著相关(r = 0.2~0.4,P = 0.01~0.05);酸杆菌门与脲酶、碱性磷酸酶、土壤容重显著相关(r = 0.2~0.4,P = 0.01~0.05),与pH极显著相关(r ≥ 0.4,P < 0.01);放线菌门与碱性蛋白酶、pH极显著相关(r = 0.2~0.4,P < 0.01);拟杆菌门与碱性蛋白酶、全硫极显著相关(r ≥ 0.4,P < 0.01)。
2.5 不同植被类型的土壤肥力指数(IFI)综合土壤理化性质、根际土壤酶活性和细菌多样性计算土壤肥力指数IFI(图 6)。运用主成分分析,抽取特征向量值大于1的主成分3个,其特征向量值分别为4.556、4.038、1.107,累进贡献率为97.008%。第一主成分贡献率达到45.559%,其中pH、脲酶、土壤脱氢酶载荷系数大;第二主成分贡献率达到40.375%,其中全氮、全碳载荷系数高;第三主成分贡献率达到11.073%,其中碱性蛋白酶载荷系数高。将不同复垦植被样地的主成分得分和贡献率进行加权,获得土壤肥力指数,由大到小依次为樟子松、云杉、桧柏、油松、侧柏,表明樟子松林和云杉林有助于提高根际土壤细菌多样性和土壤肥力。
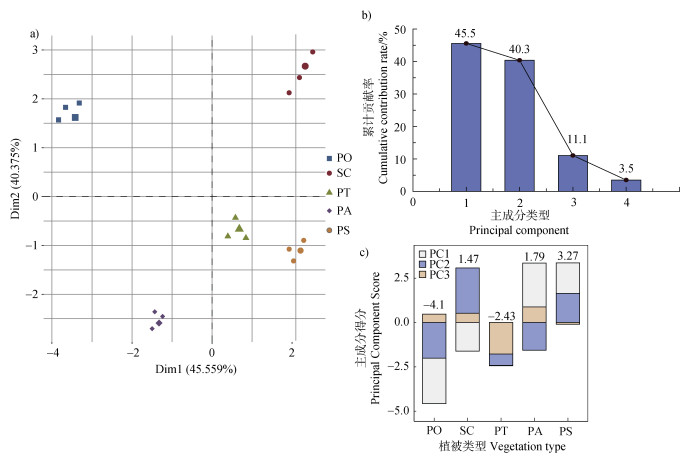
|
图 6 主成分分析(a)、主成分累计贡献率(b)和主成分得分(c) Fig. 6 Principal component analysis(a), Cumulative contribution rate of principal components(b), and Principal component score(c) |
不同植被类型由于凋落物和根际分泌物的不同,进而影响土壤碳氮磷等营养元素的含量和土壤微生物特征[24]。本研究发现樟子松林、桧柏林具有显著高的全碳和全氮(P < 0.05)(表 1),这可能是由于不同植被在凋落物质量和根际分泌物不同导致。植物凋落物对于土壤碳的输入具有重要贡献,土壤中微生物大多是异养,土壤中丰富的营养物质能够为土壤微生物维持其生命活动提供能量[25]。在植被恢复过程中,添加外源碳有机肥会刺激酶活性的提高,为微生物提供碳源和能量,提高微生物生物量[26]。本研究中樟子松林相对高的碳氮等营养元素同样导致其具有显著高的微生物丰度和微生物多样性(图 1a)。
土壤酶主要由土壤微生物和植物根际产生,土壤微生物通过释放于环境中的酶,介导土壤有机质的降解和碳氮磷等营养元素的吸收同化[27-28]。本研究中不同植被之间酶活性差异较大(表 1),可能是因为不同植被根际分泌物和根际微生物区系存在差异。蛋白酶和脲酶是土壤氮素循环相关的酶[29],蛋白酶可以将蛋白质分解为小的肽链和氨基酸,为植物生长提供氮素和能量[30]。研究中碱性蛋白酶极显著影响(P < 0.01)土壤微生物,且与大多数优势菌门显著相关(P < 0.05)(图 4),可见碱性蛋白酶能更好地指示根际微生物的变化。此外,土壤微生物能够产生碱性磷酸酶和酸性磷酸酶,但植物根只能产生酸性磷酸酶,碱性磷酸酶可以被视为磷需求的指标[31]。土壤脲酶在土壤有机碳-氮键的水解过程种发挥作用,可以反映土壤氮素供应情况[31]。云杉林的碱性磷酸酶和脲酶显著高于其他样地(P < 0.05)(表 1),这可能是由于云杉林较低的全氮、全碳等营养物质导致较高的氮、磷元素获得酶活性。
土壤细菌群落受到不同植被类型影响,如不同植被类型对黄土根际土壤微生物过程和群落结构具有影响[32]。本文非度量多维尺度分析(NMDS)结果同样表明各样地之间微生物群落差异性显著(图 1)。在本研究中,变形菌门、酸杆菌门、放线菌门、拟杆菌门是优势菌门(图 2),这与朔州平朔煤矿土壤中细菌优势门研究结果基本一致[33],优势属主要为RB41、链霉菌属(Streptomyces)、MND1、Ferruginibacter、贪噬菌属(Variovorax)等(图 3),且优势属相对丰度在不同植被类型中存在差异。不同植被类型的优势菌门也存在显著差异(图 2),其中变形菌门中包含与植物共生的固氮细菌,可以提高植物固氮能力,其丰富度可以反映土壤有机质等养分含量情况[34],因此Mantel test分析表明变形菌门与脲酶、碱性蛋白酶显著相关(P < 0.05)(图 5)。酸杆菌门可以通过代谢产酸降低碱性土壤的pH[35],在本研究中酸杆菌门也表现出与pH极显著相关(P < 0.01)。作为k-策略细菌代表的放线菌门在矿区门水平的相对丰度较高,并且放线菌与碱性蛋白酶、pH极显著相关(图 4)。RDA研究发现全硫、容重与土壤微生物显著相关(图 4),这主要是复垦区采用土石混排的覆土方式,使土壤中含有煤矸石,改变了土壤紧实度、透水透气情况,增加了土壤全硫含量,不同复垦植被对环境因子适应能力不同从而显著影响土壤微生物群落结构。
本研究偏最小二乘路径分析模型表明,植被对土壤理化、土壤酶活性和细菌群落组成与多样性产生了显著的正效应,也间接通过影响土壤理化和土壤酶活性来影响土壤细菌群落组成和多样性(图 5a)。在植物-土壤-微生物之间的物质和能量循环中,植物根部向根际分泌了大量的化合物,分泌物影响养分循环,形成土壤理化性质,并作为营养物质和信号作用于与根部相关的微生物群落[35-36]。有研究表明,在拟南芥中三萜类分泌的改变影响微生物组的组成,苹果酸的分泌因叶子病原体感染而改变,吸引了地下生物控制微生物,分泌的酚酸被植物相关的微生物选择性的代谢[37]。此外,酶是土壤微生物实现其生态功能的重要驱动因素,土壤生态酶化学计量法研究发现黄土高原植被恢复后土壤微生物养分代谢受磷限制[38]。本研究分析了植被类型对煤矿区复垦土壤根际微生物的影响,不仅为半干旱区煤矿复垦区生态恢复的植被选择提供科学依据,同时为矿区生态恢复研究领域中植物与土壤微生物互作的研究提供方法与思路。
4 结论不同植被复垦类型对土壤理化、根际土壤酶活性和细菌群落具有显著影响,樟子松林显著降低土壤pH,缓解土壤碱性,降低土壤容重,增加土壤养分,能够为微生物提供更加适宜的条件,导致其具有显著高的细菌丰度和多样性。不同植被之间细菌群落差异性显著,变形菌、放线菌、酸杆菌、拟杆菌门是其优势菌门,全硫、土壤容重和碱性蛋白酶是影响细菌结构组成的关键因子。以土壤理化性质、根际土壤酶活性和细菌多样性计算综合土壤肥力指数,表现为樟子松林和云杉林有助于提高根际土壤细菌多样性和土壤肥力,从而有利于煤矿复垦区的生态恢复。
| [1] |
Department of Natural Resources of Shanxi Province. Turning waste into treasure: 128 million cubic metres of coal bed methane extracted and utilised in Shanxi coal mining areas[EB/OL]. (2022-08-18)[2023-06-25]. https://zrzyt.shanxi.gov.cn/xw/chnl399/202208/t20220818_6958608.shtml.[山西省自然资源厅. 变废为宝山西煤炭采空区煤层气抽采利用1.28亿立方米[EB/OL]. (2022-08-18)[2023-06-25]. https://zrzyt.shanxi.gov.cn/xw/chnl399/202208/t20220818_6958608.shtml.]
(  0) 0) |
| [2] |
Yu H, Chen C, Shao C F. Spatial and temporal changes in ecosystem service driven by ecological compensation in the Xin'an River Basin, China[J]. Ecological Indicators, 2023, 146: 109798. DOI:10.1016/j.ecolind.2022.109798
(  0) 0) |
| [3] |
Glina B, Mendyk Ł, Piernik A, et al. Local weather conditions determine DOC production and losses from agricultural fen soils affected by open-pit lignite mining[J]. Catena, 2022, 211: 106012. DOI:10.1016/j.catena.2021.106012
(  0) 0) |
| [4] |
Chang Y Y, Chen F, Zhu Y F, et al. Influence of revegetation on soil microbial community and its assembly process in the open-pit mining area of the Loess Plateau, China[J]. Frontiers in Microbiology, 2022, 13: 992816. DOI:10.3389/fmicb.2022.992816
(  0) 0) |
| [5] |
Liu J, Zhang S W, Li E W, et al. Effects of cubic ecological restoration of mining wasteland and the preferred restoration scheme[J]. Science of the Total Environment, 2022, 851: 158155. DOI:10.1016/j.scitotenv.2022.158155
(  0) 0) |
| [6] |
Li M J, Song Z, Li Z B, et al. Populus root exudates are associated with rhizosphere microbial communities and symbiotic patterns[J]. Frontiers in Microbiology, 2022, 13: 1042944. DOI:10.3389/fmicb.2022.1042944
(  0) 0) |
| [7] |
Senthilnathan A, D'Andrea R. Niche theory for positive plant-soil feedbacks[J]. Ecology, 2023, 104(4): e3993. DOI:10.1002/ecy.3993
(  0) 0) |
| [8] |
Farooq T H, Chen X Y, Shakoor A, et al. Unraveling the importance of forest structure and composition driving soil microbial and enzymatic responses in the subtropical forest soils[J]. Forests, 2022, 13(10): 1535. DOI:10.3390/f13101535
(  0) 0) |
| [9] |
Ye G H, Chu B, Tang Z S, et al. Soil microbial and macroinvertebrate functional diversity in response to Zokor disturbance in Tibetan alpine meadow[J]. Catena, 2023, 225: 107014. DOI:10.1016/j.catena.2023.107014
(  0) 0) |
| [10] |
Mi W H, Guo S K, Ma J Z, et al. Long-term different fertilization regimes impact on the fate of root-derived C and microbial community structure in paddy soil[J]. European Journal of Soil Biology, 2023, 116: 103487. DOI:10.1016/j.ejsobi.2023.103487
(  0) 0) |
| [11] |
Guo Y N, Liu X H, Tsolmon B, et al. The influence of transplanted trees on soil microbial diversity in coal mine subsidence areas in the Loess Plateau of China[J]. Global Ecology and Conservation, 2020, 21: e00877. DOI:10.1016/j.gecco.2019.e00877
(  0) 0) |
| [12] |
Bai D S, Yang X, Lai J L, et al. In situ restoration of soil ecological function in a coal gangue reclamation area after 10 years of elm/poplar phytoremediation[J]. Journal of Environmental Management, 2022, 305: 114400. DOI:10.1016/j.jenvman.2021.114400
(  0) 0) |
| [13] |
Hartmann A, Rothballer M, Schmid M. Lorenz Hiltner, a pioneer in rhizosphere microbial ecology and soil bacteriology research[J]. Plant and Soil, 2008, 312(1): 7-14.
(  0) 0) |
| [14] |
Wang Y, Li W Q, Du B H, et al. Effect of biochar applied with plant growth-promoting rhizobacteria(PGPR)on soil microbial community composition and nitrogen utilization in tomato[J]. Pedosphere, 2021, 31(6): 872-881. DOI:10.1016/S1002-0160(21)60030-9
(  0) 0) |
| [15] |
Wang H F, Liu H L, Yang T H, et al. Mechanisms underlying the succession of plant rhizosphere microbial community structure and function in an alpine open-pit coal mining disturbance zone[J]. Journal of Environmental Management, 2023, 325: 116571. DOI:10.1016/j.jenvman.2022.116571
(  0) 0) |
| [16] |
Edwards J, Johnson C, Santos-Medellín C, et al. Structure, variation, and assembly of the root-associated microbiomes of rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(8): E911-E920.
(  0) 0) |
| [17] |
He X H, Yang Y Z, Yuan Z L. Protocol for sampling of root and rhizosphere soils from trees in natural fields//Microbiome protocols ebook[M]. 2021, Bio- 101: e2003655. https://bio-protocol.org/bio101/MPB.[何兴华, 杨预展, 袁志林. 野外树木根系取样及根际土收集操作规程//微生物组实验手册[M]. 2021, Bio-101: e2003655. https://bio-protocol.org/bio101/MPB.]
(  0) 0) |
| [18] |
Zhang G L, Gong Z T. Soil survey laboratory methods (In Chinese). Beijing: Science Press, 2012. [张甘霖, 龚子同. 土壤调查实验室分析方法[M]. 北京: 科学出版社, 2012.]
(  0) 0) |
| [19] |
Guan S Y. Soil enzyme and its research method (In Chinese). Beijing: Agriculture Press, 1986. [关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986.]
(  0) 0) |
| [20] |
Yang S, He X Y, Su Y R, et al. Effects of parent rock and land use pattern on soil fertility in Karst region of Northwest Guangxi (In Chinese)[J]. Chinese Journal of Applied Ecology, 2010, 21(6): 1596-1602. [杨珊, 何寻阳, 苏以荣, 等. 岩性和土地利用方式对桂西北喀斯特土壤肥力的影响[J]. 应用生态学报, 2010, 21(6): 1596-1602.]
(  0) 0) |
| [21] |
Li J J, Liu F, Zhou X M. Effects of different reclaimed scenarios on soil microbe and enzyme activities in mining areas (In Chinese)[J]. Environmental Science, 2015, 36(5): 1836-1841. [李君剑, 刘峰, 周小梅. 矿区植被恢复方式对土壤微生物和酶活性的影响[J]. 环境科学, 2015, 36(5): 1836-1841.]
(  0) 0) |
| [22] |
Wickham H. ggplot2: elegant graphics for data analysis . 2nd ed. Cham, Switzerland: Springer, 2016.
(  0) 0) |
| [23] |
Kassambara A. Factoextra: Extract and visualize the results of multivariate data analyses [R package factoextra version 1.0. 7][CP]. 2020.
(  0) 0) |
| [24] |
Shahzad T, Chenu C, Genet P, et al. Contribution of exudates, arbuscular mycorrhizal fungi and litter depositions to the rhizosphere priming effect induced by grassland species[J]. Soil Biology & Biochemistry, 2015, 80: 146-155.
(  0) 0) |
| [25] |
Smith J L, Paul E A. Chapter 7: The significance of soil microbial biomass estimations[M]//Bollag J M, Stotzky G. Soil biochemistry. New York: Routledge, 2017: 357-398.
(  0) 0) |
| [26] |
Li J J, Yan J X, Li H J. Effects of different reclaimed measures on soil carbon mineralization and enzyme actives in mining areas (In Chinese)[J]. Acta Ecologica Sinica, 2015, 35(12): 4178-4185. [李君剑, 严俊霞, 李洪建. 矿区不同复垦措施对土壤碳矿化和酶活性的影响[J]. 生态学报, 2015, 35(12): 4178-4185.]
(  0) 0) |
| [27] |
Ma J, Gonzalez-Ollauri A, Zhang Q, et al. Ecological network analysis to assess the restoration success of disturbed mine soil in Zoucheng, China[J]. Land Degradation & Development, 2021, 32(18): 5393-5411.
(  0) 0) |
| [28] |
Sinsabaugh R L, Hill B H, Follstad Shah J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment[J]. Nature, 2009, 462(7274): 795-798. DOI:10.1038/nature08632
(  0) 0) |
| [29] |
Du E Z, Terrer C, Pellegrini A F A, et al. Global patterns of terrestrial nitrogen and phosphorus limitation[J]. Nature Geoscience, 2020, 13(3): 221-226. DOI:10.1038/s41561-019-0530-4
(  0) 0) |
| [30] |
Wang K, Li M M, Liu D Q. Characteristics of biocrusts of different composition in the Tengger Desert and its effects on soil enzyme activity (In Chinese)[J]. Acta Ecologica Sinica, 2022, 42(14): 5859-5868. [王凯, 厉萌萌, 刘德权, 等. 腾格里沙漠不同组成生物结皮特征及其对土壤酶活性的影响[J]. 生态学报, 2022, 42(14): 5859-5868.]
(  0) 0) |
| [31] |
Juma N G, Tabatabai M A. Hydrolysis of organic phosphates by corn and soybean roots[J]. Plant and Soil, 1988, 107(1): 31-38. DOI:10.1007/BF02371541
(  0) 0) |
| [32] |
Ma J, Lu Y Q, Zhang Q, et al. Effects of coal mining subsidence on soil microbial community in the Loess Plateau (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(5): 1278-1288. DOI:10.11766/trxb202003160122 [马静, 卢永强, 张琦, 等. 黄土高原采煤沉陷对土壤微生物群落的影响[J]. 土壤学报, 2021, 58(5): 1278-1288.]
(  0) 0) |
| [33] |
Zhang P F. Research on the differences of soil microbial community structure under differentvegetation restoration in Reclaimed Land of Pingshuo Opencast Mine[D]. Beijing: China University of Geosciences(Beijing), 2016.[张鹏飞. 平朔矿区不同植被恢复方式下的土壤微生物群落结构差异研究[D]. 北京: 中国地质大学(北京), 2016.]
(  0) 0) |
| [34] |
Wan P, Hu Y B, Zhang G Q, et al. Soil bacterial communities under Pinus tabulaeformis Carr. and Bupleurum chinense plantations at Xiaolongshan Mountain of Gansu Province (In Chinese)[J]. Acta Ecologica Sinica, 2018, 38(17): 6016-6024. [万盼, 胡艳波, 张弓乔, 等. 甘肃小陇山油松与柴胡栽培土壤细菌群落特征[J]. 生态学报, 2018, 38(17): 6016-6024.]
(  0) 0) |
| [35] |
Zhalnina K, Louie K B, Hao Z, et al. Dynamic root exudate chemistry and microbial substrate preferences drive patterns in rhizosphere microbial community assembly[J]. Nature Microbiology, 2018, 3(4): 470-480. DOI:10.1038/s41564-018-0129-3
(  0) 0) |
| [36] |
Staley C, Ferrieri A P, Tfaily M M, et al. Diurnal cycling of rhizosphere bacterial communities is associated with shifts in carbon metabolism[J]. Microbiome, 2017, 5(1): 65. DOI:10.1186/s40168-017-0287-1
(  0) 0) |
| [37] |
McLaughlin S, Zhalnina K, Kosina S, et al. The core metabolome and root exudation dynamics of three phylogenetically distinct plant species[J]. Nature Communications, 2023, 14(1): 1649. DOI:10.1038/s41467-023-37164-x
(  0) 0) |
| [38] |
Xu M P, Li W J, Wang J Y, et al. Soil ecoenzymatic stoichiometry reveals microbial phosphorus limitation after vegetation restoration on the Loess Plateau, China[J]. Science of the Total Environment, 2022, 815: 152918. DOI:10.1016/j.scitotenv.2022.152918
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


