2. 福建师范大学地理科学学院, 福州 350007;
3. 安阳职业技术学院, 河南安阳 455099
2. School of Geographical Sciences, Fujian Normal University, Fuzhou 350007, China;
3. Anyang Vocational and Technical College, Anyang, Henan 455099, China
森林生态系统中植物凋落物通过微生物的分解作用,形成土壤有机质(SOM),影响土壤物质和能量循环过程[1]。然而,SOM库并不是均一的,根据其形成、持久性和功能上的不同,可以分成颗粒态有机质(particulate SOM,POM)与矿物结合态有机质(mineral-associated SOM,MAOM)[2-3],有机质的矿化必然与不同粒径土壤颗粒有机碳的转化以及分配有关[4]。研究不同粒径土壤颗粒中有机质的分解和生物降解性,可以评估与这些土壤颗粒相关的SOM的周转率与稳定机制[3,5]。
有机质的矿化作用主要是通过土壤微生物利用、分解土壤活性有机碳来完成[6],同时释放出CO2。大量的培养研究试图阐明不同粒径土壤颗粒中不同SOM的矿化机制,发现大粒径土壤颗粒有机碳矿化量较小粒径多,大团聚体中土壤有机质的生物利用度较高,有机碳矿化量随土壤粒径的减小而下降。比如,森林土壤分成三个粒径分级:砂粒(2 000~20 µm),粉粒(20~2 µm)和黏粒(< 2 µm)[4];或砂粒(2 000~63 µm),粉粒(63~6.3 µm)和黏粒(< 6.3 µm)[7],三者的碳矿化量为砂粒 > 黏粒 > 粉粒。或者是,砂粒(> 50 µm)碳分解快于粉粒(50~2 µm)和黏粒(< 2 µm)[8]。但也有不同的发现,比如,农业土壤通过干筛法分级为6个粒径组分(8.0~4.0、4.0~2.0、2.0~1.0、1.0~0.5、0.5~0.25和 < 0.25 mm),随着团聚体直径增加,CO2排放量降低[9];当土壤分级为团聚体4~2 mm、2~1 mm、1~0.5 mm和 < 0.5 mm,黏壤土中小粒径团聚体释放最多的CO2,但是砂壤土中较大团聚体释放最大的CO2 [10];最小的团聚体(< 2 mm)有最大的CO2累积排放量,然后为8~4 mm和4~2 mm团聚体[11]。可见,土壤不同粒径颗粒对其CO2排放的贡献不一,可能与物理分组等级的不统一,弱化了研究的可比性;以及不同粒径颗粒碳性质的差异有关。
土壤有机质的分解,与有机碳含量及物理性保护程度[11-12]、孔隙率和孔径大小[10]有关,也与比表面积、微生物活性、碳的可分解性等[4,9,13-14]有关。因此,土壤中可矿化碳的活性程度、相互转化的快慢和对环境的敏感程度,以及不同粒径土壤颗粒的性质等影响碳的生物利用,决定着碳的矿化速率。综上,不同粒径土壤颗粒有机碳的矿化可能是驱动碳动态与转化的条件之一,不同粒径土壤颗粒和全土的碳矿化差异可以揭示土壤中不同粒径土壤颗粒在整体上的相对重要性和彼此间的相互作用。然而,已有的研究对象(团聚体或粒径)的等级范围偏窄、代表性不足。因此,本文从不同粒径土壤颗粒(> 2 000、2 000~250、250~53、< 53、53~20、20~2、< 2 μm)的角度研究土壤碳的稳定与保存,有助于揭示有机质在土壤中长期保存的机理。
1 材料与方法 1.1 供试土壤试验用土来自福建省建瓯市万木林自然保护区,该地区属中亚热带季风气候,平均气温19.4℃,年均降水量1 732 mm,年均蒸发量1 466 mm,相对湿度81%,全年无霜期达277 d;土壤为花岗岩发育的红壤。于2019年9月在罗浮栲阔叶林(Castanopsis fabri),大约50 m×50 m范围内,选择三个方位,每个方位内采用随机多点取样,用土钻取土壤表层0~15 cm土样,混合后,剔除可见石块、植物根系和动植物残体,部分全土壤4℃保存备用,部分全土壤过8 mm筛,风干备用。
1.2 土壤粒径分组采用超声技术、湿筛分法和重复离心分离相结合的方法[4,14-15]进行土壤物理分组,共获得7种不同粒径大小:> 2 000、2 000~250、250~53、< 53、53~20、20~2、< 2 μm。具体方案如下:
(1)将风干土壤与去离子水混合1︰5(w︰v),用玻璃棒搅拌、浸泡2 h后,悬浮的植物残体用网兜打捞。超声探头置于土壤浑浊液中2 cm处,进行低能量超声(60 J·mL–1)(超声波处理器FS-900N,中国)。将土壤浑浊液,过2 000 μm筛网,用去离子水冲洗至筛网流出液清澈,收集筛网上 > 2 000 μm土壤颗粒。土壤浑浊液继续过250 μm筛网,用去离子水冲洗至筛网流出液清澈,收集筛网上2 000~250 μm土壤颗粒。
(2)紧接着用玻璃棒搅拌土壤浑浊液,超声探头置于2 cm处,进行高能量(450 J·mL–1)超声处理。土壤浑浊液继续过53 μm筛网,用去离子水冲洗至筛网流出液清澈,收集筛网上250~53 μm土壤颗粒。
(3)紧接着土壤浑浊液的一部分进行冷冻干燥,得到 < 53 μm土壤颗粒。< 53 μm(矿物结合态组分)包括53~20 μm、20~2 μm、< 2 μm颗粒。另一部分土壤浑浊液装入250 mL离心管中,在25 g的离心力下离心15 min后收集悬浮液,离心管中继续加去离子水搅动沉淀土壤、使其中小颗粒悬浮,再次离心15 min。重复这样的操作,离心时间减少,依次离心13 min、12 min和11 min,目的是充分沉淀 > 20 µm颗粒、悬浮 < 20 µm颗粒,收集的沉淀为53~20 µm颗粒。
(4)紧接着将收集的土壤悬浮液在15℃下以离心力150 g离心5 min后收集悬浮液,加入去离子水搅动沉淀土壤、使其中小颗粒悬浮,再次离心,重复四次。收集的沉淀为20~2 µm颗粒。紧接着将收集的土壤悬浮液在15℃下以离心力3 900 g离心30 min收集沉淀,获得 < 2 µm颗粒。
上述收集到的不同粒径土壤颗粒进行冷冻干燥,装入自封袋以供培养试验使用。计算粒径分组后,> 2 000 μm、2 000~250 μm、250~53 μm、53~20 μm、20~2 μm、< 2 μm颗粒的比例分别为14.2%、18.2%、9.8%、22.2%、16.6%、14.5%,回收率为95.4%,测定不同粒径土壤颗粒的全碳、全氮、孔隙体积、比表面积等指标,以揭示不同粒径土壤颗粒的基本理化性质差异。
1.3 培养试验针对全土壤和不同粒径土壤颗粒,各取干土100 g放入500 mL棕色玻璃瓶进行培养试验。土壤样品在20℃恒温箱中、于避光好氧(扎孔塑料盖盖于瓶口)、湿度调整为40%饱和含水量条件下,预培养14 d后。为了减少湿法筛分、超声处理、重复离心处理和冷冻干燥对土壤微生物群落的潜在影响,正式培养前于瓶中加入从新鲜全土壤中提取的营养液(100 μL)。根据Christensen [5]的理论,这种营养液是通过用100 mL去离子水与10 g新鲜全土壤混合震荡,静置一夜而制成的。不同粒径土壤颗粒接种营养液以消除微生物差异的方法被广泛应用于培养研究[4,16-17]。在25℃、60%饱和含水量条件下,正式培养60 d,培养期间每3天称重、用去离子水调节水分含量至初始值。
土壤样品于培养0、60后进行取样;于1、5、10、15、30、45、60 d进行气体取样。在每次气体取样之前,将培养瓶取出培养箱、置于实验室外空旷场地通风30 min后,抽取瓶中气体30 mL装入气袋,然后立即用带有长短气管的螺丝盖拧紧密封瓶子,密闭3 h后再取一次气体装入气袋,每次采样时间每个样品共计有2个气袋,待测气袋中的CO2浓度。在培养期间其他时间、螺丝盖取下,覆盖带有孔的塑料瓶盖确保处于好氧培养。测定培养前后不同粒径土壤颗粒的可溶性有机碳、活性与惰性有机碳和微生物生物量碳,计算CO2产生速率与累积排放量。
1.4 指标测定与计算(1)土壤基本理化性质的测定。在105℃烘干土壤至恒重后,根据水分变化计算含水率;土壤经水浸泡24 h、充分饱和后,排除重力水、烘干计算含水率[18];土壤过100目后、其全碳全氮采用碳氮元素分析仪(Elemantar vario MAX CN,德国)测定;土壤孔隙度与比表面积分别采用孔隙度分析仪和比表面积(ASAP 2460 Version 3.00)测定;芳香性指数(Specific ultraviolet absorbance at 254 nm,SUVA254)先采用紫外–可见光分光光度计(UV-2450,Shimadzu,日本)测定土壤待测液254 nm处的紫外吸光值,然后与土壤可溶性有机碳(DOC,Dissolved organic carbon)浓度之比计算得来[19]。DOC采用0.5 mol·L–1 K2SO4浸提土壤(水土比为4︰1),振荡离心后,经0.45μm滤膜抽滤,用总有机碳分析仪(TOC-VCPH/CPN,日本)测定滤液中DOC含量。游离氧化铁采用连二亚硫酸钠–柠檬酸钠–重碳酸钠提取、比色法测定[20]。
(2)土壤排放CO2浓度测定。土壤产生的CO2浓度,利用气相色谱仪(磐诺A91Plus型,中国)测定。基本参数如下:选用2m的Poropak Q(80/100mesh)作为分离柱,使用脉冲放电氦离子化检测器(PDHID)。柱箱温度、进样口温度和检测器温度分别设置为70、120和130℃,载气为高纯氦气,压力0.45MPa。CO2的产生速率计算[21]:F= k×××,式中F表示气体产生速率(μg·kg–1·d–1);k为常数,取值1.964;V为培养瓶体积(mL);m为干土重(kg);dc/dt为气体在观测时间内浓度随时间变化的直线斜率(μg·mL–1·d–1);T为培养温度(℃)。累积排放量采用相邻两次产生速率的平均值乘以间隔的时间而得。
(3)土壤活性和惰性有机碳的测定。采用两步硫酸水解法测定,称1.00 g土样于50 mL消煮管中,加20 mL2.5 mol·L–1H2SO4,盖上小漏斗105℃下消煮30 min,转移至离心管中,在4 500 r·min–1离心20 min,倒出上清液,再加入20 mL去离子水继续清洗离心,将两次上清液合并一起过0.45 μm滤膜,该水解产物为活性碳Ⅰ(labile pool Ⅰ,LPI-C)。离心管内的残留物清洗离心数次后于60℃烘干,再加2 mL13 mol·L–1H2SO4转移至离心管,室温下200 r·min–1震荡10 h,然后将酸稀释为1 mol·L–1后,再在105℃下油浴3 h,转移至离心管离心(同上),将两次的上清液过0.45 μm滤膜,此水解产物为活性碳Ⅱ(labile pool Ⅱ,LPII-C)[22]。LPI-C与LPII-C用总有机碳分析仪测定,土壤全碳减去LPI-C和LPII-C,即为惰性碳(Recalcitrant pool,RP-C)。土壤易氧化有机碳(Readily oxidizable carbon,ROC)测定采用KMnO4氧化法[23]。
(4)土壤微生物生物量碳的测定。微生物生物量碳(Microbial biomass carbon,MBC)采用氯仿熏蒸–0.5 mol·L–1硫酸钾浸提,通过总有机碳分析仪测定提取液总碳。计算MBC公式为:MBC= ΔEC/KC,式中,ΔEC为熏蒸与未熏蒸土壤提取液总有机碳含量的差值;KC为MBC的转换系数,为0.45[20]。
1.5 统计分析用Microsoft Excel 2010和SPSS 21.0软件对数据进行处理。采用单因素方差分析(One-way ANOVA)检验不同粒径土壤颗粒各指标数据的差异显著性,结合最小显著差异法(LSD),显著性水平设定为P < 0.05;统计使用IBM SPSS Statistics 25,并用于相关分析线性回归检验(n=24)。绘图由Origin 2022软件完成,图中所有数据均为平均值±标准偏差(n=3)。
全土及不同粒径土壤颗粒的综合特征采用主成分综合指数法进行评价。本文利用SPSS进行主成分分析,它们的方差累计贡献率为90.778,满足降维的要求。
2 结果 2.1 不同粒径土壤颗粒的性质差异由表 1可知,不同粒径大小的土壤颗粒以及全土的理化性质具有显著性差异。小粒径土壤颗粒(< 53 μm、20~2 μm、< 2 μm)的孔隙体积与比表面积显著高于大粒径土壤颗粒(> 2 000 μm、2 000~250 μm、250~53 μm),其中,黏粒(< 2 μm)具有最大的总孔隙体积与比表面积,表明小粒径土壤颗粒与土壤有机物有较大的接触面。< 53 μm土壤颗粒的芳香性指数整体低于 > 53 μm土壤颗粒。不同粒径土壤颗粒全碳和全氮含量整体上随着粒径增加而降低,53~20 μm最低,然后又升高。
|
|
表 1 全土与不同粒径土壤颗粒的基本理化性质 Table 1 Basic physical and chemical properties of bulk soil and soil particles with different size |
由图 1可知,不同粒径土壤颗粒的单位土壤CO2累积排放量差异显著(P < 0.001),CO2累积排放量在 < 2 μm和20~2 μm分别较53~20 μm土壤颗粒的高71.4%和56.3%,250~53 μm和 > 2 000 μm分别较 < 53 μm土壤颗粒高12.9%和8.2%。单位土壤有机碳的CO2累积排放量在 < 2 μm土壤颗粒也是最高,最低值在2 000~250 μm土壤颗粒。用不同粒径土壤颗粒的质量占比作为权重,计算全土壤CO2累积排放量为1 169.94 mg·kg–1,为实测全土(图 1)的99.8%;同样按照单位碳计算,其为40.40 g·kg–1,为实测全土的101.8%。CO2累积排放与比表面积、总孔隙体积、全碳和游离氧化铁均呈正相关,而与C/N呈负相关性(图 2)。
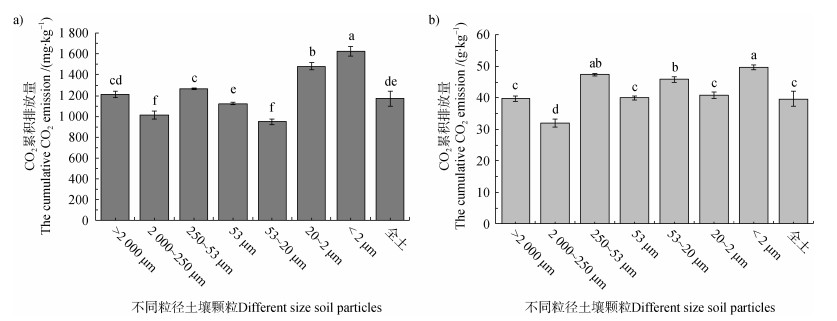
|
注:a)和b)分别代表单位土壤质量和单位有机碳的CO2累积排放量;图中不同字母表示不同粒径土壤颗粒间差异显著(P < 0.05)。下同。Note:a)and b)represent the cumulative CO2 emission of different soil particles based on soil weight and organic carbon,respectively. In the figure,different letters represent significant difference among soil particles at P < 0.05.The same as below. 图 1 不同粒径土壤颗粒CO2累积排放量 Fig. 1 The cumulative CO2 emission of different size soil particles |
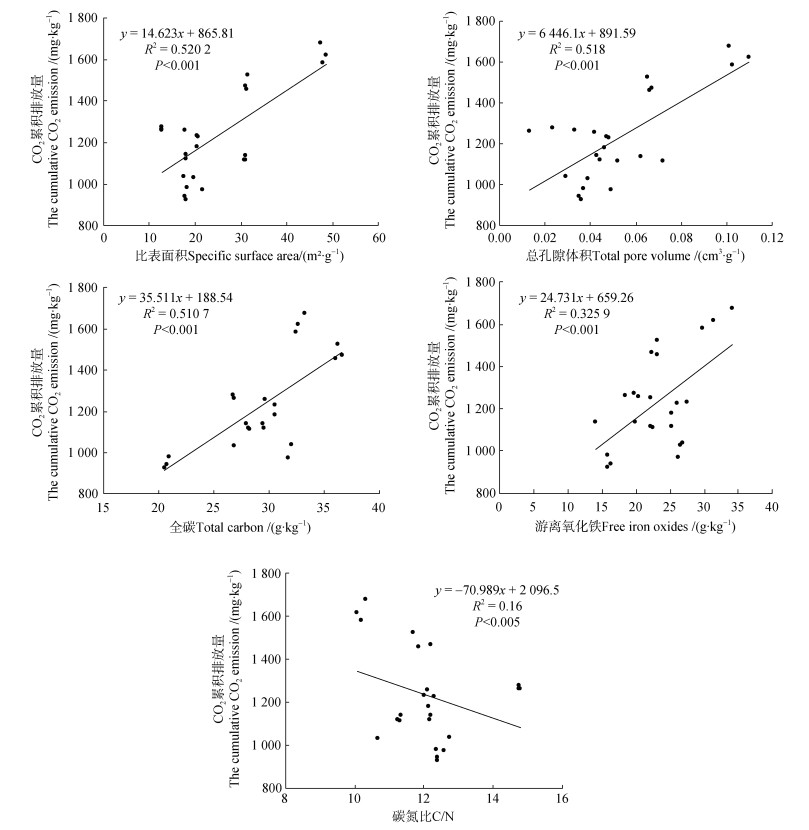
|
图 2 不同粒径土壤颗粒CO2累积排放量与其理化性质的关系 Fig. 2 The relationship between the cumulative CO2 emission of different size soil particles and their physicochemical properties |
由图 3可知,不同粒径土壤颗粒间DOC含量在培养过程中变化差异显著(P < 0.001)。与培养前相比,培养结束后不同粒径土壤颗粒的DOC含量均显著降低,MAOM(< 53 μm、53~20 μm、20~2 μm、< 2 μm)的DOC降低量整体高于全土25.0%~138.7%,POM(> 53 μm)整体低于全土46.5%~61.9%;且MAOM的DOC含量降低幅度整体大于POM。< 2 μm和20~2 μm土壤颗粒ROC最高,较最低的53~20 μm土壤颗粒分别高62.2%和82.5%。研究发现,不同粒径土壤颗粒培养前DOC和培养期间DOC降低量,及ROC与CO2累积排放呈正相关性(图 4)。
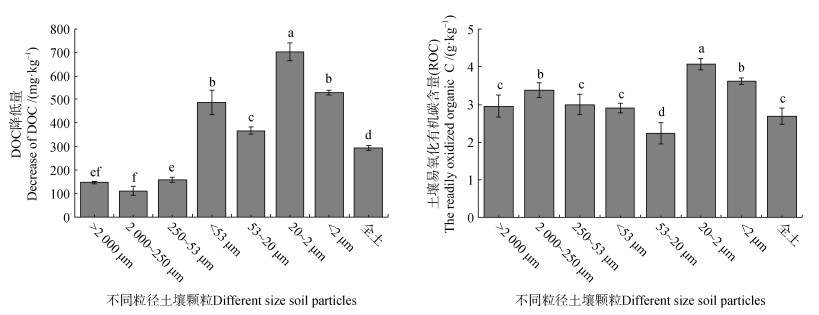
|
图 3 不同粒径土壤颗粒可溶性有机碳变化量和易氧化有机碳 Fig. 3 The changes of DOC and ROC in different size soil particles after incubation |
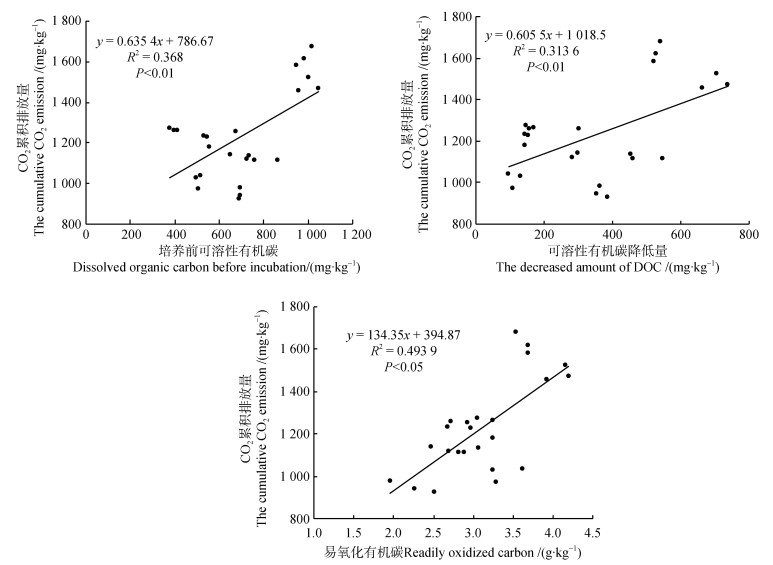
|
图 4 不同粒径土壤颗粒CO2累积排放量与DOC和ROC的关系 Fig. 4 The relationship between the cumulative CO2 emission of different size soil particles and dissolved organic carbon(DOC) or(Readily oxidizable carbon, ROC) |
结果显示,小粒径土壤颗粒有较高的MBC(图 5)。虽然培养前后,全土的MBC没有差异,但是不同粒径土壤颗粒的MBC变化还是有差异的。整体上,培养前、后各粒径土壤颗粒MBC与CO2累积排放量呈正相关性。
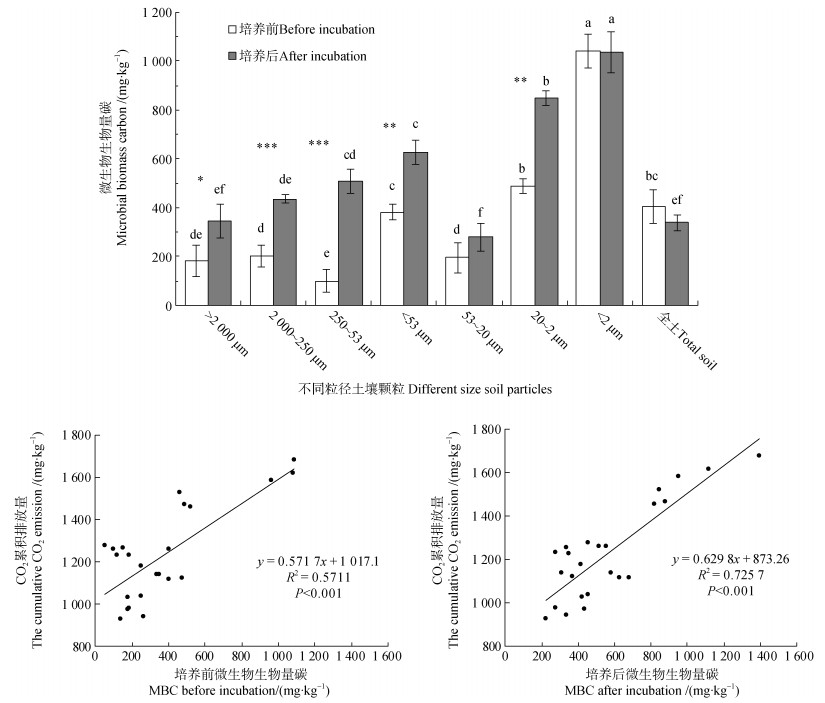
|
注:*,** 和***分别表示培养前后某一组分差异显著(分别为P < 0.05,P < 0.01和P < 0.001)。Note:*,** and *** represent significant difference between before and after incubation at P < 0.05,P < 0.01 and P < 0.001,respectively. 图 5 不同粒径土壤颗粒微生物生物量碳MBC及其与CO2累积排放量的关系 Fig. 5 The relationship between the cumulative CO2 emission of different size soil particles and MBC |
培养期间,土壤各粒径土壤颗粒的活性和惰性碳变化差异大(图 6)。LPI-C在53~20 μm、20~2 μm、< 2 μm增加,且增加幅度随粒径增加而降低,而 > 2 000 μm、2 000~250 μm、250~53 μm、< 53 μm颗粒的LPI-C则降低,> 2 000 μm颗粒降低最多(6.7 g·kg–1)。LPⅡ-C含量在培养期间的变化波动最小(–0.54~0.72 g·kg–1),RP-C变化与LPI-C相反。整体上,CO2累积排放量与LPI-C和LPⅡ-C的变化量呈正相关性,与RP-C的变化量呈负相关性(图 7)。
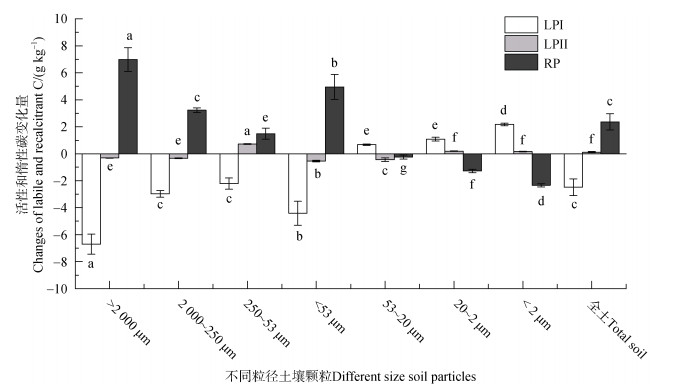
|
图 6 培养后不同粒径土壤颗粒活性碳、惰性碳变化量 Fig. 6 The changes of LPI-C, LPⅡ-C, and RP-C in different size soil particles after incubation |
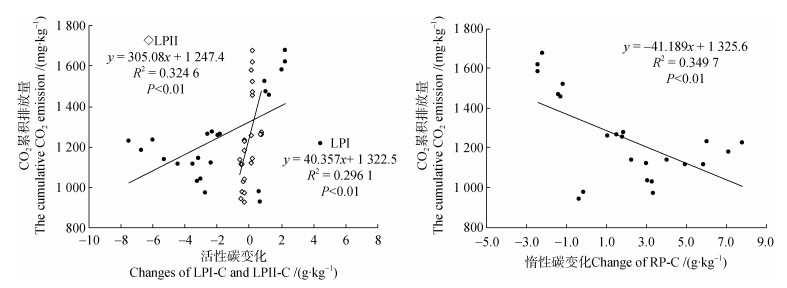
|
图 7 不同粒径土壤颗粒CO2累积排放量与活性、惰性碳变化量的关系 Fig. 7 The relationship between the cumulative CO2 emission of different size soil particles and LPI-C, LPⅡ-C, and RP-C |
本研究发现,无论是单位土壤的CO2累积排放,还是单位有机碳的CO2累积排放,根据土壤不同粒径颗粒所占质量比例(权重)计算CO2累积排放之和,分别是实测全土(图 1)的99.8%和101.8%,说明土壤分级并不会影响土壤的CO2排放,这与已有的研究一致[4]。土壤是复杂的混合物,不同粒径土壤颗粒潜在的物理化学性质差异及变化,不同程度地影响土壤的整体表现[10-11,14]。本研究发现全碳(TC)、C/N、芳香性指数或游离氧化铁含量之和,达到了实测全土的95.0%~100.4%,说明不同粒径土壤颗粒的一些指标确实能够反映全土。然而,Mueller等[7]通过分析德国南部挪威云杉林土壤砂粒(2 000~63 µm)、粉粒(63~6.3 µm)和黏粒(< 6.3 µm)和全土的矿化,发现不同粒径颗粒碳矿化高于全土壤43.8%,可能因不同粒径颗粒与空气的接触面增加,促进碳矿化有关;也或者与不同粒径颗粒间存在相互作用有关。而本研究分7组后,有部分可溶性有机碳损失,导致不同粒径颗粒碳矿化低于全土壤。研究发现土壤颗粒间有机碳的分布可能受到土壤物理分离方法的影响[24];不稳定碳是碳损失的主要来源,易受土壤环境变化的影响,物理扰动如耕作、筛分、超声分散等均会增加活性碳在总有机碳的比例[25],以及在不同土壤颗粒间的重新分配[26]。
本研究发现,不同粒径土壤颗粒CO2累积排放量存在显著差异,小粒径颗粒(20~2 μm、< 2 μm)表现出了较高的CO2累积排放量(图 1),这与已有的研究发现相似[9-11],尽管他们的研究所选择的土壤粒径划分不同,但随着团聚体直径增加,CO2排放量降低。相反,也有研究发现有机碳矿化量随土壤粒径的减小而下降[4,7-8]。而Kimura等[27]发现不同粒径大小的土壤颗粒CO2排放通量无明显差异。研究结果显示,土壤孔隙体积、比表面积与CO2累积排放呈显著正相关(图 2),这与Yang等[28]的结果相一致。较大孔隙体积与比表面积增加了土壤颗粒内部有机物与空气、水分和微生物的接触[11,29],影响土壤的微环境,进而促进有机碳的矿化。比如,耕作通过扰动改变土壤孔隙度影响土壤CO2排放[10-11]。土壤SOC的物理稳定性机制指SOC包裹在团聚体内部,形成团聚体结合态有机碳,从而减少矿化分解、提高其稳定性[26,30]。土壤通过物理分组,如湿筛与超声波震荡,分散或剥离土壤颗粒,获得粒径大小不同的颗粒。在该过程中,团聚体结构被破坏,其包闭的小颗粒分散出来、有机碳也会释放[26,31],可能对不同粒径大小土壤颗粒中碳的稳定性产生影响,改变其矿化难易程度,及CO2排放量。Mueller等[7]和Bimüller等[4]在解释机理上的差异时,前者认为砂粒中烷氧基碳含量高,碳矿化多,而后者认为,黏粒对碳的保护而降低微生物矿化更重要。研究表明,耕作[32]或砍伐森林[33]打破团聚、使黏粒暴露、减弱保护,促进碳矿化;相反降低耕作[34]或植树造林[35],促进团聚化、增加碳含量。不同粒径土壤颗粒物理特性上的改变,诱发其碳在化学或生物上的变化。
其次,不同粒径土壤颗粒有机碳浓度、DOC变化量、ROC、MBC与CO2累积排放量呈正相关性(图 2,图 4,图 7),说明不同粒径土壤颗粒有机碳变化是CO2累积排放差异的另一驱动因素。20~2 μm、< 2 μm颗粒中的DOC含量高于其他粒径土壤颗粒,可增加小粒径颗粒的CO2累积排放量[4]。这与Mangalassery等[10]的研究结果一致,碳矿化较大的小粒径颗粒(< 0.5 mm)中DOC含量也更高。Guo等[36]的研究也发现,高碳含量的微团聚体(0.1~0.053 mm和 < 0.053 mm)表现出较高的碳矿化速率,低碳含量的0.5~0.25 mm团聚体的矿化率较低。小粒径颗粒(比如20~2 μm、< 2 μm)有较高的DOC和ROC有利于微生物活动(MBC较高),提高活性碳的矿化。研究显示,< 53 μm颗粒的化学稳定(10% H2O2处理)有机碳最低[37],一旦暴露于外,很可能有更多易氧化有机碳的矿化。同时,研究发现,淋溶对 < 1 mm的土壤颗粒碳矿化降低幅度最大,主要是活性有机碳损失多[38]。因此,鉴于土壤物理分级过程中可溶性有机碳的损失,本文可能低估了 < 20 μm颗粒的CO2累积排放量或它在保存土壤碳能力方面的重要性。小粒径颗粒吸附性强,且包闭在大团聚体内部,微环境使其更加稳定[39-40]。小分子、可溶性的有机质容易进入小粒径颗粒,其DOC来自凋落物淋溶、土壤可溶性有机碳和微生物代谢物[1-3,41]。从DOC变化分析,培养期间,持续的DOC产生和消耗,维持较高DOC变化量的结果是CO2的大量产生和其他碳库的转化。酸解后的活性碳主要由淀粉、纤维素及可溶性糖类等碳水化合物组成[22],不同粒径土壤颗粒碳的化学稳定性显示,20~2 μm和 < 2 μm颗粒的LPⅠ-C在培养期间的增加和RC的降低,持续为碳矿化提供活性碳源,这是CO2排放较高的原因[42]。而 > 2 000 μm、2 000~250 μm、250~53 μm、< 53 μm颗粒和全土的LPⅠ-C在降低后,未得到RC转化的补充,导致CO2排放较低[43]。培养后较培养前RC的增加,表明土壤不可水解成分的浓度增加,可矿化碳的降低,后续(> 60 d)CO2排放的速率可能会降低[44]。
但是,不同粒径土壤颗粒C/N与CO2累积排放量呈负相关性,尤其是 < 53 μm颗粒。Zhang等[45]发现大团聚体(8~0.25 mm),微团聚体(0.25~0.053 mm)和粉砂黏粒(< 0.053 mm)的C/N与CO2累积排放量呈负相关。本研究按照Ding等[8]研究中使用的等级范围,即砂粒(> 50 µm)、粉粒(50~2 µm)和黏粒(< 2 µm),对数据分析后发现,碳矿化与C/N呈负相关性。
最后,通过对土壤不同粒径颗粒指标的降维分析,它们的综合特征指数(图 8)显示,颗粒之间的差异显著,且 < 20 μm颗粒与全土壤及其他颗粒存在显著不同的综合作用。结果表明,在使用同质量土壤研究的前提下,不同粒径土壤颗粒通过自身特性的变化,在全土中发挥着不一样的作用。诸多研究选择53 μm粒径为界划分土壤颗粒[2-3,8,36,45-47],本研究发现,在分析不同粒径土壤颗粒CO2累积排放量与其他特性关系时,以 < 53 μm颗粒为界,小于该颗粒,相关性会更好;而 > 53 μm颗粒,相关性变差,甚至相反。尽管全土壤中各颗粒是不可能以同等量共存,但本研究仍然可以说明,颗粒间的差异及关系对土壤而言是相当重要的。研究显示,小粒径颗粒团聚或被大粒径包闭,是土壤维持碳稳定的有效方式[46-47],全土具备一定比例的黏粒、小粒径颗粒碳的增加、团聚体的形成,通过物理性隔绝碳与氧气、水和微生物的作用是稳定土壤有机碳和增加碳保存有效机理。因此,不同粒径土壤颗粒的相互作用及其碳转化对全土碳的影响和重要性还有待深入分析。
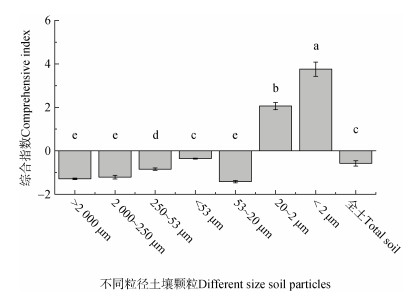
|
图 8 不同粒径土壤颗粒多指标降维分析的综合特征差异 Fig. 8 Differences in comprehensive characteristics of indexes for different size soil particles after dimensionality reduction analysis |
虽然土壤物理湿筛法分级,存在物质损失带来的影响,但通过研究不同粒径土壤颗粒来反映土壤碳的变化、分析其机理还是可行的。土壤 < 2 μm和20~2 μm颗粒CO2累积排放量显著高于其他颗粒和全土,相关分析表明,碳矿化与粒径颗粒的比表面积、总孔隙体积、DOC、ROC、MBC、活性和惰性碳、C/N等有关,且综合特征指数在 < 2 μm和20~2 μm颗粒最高。本研究,间接证明了 < 20 μm的土壤颗粒对全土壤碳稳定和保存的重要性。增加 < 20 μm颗粒,尤其是 < 2 μm颗粒碳含量,以及促进小粒径颗粒的团聚或包闭等管理措施有潜力提升土壤碳稳定或保存。
| [1] |
Cotrufo M F, Wallenstein M D, Boot C M, et al. The Microbial Efficiency-Matrix Stabilization(MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter?[J]. Global Change Biology, 2013, 19(4): 988-995. DOI:10.1111/gcb.12113
(  0) 0) |
| [2] |
Haddix M L, Paul E A, Cotrufo M F, et al. Differential isotope labeling shows the preferential movement of labile plant constituents into mineral-bonded soil organic matter[J]. Global Change Biology, 2016, 22(6): 2301-2312. DOI:10.1111/gcb.13237
(  0) 0) |
| [3] |
Lavallee J M, Soong J L, Cotrufo M F. Conceptualizing soil organic matter into particulate and mineral-associated forms to address global change in the 21st century[J]. Global Change Biology, 2020, 26(1): 261-273. DOI:10.1111/gcb.14859
(  0) 0) |
| [4] |
Bimüller C, Mueller C W, von Lützow M, et al. Decoupled carbon and nitrogen mineralization in soil particle size fractions of a forest topsoil[J]. Soil Biology and Biochemistry, 2014, 78: 263-273. DOI:10.1016/j.soilbio.2014.08.001
(  0) 0) |
| [5] |
Christensen B T. Decomposability of organic matter in particle size fractions from field soils with straw incorporation[J]. Soil Biology and Biochemistry, 1987, 19(4): 429-435. DOI:10.1016/0038-0717(87)90034-4
(  0) 0) |
| [6] |
Wang Y, Song X S, Wang J, et al. Effect of drying-rewetting alternation on soil carbon pool and mineralization of soil organic carbon (In Chinese)[J]. Acta Pedologica Sinica, 2014, 51(2): 342-350. [王苑, 宋新山, 王君, 等. 干湿交替对土壤碳库和有机碳矿化的影响[J]. 土壤学报, 2014, 51(2): 342-350.]
(  0) 0) |
| [7] |
Mueller C W, Gutsch M, Kothieringer K, et al. Bioavailability and isotopic composition of CO2 released from incubated soil organic matter fractions[J]. Soil Biology and Biochemistry, 2014, 69: 168-178. DOI:10.1016/j.soilbio.2013.11.006
(  0) 0) |
| [8] |
Ding F, Sun W, Huang Y, et al. Larger Q10 of carbon decomposition in finer soil particles does not bring long-lasting dependence of Q10 on soil texture[J]. European Journal of Soil Science, 2018, 69(2): 336-347. DOI:10.1111/ejss.12530
(  0) 0) |
| [9] |
Drury C F, Yang X M, Reynolds W D, et al. Influence of crop rotation and aggregate size on carbon dioxide production and denitrification[J]. Soil and Tillage Research, 2004, 79(1): 87-100. DOI:10.1016/j.still.2004.03.020
(  0) 0) |
| [10] |
Mangalassery S, Sjögersten S, Sparkes D L, et al. The effect of soil aggregate size on pore structure and its consequence on emission of greenhouse gases[J]. Soil and Tillage Research, 2013, 132: 39-46. DOI:10.1016/j.still.2013.05.003
(  0) 0) |
| [11] |
Reeves S H, Somasundaram J, Wang W J, et al. Effect of soil aggregate size and long-term contrasting tillage, stubble and nitrogen management regimes on CO2 fluxes from a Vertisol[J]. Geoderma, 2019, 337: 1086-1096. DOI:10.1016/j.geoderma.2018.11.022
(  0) 0) |
| [12] |
Lützow M V, Kögel-Knabner I, Ekschmitt K, et al. Stabilization of organic matter in temperate soils: Mechanisms and their relevance under different soil conditions - a review[J]. European Journal of Soil Science, 2006, 57(4): 426-445. DOI:10.1111/j.1365-2389.2006.00809.x
(  0) 0) |
| [13] |
Ma R P, An S S, Dang T H, et al. Soil organic carbon and enzymatic activity in aggregates of soils under different plant communities in hilly-gully regions of Loess Plateau (In Chinese)[J]. Acta Pedologica Sinica, 2014, 51(1): 104-113. [马瑞萍, 安韶山, 党廷辉, 等. 黄土高原不同植物群落土壤团聚体中有机碳和酶活性研究[J]. 土壤学报, 2014, 51(1): 104-113.]
(  0) 0) |
| [14] |
Hemkemeyer M, Christensen B T, Martens R, et al. Soil particle size fractions harbour distinct microbial communities and differ in potential for microbial mineralisation of organic pollutants[J]. Soil Biology and Biochemistry, 2015, 90: 255-265. DOI:10.1016/j.soilbio.2015.08.018
(  0) 0) |
| [15] |
Zhang Q, Liang G Q, Myrold D D, et al. Variable responses of ammonia oxidizers across soil particle-size fractions affect nitrification in a long-term fertilizer experiment[J]. Soil Biology and Biochemistry, 2017, 105: 25-36. DOI:10.1016/j.soilbio.2016.11.005
(  0) 0) |
| [16] |
Parfitt R L, Salt G J. Carbon and nitrogen mineralization in sand, silt, and clay fractions of soils under maize and pasture[J]. Soil Research, 2001, 39(2): 361. DOI:10.1071/SR00028
(  0) 0) |
| [17] |
Toosi E R, Clinton P W, Beare M H, et al. Biodegradation of soluble organic matter as affected by land-use and soil depth[J]. Soil Science Society of America Journal, 2012, 76(5): 1667-1677. DOI:10.2136/sssaj2011.0437
(  0) 0) |
| [18] |
Gao R H, Shi J, Huang R F, et al. Effects of pine wilt disease invasion on soil properties and Masson pine forest communities in the Three Gorges Reservoir region, China[J]. Ecology and Evolution, 2015, 5(8): 1702-1716. DOI:10.1002/ece3.1326
(  0) 0) |
| [19] |
Weishaar J L, Aiken G R, Bergamaschi B A, et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J]. Environmental Science & Technology, 2003, 37(20): 4702-4708.
(  0) 0) |
| [20] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [21] |
Cheng Y, Cai Z C, Chang S X, et al. Effects of soil pH and salt on N2O production in adjacent forest and grassland soils in central Alberta, Canada[J]. Journal of Soils and Sediments, 2013, 13(5): 863-868. DOI:10.1007/s11368-013-0663-9
(  0) 0) |
| [22] |
Rovira P, Ramón Vallejo V. Labile, recalcitrant, and inert organic matter in Mediterranean forest soils[J]. Soil Biology and Biochemistry, 2007, 39(1): 202-215. DOI:10.1016/j.soilbio.2006.07.021
(  0) 0) |
| [23] |
Blair G J, Lefroy R D B, Lisle L. Soil carbon fractions based on their degree of oxidation and the development of a carbon management index for agricultural systems[J]. Australia Journal of Agricultural Research, 1995, 46: 1459-1466. DOI:10.1071/AR9951459
(  0) 0) |
| [24] |
Sainju U M. Carbon and nitrogen pools in soil aggregates separated by dry and wet sieving methods[J]. Soil Science, 2006, 171(12): 937-949. DOI:10.1097/01.ss0000228062.30958.5a
(  0) 0) |
| [25] |
Zhang X W, Yu F H. Physical disturbance accelerates carbon loss through increasing labile carbon release[J]. Plant, Soil and Environment, 2020, 66(11): 584-589. DOI:10.17221/257/2020-PSE
(  0) 0) |
| [26] |
Lü H J, He H B, Zhang X D. The options of conditions on ultrasonic dispersion and centrifugal separation in soil particle size fractionation (In Chinese)[J]. Chinese Journal of Soil Science, 2012, 43(5): 1126-1130. [吕慧捷, 何红波, 张旭东. 土壤颗粒分级过程中超声破碎和离心分离的条件选择[J]. 土壤通报, 2012, 43(5): 1126-1130.]
(  0) 0) |
| [27] |
Kimura S D, Melling L, Goh K J. Influence of soil aggregate size on greenhouse gas emission and uptake rate from tropical peat soil in forest and different oil palm development years[J]. Geoderma, 2012, 185/186: 1-5. DOI:10.1016/j.geoderma.2012.03.026
(  0) 0) |
| [28] |
Yang C, Liu N, Zhang Y J. Soil aggregates regulate the impact of soil bacterial and fungal communities on soil respiration[J]. Geoderma, 2019, 337: 444-452. DOI:10.1016/j.geoderma.2018.10.002
(  0) 0) |
| [29] |
Kravchenko A N, Negassa W C, Guber A K, et al. Protection of soil carbon within macro-aggregates depends on intra-aggregate pore characteristics[J]. Scientific Reports, 2015, S: 16261.
(  0) 0) |
| [30] |
Angst G, Mueller K E, Nierop K G J, et al. Plant- or microbial-derived? A review on the molecular composition of stabilized soil organic matter[J]. Soil Biology and Biochemistry, 2021, 156: 108189. DOI:10.1016/j.soilbio.2021.108189
(  0) 0) |
| [31] |
Six J, Conant R T, Paul E A, et al. Stabilization mechanisms of soil organic matter: Implications for C-saturation of soils[J]. Plant and Soil, 2002, 241(2): 155-176. DOI:10.1023/A:1016125726789
(  0) 0) |
| [32] |
Dal Ferro N, Stevenson B, Morari F, et al. Long-term tillage and irrigation effects on aggregation and soil organic carbon stabilization mechanisms[J]. Geoderma, 2023, 432: 116398. DOI:10.1016/j.geoderma.2023.116398
(  0) 0) |
| [33] |
Davari M, Gholami L, Nabiollahi K, et al. Deforestation and cultivation of sparse forest impacts on soil quality(case study: West Iran, Baneh)[J]. Soil and Tillage Research, 2020, 198: 104504. DOI:10.1016/j.still.2019.104504
(  0) 0) |
| [34] |
Chen H Q, Liang Q, Gong Y S, et al. Reduced tillage and increased residue retention increase enzyme activity and carbon and nitrogen concentrations in soil particle size fractions in a long-term field experiment on Loess Plateau in China[J]. Soil and Tillage Research, 2019, 194: 104296. DOI:10.1016/j.still.2019.104296
(  0) 0) |
| [35] |
Wang J X, Lan J C, Long Q X, et al. Soil organic carbon transfer in aggregates subjected to afforestation in Karst region as indicated by 13C natural abundance[J]. Forest Ecology and Management, 2023, 531: 120798. DOI:10.1016/j.foreco.2023.120798
(  0) 0) |
| [36] |
Guo L L, Taku N, Hiromi I, et al. Carbon mineralization associated with soil aggregates as affected by short-term tillage[J]. Journal of Resources and Ecology, 2016, 7(2): 101-106. DOI:10.5814/j.issn.1674-764x.2016.02.004
(  0) 0) |
| [37] |
Fazle Rabbi S M, Wilson B R, Lockwood P V, et al. Soil organic carbon mineralization rates in aggregates under contrasting land uses[J]. Geoderma, 2014, 216: 10-18. DOI:10.1016/j.geoderma.2013.10.023
(  0) 0) |
| [38] |
Qiu L P, Zhu H S, Liu J, et al. Soil erosion significantly reduces organic carbon and nitrogen mineralization in a simulated experiment[J]. Agriculture, Ecosystems & Environment, 2021, 307: 107232.
(  0) 0) |
| [39] |
Tan W B, Wang G A, Huang C H, et al. Physico-chemical protection, rather than biochemical composition, governs the responses of soil organic carbon decomposition to nitrogen addition in a temperate agroecosystem[J]. Science of the Total Environment, 2017, 598: 282-288. DOI:10.1016/j.scitotenv.2017.04.143
(  0) 0) |
| [40] |
Xu J H, Sun Y, Gao L, et al. A review of the factors influencing soil organic carbon stability (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2018, 26(2): 222-230. [徐嘉晖, 孙颖, 高雷, 等. 土壤有机碳稳定性影响因素的研究进展[J]. 中国生态农业学报, 2018, 26(2): 222-230.]
(  0) 0) |
| [41] |
Córdova S C, Olk D C, Dietzel R N, et al. Plant litter quality affects the accumulation rate, composition, and stability of mineral-associated soil organic matter[J]. Soil Biology and Biochemistry, 2018, 125: 115-124. DOI:10.1016/j.soilbio.2018.07.010
(  0) 0) |
| [42] |
Hassan W, Bashir S, Ahmed N, et al. Labile organic carbon fractions, regulator of CO2 emission: Effect of plant residues and water regimes[J]. CLEAN – Soil, Air, Water, 2016, 44(10): 1358-1367. DOI:10.1002/clen.201400405
(  0) 0) |
| [43] |
Zhang H, Zhou Z Y. Recalcitrant carbon controls the magnitude of soil organic matter mineralization in temperate forests of Northern China[J]. Forest Ecosystems, 2018, 5: 17. DOI:10.1186/s40663-018-0137-z
(  0) 0) |
| [44] |
Rey A, Pegoraro E, Jarvis P G. Carbon mineralization rates at different soil depths across a network of European forest sites(FORCAST)[J]. European Journal of Soil Science, 2008, 59(6): 1049-1062. DOI:10.1111/j.1365-2389.2008.01065.x
(  0) 0) |
| [45] |
Zhang Y, Ge N N, Liao X L, et al. Long-term afforestation accelerated soil organic carbon accumulation but decreased its mineralization loss and temperature sensitivity in the bulk soils and aggregates[J]. Catena, 2021, 204: 105405. DOI:10.1016/j.catena.2021.105405
(  0) 0) |
| [46] |
Xu H, Liu K L, Zhang W J, et al. Long-term fertilization and intensive cropping enhance carbon and nitrogen accumulated in soil clay-sized particles of red soil in South China[J]. Journal of Soils and Sediments, 2020, 20(4): 1824-1833. DOI:10.1007/s11368-019-02544-8
(  0) 0) |
| [47] |
Zhang Y, Geng S C, Mu C C, et al. Evaluating soil carbon stability by combining δ13C and soil aggregates after afforestation on agricultural land and thinning management[J]. Plant and Soil, 2023, 487(1): 567-586.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61

