2. 南京信息工程大学环境科学与工程学院, 南京 210044;
3. 中国科学院南京土壤研究所, 南京 211135
2. School of Environmental Science and Engineering, Nanjing University of Information Science and Technology, Nanjing 210044, China;
3. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China
六氯苯(Hexachlorobenzene,HCB)是首批被列入《关于持久性有机污染物的斯德哥尔摩公约》的12种持久性有机污染物(POPs)之一[1]。由于HCB分子中氯取代基可与苯环形成p-π共轭,C-Cl键的键能较大(328 kJ·mol–1),而且多个氯原子的存在抑制了苯环裂解酶的活性[2],因此,HCB在环境中很难自然降解。尽管目前HCB的使用已经受到限制,但其污染问题仍然存在[3]。此外,由于HCB包含6个氯取代基,可代表多氯代有机化合物的反应特性,常以HCB作为模式多氯代有机化合物进行研究[4]。因为氯原子强烈的吸电子性,HCB难以被好氧微生物氧化降解。而在厌氧条件下,HCB可发生还原脱氯降解,脱除氯取代基生成的低氯代苯更易被好氧微生物进一步降解直至完全矿化[5]。因此,还原脱氯是HCB降解的关键途径。
有机氯化合物的还原脱氯主要有化学和微生物两种途径。其中,化学还原脱氯是由还原性物质驱动的反应,如土壤中异化铁还原产生的吸附态Fe(Ⅱ)具有很强的还原性,可以将电子转移至有机氯化合物使其发生化学还原脱氯[6-8]。微生物直接脱氯是某些微生物所具有的厌氧呼吸作用,这类微生物可以氧化氢气、甲酸、乙酸﹑丙酮酸等电子供体,并以含氯有机物为末端电子受体使其还原脱氯[9-10]。因此,还原脱氯源于土壤中氧化还原反应的电子传递过程以及与之偶联的微生物介导作用。
研究发现,厌氧条件下HCB一般可脱去1~4个氯取代基,生成五氯苯(PeCB)、四氯苯(TeCB)、三氯苯(TCB)和二氯苯(DCB)[11]。影响土壤中HCB厌氧脱氯降解的因素主要有微生物群落结构、土壤性质以及电子供体和电子受体的种类和数量。研究表明,土壤中主要厌氧微生物,如异化铁还原菌、产甲烷菌、硫酸盐还原菌等具有还原脱氯功能[2,6]。通常土壤pH为中性至弱碱性有利于HCB厌氧脱氯降解[2]。HCB还原脱氯是在厌氧环境下由还原性物质作为电子供体,通过微生物将电子转移至最终的电子受体HCB上[2]。因此,没有电子供体就不存在HCB的还原脱氯过程,在此过程中其他电子受体的存在对HCB还原脱氯也有很大影响。基于这些研究结果,本研究试图通过使用修复材料为土壤创造更利于还原脱氯的条件,以强化HCB的降解效率。
磁铁矿(Fe3O4)在自然环境中普遍存在。Fe3O4是由Fe(Ⅱ)和Fe(Ⅲ)的氧化物所构成。一方面,Fe3O4的氧化还原特性可被特定微生物用作电子供体或末端电子受体参与到胞外呼吸过程,从而调控微环境中电子流的源和汇[12-14];另一方面,Fe3O4具有良好的导电性,并为微生物个体生长附着提供超大接触面,从而维持微生物之间的电子传递路径[15-16]。纳米级Fe3O4粒径小,更容易挤插在微生物与电子受体间的缝隙中,在微生物与电子受体之间形成一个连续的导电网络[12]。由此推测,添加纳米Fe3O4能够有效强化微生物的胞外电子传递效率,进而促进有机氯化合物的还原脱氯降解。
此外,为了克服纳米Fe3O4磁性粒子的团聚,可将纳米Fe3O4负载于多孔载体材料表面。生物炭是生物质在高温裂解后产生的导电材料,具有比表面积大、价格低廉等优势。将纳米Fe3O4负载到生物炭上制成纳米Fe3O4/生物炭复合材料,不仅减弱纳米Fe3O4颗粒的团聚作用,而且增加微生物在纳米Fe3O4/生物炭复合材料表面的黏附性,同时可提高材料的导电性与电容量,实现微生物之间的长距离电子传递[17]。同时,生物炭还可以改善土壤的理化性质,增加土壤微生物的丰度和多样性[18-19]。
为了明确纳米Fe3O4/生物炭对厌氧土壤中HCB还原脱氯降解的影响及其机理,本研究制备纳米Fe3O4、生物炭及纳米Fe3O4/生物炭复合材料并对其进行表征,以HCB为目标污染物,分析比较纳米Fe3O4、生物炭和纳米Fe3O4/生物炭复合材料对红壤性水稻土中HCB还原脱氯降解的强化作用,通过测定反应体系的pH、Eh、吸附态和溶解态Fe(Ⅱ),揭示纳米Fe3O4/生物炭对土壤中HCB厌氧脱氯降解的影响及其主控因子,以期为制定有机氯污染土壤的高效原位修复技术方案提供参考依据。
1 材料与方法 1.1 供试土壤供试土壤为江西鹰潭地区(28°12′ N,116°55′E)红壤性水稻土的表层土(0~20 cm)。土样经过自然风干后过2 mm筛备用。供试土壤pH5.4,有机质含量43.5 g·kg–1,可溶性有机碳含量48.2 mg·kg–1,全氮含量1.76 g·kg–1,黏粒、粉粒和砂粒含量分别为24.7%、45.1%和30.2%。具体分析方法参考文献[20]。采集的土壤中未检出HCB及其他各种氯苯类化合物。
1.2 纳米Fe3O4/生物炭的制备及表征供试生物炭以水稻秸秆为原材料,水稻秸秆剪成小段,80 ℃烘干12 h后转移至炭化炉中,升温至500 ℃,厌氧高温热解3 h,冷却后研磨过100目筛备用。纳米Fe3O4/生物炭复合材料的制备参照胡小莲等[21]的方法。纳米Fe3O4采用上述纳米Fe3O4/生物炭复合材料制备方法中不加生物炭,即化学共沉淀法进行制备。
采用扫描电子显微镜(FEI Quanta 250 FEG)观察3种材料(生物炭、纳米Fe3O4和纳米Fe3O4/生物炭复合材料)的表面形貌。使用比表面积及孔径分析仪(V-Sorb 2800P)测定3种材料的氮气吸/脱附曲线(77 K),并通过BET法计算材料的比表面积、孔容与孔径大小。采用X射线衍射仪(D2PHASER)分析材料的晶型结构;采用傅里叶红外光谱仪(NicoletS10)测定3种材料的特征官能团。
1.3 试验设计采取土/水质量比为1/5的泥浆进行厌氧培养试验,设置如下5个处理:(1)灭菌HCB污染土(S-CK),(2)原始HCB污染土(CK),(3)原始HCB污染土+纳米Fe3O4(Fe3O4),(4)原始HCB污染土+生物炭(BC),(5)原始HCB污染土+纳米Fe3O4/生物炭复合材料(Fe3O4/BC)。测定出HCB的初始浓度为18.25 μmol·kg–1。将6 g红壤性水稻土与30 mL超纯水加入60 mL的棕色血清瓶中制得泥浆,并分别于处理(3)、(4)和(5)的泥浆中添加0.12 g纳米Fe3O4、0.12 g生物炭和0.24 g纳米Fe3O4/生物炭复合材料。灭菌处理的土壤在121 ℃高压灭菌锅中湿热灭菌30 min。每个处理设置3个重复。所有血清瓶混匀后,置于震荡培养箱中25 ℃避光培养。分别在培养的0、7、14、21、28、35、42 d进行破坏性采样,测定土壤中HCB及其脱氯产物(各种氯苯类化合物)的浓度、反应体系的pH和Eh、泥浆中溶解态及吸附态Fe(Ⅱ)含量。
1.4 分析方法采样前用PHB-06型mV计进行泥浆Eh的原位测定,用MODEL IQ-150型pH计进行泥浆pH测定。溶解态Fe(Ⅱ)与吸附态Fe(Ⅱ)按照Li等[22]的方法测定。
HCB及其降解产物的测定:将硅藻土与HCB污染土壤拌匀后用加速溶剂萃取仪(ASE)提取,提取液采用旋转蒸发和固相萃取技术进行浓缩和净化。用气相色谱测定HCB及其降解产物的浓度。ASE提取条件、固相萃取方法及气相色谱测定条件参照文献[23]。
1.5 数据分析用外标法测定(R2 > 0.999)各种氯苯的浓度。利用Excel 2020完成数据的初步统计与分析,利用Origin 2022完成图形的绘制与反应动力学方程的拟合,利用SPSS 18.0完成显著差异分析。
2 结果 2.1 生物炭负载纳米Fe3O4的表征图 1为生物炭、纳米Fe3O4和纳米Fe3O4/生物炭复合材料的表面形貌。可以看出,生物炭比较蓬松;纳米Fe3O4呈细小颗粒状,粒径小于100 nm,但颗粒之间团聚很严重;复合材料Fe3O4/生物炭的生物炭表面上纳米Fe3O4能均匀分布,且部分纳米Fe3O4嵌入生物炭空隙内。说明生物炭作为载体材料,很好地解决了纳米Fe3O4的颗粒团聚问题,将纳米Fe3O4有效分散开,大大增加了纳米Fe3O4的暴露面积。复合材料Fe3O4/生物炭的比表面积(170.4 m2·g–1)亦明显高于纳米Fe3O4(68.6 m2·g–1)和生物炭(53.9 m2·g–1)。Fe3O4/生物炭的平均孔径(6.5 nm)相对生物炭(11.1 nm)明显减小,说明纳米Fe3O4可促使生物炭形成新的微孔,或者部分纳米Fe3O4镶嵌在生物炭空隙里使生物炭的原孔隙减小。Fe3O4/生物炭的总孔容(0.5 cm–3·g–1)明显高于纳米Fe3O4(0.06 cm–3·g–1)和生物炭(0.09 cm–3·g–1),既进一步验证了纳米Fe3O4可以促使生物炭形成新的孔隙,又说明生物炭作为载体材料可以大大减弱纳米Fe3O4的颗粒团聚问题。

|
图 1 生物炭(a)、纳米Fe3O4(b)和纳米Fe3O4/生物炭(c)的电镜图 Fig. 1 SEM photos of biochar(a), nano-Fe3O4(b) and nano-Fe3O4/biochar(c) |
由图 2可以发现,纳米Fe3O4的XRD衍射图出现6个衍射峰,2θ分别为30.1°、35.5°、43.1°、53.4°、57.0°、62.6°,各衍射峰分别对应(220)、(311)、(400)、(422)、(511)、(440)6个晶面,表明制备的Fe3O4为尖晶石结构[21]。纳米Fe3O4/生物炭复合材料的XRD衍射图也出现了6个与纳米Fe3O4一致的衍射峰,说明生物炭作为负载材料并未对Fe3O4的晶型结构产生影响。生物炭在2θ为20°~25°有个平缓的衍射峰,说明该生物炭为无定型炭。与生物炭相比,纳米Fe3O4/生物炭复合材料在2θ为20°~25°的衍射峰更弱,说明Fe3O4较生物炭的晶型更强,遮住了生物炭的衍射峰。
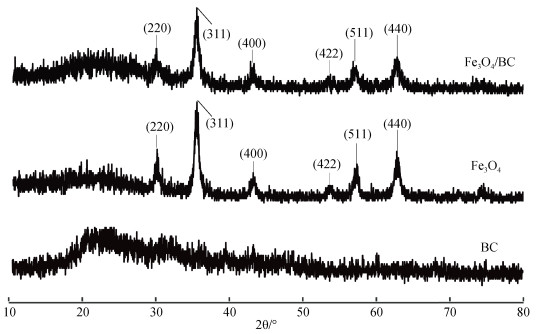
|
图 2 生物炭(BC)、纳米Fe3O4(Fe3O4)和纳米Fe3O4/生物炭(Fe3O4/BC)的XRD图谱 Fig. 2 XRD patterns of biochar(BC), nano-Fe3O4(Fe3O4)and nano-Fe3O4/biochar(Fe3O4/BC) |
图 3为纳米Fe3O4、生物炭和纳米Fe3O4/生物炭复合材料的红外吸收光谱图。其中,生物炭在1 066 cm–1处的特征吸收峰为生物炭上C-O-C的伸缩振动,1 408 cm–1处的吸收峰为生物炭上–CH3的伸缩振动,1 633 cm–1处的特征吸收峰为生物炭上C=O的伸缩振动[24]。纳米Fe3O4在1 633 cm–1处的特征吸收峰为FeOO–的伸缩振动[25]。纳米Fe3O4和纳米Fe3O4/生物炭在587 cm–1处的特征吸收峰是Fe-O键伸缩振动,也说明Fe3O4成功负载于生物炭上。纳米Fe3O4/生物炭复合材料位于1 047 cm–1处的特征峰为Fe-O-C的伸缩振动[21],表明负载于生物炭表面的Fe3O4可通过牢固的化学键与生物炭结合。
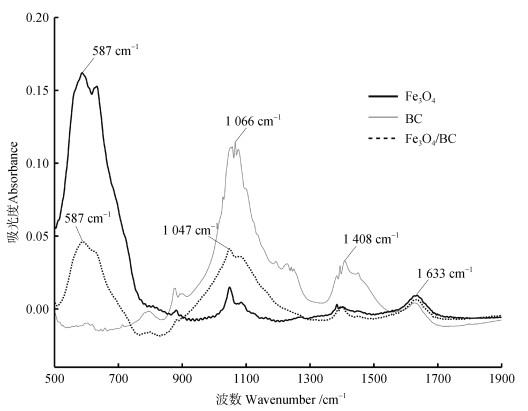
|
图 3 纳米Fe3O4(Fe3O4)、生物炭(BC)和纳米Fe3O4/生物炭(Fe3O4/BC)的红外谱图 Fig. 3 The FTIR spectra of nano-Fe3O4(Fe3O4), biochar(BC)and nano-Fe3O4/biochar(Fe3O4/BC) |
各处理反应体系pH和Eh变化过程见表 1。厌氧培养42 d内,S-CK处理的pH在5.2~5.6之间波动。CK和Fe3O4处理的pH在7 d内均降低了0.2,之后又逐渐升高,最终分别稳定在5.8和5.9。主要原因是培养初期土壤有机质在厌氧微生物作用下发酵产生有机酸类物质[26],随着培养的进行,有机酸作为微生物厌氧反应的电子供体而逐渐被消耗,导致反应体系的pH逐渐升高。BC和Fe3O4/BC处理的pH在整个培养过程中均显著高于其他3个处理(P < 0.05),是因为生物炭中的灰分含有较多的盐基离子,如钙、镁、钠、钾,这些盐基离子可以交换并降低土壤中的H+和交换性Al3+水平,进而提高酸性土壤的pH[27]。
|
|
表 1 不同处理反应体系的pH及Eh随培养时间的变化 Table 1 Temporal variation of pH and Eh in the reaction systems of different treatments during the incubation |
各处理的Eh在刚开始厌氧培养时均较高,随后逐渐降低。培养42 d内,各处理Eh平均值分别为:S-CK(63 mV)、CK(–12 mV)、Fe3O4(–75 mV)、BC(–94 mV)、Fe3O4+BC(–126 mV)。S-CK处理的Eh随培养时间的变化很小,在59~79 mV之间波动。CK、Fe3O4、BC和Fe3O4/BC处理的Eh随培养时间逐渐降低。从21 d至培养结束,各处理Eh大小顺序为:Fe3O4/BC < BC < Fe3O4 < CK。表明添加纳米Fe3O4、生物炭以及纳米Fe3O4/生物炭复合材料均能有效增强反应体系的还原性。
2.3 反应体系中吸附态和溶解态Fe(Ⅱ)含量变化由图 4可知,S-CK处理的吸附态Fe(Ⅱ)含量很少,整个培养期间在0.04~1.0 mmol·kg–1之间波动。此外4个处理的吸附态Fe(Ⅱ)含量在前7 d缓慢增加,然后迅速增加,这可能是由于人为掺入的HCB对土壤微生物产生毒性,使起初微生物的活性被抑制,但随着微生物被驯化而进一步生长繁殖,异化铁还原菌的活性也逐渐增强。整个培养过程中各处理吸附态Fe(Ⅱ)含量的高低顺序为:Fe3O4/ BC > Fe3O4 > BC > CK > S-CK。表明铁氧化物还原生成Fe(Ⅱ)主要是微生物发挥作用,添加生物炭可促进铁氧化物还原生成吸附态Fe(Ⅱ),纳米Fe3O4可刺激铁还原菌生长繁殖,因此显著增强异化铁还原生成Fe(Ⅱ),Fe3O4/BC处理的吸附态Fe(Ⅱ)含量显著高于其他处理。
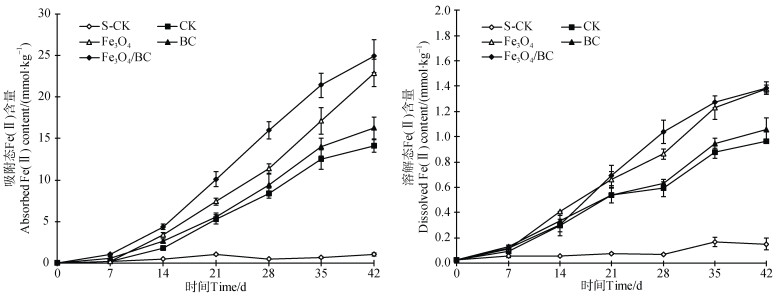
|
图 4 不同处理吸附态和溶解态Fe(Ⅱ)含量随培养时间变化 Fig. 4 Changes of absorbed and dissolved Fe(Ⅱ)contents with incubation time for different treatments |
由图 4可知,在整个培养期间,除S-CK处理的溶解态Fe(Ⅱ)含量一直很少外,其他4个处理的溶解态Fe(Ⅱ)含量在前7 d缓慢上升,然后快速上升,总体与吸附态Fe(Ⅱ)的时间变化过程类似。整个培养过程中,Fe3O4/BC和Fe3O4处理的溶解态Fe(Ⅱ)含量显著高于BC和CK处理(P < 0.05)。对比图 4吸附态和溶解态Fe(Ⅱ)含量,可以看出吸附态Fe(Ⅱ)含量大约是溶解态Fe(Ⅱ)含量的14倍~16倍,表明反应体系中铁氧化物还原生成的Fe(Ⅱ)主要以吸附态形式存在。
2.4 不同处理反应体系中HCB消减动态由图 5可知,在整个培养周期内,S-CK处理的HCB消减速率一直很低,培养结束时仅减少了初始总量的17.8%。对于未灭菌的CK、Fe3O4、BC和Fe3O4/BC处理,HCB残留量在培养的前7 d降低最快,之后降低趋势逐渐变缓,培养至42 d时,其HCB消减量分别为初始总量的39.9%、51.1%、45.3%和58.7%。
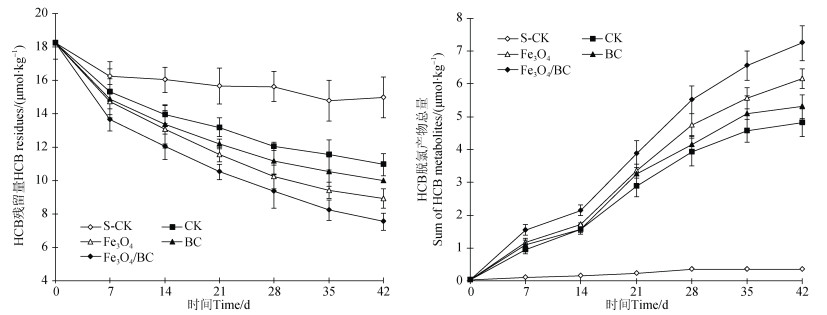
|
图 5 不同处理HCB残留量及其脱氯产物(包括PeCB、1, 2, 3, 5-TeCB、1, 2, 3, 4-TeCB、1, 2, 3-TCB、1, 3, 5-TCB和1, 2, 4-TCB)总量随培养时间的变化 Fig. 5 Changes of HCB resides and the sum of HCB metabolites(including PeCB, 1, 2, 3, 5-TeCB, 1, 2, 3, 4-TeCB, 1, 2, 3-TCB, 1, 3, 5-TCB and 1, 2, 4-TCB)with incubation time for different treatments |
采用准一级降解动力学方程和准二级降解动力学方程[28]拟合不同处理HCB的消减动态,结果见表 2。可以看出,HCB的消减过程既符合准一级降解动力学方程也符合准二级降解动力学模型,且这两种方程拟合出的反应速率常数k1和k2的大小顺序均为:Fe3O4/BC > Fe3O4 > BC > CK > S-CK。表明添加生物炭和纳米Fe3O4均能促进HCB降解,且纳米Fe3O4的效果优于生物炭;添加纳米Fe3O4/生物炭复合材料促进HCB降解的效果最佳。
|
|
表 2 不同处理HCB降解的准一/二级动力学方程拟合结果 Table 2 Pseudo-first-order and pseudo-second-order kinetic fitting results of HCB degradation for different treatments |
表 3为HCB脱氯降解产物PeCB、TeCB和TCB的生成动态。可以看出,PeCB是HCB的主要脱氯产物,TeCB与TCB仅在培养的28~42 d有检出,而且生成量显著低于PeCB。在42 d的培养过程中,S-CK处理的PeCB生成量远低于其他4个处理,未灭菌的4个处理PeCB生成量不断增加。在培养的前35 d,PeCB的生成量增加趋势明显,最后7 d,PeCB有小幅的增加。不同处理的PeCB生成量大小顺序为:Fe3O4/BC > Fe3O4 > BC > CK > S-CK。从28 d开始,除灭菌处理外的其他4个处理均检出了TeCB和TCB,包括1, 2, 3, 5-TeCB、1, 2, 3, 4-TeCB、1, 2, 3-TCB、1, 3, 5-TCB和1, 2, 4-TCB。其中1, 2, 3, 5-TeCB的生成量高于1, 2, 3, 4-TeCB;1, 3, 5-TCB的生成量高于1, 2, 3-TCB和1, 2, 4-TCB。
|
|
表 3 不同处理反应体系中HCB脱氯降解产物PeCB、TeCB (1,2,3,4-TeCB 和 1,2,3,5-TeCB)和TCB ( 1,2,3-TCB,1.2,4-TCB 和 1,3,5-TCB)的生成动态 Table 3 Dynamics of PeCB, TeCB (1,2,3,4-TeCB and 1,2,3,5-TeCB) and TCB (1,2,3-TCB, 1,2,4-TCB and 1,3,5-TCB) formation in the reactive systems for different treatments/ ( μmol·kg-1 ) |
不同处理反应体系中HCB脱氯产物(包括PeCB、1, 2, 3, 5-TeCB、1, 2, 3, 4-TeCB、1, 2, 3-TCB、1, 3, 5- TCB和1, 2, 4-TCB)总量随培养时间的变化过程见图 5。可以看出,灭菌处理的HCB脱氯产物总量最低,且随培养时间的变化很小;其他4个处理的HCB脱氯产物总量随培养时间持续上升。培养结束时,S-CK处理的HCB脱氯产物总量仅占初始HCB含量的1.9%,而未灭菌的CK、Fe3O4、BC和Fe3O4/BC处理的HCB脱氯产物总量分别占初始HCB含量的26.4%、33.7%、29.1%和39.7%,即不同处理的HCB脱氯产物总量大小顺序为:Fe3O4/BC > Fe3O4 > BC > CK > S-CK,与不同处理间HCB残留量的差异相吻合。
3 讨论 3.1 HCB还原脱氯降解途径及机制分析由表 3可以推测,HCB脱氯降解首先转化为PeCB,PeCB主要以如下两种途径(图 6)继续脱氯降解:PeCB→1, 2, 3, 5-TeCB→1, 3, 5-TCB和PeCB→1, 2, 3, 4-TeCB→1, 2, 4-TCB,且以前一种途径为主,这与Fathepure等[29]研究成果一致。主要因为苯环上不同位置的Cl被取代的难易程度不同,一般为邻位Cl最难被取代,其次是对位,间位Cl最易被取代[30]。
氯苯类化合物中HCB和PeCB已被斯德哥尔摩公约列为POPs,同时HCB、PeCB、1, 2, 4, 5-TeCB和1, 2, 4-TCB已被美国环境保护署列入31种优先控制污染物名单[31]。本研究发现,HCB还原脱氯产物主要是PeCB,TeCB和TCB很少。因此,如何强化PeCB的降解也应引起重视。本研究检测到HCB的脱氯产物1, 2, 4-TCB,说明环境中1, 2, 4-TCB的污染源既有一次污染,也有HCB、PeCB和TeCB脱氯降解产生的二次污染。一方面,1, 2, 4-TCB具有高毒性,另一方面,1, 2, 4-TCB的苯环上氯取代基包含邻位、间位和对位3种空间结构。因此,1, 2, 4-TCB作为重要的氯苯类污染物,其在环境中的降解行为也应引起关注。
灭菌处理的HCB脱氯产物总量很少,表明HCB还原脱氯需要在微生物的作用下进行。HCB的还原脱氯主要有化学和微生物两种途径。其中,化学还原脱氯是由还原性物质,如吸附态Fe(Ⅱ)驱动的反应。异化铁还原微生物活跃于铁氧化物表面,能溶解并还原Fe(Ⅲ),其还原产物Fe(Ⅱ)可与土壤中广泛存在的各种有机和无机配体发生络合作用,生成的铁络合物大部分以吸附态形式存在于土壤矿物表面。大部分Fe(Ⅱ)配合物的单电子还原电势小于游离态Fe(Ⅱ),因而具有很强的还原性,可以把电子传递给HCB使其发生化学还原脱氯降解[8]。此外,厌氧条件下,很多种属的微生物都具有还原脱氯功能,例如Desulfitobacterium、Sulfurospirillum、Anaeromyxobacter、Desulfomonile、Desulfovibrio、Desulfuromonas、Geobacter、Dehalogenimonas、Dehalococcoides以及Dehalobacter,其中Dehalococcoides和Dehalobacter是专性脱氯菌,而其他是非专性脱氯菌[5,9-10]。这些微生物可以利用反应体系中有机物厌氧发酵产生的氢气、甲酸、乙酸﹑丙酮酸等电子供体,将氯代有机污染物作为电子受体进行还原,并且在还原过程中获得能量进行生长[9-10]。但是,能够通过呼吸脱氯直接代谢有机氯的微生物往往只在严格厌氧环境中存在,并且由于其分解氯代有机物需要消耗大量能量,故其生长繁殖十分缓慢,发生还原脱氯反应也十分缓慢[5]。由此可见,无论是化学还原脱氯还是微生物还原脱氯,都必须有微生物参与才能完成。
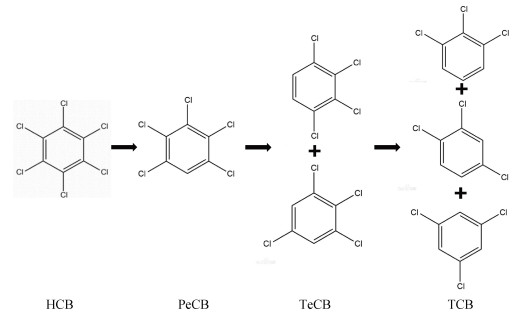
|
图 6 HCB的还原脱氯降解途径 Fig. 6 Reductive dechlorination pathway of HCB |
添加生物炭促进HCB还原脱氯。首先,因为生物炭可提高土壤的pH,缓解土壤的酸性(表 1)。大部分异化铁还原菌在近中性pH条件下铁还原能力最强[32],因此添加生物炭可促进异化铁还原生成大量吸附态Fe(Ⅱ)(图 4)且使反应体系的还原性增强(表 1),吸附态Fe(Ⅱ)可作为有效电子供体促进HCB化学还原脱氯,而且本研究发现HCB脱氯产物总量与吸附态Fe(Ⅱ)含量之间存在显著正相关关系(P < 0.05)。脱氯功能微生物,如Dehalococcoides和Dehalobacter为嗜中性微生物[4,33],因此,添加生物炭可通过改善土壤pH而促进HCB的微生物还原脱氯。此外,生物炭可通过吸附HCB而使其富集在生物炭表面[34-35],热解作用使生物炭表面含有丰富的醌基、氢醌和蒽醌等官能团,电子可以通过氧化还原过程在这些官能团之间传递[36]。因此,生物炭可作为电子穿梭体加速脱氯功能微生物与其表面吸附的HCB之间的电子传递,进而促进HCB的微生物还原脱氯。而且添加生物炭可以通过改善土壤的理化性质,提高土壤中脱氯功能微生物的丰度[34-35],进而促进有机氯污染物的微生物还原脱氯。
3.3 纳米Fe3O4促进HCB还原脱氯降解的机制添加纳米Fe3O4显著促进HCB还原脱氯降解,甚至比添加生物炭的效果更显著。首先,纳米Fe3O4作为铁源可显著增强异化铁还原菌的活性,异化铁还原菌能在胞外依赖电子穿梭体等电子传递介质将从有机质处获得的电子转移给铁氧化物,产生还原性Fe(Ⅱ),Fe(Ⅱ)可以与土壤中广泛存的在各种有机(乙酸、草酸、柠檬酸、EDTA等)及无机(OH–、Cl–、CO2–、
总之,HCB的还原脱氯降解离不开微生物的作用,微生物作用机制包括脱氯功能微生物的直接脱氯,以及铁还原菌将Fe(Ⅲ)还原,生成吸附态Fe(Ⅱ)间接还原HCB。由于HCB作为POPs具有强烈的生物毒性,难以被微生物直接利用与转化,主要依靠非生物转化过程,含低价铁的自然矿物界面的非生物脱氯转化过程是高毒性有机氯污染物降解的关键过程[37]。本研究也发现HCB脱氯产物生成与吸附态Fe(Ⅱ)含量之间存在显著正相关关系,进一步说明吸附态Fe(Ⅱ)是促进HCB还原脱氯的关键因子。
3.4 纳米Fe3O4/生物炭复合材料促进HCB还原脱氯降解的机制添加纳米Fe3O4/生物炭使HCB还原脱速率显著高于其他4个处理,主要因为纳米Fe3O4/生物炭复合材料的比表面积更大且纳米Fe3O4的分散性更好,大大增加了微生物与Fe3O4/生物炭表面的接触机会,而且纳米Fe3O4/生物炭复合材料比纳米Fe3O4具有更强的导电性和更高的电容量,可实现微生物之间长距离电子传递[19]。因此,一方面,添加纳米Fe3O4/生物炭增强了异化铁还原菌还原Fe(Ⅲ)生成吸附态Fe(Ⅱ)的能力(图 4),大量的吸附态Fe(Ⅱ)和更强的还原性(表 1)大大加快了HCB的化学还原脱氯速率;另一方面,纳米Fe3O4/生物炭有利于微生物之间的互营共代谢,强化了HCB的微生物还原脱氯降解。
4 结论不同处理HCB还原脱氯降解速率的大小顺序为:Fe3O4/BC > Fe3O4 > BC > CK > S-CK。HCB的主要脱氯降解途径为:HCB→PeCB→1, 2, 3, 5-TeCB→1, 3, 5-TCB。灭菌处理的HCB降解速率远小于非灭菌处理,表明HCB还原脱氯需要在微生物的作用下进行。添加生物炭可促进HCB还原脱氯,主要因为生物炭可缓解土壤的酸性,促进异化铁还原生成大量吸附态Fe(Ⅱ),且使反应体系的还原性增强。添加纳米Fe3O4促进HCB还原脱氯,归因于纳米Fe3O4可促进吸附态Fe(Ⅱ)的生成,而且纳米Fe3O4具有较好的导电性,有利于微生物的胞外电子传递。添加纳米Fe3O4/生物炭使HCB还原脱氯速率显著高于其他4个处理,主要因为纳米Fe3O4/生物炭复合材料的比表面积更大且纳米Fe3O4的分散性更好,大大促进了反应体系的电子传递效率。综上所述,纳米Fe3O4/生物炭复合材料是一种理想的有机氯污染土壤的修复剂。
| [1] |
UN Environment Programme. Stockholm Convention on Persistent Organic Pollutants[EB/OL]. (2001-05-22)[2016-05-23]. http://www.pops.int/documents/signature/signstatus.htm.
(  0) 0) |
| [2] |
Liu C Y, Wang Y L, Jiang X. Main transfer and transformation processes of hexachlorobenzene in soils (In Chinese)[J]. Soils, 2014, 46(1): 29-34. [刘翠英, 王艳玲, 蒋新. 六氯苯在土壤中的主要迁移转化过程[J]. 土壤, 2014, 46(1): 29-34.]
(  0) 0) |
| [3] |
Jiang Y H, Shang Y X, Yu S Y, et al. Dechlorination of hexachlorobenzene in contaminated soils using a nanometallic Al/CaO dispersion mixture: Optimization through response surface methodology[J]. International Journal of Environmental Research and Public Health, 2018, 15(5): 872. DOI:10.3390/ijerph15050872
(  0) 0) |
| [4] |
Liu C Y, Zeng T, Zheng J J, et al. Biochar-polylactic acid composite accelerated reductive dechlorination of hexachlorobenzene in paddy soils under neutral pH condition[J]. Bulletin of Environmental Contamination and Toxicology, 2021, 106(1): 175-182. DOI:10.1007/s00128-020-03070-x
(  0) 0) |
| [5] |
Xiao Z X, Jiang W, Chen D, et al. Bioremediation of typical chlorinated hydrocarbons by microbial reductive dechlorination and its key players: A review[J]. Ecotoxicology and Environmental Safety, 2020, 202: 110925. DOI:10.1016/j.ecoenv.2020.110925
(  0) 0) |
| [6] |
Li F B, Wang X G, Zhou S G, et al. Reviews on abiotic transformation of organchlorines on the interface of iron oxides and water in red soil colloids (In Chinese)[J]. Ecology and Environmental Sciences, 2006, 15(6): 1343-1351. DOI:10.3969/j.issn.1674-5906.2006.06.043 [李芳柏, 王旭刚, 周顺桂, 等. 红壤胶体铁氧化物界面有机氯的非生物转化研究进展[J]. 生态环境, 2006, 15(6): 1343-1351.]
(  0) 0) |
| [7] |
Zhou L Y, Chen S, Li H, et al. EDDS enhanced Shewanella putrefaciens CN32 and α-FeOOH reductive dechlorination of carbon tetrachloride[J]. Chemosphere, 2018, 198: 556-564. DOI:10.1016/j.chemosphere.2018.01.083
(  0) 0) |
| [8] |
Kappler A, Bryce C, Mansor M, et al. An evolving view on biogeochemical cycling of iron[J]. Nature Reviews Microbiology, 2021, 19(6): 360-374. DOI:10.1038/s41579-020-00502-7
(  0) 0) |
| [9] |
Cheng D, He J Z. Isolation and characterization of "Dehalococcoides" sp. strain MB, which dechlorinates tetrachloroethene to trans-1, 2-dichloroethene[J]. Applied and Environmental Microbiology, 2009, 75(18): 5910-5918. DOI:10.1128/AEM.00767-09
(  0) 0) |
| [10] |
Maphosa F, de Vos W M, Smidt H. Exploiting the ecogenomics toolbox for environmental diagnostics of organohalide-respiring bacteria[J]. Trends in Biotechnology, 2010, 28(6): 308-316. DOI:10.1016/j.tibtech.2010.03.005
(  0) 0) |
| [11] |
Brahushi F, Dörfler U, Schroll R, et al. Stimulation of reductive dechlorination of hexachlorobenzene in soil by inducing the native microbial activity[J]. Chemosphere, 2004, 55(11): 1477-1484. DOI:10.1016/j.chemosphere.2004.01.022
(  0) 0) |
| [12] |
Li J, Wang H H, Ma M P, et al. Mechanisms of interspecific electron transfer promoted by magnetite (In Chinese)[J]. Chinese Journal of Applied and Environmental Biology, 2022, 28(5): 1331-1340. [李建, 王鸿辉, 马美萍, 等. 磁铁矿促进微生物种间电子传递的机制[J]. 应用与环境生物学报, 2022, 28(5): 1331-1340.]
(  0) 0) |
| [13] |
Feng C H, Yue X J, Li F B, et al. Bio-current as an indicator for biogenic Fe(Ⅱ) generation driven by dissimilatory iron reducing bacteria[J]. Biosensors & Bioelectronics, 2013, 39(1): 51-56.
(  0) 0) |
| [14] |
Melton E D, Swanner E D, Behrens S, et al. The interplay of microbially mediated and abiotic reactions in the biogeochemical Fe cycle[J]. Nature Reviews Microbiology, 2014, 12(12): 797-808. DOI:10.1038/nrmicro3347
(  0) 0) |
| [15] |
Shi L, Dong H L, Reguera G, et al. Extracellular electron transfer mechanisms between microorganisms and minerals[J]. Nature Reviews Microbiology, 2016, 14(10): 651-662. DOI:10.1038/nrmicro.2016.93
(  0) 0) |
| [16] |
Huang L Y, Liu X, Zhou S G. Direct interspecies electron transfer of microbes: Mechanism and application (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(6): 1313-1324. DOI:10.11766/trxb201805240172 [黄玲艳, 刘星, 周顺桂. 微生物直接种间电子传递: 机制及应用[J]. 土壤学报, 2018, 55(6): 1313-1324.]
(  0) 0) |
| [17] |
Yang L, Wang M W, Zhang Y B. Magnetite-loaded biochar for enhanced anaerobic microbial treatment of 2, 4-dichlorophenol wastewater (In Chinese)[J]. Chemical Industry and Engineering Progress, 2022, 41(9): 5065-5073. [杨柳, 王名威, 张耀斌. 磁铁矿负载生物炭强化厌氧微生物处理2, 4-二氯苯酚废水[J]. 化工进展, 2022, 41(9): 5065-5073.]
(  0) 0) |
| [18] |
Meynet P, Hale S E, Davenport R J, et al. Effect of activated carbon amendment on bacterial community structure and functions in a PAH impacted urban soil[J]. Environmental Science & Technology, 2012, 46(9): 5057-5066.
(  0) 0) |
| [19] |
Pietikäinen J, Kiikkilä O, Fritze H. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus[J]. Oikos, 2000, 89(2): 231-242. DOI:10.1034/j.1600-0706.2000.890203.x
(  0) 0) |
| [20] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [21] |
Hu X L, Yang L Z, He S Y, et al. Preparation of Fe3O4/BC composite and its application for phosphate adsorptive removal (In Chinese)[J]. Research of Environmental Sciences, 2018, 31(1): 143-153. [胡小莲, 杨林章, 何世颖, 等. Fe3O4/BC复合材料的制备及其吸附除磷性能[J]. 环境科学研究, 2018, 31(1): 143-153.]
(  0) 0) |
| [22] |
Li X M, Zhou S G, Li F B, et al. Fe(Ⅲ) oxide reduction and carbon tetrachloride dechlorination by a newly isolated Klebsiella pneumoniae strain L17[J]. Journal of Applied Microbiology, 2009, 106(1): 130-139. DOI:10.1111/j.1365-2672.2008.03985.x
(  0) 0) |
| [23] |
Liu C Y, Wang Y, Ma Y C. Effect of iron oxide and propionic acid on anaerobic degradation of hexachlorobenzene in soil (In Chinese)[J]. China Environmental Science, 2018, 38(3): 1073-1080. DOI:10.3969/j.issn.1000-6923.2018.03.034 [刘翠英, 王宇, 马煜春. 铁氧化物与丙酸对土壤中六氯苯厌氧降解影响[J]. 中国环境科学, 2018, 38(3): 1073-1080.]
(  0) 0) |
| [24] |
Lin L N, Huang Q, Liu Z Q, et al. Preparation of biochar-ferro manganese oxide composite material and properties of removal of arsenic(Ⅲ) from aqueous solution (In Chinese)[J]. Journal of Agricultural Resources and Environment, 2017, 34(2): 182-188. [林丽娜, 黄青, 刘仲齐, 等. 生物炭-铁锰氧化物复合材料制备及去除水体砷(Ⅲ)的性能研究[J]. 农业资源与环境学报, 2017, 34(2): 182-188.]
(  0) 0) |
| [25] |
Zheng H, Han J T, Ding Y Y, et al. Adsorption of bovine serum albumin on chitosan modified magnetic nanoparticles (In Chinese)[J]. Chemical Industry and Engineering Progress, 2014, 33(1): 174-177, 186. [郑红, 韩景田, 丁媛媛, 等. 壳聚糖修饰磁性纳米粒子对BSA的吸附性能[J]. 化工进展, 2014, 33(1): 174-177, 186.]
(  0) 0) |
| [26] |
Yuan J, Shentu J, Ma B, et al. Microbial and abiotic factors of flooded soil that affect redox biodegradation of lindane[J]. Science of the Total Environment, 2021, 780: 146606. DOI:10.1016/j.scitotenv.2021.146606
(  0) 0) |
| [27] |
An M, Dong L, Zhang L, et al. Influence of different kinds of biochar on Cd and Pb forms in soil (In Chinese)[J]. Journal of Agro-Environment Science, 2018, 37(5): 892-898. [安梅, 董丽, 张磊, 等. 不同种类生物炭对土壤重金属镉铅形态分布的影响[J]. 农业环境科学学报, 2018, 37(5): 892-898.]
(  0) 0) |
| [28] |
Fan J L, Liu C Y, Zheng J J, et al. Dithionite promoted microbial dechlorination of hexachlorobenzene while goethite further accelerated abiotic degradation by sulfidation in paddy soil[J]. Ecotoxicology and Environmental Safety, 2023, 259: 115047. DOI:10.1016/j.ecoenv.2023.115047
(  0) 0) |
| [29] |
Fathepure B Z, Tiedje J M, Boyd S A. Reductive dechlorination of hexachlorobenzene to tri- and dichlorobenzenes in anaerobic sewage sludge[J]. Applied and Environmental Microbiology, 1988, 54(2): 327-330. DOI:10.1128/aem.54.2.327-330.1988
(  0) 0) |
| [30] |
Liu C Y, Jiang X, Wang F, et al. Hexachlorobenzene dechlorination as affected by nitrogen application in acidic paddy soil[J]. Journal of Hazardous Materials, 2010, 179(1/2/3): 709-714.
(  0) 0) |
| [31] |
Song Y, Wang F, Yang X L, et al. Influence and assessment of biochar on the bioavailability of chlorobenzenes in soil (In Chinese)[J]. Environmental Science, 2012, 33(1): 169-174. [宋洋, 王芳, 杨兴伦, 等. 生物质炭对土壤中氯苯类物质生物有效性的影响及评价方法[J]. 环境科学, 2012, 33(1): 169-174.]
(  0) 0) |
| [32] |
Li J Z, Wang X G, Yuan X H, et al. Relationship between pH and iron redox cycle in calcareous paddy soil (In Chinese)[J]. Acta Pedologica Sinica, 2014, 51(1): 143-149. DOI:10.11766/trxb201302030068 [李金珠, 王旭刚, 袁雪红, 等. pH与石灰性水稻土铁氧化还原过程的关系[J]. 土壤学报, 2014, 51(1): 143-149.]
(  0) 0) |
| [33] |
Chang B V, Liu J Y, Yuan S Y. Dechlorination of 2, 4-dichlorophenoxyacetic acid and 2, 4, 5-trichlorophenoxyacetic acid in soil[J]. Science of the Total Environment, 1998, 215(1/2): 1-8.
(  0) 0) |
| [34] |
Tong H, Hu M, Li F B, et al. Biochar enhances the microbial and chemical transformation of pentachlorophenol in paddy soil[J]. Soil Biology & Biochemistry, 2014, 70: 142-150.
(  0) 0) |
| [35] |
Song Y, Bian Y R, Wang F, et al. Effects of biochar on dechlorination of hexachlorobenzene and the bacterial community in paddy soil[J]. Chemosphere, 2017, 186: 116-123. DOI:10.1016/j.chemosphere.2017.07.139
(  0) 0) |
| [36] |
Yu L P, Yuan Y, Tang J, et al. Biochar as an electron shuttle for reductive dechlorination of pentachlorophenol by Geobacter sulfurreducens[J]. Scientific Reports, 2015, 5(1): 16221. DOI:10.1038/srep16221
(  0) 0) |
| [37] |
Li F B, Wang X G, Zhou S G, et al. Reviews on abiotic transformation of organchlorines on the interface of iron oxides and water in red soil colloids (In Chinese)[J]. Ecology and Environment, 2006, 15(6): 1343-1351. DOI:10.3969/j.issn.1674-5906.2006.06.043 [李芳柏, 王旭刚, 周顺桂, 等. 红壤胶体铁氧化物界面有机氯的非生物转化研究进展[J]. 生态环境, 2006, 15(6): 1343-1351.]
(  0) 0) |
| [38] |
Jin X, Wang F, Gu C G, et al. The interactive biotic and abiotic processes of DDT transformation under dissimilatory iron-reducing conditions[J]. Chemosphere, 2015, 138: 18-24. DOI:10.1016/j.chemosphere.2015.05.020
(  0) 0) |
| [39] |
Li X M, Li Y T, Li F B, et al. Interactively interfacial reaction of iron-reducing bacterium and goethite for reductive dechlorination of chlorinated organic compounds (In Chinese)[J]. Chinese Science Bulletin, 2009, 54(13): 1880-1884. [李晓敏, 李永涛, 李芳柏, 等. 有机氯脱氯转化的铁还原菌与铁氧化物界面的交互反应[J]. 科学通报, 2009, 54(13): 1880-1884.]
(  0) 0) |
| [40] |
Kato S, Hashimoto K, Watanabe K. Microbial interspecies electron transfer via electric currents through conductive minerals[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(25): 10042-10046.
(  0) 0) |
| [41] |
Aulenta F, Rossetti S, Amalfitano S, et al. Conductive magnetite nanoparticles accelerate the microbial reductive dechlorination of trichloroethene by promoting interspecies electron transfer processes[J]. ChemSusChem, 2013, 6(3): 433-436. DOI:10.1002/cssc.201200748
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61

