2. 浙江省农业资源与环境重点实验室, 杭州 310058
2. Zhejiang Provincial Key Laboratory of Agricultural Resources and Environment, Hangzhou 310058, China
因历史上工农业生产和社会发展需要,传统和新兴有机氯污染物(Organochlorine pollutants,OCPs)在农药、化工、医药、制革等行业中被广泛使用而进入到环境中。因其大多具有积累性、疏水性、生物积累性等特点,在土壤中的自然降解过程极其缓慢,造成持久性污染问题。生态环境部等六部委于2022年年底联合印发《重点管控新污染物清单(2023年版)》[1],对14类具有突出环境风险的新污染物实施禁止、限制、限排等管控措施,其中包括林丹、氯丹以及六氯苯等OCPs。在新形势下,有效防控土壤传统和新兴OCPs污染是支撑土壤健康、粮食安全、农业绿色发展等重大国家需求的基础。
自然环境中,大多数OCPs厌氧还原脱氯反应常与土壤环境中一些生源要素的生物氧化还原过程伴生,如与全球碳排放相关的产甲烷、与还原物质毒害和金属形态转化相关的铁/硫还原等过程。在厌氧条件下,土壤中胞外呼吸菌氧化电子供体(如有机碳等)产生电子,通过直接或间接方式传递至胞外不同电子受体(如Fe(Ⅲ)、SO2– 4、OCPs等),可介导电子传递在不同元素循环/污染转化中发生多过程耦合,调控土壤健康演变方向。然而,过去对土壤污染的研究多只聚焦污染过程本身,较少将土壤中元素循环与污染转化同步纳入考虑,已形成的土壤污染风险认识有待进一步完善。有鉴于此,在“一体化健康(One Health)”国际学术研究前沿需求下[2],本文以OCPs为例,在简要梳理土壤OCPs污染研究现况的基础上,从土壤氧化还原多过程耦合的视角,融合OCPs污染转化与元素循环,重新解译残留OCPs的土壤健康风险。在此基础上,呼吁基于理论创新驱动的多过程协同机制与精准调控研究,以期为实现减污降碳协同治理提供科学见解,支撑完善土壤健康理论和国家重大战略的有效实施。
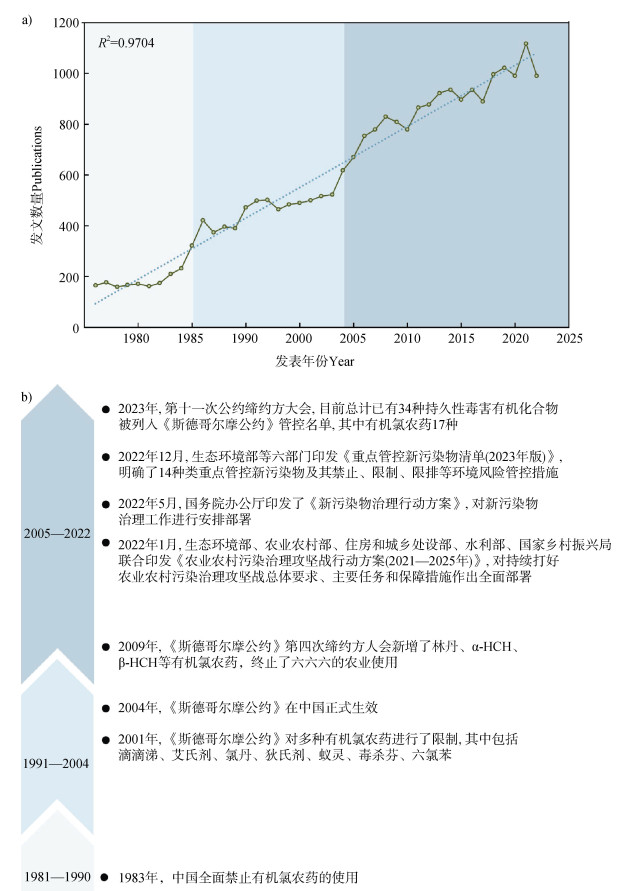
1 土壤OCPs污染研究现况为梳理土壤中OCPs研究现况,本文基于Web of Science(WoS)核心数据库进行文献检索。选取被列入《斯德哥尔摩公约》[3]中的典型OCPs为主要研究对象,组合设置检索词(“OCPs*” and “soil” and “risk” or “regulation”),使每个检索式包含至少一种OCP(表 1)。利用WoS检索分析工具对1981年1月1日至2022年12月31日已发表的24 584篇文献进行发文量及所属学科类别统计:近42年来,土壤中OCPs相关发文量呈逐年增加趋势,表明其残留赋存对土壤健康的风险问题受到社会公众的持续关注与重视(图 1a)。
|
|
表 1 斯德哥尔摩公约中典型持久性OCPs Table 1 Typical persistent OCPs in the Stockholm Convention |
|
图 1 土壤有机氯相关研究进展:a)1981—2022年发文数量;b)代表性里程碑事件 Fig. 1 Progress of the research on "Organochlorine in soil": a)the totalnumber of publications during 1981—2022;b)milestones timeline of important events about the organochlorine pollutants |
不同类型的持久性OCPs(图 1b)在土壤中被广泛检出[4-6]。表 1所列的典型OCPs,50%以上(9/16)为我国重点管控的新污染物。无论是传统OCPs还是新兴OCPs,其在环境中即使浓度较低,也可能具有显著的环境与健康风险,其危害具有潜在性和隐蔽性。2022年5月,国务院办公厅印发《新污染物治理行动方案》[7],对新污染物治理工作进行全面部署,强调防范新污染物环境与健康风险的重要性(图 1b)。OCPs污染所致的暴露问题是评估其生态环境健康风险的基础[8]。残留OCPs不易在土壤-植物系统中迁移,生物富集效应有限,尤其是低浓度残留OCPs通过食物链传输的人体健康风险总体较低[9-10]。然而,值得强调的是,Zhu等[11]通过培养实验,发现在OCPs胁迫下,反应体系内CH4的产量增加,这源于Methanosarcina等产甲烷菌的相对丰度增加,而这部分核心功能微生物也参与了OCPs的还原降解。由此可见,残留OCPs可能对土壤微生态环境中原有微生物群落产生胁迫压力,进而迫使群落重新组装构建新结构以适应OCPs污染环境;但这种变化可能会进一步影响土壤中关键元素生物地球化学循环,由此产生一定的负效应。因此,亟需采取有效措施,有效控制土壤中OCPs污染问题。
OCPs在自然界多富集在土壤和沉积物中,处于无氧或缺氧的环境。脱氯微生物利用产生的有机卤代物供给自身能量代谢,对全球卤素循环起着至关重要的生态作用。目前,基于有机卤呼吸细菌能量代谢的生物修复方法,被认为是厌氧环境中OCPs生物降解的最有效途径之一,具有潜在的应用前景。学者以OCPs污染河流沉积物为接种源,通过16S rRNA高通量测试,有效筛选得到一株新型有机卤呼吸型地杆菌(Geobacter sp. strain IAE),并验证发现其能够实现1,2-二氯乙烷和1,1,2-三氯乙烷的完全脱氯还原[12]。基于不同OCPs对电子传递链上不同功能酶的影响,适用筛选不同OCPs和快速富集高效功能脱氯菌的方法也得以开发[13]。OCPs污染微生物还原脱氯和修复治理机制是应对OCPs污染所致风险的重要研究热点之一。
值得强调的是,OCPs进入土壤后,容易被土壤颗粒吸附,其在土壤中的残留形态,可分为可提取态残留和结合态残留。前者可被溶剂提取并用常规检测方法鉴定分析,快速溶剂萃取和QuEChERS为常见的土壤中可提取态OCPs的提取方法[14-16]。然而现有研究中关于土壤OCPs的报道主要集中在有机溶剂可提取态,受检测平台限制,较少分析OCPs结合态的残留状况。在中德两国学者联合开展的新近研究中[17],在传统溶剂提取的基础上,采用分步化学处理方法,从23个青藏高原冻土样品中鉴定出270多种卤代有机化合物,其平均浓度高达310 mg·kg–1。其中,不可提取残留态占总量的99%以上。该研究表明,传统的溶解萃取方法测得的OCPs含量只是真实总量的“冰山一角”。与此同时,新近有研究整合246篇相关文献,采用荟萃分析发现淹水环境中OCPs浓度中位数处于μg·kg–1水平,并通过环境风险评估,发现以往研究尚未考虑结合态残留和多过程耦合效应,尤其是因脱氯和其他氧化还原过程的耦合所产生的潜在风险通常被忽略[18]。
2016年国务院发布的《土壤污染防治行动计划》[19]提出,到2030年全国土壤环境质量稳中向好,土壤环境风险得到全面管控,其中控制农业污染,推进土壤污染诊断、风险管控、治理与修复,加强土壤污染防治研究是重要板块。因此,在这种新形势下,更迫切需要重新关注结合残留和多过程耦合对OCPs风险评估准确性的影响。
2 土壤多过程耦合效应介导的残留OCPs潜在风险从上述研究现状分析可总结得出,有必要整合结合残留与多过程耦合的影响,全面剖析并重新认识土壤“低浓度”残留OCPs的污染风险,尤其是其在厌氧土壤环境中的地下生态环境风险。
2.1 结合残留效应导致土壤OCPs污染检测结果失真与土壤矿物/有机质牢固结合的结合态残留,无法被常规方法检测,只有基于14C放射性同位素示踪的手段才可进行精准观测。因此,在大多数基于常规检测方法的文献中,所报道的低浓度或无检出并不代表真实的土壤OCPs污染状况。通过“十三五”国家重点研发计划项目“农田有毒有害化学/生物污染与防控机制研究”的研究发现,对土壤中绝大多数农药、抗生素和酞酸酯而言,无论是好氧还是厌氧条件,其形成结合态残留的占比可达20%~90%,且在结合态残留中,以物理包埋方式形成的锁定态残留是一种可逆态残留,在土壤环境条件发生变化时,可再释放变成生物可利用态,由此构成“迟发性”土壤污染危害[20]。因此,对这部分结合态痕量物质的表征是厘清土壤中OCPs残留现状的关键,影响着对其潜在风险问题的准确认识。
2.2 多过程耦合效应介导污染转化伴生甲烷增排风险持久性OCPs的完全降解通常有耐于严格厌氧条件。尤其是对于结构复杂的高氯代OCPs而言,厌氧微生物呼吸代谢介导的还原脱氯降解被认为是其在环境中能被彻底削减的最有效途径[21-22]。然而,还原脱氯与产甲烷都是厌氧环境中发生的两大重要过程,一个影响污染削减、一个关乎全球温室气体排放。这两个过程均是得电子过程,从理论上推测可能存在微生物胞外呼吸链上电子传递的竞争关系。但前人通过纯菌研究发现[20-21]部分低分子量OCPs可在产甲烷环境下还原降解,一些产甲烷菌也被发现在OCPs脱氯中发挥积极作用,表明两个过程之间可能存在互惠关系。但目前,复杂介质如稻田中还原脱氯和产甲烷过程间的共存特征尚未有定论,互作机制亦不清楚。
为正确解答这些问题,部分学者新近开展了相关研究,加深了对OCPs残留土壤健康风险的认识。如Cheng等[23]基于稻田土壤产甲烷活性调控实验发现,促进产甲烷时还原脱氯增强,抑制产甲烷时还原脱氯也受到抑制;进一步收集数据(污染物涉及10种典型OCPs,厌氧介质涉及稻田、湿地等7大类),通过统计分析、线性模拟、实测确证等手段,发现OCPs还原脱氯所需Eh与产甲烷所需Eh区间存在重叠,这为正向协同的发生提供了理论基础;同时,即便脱氯与产甲烷存在电子竞争,OCPs也对部分产甲烷菌产生毒害,但因反应底物在化学计量上存在数量级差异,脱氯与产甲烷整体上并未形成绝对的竞争关系,多数情况下,OCPs快速还原和甲烷加速生成共存发生,表现出正向协同相关性。
此外,以往研究多将微生物介导的还原脱氯归功于脱氯功能细菌,鲜有关注产甲烷古菌对还原脱氯的作用[24]。针对该问题,Yuan等[25]从产甲烷菌的脱氯潜在功能挖掘切入,基于全球尺度微生物互作网络表征,发现产甲烷菌常作为核心节点与脱氯细菌一起维持着污染微生境的生态平衡;结合纯菌尺度非靶标代谢组分子机理探索,发现模式产甲烷菌Methanosarcina barkeri(M. barkeri)能促进OCPs类γ-HCH还原脱氯,γ-HCH也引起M. barkeri胞内外代谢物中与脱氯功能相关差异代谢物发生显著功能上调;结合分子/原子尺度量子化学计算,发现产甲烷菌辅酶F430因结构中心Ni原子存在强吸电子效应可显著降低γ-HCH还原脱氯的反应能垒。在此基础上,他们提出了强化OCPs厌氧削减时需同步关注甲烷增排风险的新观点。
上述研究揭示了不同厌氧介质中脱氯与产甲烷伴生且协同增进的普适效应,厘清了脱氯与产甲烷之间互营协同大于电子竞争的耦合关系,探明并验证了产甲烷菌的间接辅助及直接脱氯新功能,突出了关注与污染削减伴生的甲烷排放风险的必要性,是对OCPs残留风险的重新认识。
3 土壤OCPs污染多过程协同调控通常情况下,土壤中多种电子供/受/穿梭体共存,会对微生物厌氧呼吸电子传递产生高度异质化的影响。揭示该影响如何驱动不同得电子过程及其互作关系发生变化,阐明还原脱氯与元素循环多过程耦合的内在微生物学介导机制,是正确认识残留OCPs的土壤健康风险亟需突破的难点,也是调控土壤OCPs污染的关键。此外,以往聚焦简单体系的研究多将脱氯视为由专性脱氯菌(如Dehalococcoides)主导,较少关注兼性脱氯菌的贡献[26-27]。然而,土壤中微生物多样性高,专性脱氯菌常常难以形成竞争优势,兼性脱氯作用在土壤中可能不容忽视。如能厘清其中的胞外电子竞争或互营机制,基于电子传递调控增强兼性脱氯菌的脱氯潜力,将有助于厌氧土壤污染削减(OCPs脱氯降解)、温室气体排放(产甲烷)和还原物质毒害(铁/硫还原)等多过程协同管理,有效降低OCPs残留土壤的健康风险。
3.1 多过程耦合影响的脱氯机制前人以PCP为例的研究发现,淹水土壤中还原脱氯表现出与铁还原和产甲烷协同、与硫还原拮抗的耦合关系,机制主要根源于不同功能微生物厌氧呼吸时在胞外电子传递链上形成互营(脱氯与铁还原、脱氯与产甲烷)或竞争(脱氯与硫还原),致使电子传递在四种还原过程间产生耦合,且这种耦合作用受到多重土壤因子的影响,包括共存电子供体盈缺状况、电子穿梭体对还原过程中电子传递流向的调控、电子受体的竞争作用,以及底物或还原产物对功能微生物的毒害等[11,23,26,28-32]。此外,还有研究通过功能微生物群体协作机制探索,挖掘出铁还原菌的脱氯代谢新功能,发现铁还原菌一方面可通过介导Fe(Ⅲ)还原,在后续Fe(Ⅱ)接力氧化过程中将电子传递给PCP以促进其化学脱氯,另一方面可直接通过生物脱氯降解PCP[33];典型SO2– 4还原菌群虽可耐受PCP污染,但不具备脱氯功能[34];且土壤OCPs脱氯削减过程中,典型专性脱氯菌(如Dehalococcoides)常常无检出或丰度极低且无明显响应变化,而与铁/硫还原或产甲烷相关的功能菌作为核心节点,与兼性脱氯菌共同支撑着微生物互作网络的稳定性,说明还原脱氯主要由兼性脱氯菌及其与这些微生物的群体协作介导[14,29,32]。
上述研究在一定程度上厘清了厌氧条件下土壤中脱氯与铁/硫还原和产甲烷的耦合关系及电子互营/竞争机制。尤其是所揭示的兼性脱氯主导的稻田土壤OCPs降解机制,与过去聚焦均一介质揭示的专性脱氯机制明显不同,是精细识别土壤残留OCPs污染健康风险机制的新证据,也为优化复杂介质环境中残留OCPs的污染修复“多赢”策略提供了新视角。
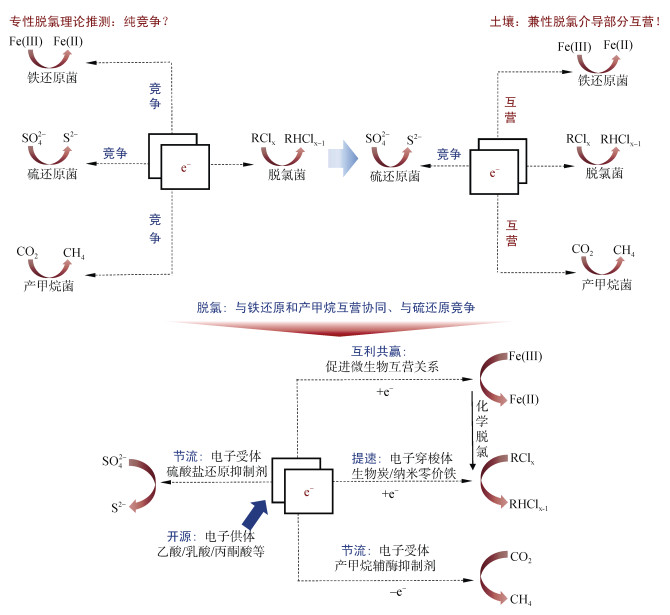
3.2 多过程协同靶向调控思路基于上述多过程耦合脱氯新机制的总结分析,我们针对OCPs残留土壤的健康重建问题,提出厌氧土壤OCPs污染多过程协同靶向调控思路:以干扰兼性脱氯功能菌群互作介导的电子传递为突破口,通过开源、节流、提速、互利共赢,调控电子传递的流向及流量,实现还原脱氯与元素转化的优化耦合,以同步协调污染削减、甲烷排放和还原物质毒害,综合增进土壤健康(图 2)。开源即补充外源电子供体,提高厌氧微生物进行污染转化与元素循环代谢过程所释放的电子总量;节流即针对与脱氯具有电子竞争关系的特定过程实施逆向调控,补充还原抑制剂(如硫酸盐还原抑制剂、产甲烷辅酶抑制剂等),减少竞争性电子受体对电子的消耗;提速即补充电子穿梭体(如生物质炭、纳米零价铁等),提升脱氯过程的电子传递速率;互利共赢即促进关键功能微生物互营(如改善兼性脱氯过程中脱氯功能菌与铁还原功能菌的群体协作等),强化生物脱氯时同步改善依赖铁还原的化学脱氯作用。
|
图 2 基于电子分流干预的土壤OCPs污染多过程协同靶向调控方法原理 Fig. 2 Mechanisms of electronic interaction/competition on element cycling and pollutant transformation in soil |
当前,厌氧微生物胞外呼吸介导的氧化还原过程及效应已成为国际土壤学研究的重大学术前沿,而科学认知受胞外电子传递调控的土壤污染转化与元素循环存在巨大挑战。如何协调厌氧微生物与土壤环境之间的交互作用,诱导微生物种群和关键功能菌的定向变化,改变电子传递路径,实现污染转化与元素循环的优化耦合,在强化污染削减时同步规避OCPs污染土壤中多过程耦合效应的健康风险,仍需更加系统深入地研究。有序推进相关工作,首要突破的困难包括:方法学上,缺乏精准表征电子传递的系统研究手段,无法对土壤氧化还原过程进行精细刻画;效应上,电子传递耦合介导机制复杂,对多过程耦合效应的认识不清;调控上,元素循环与污染转化过程耦合,协同增进土壤健康的多过程协同调控难度大。为此,建议未来研究可从如下两方面展开,以进一步支撑完善土壤健康理论。
4.1 土壤氧化还原精准研究方法体系构建系统阐释生物与化学耦合影响的电子转移机制是精准调控OCPs土壤污染风险的关键。其中,精准监测非均质土壤系统中转瞬即逝的电子转移是研究的必要前提。土壤中关键元素与污染物共存,不同电子受体还原过程间电子转移转瞬即逝且难以区分。因此,迫切需要对实验体系中不同过程(如还原脱氯、产甲烷、铁还原、硫还原)进行时空动态追踪,充分考虑土壤多团聚、非均质等特征,突破满足还原脱氯研究所需年/月长周期稳态原位监测的厌氧环境维持的难题,确保对不同氧化还原过程中表征电子转移微观过程指标的原位、长程、动态、实时、多通量与可视化观测。
针对土壤系统生物与化学互作高度异质的难点,还迫切需要将微界面转化纳入研究,融合稳定同位素指纹图谱与前沿仪器分析技术,高效甄别反应底物和产物。尤其是基于高分辨色/质谱联用技术、可疑物靶标/非靶标筛查方法等,同时结合基于碳、氢、氯等稳定同位素分馏效应分析,有望实现复杂介质中污染物的微/痕量甄别,高效鉴定确证污染转化途径与机制,突破污染转化过程电子转移科学定量的瓶颈。在此基础上,方可实现氧化还原反应电子转移动力学描述,进一步绘制不同电子供/受体的氧化还原半反应方程,使复杂体系中的氧化还原反应鉴定工作由繁趋简,实现不同过程电子转移当量的精细化学计量与电子转移机制的精准解析,为科学诠释复杂土壤系统中电子传递多过程的耦合机制与效应提供关键方法与技术手段。
4.2 基于合成微生物组学的多过程耦合互作机制探索与定向调控因土壤体系复杂,前述研究对脱氯削减伴生甲烷增排风险,以及多过程耦合脱氯机制的认知尚处于群落互作水平,亟待进一步从微生物个体细胞/分子水平上深层探索关键功能微生物(含产甲烷菌、专性/兼性脱氯菌等)的种间互作关系及机制。合成微生物群落作为模拟自然微生物群落的简化群落,具有操作性强、复杂度低、重现性高、简单可控等特点,可厘清厌氧微生物呼吸驱动的氧化还原多过程耦合机制的关键科学问题。同时,通过设计具有特定污染物降解功能的合成菌群,可对土壤中残留OCPs进行原位/异位治理。因此,结合合成微生物组学国际学术前沿,通过构建基于不同应用情景的污染转化与元素循环协同的合成微生物群落,尤其是全面厘清脱氯与产甲烷的互作机制,可为厌氧条件下土壤甲烷减排耦联残留OCPs高效削减的减污降碳精准调控提供新思路。
| [1] |
Ministry of Ecology and Environment of the People's Republic of China. Key regulated new pollutant list 2023[R/OL]. (2022-12-29). https://www.mee.gov.cn/gzk/gz/202212/t20221230_1009192.shtml.[中华人民共和国生态环境部. 重点管控新污染物清单(2023年版)[R/OL]. (2022-12-29). https://www.mee.gov.cn/gzk/gz/202212/t20221230_1009192.shtml.]
(  0) 0) |
| [2] |
Lehmann J, Bossio D A, Kögel-Knabner I, et al. The concept and future prospects of soil health[J]. Nature Reviews Earth & Environment, 2020, 1(10): 544-553.
(  0) 0) |
| [3] |
UNEP(United Nations Environment Programme). Stockholm convention on persistent organic pollutants[R/OL]. [2023-05-12]. http://chm.pops.int/TheConvention/ThePOPs/AllPOPs/tabid/2509/Default.aspx.
(  0) 0) |
| [4] |
Tao S, Xu F L, Wang X J, et al. Organochlorine pesticides in agricultural soil and vegetables from Tianjin, China[J]. Environmental Science & Technology, 2005, 39(8): 2494-2499.
(  0) 0) |
| [5] |
Tang C L, Chen Z H, Huang Y P, et al. Occurrence and potential harms of organochlorine pesticides(OCPs)in environment and their removal by periphyton[J]. Critical Reviews in Environmental Science and Technology, 2023, 53(22): 1957-1981. DOI:10.1080/10643389.2023.2196226
(  0) 0) |
| [6] |
Zhang S W, Zhao W Y, Yang C, et al. Assessment of currently used organochlorine pesticides in surface water and sediments in Xiangjiang River, a drinking water source in China: Occurrence and distribution characteristics under flood events[J]. Environmental Pollution, 2022, 304: 119133. DOI:10.1016/j.envpol.2022.119133
(  0) 0) |
| [7] |
General Office of the State Council of the People's Republic of China. New pollutant management action plan[R/OL]. (2022-05-04). https://www.mee.gov.cn/zcwj/gwywj/202205/t20220524_983032.shtml.[中华人民共和国国务院办公厅. 新污染物治理行动方案[R/OL]. (2022-05-04). https://www.mee.gov.cn/zcwj/gwywj/202205/t20220524_983032.shtml.]
(  0) 0) |
| [8] |
Matta K, Ploteau S, Coumoul X, et al. Associations between exposure to organochlorine chemicals and endometriosis in experimental studies: A systematic review protocol[J]. Environment International, 2019, 124: 400-407. DOI:10.1016/j.envint.2018.12.063
(  0) 0) |
| [9] |
Sheng J J, Wang X P, Gong P, et al. Monsoon-driven transport of organochlorine pesticides and polychlorinated biphenyls to the Tibetan Plateau: Three year atmospheric monitoring study[J]. Environmental Science & Technology, 2013, 47(7): 3199-3208.
(  0) 0) |
| [10] |
Jebara A, Turco V L, Potortì A G, et al. Organic pollutants in marine samples from Tunisian coast: Occurrence and associated human health risks[J]. Environmental Pollution, 2021, 271: 116266. DOI:10.1016/j.envpol.2020.116266
(  0) 0) |
| [11] |
Zhu M, Zhang L J, Franks A E, et al. Improved synergistic dechlorination of PCP in flooded soil microcosms with supplementary electron donors, as revealed by strengthened connections of functional microbial interactome[J]. Soil Biology & Biochemistry, 2019, 136: 107515.
(  0) 0) |
| [12] |
Jiang L S, Yang Y, Jin H J, et al. Geobacter sp. strain IAE dihaloeliminates 1, 1, 2-trichloroethane and 1, 2-dichloroethane[J]. Environmental Science & Technology, 2022, 56(6): 3430-3440.
(  0) 0) |
| [13] |
Shen R, Zhang S W, Liang Z W, et al. Mechanistic insight into co-metabolic dechlorination of hexachloro-1, 3-butadiene in Dehalococcoides[J]. Water Research, 2022, 220: 118725. DOI:10.1016/j.watres.2022.118725
(  0) 0) |
| [14] |
Bandh C, Björklund E, Mathiasson L, et al. Comparison of accelerated solvent extraction and soxhlet extraction for the determination of PCBs in Baltic Sea sediments[J]. Environmental Science & Technology, 2000, 34(23): 4995-5000.
(  0) 0) |
| [15] |
Lehmann E, Oltramare C, Nfon Dibié J J, et al. Assessment of human exposure to pesticides by hair analysis: The case of vegetable-producing areas in Burkina Faso[J]. Environment International, 2018, 111: 317-331. DOI:10.1016/j.envint.2017.10.025
(  0) 0) |
| [16] |
Wang H, Ding J, Ren N Q. Recent advances in microwave-assisted extraction of trace organic pollutants from food and environmental samples[J]. Trends in Analytical Chemistry, 2016, 75: 197-208. DOI:10.1016/j.trac.2015.05.005
(  0) 0) |
| [17] |
Zhu X J, Yang F, Li Z, et al. Substantial halogenated organic chemicals stored in permafrost soils on the Tibetan Plateau[J]. Nature Geoscience, 2023, 16(11): 989-996. DOI:10.1038/s41561-023-01293-1
(  0) 0) |
| [18] |
Liu M, Yuan J, Shi J C, et al. Chlorinated organic pollutants in global flooded soil and sediments: Pollution status and potential risk[J]. Environmental Pollution, 2023, 323: 121270. DOI:10.1016/j.envpol.2023.121270
(  0) 0) |
| [19] |
State Council of the People's Republic of China. Action plan for soil pollution prevention and control [R/OL]. (2016-05-28). https://www.gov.cn/zhengce/content/2016-05/31/content_5078377.htm.[中华人民共和国国务院. 土壤污染防治行动计划[R/OL]. (2016-05-28). https://www.gov.cn/zhengce/content/2016-05/31/content_5078377.htm.]
(  0) 0) |
| [20] |
He Y, Xue N D, Jiang J D, et al. Pollution prevention and control of farmland soil polluted by organic and biological contaminants—Summary report[R]. Hangzhou: Zhejiang University, 2020.[何艳, 薛南冬, 蒋建东, 等. 国家重点研发计划专项项目: 农田有毒有害化学/生物污染与防控机制研究总结报告[R]. 杭州: 浙江大学, 2020.]
(  0) 0) |
| [21] |
Heimann A C, Batstone D J, Jakobsen R. Methanosarcina spp. drive vinyl chloride dechlorination via interspecies hydrogen transfer[J]. Applied and Environmental Microbiology, 2006, 72(4): 2942-2949. DOI:10.1128/AEM.72.4.2942-2949.2006
(  0) 0) |
| [22] |
Qiao W J, Puentes Jácome L A, Tang X J, et al. Microbial communities associated with sustained anaerobic reductive dechlorination of α-, β-, γ-, and δ-hexachlorocyclohexane isomers to monochlorobenzene and benzene[J]. Environmental Science & Technology, 2020, 54(1): 255-265.
(  0) 0) |
| [23] |
Cheng J, Yuan J, Li S Y, et al. Promoted reductive removal of chlorinated organic pollutants co-occurring with facilitated methanogenesis in anaerobic environment: A systematic review and meta-analysis[J]. Critical Reviews in Environmental Science and Technology, 2022, 52(14): 2582-2609. DOI:10.1080/10643389.2021.1886890
(  0) 0) |
| [24] |
Xu L, Liu S, Tang Y Q, et al. Long-term dechlorination of polychlorinated biphenyls(PCBs)in Taihu Lake sediment microcosms: Identification of new pathways, PCB-driven shifts of microbial communities, and insights into dechlorination potential[J]. Environmental Science & Technology, 2022, 56(2): 938-950.
(  0) 0) |
| [25] |
Yuan J, Li S Y, Cheng J, et al. Potential role of methanogens in microbial reductive dechlorination of organic chlorinated pollutants in situ[J]. Environmental Science & Technology, 2021, 55(9): 5917-5928.
(  0) 0) |
| [26] |
Wang S Q, Chen C, Zhao S Y, et al. Microbial synergistic interactions for reductive dechlorination of polychlorinated biphenyls[J]. Science of the Total Environment, 2019, 666: 368-376. DOI:10.1016/j.scitotenv.2019.02.283
(  0) 0) |
| [27] |
He J Z, Ritalahti K M, Yang K L, et al. Detoxification of vinyl chloride to ethene coupled to growth of an anaerobic bacterium[J]. Nature, 2003, 424(6944): 62-65. DOI:10.1038/nature01717
(  0) 0) |
| [28] |
Xu Y, He Y, Zhang Q, et al. Coupling between pentachlorophenol dechlorination and soil redox as revealed by stable carbon isotope, microbial community structure, and biogeochemical data[J]. Environmental Science & Technology, 2015, 49(9): 5425-5433.
(  0) 0) |
| [29] |
Cheng J, Liu M, Su X, et al. Conductive materials on biocathodes altered the electron-transfer paths and modulated γ-HCH dechlorination and CH4 production in microbial electrochemical systems[J]. Environmental Science & Technology, 2023, 57(7): 2739-2748.
(  0) 0) |
| [30] |
Yang X L, Cheng J, Franks A, et al. Loss of microbial diversity weakens specific soil functions, but increases soil ecosystem stability[J]. Soil Biology & Biochemistry, 2023, 177: 108916.
(  0) 0) |
| [31] |
Yang X L, Yuan J, Li N N, et al. Loss of microbial diversity does not decrease γ-HCH degradation but increases methanogenesis in flooded paddy soil[J]. Soil Biology & Biochemistry, 2021, 156: 108210.
(  0) 0) |
| [32] |
He Y, Xu J M, et al. Pollution, prevention and control of organic/biological contaminants in soil (In Chinese). Beijing: Science Press, 2020. [何艳, 徐建明, 等. 土壤有机/生物污染与防控[M]. 北京: 科学出版社, 2020.]
(  0) 0) |
| [33] |
Xu Y, He Y, Tang X J, et al. Reconstruction of microbial community structures as evidences for soil redox coupled reductive dechlorination of PCP in a mangrove soil[J]. Science of the Total Environment, 2017, 596/597: 147-157. DOI:10.1016/j.scitotenv.2017.04.073
(  0) 0) |
| [34] |
Xu Y, Xue L L, Ye Q, et al. Inhibitory effects of sulfate and nitrate reduction on reductive dechlorination of PCP in a flooded paddy soil[J]. Frontiers in Microbiology, 2018, 9: 567. DOI:10.3389/fmicb.2018.00567
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


