2. 中国科学院大学, 北京 100049;
3. 中国科学院大学南京学院, 南京 211135
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. University of Chinese Academy of Sciences, Nanjing, Nanjing 211135, China
近年来,人类活动造成我国农田土壤酸化不断加剧,这已成为制约土壤农业可持续发展和生态环境安全的重要因素。从20世纪80年代到21世纪初,农田表层土壤pH平均下降约0.5个单位,强酸性土壤面积增加了近34%,土壤总酸化速率增加了2.9倍[1-3]。研究表明化学氮肥的长期过量施用是我国农田土壤加速酸化的主要原因[1]。过量铵态氮肥施入土壤后会被快速硝化,产生大量质子,且硝态氮易携带盐基阳离子淋失,不但造成氮肥损失,同时加速了土壤酸化。如何降低土壤中的硝化作用、有效固持土壤中未被作物吸收利用的无机氮、提高氮肥利用率是目前农业生产中阻控氮肥导致土壤酸化亟待解决的关键问题[4]。
近期研究发现,通过外源添加有机碳促进土壤微生物氮同化作用是一项极具潜力的土壤保氮措施[5-7]。有机碳源的质量被认为是调节土壤微生物氮同化作用的一个重要因素,如葡萄糖等易利用碳源较纤维素更能有效刺激土壤微生物对氮的同化作用[6]。在农田土壤中,秸秆还田、根茬残留、有机肥施用是提高土壤有机碳的主要措施,这些有机物料不但含有微生物易利用碳源葡萄糖,而且含有大量较难利用的纤维素、难利用的木质素,以及少量可溶性有机酸盐等物质[6,8]。这些有机物质由于化学结构和被微生物可利用的能量和效率不同,一些主要用于生物质合成(合成代谢),一些主要用于能量生产(分解代谢),其微生物碳利用效率也具有明显差异[9]。根据生物化学计量学特征,微生物同化碳的同时也会同化无机氮以满足合成代谢的需求[10-11]。这些不同类型碳源添加到土壤中将会对微生物活性和繁殖产生不同的影响,进一步将影响微生物对氮转化的过程和利用效率[8]。我们研究发现,添加易利用碳源如葡萄糖,可以通过促进农田土壤中NH4+-N和NO3–-N的微生物同化作用、显著降低硝化作用,以缓解氮肥导致的土壤酸化作用[12-13]。然而,目前关于有机物料中不同利用程度碳源对土壤肥料氮转化的研究较多[7-8,14],涉及氮转化和土壤酸化的影响研究报道较少。
本研究选择葡萄糖、苯甲酸钠(易利用的单糖和有机酸盐)、纤维素(较难利用多糖)、木质素(难利用复杂酚类聚合物)等四种不同类型的碳源物质,分别代表有机物料中微生物可利用程度不同的物质组分,通过分析这些碳源与尿素配合施用对土壤氮素转化及其诱导的土壤酸化的影响,解析通过外加有机碳源调控土壤肥料氮素转化过程以阻控土壤酸化的可能途径,研究结果对优化农田养分管理以阻控土壤酸化的对策构建具有重要理论意义。
1 材料与方法 1.1 供试土壤供试土壤为第四纪红黏土发育的红壤,采自江西省鹰潭市的中国科学院红壤生态实验站(28°12′N,116°55′E)红壤酸化长期定位观测试验地的表层土壤(0~20 cm),主要进行红薯与油菜轮作。土壤样品取回后风干、磨碎,过10目筛。土壤基本性质为:pH(土水比1︰2.5)为5.23,有机碳11.02 g·kg–1,全氮1.07 g·kg–1,NH4+-N 0.76 mg·kg–1,NO3–-N 7.17 mg·kg–1,有效磷56.48 mg·kg–1,速效钾191.37 mg·kg–1,交换性酸14.6 mmolc·kg–1,阳离子交换量13.90 cmolc·kg–1,盐基饱和度46%[13]。
1.2 实验设计称取200.0 g风干土样到500 mL塑料杯中,参照Quan等[15]的方法加入去离子水将土壤含水量调节至饱和田间持水量的40%。将土样充分拌匀,用塑料保鲜膜将塑料杯封口,并在保鲜膜上留三个小孔,以便气体交换并减少水分损失。然后将塑料杯放置在25 ℃恒温培养箱中黑暗条件下预培养7 d,以激活土壤内源微生物的活性。
土壤预培养结束后,设置以下6个处理:1)空白对照(CK);2)尿素(U);3)葡萄糖+尿素(GU);4)苯甲酸钠+尿素(SBU);5)纤维素+尿素(CU);6)木质素+尿素(LU),每个处理3次重复。葡萄糖、苯甲酸钠、纤维素和木质素的加入量以C添加量为4.0 g·kg–1干土进行计算,尿素加入量以N添加量为100 mg·kg–1干土。葡萄糖、苯甲酸钠、纤维素粉和木质素(脱碱)采购于上海阿拉丁生化科技股份有限公司,含碳量分别为40.0%、58.3%、42.4%和48.7%。为保证加入碳源的初始酸度一致,先将适量碳源和尿素加入10 mL水中,在搅拌的过程中用4 mol·L–1的盐酸或氢氧化钠调节溶液pH稳定在6.0,然后添加该溶液至土壤中拌匀,再补充去离子水至含水量为饱和田间持水量的60%,CK处理土壤直接添加去离子水至60%饱和田间持水量。从每个塑料杯中取出35.4 g的新鲜土样(相当于30 g风干土重)用于连续监测土壤的呼吸强度。剩余样品在培养0、1、3、7、14、21、30、45 d取部分土壤鲜样测定土壤pH、无机氮、微生物生物量氮、固相有机氮;培养结束时测定各处理土壤pH缓冲容量。所有样品均置于25 ℃恒温培养箱中黑暗培养45 d,每隔3 d称重1次并补充去离子水以保持土壤含水量恒定。
1.3 测定方法土壤pH的测定:在每个取样时间点称取8.0 g鲜土,以1︰2.5(风干土:水)的比例加入去离子水,涡旋搅拌5 min,静置30 min,用pH计(Thermo Scientific Orion Star A211,美国)测定样品上清液pH[16]。
土壤中各种形态氮的测定:在每个取样时间点称取5.0 g鲜土于50 mL塑料离心管中,按1︰4的干土水比加入0.5 mol·L–1 K2SO4溶液,振荡1 h,离心,上清液用0.45 μm滤膜过滤后存放在–20 ℃冰箱中用于测定可提取无机氮。浸提液中的NH4+-N、NO3–-N采用连续流动分析仪(Skalar San++ System,荷兰)测定,无机氮为NH4+-N与NO3–-N之和。经过0.5 mol·L–1 K2SO4溶液提取后的土样残渣继续用0.5 mol·L–1 K2SO4溶液振荡浸提2次,离心后倒掉上清液,将土样残渣风干,研磨过100目筛,用于测定难提取氮,包括固相有机氮和微生物生物量氮。土壤固相有机氮是为了区分土壤可溶性有机氮而命名的,土壤可溶性有机氮在之前硫酸钾溶液提取无机氮时已经被提取,因此土壤残渣中含有的为土壤固相有机氮,但是土壤残渣没有经过氯仿熏蒸处理,因此土壤残渣还含有土壤微生物生物量氮[15]。同时在每个取样时间点称取5.0 g鲜土,采用氯仿熏蒸浸提法[16],浸提的土壤溶液采用连续流动分析仪测定全氮含量,土壤微生物生物量氮的含量以熏蒸和不熏蒸土壤浸提液中全氮的差值除以转化系数(0.45)得到。难提取氮的测定:称取提取完可溶性氮的风干残渣土样,采用凯氏消煮法用凯氏定氮仪测定,由于此方法测定的氮不包括固定态铵,因此难提取氮减去微生物生物量氮的差值即为土壤固相有机氮[15]。
土壤呼吸强度采用室内密闭培养法测定[16],并计算土壤中CO2-C的释放速率和累积释放量。培养结束的土壤研磨过60目筛,采用酸碱滴定法测定土壤pH缓冲容量(pHBC),根据土壤pH与酸碱加入量之间的关系计算土壤pH缓冲容量[17]。
1.4 H+产生量的计算土壤氮转化产生H+的过程主要涉及氮矿化、硝化、同化、氨挥发和反硝化。由于本研究选用的酸性红壤在好氧条件下培养,氨挥发和反硝化作用较小、忽略不计。因此,红壤中氮循环对H+的贡献(H(N cycling)+)主要由净氮矿化、净硝化和净氮同化产生或消耗的H+含量组成[18-20],计算如下:以培养0 d CK处理土壤pH、NH4+-N、NO3–-N和无机氮为背景值,净氮矿化对土壤酸度贡献质子(H(m)+)的计算方法为每增加1 mol无机氮消耗1 mol H+;净硝化对土壤酸度的贡献质子(H(n)+)的计算方法为每增加1 mol NO3–-N产生2 mol H+;净氮同化对土壤酸度的贡献的计算方法(H(i)+)的计算方法通过综合考虑NH4+-N或NO3–-N的净减少量计算所得,每净减少1 mol NH4+-N产生1 mol H+,每净减少1 mol NO3–-N消耗1 mol H+。由土壤pH缓冲容量和pH的变化值(∆pH)相乘得土壤总净H+产生或消耗量(H(∆pH)+)。
1.5 数据处理采用IBM SPSS Statistics 26进行单因素方差分析,选择Duncan检验对各处理土壤中各种形态氮的含量、pH和C矿化等进行差异显著性分析,并对各测定指标进行皮尔逊相关分析,同时对培养过程中土壤呼吸、无机氮、微生物生物量氮、固相有机氮的动态变化量与对应土壤pH进行逐步线性回归、多元线性回归分析,P < 0.05表示显著差异或显著相关性。
2 结果 2.1 土壤呼吸速率与CO2-C累积释放量与对照相比,添加尿素增加了土壤呼吸CO2-C释放速率和累积释放量;与单加尿素处理相比,有机碳源和尿素配施处理大幅提高土壤呼吸CO2-C释放速率峰值和累积释放量(图 1)。其中,葡萄糖与尿素配施处理的土壤呼吸速率在培养2 d时达到峰值779.7 mg·kg–1 d–1,木质素、纤维素、苯甲酸钠与尿素配施处理的土壤呼吸速率分别在培养2、7、14 d时达到峰值,且峰值由大到小依次为葡萄糖、苯甲酸钠、木质素、纤维素(图 1a)。培养结束时添加不同有机碳源处理土壤CO2-C释放量由大到小依次为苯甲酸钠、葡萄糖、纤维素、木质素,CO2-C释放量分别占碳源添加量的96.0%、90.6%、51.3%、21.2%(图 1b)。以上结果表明有机碳源的可利用性或可分解程度不同,因而对土壤呼吸的刺激也存在明显差异。
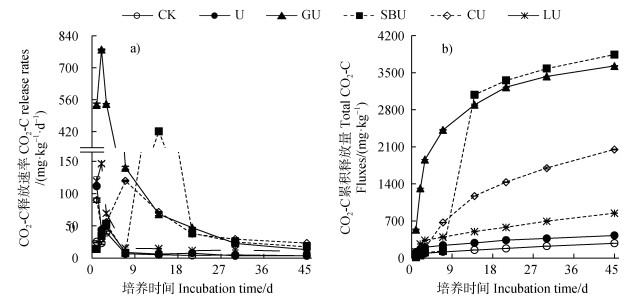
|
注:CK,空白对照;U,尿素;GU,葡萄糖+尿素;SBU,苯甲酸钠+尿素;CU,纤维素+尿素;LU,木质素+尿素。图中数据为3次重复的平均值±标准误。下同。 Note: CK, control; U, urea; GU, glucose+urea; SBU, sodium benzoate+urea; CU, cellulose+urea; LU, lignin+urea. The data in the figure are the mean ± standard error of three replicates(n = 3). The same below. 图 1 土壤呼吸CO2-C释放速率(a)和累积释放量(b)在45 d培养期间的动态变化 Fig. 1 Dynamic changes of the release rates(a)and total fluxes(b)of soil respiration CO2-C during the 45-day incubation |
培养过程中,对照处理土壤无机氮从12.87 mg·kg–1逐渐增加至43.21 mg·kg–1,这表明红壤在好氧条件下会发生有机氮的净矿化作用,单加尿素处理在培养前7天尿素基本水解完成,促使土壤无机氮增加至115.27 mg·kg–1,之后基本保持不变(图 2a)。葡萄糖、苯甲酸钠、纤维素与尿素配施处理中土壤无机氮含量培养前期明显降低,与尿素处理土壤无机氮含量相比分别在培养1、14、7 d降低了98.3%、54.0%、95.0%;随后添加葡萄糖、苯甲酸钠处理的土壤无机氮逐渐增加,而添加纤维素的土壤无机氮几乎保持不变。木质素与尿素配施处理土壤无机氮在培养前14天增加,随后略有降低,其变化趋势与单施尿素处理的相似,只是培养期间较后者低10.43~25.38 mg·kg–1。培养结束时葡萄糖、苯甲酸钠、纤维素、木质素和尿素配施处理的土壤无机氮分别较单独添加尿素处理仍降低56.6%、36.7%、99.4%、17.1%(图 2a)。以上结果表明添加不同类型的有机碳源促进无机氮被土壤固持的程度不同。
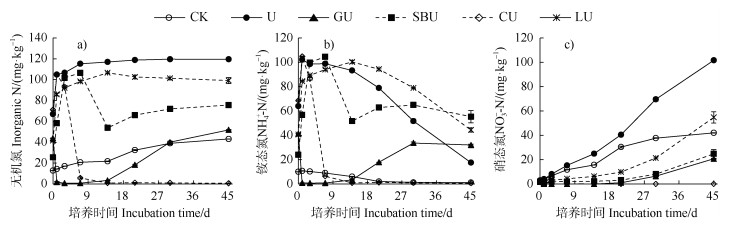
|
图 2 土壤无机氮(a)、铵态氮(b)和硝态氮(c)在45 d培养期间的动态变化 Fig. 2 Dynamic changes of soil inorganic N(a), NH4⁺-N(b), and NO3–-N(c)during the 45-day incubation |
不同处理中土壤NH4+-N的变化趋势基本与无机氮的变化趋势类似,其中有明显差异的是对照、尿素处理中NH4+-N从第1天开始明显降低,相应处理的NO3–-N迅速增加,表明这些处理均发生了明显的硝化作用(图 2b和图 2c)。而不同类型的有机碳源均有效降低了土壤的硝化作用,其中纤维素与尿素配施处理的NO3–-N培养结束时仍低于0.1 mg·kg–1,葡萄糖、苯甲酸钠、木质素与尿素配施处理土壤NO3–-N含量与尿素处理相比分别降低了79.6%、75.6%、46.1%(图 2c)。此外,木质素和尿素配施处理的NH4+-N在培养14 d后明显降低,但木质素、苯甲酸钠与尿素配施处理土壤NH4+-N的含量分别在14、30 d后高于尿素处理,而其NO3–-N含量在培养45 d后仍显著低于尿素处理,表明木质素和苯甲酸钠具有直接抑制硝化作用的能力(图 2b和图 2c)。与单施尿素处理相比,葡萄糖、苯甲酸和纤维素与尿素配施的处理分别在培养1、14、7 d促进NH4+-N降低了99.1%、44.6%、93.6%,随后只有葡萄糖、苯甲酸钠与尿素配施的处理释放了32.80、13.24 mg·kg–1 NH4+-N(图 2b),表明葡萄糖和纤维素主要促进铵态氮的固持而抑制了硝化作用。
2.3 土壤微生物生物量氮和固相有机氮的动态变化对照处理中土壤微生物生物量氮(MBN)含量在培养期间总体呈逐渐增加趋势,单独添加尿素处理的MBN含量在培养结束时略有减少(图 3a)。与单独添加尿素处理相比,有机碳源和尿素配施的处理MBN含量随培养时间的增加总体呈现先增加后降低的趋势,不同碳源处理的土壤MBN变化的快慢不一样,葡萄糖、苯甲酸钠、纤维素、木质素与尿素配施处理的MBN含量分别在培养1、14、7和14 d达到峰值,分别较单独添加尿素处理的MBN含量高56.70、38.47、58.52、12.69 mg·kg–1,且峰值出现时间与无机氮最低值出现的时间一致(图 3a和图 2a)。有机碳源和尿素配施处理MBN出现峰值后迅速下降,而土壤固相有机氮含量则有不同程度的提高,其中葡萄糖、木质素与尿素配施处理土壤固相有机氮含量在第3天最高,后期明显降低,而苯甲酸钠、纤维素与尿素配施处理土壤固相有机氮在第21天到达或基本接近峰值,后期变化不大(图 3b)。培养结束时,与单施尿素处理相比,葡萄糖、苯甲酸钠、纤维素、木质素与尿素配施处理MBN含量分别增加91.2%、17.2%、31.2%、40.5%(图 3a),土壤固相有机氮分别增加6.6%、3.8%、13.4%、2.1%(图 3b)。以上结果表明添加有机碳源促进了土壤无机氮向微生物生物量氮和固相有机氮的转化。
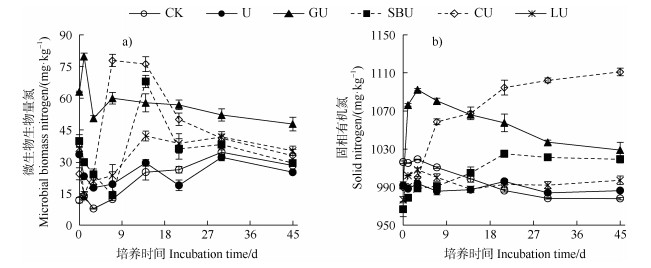
|
图 3 土壤微生物生物量氮(a)和固相有机氮(b)在45 d培养期间的动态变化 Fig. 3 Dynamic changes of soil microbial biomass N(a)and solid organic N(b)during the 45-day incubation |
由图 4可知,培养过程中对照处理土壤pH逐渐降低,结束时pH降低了0.55个单位,添加尿素处理的土壤pH在培养开始时显著高于对照处理,随后逐渐降低,培养结束时pH降低了1.17个单位,较对照处理土壤pH低0.26个单位。葡萄糖、纤维素与尿素配施处理土壤pH分别在培养3 d、7 d内降低,随后逐渐增加,而木质素与尿素配施处理土壤pH则在培养3 d内略有增加,随后逐渐降低。苯甲酸钠与尿素配施处理土壤pH快速增加,在培养14 d时达到峰值8.03。培养结束时葡萄糖、苯甲酸钠、纤维素、木质素与尿素配施土壤pH分别较尿素单施处理土壤pH高0.67、3.11、0.78、0.69个单位。表明外加有机碳源与尿素配施在不同程度上抑制了氮肥施用诱导的土壤酸化过程。从培养45 d结束时土壤净氮矿化、净硝化、净氮同化计算的H+含量(表 1)可以看出,对照处理净硝化H+产生量显著高于净氮矿化H+消耗量,最终土壤内部氮循环H+产生量为3.44 mmolc·kg–1;添加尿素促进了土壤净氮矿化和净硝化作用,最终氮循环H+产生量为6.52 mmolc·kg–1。添加有机碳源主要通过促进微生物对无机氮的同化作用、降低硝化作用来减少氮循环产生的H+。培养结束时纤维素、木质素与尿素配施处理土壤氮循环净H+产生量分别减少了92.8%、80.7%。葡萄糖、苯甲酸钠与尿素配施处理土壤氮循环过程表现为净消耗H+,H+消耗量分别为0.29和1.67 mmolc·kg–1。
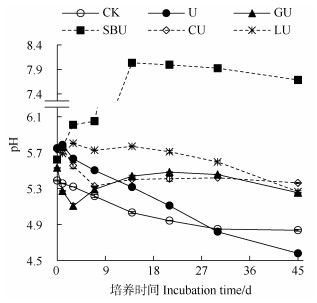
|
图 4 土壤pH在45 d培养期间的动态变化 Fig. 4 Dynamic changes of soil pH during the 45-day incubation |
|
|
表 1 培养45 d时基于土壤净氮矿化、净硝化、净氮同化过程以及土壤ΔpH计算的H+产消量 Table 1 The H+ content calculated by net N mineralization, net nitrification, net N immobilization and soil ΔpH after the 45-day incubation |
皮尔逊相关分析表明土壤pH与NH4+-N、C矿化量呈显著正相关,与NO3–-N呈显著负相关(P < 0.05)。对土壤pH与土壤呼吸(MinC)、土壤无机氮(NH4+-N、NO3–-N和EIN)、土壤微生物生物量氮(MBN)和固相有机氮(SON)进行逐步线性回归和多元线性回归分析,其中逐步线性回归分析方程为pH = 0.0004 MinC + 0.019 NH4+-N - 0.014 EIN - 0.009 SON + 14.318(R² = 0.608,P < 0.05)。多元线性回归分析结果显示土壤呼吸CO2-C累积释放量(β = 0.795,P < 0.05)显著正向预测土壤pH,土壤固相有机氮(β = –0.435,P < 0.05)显著正向预测土壤pH,土壤呼吸CO2-C累积释放量与土壤各种形态氮的含量可共同解释土壤pH 60.7%的变异。进一步分析以氮转化过程控制土壤pH变化为主的处理,如表 1中对照、尿素、葡萄糖、纤维素等处理中基于土壤ΔpH计算的H+产消量与因氮循环过程的H+产消量,并进行线性回归分析,其线性回归方程为y1 = 0.81 x1–1.37(R² = 0.99),x1是表 1中基于土壤氮循环计算的H+产消量(H(N cycling)+),y1是表 1中土壤pH缓冲容量与pH变化值(∆pH)乘积计算的H+产消量(H(∆pH)+),相关性达极显著,且斜率为0.81,这说明氮循环过程与土壤pH变化紧密相关。基于氮循环过程计算的H+产消量与因净硝化计算的H+产消量之间的线性回归方程为y2 = 0.48 x2– 0.13(R² = 0.89),x2是表 1中因净硝化计算的H+产消量(H(n)+),y2是表 1中土壤氮循环计算的H+产消量(H(N cycling)+),这说明硝化作用与土壤酸化存在显著正相关关系。
3 讨论 3.1 不同类型有机碳源对土壤碳、氮转化的影响本研究发现不同有机碳源对土壤呼吸的刺激作用存在明显差异(图 1),其主要受碳源的可利用性或可分解程度的影响。亲水化合物葡萄糖(单糖)、苯甲酸钠(有机羧酸盐)等小分子易溶性碳源,是微生物的易利用碳源,因此其通过提高微生物活性而促进土壤呼吸的作用最强[13]。其中苯甲酸钠具有一定的生物毒性[21],因此培养第1周内土壤呼吸较弱,但在第2周微生物适应环境后快速促进了苯甲酸钠的代谢。而且由于苯甲酸钠含有羧基,较葡萄糖的碳氧化态高,因此更容易矿化、促进呼吸的作用也更强[10,22]。疏水性纤维素和结构复杂的木质素,在水中溶解度很低,被微生物利用前需要酶裂解成简单的有机分子,尤其木质素是难利用碳源,分子结构更复杂,只能被更有限的土壤微生物分解,因此很难矿化,更有利于促进有机碳的土壤积累[8,22-23]。
土壤无机氮的变化结果表明添加不同类型有机碳源均在一定程度上促进了无机氮的土壤固持,而且无机氮固持量最大时对应的时间与各处理中的土壤呼吸速率最大的时间相吻合(图 1和图 2a)。同时外加有机碳源和尿素配施处理MBN含量的峰值出现时间与其土壤无机氮最低值的相对应(图 2a和图 3a),表明添加不同碳源均提高了微生物活性,促进了土壤无机氮被微生物同化固持。但不同有机碳源对无机氮的微生物同化能力差异较大,其中易利用碳源葡萄糖促进土壤微生物对无机氮的固持速度最快,1 d内几乎将无机氮基本全部固持,培养7 d后又发生无机氮的净矿化释放;苯甲酸钠虽然促进土壤呼吸作用还略高于葡萄糖,但是其促进微生物同化固持无机氮的能力却只有葡萄糖的55.2%(图 2a)。较难利用的纤维素在培养第7 d时土壤微生物才将绝大部分无机氮固持,但固持的氮在培养45 d基本没有矿化释放,表现为较缓慢但持久的氮固持;难利用的木质素则表现为更缓慢且较弱的氮固持作用[6-8](图 2a)。但是,MBN增加量的大小顺序并不与最大呼吸强度或累积呼吸量大小相一致(图 1和3a),这主要是因为不同有机碳源的碳利用效率存在差异[10,23]。根据生物化学计量学原理,微生物同化碳和氮的比例是一定的,碳、氮的同化过程是相耦合的,因此氮的同化量大小很大程度上可以反映出碳的同化量大小[10-11]。根据氮的同化量推测纤维素促进微生物同化氮、碳的能力与葡萄糖相当,但其呼吸强度只有葡萄糖的56.6%(图 1b和图 2a),表明纤维素的碳同化效率显著高于葡萄糖,这是因为纤维素结构复杂,主要是真菌的碳源,虽然真菌摄取碳源的速度慢,但其同化有机碳的效率明显高于以葡萄糖等易利用碳源为主的细菌[8-9,24]。同理,虽然苯甲酸钠的累积呼吸量比葡萄糖还高,但碳氧化态高的苯甲酸钠主要是被矿化为CO2提供能量以满足微生物的生理活动(主要用于分解代谢),而促进微生物繁殖的合成代谢能力相对不足,因此促进土壤微生物对氮的同化作用较弱[9,22];难利用的碳源木质素的微生物碳利用效率低,从而导致土壤微生物对氮的同化作用也较弱[6,8,23](图 1b和图 2a)。
微生物氮被认为是土壤快速周转的氮素形态,本研究发现有机碳源与尿素配施均促进肥料氮的微生物同化,且同化的氮会很快转化为土壤固相有机氮或矿化为无机氮[13,15](图 2和图 3)。不同有机碳源不但促进物生物同化氮的能力有明显差异,而且产生的微生物氮的后续转化过程也有明显差异。本研究发现葡萄糖和苯甲酸钠这类微生物易利用碳源主要被细菌利用,短期内同化的氮一部分转化为土壤固相有机氮,一部分矿化为无机氮,对肥料氮在短期内起到暂存缓释作用;而纤维素主要被真菌利用,其同化氮的速度较慢,但同化效率高,且同化的氮主要转变为土壤固相有机氮,有利于肥料氮在土壤中的固持[25](图 2和图 3b)。这和Chen等[26]的研究结果一致,说明有机物料中纤维素含量的增加会促进土壤微生物对无机氮的同化。难利用的木质素促进土壤微生物氮同化作用,以及土壤固相有机氮的提高作用均较弱(图 3)。
由于有机碳源均不同程度地促进了尿素水解产生的NH4+-N的同化,尤其是葡萄糖、纤维素分别在培养1 d、7 d促进了93%以上NH4+-N的同化,减少了硝化作用的底物,因此添加有机碳源均不同程度地抑制了土壤的硝化作用(图 2b和图 2c)。此外,虽然木质素、苯甲酸钠与尿素配施处理土壤NH4+-N的含量分别在14 d、30 d后高于尿素处理,但其NO3–-N含量在培养45 d后仍显著低于尿素处理,表明木质素和苯甲酸钠可能具有直接抑制硝化作用的能力(图 2c)。木质素具有大量的多酚或多酚类的功能基团,这些基团可以抑制土壤硝化作用,而且木质素降解过程中产生的腐殖酸可能与NH4+形成比较稳定的络合物,从而降低硝化作用的底物[27-28]。苯甲酸钠发生脱羧反应后也会产生苯酚等类似结构的物质,因此也具有抑制硝化作用的能力[29]。以上结果表明葡萄糖和纤维素主要通过促进微生物氮同化作用,减少硝化作用的底物从而间接降低硝化作用;苯甲酸钠和木质素则具有通过促进微生物氮同化的间接作用和直接作用抑制硝化。
3.2 不同类型有机碳源对土壤酸度的影响培养过程中土壤pH的变化主要和碳、氮转化过程相关。对照和尿素处理土壤呼吸作用很弱,土壤发生净氮矿化和净硝化作用,但由于有机氮的矿化会消耗H+,而1 mol NH4+-N的硝化会产生2 mol H+,强烈的硝化作用释放大量H+,最终导致土壤pH大幅降低[19](图 4)。葡萄糖分解时糖酵解、三羧酸循环等过程会产生中间产物有机酸,如丙酮酸、乳酸、柠檬酸等,有机酸解离出质子从而导致土壤pH下降[30],同时添加葡萄糖促进土壤微生物对铵态氮的快速同化也会释放H+,降低土壤pH,随后由于有机羧酸根矿化释放CO2以及有机氮的矿化作用均会消耗H+[13],因此葡萄糖与尿素配施处理土壤pH有前期明显下降而后期逐渐上升的趋势(图 1a、图 2a、图 3b和图 4)。纤维素与尿素配施的处理由于1周内大量铵态氮被土壤微生物同化,释放大量H+,同时纤维素与葡萄糖类似,被分解也会产生有机酸,随后有机羧酸根的矿化消耗大量H+,因此土壤pH也呈先降低后增加的趋势(图 1a、图 2a和图 4)。木质素促进土壤微生物对氮的同化作用较弱,测定结果发现木质素中大部分C残留在土壤中而未通过土壤呼吸释放,但提高了土壤pH缓冲容量(较尿素处理土壤pH缓冲容量提高8.6%),而培养后期土壤硝化作用增强导致土壤pH略有降低趋势,因此木质素处理土壤pH变化幅度较小(图 1b、图 2b和图 4)。添加苯甲酸钠一方面促进了土壤微生物对无机氮的同化作用,通过直接或间接作用降低了土壤硝化作用(图 2和图 3a),另一方面苯甲酸钠中大量的羧酸根有利于土壤中发生强烈的脱羧作用,因此土壤pH达到峰值的时间恰好与土壤呼吸强度最大的时间相一致(图 1a和图 4)。利用C、N循环过程与质子产消的耦合关系,分析发现苯甲酸钠与尿素配施处理土壤氮循环消耗H+量仅占总H+消耗量的3.8%,而添加苯甲酸钠的羧基含量与总H+消耗量几乎相等,说明苯甲酸钠作为有机酸盐主要是通过脱羧作用消耗大量的H+从而大幅提高土壤pH[30-31]。
多元线性回归分析的结果表明土壤呼吸CO2-C累积释放量与土壤各种形态氮的含量可共同解释土壤pH 60.7%的变异,说明土壤碳、氮转化过程是控制土壤pH变化的主要原因。而且,因氮循环过程的H+产消量分别与基于土壤ΔpH计算的H+产消量、净硝化计算的H+产消量之间的线性回归分析结果进一步表明氮素转化过程与土壤H+产消紧密相关,且利用有机碳源调控土壤氮转化可以有效阻控氮肥诱导的土壤酸化。
4 结论在红壤中单施尿素会发生强烈的硝化作用而导致土壤酸化,外加有机碳源与氮肥配施通过调控微生物同化介导的土壤碳、氮转化过程,可以暂存缓释氮肥、提高氮肥利用率、抑制硝化和阻控土壤酸化。其中易利用的葡萄糖,可通过促进前期肥料氮被微生物快速同化和后期有机氮的矿化作用,对肥料氮起暂存和缓释作用,其中较难利用的纤维素更有利于肥料氮被较长时间固持在土壤中,难利用的木质素促进肥料氮的微生物同化作用弱,但显著抑制了硝化作用。苯甲酸钠作为易利用有机酸盐促进肥料氮的微生物同化作用显著低于葡萄糖和纤维素,但其代谢产物能够通过直接抑制硝化,而且苯甲酸钠的脱羧作用可以快速消耗大量H+、大幅提升土壤pH。因此,有机碳源本身的性质,如化学结构的复杂程度、微生物碳利用效率,以及有机物本身的毒性效应等均对肥料氮转化与酸化调控的过程具有重要影响。在田间实际应用过程中,如何根据不同碳源的特性,调控有机物料的组成,实现土壤氮素供应与作物需求相匹配、提高肥料氮的高效利用、实现氮肥诱导土壤酸化的有效控制还需系统深入的研究。
| [1] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010. DOI:10.1126/science.1182570
(  0) 0) |
| [2] |
Xu R K, Li J Y, Zhou S W, et al. Scientific issues and controlling strategies of soil acidification of croplands in China (In Chinese)[J]. Bulletin of Chinese Academy of Sciences, 2018, 33(2): 160-167. [徐仁扣, 李九玉, 周世伟, 等. 我国农田土壤酸化调控的科学问题与技术措施[J]. 中国科学院院刊, 2018, 33(2): 160-167.]
(  0) 0) |
| [3] |
Zhu Q C, de Vries W, Liu X J, et al. Enhanced acidification in Chinese croplands as derived from element budgets in the period 1980-2010[J]. Science of the Total Environment, 2018, 618: 1497-1505. DOI:10.1016/j.scitotenv.2017.09.289
(  0) 0) |
| [4] |
Qiao C L, Liu L L, Hu S J, et al. How inhibiting nitrification affects nitrogen cycle and reduces environmental impacts of anthropogenic nitrogen input[J]. Global Change Biology, 2015, 21(3): 1249-1257. DOI:10.1111/gcb.12802
(  0) 0) |
| [5] |
Tahovská K, Kaňa J, Bárta J, et al. Microbial N immobilization is of great importance in acidified mountain spruce forest soils[J]. Soil Biology & Biochemistry, 2013, 59: 58-71.
(  0) 0) |
| [6] |
Cao Y S, He Z L, Zhu T B, et al. Organic-C quality as a key driver of microbial nitrogen immobilization in soil: A meta-analysis[J]. Geoderma, 2021, 383: 114784. DOI:10.1016/j.geoderma.2020.114784
(  0) 0) |
| [7] |
Cheng Y, Wang J, Wang J Y, et al. The quality and quantity of exogenous organic carbon input control microbial NO3–-immobilization: A meta-analysis[J]. Soil Biology & Biochemistry, 2017, 115: 357-363.
(  0) 0) |
| [8] |
Luu A T, Hoang N T, Dinh V M, et al. Effects of carbon input quality and timing on soil microbe mediated processes[J]. Geoderma, 2022, 409: 115605. DOI:10.1016/j.geoderma.2021.115605
(  0) 0) |
| [9] |
Mehnaz K R, Corneo P E, Keitel C, et al. Carbon and phosphorus addition effects on microbial carbon use efficiency, soil organic matter priming, gross nitrogen mineralization and nitrous oxide emission from soil[J]. Soil Biology & Biochemistry, 2019, 134: 175-186.
(  0) 0) |
| [10] |
Manzoni S, Taylor P, Richter A, et al. Environmental and stoichiometric controls on microbial carbon-use efficiency in soils[J]. New Phytologist, 2012, 196(1): 79-91. DOI:10.1111/j.1469-8137.2012.04225.x
(  0) 0) |
| [11] |
Creamer C A, Jones D L, Baldock J A, et al. Stoichiometric controls upon low molecular weight carbon decomposition[J]. Soil Biology & Biochemistry, 2014, 79: 50-56.
(  0) 0) |
| [12] |
Li J Y, Deng K Y, Zhang W, et al. Effects of amendment of glucose on fertilizer nitrogen transformation and acidification in Ultisol cropland (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(1): 162-168. [李九玉, 邓开英, 章威, 等. 添加葡萄糖对红壤农田肥料氮转化及其酸化的影响[J]. 土壤学报, 2021, 58(1): 162-168.]
(  0) 0) |
| [13] |
Guan P, Wang R H, Nkoh J N, et al. Enriching organic carbon bioavailability can mitigate soil acidification induced by nitrogen fertilization in croplands through microbial nitrogen immobilization[J]. Soil Science Society of America Journal, 2022, 86(3): 579-592. DOI:10.1002/saj2.20400
(  0) 0) |
| [14] |
Chen Z X, Zhang H M, Tu X S, et al. Characteristics of organic material inputs affect soil microbial NO3− immobilization rates calculated using different methods[J]. European Journal of Soil Science, 2021, 72(1): 480-486. DOI:10.1111/ejss.12963
(  0) 0) |
| [15] |
Quan Z, Huang B, Lu C Y, et al. The fate of fertilizer nitrogen in a high nitrate accumulated agricultural soil[J]. Scientific Reports, 2016, 6: 21539. DOI:10.1038/srep21539
(  0) 0) |
| [16] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000.]
(  0) 0) |
| [17] |
Xu R K, Zhao A Z, Yuan J H, et al. pH buffering capacity of acid soils from tropical and subtropical regions of China as influenced by incorporation of crop straw biochars[J]. Journal of Soils and Sediments, 2012, 12(4): 494-502. DOI:10.1007/s11368-012-0483-3
(  0) 0) |
| [18] |
Xiao K C, Xu J M, Tang C X, et al. Differences in carbon and nitrogen mineralization in soils of differing initial pH induced by electrokinesis and receiving crop residue amendments[J]. Soil Biology & Biochemistry, 2013, 67: 70-84.
(  0) 0) |
| [19] |
Bolan N S, Hedley M J, White R E. Processes of soil acidification during nitrogen cycling with emphasis on legume based pastures[J]. Plant and Soil, 1991, 134(1): 53-63.
(  0) 0) |
| [20] |
Wang J, Chen Z X, Xu C, et al. Organic amendment enhanced microbial nitrate immobilization with negligible denitrification nitrogen loss in an upland soil[J]. Environmental Pollution, 2021, 288: 117721.
(  0) 0) |
| [21] |
Wang S W, Gong J, Gao A, et al. Pharmaco-toxicological study of preservative: Sodium benzoate (In Chinese)[J]. Journal of Anhui Agricultural Sciences, 2010, 38(30): 16724, 16846. [王思文, 巩江, 高昂, 等. 防腐剂苯甲酸钠的药理及毒理学研究[J]. 安徽农业科学, 2010, 38(30): 16724, 16846.]
(  0) 0) |
| [22] |
Gunina A, Kuzyakov Y. From energy to(soil organic)matter[J]. Global Change Biology, 2022, 28(7): 2169-2182.
(  0) 0) |
| [23] |
Di Lonardo D P, de Boer W, Klein Gunnewiek P J A, et al. Priming of soil organic matter: Chemical structure of added compounds is more important than the energy content[J]. Soil Biology & Biochemistry, 2017, 108: 41-54.
(  0) 0) |
| [24] |
Meidute S, Demoling F, Bååth E. Antagonistic and synergistic effects of fungal and bacterial growth in soil after adding different carbon and nitrogen sources[J]. Soil Biology & Biochemistry, 2008, 40(9): 2334-2343.
(  0) 0) |
| [25] |
Ma Q, Zheng J S, Watanabe T, et al. Microbial immobilization of ammonium and nitrate fertilizers induced by starch and cellulose in an agricultural soil[J]. Soil Science and Plant Nutrition, 2021, 67(1): 89-96.
(  0) 0) |
| [26] |
Chen Z X, Elrys A S, Zhang H M, et al. How does organic amendment affect soil microbial nitrate immobilization rate?[J]. Soil Biology & Biochemistry, 2022, 173: 108784.
(  0) 0) |
| [27] |
Huang Y Z, Feng Z W, Zhang F Z, et al. Effects of lignin on nitrification in soil[J]. Journal of Environmental Sciences, 2003, 15(3): 363-366.
(  0) 0) |
| [28] |
Peng J J, Wang D H, Liao Z W. Effect of lignin from paper-making black liquor on the transformation and the bio-utilization of urea-N (In Chinese)[J]. Journal of South China Agricultural University: Natural Science Edition, 2004, 25(1): 21-24. [彭俊杰, 王德汉, 廖宗文. 造纸黑液木质素对尿素氮在土壤中转化与生物利用的影响[J]. 华南农业大学学报: 自然科学版, 2004, 25(1): 21-24.]
(  0) 0) |
| [29] |
Yu J Q. Determination of phenol in sodium benzoate by HPLC (In Chinese)[J]. Chemical Analysis and Meterage, 2006, 15(6): 60-61. [于军强. 液相色谱法测定食品添加剂苯甲酸钠中的苯酚含量[J]. 化学分析计量, 2006, 15(6): 60-61.]
(  0) 0) |
| [30] |
Rukshana F, Butterly C R, Baldock J A, et al. Model organic compounds differ in their effects on pH changes of two soils differing in initial pH[J]. Biology and Fertility of Soils, 2011, 47(1): 51-62.
(  0) 0) |
| [31] |
Cai Z J, Xu M G, Zhang L, et al. Decarboxylation of organic anions to alleviate acidification of red soils from urea application[J]. Journal of Soils and Sediments, 2020, 20(8): 3124-3135.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


