2. 西南民族大学, 四川若尔盖高寒湿地生态系统国家野外科学观测研究站, 成都 610225
2. Sichuan Zoige AlpineWetland Ecosystem National Observation and Research Station, Southwest Minzu University, Chengdu 610225, China
磷是植物生长所必需的养分元素之一。然而,磷素极易被土壤矿物吸附和固定,这使得全球陆地生态系统普遍存在磷限制[1]。工业革命以来,人类活动导致了大气活性氮迅速增加,据估计,1860年至1995年间全球活性氮的年排放量已从15 Tg增加至156 Tg,2050年该排放量预计可达200 Tg[2]。大气中的活性氮可通过大气沉降方式进入陆地和海洋生态系统,这些生态系统的氮沉降量因而迅速上升[3]。氮沉降会增加植物和微生物对磷的需求,可能造成森林生态系统磷限制[4]。土壤磷以多种形态存在,根据其生物有效性高低,可依次分为树脂磷、易利用磷、中等活性磷和难利用磷[5]。目前有关氮沉降影响土壤磷的研究多关注于对植物和微生物有效性较高的速效磷[6],而涉及难利用磷、中等活性磷等对氮沉降如何响应仍缺乏深入探索,这就限制了人们对氮沉降下土壤磷循环过程的全面了解。此外,目前关于氮沉降影响磷组分的研究结论存在较大的不一致性,比如Fan等[7]通过林下无机氮喷施试验发现,氮沉降促进了森林土壤有机磷的矿化;Block等[8]采用自然氮沉降梯度的研究却表明,氮沉降可促使磷从顽固态重新分配至有机态,扩大了有机磷库;而陈雨芩等[9]的林下无机氮喷施试验发现,十年氮添加对苦竹林土壤各磷组分均无显著影响。导致上述结论不一致可能的原因是以往研究模拟氮沉降的方式和所用氮的形态偏离了实际情况。
在森林生态系统中,以往氮沉降试验通常采用林下施氮方式来模拟氮沉降。但林冠对沉降氮有截留吸收作用[10],因此林下施氮并不能真实反映氮沉降对森林生态系统土壤养分循环的影响效应。有研究[4,11]发现,氮沉降会通过刺激根系和土壤微生物分泌磷酸酶,使植物加强磷获取、扩大植物磷库来维持其氮、磷养分平衡,进而降低土壤全磷(TP)。近期有研究发现,相较于林下模拟氮沉降,林冠模拟氮沉降下植物叶片具有更高的氮水平[12],而为了满足更高氮水平下植物更强的磷需求,林冠模拟氮沉降下的植物磷库可能要高于林下模拟结果。然而,这是否会进一步导致土壤TP的减少尚未可知。由此笔者提出第一个科学假设:传统林下模拟氮沉降方式可能低估了大气氮沉降对土壤磷库的削减效应。
无机态氮和有机态氮是大气沉降氮的两个重要组成部分,前者在大气氮湿沉降中占比约70%,主要成分是硝酸铵;后者在大气氮湿沉降中占比约30%,主要成分是游离氨基酸、尿素和多肽[13]。然而,目前大多数氮沉降研究仅考虑的是无机氮沉降的影响效应,而关于有机氮沉降的影响效应仍知之甚少。前人研究表明,有机氮沉降成分中尿素的氨挥发量高于硝酸铵的氨挥发量[14],这可能使得有机氮沉降下的土壤磷限制低于无机氮沉降。还有研究指出,在较高的沉降量下有机氮对土壤酸化的影响弱于无机氮沉降的酸化幅度[15],这可能缓解土壤酸化对微生物活性的抑制作用[9],从而促进土壤磷循环。因此笔者提出第二个科学假设:无机氮沉降相比有机氮沉降,更容易造成土壤磷限制。
种植人工林是我国增加森林资源最为有效的途径[16],其中毛竹是我国十分重要的的优良经济竹种[17]。毛竹主要分布于亚热带地区,这也是国内目前和未来氮沉降量最大的区域[3],亦是有机氮、无机氮沉降共存的典型区域[18]。同步对比研究林冠、林下不同形态氮沉降对毛竹林土壤磷组分的影响,有助于真实地理解亚热带森林土壤磷循环对氮沉降的响应机制,为提高毛竹林生态和经济价值提供参考。
1 材料与方法 1.1 研究区概况试验样地位于浙江省安吉县天荒坪镇“浙江农林大学毛竹林林冠氮沉降研究试验基地”(30º29'N,119º38'E),气候类型为亚热带季风气候,1981—2010年年均降水量1 423.4 mm,年均气温16.1 ℃,无霜期平均为230 d,年日照时数约2 000 h,土壤类型以花岗岩发育的红壤为主。林下植被主要有山橿(Lindera reflexa)、络石(Trachelospermum jasminoides)、黑足鳞毛蕨(Dryopteris fuscipes)、百步(Stemona japonica)、寒莓(Rubus buergeri)、山莓(Rubus corchorifolius)、菝葜(Smilax china)、金星蕨(Parathelypteris glanduligera)、淡竹叶(Lophatherum gracile)、紫金牛(Ardisia japonica)等[19]。
1.2 试验设计试验设置了林冠模拟氮沉降(CNA)和林下模拟氮沉降(UNA)的对比试验,氮喷施分别采用无机氮(IN)、有机氮(ON)和水(CK),施氮量为50 kg·hm–2·a–1(基于氮原子质量,下同),IN采用硝酸铵,ON采用25 kg·hm–2·a–1(尿素)+25 kg·hm–2·a–1(甘氨酸)混合,CK为添加等量的水。具体如下,将样地分为4个区组,每个区组内均设置林冠IN添加(CNA-IN)、林冠ON添加(CNA-ON)、林冠CK(CNA-CK)、林下IN添加(UNA-IN)、林下ON添加(UNA-ON)和林下CK(UNA-CK)六个处理,四个区组总计24个处理小区,每个冠层施氮小区面积1 256 m2(直径40 m),每个林下施氮小区面积1 200 m2。样地之间设置宽为20 m的缓冲带,以避免相邻样地的干扰。在样地上方设立氮溶液储存和喷洒控制系统,将氮溶液通过埋藏的聚氯乙烯(PVC)管道从控制室向林冠喷淋塔顶部和林下喷淋设施输送。林冠模拟氮沉降具体操作为:在每个林冠模拟氮沉降样地的中心设置高为25 m的喷淋塔,调试喷淋系统压力至辐射距离20 m,氮溶液通过塔顶360°旋转的喷头均匀喷洒在冠层上。林下氮沉降模拟具体操作为:在每个林下模拟氮沉降样地设置高出地面1 m的喷淋设施5个,控制氮溶液从五个林下喷淋设施向样地内喷淋,确保喷氮含量及喷施面积与林冠喷施基本一致。试验设计示意图如图 1所示。
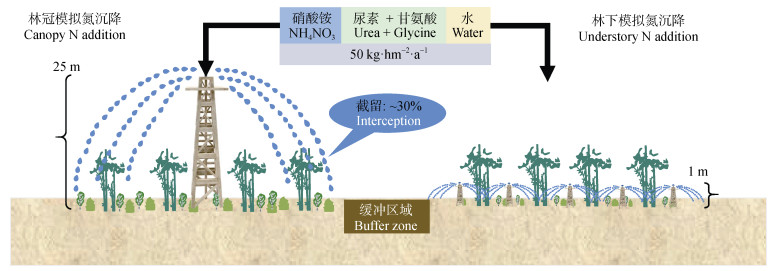
|
图 1 毛竹林林冠—林下模拟氮沉降野外控制试验示意图[20] Fig. 1 Schematic diagram of stimulating canopy and understory N deposition experiment in a Moso bamboo forest[20] |
采用五点法于2021年7月中旬在每个小区内采集0~10 cm层土壤样品,混合均匀后,用冰袋冷藏并迅速带回实验室。仔细剔除石粒、土壤动植物残留物后,土样过2 mm筛,并分成三部分,一部分土样自然风干后保存,用于理化性质测定,一部分保存于4 ℃冰箱并及时测定酶活性,一部分冷冻干燥后保存于-80 ℃冰箱,用于磷循环功能基因丰度测定。采集毛竹叶片时,在每个样地选取三至五株长势良好且胸径相近的毛竹,用高枝剪剪下毛竹靠近中上部的两个枝条,将同一样地采集的毛竹叶混合送回实验室,先在105 ℃下杀青30 min,再在65 ℃恒温下烘干至恒重,用植物粉碎机粉碎,过0.25 mm筛后保存备用以测定毛竹叶TP含量。
土壤pH用煮沸的去离子水浸提(2.5︰1水土比),加入磁力转子搅拌30 s后,静置30 min,上清液用pH计(Seven Compact,METTLER TOLEDO,美国)测定。土壤全氮(TN)和土壤有机碳(SOC)用碳氮元素分析仪(Vario MACRO cube,Elementar,德国)测定,测定前土样用0.5 mol·L–1 HCl去除无机碳并干燥。测定溶解性有机碳(DOC)时,称取5 g鲜土加入25 mL去离子水(水土比5︰1),170 r·min–1振荡30 min后,3 500 r·min–1离心20 min,上清液过0.45 μm滤膜后,用TOC仪器(Multi C/N 3100,Analytik Jena,德国)测定DOC含量。测定无定型铁和无定型铝时,称取0.5 g风干土用25 mL 0.2 mol·L–1酸性草酸铵溶液(pH=3)浸提(25 ℃,250 r·min–1避光振荡2.5 h),4 000 r·min–1离心8 min后,上清液用电感耦合等离子体光学发射光谱仪(Optima 5300 DV ICP-OES Spectrometer,PerkinElmer,美国)测定提取物中无定型铁和无定型铝的浓度。
土壤磷分级测定:参照改进Hedley浸提法后的Tiessen连续提取方法[21](图 2),取0.5 g过0.15 mm筛的土壤,依次采用树脂膜、0.5 mol·L–1 NaHCO3、0.1 mol·L–1 NaOH、1.0 mol·L–1 HCl、浓盐酸、浓硫酸-高氯酸浸提,分别得到树脂磷(resin-P)、碳酸氢钠浸提态无机磷(NaHCO3-Pi)+碳酸氢钠浸提态有机磷(NaHCO3-Po)、氢氧化钠浸提态无机磷(NaOH-Pi)+氢氧化钠浸提态有机磷(NaOH-Po)、稀盐酸浸提态磷(HCl-P)、浓盐酸浸提态无机磷(conc.HCl-Pi)+浓盐酸浸提态有机磷(conc.HCl-Po)和残渣磷(residual-P)。上述各有机磷含量为同一浸提液提取的全磷含量与无机磷含量之差。根据以往研究[5],可将磷组分依次分为四类:(1)树脂磷(resin-P),(2)易利用磷(NaHCO3-Pi、NaHCO3-Po),(3)中等活性磷(NaOH-Pi、NaOH-Po),(4)难利用磷(HCl-P、conc.HCl-Pi、conc.HCl-Po、residual-P)。TP为上述所有磷组分之和。土壤总有机磷(TPo)为NaHCO3-Po、NaOH-Po和conc.HCl-Po之和。
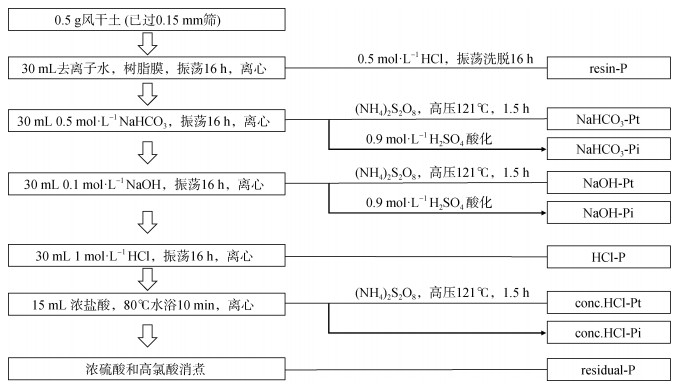
|
注:resin-P,树脂浸提态磷。NaHCO3-Pt,碳酸氢钠浸提态全磷。NaHCO3-Pi,碳酸氢钠浸提态无机磷。NaOH-Pt,氢氧化钠浸提态全磷。NaOH-Pi,氢氧化钠浸提态无机磷。HCl-P,稀盐酸浸提态磷。conc.HCl-Pt,浓盐酸浸提态全磷。conc.HCl-Pi,浓盐酸浸提态无机磷。residual-P,残渣磷。 Note: resin-P, P extracted by resin. NaHCO3-Pt, total P extracted by NaHCO3 solution. NaHCO3-Pi, inorganic P extracted by NaHCO3 solution. NaOH-Pt, total P extracted by NaOH solution. NaOH-Pi, inorganic P extracted by NaOH solution. HCl-P, P extracted by HCl solution. conc.HCl-Pt, total P extracted by conc.HCl solution. conc.HCl-Pi, inorganic P extracted by conc.HCl solution. residual-P, residual P. 图 2 土壤磷连续提取的操作步骤(改绘自Tiessen和Moir[21]) Fig. 2 Steps of sequential soil P fractionation(modified from Tiessen and Moir[21]) |
微生物生物量碳(MBC)和微生物生物量氮(MBN)采用氯仿熏蒸—硫酸钾浸提法[22],用TOC分析仪(Multi C/N 3100,Analytik Jena,德国)测定提取液中碳、氮含量(MBC浸提系数为0.45,MBN浸提系数为0.54);微生物生物量磷(MBP)采用氯仿熏蒸—Bray-1(0.03 mol·L–1 NH4F- 0.025 mol·L–1 HCl)浸提法[23],用钼锑抗比色法测定提取液中磷含量(MBP浸提系数为0.4)。酸性磷酸酶(ACP)活性采用微孔板荧光法测定[24]。毛竹叶磷含量采用干灰化法,电感耦合等离子体发射光谱仪(ICAP 6300,Thermo Fisher,美国)测定[25]。
土壤磷循环功能基因丰度采用定量微生物元素循环(QMEC)基因芯片定量测定[26](美格基因,广州)。具体步骤为:称取500 mg冻干后的土样,按照PowerSoil®Pro DNA提取试剂盒(MOBIO,Qiagen,德国)说明进行总DNA提取,用超微量紫外分光光度计(NanoDrop- One,Thermo Fisher Scientific,美国)评估总DNA的质量和数量。将经过检测的合格DNA样品和qPCR所需的试剂分别加入一个384孔板的样品孔中,作为样品板。同时,将引物和qPCR所需的试剂加入另一个384孔板的引物孔中,作为引物板。将样品板和引物板中的试剂通过高通量自动微量加样设备分别加入高通量qPCR芯片的纳米孔中。并在SmartChip Real-Time PCR系统中进行qPCR反应和荧光信号检测,获得扩增和溶解曲线。在Canco软件上得到各基因在各样本中的检出情况和扩增循环数(Ct值),将16S rRNA作为内参,对数据进行标准化,得到各基因在其样本中相对定量信息。根据Roche仪器的检测结果,获取16S rRNA基因的绝对定量信息,然后通过转换,获得其他基因的绝对定量信息。每个样品均设置3个技术重复与阴性对照,DNA样品满足如下质控条件判定为合格:阴性对照无扩增、扩增效率在1.8和2.2之间、Ct < 31,判定该基因检测信号为阳性方可用于后续的数据分析。
1.4 数据处理采用SPSS 27.0和R 3.6.2软件进行数据处理与统计分析。数据均通过正态分布、方差齐性检验。采用nlme包进行线性混合模型分析,将氮沉降模拟方式和氮形态设置为固定效应,将区组设置为随机效应,比较氮沉降模拟方式和沉降氮形态对土壤磷组分及环境因子的总体影响。采用单因素方差分析及邓肯(Duncan)多重比较法对比林冠林下模拟氮沉降、有机无机沉降氮之间土壤磷组分含量、MBP含量、ACP活性、磷循环功能基因丰度以及土壤理化性质的显著性差异。采用斯皮尔曼法(Spearman)分析土壤磷组分与环境因子之间的相关性。采用Origin 2021软件作图。
2 结果 2.1 土壤磷组分氮沉降模拟方式和沉降氮形态对部分土壤磷组分有显著影响。其中,UNA处理的土壤TP、难利用磷和易利用磷含量分别显著高于CNA处理15.1%~26.5%、18.3%~21.5%和9.7%~38.3%(P < 0.05)(图 3a,图 4),但是树脂磷、中等活性磷和TPo含量在UNA和CNA处理间无显著差异。IN处理的土壤树脂磷含量显著低于ON处理(P < 0.05)(图 4),但是IN与ON处理的土壤TP、易利用磷、中等活性磷、难利用磷和TPo含量在总体上无显著差异。氮沉降模拟方式和沉降氮形态的交互作用对所有磷组分均无显著影响(图 3,图 4)。
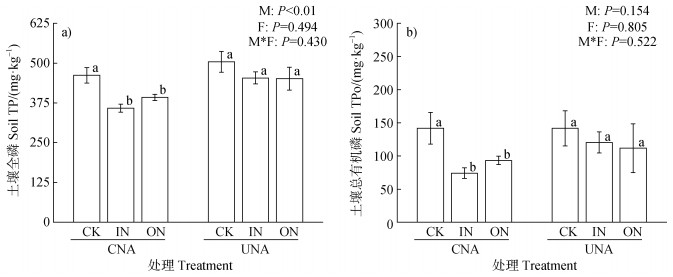
|
注:数据为平均值±标准误差(n=4)。CK,对照;IN,无机氮;ON,有机氮;CNA,林冠模拟氮沉降;UNA,林下模拟氮沉降。M,氮沉降模拟方式的影响;F,沉降氮形态的影响;M*F,氮沉降模拟方式和沉降氮形态的交互效应。TP,全磷。TPo,总有机磷。不同小写字母表示在相同氮沉降模拟方式下不同氮形态间的显著差异(P < 0.05)。下同。 Note: Data are means ± standard error(n=4). CK, control; IN, inorganic nitrogen; ON, organic nitrogen; CNA, canopy nitrogen addition; UNA, understory nitrogen addition. M, the effect of N deposition simulation approaches; F, the effect of N addition components. M*F, the interaction effect of N deposition simulation approaches and N addition components. TP, total P. TPo, total organic P. Different lowercase letters indicate significant differences(P < 0.05)between N addition components within the same N deposition simulation approach. The same as below. 图 3 不同氮沉降模拟方式和沉降氮形态下毛竹林土壤全磷(TP)(a)和总有机磷(TPo)含量(b) Fig. 3 Soil total phosphorus content(a)and total organic phosphorus content(b)in a Moso bamboo forest under the influences of different N deposition simulation approaches and N components |
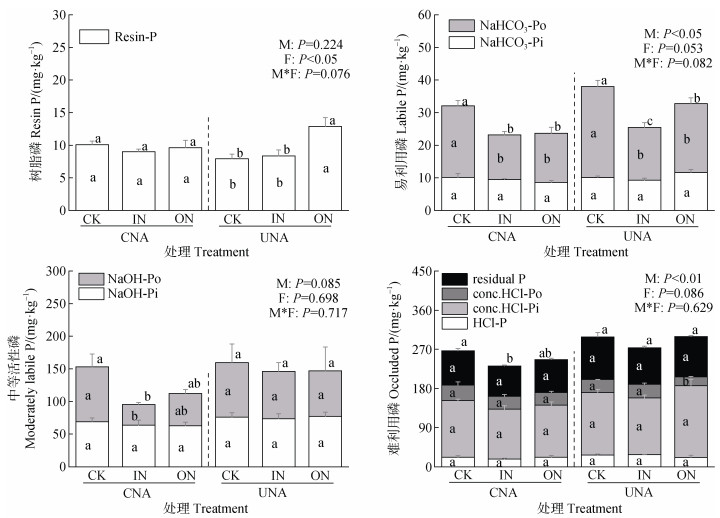
|
注:NaHCO3-Po,碳酸氢钠浸提态有机磷。NaOH-Po,氢氧化钠浸提态有机磷。conc.HCl-Po,浓盐酸浸提态有机磷。下同。 Note: NaHCO3-Po, organic P extracted by NaHCO3 solution. NaOH-Po, organic P extracted by NaOH solution. conc.HCl-Po, organic P extracted by conc.HCl solution. The same as below. 图 4 不同氮沉降模拟方式和沉降氮形态下毛竹林土壤磷组分含量 Fig. 4 Soil phosphorus fractions in a Moso bamboo forest under the influences of different N deposition simulation approaches and N components |
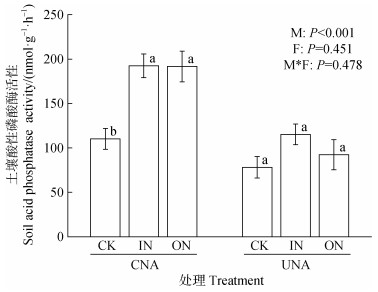
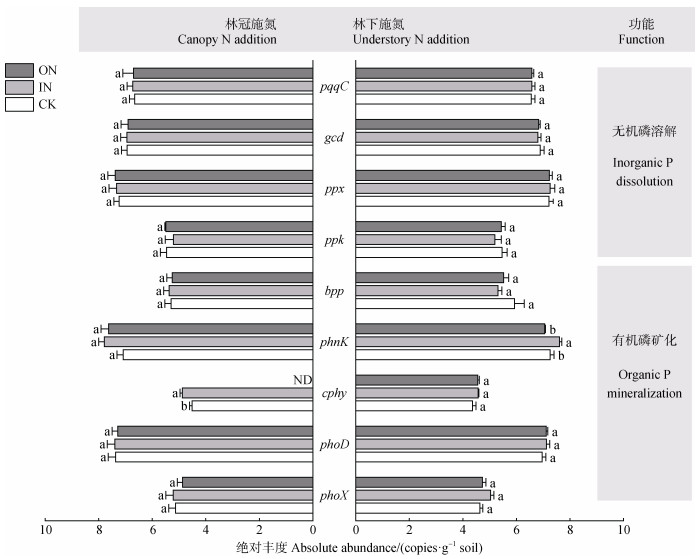
氮沉降模拟方式对土壤ACP活性有显著影响,UNA处理的土壤ACP活性显著低于CNA处理(P < 0.05)(图 5);沉降氮形态对土壤ACP活性无显著影响。氮沉降模拟方式、沉降氮形态以及两者的交互作用对土壤磷循环功能基因丰度均无显著影响(图 6)。
|
图 5 不同氮沉降模拟方式和沉降氮形态下毛竹林土壤酸性磷酸酶(ACP)活性 Fig. 5 Soil acid phosphatase(ACP)activity in a Moso bamboo forest under the influences of different N deposition simulation approaches and N components |
|
注:所有数据在绘图前都经过了log10对数转换。ND表示数据未检出。 Note: All data were log10-transcomponented before plotting. ND means data not detected. 图 6 不同氮沉降模拟方式和沉降氮形态下毛竹林土壤磷循环功能基因的绝对丰度 Fig. 6 Absolute abundances of P-cycling genes in a Moso bamboo forest under the influences of different N deposition simulation approaches and N components |
氮沉降模拟方式和沉降氮形态对土壤pH、TN、无定型铁、无定型铝、DOC和SOC含量均无显著影响;氮沉降模拟方式和沉降氮形态的交互作用对pH、TN、无定型铁、无定型铝、DOC和SOC含量亦无显著影响(表 1)。
|
|
表 1 不同氮沉降模拟方式和沉降氮形态下毛竹林土壤理化性质 Table 1 The soil physicochemical properties in a Moso bamboo forest under the influences of different N deposition simulation approaches and N components |
氮沉降模拟方式对毛竹叶磷含量有显著影响,UNA处理的毛竹叶磷含量显著高于CNA处理(P < 0.05),而对土壤TPo、MBC、MBN、MBP含量和MBC/MBN无显著影响。沉降氮形态对MBN含量和MBC/MBN有显著影响,IN处理的土壤MBN含量显著高于ON处理(P < 0.05),IN处理的MBC/MBN显著高于ON处理,而对土壤MBC、MBP、毛竹叶磷含量无显著影响。氮沉降模拟方式和沉降氮形态的交互作用对土壤TPo、MBC、MBN、MBP含量、毛竹叶磷含量和MBC/MBN的影响均不显著(图 3b,表 2)。
|
|
表 2 不同氮沉降模拟方式和沉降氮形态下毛竹林土壤微生物生物量碳氮磷、叶磷含量及微生物生物量碳氮比 Table 2 Soil microbial biomass C N P, leaf P concentration and microbial biomass C/N in a Moso bamboo forest under the influences of different N deposition simulation approaches and N components |
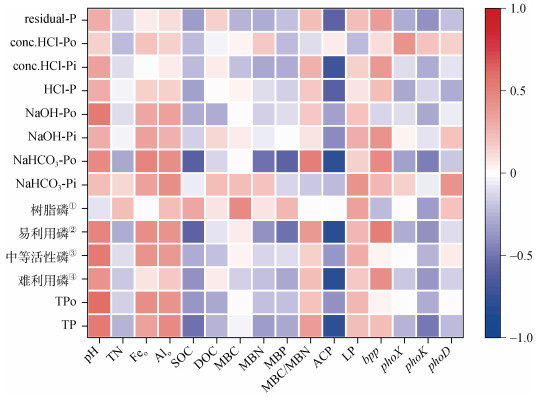
土壤TP含量与pH、无定型铝含量显著正相关,但与SOC含量、ACP活性、phnK(有机磷矿化相关)基因绝对丰度显著负相关(P < 0.05);TPo含量与pH、无定型铁含量、无定型铝含量显著正相关(P < 0.05);难利用磷含量与pH、bpp(有机磷矿化相关)基因绝对丰度显著正相关,与ACP活性显著负相关(P < 0.05);中等活性磷含量与pH、无定型铁含量显著正相关(P < 0.05);易利用磷含量与pH、无定型铁含量、无定型铝含量、有机磷矿化功能相关bpp基因绝对丰度显著正相关,与SOC含量、MBP含量、ACP活性显著负相关(P < 0.05);树脂磷含量仅与MBC含量显著正相关(P < 0.05)。NaHCO3-Pi与无定型铝含量、毛竹叶磷含量、phoD(有机磷矿化相关)基因绝对丰度显著正相关(P < 0.05);NaHCO3-Po与pH、无定型铁含量、无定型铝含量、MBC/MBN、bpp基因绝对丰度显著正相关,与SOC含量、MBN含量、MBP含量、ACP活性、phnK基因绝对丰度显著负相关(P < 0.05);NaOH-Pi与ACP活性显著负相关(P < 0.05),与bpp基因绝对丰度显著正相关(P < 0.05);NaOH-Po与pH显著正相关(P < 0.01);HCl-P与ACP显著负相关(P < 0.01);conc.HCl-Pi与ACP活性显著负相关(P < 0.001);conc.HCl-Po与phoX(有机磷矿化相关)基因绝对丰度显著正相关(P < 0.05);residual-P与ACP活性显著负相关(P < 0.01)(图 7)。
|
注:*、**和***分别表示在P < 0.05、P < 0.01和P < 0.001下显著相关。 Note: *, ** and *** means significant correlation at P < 0.05, P < 0.01 and P < 0.001 respectively. ①Resin P, ②Labile P, ③Moderately labile P, ④Occluded P. 图 7 土壤因子、叶磷和土壤磷组分之间的相关性 Fig. 7 The correlations between the soil factors, leaf phosphorus and soil phosphorus fractions |
不同氮沉降方式均在一定程度上降低了毛竹林土壤的TP含量,但UNA处理的TP含量显著高于CNA处理(图 3a)。这说明传统的UNA方法低估了大气氮沉降对森林生态系统土壤TP的削减效应,这与本研究第一个假设相符合。通过比较CNA和UNA组土壤磷组分的变化,发现UNA组难利用磷和易利用磷含量均显著高于CNA组,而其他磷组分含量在两种氮沉降模拟方式间无显著差异(图 4)。因此,难利用磷和易利用磷对氮沉降模拟方式的不同响应可能是导致不同氮沉降模拟方式下土壤TP含量差异的重要原因。
稳态磷在酸性土壤中稳定性较差[27],而氮输入会诱导氢离子产生,造成土壤酸化,这可能很大程度上推动稳态磷的溶解[28],通过相关性分析,本研究发现难利用磷的含量与pH显著正相关(图 7)。CNA组氮沉降处理土壤pH相比CK显著降低,并且伴随着难利用磷组分不同程度的降低(表 1),这与Zhang等[29]的林冠氮沉降试验结果一致,因此,可以推断CNA组难利用磷的减少可能与土壤pH的降低有关。以往研究表明,长期或反复的氮输入会促进植物生长,进而增加植物对其他养分元素(磷、钾等)的需求,并增加了森林生态系统中养分失衡或其他养分元素缺乏的风险[30]。SOC/TPo常被用来判定土壤有效磷的供应状况,当SOC/TPo小于100时,表明土壤有效磷供应充足,当SOC/TPo大于200时,表明土壤有效磷供应不足[31]。林冠氮喷施后,土壤SOC/TPo达到374.21~410.6,林下氮喷施后,土壤SOC/TPo达到264.41~357.7,由此可见,氮沉降后研究区土壤普遍存在有效磷供应不足的情况。CNA组叶片磷含量较UNA组显著更低(表 2),植物为维持氮、磷平衡,根系会分泌ACP和低分子量有机酸[32]以增强磷的获取。通常情况下,ACP活性越高,意味着植物所经历的磷限制程度越严重,UNA组ACP活性较CNA组显著低40.1%~51.8%(图 5),表明CNA组毛竹林生态系统受到了更大的磷限制胁迫,并且CNA组TPo含量相应地在更强的ACP矿化作用下显著降低(图 3b)。低分子量有机酸可活化土壤中与铁铝结合的中等活性磷[33],CNA组中等活性磷含量出现的不同程度降低(图 4)可能是根系分泌低分子量有机酸导致,同时这也可解释本研究中CNA组无定型铝含量在氮沉降下出现了不同程度减少的现象(表 1),因为低分子量有机酸具有络合无定型铝的能力[34]。而UNA组土壤TPo、中等活性磷、难利用磷组分较CK均无显著变化,并且CNA组难利用磷含量显著低于UNA组(P<0.05)(图 3b,图 4),说明用UNA方法模拟氮沉降低估了氮沉降对土壤难利用磷的削减效应。这可能是UNA组缺少林冠对氮的截留吸收过程导致(根据初步测算,毛竹冠层对氮沉降的截留率约30%),UNA组植物生长磷限制弱于CNA组,分泌的ACP也显著低于CNA组(图 5),对土壤中等活性磷和难利用磷的活化与吸收相对较弱。
土壤微生物对磷循环过程也有重要影响[35]。有效磷供应不足时,NaHCO3-Po通常最易被植物微生物率先活化利用,CNA组NaHCO3-Po含量在氮沉降后显著下降,易利用磷含量显著降低(图 4),这与Zhang等[29]的冠层氮沉降试验结果一致。MBN、MBP与NaHCO3-Po均呈显著负相关(图 7),由此可见,微生物可能也参与了土壤有效磷的活化固定。UNA组的NaHCO3-Po和易利用磷含量在氮沉降后也显著减少(图 4),这与Zeng等[36]在毛竹林生长季的氮沉降试验得出的结果相同,与此相关的是,UNA组MBP含量在氮沉降后显著增加(P<0.05)(表 2)。但是UNA组易利用磷显著高于CNA组(P<0.05)(图 4),这说明UNA方法低估了氮沉降下易利用磷的减少量。由于ACP具有矿化NaHCO3-Po的作用,并且发现NaHCO3-Po含量与ACP活性显著负相关(P<0.001)(图 7),因此可能是UNA组相对CNA组更低的ACP活性导致了UNA和CNA组易利用磷含量的差异。
树脂磷组分在UNA和CNA组间无显著差异(图 4)。而CNA组有效性最高的树脂磷在土壤难利用磷、中等活性磷和易利用磷均显著降低的情况下,却并未得到补充,这可能是因为土壤植物或微生物仍处于磷限制状态,刚转化而成的树脂磷立刻通过生物吸收固存等方式被利用[6],这也是导致CNA组氮沉降对土壤TP更大削减效应的一个重要原因。
值得注意的是,大部分磷循环功能基因对氮沉降响应不显著,但是bpp、phoX、phnK、phoD基因丰度与磷组分存在显著相关性(图 7),说明磷循环功能基因绝对丰度对磷组分存在一定影响,在未来研究中,尚需持续关注磷循环功能基因与磷组分对氮沉降响应的异同性。
3.2 不同沉降氮形态对土壤磷组分的影响本研究发现,总体上ON处理和IN处理下的土壤TP无显著差异(图 3a),这与本试验第二个假设不相符,但与Wei等[37]研究得出的结果相同。进一步分析土壤磷组分发现,总体上IN处理的土壤树脂磷含量显著低于ON处理,IN处理的土壤难利用磷、中等活性磷和易利用磷含量与ON处理无显著差异(图 4)。这可能是因为每次喷施ON后,ON成分中的尿素在水解后产生的OH–占据了部分土壤磷的吸附位点,相对减轻了本研究区酸性土壤对活性磷组分的固定[38]。此外,MBC/MBN可反映微生物群落中真菌群落和细菌群落哪个更占据优势,真菌和细菌平均碳氮比分别为5~15和3~6[39],土壤MBC/MBN越大,说明真菌越占据优势,本研究IN组的MBC/MBN显著低于ON组46.7%~65.5%(P<0.05)(表 2),说明IN组较ON组具有更多的土壤细菌,当IN组土壤微生物以细菌为主时,有机质中更多的轻组碳可被细菌分解利用,随着微生物的生长,它们可能会受到高C:P基质的限制,造成微生物功能性磷胁迫[6]。因此,IN组被释放出来的土壤速效磷养分会迅速被微生物固持,这便导致了总体上IN处理的土壤树脂磷含量显著低于ON处理。另一个可能原因是ON成分中含易利用的有机碳,这些有机碳进入土壤后增加了ON处理的DOC含量,这些易利用的碳源增加会促进微生物代谢活动[40],进而使其分泌更多低分子量有机酸并活化产生更多的树脂磷。而CNA组的四类磷组分在ON和IN间均无显著差异(图 4),这可能是因为CNA组具有更大的磷限制,稳态磷被活化为树脂磷和易利用态磷后又迅速被受磷限制的植物吸收固存,因此掩盖了ON和IN对树脂磷影响的差异。
4 结论林冠模拟氮沉降下的土壤全磷含量显著低于林下模拟氮沉降下的结果,磷组分中难利用磷和易利用磷含量的变化主要构成了该差异,酸性磷酸酶活性、pH是该差异的主要驱动因子。因此,采用林下方法来研究氮沉降对森林生态系统磷循环的影响效应,可能会低估氮沉降对土壤磷组分中难利用磷和易利用磷的削减效应。林冠有机氮和无机氮沉降对土壤磷组分的影响无显著差异,林下无机氮沉降下土壤树脂磷和易利用磷含量显著低于林下有机氮沉降的结果。由于磷与碳、氮等元素循环过程密切耦合,且这些耦合过程对维持生态系统的养分平衡、土壤健康和植物生长均具有重要意义,因此,在未来的氮沉降模拟试验中,应同步考虑氮沉降模拟方式和沉降氮形态对土壤碳、氮、磷循环和生态系统生态功能的影响。
致谢 感谢中国科学院水利部成都山地灾害与环境研究所刘美玉、中国科学院成都生物研究所王吉鹏在工作中给予的帮助。
| [1] |
Hou E Q, Luo Y Q, Kuang Y W, et al. Global meta-analysis shows pervasive phosphorus limitation of aboveground plant production in natural terrestrial ecosystems[J]. Nature Communications, 2020, 11(1): 637. DOI:10.1038/s41467-020-14492-w
(  0) 0) |
| [2] |
Galloway J N, Townsend A R, Erisman J W, et al. Transformation of the nitrogen cycle: Recent trends, questions, and potential solutions[J]. Science, 2008, 320(5878): 889-892. DOI:10.1126/science.1136674
(  0) 0) |
| [3] |
Liu X J, Zhang Y, Han W X, et al. Enhanced nitrogen deposition over China[J]. Nature, 2013, 494(7438): 459-462. DOI:10.1038/nature11917
(  0) 0) |
| [4] |
Deng Q, Hui D F, Dennis S, et al. Responses of terrestrial ecosystem phosphorus cycling to nitrogen addition: A meta-analysis[J]. Global Ecology and Biogeography, 2017, 26(6): 713-728. DOI:10.1111/geb.12576
(  0) 0) |
| [5] |
Fan Y X, Zhong X J, Lin F, et al. Responses of soil phosphorus fractions after nitrogen addition in a subtropical forest ecosystem: Insights from decreased Fe and Al oxides and increased plant roots[J]. Geoderma, 2019, 337: 246-255. DOI:10.1016/j.geoderma.2018.09.028
(  0) 0) |
| [6] |
Chen M L, Chen H, Mao Q G, et al. Effect of nitrogen deposition on the soil phosphorus cycle in forest ecosystems: A review (In Chinese)[J]. Acta Ecologica Sinica, 2016, 36(16): 4965-4976. [陈美领, 陈浩, 毛庆功, 等. 氮沉降对森林土壤磷循环的影响[J]. 生态学报, 2016, 36(16): 4965-4976.]
(  0) 0) |
| [7] |
Fan Y X, Lin F, Yang L M, et al. Decreased soil organic P fraction associated with ectomycorrhizal fungal activity to meet increased P demand under N application in a subtropical forest ecosystem[J]. Biology and Fertility of Soils, 2018, 54(1): 149-161. DOI:10.1007/s00374-017-1251-8
(  0) 0) |
| [8] |
Block C E, Knoepp J D, Fraterrigo J M. Interactive effects of disturbance and nitrogen availability on phosphorus dynamics of southern Appalachian forests[J]. Biogeochemistry, 2013, 112(1): 329-342.
(  0) 0) |
| [9] |
Chen Y Q, Chen G T, Liang Z, et al. Ten-year nitrogen addition did not significantly affect soil phosphorus fractions in a Pleioblastus amarus plantation (In Chinese)[J]. Ecology and Environmental Sciences, 2018, 27(4): 677-684. [陈雨芩, 陈冠陶, 梁政, 等. 10年氮添加未显著影响苦竹林土壤磷组分[J]. 生态环境学报, 2018, 27(4): 677-684.]
(  0) 0) |
| [10] |
Zhang W, Shen W J, Zhu S D, et al. Can canopy addition of nitrogen better illustrate the effect of atmospheric nitrogen deposition on forest ecosystem?[J]. Scientific Reports, 2015, 5(1): 11245. DOI:10.1038/srep11245
(  0) 0) |
| [11] |
Marklein A R, Houlton B Z. Nitrogen inputs accelerate phosphorus cycling rates across a wide variety of terrestrial ecosystems[J]. New Phytologist, 2012, 193(3): 696-704. DOI:10.1111/j.1469-8137.2011.03967.x
(  0) 0) |
| [12] |
Tian Y, Wang J, Zhou L, et al. Nitrogen budgets of a lower subtropical forest as affected by 6 years of over-canopy and understory nitrogen additions[J]. Science of the Total Environment, 2022, 852: 158546. DOI:10.1016/j.scitotenv.2022.158546
(  0) 0) |
| [13] |
Cornell S E. Atmospheric nitrogen deposition: Revisiting the question of the importance of the organic component[J]. Environmental Pollution, 2011, 159(10): 2214-2222. DOI:10.1016/j.envpol.2010.11.014
(  0) 0) |
| [14] |
Pan B B, Lam S K, Mosier A, et al. Ammonia volatilization from synthetic fertilizers and its mitigation strategies: A global synthesis[J]. Agriculture, Ecosystems & Environment, 2016, 232: 283-289.
(  0) 0) |
| [15] |
Wang Z, Tao T T, Wang H, et al. Forms of nitrogen inputs regulate the intensity of soil acidification[J]. Global Change Biology, 2023, 29(14): 4044-4055. DOI:10.1111/gcb.16746
(  0) 0) |
| [16] |
Chen C, Park T, Wang X H, et al. China and India lead in greening of the world through land-use management[J]. Nature Sustainability, 2019, 2(2): 122-129. DOI:10.1038/s41893-019-0220-7
(  0) 0) |
| [17] |
Yao Y H, Zhang S B, Zhou J S, et al. Effects of nitrogen and phosphorus addition on organic carbon mineralization and priming effect in a Moso bamboo plantation soil (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(4): 1088-1100. DOI:10.11766/trxb202205060034 [姚易寒, 张少博, 周家树, 等. 氮磷添加对毛竹林土壤有机碳矿化及其激发效应的影响[J]. 土壤学报, 2023, 60(4): 1088-1100.]
(  0) 0) |
| [18] |
Yu X, Pan Y P, Song W, et al. Wet and dry nitrogen depositions in the Pearl River Delta, South China: Observations at three typical sites with an emphasis on water-soluble organic nitrogen[J]. Journal of Geophysical Research: Atmospheres, 2020, 125(3): e2019JD030983. DOI:10.1029/2019JD030983
(  0) 0) |
| [19] |
Jiang W T, Tian L B, Zhu G D, et al. Effects of different forms of nitrogen addition on N2O emissions from the soil of Moso bamboo(Phyllostachys edulis)forest (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2022, 28(5): 857-868. [蒋文婷, 田立斌, 朱高荻, 等. 不同形态氮添加对毛竹林土壤N2O排放的影响[J]. 植物营养与肥料学报, 2022, 28(5): 857-868.]
(  0) 0) |
| [20] |
Jiang W T, Zhang H K, Fang Y Y, et al. Understory N application overestimates the effect of atmospheric N deposition on soil N2O emissions[J]. Geoderma, 2023, 437: 116611. DOI:10.1016/j.geoderma.2023.116611
(  0) 0) |
| [21] |
Moir J, Tiessen H. Characterization of available P by sequential extraction[M]//Carter M R, Gregorich E G, ed. Soil sampling and methods of analysis. 2nd Ed. Boca Raton: CRC Press, 2007: 293-306.
(  0) 0) |
| [22] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707. DOI:10.1016/0038-0717(87)90052-6
(  0) 0) |
| [23] |
Brookes P C, Powlson D S, Jenkinson D S. Measurement of microbial biomass phosphorus in soil[J]. Soil Biology and Biochemistry, 1982, 14(4): 319-329. DOI:10.1016/0038-0717(82)90001-3
(  0) 0) |
| [24] |
Zhang H K, Zhang B G, Zhou Z Y, et al. Effects of converting natural forests to Moso bamboo and tea plantations on soil extracellular enzyme activity in subtropical China (In Chinese)[J]. Journal of Agro-Environment Science, 2022, 41(4): 826-833. [张海阔, 张宝刚, 周钟昱, 等. 亚热带天然林转变为毛竹林和茶园对土壤胞外酶活性的影响[J]. 农业环境科学学报, 2022, 41(4): 826-833.]
(  0) 0) |
| [25] |
Shi Y Z, Ma L F, Han W Y, et al. Study on simultaneous determination of phosphorus, potassium, lead, zinc etc. altogether 17 elements in tea (In Chinese)[J]. Food Science, 2006, 27(1): 193-196. [石元值, 马立峰, 韩文炎, 等. 茶叶中磷、钾、铅、锌等17种元素的快速测定方法研究[J]. 食品科学, 2006, 27(1): 193-196.]
(  0) 0) |
| [26] |
Zhang J J, Priemé A, Chen X K, et al. OMEC-based analysis of the soil microbial functional potentials across different Tibetan Plateau glacier forelands (In Chinese)[J]. Environmental Science, 2023, 44(1): 512-519. [张洁洁, Priemé A, 陈显轲, 等. 基于QMEC分析的青藏高原不同类型冰川前缘地土壤微生物功能潜力[J]. 环境科学, 2023, 44(1): 512-519.]
(  0) 0) |
| [27] |
Helfenstein J, Pistocchi C, Oberson A, et al. Estimates of mean residence times of phosphorus in commonly considered inorganic soil phosphorus pools[J]. Biogeosciences, 2020, 17(2): 441-454. DOI:10.5194/bg-17-441-2020
(  0) 0) |
| [28] |
Wang R Z, Yang J J, Liu H Y, et al. Nitrogen enrichment buffers phosphorus limitation by mobilizing mineral‐bound soil phosphorus in grasslands[J]. Ecology, 2022, 103(3): e3616. DOI:10.1002/ecy.3616
(  0) 0) |
| [29] |
Zhang H Z, Shi L L, Fu S L. Effects of nitrogen deposition and increased precipitation on soil phosphorus dynamics in a temperate forest[J]. Geoderma, 2020, 380: 114650. DOI:10.1016/j.geoderma.2020.114650
(  0) 0) |
| [30] |
Gilliam F S, Billmyer J H, Walter C A, et al. Effects of excess nitrogen on biogeochemistry of a temperate hardwood forest: Evidence of nutrient redistribution by a forest understory species[J]. Atmospheric Environment, 2016, 146: 261-270. DOI:10.1016/j.atmosenv.2016.04.007
(  0) 0) |
| [31] |
Zeng Q X, Zeng X M, Lin K M, et al. Responses of soil phosphorus fractions and microorganisms to nitrogen application in a subtropical Phyllostachys pubescen forest (In Chinese)[J]. Chinese Journal of Applied Ecology, 2020, 31(3): 753-760. [曾泉鑫, 曾晓敏, 林开淼, 等. 亚热带毛竹林土壤磷组分和微生物对施氮的响应[J]. 应用生态学报, 2020, 31(3): 753-760.]
(  0) 0) |
| [32] |
Chen H, Tang H Y, Guo J H, et al. Root exudates' roles and analytical techniques progress (In Chinese)[J]. Soils, 2023, 55(2): 225-233. [陈虹, 唐昊冶, 郭家欢, 等. 根系分泌物主要作用及解析技术进展[J]. 土壤, 2023, 55(2): 225-233.]
(  0) 0) |
| [33] |
Zhang N Y, Yan S D, Li J, et al. Meta-analysis on the effects of low molecular weight organic acids on increasing availability of soil phosphorus (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2019, 25(12): 2076-2083. [张乃于, 闫双堆, 李娟, 等. 低分子量有机酸对土壤磷组分影响的Meta分析[J]. 植物营养与肥料学报, 2019, 25(12): 2076-2083.]
(  0) 0) |
| [34] |
Chen Y T, Wang Y, Yeh K C. Role of root exudates in metal acquisition and tolerance[J]. Current Opinion in Plant Biology, 2017, 39: 66-72. DOI:10.1016/j.pbi.2017.06.004
(  0) 0) |
| [35] |
Kong Y L, Qin H, Zhu C Q, et al. Research progress on the mechanism by which soil microorganisms affect soil health (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(2): 331-347. DOI:10.11766/trxb202301200448 [孔亚丽, 秦华, 朱春权, 等. 土壤微生物影响土壤健康的作用机制研究进展[J]. 土壤学报, 2024, 61(2): 331-347.]
(  0) 0) |
| [36] |
Zeng Q X, Fan Y X, Zhang Q F, et al. Differential factors determine the response of soil P fractions to N deposition in wet and dry seasons in a subtropical Moso bamboo forest[J]. Plant and Soil, 2022,
https://doi.org/10.1007/ s11104-022-05768-9.
(  0) 0) |
| [37] |
Wei K, Sun T, Tian J H, et al. Soil microbial biomass, phosphatase and their relationships with phosphorus turnover under mixed inorganic and organic nitrogen addition in a Larix gmelinii plantation[J]. Forest Ecology and Management, 2018, 422: 313-322. DOI:10.1016/j.foreco.2018.04.035
(  0) 0) |
| [38] |
Hartikainen H, Yli-Halla M. Solubility of soil phosphorus as influenced by urea[J]. Zeitschrift für Pflanzenernä hrung und Bodenkunde, 1996, 159(4): 327-332. DOI:10.1002/jpln.1996.3581590403
(  0) 0) |
| [39] |
Xi Y Q, Li X, Liu X F. Effects of simulated nitrogen addition on soil organic carbon mineralization in subtropical Cunninghamia lanceolata plantation (In Chinese)[J]. Soils, 2023, 55(1): 196-204. [席颖青, 李晓, 刘小飞. 模拟氮添加对亚热带杉木人工林土壤有机碳矿化的影响[J]. 土壤, 2023, 55(1): 196-204.]
(  0) 0) |
| [40] |
Anderson O R, Juhl A R, Bock N. Effects of organic carbon enrichment on respiration rates, phosphatase activities, and abundance of heterotrophic bacteria and protists in organic-rich Arctic and mineral-rich temperate soil samples[J]. Polar Biology, 2018, 41(1): 11-24. DOI:10.1007/s00300-017-2166-4
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


