磷是农业生态系统生产力的限制性养分,磷素作为农作物生长发育所必需的大量营养元素之一,其有效性极大地限制着农作物的高产、高效和优质[1-2]。在集约化农业区,持续过量的磷肥施用已导致土壤中磷的富集,盈余的磷极易与土壤组分发生多种相互作用,通过吸附或者沉淀的方式被固定[3-4],导致磷肥的当季利用率一般仅有10%~25%[5]。例如在石灰性土壤中,可溶性磷酸盐易与土壤中钙素结合,从而形成不同种类的钙磷(Ca-P)沉淀,主要包括沉淀初期形成易溶的无定形磷酸钙沉淀颗粒(ACP),以及后期逐渐相变形成的枸溶性的磷酸氢钙(CaHPO4·2H2O,DCPD)、磷酸三钙(Ca3(PO4)2,TCP)、磷酸八钙(Ca8(HPO4)2(PO4)4·5H2O,OCP)以及难溶的羟基磷灰石(Ca10(PO4)6(OH)2,HAP)等[6]。通常条件下Ca/P摩尔比越大,对应的正磷酸钙酸性越弱,溶解度越小[6]。并且在土壤中,可溶性磷酸盐会通过再结晶的方式向难溶性磷酸盐转变,最终这些沉淀态的磷酸盐逐渐在土壤中形成了一个潜在的巨大磷库。因此,如何有效调动土壤中盈余的磷,实现磷肥节约、产量提高和污染控制,对于促进农业可持续发展具有重要意义。
为了更好地利用沉淀态的Ca-P等,植物根际会通过分泌质子或者有机酸增加沉淀态钙磷的溶解。还可通过农艺措施,如磷肥集中施用,磷肥与生理酸性肥料混合条施,在碱性土壤中选择酸性磷肥或者酸性土壤上选用碱性磷肥等减少磷在土壤中的固定[7]。其中,氮肥的施用能显著影响土壤磷素转化、迁移与有效性[3,8-11],如降低土壤中难溶性磷的比例,促进沉淀态无机磷的活化,提高微生物的生命活动,从而促进土壤有机磷向无机磷的矿化作用等[12-14]。
科学合理施肥是提高土壤养分利用效率、提高农作物产量和改善农作物品质的有效措施[15]。虽然关于氮肥影响磷素释放与吸收的研究较多,但大多数集中在宏观尺度的农作物对土壤磷素的利用效率上,而在微观尺度下,不同用量氮肥的加入如何直接活化土壤沉淀态钙磷的研究仍然缺乏。因此,本研究选择了土壤中常见的磷酸钙的沉淀形态,即枸溶性的DCPD(Ca2-P)和难溶性HAP(Ca10-P)为供试材料,以不同浓度的氯化铵(NH4Cl)溶液表示不同的施氮水平,通过原子力显微镜的原位实时观察,在纳米尺度上探究了不同氮肥水平对不同形态磷酸钙的原位溶解动力学的影响,以期为以氮促磷、提高土壤沉淀态磷素有效性提供直接依据。
1 材料与方法 1.1 供试材料本试验所用的试剂均购买自西格玛奥德里齐(上海)贸易有限公司,配制反应溶液的超纯水依次通过自动三重水蒸馏器和Milli-Q Advantage A10超纯水系统过滤制备。
1.2 DCPD晶体合成与表征方法首先将配制的5.7%偏硅酸钠利用5 mol·L–1的醋酸酸化至pH 6,紧接着将0.1 mol·L–1磷酸氢二钠与上述偏硅酸钠溶液混合;随后将混合溶液转移至试管中静置形成凝胶后,将0.5 mol·L–1氯化钙溶液缓慢加入凝胶上部,并使钙磷摩尔比为1:1;最后置于室温反应一个月即可获得DCPD晶体[16]。利用原子力显微镜(AFM,Bruker MM8,美国)、拉曼光谱(Raman,Horiba LabRAM HR800,法国)和X-射线衍射仪(XRD,Bruker D8,美国)分别对DCPD进行表征。
1.3 DCPD和HAP溶解动力学的原位观察方法将合成的DCPD晶体固定在原子力显微镜液体反应池中,分别通入不同氮素水平的氯化铵溶液(0、0.5、5、50、500、1 000 mmol·L–1,pH 6.5),在原子力显微镜的接触模式下,利用DNP-10原子力探针,原位实时观察DCPD的溶解动力学。对于HAP的原位溶解观察,首先利用压片机将HAP颗粒在10~15 MPa下压片3 min,从而制备HAP基底。接着,将HAP基底同样固定在液体反应池中,在AFM的自动扫描模式下,通入不同浓度氯化铵溶液,利用SNL-10探针,实时观察HAP表面的溶解动力学。在反应过程中,超纯水以及氯化铵溶液分别通过高精度注射泵(R100-E,Razel Scientific Instrument Model,美国)以2 mL·h–1的速率流过液体反应池,从而保证了稳态的动力学溶解条件。
1.4 氯化铵和磷酸钙表面相互作用的定量表征方法基于AFM探针针尖修饰方法[17],将末端为铵根的自组装分子11-巯基铵盐(HS-(CH2)11-NH2·H2O)通过金硫键(Au-S)共价修饰至镀金的探针针尖上,随后在磷酸钙矿物表面进行动力学力谱试验(DFS)。动力学力谱试验在AFM的Force volume模式下进行。每次测试之前,需要对功能化的针尖分别进行悬臂偏转灵敏度和弹性系数校正[18],以获得准确的DFS数据。在pH 6.5的水溶液中测定铵根和磷酸钙表面相互作用力时,设定最小触发力200 pN,矿物表面停留时间1 s以及恒定的探针前进速度200 nm·s–1,当功能化的探针针尖接触样品表面,活性基团铵根和样品表面发生相互作用。此时将探针缓慢撤离DCPD和HAP样品表面,撤退速度则依次从20 nm·s–1增加至3 910 nm·s–1,直至铵根-DCPD/HAP相互作用断开,此时便得到不同撤退速率下的铵根和矿物表面相互作用的断裂力。设置不同的撤退速度是为了分别获取在近平衡和动力学状态下收集力-距离曲线。每个撤退速度下在2×2 μm2的磷酸钙表面收集256条力-距离曲线,至少挑选其中的50条用于数据分析,以此来降低矿物表面异质性的干扰。利用Friddle-Noy-De Yoreo(FNDY)模型,对DFS数据分析得到铵根和磷酸钙之间的相互作用力[19]。
1.5 氯化铵溶解磷酸钙释放磷的质量定量分析在室温条件下,进行氯化铵溶解磷酸钙(DCPD和HAP)的溶解试验。首先,称取相同质量的DCPD和HAP各2 mg,经充分研磨后,置于10 mL比色管中,分别加入9 mL超纯水(pH 6.5)或者不同浓度的氯化铵溶液(0.5~1 000 mmol·L–1,pH 6.5),反应10 min后利用钼蓝染色法对溶解出磷的质量进行测定。具体步骤为:加入1 mL抗坏血酸溶液(10%),30 s后加入2 mL钼蓝显色溶液充分显色30 min,利用紫外-可见分光光度计(UV-5600,上海元析仪器有限公司,上海)在波长700 nm进行吸光度测定[20]。
1.6 数据分析DCPD表面三角形台阶撤退速率、蚀坑加深速率、蚀坑密度速率以及HAP表面高度变化等溶解动力学参数均利用NanoScope Analysis 1.9软件测定。所有数据处理与统计分析分别使用Origin 2021和SPSS Statistics 25软件进行。
2 结果与讨论 2.1 DCPD表面形貌的观察与表征为了更好地利用AFM观察枸溶性磷酸钙DCPD(CaHPO4·2H2O)的原位溶解动力学过程,试验先制备了纯度及平整度较高的DCPD晶体用于AFM监测。原位溶解试验显示,在通入超纯水溶解过程中,DCPD主要暴露面(101)表面会出现典型的三角形溶解蚀坑(图 1a,图 1b),该蚀坑具有三个台阶方向
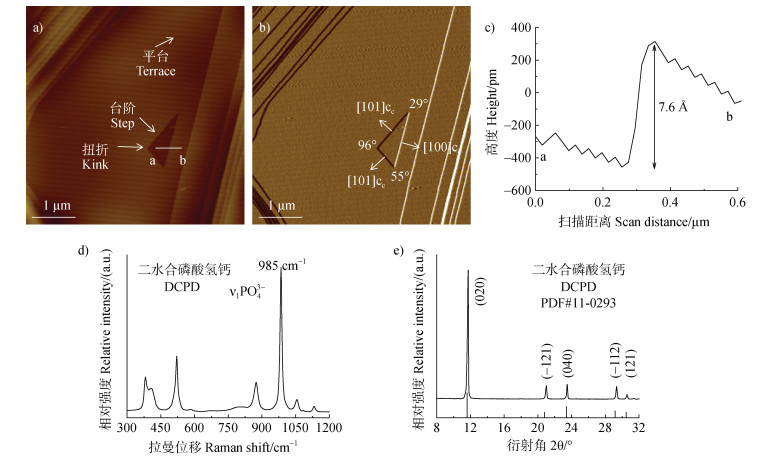
|
注:原子力显微镜对二水合磷酸氢钙(101,DCPD)表面形貌表征(a,b)、二水合磷酸氢钙的表面台阶高度测定(c)、拉曼光谱(d)和X射线衍射仪对二水合磷酸氢钙晶体结构表征(e)。Notes:AFM characterization of(101)surface morphology of dicalcium phosphate dihydrate(101,DCPD)(a,b),determination of surface step height of DCPD(c),Raman spectrum(d)and XRD characterization of crystal structure of DCPD(e). 图 1 磷酸氢钙晶体的表征 Fig. 1 Characterization of dicalcium phosphate dihydrate crystal |
将DCPD晶体固定在AFM液体池中,通入超纯水(pH 6.5)后,观察DCPD(101)表面上的三角形蚀坑在同一位置沿着三个台阶方向溶解的动力过程(图 2a1~图 2a4)。通入0.5 m mol·L–1的氯化铵溶液(pH 6.5)后,三角形蚀坑台阶撤退的速率明显加快,单台阶撤退的同时表面蚀坑的台阶方向和三角形角度保持不变(图 2b1~图 2b4)。通过台阶撤退速率的定量分析表明,[101]、

|
注:二水合磷酸氢钙(101)表面分别在水(a1~a4)、0.5 mmol·L–1氯化铵(b1~b4)、5 mmol·L–1氯化铵(c1~c2)、50 mmol·L–1氯化铵(d1~d2)、500 mmol·L–1氯化铵(e1~e2)、1 000 mmol·L–1氯化铵溶液(f1-f2)(pH 6.5)中原位溶解动力学的原子力显微镜形貌图。 Note: AFM imaging of in situ dissolution kinetics of(101)surface of dicalcium phosphate dihydrate(DCPD)in the presence of water(a1-a4), 0.5 mmol·L–1 NH4Cl(b1-b4), 5 mmol·L–1 NH4Cl(c1-c2), 50 mmol·L–1 NH4Cl(d1-d2), 500 mmol·L–1NH4Cl(e1-e2), 1 000 mmol·L–1 NH4Cl(f1-f2)(pH 6.5). 图 2 磷酸氢钙表面溶解的原位表征 Fig. 2 In situ characterization of the surface dissolution of dicalcium phosphate dihydrate |
|
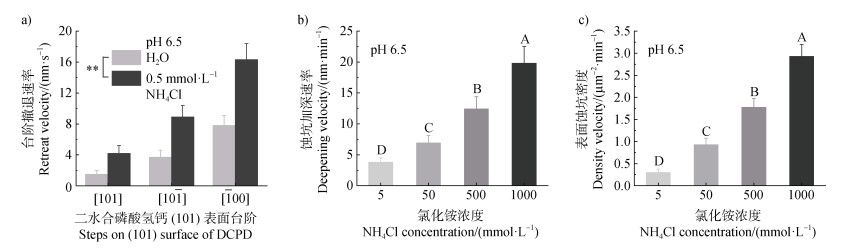
注:二水合磷酸氢钙(101)表面上三个方向台阶撤退速率(a)、蚀坑加深速率(b)以及(c)蚀坑密度速率的定量分析。图中数据为试验数据的平均值±标准差(n = 3)。**和不同大写字母表示不同处理间差异极显著(P < 0.01)。 Note: Quantification of retreat velocity of three steps(a), etch pit deepening(b), and density of(101)surface of dicalcium phosphate dihydrate(DCPD)(c). Data are presented by mean ± standard deviation(SD)of all the experiment(n = 3). ** and different uppercase letters indicate significant differences between treatments at P < 0.01. 图 3 磷酸氢钙表面溶解的定量分析 Fig. 3 Quantification analysis of the surface dissolution of dicalcium phosphate dihydrate |
一般而言,DCPD晶体(101)表面的溶解速率取决于台阶撤退速率、蚀坑加深速率以及蚀坑密度的总和[23]。本试验中,在pH 6.5的试验条件下,DCPD(101)表面带有负电荷[24]。当带负电的(101)表面和氯化铵溶液相互作用时,带正电的铵根阳离子直接通过静电作用、范德华力、氢键等弱相互作用力,扰乱DCPD表面的水化环境从而破坏界面离子的化学平衡[25],促进了磷酸根的溶解释放。随着氯化铵浓度的逐渐增加,弱相互作用力诱导的表面溶解会进一步加剧,具体表现为台阶撤退速率增加,蚀坑加深速率增加以及表面蚀坑密度增加(图 3)。反之,这也表明由于铵根阳离子的存在,DCPD表面新蚀坑形成所需要的能垒一定是下降的。此外,本研究注意到三角形蚀坑台阶具有显著的各向异性,具体表现为:[101]台阶以钙离子为末端,带有正电性;
HAP是磷素在土壤转化中最稳定且最难溶解的形态[2],为了进一步研究氮对其溶解的影响,试验先将HAP固定在AFM液体池中,逐次通入不同浓度的氯化铵溶液,在纳米尺度上原位观察了HAP颗粒的原位溶解过程,从而探究不同的氮素水平对HAP活化作用。结果表明,当pH 6.5的水与HAP颗粒相互作用时,随着时间的进行,其表面形貌基本未发生变化。例如,在图 4a1~图 4a2中,短划线圆圈中的单个HAP颗粒在0 s和810 s时的形貌基本不变。进一步对HAP表面高度分析表明,图 4a1和图 4a2中的短划线标注区域的高度曲线基本重合(图 4a3),这表明HAP颗粒在水中基本不发生溶解反应。当HAP颗粒表面与1 000 mmol·L–1的氯化铵溶液(pH 6.5)反应时,用同样的分析表明,随着反应时间的进行,颗粒表面形貌(图 4b1~图 4b2)及高度(图 4b3)基本不变。
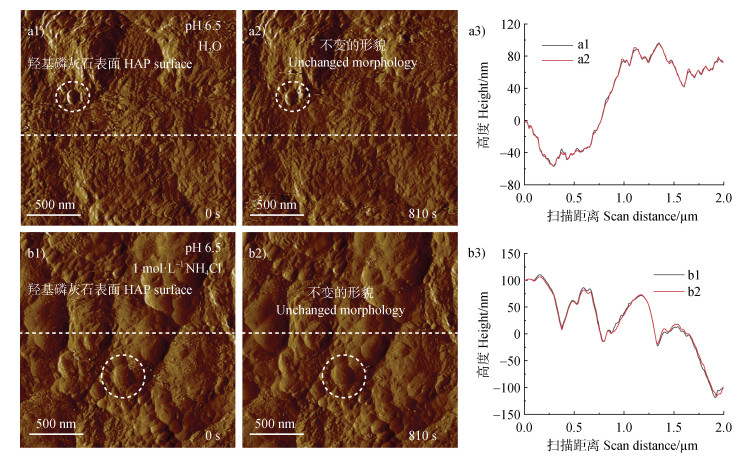
|
注:羟基磷灰石表面分别在水(a1~a2)和1 mol·L–1氯化铵溶液(pH 6.5)(b1~b2)中原位溶解动力学的原子力显微镜形貌图及对应的羟基磷灰石表面高度测定(a3~b3)。Notes:AFM imaging of in situ dissolution kinetics of HAP surface in the presence of water(a1-a2)and 1 mol·L–1 NH4Cl(pH 6.5)(b1-b2)and the corresponding surface height determination of hydroxyapatite(HAP)surface(dashed lines,a3-b3). 图 4 羟基磷灰石表面溶解的原位表征 Fig. 4 In situ characterization of the surface dissolution of hydroxyapatite |
因此,基于原子力显微镜实时的可视化表征,在纳米尺度确定了氯化铵对两类代表性磷酸钙矿物的表面溶解动力学。具体表现为:随着氯化铵浓度的增加,DCPD表面三角形台阶撤退速率、三角形蚀坑加深速率以及三角形蚀坑密度均显著提高,但是HAP表面形貌基本未发生变化。这表明,氯化铵能够驱动DCPD中共沉淀磷的溶解释放,而HAP表面未发生溶解反应,其中共沉淀的磷也基本不会被活化释放。
2.4 铵根阳离子和磷酸钙表面相互作用力的定量表征为进一步探明氯化铵调控DCPD和HAP表面溶解动力学显著性差异的原因,本研究利用原子力显微镜的动力学力谱(DFS)技术定量测定铵根和DCPD/HAP表面之间的相互作用力(图 5a)。代表性力-距离曲线表明,铵根与DCPD之间的断裂力大于其与HAP之间的断裂力(图 5b)。数据拟合后发现,在近平衡态时,铵根与DCPD之间的相互作用力(230.6 pN)显著大于其与HAP之间的相互作用力(154.0 pN)(图 5c)。这表明,铵根与DCPD之间的结合强度明显高于其与HAP之间的结合强度。正是由于这种相对较弱的相互作用,铵根阳离子对于HAP表面水化层的破坏有限,因此HAP表面溶解动力学未出现明显差异。

|
注:动力学力谱技术测定铵根和磷酸钙矿物之间相互作用力示意图(a)、铵根和磷酸钙矿物之间相互作用中的代表性力-距离曲线(b)及动力学力谱拟合铵根和磷酸钙矿物表面的断裂力-加载速率曲线(c)。**表示不同处理间差异极显著(P < 0.01)。Notes:The schematic of dynamic force spectroscopy(DFS)detecting interactions between ammonium cation and calcium phosphate surface(a),representative force-distance curves of interactions between ammonium cation and calcium phosphate surface(b)and representative rupture force-loading rate curves of interactions between ammonium cation and calcium phosphate surface derived from DFS fitting(c). ** indicates significant differences between treatments at P < 0.01. 图 5 铵根和磷酸钙表面相互作用的原位表征 Fig. 5 In situ characterization of interactions between ammonium cation and calcium phosphate surface |
基于以上磷酸钙矿物的原位溶解观察,直接明确了氮素的添加对于DCPD矿物中沉淀态钙磷素的溶解活化作用。为了进一步明确氮磷体系中对于提高土壤磷素有效性的作用,定量分析了氮素添加过程中溶解磷酸钙后释放的磷的质量。结果表明,以DCPD和HAP在超纯水(pH 6.5)中溶解作为对照,测得溶解出的磷质量分别为13.00 mg·kg–1和3.000 mg·kg–1(图 6)。随着氯化铵浓度从0.5 mmol·L–1增加至1 000 mmol·L–1,从DCPD矿物中溶解磷的质量从27 ± 5 mg·kg–1显著增加至145.0 mg·kg–1(图 6)。对于HAP的溶解,即使氯化铵浓度增至1 000 mmol·L–1,溶解出的磷质量为5.000 mg·kg–1,与水中的溶解量相比未发生显著性变化(图 6)。试验进一步证明了原位溶解结果与定量溶解磷的质量结果的一致性,并再次明确了氮素的添加对于磷酸钙中易溶态的DCPD具有显著的溶解效果,但是对于难溶态的HAP几乎无作用。

|
注:不同大写字母表示不同处理间差异极显著(P < 0.01)。Notes:Different uppercase letters indicate significant differences between treatments at P < 0.01. 图 6 二水合磷酸氢钙和羟基磷灰石分别在水和不同浓度氯化铵溶液(pH 6.5)溶解磷质量的定量分析 Fig. 6 Quantification of P mass dissolved from DCPD/HAP in the presence of different concentrations of NH4Cl(pH 6.5) |
近40年来,我国大多数土壤中的磷养分处于盈余状态,尤其是1980年以来现代农业的发展、过量磷肥的施用,已造成其在土壤中的大量积聚,将土壤磷含量从7.4 mg·kg –1提高至24.7 mg·kg–1,已达到甚至超出农学阈值范围[27-29]。且随着施肥年限的延长,土壤中磷的形态也会发生转变,包括溶解态或吸附态磷转变为沉淀态磷,同时弱晶质的沉淀态磷能够晶相转变为晶质矿物,其有效性进一步降低,因此土壤中大量分布着不同形态的磷,成为植物的重要磷池[29],例如,在石灰性土壤上连续施用磷肥,主要增加无机磷中的枸溶性的磷酸二钙(Ca2-P)和磷酸八钙(Ca8-P),以及难溶性的磷灰石(Ca10-P)[30]。其中Ca2-P易被作物吸收,是作物的有效磷源;Ca8-P有效性低于Ca2-P,可作为作物的第二有效磷源;Ca10-P在短时期内不易被作物吸收利用,是作物的潜在磷源[2]。然而无论何种形态的磷,相关研究表明[14],氮磷配施均可提高可供植物直接吸收利用的Ca2-P以及具有缓效作用的Ca8-P、Al-P比例,降低土壤中难溶性Ca10-P的比例[31]。在“化肥零增长”目标指引下,充分活化土壤中残余磷是磷肥高效利用的有效途径之一。
3 结论本研究利用纳米尺度上的DCPD(Ca2-P)和HAP(Ca10-P)原位溶解动力学以及宏观上的溶解磷的质量,揭示了不同浓度氯化铵对磷酸钙的溶解效果。在有限的溶解时间内,氯化铵对枸溶性的DCPD具有显著的溶解效果,但对于难溶性的HAP溶解效果较小,并从离子-矿物结合角度阐明了该显著性差异的微观机制。本研究率先从矿物界面溶解角度出发,进一步说明了农田氮磷配合施用过程中,氮肥的投入对于土壤磷的活化及再利用具有显著的贡献作用,特别是对于初期形成的枸溶性磷酸钙,其促进效果尤为显著,从而可以考虑减少当季磷肥的施用。但是对于含HAP较多的碱性土壤,仅通过铵态氮肥的施用,短时间内无法达到磷活化释放的效果,这时需要考虑减少HAP沉淀的形成或者增加已形成HAP的溶解。因此,对于土壤中HAP的活化利用可考虑多因素的综合调控,如有机质抑制HAP形成[32]、有机酸介导HAP溶解[33]。总之,挖掘土壤中盈余磷的利用潜力将对磷肥的合理施用具有重要意义,而氮肥对磷的促溶效果也为磷的活化利用及提高土壤的持续供磷能力提供了新的思路。
| [1] |
Shi W, Zhang L M, Wang J S, et al. The subsequent effects of phosphorus fertilization in upland red soils and the underlying mechanisms (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(4): 1100-1111. [石伟, 张丽梅, 王劲松, 等. 磷肥在旱地红壤上的后期效应及其作用机制[J]. 土壤学报, 2022, 59(4): 1100-1111.]
(  0) 0) |
| [2] |
Wang X, Li H G, Cheng L Y, et al. Advances of root-soil interface effect of phosphorus and water interaction and mechanisms of their efficient use (In Chinese)[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(4): 1054-1064. [王昕, 李海港, 程凌云, 等. 磷与水分互作的根土界面效应及其高效利用机制研究进展[J]. 植物营养与肥料学报, 2017, 23(4): 1054-1064.]
(  0) 0) |
| [3] |
Xian J T, Chen X B, Wang S, et al. Phosphorus availability in saline soil: A review (In Chinese)[J]. Soils, 2023, 55(3): 474-486. [咸敬甜, 陈小兵, 王上, 等. 盐渍土磷有效性研究进展与展望[J]. 土壤, 2023, 55(3): 474-486.]
(  0) 0) |
| [4] |
Niu B, Wang Y L. Retention capacity and release potential of soil phosphorus in paddy red soil pedogenic horizons with different planting years (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(6): 1724-1736. [牛犇, 王艳玲. 不同年限稻田红壤发生层土壤磷的固持容量及其释放潜能研究[J]. 土壤学报, 2023, 60(6): 1724-1736.]
(  0) 0) |
| [5] |
Wang L, Wang Y L, Li H, et al. Redundancy analysis of influencing factors of phosphorus availability in red soil upland under long-term fertilization (In Chinese)[J]. Soil and Fertilizer Sciences in China, 2021(1): 17-25. [王蕾, 王艳玲, 李欢, 等. 长期施肥下红壤旱地磷素有效性影响因子的冗余分析[J]. 中国土壤与肥料, 2021(1): 17-25.]
(  0) 0) |
| [6] |
Cai G, Hu Y J, Wang T T, et al. Characteristics and influencing factors of biologically-based phosphorus fractions in the farmland soil (In Chinese)[J]. Environmental Science, 2017, 38(4): 1606-1612. [蔡观, 胡亚军, 王婷婷, 等. 基于生物有效性的农田土壤磷素组分特征及其影响因素分析[J]. 环境科学, 2017, 38(4): 1606-1612.]
(  0) 0) |
| [7] |
Yang J, Xin X L, Zhong X Y, et al. Effects of long-term fertilization on phosphorus adsorption characteristics of fluvo-aquic soils (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(4): 1047-1057. [杨娇, 信秀丽, 钟新月, 等. 长期不同施肥对潮土磷素吸附特征的影响[J]. 土壤学报, 2023, 60(4): 1047-1057.]
(  0) 0) |
| [8] |
Li H, Fan H L, Zhang J M, et al. The phosphorus storage capacity and phosphorus loss risk of red soil profiles in sloping farmland (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(1): 98-109. [李欢, 樊慧琳, 张佳敏, 等. 坡耕地红壤剖面磷的储存容量及其流失风险研究[J]. 土壤学报, 2024, 61(1): 98-109.]
(  0) 0) |
| [9] |
Bi Q F. Different fertilization modes and cultivation years affect soil phosphorus availability and carbon-nitrogen-phosphorus coupling transformations and their microbial mechanisms[D]. Hangzhou: Zhejiang University, 2020.[毕庆芳. 施肥模式和耕作年限影响土壤磷有效性和碳氮磷耦合转化的微生物学机制[D]. 杭州: 浙江大学, 2020.]
(  0) 0) |
| [10] |
Du J X, Liu K L, Huang J, et al. Spatio-temporal evolution characteristics of soil available phosphorus and its response to phosphorus balance in paddy soil in China (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(2): 476-486. [都江雪, 柳开楼, 黄晶, 等. 中国稻田土壤有效磷时空演变特征及其对磷平衡的响应[J]. 土壤学报, 2021, 58(2): 476-486.]
(  0) 0) |
| [11] |
Liu X Y, Yang J S, Tao J Y, et al. Elucidating the effect and interaction mechanism of fulvic acid and nitrogen fertilizer application on phosphorus availability in a salt-affected soil[J]. Journal of Soils and Sediments, 2021, 21(7): 2525-2539. DOI:10.1007/s11368-021-02941-y
(  0) 0) |
| [12] |
Hao Y H. Effects of long-term nitrogen and phosphorus addition on soil carbon, nitrogen, phosphorus and bacterial characteristics in farmland of Loess Plateau[D]. Xi'an: Shaanxi Normal University, 2017.[郝亚辉. 长期氮磷添加对黄土旱塬农田土壤碳氮磷及细菌特征的影响[D]. 西安: 陕西师范大学, 2017.]
(  0) 0) |
| [13] |
Jiao Y P, Qi P, Wang X J, et al. Effects of nitrogen and phosphorus fertilization on inorganic phosphorus forms of typical farmland soil in the dry farming area of the Loess Plateau (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2020, 26(8): 1459-1472. [焦亚鹏, 齐鹏, 王晓娇, 等. 氮磷配施对黄土高原旱作农业区典型农田土壤无机磷形态的影响[J]. 植物营养与肥料学报, 2020, 26(8): 1459-1472.]
(  0) 0) |
| [14] |
Zhu L X, Yue S C, Shen Y F, et al. Effects of nitrogen fertilization and film mulching on soil microbial biomass and enzyme activity of spring maize in semi-arid cropland (In Chinese)[J]. Agricultural Research in the Arid Areas, 2019, 37(1): 130-136. [朱利霞, 岳善超, 沈玉芳, 等. 施氮和覆膜对旱作春玉米农田土壤微生物量和土壤酶活性的影响[J]. 干旱地区农业研究, 2019, 37(1): 130-136.]
(  0) 0) |
| [15] |
Zhang X, Xing Y, Liu Z X, et al. Effects of combined application of nitrogen and phosphorus fertilizer on apple rootstock seedling growth, soil inorganic phosphorus forms and phosphorus utilization (In Chinese)[J]. Journal of Soil and Water Conservation, 2021, 35(4): 237-242. [张鑫, 邢玥, 刘照霞, 等. 氮磷配施对苹果幼苗生长、土壤无机磷形态和磷素利用的影响[J]. 水土保持学报, 2021, 35(4): 237-242.]
(  0) 0) |
| [16] |
Ge X F, Fan Y K, Zhai H, et al. Direct observations of nanoscale brushite dissolution by the concentration-dependent adsorption of phosphate or phytate[J]. Water Research, 2024, 248: 120851.
(  0) 0) |
| [17] |
Newcomb C J, Qafoku N P, Grate J W, et al. Developing a molecular picture of soil organic matter–mineral interactions by quantifying organo–mineral binding[J]. Nature Communications, 2017, 8(1): 396.
(  0) 0) |
| [18] |
Ge X F, Zhang W J, Putnis C V, et al. Molecular mechanisms for the humic acid-enhanced formation of the ordered secondary structure of a conserved catalytic domain in phytase[J]. Physical Chemistry Chemical Physics, 2022, 24(7): 4493-4503.
(  0) 0) |
| [19] |
Ge X F, Wang L J, Zhang W J. Molecular-scale determination of facet- and adsorbent-dependent phosphate adsorption by metal-based adsorbents[J]. Environmental Science: Nano, 2022, 9(9): 3372-3384.
(  0) 0) |
| [20] |
Ge X F, Zhang W J, Putnis C V, et al. Direct observation of humic acid-promoted hydrolysis of phytate through stabilizing a conserved catalytic domain in phytase[J]. Environmental Science: Processes & Impacts, 2022, 24(7): 1082-1093.
(  0) 0) |
| [21] |
Qin L H, Wang L J, Wang B S. Role of alcoholic hydroxyls of dicarboxylic acids in regulating nanoscale dissolution kinetics of dicalcium phosphate dihydrate[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(5): 3920-3928.
(  0) 0) |
| [22] |
Ge X F, Wang L J, Yang X, et al. Alginate promotes soil phosphorus solubilization synergistically with redox-active antibiotics through Fe(Ⅲ)reduction[J]. Environmental Science: Nano, 2022, 9(5): 1699-1711.
(  0) 0) |
| [23] |
Ruiz-Agudo E, Kowacz M, Putnis C V, et al. The role of background electrolytes on the kinetics and mechanism of calcite dissolution[J]. Geochimica et Cosmochimica Acta, 2010, 74(4): 1256-1267.
(  0) 0) |
| [24] |
Espanol M, Mestres G, Luxbacher T, et al. Impact of porosity and electrolyte composition on the surface charge of hydroxyapatite biomaterials[J]. ACS Applied Materials & Interfaces, 2016, 8(1): 908-917.
(  0) 0) |
| [25] |
Ruiz-Agudo E, Urosevic M, Putnis C V, et al. Ion-specific effects on the kinetics of mineral dissolution[J]. Chemical Geology, 2011, 281(3/4): 364-371.
(  0) 0) |
| [26] |
Qin L H, Zhang W J, Lu J W, et al. Direct imaging of nanoscale dissolution of dicalcium phosphate dihydrate by an organic ligand: Concentration matters[J]. Environmental Science & Technology, 2013, 47(23): 13365-13374.
(  0) 0) |
| [27] |
Zhang F S, Huang C D, Shen J B, et al. Green intelligent fertilizer: New insight into making full use of mineral nutrient resources and industrial approach (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(5): 1203-1212. [张福锁, 黄成东, 申建波, 等. 绿色智能肥料: 矿产资源养分全量利用的创新思路与产业化途径[J]. 土壤学报, 2023, 60(5): 1203-1212.]
(  0) 0) |
| [28] |
Zhang Q S. Nitrogen, phosphorus and potassium nutrient balance and optimization approaches of major crops in China[D]. Beijing: China Agricultural University, 2021.[张青松. 中国主要作物氮磷钾养分平衡与优化途径[D]. 北京: 中国农业大学, 2021.]
(  0) 0) |
| [29] |
Zhang W, Chen X J, Ma L, et al. Re-prediction of phosphate fertilizer demand in China based on agriculture green development (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(5): 1389-1397. [张伟, 陈轩敬, 马林, 等. 再论中国磷肥需求预测--基于农业绿色发展视角[J]. 土壤学报, 2023, 60(5): 1389-1397.]
(  0) 0) |
| [30] |
Cheng Y L, Cheng X L, Zou D Y. Long-term located fertilizer experiments after 15-years in brown soil forms and availability of phosphate nutrient (In Chinese)[J]. Chinese Journal of Soil Science, 2009, 40(6): 1362-1366. [程艳丽, 程希雷, 邹德乙. 棕壤长期定位施肥15年后磷素形态及有效性[J]. 土壤通报, 2009, 40(6): 1362-1366.]
(  0) 0) |
| [31] |
Zhao H M, Wang S Q, Zhao X, et al. Visual analysis for soil C, N and P interaction based on citespace analysis (In Chinese)[J]. Soils, 2022, 54(4): 682-690. [赵洪猛, 王慎强, 赵旭, 等. 基于Citespace的土壤碳氮磷交互研究可视化分析[J]. 土壤, 2022, 54(4): 682-690.]
(  0) 0) |
| [32] |
Ge X F, Wang L J, Zhang W J, et al. Molecular understanding of humic acid-limited phosphate precipitation and transformation[J]. Environmental Science & Technology, 2020, 54(1): 207-215.
(  0) 0) |
| [33] |
Ge X F, Wang L J, Zhang W J. Direct observation of alginate-promoted soil phosphorus availability[J]. ACS Sustainable Chemistry & Engineering, 2022, 10(24): 8011-8021.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


