2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
苯、甲苯、乙苯、二甲苯(BTEX)是石油化工污染场地常见的污染物类型之一,同时也被欧美等国列入恶臭污染物优控名录[1]。因其具有高毒性及三致效应,长期接触可导致神经损伤[2],已被世界卫生组织确认为强烈致癌物质。而且因其具有强挥发性、迁移性以及难闻气味[3],能通过挥发以及迁移扩散污染室内空气及地下水,对当地居民的生活造成困扰,也对当地居民的健康和生态造成风险。因此对BTEX污染场地土壤的修复一直受到各界广泛的关注。
为修复BTEX污染场地土壤,相关研究者提出了一系列修复方法,例如物理吸附[4]、多相抽提、生物降解[5]和化学氧化[6],其中高级氧化技术因可在短时间内通过自由基将有机污染物转化为较低分子量的化合物,快速高效降低其浓度和毒性[7],受到广泛和持续的关注。高级氧化技术常用的氧化剂有过硫酸盐(PS)[8-9]、H2O2[10]、O3[11]和KMnO4[12]等。因过硫酸盐具有较好的水溶性和稳定性,且其产生的SO4˙–具有较高的氧化还原电位(2.5~3.1eV)、较高选择性和较长半衰期(较羟基自由基寿命长数千倍)等特点[13],过硫酸盐的高级氧化工艺在近十多年得到越来越广泛的关注。
与其他高级氧化技术相同,过硫酸盐高级氧化技术的研究重点在于如何有效活化过硫酸盐(PS)并产生持续的自由基。已知的PS活化方式有过渡金属[14-15]、超声波[16]、热、NaOH[17]、紫外照射[18]等。通常采用高压注射方式将过硫酸盐注入场地污染区,因此均相的螯合亚铁[19]、NaOH、H2O2以及高温等活化方式的运用较为广泛。然而上述活化方式依然存在诸多问题,例如,螯合铁容易在活化初期与产生的自由基发生自淬灭反应[20],NaOH活化体系为保持pH大于10的最佳条件而需要多次注射以防止体系pH迅速下降[21],H2O2活化的最大问题是其自身的不稳定性[13],高温则需要额外的能量和加热设备。因此,研发具有稳定催化PS产生自由基、受pH影响小、寿命长、使用方便等优势的活化剂成为研究的热点。铁基材料由于安全廉价、易获得、低毒性等特点,作为还原剂以及高级氧化反应的催化剂,广泛用于各种污染场地的治理[22]。纵观铁基材料在污染场地的使用,研发经历了铁矿物、工业铁粉、纳米零价铁(nZVI)、硫化纳米零价铁(S-nZVI)的历程[23-24],总体趋势为铁基材料的微纳米化及表面修饰[25],改善其在场地使用中的传输性、高效性、长效性,目前,硫化纳米零价铁的制备、性能及应用是研究的焦点。表面硫化处理不仅保持了nZVI的高反应性,抑制其易团聚性以及与水的析氢反应,而且还使其具有较好的稳定性、电子传递的专一性以及对污染物降解的高效性[26-27]。
同时,生物质炭(BC)因具有高比表面积、丰富的含氧基团和持久性自由基[28-29],其作为载体能有效提高S-nZVI的分散性和稳定性,增强电子转移效率,从而提高S-nZVI的反应活性。Xu等[30]研究了硫化类型和颗粒特性对S-nZVI的选择性和反应活性的影响,发现一步液相还原法合成的S-nZVI的降解效果更好,选择性更强,寿命更长;Jiang等[8]研究发现生物质炭负载硫化纳米零价铁(S-nZVI@ BC)能有效活化PS,达到对阿特拉津100%的降解率,且多次循环使用后仍保持着较高的催化活性;Gao等[31]发现S-nZVI@BC/PS体系可在较宽的pH范围内去除环丙沙星,并证明了该材料具有稳定性和可重复利用性。上述研究表明S-nZVI@BC活化PS降解有机物污染物的可行性和高效性。然而,该体系对场地恶臭类污染物BTEX的降解效果及机理研究较少,因此研究S-nZVI@BC活化PS降解BTEX的效果、规律和机制具有一定理论和现实意义。
本研究采用一步液相还原法合成S-nZVI@ BC[30],评估了S/Fe摩尔比、Fe/C质量比、PS浓度、初始pH及材料投加量对BTEX降解效果的影响,根据反应过程中PS浓度及总铁浸出率变化推测反应趋势,通过化学探针实验及电子顺磁共振(EPR)鉴定主要活性自由基,并结合以上实验结果及气相色谱质谱联用仪(GC-MS)检测到的中间产物提出BTEX可能的降解路径。该研究为高级氧化技术修复恶臭污染场地土壤提供了科学依据。
1 材料与方法 1.1 实验材料与试剂供试土壤采自南京郊区某地0~20 cm的表层土壤。土壤基本性质如下:土壤有机质10.32 g·kg–1,pH6.8。砂粒(> 0.05 mm)、粉粒(0.05~0.002 mm)和黏粒(< 0.002 mm)的体积百分含量分别23.22%、53.72%和24.06%。土壤样品于通风处避光风干,60目筛网过筛,常温保存备用。由于BTEX极容易挥发,因此污染土采用人工即时添加BTEX制备,即称取1 g土壤于20 mL顶空瓶中,加入40 µL的污染物储备液使土壤中BTEX总浓度约为210 μg·g–1。
生物质炭(BC)采用玉米秸秆为原料,在管式炉中热解制备,热解温度为600℃,将制备的生物质炭研磨过100目筛后用去离子水多次清洗,并置于烘箱干燥,装入自封袋记录备用。
分析纯的苯、甲苯、乙苯、二甲苯均购自上海安谱实验科技有限公司,七水合硫酸亚铁、连二亚硫酸钠、过硫酸钠、硫代硫酸钠均为分析纯,购自国药集团化学试剂有限公司,5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)购自同仁化学,甲醇、无水乙醇、叔丁醇均为分析纯,购自南京试剂股份有限公司,对苯醌(分析纯)购自上海麦克林生化科技股份有限公司,硼氢化钠(分析纯)购自上海凌峰化学试剂有限公司。
1.2 PS活化材料的制备S-nZVI@BC参考前人研究[30],采用一步液相还原合成法制备,步骤如下:氮气吹扫条件下,在三口烧瓶中,将一定质量FeSO4·7H2O溶于200mL去离子水,而后称取一定量的生物质炭放置于三口烧瓶中,与Fe2+溶液充分搅拌混合1h后,将硼氢化钠和连二亚硫酸钠(浓度根据所需材料硫铁摩尔比配置)用蠕动泵逐滴加入到上述混合体系中,滴加结束后继续反应1h,然后利用磁铁沉降法分离材料,弃上清液,用无水乙醇和去离子水清洗材料2-3次,磁铁沉降分离出材料,将其放入真空冷冻干燥机中进行干燥,干燥后研磨并抽真空储存备用。在上述条件下,通过改变生物炭和连二亚硫酸钠用量,分别制备不同铁碳比(1/1、1/2、1/3)材料以及不同硫铁比(1/2、1/4、1/6)材料。基于S-nZVI@BC的制备,在不添加生物质炭和连二亚硫酸钠的情况下利用液相还原法制备nZVI,不添加生物质炭的情况下制备S-nZVI,不添加连二亚硫酸钠的情况下制备nZVI@BC。
1.3 氧化降解实验设计苯、甲苯、乙苯、二甲苯各取140 µL,用少量甲醇溶解后,于100 mL容量瓶中定容,得混合BTEX储备液,密封置于冰箱中保存。
在配置好污染土的顶空瓶中加入一定量的S-nZVI@BC和过硫酸钠溶液,反应体系的土水质量比约为1︰5,快速盖好顶空瓶盖,置于水浴摇床,温度设置为25℃,振荡频率为200 r·min–1,分别于10、20、30、40、50、60、90和120 min进行破坏性取样,即用气密性进样针向顶空瓶反应体系中加入2 mL饱和硫代硫酸钠溶液并置于冰水中以终止反应。然后利用顶空-气相(HS-GC)联用仪对顶空瓶中剩余BTEX浓度进行测定,利用紫外分光光度法测定体系中过硫酸盐浓度及总铁含量。通过研究合成材料的铁碳比、硫铁比(同2.2.1)、过硫酸盐浓度(10、30、50 mmol·L–1)、材料投加量(0.005、0.010、0.015 g·g–1)和反应体系初始pH(2、3、5、7、9,通过H2SO4和NaOH滴定调节)对BTEX降解的影响,探究材料的最佳合成条件和降解的最佳反应条件。所有处理均设置三个重复、三个空白。
1.4 分析方法材料的微观形貌采用扫描电子显微镜结合能量色散光谱仪(SEM-EDS)(ZEISS Sigma 300,德国)及透射电子显微镜(TEM)(FEI Tecnai F20,美国)观察;材料的物质结构和物相组成采用X射线衍射仪(XRD)(Bruker D2 Phaser,德国)分析,铜靶为射线源(波长为0.154 nm),扫描角度范围为10~90 °,扫描速度为2 °·min–1;利用傅里叶红外光谱仪(FTIR)(Thermo Scientifc Nicolet iS20,美国)测试生物质炭改性前后表面官能团的变化信息;材料的元素构成及价态信息采用X射线光电子能谱(XPS)(Thermo Scientific K-Alpha,美国)分析。
BTEX的浓度采用气相色谱-火焰离子化检测器(GC-FID)(安捷伦7890B,美国)测定,该色谱法配有顶空自动采样器(安捷伦7697A,美国),HP-5色谱柱(30 m×320 μm×0.25 μm),载气为高纯氮气,分流比为10︰1,色谱柱程序升温为:初温40 ℃,保持6 min,以5 ℃·min–1的速度升至110 ℃,保持1 min,再以6 ℃·min–1的速度升至200 ℃,保持1 min。氢气及空气流量分别为45 mL·min–1和450 mL·min–1,采用外标法定量。
化学探针实验用于反应体系中主导自由基的鉴定,分别使用硫代硫酸钠、叔丁醇、对苯醌作为SO4˙–、HO˙及O2˙–的淬灭剂进行自由基清除实验(淬灭剂和氧化剂的物质量比为10︰1),在反应开始前提前向反应体系中加入相应的自由基淬灭剂,并于2 h后进行破坏性取样,采用HS- GC测定顶空瓶反应系统中剩余BTEX浓度,具体参见1.3。
体系中产生的自由基物种采用电子顺磁共振(Bruker E500-9.5/12,德国)鉴定,以DMPO为自由基捕获剂,先向2 mL的液相进样瓶中加入一定量2 mol·L–1的DMPO溶液,然后加入一定量的S-nZVI@BC和过硫酸盐溶液(使体系中S-nZVI浓度为0.002 g·mL–1,PS浓度为5 mmol·L–1),在超纯水体系下检测SO4˙–、HO˙,在甲醇体系下检测O2˙–。
四种苯系物的降解产物利用气质联用仪(GC-MS)测定,设备配备吹扫捕集仪、DB-624色谱柱(60 m×250 μm×1.4 μm),初始烘箱温度设定为38 ℃,持续1.8 min,随后以10 ℃·min–1的速度升至120 ℃,再以15 ℃·min–1升至240℃,并保持恒定4 min,采用电子轰击(EI)电离模式,载气为氦气(He),其速度设定为1 mL·min–1,进样量为1 μL,分流比为30/1。
2 结果与讨论 2.1 材料的表征扫描电镜(SEM)观察显示,如图 1d,纳米零价铁外观呈球状且形状大小均匀,且由于其高表面能和磁相互吸引力而聚集成链状结构;经硫改性后,由于S的掺杂,使S-nZVI(图 1e)尺寸大于nZVI,且表面粗糙。如图 1a~图 1c、图 1f,S-nZVI@BC的SEM图像显示硫化纳米零价铁较为均匀地分散在生物质炭的表面,有效增大了其比表面积及反应活性位点。如图 1g、图 1h,EDS元素分析及元素谱图显示,催化材料主要由C、Fe、S、O四种元素组成,且四种元素分布较为均匀。

|
注:S-nZVI@BC为生物炭负载硫化纳米零价铁,nZVI为纳米零价铁,S-nZVI为硫化纳米零价铁。下同。 Note:S-nZVI@BC is Sulfidized Nano-zero-valent Iron Loaded on Biochar,nZVI is Nano-zero-valent Iron,S-nZVI is Sulfidized Nano-zero-valent Iron. The same as below. 图 1 S-nZVI@BC(a~c)的具有代表性的扫描电子显微镜(SEM)图像,nZVI(d)、S-nZVI(e)、S-nZVI@BC(f)的高倍SEM图像,S-nZVI@BC的能量色散光谱(EDS)元素分析(g)和元素图谱(h) Fig. 1 Representative scanning electron microscope(SEM)images of S-nZVI@BC(a-c), high-resolution SEM images of nZVI(d), S-nZVI(e), S-nZVI@BC(f), energy dispersive spectrometer(EDS)elemental analysis(g), and elemental mapping(h) |
如图 2a透射电镜结果所示,纳米零价铁呈形状大小均匀的球状结构,且由于其具有磁性而聚集成链状结构,而图 2bS-nZVI呈核壳结构,表明纳米零价铁经过硫化改性后,表面形成了一层片状结构,通常为FeS,该结构可有效减缓nZVI的团聚及氧化[32]。图 2c显示S-nZVI@BC相较于S-nZVI颗粒更分散,表明S-nZVI@BC经生物质炭负载后负载的S-nZVI颗粒将具有更大的比表面积和活性点位。

|
图 2 nZVI(a)、S-nZVI(b)、S-nZVI@BC(c)的透射电子显微镜(TEM)图像 Fig. 2 Representative transmission electron microscope(TEM)images of nZVI(a), S-nZVI(b), and S-nZVI@BC(c) |
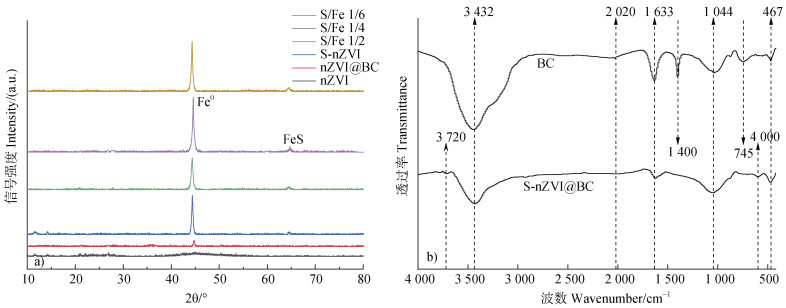
如图 3a,XRD结果显示所有样品在44.6°出现明显的Fe0特征峰,这证实在合成的过程中Fe2+被成功还原为Fe0;与nZVI、nZVI@BC及S-nZVI相比较,S-nZVI@BC的nZVI的衍射峰强度显著增加;此外,一个新的特征峰出现在65°,证实该材料中有FeS的存在[33],nZVI已发生了硫化改性;且从图中也可看出,当S/Fe的摩尔比为1/4时,Fe0和FeS的特征峰最强。如图 3b,FTIR测定显示3 432 cm–1附近均存在吸收峰,推测该吸收峰为生物质炭表面的羟基官能团氢氧键拉伸振动所造成,1 633 cm–1附近的吸收峰为生物质炭本身携带的-COOH官能团碳氧双键伸缩振动造成,1 044 cm–1附近的吸收峰代表C-O键的振动[34];而S-nZVI@BC于这三个位置特征峰的强度与BC相比有所下降,表明S-nZVI在BC上负载时二者可能存在相互作用。S-nZVI@BC于1 400 cm–1和745 cm–1附近的吸收峰消失,表明经过改性后的生物质炭由于表面被铁基材料覆盖导致官能团数量减少,而S-nZVI@BC于599 cm–1附近出现的新型谱带,可能由零价铁表面氧化腐蚀生成的Fe-O键振动造成,也可能由硫化物的官能团化学键振动造成[35],即证实硫化改性的成功发生。
|
图 3 不同催化材料的X射线衍射(XRD)图谱(a)及生物质炭(BC)和S-nZVI@BC的红外光谱图(b) Fig. 3 X-Ray Diffraction(XRD)analysis of different catalyst materials(a), infrared spectra of biochar(BC)and S-nZVI@BC(b) |
S-nZVI@BC的XPS表征分析结果(本文未展示图片)显示,总谱图存在Fe2p、O1s、C1s、S2p四类峰,这证实了S-nZVI@BC表面存在Fe、O、C、S元素。而在分峰图谱中,碳元素被拟合为三个峰,即284.8 eV处的C-C或C=C官能团、286.18 eV的C-O、288.9 eV的C=O或者O-C=O基团[36],表明S-nZVI未覆盖全部生物质炭表面,且生物质炭自身的含碳量和含碳基团的种类较为丰富。O1s的原始峰分为了四个峰:529.38 eV的Fe3O4、530.58 eV的Fe-O、531.48 eV的C-O/Fe-O-H和532.78 eV的C=O基团[37]。Fe2p原始峰分为四个峰,其中结合能为726.68 eV、712.78 eV可分别对应着Fe2p 1/2和Fe2p 3/2,除此以外,712.78 eV处的峰也可能归因于零价铁的硫化而导致Fe(Ⅲ)-S的存在,而718.5 eV对应于Fe0[38],这表明Fe2+已成功被还原为零价铁。S2p的分峰光谱图有三个特征峰,即160.68 eV的S2–、163.2 eV的Sn–及168.1eV的SO42–,S2–会被空气氧化可能产生SO42–,而于活化PS的过程中,S2–易失电子,促进Fe(Ⅲ)向Fe(Ⅱ)的转化[39]。
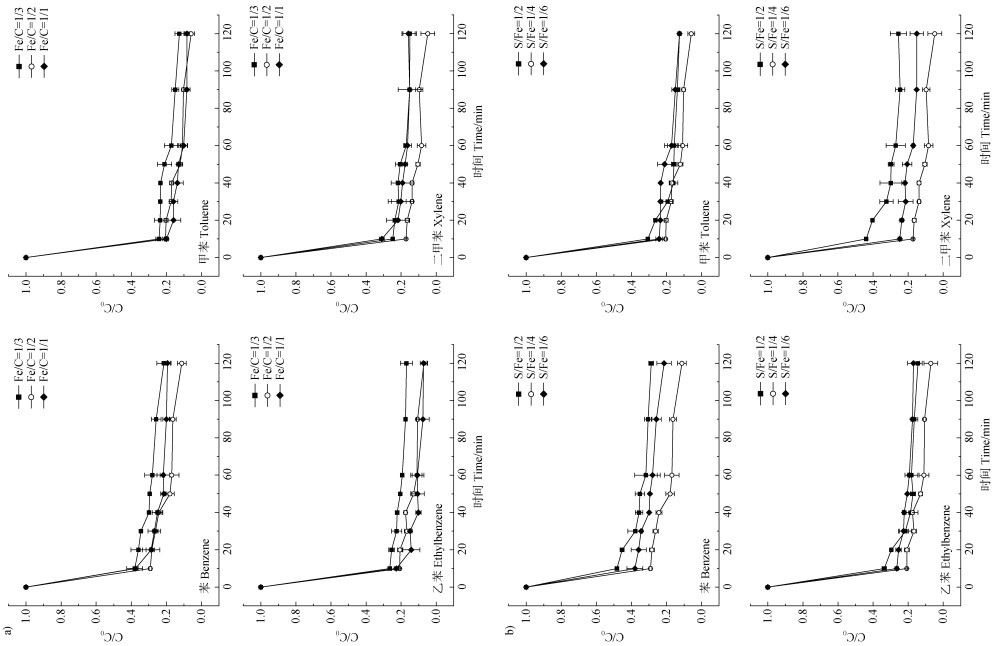
2.2 不同条件下S-nZVI@BC/PS对BTEX的降解效果 2.2.1 S-nZVI@BC合成条件对BTEX降解的影响不同铁炭比合成的S-nZVI@BC活化PS对BTEX的降解结果如图 4a所示,随着Fe/C质量比由1/3增至1/1的过程,BTEX的降解效率均呈先增高后降低的趋势,当Fe/C的质量比为1/2时,BTEX的降解效果最佳,苯、甲苯、乙苯、二甲苯的降解率于2 h分别可达到90%、94.2%、93%、95.3%。可能的原因一是生物质炭较大的表面积、丰富的碳孔能增加对BTEX的吸附量,从而增大污染物与S-nZVI上反应点的接触面,其次是一定程度上BC的负载能有效分散S-nZVI从而减缓其氧化。Fe/C质量比为1/3时,相较于1/2时降解率有所降低,这可能是由于生物质炭的过量负载会掩盖S-nZVI的活性位点,导致降解效率降低[40]。不同S/Fe摩尔比的S-nZVI@BC活化过硫酸盐降解BTEX的结果如图 4b所示,随着硫化程度的降低,BTEX的降解效率均呈现先增高后降低的趋势,于S/Fe为1/4时有最佳降解效果,该结果与XRD的分析结果(图 3)一致,即S/Fe为1/4时Fe0和FeS的特征峰最强,可见硫化程度过高或过低均会影响S-nZVI@BC活化PS的性能。相关研究也表明,适当程度的硫化使材料表面形成了FeS,其具有较Fe0更高的电极电势,可加快电子转移速率,同时也可有效减缓nZVI的氧化[8];硫化程度过低,形成的硫化物保护nZVI的作用有限;而硫化程度过高,会产生大量的硫铁化物覆盖在铁基表面,导致电子的转移速率降低,与污染物的接触位点减少。因此,在后续实验中采用了1/4的硫铁比。
|
注:C0为污染物的初始浓度,Ct为不同时间污染物的浓度。下同。 Note:C0 is the initial concentration of the contaminant,and Ct is the concentration of the contaminant at different times. The same as below. 图 4 不同铁碳质量比(a)及硫铁摩尔比(b)对苯系物(BTEX)降解的影响 Fig. 4 The effect of different Fe/C mass ratios(a)and S/Fe mole ratios(b)on benzene congeners(BTEX)degradation |
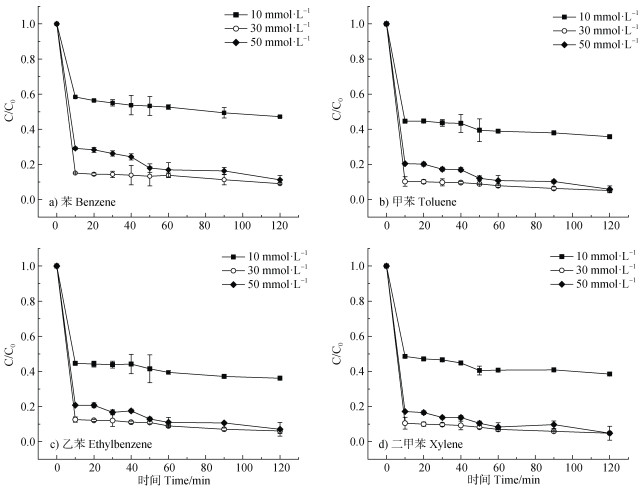
S-nZVI@BC活化不同浓度过硫酸盐降解BTEX的结果如图 5所示,当PS的浓度从10 mmol·L–1增至50 mmol·L–1,BTEX的降解率均先增高后降低,当PS浓度为30 mmol·L–1时,苯、乙苯的降解率在10 min内超过85%,而甲苯、二甲苯去除率达到90%。有研究表明,随着PS浓度的增加,促进活性物质的产生,BTEX达到更高的降解效率;但PS浓度过高时,其可能会氧化S-nZVI,使其表面钝化,抑制其溶解,且过量的PS可能会造成氧化性自由基的淬灭,从而使氧化降解效率降低[8]。而在最佳PS浓度反应体系中,随着反应进程PS浓度先快速降低而后趋于平稳,与此同时,总铁浸出率先快速升高而后趋于平稳,二者具有较好的相关性(PS浓度变化和总铁浸出率图未展示)。PS浓度的变化趋势同BTEX的降解趋势(图 5)一致,即前20 min内大幅下降,这是由于过硫酸盐快速将Fe0氧化为Fe2+而被消耗,同时,H+攻击S-nZVI@BC会大量持续释放Fe2+,Fe2+通过转移电子给过硫酸盐,致使过硫酸盐中的氧氧键断裂而进一步消耗,形成SO4˙–,且Fe2+被氧化为Fe3+,同时Fe3+和过硫酸盐会进一步反应使Fe2+再生而消耗PS,这也解释了前20 min总铁浸出率迅速上升的原因。而后,PS浓度变化幅度降低,证实PS活化程度的降低,这主要是因为随着溶液中H+被不断消耗,S-nZVI@BC受腐蚀程度减弱,Fe2+的生成速率也趋于平缓,故PS被活化的速率相对下降。
|
图 5 不同过硫酸盐(PS)浓度对BTEX降解的影响 Fig. 5 The effect of Persulfate(PS)concentrations on BTEX degradation |
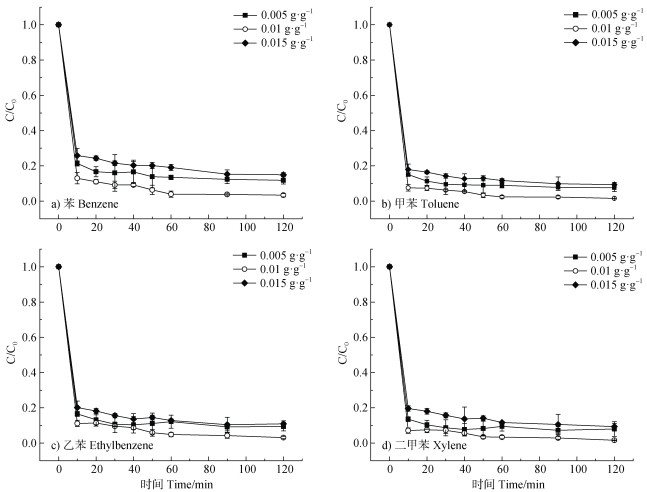
不同活化剂用量对BTEX降解的影响如图 6所示,当活化剂投加量为0.01 g·g–1时,四种污染物降解效果最佳,2 h内的降解率均可达95%以上,而继续增加投加量,BTEX的降解率有所降低。该现象可能由以下原因导致:首先,活化剂本身具有一定的磁性,可能会发生团聚从而降低其比表面积及表面活性位点;其次,过量的活化剂会迅速产生和释放Fe2+,Fe2+被反应体系中自由基直接氧化为Fe3+,使自由基消耗而无法氧化降解有机污染物[41]。因此,本研究选择0.01 g·g–1作为最佳投加量,进一步说明该催化剂对PS的活性高,仅需少量催化剂即可得到理想的降解效果,既可节约成本,又能减少对环境的影响。
|
图 6 活化剂不同投加量对BTEX降解的影响 Fig. 6 The effect of different catalyst dosages on BTEX degradation |
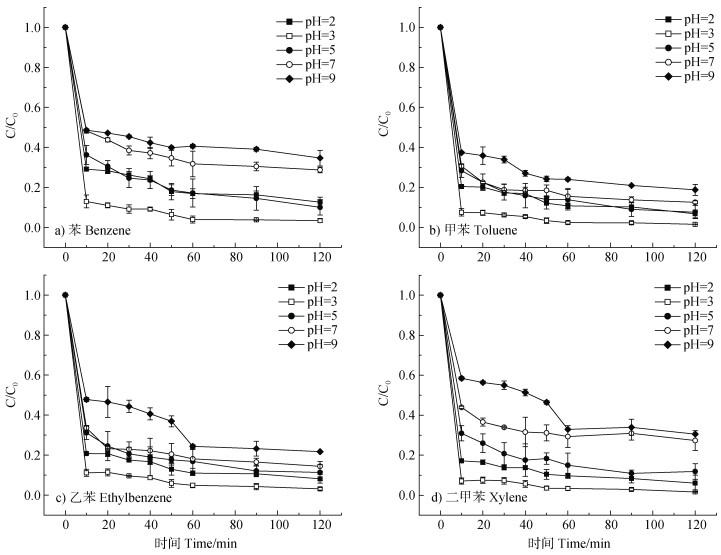
不同pH下BTEX的降解效果如图 7所示,S-nZVI@BC/PS体系在pH为2、3和5时对BTEX具有较好的降解效果,而随着pH的持续升高,降解率呈下降趋势,当pH为9时,四种污染物的降解率分别达到65.4%、81.3%、78.3%、70.5%,即S-nZVI@BC/PS体系在酸性环境中催化PS降解BTEX的效率要优于中性和碱性环境[41]。相较于芬顿(Fenton)氧化、PS的碱活化氧化等体系,S-nZVI@BC/PS体系在较宽的pH范围内具有良好的降解效果,其中,pH=3时降解效果最好。该现象主要是由于S-nZVI@BC在酸性条件下更易被腐蚀,从而去除其表面的铁氧化物,形成更高的表面活性环境,加速催化PS产生SO4˙–,从而高效降解污染物;但酸度过高也可能会造成大量铁的腐蚀消耗[10],从而降低BTEX的降解率;而在中碱性条件下,由于较多OH–的存在,可能会生成铁的氢氧化物附着在材料表面,导致材料钝化,抑制nZVI的电子传递反应和PS的活化[20]。
|
图 7 反应体系pH对BTEX降解的影响 Fig. 7 The effect of different pH conditions on BTEX degradation |
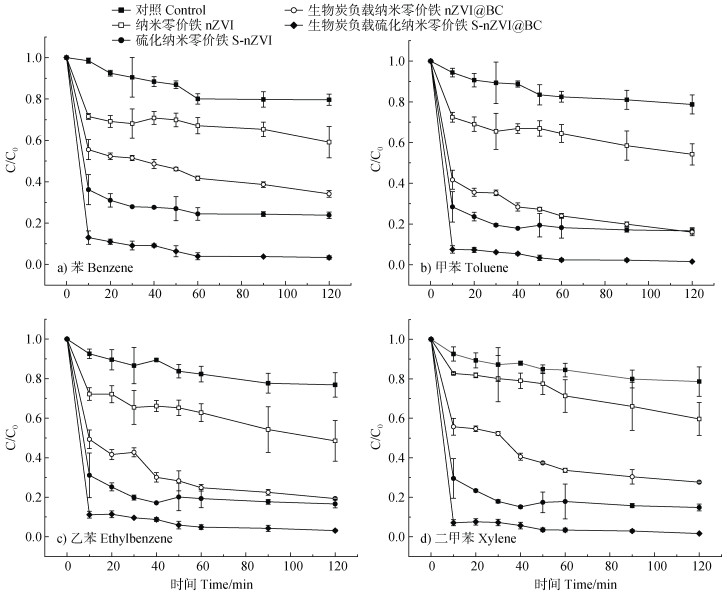
不同催化体系下BTEX的降解效果如图 8所示,呈现的总体规律为:PS < nZVI/PS < nZVI@BC/PS < S-nZVI/PS < S-nZVI@BC/PS。无活化剂的过硫酸盐体系作对照,2 h内仅有约20%的降解效果,相较之下,硫化改性后的纳米零价铁与nZVI@BC相比,nZVI具有更好的降解性能;而S-nZVI@BC综合了硫化和生物质炭负载两者的优势,对BTEX有最佳的降解效果,BTEX降解率于2 h内均可达到96%以上,其中甲苯和二甲苯可达98%。该规律是由于S-nZVI的硫化铁层可有效减缓nZVI的腐蚀速度,改善材料的疏水性能和电子传递,且生物质炭负载能提高nZVI的分散性,减缓其氧化。
|
图 8 不同活化剂下BTEX的降解效果 Fig. 8 The effect of different catalytic systems on BTEX degradation |
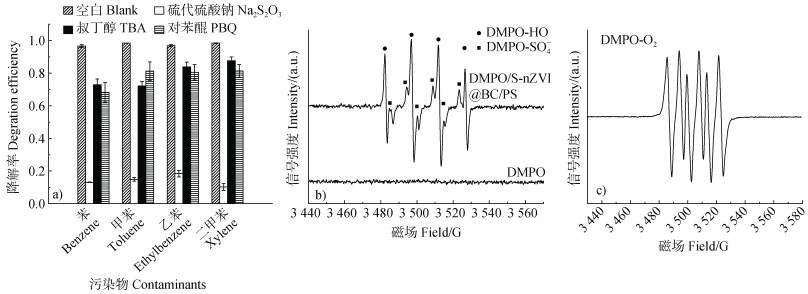
基于氧化体系条件的研究,在最佳降解效果的反应体系中使用硫代硫酸钠、叔丁醇、对苯醌分别作为SO4˙–、HO˙及O2˙–的淬灭剂进行化学探针实验,以便确定体系中起主导作用的自由基。结果如图 9a所示,四种苯系物的反应体系中,硫代硫酸钠的添加均导致降解效率低于20%,而硫代硫酸钠是SO4˙–淬灭剂,表明SO4˙–在氧化降解体系中起着主要作用,而HO˙和O2˙–作用相对较小,可以推测PS在S-nZVI@BC的活化下产生大量的SO4˙–。EPR测试结果如图 9b和图 9c所示,反应体系中检测到SO4˙–、HO˙及O2˙–。值得注意的是,虽然EPR图谱中DMPO-HO的信号高于DMPO-SO– 4,但这并不能代表HO˙对四种污染物的降解贡献高于SO4˙–,而是由于DMPO对HO˙的捕获能力相对较强,并且SO4˙–将自身电子传递给H2O从而转化为HO˙。综上所述,SO4˙–是形成HO˙以及降解BTEX的主要驱动力。
|
注:DMPO为二甲基吡啶N-氧化物。 Note:DMPO is Dimethyl pyridine N-oxide. 图 9 自由基淬灭实验及EPR(Electron Paramagnetic Resonance)测试图谱 Fig. 9 Free radical quenching experiments and EPR(Electron Paramagnetic Resonance)test pattern |
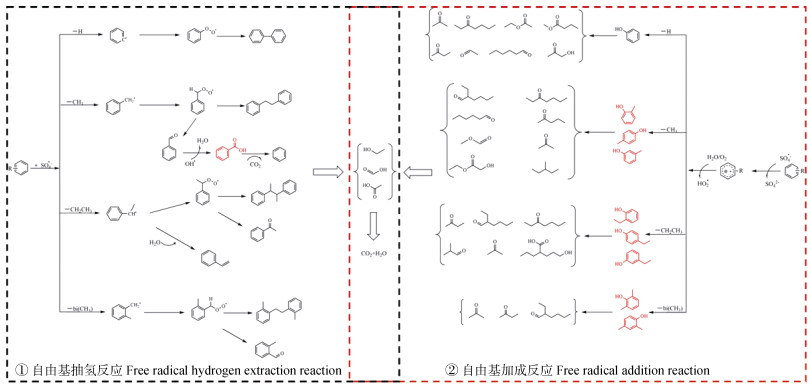
利用吹扫捕集-气质联用仪对产物进行鉴定,基于检测结果和前人的研究[19,42],提出了BTEX两种可能的降解途径。即自由基抽氢(图 10途径①)和自由基加成反应(图 10途径②)。在途径①中,SO4˙–通过抽取氢原子产生中间体苯自由基及苄基自由基,并进一步氧化转化为诸如苯甲醛、苯乙酮、苯乙烯和2-甲基苯甲醛等中间体,并且抽氢反应产生的中间体自由基也会通过二聚反应生成联苯、联苄、二甲基联苄等二聚产物;在途径②中,SO4˙–加成苯环而后从苯环中去除电子,生成有机自由基阳离子,并进一步氧化生成酚类化合物,而后可能氧化产生醌类、酸酐类化合物,随后氧化开环断链,因此,体系中能检测到链状的醛类、酮类、酯类、烷烃及羟基酸类化合物以及乙醇、甲酸、乙酸等更小的分子化合物,并最终矿化为CO2、H2O。而其中标红的产物(如苯甲酸、甲基酚类、乙基酚类、二甲基酚类)及推测的醌类及酸酐类化合物可能由于浓度太低,无法通过GC/MS检测出来,但不能排除这些中间产物的形成。
|
图 10 S-nZVI@BC/ PS氧化系统降解BTEX的路径 Fig. 10 Degradation pathway of BTEX by S-nZVI@BC/PS oxidation process |
本研究利用S-nZVI@BC/PS系统实现了BTEX的高效去除并探究其降解机理,主要结论如下:(1)在pH=3、S/Fe=1/4、Fe/C=1/2、材料投加量为0.01 g·g –1、PS浓度为30 mmol·L–1的条件下,S-nZVI@BC/PS系统对土壤中BTEX有着最佳的降解效果。(2)比较了六种不同催化剂体系下BTEX的降解效果,结果表明:PS < nZVI/PS < nZVI@BC/PS < S-nZVI/PS < S-nZVI@BC/PS,这意味着硫改性及生物质炭的负载有效提高了nZVI的稳定性。(3)根据反应过程中PS浓度及总铁浸出率变化推测反应趋势,通过化学探针实验及电子顺磁共振实验(EPR)确定SO4˙–为反应过程中的主要活性物质,结合BTEX的转化产物,提出了自由基抽氢和自由基加成两条降解途径。本研究为土壤中恶臭污染物的高级氧化降解技术的建立和优化提供了理论支撑。
| [1] |
Lu J, Huang Y W, Huang C. Hazardous volatile organic compound emission inventory study and its application in a typical chemical industry in the Yangtze River Delta (In Chinese)[J]. Environmental Science, 2019, 40(11): 4856-4861. [鲁君, 黄奕玮, 黄成. 典型化工行业有害VOCs排放清单及长三角地区应用[J]. 环境科学, 2019, 40(11): 4856-4861.]
(  0) 0) |
| [2] |
Mohamed M, Ouki S. Removal mechanisms of toluene from aqueous solutions by chitin and chitosan[J]. Industrial & Engineering Chemistry Research, 2011, 50(16): 9557-9563.
(  0) 0) |
| [3] |
Weelink S A B, van Eekert M H A, Stams A J M. Degradation of BTEX by anaerobic bacteria: Physiology and application[J]. Reviews in Environmental Science and Bio/Technology, 2010, 9(4): 359-385. DOI:10.1007/s11157-010-9219-2
(  0) 0) |
| [4] |
Su F S, Lu C, Hu S. Adsorption of benzene, toluene, ethylbenzene and p-xylene by NaOCl-oxidized carbon nanotubes[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2010, 353(1): 83-91.
(  0) 0) |
| [5] |
Jin H M, Choi E J, Jeon C O. Isolation of a BTEX-degrading bacterium, Janibacter sp. SB2, from a sea-tidal flat and optimization of biodegradation conditions[J]. Bioresource Technology, 2013, 145: 57-64. DOI:10.1016/j.biortech.2013.02.004
(  0) 0) |
| [6] |
Pepino Minetti R C, Macaño H R, Britch J, et al. In situ chemical oxidation of BTEX and MTBE by ferrate: pH dependence and stability[J]. Journal of Hazardous Materials, 2017, 324: 448-456. DOI:10.1016/j.jhazmat.2016.11.010
(  0) 0) |
| [7] |
Priyadarshini M, Das I, Ghangrekar M M, et al. Advanced oxidation processes: Performance, advantages, and scale-up of emerging technologies[J]. Journal of Environmental Management, 2022, 316: 115295. DOI:10.1016/j.jenvman.2022.115295
(  0) 0) |
| [8] |
Jiang Q, Jiang S M, Li H, et al. A stable biochar supported S-nZVI to activate persulfate for effective dichlorination of atrazine[J]. Chemical Engineering Journal, 2022, 431: 133937. DOI:10.1016/j.cej.2021.133937
(  0) 0) |
| [9] |
Kiejza D, Kotowska U, Polińska W, et al. Peracids - New oxidants in advanced oxidation processes: The use of peracetic acid, peroxymonosulfate, and persulfate salts in the removal of organic micropollutants of emerging concern − A review[J]. Science of the Total Environment, 2021, 790: 148195. DOI:10.1016/j.scitotenv.2021.148195
(  0) 0) |
| [10] |
Babuponnusami A, Muthukumar K. Advanced oxidation of phenol: A comparison between Fenton, electro-Fenton, sono-electro-Fenton and photo-electro- Fenton processes[J]. Chemical Engineering Journal, 2012, 183: 1-9. DOI:10.1016/j.cej.2011.12.010
(  0) 0) |
| [11] |
Li X, Luo T, Wang Y X, et al. Improving the degradation of benzo[a]pyrene and soil biodegradability by enhanced ozonation with mechanical agitation[J]. Chemical Engineering Journal, 2021, 423: 130056. DOI:10.1016/j.cej.2021.130056
(  0) 0) |
| [12] |
Boulangé M, Lorgeoux C, Biache C, et al. Fenton-like and potassium permanganate oxidations of PAH-contaminated soils: Impact of oxidant doses on PAH and polar PAC(polycyclic aromatic compound)behavior[J]. Chemosphere, 2019, 224: 437-444. DOI:10.1016/j.chemosphere.2019.02.108
(  0) 0) |
| [13] |
Shang K F, Li W F, Wang X J, et al. Degradation of p-nitrophenol by DBD plasma/Fe2+/persulfate oxidation process[J]. Separation and Purification Technology, 2019, 218: 106-112. DOI:10.1016/j.seppur.2019.02.046
(  0) 0) |
| [14] |
Li J J, Liang Y Q, Jin P L, et al. Heterogeneous metal-activated persulfate and electrochemically activated persulfate: A review[J]. Catalysts, 2022, 12(9): 1024. DOI:10.3390/catal12091024
(  0) 0) |
| [15] |
Yan D Y S, Lo I M C. Removal effectiveness and mechanisms of naphthalene and heavy metals from artificially contaminated soil by iron chelate-activated persulfate[J]. Environmental Pollution, 2013, 178: 15-22. DOI:10.1016/j.envpol.2013.02.030
(  0) 0) |
| [16] |
Gujar S K, Divyapriya G, Gogate P R, et al. Environmental applications of ultrasound activated persulfate/peroxymonosulfate oxidation process in combination with other activating agents[J]. Critical Reviews in Environmental Science and Technology, 2023, 53(6): 780-802. DOI:10.1080/10643389.2022.2085965
(  0) 0) |
| [17] |
Chen Y S, Shi R, Hu Y F, et al. Alkali-thermal activated persulfate treatment of tetrabromobisphenol A in soil: Parameter optimization, mechanism, degradation pathway and toxicity evaluation[J]. Science of the Total Environment, 2023, 903: 166477. DOI:10.1016/j.scitotenv.2023.166477
(  0) 0) |
| [18] |
Chen Y Q, Tong Y, Liu Z Z, et al. Enhanced degradation of Orange Ⅱ using a novel UV/persulfate/sulfite system[J]. Environmental Chemistry Letters, 2019, 17(3): 1435-1439. DOI:10.1007/s10311-019-00880-2
(  0) 0) |
| [19] |
Long A H, Zhang H. Selective oxidative degradation of toluene for the recovery of surfactant by an electro/Fe2+/persulfate process[J]. Environmental Science and Pollution Research, 2015, 22(15): 11606-11616. DOI:10.1007/s11356-015-4406-x
(  0) 0) |
| [20] |
Zou H W, Hu E D, Yang S Y, et al. Chromium(Ⅵ)removal by mechanochemically sulfidated zero valent iron and its effect on dechlorination of trichloroethene as a co-contaminant[J]. Science of the Total Environment, 2019, 650: 419-426. DOI:10.1016/j.scitotenv.2018.09.003
(  0) 0) |
| [21] |
Zhao D, Liao X Y, Yan X L, et al. Effect and mechanism of persulfate activated by different methods for PAHs removal in soil[J]. Journal of Hazardous Materials, 2013, 254/255: 228-235. DOI:10.1016/j.jhazmat.2013.03.056
(  0) 0) |
| [22] |
Luo H W, Zeng Y F, He D Q, et al. Application of iron-based materials in heterogeneous advanced oxidation processes for wastewater treatment: A review[J]. Chemical Engineering Journal, 2021, 407: 127191. DOI:10.1016/j.cej.2020.127191
(  0) 0) |
| [23] |
Yan B J, Deng H, Wei H Y, et al. Performance and kinetics of BPA degradation initiated by powdered iron(or ferrous sulfate)and persulfate in aqueous solutions[J]. Catalysts, 2022, 13(1): 36. DOI:10.3390/catal13010036
(  0) 0) |
| [24] |
Zhang T T, Yang Y L, Gao J F, et al. Synergistic degradation of chloramphenicol by ultrasound-enhanced nanoscale zero-valent iron/persulfate treatment[J]. Separation and Purification Technology, 2020, 240: 116575. DOI:10.1016/j.seppur.2020.116575
(  0) 0) |
| [25] |
Karim A V, Jiao Y L, Zhou M H, et al. Iron-based persulfate activation process for environmental decontamination in water and soil[J]. Chemosphere, 2021, 265: 129057. DOI:10.1016/j.chemosphere.2020.129057
(  0) 0) |
| [26] |
Cai J, Zhang Y. Enhanced degradation of bisphenol S by persulfate activated with sulfide-modified nanoscale zero-valent iron[J]. Environmental Science and Pollution Research, 2022, 29(6): 8281-8293. DOI:10.1007/s11356-021-16156-8
(  0) 0) |
| [27] |
Chen J S, Luo H Y, Luo D Y, et al. New insights into the degradation of nitrobenzene by activated persulfate with sulfidated nanoscale zero-valent iron: Synergistic effects of reduction and reactive oxygen species oxidation[J]. Separation and Purification Technology, 2023, 322: 124252. DOI:10.1016/j.seppur.2023.124252
(  0) 0) |
| [28] |
Guo J Y, Jiang J Y, Chen Y H, et al. Synthesis of nZVI-BC composite for persulfate activation to degrade pyrene: Performance, correlative mechanisms and degradation pathways[J]. Process Safety and Environmental Protection, 2022, 162: 733-745. DOI:10.1016/j.psep.2022.04.051
(  0) 0) |
| [29] |
Zhou Y M, Gao B, Zimmerman A R, et al. Biochar-supported zerovalent iron for removal of various contaminants from aqueous solutions[J]. Bioresource Technology, 2014, 152: 538-542. DOI:10.1016/j.biortech.2013.11.021
(  0) 0) |
| [30] |
Xu J, Wang Y, Weng C, et al. Reactivity, selectivity, and long-term performance of sulfidized nanoscale zerovalent iron with different properties[J]. Environmental Science & Technology, 2019, 53(10): 5936-5945.
(  0) 0) |
| [31] |
Gao J, Han D Q, Xu Y, et al. Persulfate activation by sulfide-modified nanoscale iron supported by biochar(S-nZVI/BC)for degradation of ciprofloxacin[J]. Separation and Purification Technology, 2020, 235: 116202. DOI:10.1016/j.seppur.2019.116202
(  0) 0) |
| [32] |
Brumovský M, Filip J, Malina O, et al. Core-shell Fe/FeS nanoparticles with controlled shell thickness for enhanced trichloroethylene removal[J]. ACS Applied Materials & Interfaces, 2020, 12(31): 35424-35434.
(  0) 0) |
| [33] |
Cao Z, Li H, Lowry G V, et al. Unveiling the role of sulfur in rapid defluorination of florfenicol by sulfidized nanoscale zero-valent iron in water under ambient conditions[J]. Environmental Science & Technology, 2021, 55(4): 2628-2638.
(  0) 0) |
| [34] |
Wang X Q, Guo Z Z, Hu Z, et al. Adsorption of phenanthrene from aqueous solutions by biochar derived from an ammoniation-hydrothermal method[J]. Science of the Total Environment, 2020, 733: 139267. DOI:10.1016/j.scitotenv.2020.139267
(  0) 0) |
| [35] |
Liang W J. Study on mechanism of degradation of decabromodiphenyl ether in contaminated sites by activated persulfate with nano-zero-valent iron sulfide loaded on lotus root biochar[D]. Taiyuan: Taiyuan University of Technology, 2021.[梁文静. 莲藕生物炭负载硫化纳米零价铁活化过硫酸盐降解污染场地中十溴联苯醚的机制研究[D]. 太原: 太原理工大学, 2021.]
(  0) 0) |
| [36] |
Kovtun A, Jones D, Dell'Elce S, et al. Accurate chemical analysis of oxygenated graphene-based materials using X-ray photoelectron spectroscopy[J]. Carbon, 2019, 143: 268-275.
(  0) 0) |
| [37] |
Jiang Q, Zhang Y, Jiang S M, et al. Graphene-like carbon sheet-supported nZVI for efficient atrazine oxidation degradation by persulfate activation[J]. Chemical Engineering Journal, 2021, 403: 126309.
(  0) 0) |
| [38] |
Liang S. Degradation of tetracycline by sulfide nano zero-valent iron supported on biochar[D]. Shanghai: Donghua University, 2022.[梁爽. 生物质炭负载硫化纳米零价铁对四环素的降解研究[D]. 上海: 东华大学, 2022.]
(  0) 0) |
| [39] |
Wang J L, Wang S Z. Activation of persulfate(PS)and peroxymonosulfate(PMS)and application for the degradation of emerging contaminants[J]. Chemical Engineering Journal, 2018, 334: 1502-1517.
(  0) 0) |
| [40] |
Ouyang D, Yan J C, Qian L B, et al. Degradation of 1, 4-dioxane by biochar supported nano magnetite particles activating persulfate[J]. Chemosphere, 2017, 184: 609-617.
(  0) 0) |
| [41] |
He S Y. Removal of decabromodiphenyl ether from soil of electronic waste dismantling site by activated persulfate with Kaolin-supported sulfide nano-zero- valent iron[D]. Taiyuan: Taiyuan University of Technology, 2019.[何思莹. 高岭土负载硫化纳米零价铁激活过硫酸盐去除电子垃圾拆解地土壤中的十溴联苯醚[D]. 太原: 太原理工大学, 2019.]
(  0) 0) |
| [42] |
Xue Y F, Lu S G, Fu X R, et al. Simultaneous removal of benzene, toluene, ethylbenzene and xylene(BTEX)by CaO2 based Fenton system: Enhanced degradation by chelating agents[J]. Chemical Engineering Journal, 2018, 331: 255-264.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


