全球气候变暖对人类生存和发展会产生深刻影响,是当今国际社会面临的重大挑战之一。草地作为陆地生态系统的重要组成部分,约占其表面积的41%[1],储存有343 Pg C(地下1 m),其储量的微小变化将对大气CO2浓度和全球气候变化产生重大影响[2]。在全球气候变化(例如,大气CO2浓度增加、地表温度上升、氮沉降和降水模式改变)和过度放牧等的影响下,草地生态系统普遍出现木本或灌木植物的密度、盖度和生物量增加的现象,即草地灌丛化(Shrub encroachment)[3]。草地灌丛化对土壤有机碳(SOC)的影响不尽一致,它有可能使SOC含量增加[4]、减少[5]、抑或是保持不变[6]。因此,了解灌从化对土壤碳库的影响,能够为高寒草地土壤碳源汇效应提供一定的理论基础。
土壤微生物是土壤养分矿化、碳氮固存等多种生物地球化学过程的驱动者[7]。灌丛化后植物群落优势种由草本植物到木本植物的转变会改变凋落物和根系分泌物的数量和质量,进而影响微生物群落组成和多样性[8]。Ma等[9]的研究结果表明,灌丛化增加了酸杆菌(Acidobacteria)等寡营养菌相对丰度,导致放线菌(Actinobacteria)等富营养菌在灌丛土壤中丰度降低。地上植物群落的变化可能还会引起微生物共生网络发生改变[10]。Li等[11]的研究表明,灌丛土壤中微生物对生存空间、养分以及水分等资源竞争降低,菌群间共生或互利共生的相互作用增强。共生关系有利于不同物种的生长繁殖,增加土壤微生物功能的互补性,进而能够提高生态系统能量流动和物质循环速率[11]。Kehe等[12]发现共生菌群可分泌碳源降解酶,增加了碳的可利用性,促进了碳循环。竞争关系在土壤资源相对短缺时可能更加重要[13]。土壤养分贫瘠时,微生物会通过合成获取有限资源的酶/替代酶和分解惰性物质来补偿养分的不足[14]。这种资源获取方式的转变,会影响土壤碳周转率。因此,灌丛化后微生物群落结构的变化,最终将影响土壤生物地球化学过程,如CO2的产生和固定。
青藏高原又被称为世界第三极,是气候变化的敏感区[15]。近年来,在全球气候变化和人类活动的影响下,青藏高原灌丛化现象日益严重。1990年至2009年,青藏高原东南麓已有39%的高山草甸灌丛化[16]。以往对灌丛化的研究主要集中在干旱半干旱区灌丛化对地上植物群落、土壤理化性质和土壤微生物的影响,而土壤微生物群落对灌丛化的响应可能因气候、植被和土壤类型的不同而不同。因此,本研究利用16S基因的高通量测序技术,研究了青藏高原东缘3种典型灌丛化草地(高山绣线菊Spiraea alpina、金露梅Potentilla fruticosa、小叶锦鸡儿Caragana microphylla)土壤表层(0~10 cm)和深层(50~60 cm)细菌群落结构,明确了高寒草地灌丛化对土壤微生物群落及土壤有机碳化学组成的影响,以期为青藏高原灌丛化草地的地下碳循环提供理论依据。
1 材料与方法 1.1 研究区概况本研究野外采样点分布在四川省红原县。该区域位于青藏高原东部边缘,平均海拔3 500 m,年均温0.9℃,年均降水量690 mm。气候类型为高原寒温带半湿润季风气候,土壤类型为高山灌丛草甸土。灌丛样地中优势种分别为高山绣线菊(Spiraea alpina)、金露梅(Potentilla fruticosa)、小叶锦鸡儿(Caragana microphylla),草本植物主要有四川剪股颖(Agrostis szechuanica)、垂穗披碱草(Elymus nutans)、早熟禾(Poa annua)、发草(Deschampsia Caespitosa)、四川嵩草(Kobresia setchwanensis)、草玉梅(Anemone rivularis)等。
1.2 样品采集与处理野外取样在2019年8月初进行。选择3种青藏高原典型灌丛(高山绣线菊、金露梅、小叶锦鸡儿)和无灌木生长的草地作为对照。每个样地面积为50 m×50 m,间距为100 m。每个样地内设置3个1 m×1 m的小样方,根据《中国植物志》[17]和《青海植物志》[18]等参考书籍,调查每个灌丛样方内所有物种的物种数,测量每个物种植株的高度、多度和分盖度,以计算植物物种多样性和丰富度。记录完成后,将地上植物齐地刈割,测定灌木地上部分鲜物质量;同时将称过鲜物质量的灌木(各取样100 g左右)和所有草本植物带回实验室。在实验室内用烘箱将植物样品烘干至恒重(65 ℃,48 h),根据灌木的干鲜物质量比值计算不同样方内灌木地上生物量,并与草本植物部分的干物质量相加得到灌丛样地地上生物量。每个小样方采用五点法(4个点,样地中心)采集表层(0~10 cm)和深层(50~60 cm)土壤,土层选取参考Fontaine等[19]。相应土层混合为1份土样,剔除植物根茎、凋落物和小石砾等杂物后置于灭菌管。草地和灌丛样地土壤共48份样品(为了增加微生物测定的准确性,将重复增加至6个),其中包括草地12份(6个重复×2个土层)和灌丛36份(3种灌丛×6个重复×2个土层)。样品做好标记后放入冰盒内,并迅速带回实验室,一部分土样保存于–20 ℃冰箱内用于提取土壤微生物DNA,另一部分土样置于自封袋带回实验室自然风干,用于测量土壤理化性质(pH、SOC、全氮TN)和有机碳化学组分。
1.3 土壤理化性质测定土壤pH用酸度计测定,水土比为2.5︰1。SOC采用元素分析仪(Elementar Variomax CNS Analyser,Elementar Crop.,德国)测定,TN采用凯氏定氮法测定。SOC化学组成采用傅里叶变换红外光谱仪(Nicolet 6700,Thermo Fisher,美国)分析。具体方法如下:将待测土壤样品与KBr(光谱纯)按1︰10的比例在玛瑙研钵中充分研磨混匀后,在75 KPa下压片,通过傅里叶变换红外光谱仪扫描并记录光谱图。光谱测定范围为400~4 000 cm–1,分辨率为4 cm–1,扫描16次。不同特征峰用来评估SOC不同的碳组分:脂肪族(2 930 cm–1)、芳香族(1 620 cm–1)、多糖(1 034 cm–1)和酚醇(3 435 cm–1)[20]。
1.4 土壤DNA的提取及测序土壤样品采用MO BIO土壤DNA提取试剂盒(MO BIO Laboratories,Carlsbad,CA,美国),按照其说明书对土壤DNA进行提取。细菌以16S V4~V5区515F(5'-GTGCCAGCMGCCGCGGTAA-3')和909R(5'-CCCCGYCAATTCMTTTRAGT-3')为引物[21]。反应体系为:上游引物515F和下游引物909R各1 μL,9.5 μL无菌水,1 μL DNA样品。PCR扩增程序包括:94 ℃变性3 min,随后进行30次下列循环过程,94 ℃变性40 s,50 ℃退火60 s,72 ℃延伸60 s,完成30个循环后在72 ℃延伸10 min。使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建并利用Illumina HiSeq测序仪进行PE250测序。使用FLASh(V1.2.7,http://ccb.jhu.edu/software/FLASH/)[22]对每个样品的reads进行拼接,得到的拼接序列为原始测序数据。利用Qiime(V1.9.0,http://qiime.org/scripts/split_ libraries_fastq.html)平台将低质量的序列(Q<30)和长度不足300 bp的序列去掉,嵌合体采用UCHIME算法过滤,进而得到高质量的测序数据。利用Qiime软件对所有样品的有效数据(Effective Tags)进行聚类(CD-HI方法),默认以97%相似性将序列聚类成为操作分类单元(OTU)[23]。利用Qiime软件对OTU代表序列进行物种注释,使用Silva v132和UNITE(version 8.0)作为参考数据库。
1.5 数据处理与作图对于土壤pH、SOC、TN、SOC化学组成、植物多样性和细菌功能的显著性分析分别采用Shapiro-Wilk和Levene’s检验对数据进行正态和方差齐性检验。当数据同时满足正态分布和方差齐性时,采用SPSS22.0进行单因素方差分析(ANOVA),图基事后检验(Tukey’s HSD)分析组间差异的显著性;当数据不服从正态分布,则采用非参数检验。使用基于Bray-Curtis距离矩阵的非度量多维尺度分析(NMDS)和相似性分析(Anosim)分析植物群落和微生物群落的变化。采用随机森林模型预测土壤细菌对灌丛化的平均重要性。基于京都基因与基因组百科全书(KEGG)数据库,使用PICRUSt(http://picrust.github.io/picrust/)预测可能由细菌群落传递的功能特征。曼特尔检验(Mantel test)用于评估土壤和植物特性与微生物群落结构之间的关系。
采用共现性网络(Co-occurrence network)分析三种灌丛和草地表层、深层土壤中微生物群落之间的相互关系。采用R(V.3.6.1)软件psych包中corr函数,使用斯皮尔曼(spearman)相关分析计算OTU间的相关性,进一步筛选具有显著相关的OTU(|r| > 0.6且P < 0.05)。利用Gephi0.9.2软件对微生物网络图进行可视化,计算各个网络的拓扑结构性质,包括平均度(Average degree)、平均聚类系数(Average clustering coefficient)、平均路径距离(Average path distance)、模块性(Modularity)、复杂性(Complexity)和自然连通度(Network connectivity)。
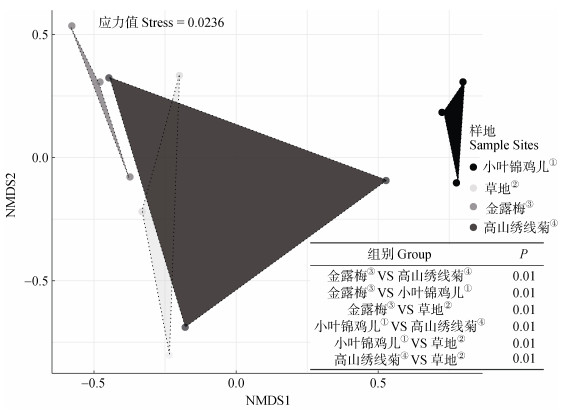
2 结果 2.1 灌丛化草地的植被特征三种灌丛和草地植物群落组成的NMDS分析结果如图 1所示,胁迫系数(stress)值为0.023 6,表明拟合度较好,分类结果可信。金露梅、小叶锦鸡儿和草地的植物群落形成了分离的群落(P < 0.01),高山绣线菊与草地物群落组成无显著差异(P > 0.05)。
|
图 1 灌丛和草地植物群落组成的非度量多维尺度(NMDS)分析 Fig. 1 Plant community composition of shrub-encroached and grass plots using non-metric multidimensional scaling analysis(NMDS) |
由表 1可知,三种灌丛与草地植物群落的香农(Shannon)多样性和玛格列夫(Margalef)丰富度指数均无显著差异(P > 0.05)。三种灌丛地上生物量在1.48~2.29 kg∙m–2之间,而草地地上生物量平均仅有0.26 kg∙ m–2,且三种灌丛地上生物量均显著高于草地(P < 0.05)。
|
|
表 1 灌丛和草地植物群落多样性和生物量 Table 1 Plant community diversity and biomass of shrub-encroached and grass plots |
三种灌丛样地表层和深层SOC平均含量分别在58.04~66.95 g∙kg–1和50.10~55.76 g∙kg–1之间,TN含量在4.92~6.15 g∙kg–1和3.96~5.05 g∙kg–1之间(表 2)。三种灌丛土壤表深层SOC和TN含量均与草地无显著性差异(P > 0.05)。由表 2可知,在灌丛和草地表层、深层土壤SOC组分均以芳香族为主(除小叶锦鸡儿深层土壤外)。
|
|
表 2 灌丛和草地表层和深层土壤性质 Table 2 Soil properties in top- and subsoils of shrub-encroached and grass plots |
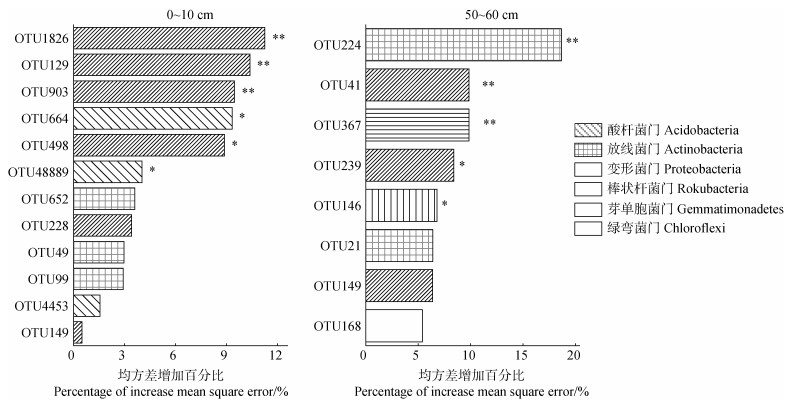
通过随机森林模型分析确定土壤细菌群落对灌丛化的平均重要性(图 2)。结果表明,酸杆菌门(P < 0.01,例如OTU1826、OTU129和OTU903)和变形菌门(P < 0.05,例如OTU664和OTU48889)是表层土壤灌丛化的重要预测因子。深层土壤中,放线菌门(OTU224)、酸杆菌门(OTU41和OTU239)和棒状杆菌门(OTU367)是灌丛化的显著预测因子(P < 0.01)。
|
注: OTU1826、OTU129、OTU903、OTU498、OTU149、OTU41和OTU239属酸杆菌门;OTU664、OTU48889和OTU4453属变形菌门;OTU652、OTU49、OTU99、OTU224和OTU21属放线菌门;OTU367属棒状杆菌门;OTU146属芽单胞菌门;OTU168属绿弯菌门;*和**分别表示在P < 0.05和P < 0.01水平上有显著差异。 Note: OTU1826,OTU129,OTU903,OTU498,OTU149,OTU41 and OTU239 for Acidobacteria;OTU664,OTU48889 and OTU4453 for Actinobacteria;OTU652,OTU49,OTU99,OTU224 and OTU21 for Proteobacteria;OTU367 for Rokubacteria;OTU146 for Gemmatimonadetes;OTU168 for Chloroflexi. * and ** indicate statistical significance at P < 0.05 and P < 0.01 levels. 图 2 基于随机森林模型分析筛选灌丛化土壤中细菌操作分类单元(OTU)的相对重要性 Fig. 2 Importance of soil bacterial community under shrub encroachment from random forest analysis |
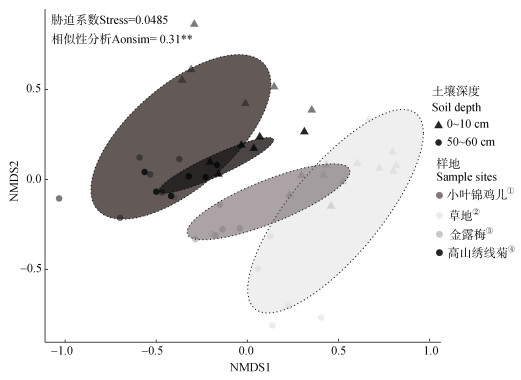
三种灌丛和草地土壤细菌β多样性变化如图 3所示,胁迫系数(stress)值为0.0485,stress < 0.05,拟合极好,分类结果可信。进一步通过相似性分析(Anosim)分析不同样地间细菌群落组成表明,三种灌丛土壤表层和深层细菌群落组成与草地细菌群落差异显著(P < 0.05)。
|
图 3 灌丛和草地土壤细菌群落组成的非度量多维尺度(NMDS)分析 Fig. 3 Soil bacterial community composition of shrub-encroached and grass plots using non-metric multidimensional scaling analysis(NMDS) |
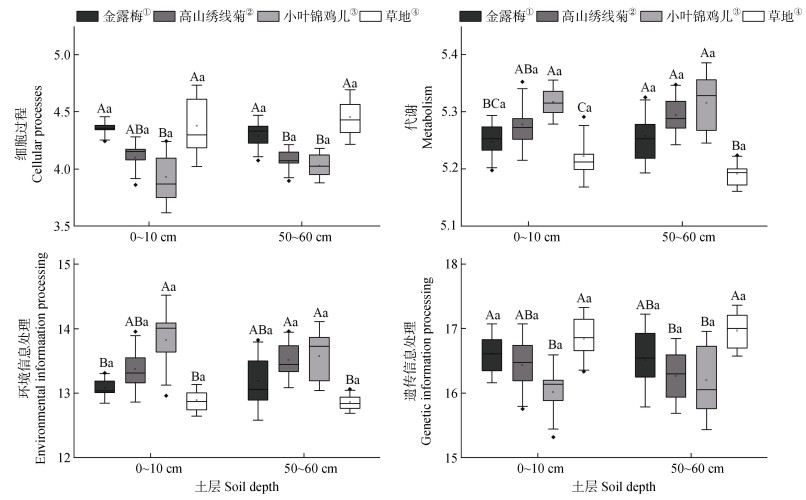
通过与KEGG数据库进行比对共得到4个生物代谢通路(图 4),分别为细胞过程(Cellular processes)、环境信息处理(Environmental information processing)、代谢(Metabolism)和遗传信息处理(Genetic information processing),其中细菌的代谢功能相对丰度最高,平均占比52.65%。小叶锦鸡儿和高山绣线菊表层、深层土壤中细菌代谢功能显著高于草地(P < 0.05),金露梅仅在深层土壤中显著高于草地(P < 0.05)(图 4)。
|
注: 结果以均值±标准误(n = 6)表示,不同大小写字母分别表示不同植被类型在同一土层和同一植被类型内不同土层间的差异显著性,P < 0.05。 Note: Values are given as mean ± standard error(n = 6),Different lower- and uppercase letters indicate significant differences between the different soil layers within the same vegetation types and different vegetation types within the same soil layer,respectively,at the P < 0.05 level. ①Potentilla fruticosa,②Spiraea alpina,③Caragana microphylla,④Grassland. 图 4 灌丛和草地土壤细菌功能预测 Fig. 4 Soil bacteria functional prediction in shrub-encroached and grass plots |
采用曼特尔检验(Mantel test)评估灌丛和草地土壤细菌群落组成与土壤理化性质和植被特征的关系,结果(图 5)表明,灌丛表层土壤细菌群落组成受到植物群落结构(R = 0.30,P = 0.001)和脂肪族(R = 0.47,P = 0.01)变化的显著影响;pH(R = 0.38,P = 0.001)、多糖(R = 0.41,P = 0.001)、芳香族(R = 0.46,P = 0.001)、脂肪族(R = 0.47,P = 0.001)、地上生物量(R = 0.20,P = 0.02)和植物群落结构(R =0.37,P = 0.001)与灌丛深层土壤细菌群落组成的变化显著相关。
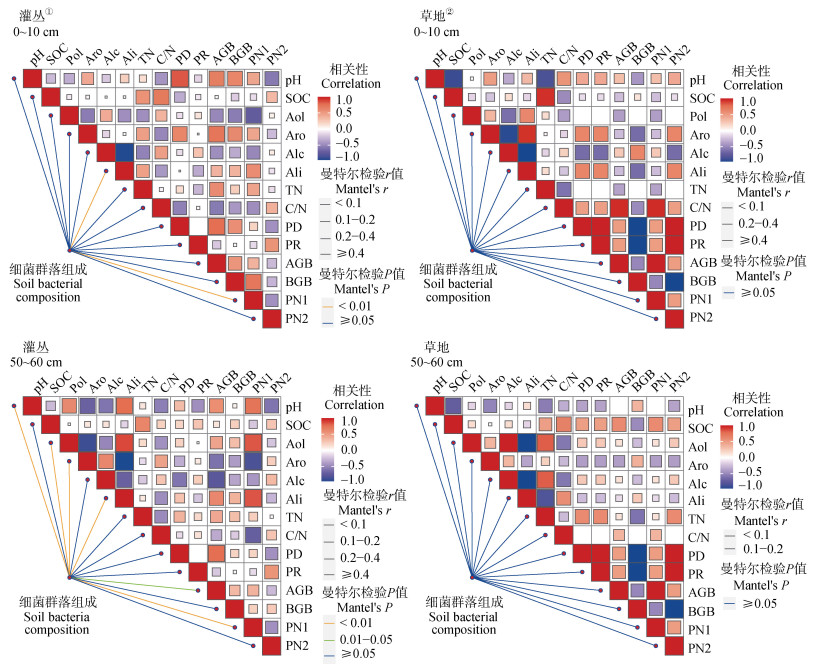
|
注: AGB,地上生物量;BGB,地下生物量;Ali,脂肪族;Aro,芳香族;Pol,多糖;Alc,酚醇;PD,植物多样性;PR,植物丰富度;PN1,植物NMDS轴1;PN2,植物NMDS轴2。 Note: AGB for aboveground biomass,BGB for underground biomass,Ali for aliphatic,Aro for aromatic,Pol for polysaccharides,Alc for alcohol,PD for plant diversity,PR for plant richness,PN1 for plant community composition NMDS1,PN2 for plant community composition NMDS2. ①Shrub plots,②Grassland. 图 5 土壤细菌群落结构与土壤因子和植被特征的曼特尔检验 Fig. 5 Mantel tests for soil bacteria community structure with soil and vegetation properties |
由细菌网络拓扑参数可知,三种灌丛的节点数和边均高于草地,说明灌丛较草地具有更大规模的网络。三种灌丛和草地表层、深层节点间均以正相互作用为主(表 3)。通过逐步去除节点来估计网络稳性,以评估细菌存在或不存在的情况下,共现网络中自然连通度下降的速度,其斜率绝对值越小,微生物网络越稳定[24]。由图 6可知,灌丛化增加了土壤细菌群落共现性网络的稳定性。
|
|
表 3 四组样地细菌群落共现网络特征参数 Table 3 The topological properties of co-occurrence networks from four plots |
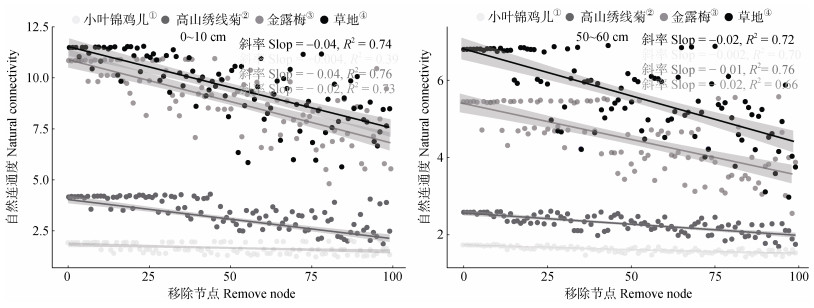
|
图 6 灌丛化对土壤细菌群落共现性网络稳定性的影响 Fig. 6 The effects of shrub encroachment on soil bacteria co-occurrence network stability |
物种多样性是表征草地生态系统生产力和稳定性的重要指标[25]。本研究发现,高寒草地灌丛化对地上植物群落多样性和丰富度无显著影响(表 1)。这与Alday等[26]的结果相一致。这可能是由于灌木盖度的增加,喜阳植物与灌木竞争光源而受到抑制,同时有利于耐荫植物的生长,植物群落组成从一年生植物、喜阳植物转变为喜荫湿物种,进而可保持物种丰富度和多样性不变[27]。通过分析三种灌丛与草地地上生物量发现,灌丛化显著增加地上生物量(表 1,P < 0.05)。这可能是由于灌木一定程度上限制了家畜和野生动物的采食,减少了生物量损失。
3.2 高寒草地灌丛化对土壤理化性质的影响灌丛化对高寒草地土壤碳氮含量无显著影响(表 2)。这与Zhao等[4]的研究结果不一致,其结果表明灌丛化增加土壤中的C和N含量,形成“沃岛效应”。灌丛化通常会增加凋落物输入的数量,进而通过提供可利用养分而引起微生物数量的增加[28]。但是在微生物大量繁殖的同时,养分需求增加,使其发生共代谢进行氮挖掘,促进SOC的矿化,这可能是本研究中灌丛与草地土壤SOC和TN含量无显著变化的原因。SOC的垂向分布结果表明,草地表层和深层的SOC含量存在显著差异,呈表聚性分布,但三种灌丛样地中各自的表层和深层土壤SOC含量之间无显著差异(表 2)。灌丛表层土壤碳主要来源于叶片,而根源和叶源碳在草本有机质中更占优势[29]。虽然草本植物在土壤表层分配了大量的碳,但它们短而密集的根系无法到达更深的土层。相比于草本植物,灌木的根系分布更广更深,产生更多的根系分泌物和凋落物,促进深层碳的积累。因此,与草地相比,深层灌丛根系碳输入的增加降低了表层和深层碳含量的差异,导致垂向SOC含量无显著变化(表 2)。灌丛化和未灌丛化样地SOC以芳香族为主(表 2)。这与之前的研究结果一致,即高寒草地的大部分SOC呈惰性[30],对土壤碳库的长期储存具有重要作用。这可能是因为高寒生态系统低温低氧环境阻碍了微生物和酶的活动,抑制SOC的分解,产生稳定的SOC组分。
3.3 高寒草地灌丛化对土壤细菌群落结构的影响通过相似性分析表明,灌丛化后表层和深层土壤细菌群落组成发生显著改变(图 3),说明细菌群落是植物种类变化的敏感指标之一。这与Xiang等[8]在内蒙古和Ma等[9]在青藏高原的研究结果相一致。先前研究表明,植物通过根系分泌物影响相关的微生物群落结构[31]。因此,本研究中灌丛样地细菌群落组成的变化可能与灌丛化后地上植物群落组成的变化有关。本研究通过随机森林分析(图 2)发现,土壤表层酸杆菌门为灌丛化的显著预测因子。这可能是由于灌木凋落物中富含木质素等惰性化合物,而酸杆菌含有编码纤惰性碳分解的基因[32]。在高寒灌丛化草地京都基因与基因组百科(KEGG)水平代谢通路中,大多数与代谢途径有关。这是因为土壤微生物主要是通过其代谢活动参与土壤物质的循环与转化,进而调控生物体的代谢过程。
网络分析可揭示微生物物种之间的共生模式和群落内的复杂关联[33]。细菌共生网络拓扑参数分析结果表明,灌丛化增加了细菌网络的复杂性(具有高连接数和复杂性)(表 3),可能是由于灌丛土壤养分含量增加(TN和SOC略高于草地)(表 2),为不同物种提供了更多相互作用的机会。通过分析自然连通度发现,高寒草地灌丛化增加了土壤细菌群落共现网络的稳定性(图 6)。由此可推断,当外界环境发生扰动时,灌丛细菌网络可减缓扰动的传递,使其结构保持稳定。灌丛和草地表层与深层土壤共现网络中正相互作用占总链数的54%以上(表 3),表明偏利共生或共生关系在高寒草地的细菌群落结构中发挥重要作用。先前研究也表明微生物依靠分解和代谢微生物残体获取养分,使得自然界中微生物间以正相互作用为主[12]。共生关系中不同物种的生长繁殖,会增加土壤微生物功能的互补性,使得生态系统更加稳定,提高生态系统物质循环的效率[3,12]。综上所述,灌丛化可能通过改变菌群间的相互作用,进而提高草地生态系统碳循环效率。
3.4 植物群落和土壤理化性质对土壤细菌群落结构的影响灌丛表层和深层土壤细菌群落组成均受到植物群落组成的显著影响(图 5)。有研究表明,植被类型在不同程度上是土壤微生物群落结构的主要决定因素[34]。不同植物的根系分泌物招募不同的土壤微生物,最终改变细菌群落组成。灌丛深层土壤中,微生物群落主要受芳香族和多糖的影响(图 5)。Shao等[35]发现,SOC的化学组成(脂肪族、芳香族和多糖)是引起微生物群落组成变化的主要驱动因子。这可能归因于养分的可利用性差异,由于微生物不同的碳利用策略,引起寡营养细菌或富营养细菌的富集。如先前在本样地中深层土壤酸杆菌(寡营养菌)的相对丰度下降,放线菌(富营养菌)的相对丰度增加[36]。相比于表层土壤,深层土壤养分匮乏,微生物仅能分解惰性物质以获取养分,从而使得深层微生物群落主要受到芳香族碳组分的影响。深层微生物利用的多糖可能是微生物合成的多糖以及惰性或复杂土壤有机质化合物中的多糖。
4 结论本研究揭示了高寒草原灌丛化对细菌群落结构、细菌共现网络和土壤碳库的影响,探究了细菌群落的主要影响因子。地上植物群落组成、多样性及丰富度对灌丛化的响应不一致,具体表现为灌丛化草地地上植物群落组成发生显著改变,而相应的地上植物群落多样性和丰富度无显著变化。高寒草地灌丛化对SOC和SOC惰性组分影响不显著,但削弱了表层与深层碳含量的差异。土壤细菌群落组成受到植物群落组成和SOC化学组成等多个因子的综合影响,这些因子共同作用改变了细菌群落结构。高寒草地灌丛化增加了细菌网络的复杂性和稳定性,并且使得细菌菌群间的互作关系倾向于共生或偏利共生。
| [1] |
Zhao Y Y, Liu Z F, Wu J G. Grassland ecosystem services: A systematic review of research advances and future directions[J]. Landscape Ecology, 2020, 35(4): 793-814. DOI:10.1007/s10980-020-00980-3
(  0) 0) |
| [2] |
Wang B, Gray J M, Waters C M, et al. Modelling and mapping soil organic carbon stocks under future climate change in south-eastern Australia[J]. Geoderma, 2022, 405: 115442. DOI:10.1016/j.geoderma.2021.115442
(  0) 0) |
| [3] |
Liu Y F, Zhang Z C, Liu Y, et al. Shrub encroachment enhances the infiltration capacity of alpine meadows by changing the community composition and soil conditions[J]. Catena, 2022, 213: 106222. DOI:10.1016/j.catena.2022.106222
(  0) 0) |
| [4] |
Zhao J X, Yang W, Ji-Shi A W, et al. Shrub encroachment increases soil carbon and nitrogen stocks in alpine grassland ecosystems of the central Tibetan Plateau[J]. Geoderma, 2023, 433: 116468. DOI:10.1016/j.geoderma.2023.116468
(  0) 0) |
| [5] |
Nadal-Romero E, Rubio P, Kremyda V, et al. Effects of agricultural land abandonment on soil organic carbon stocks and composition of soil organic matter in the Central Spanish Pyrenees[J]. Catena, 2021, 205: 105441. DOI:10.1016/j.catena.2021.105441
(  0) 0) |
| [6] |
Zhang D, Liu J Q, Ma W M, et al. Effects of shrub encroachment on soil organic carbon components in Qinghai-Xizang alpine grassland (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(6): 1810-1821. DOI:10.11766/trxb202203220004 [张东, 刘金秋, 马文明, 等. 灌丛化对高寒草地土壤有机碳组分的分异研究[J]. 土壤学报, 2023, 60(6): 1810-1821.]
(  0) 0) |
| [7] |
Raza T, Qadir M F, Khan K S, et al. Unravealing the potential of microbes in decomposition of organic matter and release of carbon in the ecosystem[J]. Journal of Environmental Management, 2023, 344: 118529. DOI:10.1016/j.jenvman.2023.118529
(  0) 0) |
| [8] |
Xiang X J, Gibbons S M, Li H, et al. Shrub encroachment is associated with changes in soil bacterial community composition in a temperate grassland ecosystem[J]. Plant and Soil, 2018, 425(1): 539-551.
(  0) 0) |
| [9] |
Ma W M, Ding K Y, Bai S, et al. Response of bacterial communities to shrub encroachment and forage planting in alpine grassland of the Qinghai-Tibetan Plateau[J]. Ecological Engineering, 2023, 186: 106837. DOI:10.1016/j.ecoleng.2022.106837
(  0) 0) |
| [10] |
Jiao S, Yang Y F, Xu Y Q, et al. Balance between community assembly processes mediates species coexistence in agricultural soil microbiomes across eastern China[J]. The ISME Journal, 2020, 14(1): 202-216. DOI:10.1038/s41396-019-0522-9
(  0) 0) |
| [11] |
Li S Y, Chen W M, Li Z B, et al. Fertile islands lead to more conspicuous spatial heterogeneity of bacteria than soil physicochemical properties in a desert ecosystem[J]. Catena, 2021, 206: 105526. DOI:10.1016/j.catena.2021.105526
(  0) 0) |
| [12] |
Kehe J, Ortiz A, Kulesa A, et al. Positive interactions are common among culturable bacteria[J]. Science Advances, 2021, 7(45): eabi7159. DOI:10.1126/sciadv.abi7159
(  0) 0) |
| [13] |
Huang L T, Ni H W, Li X Y, et al. Molecular ecological network of bacteria and fungi in paddy soil profile of typical red soil (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(4): 1018-1027. DOI:10.11766/trxb202001170025 [黄兰婷, 倪浩为, 李新宇, 等. 典型红壤水稻土剖面细菌和真菌分子生态网络特征研究[J]. 土壤学报, 2021, 58(4): 1018-1027.]
(  0) 0) |
| [14] |
Schmidt T M, Konopka A E. Physiological and ecological adaptations of slow-growing, heterotrophic microbes and consequences for cultivation[M]//Epstein S. Uncultivated microorganisms. Berlin, Heidelberg: Springer, 2009: 257—276.
(  0) 0) |
| [15] |
Zhang G F, Nan Z T, Hu N, et al. Qinghai-Tibet plateau permafrost at risk in the late 21st century[J]. Earth's Future, 2022, 10(6): e2022EF002652. DOI:10.1029/2022EF002652
(  0) 0) |
| [16] |
Brandt J S, Haynes M A, Kuemmerle T, et al. Regime shift on the roof of the world: Alpine meadows converting to shrublands in the southern Himalayas[J]. Biological Conservation, 2013, 158: 116-127. DOI:10.1016/j.biocon.2012.07.026
(  0) 0) |
| [17] |
Editorial Committee of Flora of China. Flora reipublicae popularis sinicae (In Chinese). Beijing: Science Press: 1959-2004. [中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社: 1959-2004.]
(  0) 0) |
| [18] |
Editorial Committee of the Flora Qinghaiica. Flora Qinghaiica (In Chinese). Xining: Qinghai People's Publishing House: 1996-1999. [青海植物志编辑委员会. 青海植物志[M]. 西宁: 青海人民出版社: 1996-1999.]
(  0) 0) |
| [19] |
Fontaine S, Barot S, Barré P, et al. Stability of organic carbon in deep soil layers controlled by fresh carbon supply[J]. Nature, 2007, 450(7167): 277-280. DOI:10.1038/nature06275
(  0) 0) |
| [20] |
Calderón F, Haddix M, Conant R, et al. Diffuse-reflectance Fourier-transform mid-infrared spectroscopy as a method of characterizing changes in soil organic matter[J]. Soil Science Society of America Journal, 2013, 77(5): 1591-1600. DOI:10.2136/sssaj2013.04.0131
(  0) 0) |
| [21] |
Rui J P, Li J B, Zhang S H, et al. The core populations and co-occurrence patterns of prokaryotic communities in household biogas digesters[J]. Biotechnology for Biofuels, 2015, 8: 158. DOI:10.1186/s13068-015-0339-3
(  0) 0) |
| [22] |
Magoč T, Salzberg S L. FLASH: Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507
(  0) 0) |
| [23] |
Edgar R C. UPARSE: Highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604
(  0) 0) |
| [24] |
Yang T, Tedersoo L, Liu X, et al. Fungi stabilize multi-kingdom community in a high elevation timberline ecosystem[J]. iMeta, 2022, 1(4). DOI:10.1002/imt2.49
(  0) 0) |
| [25] |
Chen L T, Jiang L, Jing X, et al. Above- and belowground biodiversity jointly drive ecosystem stability in natural alpine grasslands on the Tibetan Plateau[J]. Global Ecology and Biogeography, 2021, 30(7): 1418-1429. DOI:10.1111/geb.13307
(  0) 0) |
| [26] |
Alday J G, Santana V M, Marrs R H, et al. Shrub-induced understory vegetation changes in reclaimed mine sites[J]. Ecological Engineering, 2014, 73: 691-698. DOI:10.1016/j.ecoleng.2014.09.079
(  0) 0) |
| [27] |
Alday J G, Marrs R H, Martínez-Ruiz C. The importance of topography and climate on short-term revegetation of coal wastes in Spain[J]. Ecological Engineering, 2010, 36(4): 579-585. DOI:10.1016/j.ecoleng.2009.12.005
(  0) 0) |
| [28] |
Liu W L, Pei X J, Peng S M, et al. Litter inputs drive increases in topsoil organic carbon after scrub encroachment in an alpine grassland[J]. Pedobiologia, 2021, 85: 150731.
(  0) 0) |
| [29] |
Zhou L H, Li H, Shen H H, et al. Effects of shrub encroachment on vertical changes in soil organic carbon in Mongolian grasslands: Using a multi-biomarker approach[J]. Plant and Soil, 2018, 431(1): 217-230.
(  0) 0) |
| [30] |
Huang Y Z, Xin Z B, Liu J H, et al. Divergences of soil carbon turnover and regulation in alpine steppes and meadows on the Tibetan Plateau[J]. Science of the Total Environment, 2022, 814: 152687. DOI:10.1016/j.scitotenv.2021.152687
(  0) 0) |
| [31] |
Chen H, Tang H Y, Guo J H, et al. Root exudates' roles and analytical techniques progress (In Chinese)[J]. Soils, 2023, 55(2): 225-233. [陈虹, 唐昊冶, 郭家欢, 等. 根系分泌物主要作用及解析技术进展[J]. 土壤, 2023, 55(2): 225-233.]
(  0) 0) |
| [32] |
Lauber C L, Hamady M, Knight R, et al. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J]. Applied and Environmental Microbiology, 2009, 75(15): 5111-5120. DOI:10.1128/AEM.00335-09
(  0) 0) |
| [33] |
Zhao X R, Wu H Y, Zhang G L. Characteristics of bacterial communities and their co-occurrence networks in a typical plinthic horizon (In Chinese)[J]. Soils, 2022, 54(5): 986-992. [赵晓蕊, 吴华勇, 张甘霖. 典型网纹红土结构土壤细菌群落及其生态网络特征[J]. 土壤, 2022, 54(5): 986-992.]
(  0) 0) |
| [34] |
Pan J X, Peng Y F, Wang J S, et al. Controlling factors for soil bacterial and fungal diversity and composition vary with vegetation types in alpine grasslands[J]. Applied Soil Ecology, 2023, 184: 104777. DOI:10.1016/j.apsoil.2022.104777
(  0) 0) |
| [35] |
Shao P S, Liang C, Rubert-Nason K, et al. Secondary successional forests undergo tightly-coupled changes in soil microbial community structure and soil organic matter[J]. Soil Biology and Biochemistry, 2019, 128: 56-65. DOI:10.1016/j.soilbio.2018.10.004
(  0) 0) |
| [36] |
Dengzeng Z M, Ma W M, Wang C T, et al. Effect of shrub encroachment on alpine grass soil microbial community assembly[J]. Frontiers in Soil Science, 2022, 2: 829575. DOI:10.3389/fsoil.2022.829575
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


