土壤氮素矿化过程是农田土壤向植物供应可利用有效氮的关键过程,受生物和非生物因子控制[1]。氨化细菌作为土壤有机氮矿化为NH4+(氨化作用)的重要驱动者,其数量和活性在一定程度上可反映土壤铵态氮的供应能力[2]。由微生物产生的谷氨酸脱氢酶(GDH),于氨化过程中催化谷氨酸氧化脱氨基产生α-酮戊二酸(2-OG)和NH4+,其编码谷氨酸脱氢酶基因(gdh)可用于反映土壤中有机氮转化为矿质氮的能力[3-4]。
在农业生产中,长期连续施肥在显著提高作物产量的同时,也带来了氮素利用率不高和土壤质量退化等问题[5]。2022年农业农村部印发《到2025年化肥减量化行动方案》,提出通过推进化肥减量增效、科学施用有机肥等技术解决氮肥不合理使用、有机肥资源还田率偏低等问题[6]。通常认为,有机肥是无机氮肥的有效替代品,土壤有机质的提升,以及有机无机复合肥配施均能显著提升氨化细菌等功能微生物的数量[7]。谭周进等[8]则认为,相比于有机无机肥配施处理,单施氮肥可明显提高土壤氨化细菌数量和活性、促进土壤氨化作用。李春越等[9]指出,由于氨化细菌对氮素耐受性有限,减量施氮相较于常规施氮更有利于氨化细菌生长。雍太文等[10]研究结果却显示,与常规施氮相比,减量施氮降低了玉米根区土壤的氨化作用。除施肥措施外,温度、通气和土壤类型等差异也是影响土壤氨化微生物分布与活性的重要因子[11-13]。截至目前,关于土壤深度、作物生育期和施肥方式等环境因子及其相互作用如何调控土壤氨化微生物分布特征及其氮转化活性仍不清楚。因此,在农田管理中,能否通过科学调整氮肥种类(化肥、有机氮肥)与施用量,改变土壤氮素转化途径,进而达到提升农业氮肥利用效率、促进作物氮素吸收的目的,尚需进一步研究。
本研究依托沈阳农业大学29年长期定位施肥试验站,针对4种不同施氮处理土壤,采用实时荧光定量PCR(qPCR)方法,从DNA和RNA分析入手,检测土壤深度、采样时期差异下,长期施肥农田土壤中氨化细菌丰度和活性变化,结合土壤净氮矿化速率的变化,探讨氨化细菌对环境变化的响应方式,明确调控氨化细菌的重要环境因子,为长期施氮后土壤供氮能力生物评价以及农田土壤合理施肥提供科学依据。
1 材料与方法 1.1 研究区域与土壤样品采集土壤样品采自辽宁省沈阳市沈阳农业大学始于1987年的棕壤长期定位施肥试验站(41°49′N,123°34′E)。研究区定植作物为玉米(Zea mays L.),每年5月初播种,10月初收获。本试验共选取其中4个施肥处理,即不施肥(CK)、施用化肥(HCF,尿素氮270 kg·hm–2·a–1)、施用减量化肥(LCF,尿素氮135 kg·hm–2·a–1)、化肥减量配施有机肥(CMF,尿素和猪厩肥施用量折合氮量均为135 kg·hm–2·a–1)。于每年5月初播种前,将所有类型肥料进行一次性基施,试验小区面积均设置为69 m2,每个施肥处理3次重复,采用随机区组设计。
土壤样品采集于2016年,采样时期选定为未施用基肥的玉米播种前期(4月20日)、抽雄期(7月20日)和收获后(11月5日),将土壤剖面以20 cm间距分段采样至60 cm。选用五点取样法进行样品采集,剔除土壤样品中作物根系及其他杂质,混合形成每个重复小区的复合样本。将采集好的土壤样品分为两份:一份于–80 ℃保存,用于提取土壤总DNA和RNA;另一份于4 ℃保存,用于各种土壤化学性质的分析。
1.2 土壤化学性质测定土壤pH采用pH计(Metrohm 702,瑞士)测定(水土比为2.5:1)。土壤全氮(TN)和有机碳(SOC)含量采用元素分析仪(Elementar Vario MAX cube,德国)测定;铵态氮(NH4+-N)和硝态氮(NO3–-N)含量采用自动连续流动分析仪(Auto Analyzer 3,德国)测定。具体的测定方法参考Bai等[14],前期研究显示,长期施肥后土壤基本化学性质发生变化[15],其中,土壤主要化学性质测定结果如表 1所示。
|
|
表 1 供试土壤基本化学性质 Table 1 Basic chemical properties of tested soil |
土壤净氮矿化速率测定参照张祚恩等[1]的方法进行,主要步骤为,将供试土壤置于28 ℃恒温培养,定期进行通气和含水量调节,分别在培养0 d和7d时,测定土壤铵态氮(NH4+-N)和硝态氮(NO3–-N)含量,根据培养前后无机氮变化情况,计算土壤净氮矿化速率。计算公式如下:
| $ \text { 净铵化量 }=\text { 培养后 }\left[\mathrm{NH}_4^{+}-\mathrm{N}\right] \text {-培养前 }\left[\mathrm{NH}_4^{+}-\mathrm{N}\right] $ | (1) |
| $ 净硝化量 = 培养后 \left[\mathrm{NO}_3^{-}-\mathrm{N}\right]- 培养前 \left[\mathrm{NO}_3^{-}-\mathrm{N}\right] $ | (2) |
| $ 无机氮累积量 = 净铵化量 + 净硝化量 $ | (3) |
| $ 净氮矿化速率=无机氮累积量/培养时间 $ | (4) |
土壤总DNA和RNA提取分别采用E.Z.N.Z.® Soil DNA Kit(Omega,美国)和E.Z.N.Z.® Soil RNA Kit(Omega,美国),按照说明书进行操作,设3次重复。提取的土壤DNA和RNA采用NanoDrop 2000分光光度计(Thermo Scientific,美国)和Qubit 3.0(Thermo Scientific,美国)检测其质量及浓度,合格样品于–80 ℃保存待用。土壤总cDNA使用HiFi Script cDNA Synthesis Kit(CWBIO,北京)进行合成,并于–20 ℃保存用于后续分析。
1.5 目的基因扩增与克隆使用引物gdh F(5'-CCACTTATTGCATTTAC GTCAAAGA-3')和gdh R(5'-CCCAGTCATCTCAG CAAGAGAA-3')扩增氨化基因gdh[3],PCR反应体系为25 μL,含2×Es Taq Master Mix(CWBIO,北京)12.5 μL,上下游引物各0.5 μL(10 μmol·L–1),核酸模板2 μL,最后用ddH2O补至25 μL。采用AxyPrep DNA Gel Extraction Kit(Axygen,美国)回收gdh基因的PCR产物连接至pMD19-T载体(TakaRa,大连)并转化至大肠杆菌DH5α(TakaRa,大连)感受态细胞中。
使用PurePlasmid Mini Kit(CWBIO,北京)提取含gdh基因的质粒DNA,使用Qubit 3.0测定质粒DNA浓度并计算gdh基因拷贝数。质粒DNA以10倍梯度进行系列稀释,保存于–20 ℃,用于标准曲线制备。
1.6 实时荧光定量PCR测定使用Step One Plus Real-Time PCR System(Applied Biosystems,美国)检测土壤样品中gdh基因拷贝数。使用1.4氨化基因引物gdh F和gdh R进行检测,qPCR反应程序为95 ℃预变性10 min,95 ℃变性15 s,58 ℃退火30 s,最后于72 ℃延伸15 s,45个循环。反应体系为20 μL,含Ultra SYBR Mixture(CWBIO,北京)10 μL,上下游引物各0.8 μL(10 μmol·L–1),核酸模板2 μL,最后用ddH2O补至20 μL。核酸模板为稀释100倍的土壤总DNA和cDNA。qPCR反应通过熔解曲线证实其扩增特异性,标准曲线的扩增效率为90.86%,R2为0.984。
1.7 数据分析采用SPSS 19.0和Excel 2019进行统计分析,显著性分析采用单因素方差分析(ANOVA)和最小显著差异法(LSD),相关性分析采用皮尔逊相关性分析(Pearson’s correlation)。通过R 3.5.1中的Vegan包进行置换多元方差分析(PERMANOVA)、randomForest包进行随机森林分析,以评估环境因子对氨化基因gdh的影响。
2 结果 2.1 长期施氮对土壤矿质氮含量的影响从表 2可以看出,与表土层(0~20 cm)相比,亚表层(20~40 cm)和深层(40~60 cm)土壤中铵态氮含量显著降低(P < 0.05)。相同土层中,采样时期对土壤铵态氮含量的影响表现为,播种前土壤铵态氮含量显著高于抽雄期和收获后(P < 0.05)。不同施肥处理对土壤铵态氮的影响表现为,与不施肥CK处理相比,施肥可不同程度提高土壤铵态氮含量。
|
|
表 2 不同处理土壤矿质氮含量 Table 2 Soil mineral nitrogen content under different treatments |
土壤硝态氮含量在不同土层中无显著差异。从表 2可以看出,相同土层中,采样时期对土壤硝态氮含量的影响表现为,不施肥CK处理硝态氮含量在播种前最低,而化肥减量配施有机肥(CMF)处理在播种前最高,单施化肥(LCF和HCF)处理则表现为抽雄期最高。不同施肥处理对土壤硝态氮的影响表现为,与不施肥CK处理相比,施肥可不同程度提高土壤硝态氮含量,其中,表土层(0~20 cm)中,施用化肥(HCF)处理和化肥减量配施有机肥(CMF)处理可显著增加土壤硝态氮含量;亚表层(20~40 cm)和深层(40~60 cm)土壤中,各施肥(LCF、HCF和CMF)处理均显著增加土壤硝态氮含量(P < 0.05)。
综上,土壤铵态氮含量在表土层(0~20 cm)最高,硝态氮含量在不同土层中无显著变化,施肥可显著提高二者含量;土壤铵态氮含量在播种前最高,硝态氮含量在不同施肥处理下变化趋势不同。
2.2 长期施氮对土壤净氮矿化速率的影响土壤净矿化速率在不同土层中无显著差异,三个采样时期中,抽雄期土壤净氮矿化速率最高,播种前最低(P < 0.05,图 1)。从图 1可以看出,相同土层中,不同施肥处理对土壤净矿化速率的影响表现为,与不施肥CK处理相比,单施化肥(LCF和HCF)处理大多表现为显著增加播种前和抽雄期土壤净矿化速率(P < 0.05),但显著降低收获后表土层(0~20 cm)和深层(40~60 cm)土壤净氮矿化速率(P < 0.05);化肥减量配施有机肥(CMF)对土壤净矿化速率多表现出稳定或提高作用。
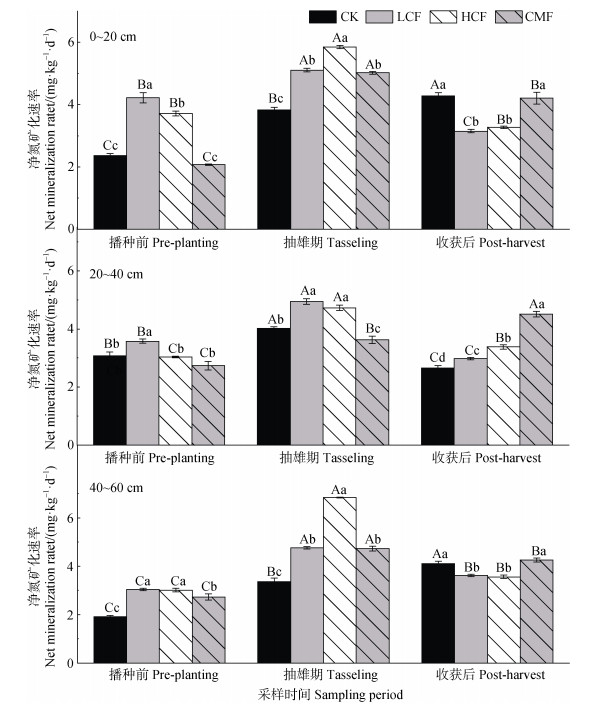
|
注:不同大写字母代表相同施肥处理不同采样时间间差异显著(P < 0.05),不同小写字母代表相同采样时间不同施肥处理间差异显著(P < 0.05)。 Note: Different uppercase letters represent significant differences between different sampling periods for the same fertilization treatment (P < 0.05), while different lowercase letters represent significant differences between different fertilization treatments for the same sampling period (P < 0.05). 图 1 不同处理的土壤净氮矿化速率 Fig. 1 Soil net nitrogen mineralization rate under different treatments |
综上,采样时期显著影响土壤净氮矿化速率。与不施肥CK处理相比,单施化肥(LCF和HCF)显著增加土壤净矿化速率(P < 0.05),化肥减量配施有机肥(CMF)则无明显差异。
2.3 长期施氮对土壤氨化基因gdh丰度的影响土壤gdh基因拷贝数如图 2所示,不同处理gdh基因丰度在6.35×104~2.75×108 copies·g–1(干土)。其中,gdh基因丰度在不同土层中无显著差异。相同土层中,采样时期对gdh基因丰度的影响表现为,与播种前相比,抽雄期和收获后gdh基因丰度均显著提高(P < 0.05)。不同施肥处理对土壤gdh基因丰度的影响表现为,与不施肥CK处理相比,施用减量化肥(LCF)处理显著提高各土层播种前期gdh基因丰度(P < 0.05);化肥减量配施有机肥(CMF)处理则不同程度增加各土层采样时期下gdh基因丰度(表土层抽雄期除外);施用化肥(HCF)处理土壤gdh基因丰度在不同时期和土层与不施肥CK处理无显著差异(图 2)。
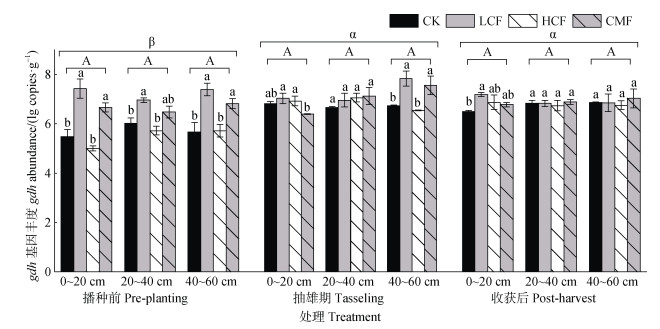
|
注:不同大写字母代表不同采样深度间差异显著(P < 0.05),不同小写字母代表不同施肥处理间差异显著(P < 0.05),不同罗马字母代表不同采样时期间差异显著(P < 0.05),下同。 Note: Different uppercase letters represent significant differences between different sampling depths (P < 0.05), different lowercase letters represent significant differences between different fertilization treatments (P < 0.05), and different Roman letters represent significant differences between different sampling periods (P < 0.05). The same as below. 图 2 不同处理土壤gdh基因丰度 Fig. 2 Abundance of soil gdh gene under different treatments |
综上,与不施肥处理CK相比,施用减量化肥(LCF)处理不同程度提高gdh基因丰度。长期施氮并未减少土壤氨化细菌丰度,适量施加氮肥可显著增加土壤氨化细菌丰度。该现象在施用减量化肥(LCF)的表土层和深层土壤,以及化肥减量配施有机肥(CMF)的深层土壤中尤为明显。
2.4 长期施氮对土壤氨化基因gdh活性的影响如图 3所示,土壤氨化基因gdh在RNA与DNA水平的丰度比值(RNA/DNA)在0.07~0.97之间。其中,土壤深度、采样时期和施肥处理均显著影响gdh基因活性。与深层(40~60 cm)土壤相比,抽雄期表土层(0~20 cm)土壤显著增加土壤gdh基因活性(P < 0.05)。相同土层中,采样时期对gdh基因活性的影响表现为,抽雄期gdh基因活性最高,播种期最低(P < 0.05)。不同施肥处理对gdh基因活性的影响表现为,与不施肥CK处理相比,单施化肥(LCF和HCF)处理均可显著增加表层(0~20 cm)土壤播种前土壤gdh基因活性,显著降低其表层(0~20 cm)和深层(40~60 cm)土壤收获后gdh基因活性(P < 0.05);化肥减量配施有机肥(CMF)虽显著降低各土层播种前gdh基因活性(P < 0.05),却较好地稳定或提升收获后基因活性;此外,所有施肥(LCF、HCF和CMF)处理均显著增加亚表层(20~40 cm)收获后gdh基因活性。
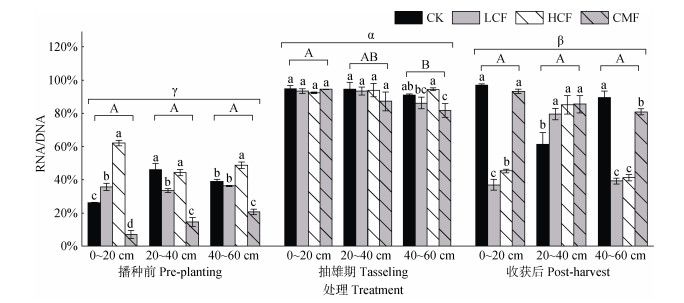
|
图 3 不同处理土壤gdh基因RNA/DNA比 Fig. 3 RNA/DNA ratio of soil gdh genes under different treatments |
综上,与不施肥CK处理相比,单施化肥(LCF和HCF)处理显著增加播种前表土层(0~20 cm)gdh基因活性,降低其收获后活性,而化肥减量配施有机肥(CMF)处理有助于稳定或提升收获后各土层gdh基因活性;采样时期显著影响gdh基因活性,其变化趋势为,抽雄期、收获后、播种前依次降低。
2.5 环境因子对氨化基因gdh的影响将环境因子和氨化基因gdh丰度及活性分别进行多元方差分析(PERMANOVA)。由图 4可以看出,施肥处理、采样时期、土层深度及其交互作用对土壤氨化基因gdh丰度和活性的总贡献率分别为71.68%和94.34%。其中,gdh基因丰度与采样时期、施肥处理及二者的交互作用显著相关(P < 0.05;图 4a)。与gdh基因丰度不同,gdh基因活性与土层深度、采样时期、施肥处理及其交互作用均显著相关(P < 0.05,图 4b),其中采样时期对其独立影响贡献率为50.63%(P < 0.001),显著高于其他影响因素。
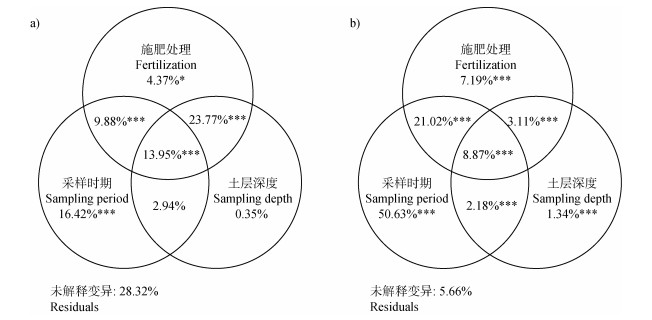
|
注:*、**和***分别表示P < 0.05、P < 0.01和P < 0.001。下同。 Note: *, ** and *** represented P < 0.05, P < 0.01 and P < 0.001. The same as below. 图 4 不同处理土壤gdh基因丰度(a)和活性(b)的置换多元方差分析 Fig. 4 Permutational multivariate analysis of variance of soil gdh gene abundance (a) and activity (b) under different treatments |
相关性分析(Pearson’s correlation)结果(表 3)显示,土壤gdh基因丰度(P < 0.01)、活性(P < 0.001)均与净氮矿化速率呈显著正相关。土壤gdh基因丰度(P < 0.01)、活性(P < 0.001)和净氮矿化速率(P < 0.05)与土壤铵态氮含量呈显著负相关,且三者均与铵硝比呈极显著负相关(P < 0.001)。此外,土壤gdh基因丰度(P < 0.05)、活性(P < 0.01)和净氮矿化速率(P < 0.001)均与硝态氮含量呈显著正相关,与土壤有机碳、全氮、C/N均无明显相关性(P > 0.05)。
|
|
表 3 土壤化学性质与gdh基因丰度、活性和净矿化速率的相关性 Table 3 Correlation analysis of soil chemical properties with gdh gene abundance, activity, and net mineralization rate |
采用随机森林(ntree = 1 000)分析,以进一步反映土壤化学性质对gdh基因丰度和活性的影响程度。结果(图 5)表明,铵硝比对土壤gdh基因丰度和活性的贡献率最高,土壤pH、全氮、有机碳、矿质氮、碳氮比等土壤性质则表现各异。与gdh基因丰度相比,gdh基因活性对土壤铵硝比和矿质氮等环境因子变化的响应更为明显。
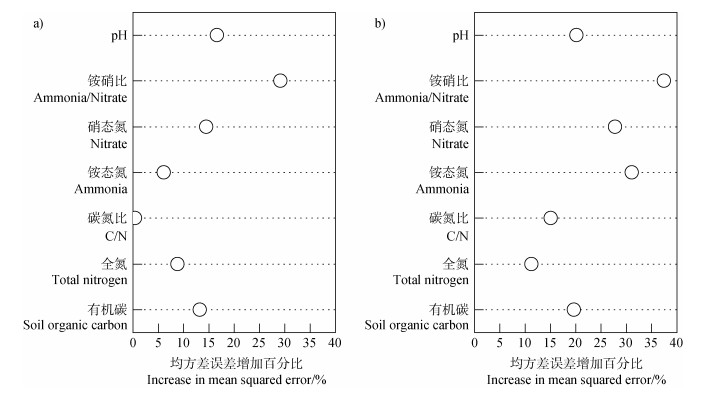
|
图 5 土壤化学性质对gdh基因丰度(a)和活性(b)的随机森林分析 Fig. 5 Random forest analysis of soil chemical properties for gdh gene abundance (a) and activity (b) |
施肥能迅速改变土壤可利用氮素含量,进而影响参与氮素周转的微生物丰度、活性及氮素转化过程[16]。本研究中,与不施肥CK处理相比,施用减量化肥(LCF)和化肥减量配施有机肥(CMF)处理可不同程度提高氨化基因gdh丰度,而施用化肥(HCF)处理对gdh基因丰度无显著影响(P > 0.05,图 2),该结果与李春越等[9]采用可培养技术研究土壤氨化细菌的研究结果相一致。其原因可能是,适量施氮可提高土壤养分含量,促进作物生长和根系分泌物的释放,为氨化微生物生长提供充足的营养物质和反应底物,进而提高氨化细菌的数量和活性[17]。当氮肥施用量过高时,大量无机氮肥施入土壤,土壤铵态氮含量增加直至接近饱和状态,抑制氨化细菌数量及其参与的氨化作用[5]。
土壤净氮矿化速率常用于表征土壤中氮素可利用性[1],土壤gdh基因在RNA与DNA水平的丰度比值(RNA/DNA)一定程度上代表了氨化细菌的生长速度和活跃程度[18]。随机森林分析结果也显示,gdh基因活性对环境因子的响应更为敏感(图 4b),表明与DNA数据相比,RNA/DNA分析可更准确反映微生物代谢活性。本研究中,土壤净氮矿化速率和gdh基因活性呈极显著正相关(P < 0.001,表 3),该结果进一步验证了氨化细菌在土壤氮矿化过程中的重要贡献。与不施肥CK处理相比,单施化肥(LCF和HCF)显著增加播种前表土层(0~20 cm)gdh基因活性(P < 0.05,图 3),而化肥减量配施有机肥(CMF)处理有助于稳定收获后土壤gdh基因活性。李平等[19]研究结果指出,土壤中碳氮比提高可降低氨化细菌活性,该结果与本研究中长期化肥减量配施有机肥(CMF)后,增加土壤中有机碳含量[15],降低gdh活性(图 3)结果相似。此外,与化肥减量配施有机肥(CMF)处理比,单施化肥(LCF和HCF)处理降低了收获后土壤gdh活性(图 3),相应减少了下一年份土壤铵态氮含量,这可能是引起播种前期该处理土壤gdh基因活性相对较高的原因之一。
3.2 不同采样时期对氨化基因和净氮矿化速率的影响通常认为,作物不同生育时期土壤温度等参数变化,能够调节微生物数量、种群组成和土壤酶活性等生物学性质,进而影响土壤元素循环和养分有效性[20]。本研究中,采样时期是影响土壤氨化基因gdh丰度和活性以及土壤氮矿化的主要调控因素(图 4,P < 0.001)。所有处理土壤gdh基因丰度均在抽雄期较高(图 2),且土壤氨化基因活性和净氮矿化速率也表现出抽雄期显著高于播种前和收获后(P < 0.05;图 1和图 3)。上述结果暗示,与播种前(11.5 ℃)和收获后(–0.7 ℃)相比,抽雄期温度(25.1 ℃)更适宜土壤氨化细菌生长与繁殖,进而促进土壤的氮素矿化作用[21],该结果与杨贵森等[12]基于稀释培养法获得的结果相类似。此外,不同生育时期作物对氮素的吸收状况也会影响土壤氨化细菌的数量与活性[22]。玉米抽雄期对土壤氮素等养分的吸收量增加,导致土壤矿质氮含量减少,进而推动土壤氨化细菌通过启动矿化过程来满足土壤氮素供应。
唐海明等[23]研究认为,化学氮肥可通过刺激土壤硝化作用加快土壤氮矿化作用。本研究也获得了相似结果(图 1),与不施肥CK处理相比,施肥(LCF、HCF和CMF)均显著增加抽雄期表层土壤净氮矿化速率(P < 0.05),且单施化肥(LCF和HCF)处理增幅更为明显。与抽雄期不同,玉米收获后期表层土壤氮矿化速率因施肥种类不同表现出显著差异(图 1):单施化肥(LCF和HCF)会显著降低土壤矿化速率(P < 0.05),化肥减量配施有机肥(CMF)能较好地稳定土壤氮矿化速率。因此,与单施化肥(LCF和HCF)相比,化肥减量配施有机肥(CMF)有助于土壤有机氮的分解作用,并在更长时期内维持土壤氮素供应,满足作物生长需求。
3.3 土壤化学性质对氨化基因和净氮矿化速率的影响土壤化学性质的改变可干扰其生境内微生物的数量与活性[11]。土壤铵态氮和硝态氮统称为矿质氮,是作物直接吸收利用土壤有效态氮的主要形式[1]。本研究通过皮尔逊相关性分析发现,土壤铵硝比和矿质氮均可显著影响gdh基因丰度、活性和土壤净氮矿化速率(表 3)。土壤化学性质重要性排序结果显示,铵硝比是影响gdh基因和净氮矿化率的重要因子,并与二者呈显著负相关(图 5)。分析其原因可能与氮代谢过程中酶活性的诱导与抑制有关。通常认为,适量铵态氮供应有利于诱导硝酸还原酶活性,推动氨化进程,并通过提高谷氨酰胺合成酶活性,增加对氨的亲和作用。然而,随着环境铵态氮浓度增加,硝酸还原酶活性受到明显抑制,氨同化进程受到阻碍,导致氨毒害现象产生[24]。此外,由于铵态氮带正电荷易被土壤胶体吸附或固定在土壤矿物晶格中,难以向下淋溶,不同施肥处理后土壤铵态氮多固持于表层,潜在影响土壤净氮矿化速率[25]。随土壤深度增加,化肥减量配施有机肥(CMF)处理显著增加氨化基因gdh丰度(图 2),可能是由于深层(40~60 cm)土壤中,土壤养分相对贫瘠,氨化细菌开始利用有机肥中的有机质作为反应底物完成氨化作用[22]。这进一步证实氨化细菌的生态策略,即氮素充足时氨化细菌优先利用低分子量氮进行氮同化作用,而随着可利用氮素含量减少,氨化细菌对有机质的分解作用会逐渐增强[26]。
尽管大量研究认为,土壤pH是影响细菌分布的重要因素,但本研究中并未发现土壤pH与氨化基因gdh丰度和活性之间存在显著性关系(表 3)。分析其原因,可能与供试土壤pH变化范围(5.16~5.91)较窄有关[27]。此外,土壤中大部分的异养细菌均可进行氨化作用,微生物具有高度的“功能冗余”特征,菌群之间的替代作用,使得具有氨化功能的微生物在数量或活性上保持相对稳定[8,28]。然而,哪些氨化细菌是参与土壤氮素转化的关键类群,以及氨化细菌种群的更替在多大程度上影响土壤的氨化强度,这些问题仍需进一步研究。
4 结论本研究通过检测gdh基因和土壤氮矿化速率揭示长期施氮对土壤氨化细菌丰度、活性及土壤氨化作用的影响。结果表明,与gdh基因丰度相比,gdh基因DNA/RNA表征的氨化活性对环境因子的响应更为敏感,并与土壤氮矿化速率极显著相关。土壤氨化基因gdh活性与氮矿化速率受采样时期显著影响,铵硝比是影响土壤氨化基因丰度和氮矿化速率的重要环境因子。长期施加化肥虽明显提高玉米抽雄期土壤氮矿化速率,化肥减量配施有机肥(CMF)则有助于玉米收获后稳定土壤氮矿化速率,通过土壤有机氮的氨化过程,潜在增强土壤持续供氮能力,促进氮素周转与供应。
| [1] |
Zhang Z E, Diao H J, Hao J, et al. The effects of different nitrogen compounds additions on net nitrogen mineralization of grassland in the agro-pastoral ecotone in northern China (In Chinese)[J]. Acta Agrestia Sinica, 2023, 31(5): 1322-1330. [张祚恩, 刁华杰, 郝杰, 等. 不同氮化合物添加对农牧交错带草地土壤净氮矿化速率的影响[J]. 草地学报, 2023, 31(5): 1322-1330.]
(  0) 0) |
| [2] |
Liu S, Zhang H, Zhang Q S, et al. Screening, identification and ammoniation features of high effective ammonifying Bacillus strains isolated from tobacco-planted soils (In Chinese)[J]. Chinese Tobacco Science, 2020, 41(2): 15-20. [刘尚, 张红, 张乾申, 等. 烟区土壤高效氨化芽孢杆菌菌株的筛选鉴定及特性研究[J]. 中国烟草科学, 2020, 41(2): 15-20.]
(  0) 0) |
| [3] |
Luo G W, Friman V P, Chen H, et al. Long-term fertilization regimes drive the abundance and composition of N-cycling-related prokaryotic groups via soil particle-size differentiation[J]. Soil Biology and Biochemistry, 2018, 116: 213-223. DOI:10.1016/j.soilbio.2017.10.015
(  0) 0) |
| [4] |
Gong Y Y, Yan L, Lin J Z, et al. Research advances on glutamate dehydrogenase genes of lower organisms for crop genetic improvement (In Chinese)[J]. Life Science Research, 2021, 25(1): 31-38. [龚茵茵, 燕璐, 林建中, 等. 低等生物谷氨酸脱氢酶基因用于作物遗传改良的研究进展[J]. 生命科学研究, 2021, 25(1): 31-38.]
(  0) 0) |
| [5] |
Nett L, Averesch S, Ruppel S, et al. Does long-term farmyard manure fertilization affect short-term nitrogen mineralization from farmyard manure?[J]. Biology and Fertility of Soils, 2010, 46(2): 159-167. DOI:10.1007/s00374-009-0416-5
(  0) 0) |
| [6] |
Ministry of Agriculture and Rural Affairs. Notice of the Ministry of Agriculture and Rural Affairs on Issuing the Action Plan for Reducing Chemical Fertilizer by 2025 and the Action Plan for Reducing Chemical Pesticides by 2025[EB/OL]. 2022 [2022-11-18]. https://www.moa.gov.cn/govpublic/ZZYGLS/202212/t20221201_6416398.htm.[农业农村部. 农村农业部关于印发《到2025年化肥减量化行动方案》和《到2025年化学农药减量化行动方案》的通知[EB/OL]. 2022 [2022-11-18]. https://www.moa.gov.cn/govpublic/ZZYGLS/202212/t20221201_6416398.htm.]
(  0) 0) |
| [7] |
Chu C, Wu Z Y, Huang Q R, et al. Effect of organic matter promotion on nitrogen-cycling genes and functional microorganisms in acidic red soils (In Chinese)[J]. Environmental Science, 2020, 41(5): 2468-2475. [储成, 吴赵越, 黄欠如, 等. 有机质提升对酸性红壤氮循环功能基因及功能微生物的影响[J]. 环境科学, 2020, 41(5): 2468-2475.]
(  0) 0) |
| [8] |
Tan Z J, Zhou W J, Zhang Y Z, et al. Effect of fertilization systems on microbes in the paddy soil (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2007, 13(3): 430-435. [谭周进, 周卫军, 张杨珠, 等. 不同施肥制度对稻田土壤微生物的影响研究[J]. 植物营养与肥料学报, 2007, 13(3): 430-435.]
(  0) 0) |
| [9] |
Li C Y, Xue Y L, Wang Y, et al. Effects of long-term fertilization on soil nitrogen-transforming bacteria and phosphate-solubilizing bacteria in rainfed cropland of Loess Plateau, China (In Chinese)[J]. Chinese Journal of Ecology, 2020, 39(11): 3658-3667. [李春越, 薛英龙, 王益, 等. 长期施肥对黄土旱塬农田土壤氮素生理菌群和解磷菌的影响[J]. 生态学杂志, 2020, 39(11): 3658-3667.]
(  0) 0) |
| [10] |
Yong T W, Chen P, Liu X M, et al. Effects of reduced nitrogen on soil ammonification, nitrification, and nitrogen fixation in maize-soybean relay intercropping systems (In Chinese)[J]. Acta Agronomica Sinica, 2018, 44(10): 1485-1495. [雍太文, 陈平, 刘小明, 等. 减量施氮对玉米-大豆套作系统土壤氮素氨化、硝化及固氮作用的影响[J]. 作物学报, 2018, 44(10): 1485-1495.]
(  0) 0) |
| [11] |
Ouyang Y, Norton J M. Short-term nitrogen fertilization affects microbial community composition and nitrogen mineralization functions in an agricultural soil[J]. Applied and Environmental Microbiology, 2020, 86(5): e02278-e02219.
(  0) 0) |
| [12] |
Yang G S, Lü X Y, Hu R, et al. Spatial and temporal patterns of soil microbial functional groups in different microhabitats in sand-fixing revegetation area in the Tengger Desert (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(2): 580-590. DOI:10.11766/trxb202006140295 [杨贵森, 吕星宇, 虎瑞, 等. 腾格里沙漠固沙植被区微生境土壤微生物功能群时空格局[J]. 土壤学报, 2022, 59(2): 580-590.]
(  0) 0) |
| [13] |
Song S Y, Lü S Y, Qiu L J, et al. Responses of soil nitrogen mineralization and enzyme activities at different depths to nitrogen additions in an evergreen broad-leaved forest (In Chinese)[J]. Acta Ecologica Sinica, 2022, 42(22): 9045-9056. [宋思意, 吕思扬, 邱岭军, 等. 华西雨屏区常绿阔叶林不同深度土壤氮矿化及酶活性对模拟氮沉降的响应[J]. 生态学报, 2022, 42(22): 9045-9056.]
(  0) 0) |
| [14] |
Bai S H, Blumfield T J, Xu Z H, et al. Soil organic matter dynamics and nitrogen availability in response to site preparation and management during revegetation in tropical Central Queensland, Australia[J]. Journal of Soils and Sediments, 2012, 12(3): 386-395. DOI:10.1007/s11368-011-0466-9
(  0) 0) |
| [15] |
An T T, Wang F, Ren L L, et al. Ratio of nitrate to ammonium mainly drives soil bacterial dynamics involved in nitrate reduction processes[J]. Applied Soil Ecology, 2022, 169: 104164. DOI:10.1016/j.apsoil.2021.104164
(  0) 0) |
| [16] |
Fontaine S, Mariotti A, Abbadie L. The priming effect of organic matter: A question of microbial competition?[J]. Soil Biology and Biochemistry, 2003, 35(6): 837-843. DOI:10.1016/S0038-0717(03)00123-8
(  0) 0) |
| [17] |
Sun R B, Li W Y, Hu C S, et al. Long-term urea fertilization alters the composition and increases the abundance of soil ureolytic bacterial communities in an upland soil[J]. FEMS Microbiology Ecology, 2019, 95(5): fiz044.
(  0) 0) |
| [18] |
Wu J Y, Gao W M, Johnson R H, et al. Integrated metagenomic and metatranscriptomic analyses of microbial communities in the meso- and bathypelagic realm of North Pacific Ocean[J]. Marine Drugs, 2013, 11(10): 3777-3801. DOI:10.3390/md11103777
(  0) 0) |
| [19] |
Li P, Lang M, Li Y S, et al. Effects of different fertilization on nitrification and mineralization in black soil (In Chinese)[J]. Journal of Agro-Environment Science, 2015, 34(7): 1326-1332. [李平, 郎漫, 李煜姗, 等. 不同施肥处理对黑土硝化作用和矿化作用的影响[J]. 农业环境科学学报, 2015, 34(7): 1326-1332.]
(  0) 0) |
| [20] |
Zhang H M, Li X L, Yang F. Effects of warming and nitrogen fertilization on soil microbial nitrogen physiology groups in alpine meadow (In Chinese)[J]. Acta Agrestia Sinica, 2020, 28(3): 606-612. [张慧敏, 李希来, 杨帆. 增温和氮添加对高寒草甸土壤微生物氮素生理群的影响[J]. 草地学报, 2020, 28(3): 606-612.]
(  0) 0) |
| [21] |
Liaoning Provincial Bureau of Statistics. Liaoning statistical yearbook-2017 (In Chinese). Beijing: China Statistics Press, 2017. [辽宁省统计局, 国家统计局辽宁调查总队. 辽宁统计年鉴-2017[M]. 北京: 中国统计出版社, 2017.]
(  0) 0) |
| [22] |
Lu X N, Chen L Y, Li Y C, et al. Effects of exchanging litters on soil nitrogen mineralization and microbial contributions in Moso bamboo (Phyllostachys edulis) and broad-leaved forests (In Chinese)[J]. Acta Ecologica Sinica, 2022, 42(12): 4988-4997. [卢小妮, 陈露雨, 李永春, 等. 毛竹林和阔叶林凋落物互置对土壤氮矿化的影响及微生物贡献[J]. 生态学报, 2022, 42(12): 4988-4997.]
(  0) 0) |
| [23] |
Tang H M, Shi L H, Wen L, et al. Effects of different long-term fertilizer managements on rhizosphere soil nitrogen in the double-cropping rice field (In Chinese)[J]. Ecology and Environmental Sciences, 2023, 32(3): 492-499. [唐海明, 石丽红, 文丽, 等. 长期施肥对双季稻田根际土壤氮素的影响[J]. 生态环境学报, 2023, 32(3): 492-499.]
(  0) 0) |
| [24] |
Chang X, Zhang Y L, Xu L Q, et al. Effects of different nitrogen forms on key enzymes of nitrogen assimilation in sugar beet[J/OL]. Crops, 2024, 1—9[2024-05-22]. http://kns.cnki.net/kcms/detail/11.1808.S.20240318.1817.002.html.[常晓, 张云龙, 徐翎清, 等. 不同氮素形态配比对甜菜氮同化关键酶的影响[J/OL]. 作物杂志, 2024, 1—9[2024-05-22]. http://kns.cnki.net/kcms/detail/11.1808.S.20240318.1817.002.html.]
(  0) 0) |
| [25] |
Chen D K, Luo H, Lü J R, et al. Mineral nitrogen accumulation and its spatial distribution in soils in dense planting dwarf rootstock apple orchard on the Weibei dry plateau, Northwest China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2022, 33(1): 97-103. [陈东凯, 骆汉, 吕佼容, 等. 渭北旱塬矮砧密植苹果园土壤矿质氮积累与空间分布特征[J]. 应用生态学报, 2022, 33(1): 97-103.]
(  0) 0) |
| [26] |
Zhu Z K, Fang Y Y, Liang Y Q, et al. Stoichiometric regulation of priming effects and soil carbon balance by microbial life strategies[J]. Soil Biology and Biochemistry, 2022, 169: 108669.
(  0) 0) |
| [27] |
Fierer N. Embracing the unknown: Disentangling the complexities of the soil microbiome[J]. Nature Reviews Microbiology, 2017, 15(10): 579-590.
(  0) 0) |
| [28] |
Isobe K, Ise Y, Kato H, et al. Consequences of microbial diversity in forest nitrogen cycling: Diverse ammonifiers and specialized ammonia oxidizers[J]. The ISME Journal, 2020, 14(1): 12-25.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


