土壤是地球生态系统中至关重要的组成部分,其中包含着多种物质,包括有机物、无机矿物和微生物胶体颗粒。其中,1~1 000 nm的颗粒被认为是土壤中最活跃的成分[1],约占土壤比表面积的80%和土壤表面电荷的85%[2-3]。这些颗粒通常被称为土壤胶体颗粒,其相互作用对于土壤团聚体的稳定性[4]和土壤物质迁移[5]以及土壤侵蚀[6-8]产生着重要影响。
Derjaguin、Landau、Verwey、Overbeek(DLVO)理论提供了有关胶体粒子相互作用的重要理论基础。根据该理论,胶体粒子之间的相互作用主要由静电斥力和长程范德华引力主导。当水进入土壤时,电解质被稀释,浓度降低,导致凝聚体中的静电斥力大于范德华引力,从而引发土壤团聚体破碎、土壤孔隙塌陷或堵塞。相反,当范德华引力大于静电斥力时,团聚体和土壤孔隙保持稳定[9-12]。
动态光散射(DLS)技术[13]被广泛应用于研究土壤颗粒之间的相互作用。该技术在土壤黏土矿物和腐殖质(主要包括胡敏酸(HA)和富里酸(FA))[14-15]等的研究中取得了显著进展。以天然有机质(NOM)的凝聚研究为例,Wei等[16]发现聚合过程受NOM颗粒性质和溶液中电解质的影响;Tan等[17]应用DLS技术估计了Suwannee河NOM的凝聚行为,发现存在显著的离子特异性效应;Li等[18]通过DLS测量HA的凝聚过程,发现Mg2+诱导的HA凝聚的临界凝聚浓度(CCC)值大于Ca2+;Zhang等[19]的研究结果表明,在高浓度电解质下,HA仍然保持着稳定性,这可能与其较高的电荷密度和较低的范德华引力有关;其结果还表明,对于不同组分具有任意混合比例的混合组分,混合组分聚合中仅出现一个CCC值,且双组分混合胶体的CCC值始终在单组分聚合体的CCC值之间,三组分聚合体的CCC值始终在双组分聚合体的CCC值之间。
然而,目前的研究主要集中在土壤中某单组分胶体颗粒在单一电解质体系中的相互作用上,而实际土壤既含有多种胶体成分,也包含有多种不同的电解质。不同组分的颗粒具有不同的静电斥力和范德华引力,不同电解质离子对双电层压缩的能力也存在差异[20],因此不同组分的颗粒或离子间的相互作用方式会有很大不同。本研究以黏土矿物蒙脱石(Mont)和有机胶体HA构成混合胶体体系,以LiNO3、NaNO3、KNO3和CsNO3四种电解质两两混合构成混合电解质条件,探究混合电解质对于矿物-有机混合体的凝聚效应与机理,为揭示更复杂的胶体和电解质组成背景下的真实土壤胶体颗粒凝聚行为提供重要参考。
1 材料与方法 1.1 胶体悬液的制备Mont由中国内蒙古物华天宝矿产资源有限公司提供,HA提取自重庆北碚(29.69°N,106.38°E)竹林地。
1.1.1 Mont胶体悬液的制备与性质测定Mont胶体的制备采用静水沉降虹吸法[2]。具体步骤如下:(1)称取50 g Mont样品放入500 mL烧杯中;(2)加入0.5 mol·L–1的KOH溶液10 mL,用超纯水定容至500 mL,搅拌均匀;(3)使用探针型超声波处理器(Scientz-IID,宁波新芝生物科技有限公司)在20 kHz下分散15 min;(4)将悬液转移至5 L烧杯并用超纯水定容至刻度;(5)在多孔圆盘搅拌后,悬液在25 ℃恒温条件下静置;(6)根据Stokes沉降公式,计算出小于200 nm颗粒沉降10 cm所需的时间,并在计算时间内用虹吸管反复提取小于200 nm胶体颗粒;(7)所提胶体悬液收集后用0.1 mol·L–1 HCl溶液进行浓缩,经水洗三次,低温保存为H+饱和胶体;(8)通过烘干法(温度为105℃)测得Mont胶体悬液的颗粒密度为24 g·L–1;(9)取出一部分H+饱和胶体,用超纯水反复清洗至接近中性,接着使用0.01 mol·L–1 KOH调节体系的pH至6.5,此时,氢质胶体被转化为钾饱和样;(10)再次使用超声波分散器(20 kHz)分散胶体悬液15 min,使其呈稳定分散状态用于胶体的凝聚实验。Mont的表面电荷性质采用联合测定法[21]测定。
为了制备DLS测量所需的Mont胶体悬液,将10.5 mL H+饱和Mont悬液用489.5 mL超纯水稀释,然后用0.01 mol·L–1 KOH溶液(约4 mL)调节pH至6.5。然后,将Mont悬液用探针式超声波处理器在20 kHz下分散15 min,得到的HA胶体悬液颗粒密度为500 mg·L–1。
1.1.2 HA胶体悬液的制备与性质测定HA胶体的提取参照Pollo法和国际胡敏酸协会(IHSS)的标准方法[22]:(1)称取600 g风干土样(过1 mm筛网),置于5 L烧杯中,加入超纯水(土水比1︰5)并充分搅拌,然后弃去上清液。接着,加入3 L 0.1 mol·L–1 NaOH和Na4P2O7混合溶液,混匀后静置24 h,取上部黑棕色悬液备用。(2)加入1.5 L 0.1 mol·L–1的NaOH与Na4P2O7的混合溶液,重复浸提3次,离心(转速2 000 r·min–1,离心时间10 min),用HCl溶液调节悬液pH为1.0~1.5,在60~70 ℃恒温培养箱保温1~2 h,静置过夜。(3)第二天,使用虹吸管将上层的橙黄色清液吸出,剩下的黑棕色悬液经离心(转速3 000 r·min–1,离心时间15 min)后可收集到HA沉淀。(4)用适量0.1 mol·L–1 KOH和0.3 mol·L–1 KCl混合溶液充分溶解HA沉淀,然后用HCl溶液调节pH为1.0,静置12~16 h后再次离心(转速4 000 r·min-1,离心时间10 min),重复4次左右收集HA沉淀。最后,通过水洗直至HA溶液pH约为3.5,将HA胶体低温保存于7~8℃条件下。
取少量HA胶体悬液,加入少量0.01 mmol·L–1 KOH和去离子水,得到的悬液采用探针型超声波处理器超声分散15 min(20 kHz)后,保存为K+饱和胶体(pH6.5)。采用DLS测定K+饱和HA胶体颗粒的粒径(水动力学直径)为120±10 nm。
HA的表面电荷性质采用联合测定法[23]测定。
1.2 有机-无机混合胶体的制备取上述制备好的Mont胶体和HA胶体进行混合,制备成不同比例的混合胶体。具体设置如下:DLS实验中,有机-无机混合体总颗粒密度控制为50 mg·L–1。考虑到有机-无机混合体的平均效应的显著性(以便于与单一无机组分胶体的凝聚结果进行对比)以及HA在真实土壤中的含量,本研究将混合体的比例设置为“99%Mont + 1%HA”、“97%Mont + 3%HA”。
1.3 动态光散射(DLS)实验动态光散射是一种利用光子相关光谱技术的方法,它通过分析由于颗粒布朗运动引起的散射光强信号的时间波动,获得颗粒的粒径(水动力学直径)信息,适用于粒径小于10 μm的颗粒。本研究中,光散射实验采用广角度动态静态激光散射仪(BI-200SM,Brookhaven公司,美国)和BI-9000AT数字相关器,激光的功率设定为15 mW,通过恒温循环器将温度控制在25℃。实验中,散射角度被设定为90°,狭缝选择为200 μm,激光波长为532 nm。
将胶体悬液加入散射瓶中,然后加入去离子水和多组分电解质溶液(LiNO3、NaNO3、KNO3,CsNO3)(NO3–可在水溶液中完全解离,在凝聚实验中对溶液pH无明显影响)来调节电解质浓度。多组分电解质的比例为以上四种电解质两两组合,1︰1比例加入。以LiNO3+NaNO3体系为例来说明测定步骤:(1)使用移液枪将胶体悬液吸取至散射瓶中,吸取的悬液体积由烘干后得到的胶体悬液颗粒密度决定。(2)添加去离子水和1 mol·L–1的LiNO3溶液以及1 mol·L–1的NaNO3溶液,以调节胶体体系的电解质浓度,使得体系总体积为10 mL,同时控制颗粒密度在50 mg·L–1。(3)在298±0.5 K的温度下,使用DLS技术每30 s记录一次混合胶体颗粒的水动力直径。根据Jia等[23]建立的理论,可通过观察胶体颗粒凝聚过程中的总体平均凝聚速率(TAA)来计算胶体颗粒临界凝聚浓度值(CCC):
| $ {\tilde v_T}({c_0}) = \frac{1}{{{t_0}}}\int_0^{{t_0}} {\tilde v(t, \;{c_0})dt = } \frac{1}{{{t_0}}}\int_0^{{t_0}} {\frac{{D(t) - {D_0}}}{t}dt} $ | (1) |
式中,
| $ \Delta E({c_0}) = - k{\text{T}}ln\frac{{{{\tilde v}_{\text{T}}}({c_0})}}{{{{\tilde v}_{\text{T}}}({\text{CCC}})}} $ | (2) |
式中,
DLS测量的Mont和HA的粒径(水动力直径)分布如图 1a所示。Mont和HA颗粒的水动力直径分别为277.5±10 nm和120.3±10 nm。Mont和HA的粒径不随时间变化(图 1b),说明悬浮液是稳定的。当两种组分混合为“99%Mont + 1%HA”、“97%Mont + 3%HA”,采用DLS检测混合组分的粒度分布,结果如图 1b和表 1所示。可以看出,混合组分的粒径在30 min内保持不变,说明不同混合组分的颗粒在悬浮液中共存,混合组分悬浮液保持稳定。
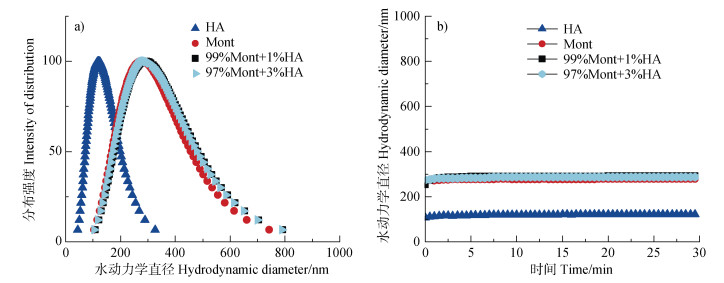
|
注:HA为胡敏酸,Mont为蒙脱石。下同。 Note:HA stands for humic acid,and Mont stands for montmorillonite. The same as below. 图 1 HA和Mont胶体及其混合胶体水动力直径分布(a)以及水动力直径随时间的变化(b) Fig. 1 Distribution of hydrodynamic diameters of HA and Mont colloids and their mixed colloids(a), and changes in hydrodynamic diameter over time(b) |
|
|
表 1 各组分胶体的粒径 Table 1 Particle sizes of various component colloids |
经联合测定法测定,Mont的比表面积(S)为677.0±23 m2·g–1,表面电荷量(cT)为–67.30± 0.32 cmol·kg–1,表面电荷密度(σ)为0.0959 C·m–2;HA的比表面积(S)为2507±232 m2·g–1,表面电荷量(cT)为–784±5.5 cmol·kg–1,表面电荷密度(σ)为0.3017 C·m–2。
2.2 单一组分胶体颗粒在电解质溶液中的凝聚动力学 2.2.1 单一组分胶体颗粒在单一电解质溶液中的凝聚动力学实验测定了凝聚体水动力直径与凝聚时间之间的关系,然后根据式(1)计算Mont和HA在四种不同电解质溶液(LiNO3、KNO3、CsNO3、NaNO3,下同)中的平均凝聚速率,结果如图 2所示。Mont在不同电解质中均呈现两条直线,一条斜率较大的直线代表RLCA凝聚,另一条直线代表DLCA凝聚,两条直线的转折点所对应的电解质浓度即为临界凝聚浓度(CCC)[23]。显而易见,不同离子引发胶体凝聚的CCC表现出显著的离子特异性效应。在本实验中,Li+、Na+、K+、Cs+引发胶体凝聚的CCC值分别为28.65、20.44、8.25、6.27 mmol·L–1,遵循以下规律:Li+ > Na+ > K+ > Cs+。在任何电解质的任何浓度下,HA的平均聚集率均为0,表明Cs+、K+、Na+、Li+均无法诱导HA的凝聚。
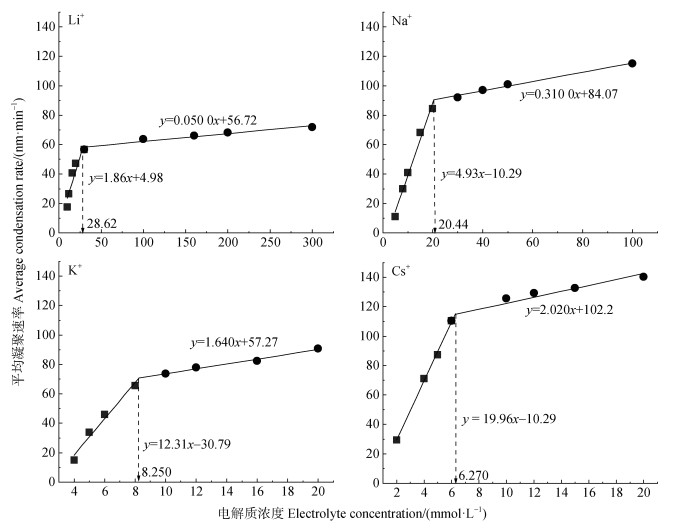
|
图 2 不同电解质溶液中Mont胶体平均凝聚速率随电解质浓度的变化 Fig. 2 Coagulation rate of montmorillonite colloid in different electrolyte solutions as a function of electrolyte concentration |
在Mont胶体中添加六种不同组分的混合电解质(LiNO3 +NaNO3、LiNO3 +KNO3、LiNO3 +CsNO3、NaNO3+KNO3、NaNO3+ CsNO3、KNO3+CsNO3,下同)后,测定Mont胶体凝聚体水动力直径随凝聚时间的变化,然后根据式(1)计算得到Mont胶体在混合电解质溶液中的平均凝聚速率以及CCC值,其结果如图 3所示。
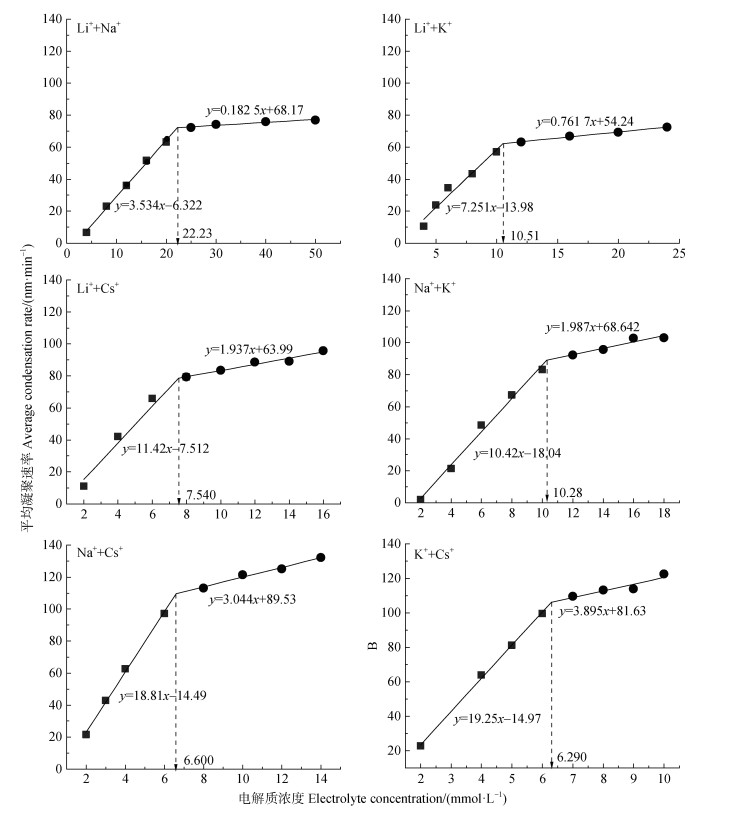
|
图 3 Mont胶体平均凝聚速率随混合电解质浓度的变化 Fig. 3 Coagulation rate of montmorillonite colloid as a function of mixed electrolyte concentration |
显而易见的是,每一种混合电解质溶液体系中仅存在一个CCC值,并且混合电解质促使Mont胶体凝聚的CCC值遵循Hofmeister序列:Li++Na+(22.23 mmol·L–1) > Li++K+(10.51mmol·L–1) > Na++K+(10.28 mmo·L–1) > Li++Cs+(7.540 mmol·L–1) > Na++ Cs+(6.600 mmol·L–1) > K++Cs+(6.290 mmol·L–1)。说明对于双电层的压缩,两种阳离子均发挥了作用,屏蔽胶体电场的能力存在一种平均效应,不是某一种单一阳离子引发的凝聚。
该研究结果表明,六种混合电解质体系的CCC值偏向CCC值更小的那种电解质一方。由于Mont胶体在LiNO3溶液中的CCC值为28.62 mmol·L–1,在CsNO3溶液中的CCC为6.270 mmol·L–1(图 2),而在CsNO3和LiNO3的混合体系中为7.540 mmol·L–1。该结果意味着在给定的Mont胶体条件下,CsNO3和LiNO3的混合电解质体系中,Cs+屏蔽胶体电场起着主导作用。因此,对于Li++Cs+混合电解质溶液条件下的Mont胶体压缩双电层的能力表现为:Li++Li+ > Li++Cs+ > Cs++Cs+。该结果还指出,含有Cs+的混合电解质体系胶体凝聚的CCC值最低。例如:Li+(28.62 mmol·L–1) > Li++Na+(22.23 mmol·L–1) > > Li++Cs+(7.540 mmol·L–1) > Na++ Cs+(6.600 mmol·L–1) > K++Cs+(6.290 mmol·L–1)≈Cs+(6.270 mmol·L–1)。上述结果说明了,在1:1的混合电解质体系中,虽然混合电解质中的两种阳离子对于胶体凝聚均有影响,但起主导作用的均为离子特异性更强的那种阳离子。
通过将胶体凝聚的CCC代入式(2)中,可观察到不同体系的混合电解质溶液中,Mont胶体凝聚的活化能随电解质浓度的变化而变化,具体的结果如图 4展示。从图 4中可以看出,在电解质浓度相同的条件下,不同体系的混合电解质对Mont胶体凝聚活化能的影响是:Li++Na+ > Li++K+ > Na++K+ > Li++Cs+ > Na++Cs+ > K++Cs+。
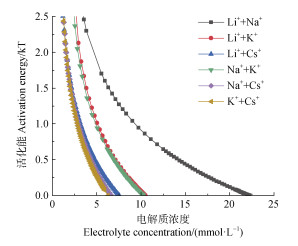
|
图 4 不同混合电解质溶液中Mont胶体凝聚活化能随电解质浓度的变化 Fig. 4 Variation of coagulation activation energy of montmorillonite colloid in different mixed electrolyte solutions as a function of electrolyte concentration |
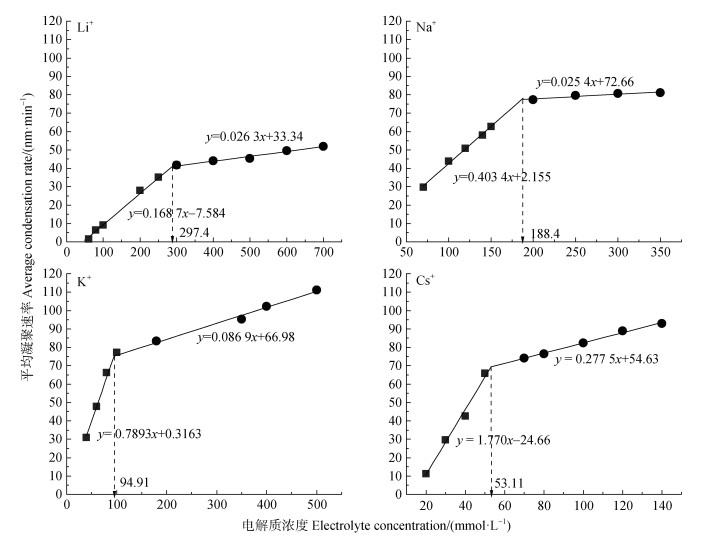
在pH 6.5的条件下,Mont与HA表面均带有负电荷,颗粒间的静电排斥压使得Mont+HA混合胶体可保持稳定。在99%Mont +1%HA混合胶体(即Mont和HA)中加入四种电解质溶液后,用DLS测定凝聚体粒径(水动力直径)随时间的变化关系,然后根据式(1)计算99%Mont +1%HA混合胶体在不同电解质溶液中的平均凝聚速率,结果如图 5所示。由图 5可知,Li+、Na+、K+、Cs+引发99%Mont +1%HA混合胶体凝聚的CCC值分别为297.4、188.4、94.91、53.11 mmol·L–1,表现为:Li+ > Na+ > K+ > Cs+。与单一Mont胶体凝聚的CCC值相比,99%Mont +1%HA混合胶体在四种不同电解质溶液(LiNO3、NaNO3、KNO3、CsNO3)条件下凝聚的CCC值分别增加了268.8、168.0、86.66、46.84 mmol·L–1,分别为单一Mont胶体凝聚CCC值的10.39倍、9.217倍、11.50倍、8.470倍。结果表明,HA的加入,使CCC值显著增加。
|
图 5 99%Mont +1%HA混合胶体平均凝聚速率随单一电解质浓度的变化 Fig. 5 Coagulation rate of 99% montmorillonite + 1% HA mixed colloid as a function of single electrolyte concentration |
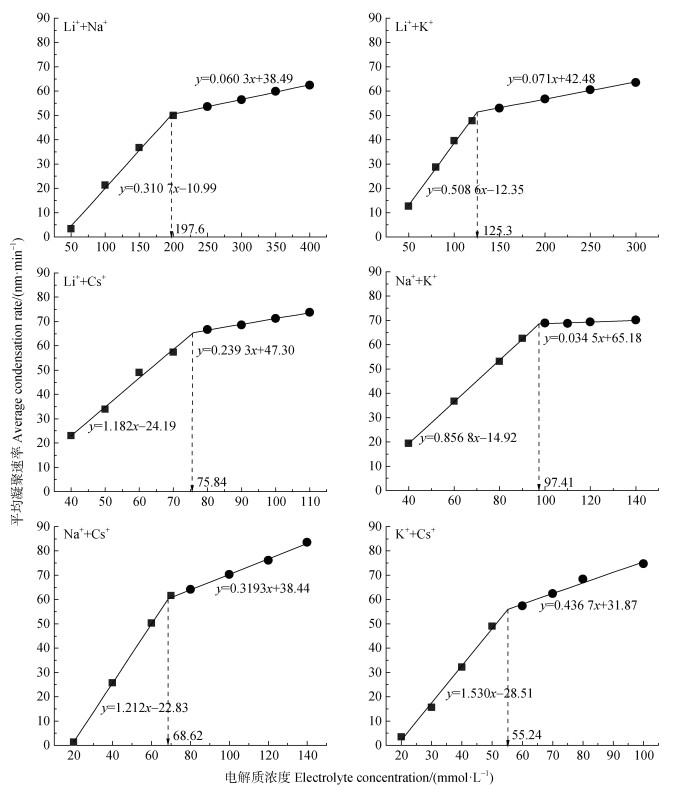
在99%Mont +1%HA混合胶体中添加六种不同组分的混合电解质后,测定99%Mont +1%HA混合胶体凝聚体水动力直径随凝聚时间的变化,然后根据式(1)计算得到混合体在混合电解质溶液中的平均凝聚速率以及CCC值,其结果如图 6所示。结果表明,每一种混合电解质溶液体系中仅存在一个CCC值,并且混合电解质促使混合胶体凝聚的CCC值遵循Hofmeister序列:Li++Na+(197.6 mmol·L–1) > Li++K+(125.3 mmol·L–1) > Na++K+(97.41 mmol·L–1) > Li++Cs+(75.84 mmol·L–1) > Na++Cs+(68.62 mmol·L–1) > K++Cs+(55.24 mmol·L–1)。
|
图 6 99%Mont +1%HA混合胶体平均凝聚速率随混合电解质浓度的变化 Fig. 6 Coagulation rate of 99% montmorillonite + 1% HA mixed colloid as a function of mixed electrolyte concentration |
与单一Mont胶体凝聚的CCC值相比,99%Mont +1%HA混合胶体在混合电解质溶液中凝聚的CCC值分别增加了175.3、114.8、68.30、87.13、62.02、48.95 mmol·L–1,分别为单一Mont胶体凝聚的CCC值的8.889倍、11.92倍、10.06倍、9.476倍、10.40倍、8.782倍。上述结果表明,在混合电解质中HA的加入使CCC值显著增加。
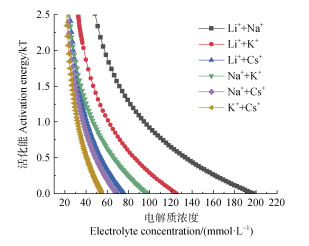
将混合胶体凝聚的CCC代入式(2),可以得出不同体系混合电解质溶液中99%Mont +1%HA混合胶体凝聚的活化能随电解质浓度的变化,其结果如图 7所示。相同电解质浓度条件下不同体系混合电解质促使Mont胶体凝聚的活化能遵循:Li++Na+ > Li++K+ > Na++K+ > Li++Cs+ > Na++Cs+ > K++Cs+。与单一Mont胶体凝聚的活化能达到1时的混合电解质浓度相比,99%Mont +1%HA混合胶体在混合电解质溶液中凝聚的活化能达到1时的混合电解质浓度分别增加了85.74、55.58、37.42、41.74、33.89、29.05 mmol·L–1,分别为单一Mont胶体凝聚的10.50倍、12.01倍、12.92倍、10.27倍、12.65倍、11.45倍。上述结果表明,与单一Mont凝聚的活化能相比,混合电解质中HA的加入使凝聚活化能显著增加。
|
图 7 不同混合电解质溶液中99%Mont +1%HA混合胶体凝聚活化能随电解质浓度的变化 Fig. 7 Variation of coagulation activation energy of 99% montmorillonite + 1% HA mixed colloid in different mixed electrolyte solutions as a function of electrolyte concentration |
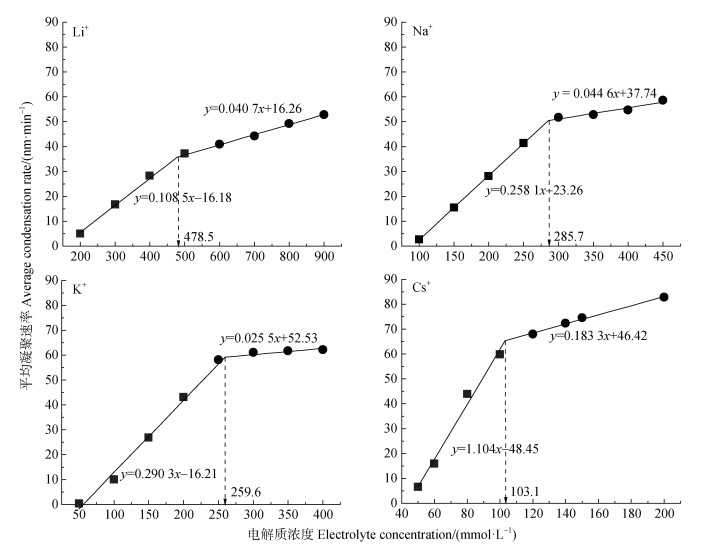
在97%Mont +3%HA混合胶体中加入四种电解质溶液后,用DLS测定凝聚体粒径(水动力直径)随时间的变化关系,然后根据式(1)计算97%Mont +3%HA混合胶体在不同电解质溶液中的平均凝聚速率,结果如图 8所示。在本实验中,Li+、Na+、K+、Cs+引发97%Mont +3%HA混合胶体凝聚的CCC值分别为478.5、285.7、259.6、103.1 mmol·L–1,表现为:Li+ > Na+ > K+ > Cs+。与99%Mont +1%HA混合胶体凝聚的CCC值相比,97%Mont +3%HA混合胶体在四种不同电解质溶液条件下凝聚的CCC值分别增加了181.1、97.3、164.7、49.99 mmol·L–1,分别为99%Mont +1%HA混合胶体凝聚的CCC值的1.609倍、1.516倍、2.735倍、1.941倍。上述结果表明,在单一电解质中HA加入量的增加使CCC值显著增加。
|
图 8 97%Mont +3%HA混合胶体平均凝聚速率随单一电解质浓度的变化 Fig. 8 Coagulation rate of 97% montmorillonite + 3% HA mixed colloid as a function of single electrolyte concentration |
在97%Mont +3%HA混合胶体中添加六种不同组分的混合电解质后,得到99%Mont +3%HA混合胶体凝聚体水动力直径随凝聚时间的变化,然后根据式(1)计算得到混合体在混合电解质溶液中的平均凝聚速率以及CCC值,其结果如图 9所示。显而易见,每一种混合电解质溶液体系中仅存在一个CCC值,并且混合电解质促使混合胶体凝聚的CCC值遵循Hofmeister序列:Li++Na+(359.6 mmol·L–1) > Li++K+(333.5 mmol·L–1) > Na++K+(267.3 mmol·L–1) > Li++Cs+(217.8 mmol·L–1) > Na++Cs+(165.1 mmol·L–1) > K++Cs+(119.7 mmol·L–1)。同样地,在二元混合电解质体系中两种阳离子对电场的共同屏蔽能力越强,混合胶体凝聚的值越小:Li+(478.5 mmol·L–1) > Li++Na+(359.6 mmol·L–1) > > Li++Cs+(217.8 mmol·L–1) > Na++Cs+(165.1 mmol·L–1) > K++Cs+(119.7 mmol·L–1)≈Cs+(103.1 mmol·L–1)。所以,二元混合电解质体系的凝聚能力由两种阳离子对电场的共同屏蔽能力决定。
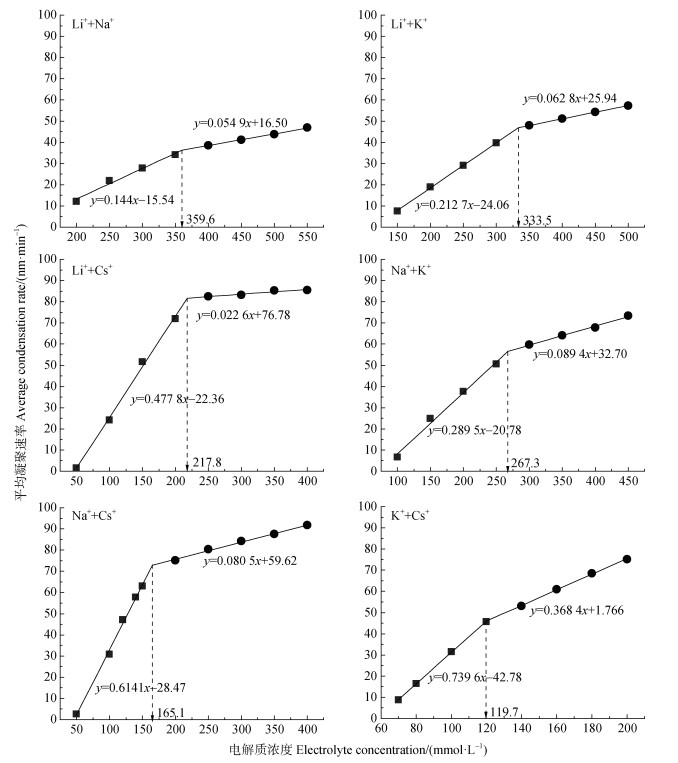
|
图 9 97%Mont +3%HA混合胶体平均凝聚速率随混合电解质浓度的变化 Fig. 9 Coagulation rate of 97% montmorillonite + 3% HA mixed colloid as a function of mixed electrolyte concentration |
与99%Mont +1%HA混合胶体凝聚的CCC值相比,97%Mont +3%HA混合胶体在六种混合电解质溶液中凝聚的CCC值分别增加了162.0、208.2、141.9、169.9、96.47、64.47 mmol·L–1,分别为99%Mont +1%HA混合胶体凝聚的CCC值的1.820倍、2.663倍、2.872倍、2.744倍、2.406倍、2.167倍。比较结果表明,混合电解质中HA加入量的增加使CCC值显著增加。
将混合胶体凝聚的CCC代入式(2)中,可观察到在不同的混合电解质溶液体系中,由97%Mont +3%HA混合胶体凝聚的活化能随电解质浓度的变化而变化,其结果已在图 10中详细描绘。在相同电解质浓度条件下,不同的电解质溶液体系促使混合胶体凝聚的活化能遵循以下规律:Li++Na+ > Li++K+ > Na++K+ > Li++Cs+ > Na++Cs+ > K++Cs+。与99%Mont +1%HA混合胶体凝聚活化能达到1 kT时的混合电解质浓度相比,99%Mont +3%HA混合胶体在六种混合电解质溶液中凝聚的活化能达到1 kT时的混合电解质浓度分别增加了105.5、130.4、66.60、97.14、52.97、48.24 mmol·L–1,分别为99%Mont +1%HA混合胶体凝聚的2.113倍、3.151倍、2.242倍、3.101倍、2.439倍、2.521倍。与99%Mont +1%HA混合胶体凝聚的活化能比较结果表明,混合电解质中HA的加入使凝聚活化能显著增加。
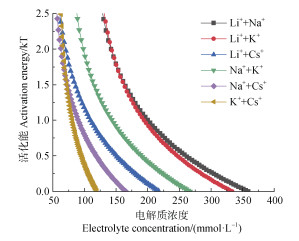
|
图 10 不同混合电解质溶液中97%Mont +3%HA混合胶体凝聚活化能随电解质浓度的变化 Fig. 10 Variation of coagulation activation energy of 97% montmorillonite + 3% HA mixed colloid in different mixed electrolyte solutions as a function of electrolyte concentration |
在之前的研究中,已经观察到一价金属离子对矿物-有机混合胶体凝聚存在显著的Hofmeister效应[25]。在本研究中,实验进一步引入了六种不同组分的混合电解质,研究了它们对Mont胶体、99%Mont+ 1%HA混合胶体以及97%Mont+3%HA混合胶体凝聚的影响。结果发现,无论是无机矿物胶体还是矿物-有机混合胶体,在混合电解质条件下均仅观察到一个临界凝聚浓度值(CCC)(图 3,图 6,图 9),该结果表明混合电解质中的两种阳离子共同作用于胶体凝聚过程。
在不同混合电解质体系中,胶体凝聚的CCC值与活化能遵循特定的混合离子Hofmeister序列,如:Li++Na+ > Li++K+ > Na++K+ > Li++Cs+ > Na++Cs+ > K++Cs+。这表明在混合电解质体系中,不同离子对胶体凝聚的影响顺序与单一离子溶液下的情况不同,例如在97%Mont +3%HA混合胶体凝聚中,不是按照以往研究中单一离子溶液下的Hofmeister效应CCC序列Li+ > Na+ > K+ > Cs+[26],而是Na++K+(267.3 mmol·L–1) > Li++Cs+(217.8 mmol·L–1)(图 9),Li+存在时的CCC值小于存在Na+或K+体系的CCC。该发现意味着离子竞争吸附可能会对土壤胶体凝聚过程产生复杂的影响。
众所周知,离子竞争吸附顺序为Cs+ > K+ > Na+ > Li+[27]。由于阳离子竞争吸附越强,该离子与表面的吸附能越高,屏蔽负电场的能力越强,所以离子屏蔽电场的能力与它们引发胶体凝聚的能力也为Cs+ > K+ > Na+ > Li+[28]。对于混合电解质溶液A+B,如果B屏蔽电场能力强于A,那么A+B屏蔽胶体电场的能力高于A而低于B。实验观察到无论是矿物胶体还是矿物-有机混合胶体,其CCC值低于A的单一电解质溶液而高于B的单一电解质溶液(图 3,图 6,图 9)。同时,如果B电解质溶液屏蔽电场能力远远强于A,那么胶体凝聚的CCC值将更接近B的单一电解质溶液中胶体凝聚的CCC值(如图 3、图 6、图 9所示,含Cs+的混合电解质体系的CCC更接近单一Cs+的电解质溶液),那么B就在胶体凝聚中起着决定性作用。
实验结果表明,在两种阳离子混合体系中,虽然这两种阳离子共同作用于胶体凝聚,但从胶体凝聚速率、凝聚CCC或凝聚活化能可发现,竞争吸附能力强的那种离子在凝聚中的确起决定性作用(图 3,图 6,图 9)。以CCC为例,如果用两种离子共存时的CCC(A+B)值与它们单独存在时的CCC之差的绝对值,来反映混合离子体系中两种离子各自对胶体凝聚作用的大小,那么绝对差值小的那种离子对胶体凝聚的作用相对较强。例如,根据图 5和图 6,在99%Mont+1%HA混合胶体体系中,Li+Na混合离子体系的CCC(Li+Na)为197.6 mmol·L–1,它们单独存在时的CCC分别为CCC(Li)= 297.4和CCC(Na)=188.4 mmol·L–1。显然CCC(Li)与CCC(Li+Na)之差的绝对值为99.8,而CCC(Na)与CCC(Li+Na)之差的绝对值仅为9.2,后者远小于前者且CCC(Li+Na)非常接近Na+单独存在的CCC(Na)。因此,在Li+Na混合体系中,Na+对胶体凝聚起决定性作用。Na+K混合离子体系的CCC(Na+K)为97.41 mmol·L–1,它们单独存在时的CCC(Na)=188.4和CCC(K)=94.91 mmol·L–1。CCC(Na)与CCC(Na+K)之差的绝对值为90.99,而CCC(K)与CCC(Na+K)之差的绝对值仅为2.50,后者远小于前者且Na+K混合体系的CCC非常接近K+单独存在的CCC。因此,在Na+K混合体系中,K+对胶体凝聚起决定性作用。K+Cs混合离子体系的CCC(K+Cs)为55.24 mmol·L–1,它们单独存在时的CCC(K)=94.91、CCC(Cs)=53.11 mmol·L–1。CCC(K)与CCC(K+Cs)之差的绝对值为39.67,而CCC(Cs)与CCC(K+Cs)之差的绝对值为2.13,后者远小于前者且K+Cs混合体系的CCC非常接近Cs+单独存在的CCC。因此,在K+Cs混合体系中,Cs+对胶体凝聚起决定性作用。在100%Mont+0%HA和97%Mont+3%HA的胶体体系中所得结果也是类似的。上述所有结果均一致表明,两种混合阳离子引发胶体凝聚时,竞争吸附能力高的离子在胶体凝聚中起决定性作用。由此可以推测,在多种混合阳离子体系中,对土壤胶体凝聚起决定性作用的必将是其中竞争吸附能力强的那种阳离子。
3.2 有机物含量和电荷密度对胶体稳定性的影响从图 3、图 6、图 9的结果还发现,在混合电解质体系中,随着HA加入量的增加(0%、1%、3%),混合胶体凝聚的难易程度显著不同,随HA含量增加,胶体凝聚的CCC值显著增加,Hwang等[29]与Liu等[1]的研究也呈现出类似的现象。与0%HA含量时比较,1%和3%的HA含量时,胶体凝聚的CCC值分别平均增大了9.921倍和24.48倍。这表明,增加HA的含量显著提高了混合胶体的稳定性,使其需要更高的电解质浓度才能发生凝聚。本研究中混合胶体颗粒表面的平均电荷密度随HA含量的变化如表 2所示。从表 2可以看出,随着HA加入量的增加,混合胶体颗粒表面的平均电荷密度逐渐增加。这表明HA分子在混合胶体颗粒表面的吸附增加了颗粒的表面电荷密度[30–31]。增加表面电荷密度就增加了胶体颗粒凝聚的排斥力,使胶体凝聚难以发生。这可以解释增加HA含量会导致CCC值增加,因为需要更高的电解质浓度才能克服这种排斥力而引发凝聚。因此可以得出一个推论,混合电解质中平均电荷密度的增加通过增强颗粒之间的静电排斥力导致胶体凝聚的CCC值增加。
|
|
表 2 本研究Mont与HA混合胶体的表面电荷密度 Table 2 Surface charge density of montmorillonite-humic acid mixed colloids in this experiment |
本研究探讨了Mont-HA混合胶体在不同混合电解质条件下的凝聚动力学过程,着重关注了凝聚速率和临界凝聚浓度值(CCC),以研究混合电解质对胶体粒子相互作用的影响。研究结果表明混合电解质中的两种阳离子共同作用于土壤无机胶体或有机/无机混合胶体的凝聚,且竞争吸附能力强的阳离子在凝聚中发挥着决定性作用。此外,增加胡敏酸(HA)的含量显著提高了有机/无机混合胶体的稳定性,需要更高的电解质浓度才能引发凝聚,这归因HA的加入增加了颗粒表面电荷密度,进而增强了颗粒之间的静电排斥力。
| [1] |
Liu F, Xu B L, He Y, et al. Differences in transport behavior of natural soil colloids of contrasting sizes from nanometer to micron and the environmental implications[J]. Science of the Total Environment, 2018, 634: 802-810. DOI:10.1016/j.scitotenv.2018.03.381
(  0) 0) |
| [2] |
Hseung Y. Soil colloid (In Chinese). Beijing: Science Press, 1983. [熊毅. 土壤胶体[M]. 北京: 科学出版社, 1983.]
(  0) 0) |
| [3] |
Huang C Y. Soil science (In Chinese). Beijing: China Agriculture Press, 2000. [黄昌勇. 土壤学[M]. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [4] |
Wei C F, Xie D T, Li B G. Progress in research on soil organo-mineral complexes (In Chinese)[J]. Advances in Earth Science, 2003, 18(2): 221-227. [魏朝富, 谢德体, 李保国. 土壤有机无机复合体的研究进展[J]. 地球科学进展, 2003, 18(2): 221-227.]
(  0) 0) |
| [5] |
Liu G N, Liu X H. A review on the impact of soil colloids on heavy metal transport (In Chinese)[J]. Environmental Chemistry, 2013, 32(7): 1308-1317. [刘冠男, 刘新会. 土壤胶体对重金属运移行为的影响[J]. 环境化学, 2013, 32(7): 1308-1317.]
(  0) 0) |
| [6] |
Li S. Effect of ionic interface reaction on soil erosion intensity[D]. Chongqing: Southwest University, 2015.[李嵩. 离子界面反应对土壤侵蚀强度的影响[D]. 重庆: 西南大学, 2015.]
(  0) 0) |
| [7] |
Liu F, Xu B L, He Y, et al. Co-transport of phenanthrene and pentachlorophenol by natural soil nanoparticles through saturated sand columns[J]. Environmental Pollution, 2019, 249: 406-413. DOI:10.1016/j.envpol.2019.03.052
(  0) 0) |
| [8] |
Yu Z H. The specific ion effects on water movement under the influence of soil elecrtric field[D]. Chongqing: Southwest University, 2013.[余正洪. 土壤电场作用下水分运动的特殊离子效应[D]. 重庆: 西南大学, 2013.]
(  0) 0) |
| [9] |
Gong Y, Tian R, Li H. Coupling effects of surface charges, adsorbed counterions, and particle-size distribution on soil water infiltration and transport[J]. European Journal of Soil Science, 2018, 69(6): 1008-1017. DOI:10.1111/ejss.12721
(  0) 0) |
| [10] |
Hu F N, Xu C Y, Li H, et al. Particles interaction forces and their effects on soil aggregates breakdown[J]. Soil and Tillage Research, 2015, 147: 1-9. DOI:10.1016/j.still.2014.11.006
(  0) 0) |
| [11] |
Pham D V, Munehide I, Thi T H T, et al. Influence of phosphate sorption on dispersion of a Ferralsol[J]. Soil Science and Plant Nutrition, 2014, 60(3): 356-366. DOI:10.1080/00380768.2014.902730
(  0) 0) |
| [12] |
Yu Z H, Li H, Liu X M, et al. Influence of soil electric field on water movement in soil[J]. Soil and Tillage Research, 2016, 155: 263-270. DOI:10.1016/j.still.2015.08.020
(  0) 0) |
| [13] |
Holthoff H, Egelhaaf S U, Borkovec M, et al. Coagulation rate measurements of colloidal particles by simultaneous static and dynamic light scattering[J]. Langmuir, 1996, 12(23): 5541-5549. DOI:10.1021/la960326e
(  0) 0) |
| [14] |
He S Q, Zheng Z C, Zhu R H. Long-term tea plantation effects on composition and stabilization of soil organic matter in Southwest China[J]. Catena, 2021, 199: 105132. DOI:10.1016/j.catena.2020.105132
(  0) 0) |
| [15] |
Song X Y, Liu S T, Liu Q H, et al. Carbon sequestration in soil humic substances under long-term fertilization in a wheat-maize system from North China[J]. Journal of Integrative Agriculture, 2014, 13(3): 562-569. DOI:10.1016/S2095-3119(13)60713-3
(  0) 0) |
| [16] |
Wei P Y, Xu F C, Fu H Y, et al. Impact of origin and structure on the aggregation behavior of natural organic matter[J]. Chemosphere, 2020, 248: 125990. DOI:10.1016/j.chemosphere.2020.125990
(  0) 0) |
| [17] |
Tan L Q, Zhao C F, Tan X L, et al. Effect of co-existing Co2+ ions on the aggregation of humic acid in aquatic environment: Aggregation kinetics, dynamic properties and fluorescence spectroscopic study[J]. Science of the Total Environment, 2019, 674: 544-553. DOI:10.1016/j.scitotenv.2019.04.119
(  0) 0) |
| [18] |
Li Q Q, Xie L, Jiang Y, et al. Formation and stability of NOM-Mn(Ⅲ)colloids in aquatic environments[J]. Water Research, 2019, 149: 190-201. DOI:10.1016/j.watres.2018.10.094
(  0) 0) |
| [19] |
Zhang Y K, He A Z, Tian R, et al. Co-aggregation of mixture components of montmorillonite, kaolinite, and humus[J]. European Journal of Soil Science, 2022, 73(1): e13158. DOI:10.1111/ejss.13158
(  0) 0) |
| [20] |
Chen C, Xu L, Zhu J M, et al. Effects of mixed salt solutions on soil aggregate stability[J]. Soil Science Society of America Journal, 2010, 74(3): 957-964.
(  0) 0) |
| [21] |
Li H, Hou J, Liu X M, et al. Combined determination of specific surface area and surface charge properties of charged particles from a single experiment[J]. Soil Science Society of America Journal, 2011, 75(6): 2128. DOI:10.2136/sssaj2010.0301
(  0) 0) |
| [22] |
Gao X D, Xu Y D, Li Z Y, et al. Heteroaggregation of humic acid with montmorillonite in divalent electrolytes: Effects of humic acid content and ionic concentration[J]. Journal of Soils and Sediments, 2021, 21(3): 1317-1328. DOI:10.1007/s11368-020-02858-y
(  0) 0) |
| [23] |
Jia M Y, Li H, Zhu H L, et al. An approach for the critical coagulation concentration estimation of polydisperse colloidal suspensions of soil and humus[J]. Journal of Soils and Sediments, 2013, 13(2): 325-335. DOI:10.1007/s11368-012-0608-8
(  0) 0) |
| [24] |
González A E. Universality of colloid aggregation in the reaction limit: The computer simulations[J]. Physical Review Letters, 1993, 71(14): 2248-2251. DOI:10.1103/PhysRevLett.71.2248
(  0) 0) |
| [25] |
Li Q Y, Tang Y, He X H, et al. Approach to theoretical estimation of the activation energy of particle aggregation taking ionic nonclassic polarization into account[J]. AIP Advances, 2015, 5(10): 107218. DOI:10.1063/1.4934594
(  0) 0) |
| [26] |
Tang J, Zhu X, Liu X T, et al. Hofmeister effects of 2: 1 and 1: 1 clay minerals in agglomeration: A comparative study (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(2): 381-391. DOI:10.11766/trxb201809170258 [唐嘉, 朱曦, 刘秀婷, 等. 2︰1和1︰1型黏土矿物胶体凝聚中Hofmeister效应的比较研究[J]. 土壤学报, 2020, 57(2): 381-391.]
(  0) 0) |
| [27] |
Tian R. Specific ion effects on soil colloidal particles aggregations[D]. Chongqing: Southwest University, 2014.[田锐. 土壤胶体凝聚中的离子特异性效应[D]. 重庆: 西南大学, 2014.]
(  0) 0) |
| [28] |
Wu Y B, Liu X M, Li R, et al. Hofmeister effect in ion adsorption kinetics on surface of yellow earth particles (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(6): 1450-1459. DOI:10.11766/trxb201802010577 [吴英博, 刘新敏, 李睿, 等. 黄壤颗粒表面离子吸附动力学中的离子特异性效应[J]. 土壤学报, 2018, 55(6): 1450-1459.]
(  0) 0) |
| [29] |
Hwang G, Gomez-Flores A, Bradford S A, et al. Analysis of stability behavior of carbon black nanoparticles in ecotoxicological media: Hydrophobic and steric effects[J]. Colloids & Surfaces A–Physicochemical & Engineering Aspects, 2018, 554: 306-316.
(  0) 0) |
| [30] |
Wang H T, Adeleye A S, Huang Y X, et al. Heteroaggregation of nanoparticles with biocolloids and geocolloids[J]. Advances in Colloid and Interface Science, 2015, 226: 24-36.
(  0) 0) |
| [31] |
Yan C R, Cheng T, Shang J Y. Effect of bovine serum albumin on stability and transport of kaolinite colloid[J]. Water Research, 2019, 155: 204-213.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


