2. 宁夏农林科学院园艺研究所, 银川 750002;
3. 江苏省土壤利用与农业可持续发展工程研究中心, 南京 210023;
4. 江苏省地理信息资源开发与利用协同创新中心, 南京 210023
2. Institute of Horticulture, Ningxia Academy of Agriculture and Forestry Science, Yinchuan 750002, China;
3. Engineering Research Center for Soil Utilization and Agricultural Sustainable Development of Jiangsu Province, Nanjing 210023, China;
4. Collaborative Innovation Center for the Development and Utilization of Jiangsu Geographic Information Resources, Nanjing 210023, China
集约化设施栽培具有充分利用土地资源、挖掘生长条件潜能、获得高产量和高效益等特点。在我国耕地资源紧张的现状下,发展设施农业已成为我国农业增效和农民增收的重要途径。目前,我国设施栽培面积已超过400万hm2[1],其规模和效益日益凸显。宁夏回族自治区日照时间长、昼夜温差大、干旱少雨,素有“塞上江南、鱼米之乡”的美誉,具有发展设施农业得天独厚的优势。截至2021年,宁夏地区蔬菜栽培面积19.74万hm2,其中设施蔬菜栽培面积3.71万hm2,已成为我国“冬菜北上、夏菜南下”和无公害、绿色蔬菜的重要生产基地[2]。
设施栽培具有施肥量大和复种指数高等特点,时常导致土壤盐渍化、养分富集和比例失衡等问题,对土壤的理化性质和微生物学性质具有重要影响[1]。Ti等[3]研究表明设施栽培大量氮肥的投入显著增加了土壤氮素含量,造成土壤酸化等问题;Ammari等[4]研究表明设施栽培灌溉和施肥过量且排水不良导致土壤盐分累积,从而导致土壤电导率显著增加,对作物产生不利影响;Wang等[5]研究发现设施栽培管理措施导致重金属累积,且镉是土壤中主要的重金属污染物。上述研究均表明设施栽培已显著引起土壤理化性质的变化。此外,诸多研究已揭示农田、草地、林地、森林等土地利用类型对土壤微生物学性质产生重要影响[6-7],但农田系统中设施栽培模式对土壤微生物学性质的影响仍然不明,导致对设施栽培大力发展背景下的土壤质量变化认知不足。因此,充分认识设施栽培模式下土壤微生物学性质的变化及原因,对现代设施农业的健康与可持续发展意义重大。
土壤微生物作为土壤生态链中的关键组成部分,在土壤养分转化循环、促进植物抗逆境胁迫以及维持植物健康等方面具有重要作用,是土壤可持续生产力的重要影响因素之一[8]。Xiao等[9]研究发现水稻土壤微生物具有自养固氮的遗传潜力,并且自养土壤微生物可固定大气中的CO2,在提高土壤有机碳库累积中起着关键作用。Fan等[10]研究发现关键微生物种群的多样性与土壤多功能基因和作物产量之间呈正相关关系,在维持土壤功能和作物产量方面具有重要作用。Li等[11]研究发现根际土壤竞争互作微生物群落可产生更多的抑菌物质,或者充分占据根际有限的生态位,从而有效抑制病原菌的入侵,抑制土传病害爆发,促进植物健康生长。细菌在土壤微生物中占有绝对的数量优势,可调节土壤结构和肥力、养分利用效率、植物生长发育等。土壤细菌多样性、群落组成和结构等可作为土壤质量的重要指标。本研究对宁夏回族自治区67个设施-大田配对土壤样品进行了比较,基于扩增子测序技术研究了设施栽培对细菌群落多样性、组成、种间互作、构建过程等的影响,以期阐明集约化设施栽培下土壤细菌群落的变化规律及其主要影响因素,为当地设施土壤生态功能优化和设施农业的可持续发展提供理论指导。
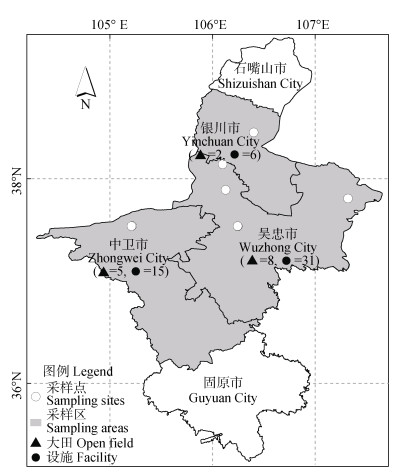
1 材料与方法 1.1 土壤样本采集供试土壤采自宁夏回族自治区的吴忠市、中卫市和银川市(图 1),该地区属温带大陆性干旱半干旱气候,年均温为8.2~9.5 ℃,平均9.0 ℃,年均降水为194.6~322.7 mm,平均232.1 mm。选择典型设施栽培区域,采集设施(主栽番茄和黄瓜,年限介于3~20年)及其邻近大田(小麦-玉米轮作)配对土壤样本,包含设施土壤样品52个,大田土壤样品15个。采样时,使用直径为2.5 cm的土钻,按S型采样法以每公顷150个样点的密度采集0~20 cm土壤,混匀后作为一个土壤样品,用无菌袋密封尽快运回实验室进行处理和分析。挑拣土壤中石块、植物残体等杂质,过2 mm筛并充分混匀后,取一部分保存于4 ℃用于测定土壤各理化指标,另一部分保存于–80 ℃用于提取土壤DNA。
|
图 1 采样点位置图 Fig. 1 Location of sampling sites |
土壤pH和电导率(Electrical conductivity,EC)分别使用S220K pH计(Mettler,瑞士)和S230K电导率仪(Mettler,瑞士)进行测定,土水比分别为1︰2.5(w/v)和1︰5(w/v)。土壤铵态氮(NH4+-N)和硝态氮(NO3–-N)用2 mol·L–1 KCl溶液浸提,土液比为1︰5(w/v),使用流动分析仪(Skalar San++,荷兰)测定。土壤有机质(OM)采用重铬酸钾氧化—外加热法测定。土壤有效磷(AP)用0.5 mol·L–1碳酸氢钠溶液浸提,采用钼锑抗比色法测定含量。土壤速效钾(AK)用1 mol·L–1乙酸铵溶液浸提,采用火焰光度法测定含量[12]。
1.3 土壤细菌定量和扩增子测序使用试剂盒FastDNA® SPIN Kit(MP Biomedicals,美国)提取土壤总DNA,提取后使用DS-11超微量分光光度计(DeNovix,美国)检测所有DNA样品的浓度和纯度。采用QuantStudio 3 Real-Time PCR System(Applied Biosystems,美国)对土壤中的细菌16S rRNA基因进行定量PCR扩增,反应体系(共20 μL)包括:2 μL DNA模板,10 μL SYBR® Premix Ex Taq™(2×,Takara,大连),正、反特异性引物(10 μmol·L–1)各1 μL及6 μL无菌水。细菌的定量反应条件:95 ℃ 2 min预变性,95 ℃ 10 s解链,53 ℃ 20 s退火,72 ℃ 30 s延伸,40个循环。在每个循环的延伸阶段采集荧光信号,反应结束后绘制熔解曲线。细菌定量引物采用Eub338F和Eub518R(表 1),根据Huang等[13]的方法构建标准曲线。
|
|
表 1 细菌定量和测序引物 Table 1 Primers used in microbial quantifications and sequencing |
采用通用引物515F/907R对土壤细菌16S rRNA基因的V4~V5区域进行扩增。将PCR产物调整至等摩尔浓度,纯化后建库,采用Illumina MiSeq系统进行双向高通量测序(上海美吉)。使用QIIME(v1.9.1)软件对高通量测序数据进行分析,对原始数据进行拼接和质量控制,在97%相似度上聚类为操作分类单元(Operational taxonomic units,OTU)。为降低测序深度对群落多样性分析的影响,过滤掉绝对丰度低于样品数的OTU后,按所有样品中最小序列数(48 038)进行抽平,使用SILVA 138数据库对每个OTU进行细菌物种注释。
1.4 数据处理年均温(MAT)和年均降水(MAP)数据通过全球气候数据库(www.worldclim.org)平台获取。将土壤样本的铵态氮、硝态氮、有机质、有效磷、速效钾5种养分含量进行标准化,将标准化后的数据加和计算每个土壤中的养分含量指数[16]。细菌定量数据进行log10转化。使用R中vegan包计算所有样本的α多样性指数;基于OTU的Bray-Curtis距离矩阵,使用vegan包进行主坐标分析(Principal co-ordinates analysis,PCoA)、冗余分析(Redundancy analysis,RDA)、多元置换方差检验(Permutational multivariate analysis of variance,PERMANOVA)、方差分解分析(Variance partitioning analysis,VPA),使用vegan和dplyr包进行曼特尔检验分析(Mantel test),检验环境因子和细菌群落的关系;使用circlize包进行大田和设施样本细菌物种组成差异分析;使用随机森林模型分析对大田和设施组间差异具有重要贡献的物种;保留细菌群落中平均相对丰度大于0.05%的OTU,使用psych包计算细菌OTU之间的斯皮尔曼(Spearman)相关性系数,并以相关系数|r| > 0.7且P < 0.01为标准构建细菌物种共现性网络,使用Gephi(10.1)软件对细菌网络的拓扑性质进行分析和可视化,使用vegan和dplyr包对环境因子和网络模块进行Mantel test检验;使用原核生物功能注释数据库(FAPROTAX)进行细菌功能预测,将细菌OTU分类表与FAPROTAX数据库进行对比,通过python脚本输出细菌群落功能注释预测结果;采用Z-score方法对功能预测结果进行标准化处理,使用complexheatmap包绘制热图;基于Hmisc、minpack.lm和stats4包采用中性群落模型分析随机性过程和确定性过程对细菌群落组装的相对贡献。
2 结果 2.1 土壤理化性质、细菌数量和α多样性相较于大田土壤,设施土壤中电导率、硝态氮、有机质、有效磷、速效钾均显著(P < 0.05)增加,分别增加了87.0%、1.92倍、26.7%、5.47倍、63.0%(表 2),pH显著下降(P < 0.001),下降了4.9%。上述结果表明,宁夏地区设施栽培显著影响了土壤的理化性质。
|
|
表 2 理化因子对大田与设施土壤的影响 Table 2 Effects of physicochemical factors on the open field and the facility soils |
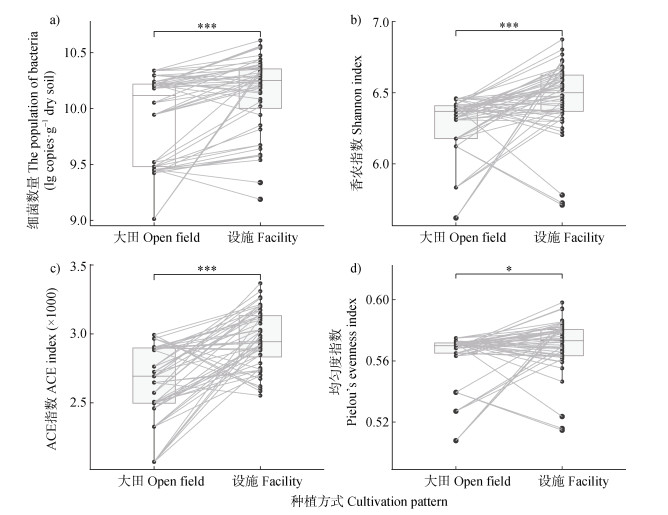
相较于大田土壤,设施土壤中细菌数量、多样性指数(Shannon)、丰富度指数(ACE)和均匀度指数(Pielou)均显著(P < 0.05)增加,分别增加了63.3%、3.20%、11.4%和1.69%(图 2)。基于配对样品的比较,设施土壤细菌数量相较于大田土壤增加的比例为82.7%,平均增加量为5.99×109 copies·g–1土;设施土壤Shannon指数相较于大田土壤增加的比例为73.1%,平均增加量为0.19;设施土壤ACE指数相较于大田土壤增加的比例为84.6%,平均增加量为321;设施土壤Pielou指数相较于大田土壤增加的比例为61.5%,平均增加量为0.01。上述结果表明,宁夏地区设施栽培对细菌数量、多样性指数、丰富度指数和均匀度指数具有不同程度的促进作用。
|
注:采用Wilcox检验大田与设施土壤的差异显著性。 Note: Wilcox test was used to test the difference between the open field and the facility soil. 图 2 大田与设施土壤细菌丰度和α多样性比较 Fig. 2 Comparison of bacterial abundance and alpha diversity between the open field and the facility soil |
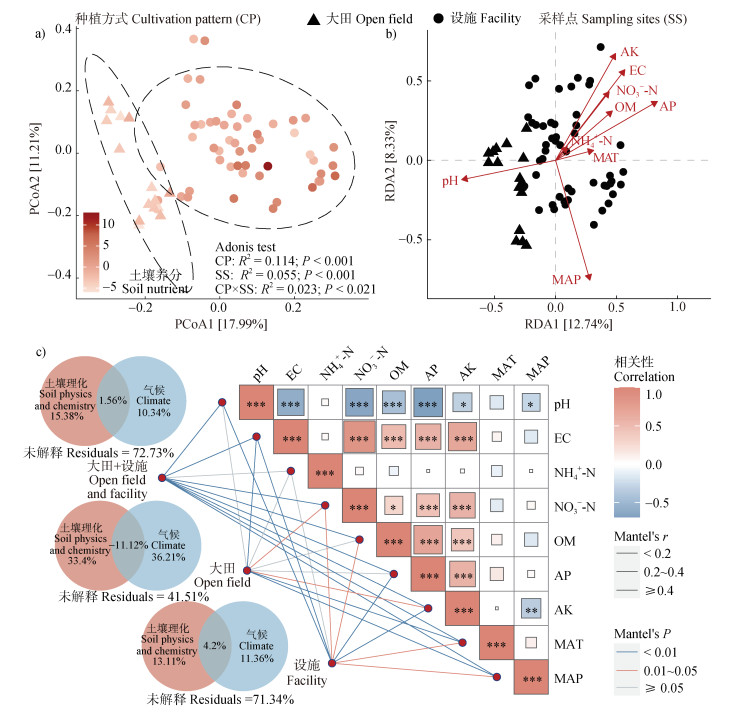
设施土壤样本组与大田土壤样本组细菌群落组成有明显差别(图 3a)。置换多元方差分析表明种植模式、采样点以及土壤养分含量均显著(P < 0.001)影响了细菌的群落结构,其中种植方式是最主要的影响因素。有效磷(R2=0.657,P < 0.001)、pH(R2=0.529,P < 0.001)、电导率(R2=0.572,P < 0.001)是导致不同种植模式下细菌群落结构变化的主要土壤理化因子(图 3b)。
|
注:图a,大田和设施土壤细菌群落的群落结构分析(PCoA,基于Bray-Curtis距离),采用Adonis函数检验大田和设施土壤细菌群落结构的差异显著性;图b,大田和设施土壤细菌群落与环境因子的冗余分析(RDA);图c,大田和设施土壤细菌群落与环境因子的方差分解分析(VPA)、曼特尔检验分析(Mantel test)。VPA分析中,土壤理化因素包括pH、EC、NH4+-N、NO3–-N、OM、AP和AK,气候因素包括年均温(MAT)和年均降水(MAP)。 Note: Figure a, analysis of bacterial community structure in the open field and the facility soils (Principal coordinates analysis, PcoA, based on the Bray-Curtis distance). The Adonis function was used to test the significant difference in bacterial community structure between the open field and the facility soils. Figure b, redundancy analysis (RDA) of bacterial communities and environmental factors in the open field and the facility soils. Figure c, variance partitioning analysis (VPA) and Mantel test analysis of bacterial communities and environmental factors in the open field and the facility soils. In VPA analysis, soil physicochemical factors included pH, EC, NH4+-N, NO3–-N, OM, AP and AK, and climatic factors included mean annual temperature (MAT) and mean annual precipitation (MAP). 图 3 大田和设施土壤细菌群落β多样性及其与环境因子的关联 Fig. 3 β diversity of bacterial community in the open field and the facility soils and its correlation with environmental factors |
VPA分析结果(图 3c)表明,气候因素对大田土壤细菌组成的贡献率高于土壤理化因素,而土壤理化因素对设施土壤细菌组成的贡献率高于气候因素,且土壤理化因素对大田和设施土壤总样本细菌组成的贡献率高于气候因素。土壤理化和气候因素对大田土壤细菌总的解释度高于设施土壤。Mantel检验结果(图 3c)表明,年均降水、电导率、年均温、硝态氮、速效钾显著(P < 0.05)影响了大田土壤样本细菌群落的组成,有效磷、速效钾、pH、电导率、有机质、硝态氮、年均温、年均降水显著(P < 0.05)影响了设施土壤样本细菌群落的组成,有效磷和pH是影响所有土壤细菌组成的两个最重要环境因子。
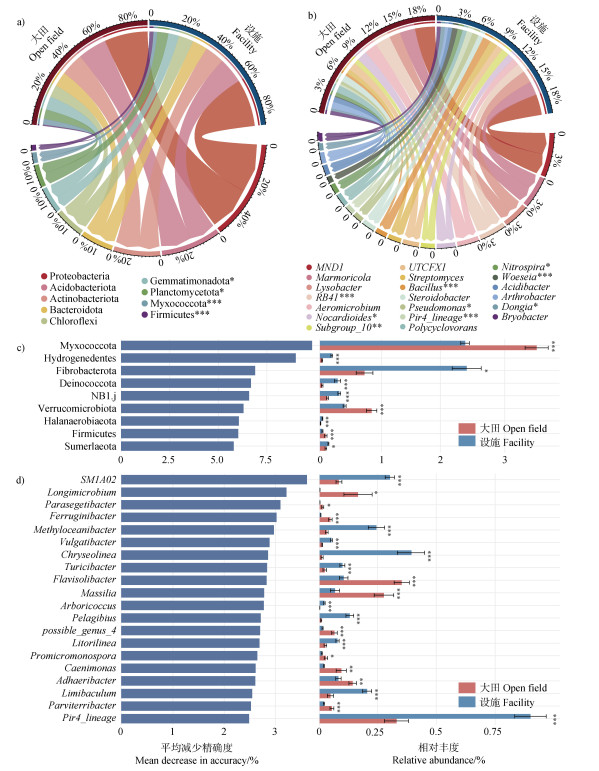
2.3 土壤细菌群落组成变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和绿弯菌门(Chloroflexi)是大田和设施土壤样本中最主要的细菌门类,占大田细菌总序列的74.6%,占设施细菌总序列的75.1%(图 4a)。与大田土壤相比,设施土壤中浮霉菌门(Planctomycetota)和厚壁菌门(Firmicutes)的相对丰度显著(P < 0.05)增加,芽单胞菌门(Gemmatimonadota)和黏球菌门(Myxococcota)的相对丰度显著(P < 0.05)降低。在细菌属水平上,设施土壤中显著(P < 0.05)富集了芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、硝化螺旋菌属(Nitrospira)、Woeseia、Dongia等优势属,而Nocardioides优势属的相对丰度显著(P < 0.05)降低(图 4b)。随机森林分析结果显示黏球菌门、Hydrogenedents、Fibrobacterota等稀有类群是影响大田和设施土壤细菌群落组成差异的主要门(图 4c)。与之相似,SM1A02、Longimicrobium和Parasegetibacter等稀有类群是影响大田和设施土壤细菌群落组成差异的主要属(图 4d)。
|
注:图a和图b表示大田和设施土壤之间优势细菌门(a)和属(b)组成差异。采用t-test检验该物种在大田和设施土壤中相对丰度的差异显著性。图c和图d表示大田和设施土壤细菌群落组成的主要差异门(c)和属(d)。 Note: Figures a and b represent the differences in the composition of dominant bacterial phylum (a) and genus (b) between the open field and the facility soils. t-test was used to test the significant difference in the relative abundance of the taxon in the open field and the facility soils. Figures c and d represent the main differential phylum (c) and genus (d) in the open field and the facility soils. 图 4 大田和设施土壤细菌群落组成和主要差异物种 Fig. 4 Bacterial community composition and main differential taxon in the open field and the facility soils |
设施栽培模式显著改变了土壤细菌的共现网络模式(图 5a和图 5b)。大田土壤细菌网络的边、平均度、聚类系数、模块化程度均高于设施土壤,分别提高了10.8倍、11.0倍、36.8%、1.78倍;平均路径长度低于设施土壤(图 5c),降低了51.4%,表明大田土壤细菌网络的复杂程度显著高于设施土壤。大田和设施土壤网络中的相关关系均以正相关为主,大田土壤细菌网络中负相关关系比例显著高于设施土壤,表明大田土壤细菌群落之间的竞争更强,网络更加稳定。大田和设施土壤不同的模块中细菌门的组成不同(图 5d和图 5e),大田土壤互作网络最大模块(模块1)中包含156个节点,占总节点数的37.8%,主要包含变形菌门(32.6%)、放线菌门(19.6%)、酸杆菌门(18.3%)等类群;设施土壤互作网络最大模块(模块1)中包含41个节点,占总节点数的9.81%,主要包含变形菌门(39.9%)、拟杆菌门(18.4%)、酸杆菌门(15.6%)等类群。相较于大田土壤,设施土壤最大模块中缺少放线菌门和黏球菌门两个类群,其中设施土壤绿弯菌门的相对丰度为大田土壤的9.42倍,而大田土壤拟杆菌门的相对丰度是设施土壤的2.42倍。Mantel检验表明(图 5f和图 5g),年均降水、电导率、年均温和硝态氮对大田土壤细菌网络最大模块组成具有显著(P < 0.05)影响,速效钾、有效磷、硝态氮和电导率对设施土壤细菌网络最大模块组成具有显著(P < 0.05)影响。
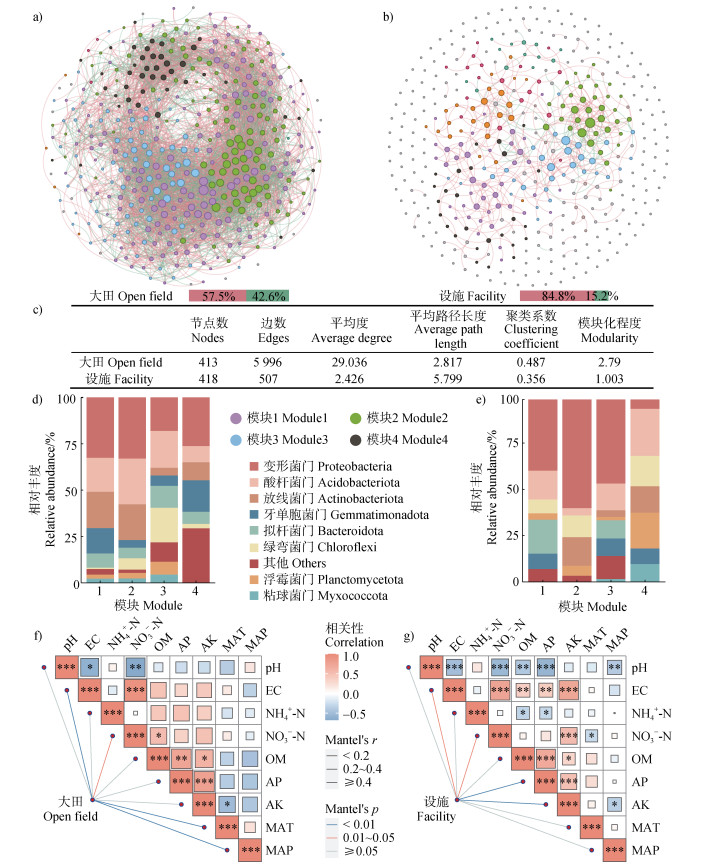
|
注:图a和图b分别表示大田和设施土壤细菌网络分析,连接两个节点的边代表正(红线)或负(绿线)相关关系;图c表示大田和设施土壤细菌网络的主要拓扑特征;图d和图e分别表示大田和设施土壤主要模块的细菌门组成,每个门的相对丰度由该门在所有土壤样本中的平均相对丰度除以每个模块中所有门总的平均相对丰度计算得出,模块1~模块4按照由大至小排序;图f和图g分别表示大田和设施土壤细菌网络最大模块与环境因子的Mantel分析。 Note: Figures a and b represent the bacterial network analysis of the open field and the facility soils, respectively. The edges connecting two nodes represent positive (red lines) or negative (green lines) correlation. Figure c represents the main topological characteristics of the bacterial networks. Figures d and e represent the bacterial phylum composition of the main modules of the networks in the open field and the facility soils, respectively. The relative abundance of each phylum was calculated by dividing the average relative abundance of the phylum in all soil samples by the average relative abundance of all phyla in each module. Modules 1-4 are ordered from large to small. Figures f and g represent the Mantel analysis of the largest module and environment factors of the bacterial network in the open field and the facility soils. 图 5 大田和设施土壤细菌共现网络分析 Fig. 5 Analysis of bacterial co-occurrence network in the open field and the facility soils |
设施土壤中植物病原菌(Plant pathogen)、细胞内寄生虫(Intracellular parasites)、木质素分解(Ligninolysis)、塑料降解(Plastic degradation)、脂肪族非甲烷烃降解(Aliphatic non methane hydrocarbon degradation)、芳烃碳氮降解(Aromatic hydrocarbon degradation)、氨化作用(Nitrate ammonification)、铁呼吸(Iron respiration)、异化砷酸盐还原(Dissimilatory arsenate reduction)、异化砷酸盐氧化(Dissimilatory arsenite oxidation)等功能类群的相对丰度显著(P < 0.05)高于大田土壤,而捕食性细菌(Predatory or exoparasitic)和尿素分解(Ureolysis)这两个功能类群的相对丰度显著(P < 0.05)低于大田土壤(图 6a)。结果表明,宁夏地区设施栽培显著影响了碳、氮等元素循环及病原菌有关的细菌功能类群的相对丰度。大田和设施土壤细菌群落均呈现显著(P < 0.001)的地理距离衰减关系,然而设施土壤距离衰减关系的斜率显著低于大田土壤,表明不同地理距离下设施土壤细菌群落差异较大田土壤更小(图 6b)。大田土壤中中性群落模型的解释率高于设施土壤,表明大田土壤细菌群落的构建受随机性过程的影响较大,而设施土壤与之相反,受确定性过程的影响较大(图 6c和图 6d)。此外,大田土壤细菌群落的群落扩散系数(Nm)高于设施土壤,表明细菌群落在大田土壤中的扩散程度高于设施土壤,扩散受到的限制低于设施土壤。
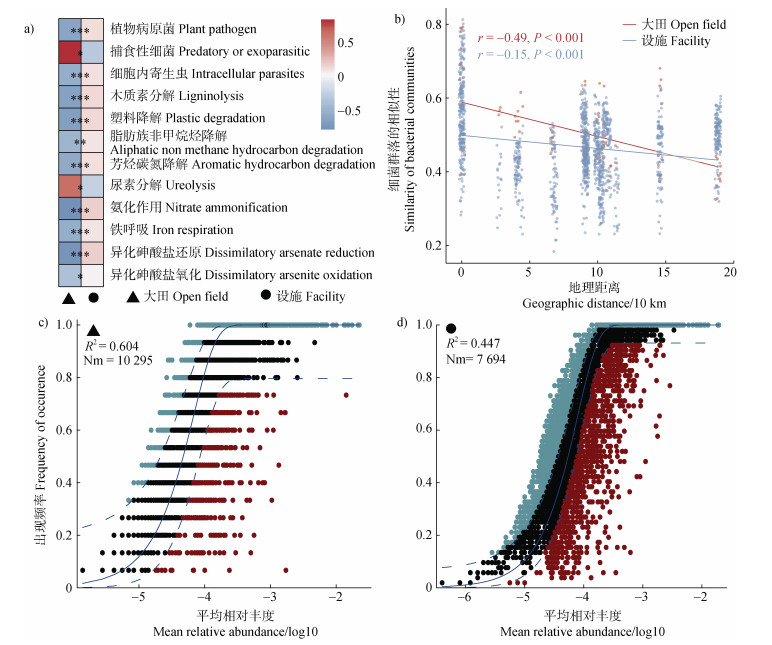
|
注:图a表示大田和设施土壤细菌功能类群的差异;图b表示大田和设施土壤细菌群落的距离-衰减曲线(基于Bray-Curtis距离);图c和图d分别表示大田和设施土壤细菌群落的中性群落模型拟合,R2为中性群落模型的整体拟合优度,Nm是元群落规模(N)与迁移率(m)的乘积,量化了对群落之间扩散的估计。 Note: Figure a represents differences in bacterial functional groups in the open field and the facility soils. Figure b represents the distance-attenuation curve of the soil bacterial community in the open field and the facility cultivation systems (based on the Bray-Curtis distance). Figures c and d represent the neutral community model fitting of bacterial communities in the open field and the facility soils, respectively. R2 is the overall goodness of fit of the neutral community model, and Nm is the product of meta-community size (N) and mobility (m), quantifying the estimation of diffusion between community assembly. 图 6 大田和设施土壤细菌群落的生态学过程 Fig. 6 Ecological process of soil bacterial community in the open field and the facility soils |
细菌群落多样性是评价土壤质量和土壤生态系统稳定的重要指标[8],但却少有研究系统地比较设施与其邻近大田土壤细菌群落的差异。张翔等[17]基于河北省中南部地区14个设施和大田土壤的16S rRNA基因扩增子测序结果表明,设施土壤细菌丰富度指数(Chao1)和多样性指数(Shannon)均低于大田土壤。李玉娣等[18]研究发现,相较于年限为10年的设施土壤,20年的设施土壤细菌多样性指数显著下降,土壤中细菌物种丰富度和群落总体代谢活性均较低。种植模式单一以及大量施肥、施药等特点导致设施土壤养分和有害物质积累,进而造成细菌物种减少以及多样性下降[19]。然而,本研究发现设施栽培显著增加了土壤细菌群落α多样性(图 2),表明设施栽培所引起的土壤细菌群落多样性的变化具有地区依赖性。宁夏地区设施栽培发展相对较晚,本研究所调查设施大棚种植年限均处于10年以下;设施栽培过程中有机类肥料的投入量高于大田土壤,设施土壤有机质含量相较于大田土壤提升了26.7%。黄绍文等[20]研究表明,我国设施土壤有机肥料用量为露地土壤的2倍~3倍。有机类肥料的投入为土壤细菌提供良好的生存环境和营养条件,可显著增加土壤细菌的丰度和多样性。杜思瑶等[21]研究也表明,相较于常规设施种植模式,有机设施种植可显著增加土壤细菌群落多样性。此外,本研究发现设施栽培显著改变了土壤细菌群落结构(图 3a),这与前人[17-19]研究结果一致,表明设施栽培造成土壤微生物群落结构变化的结果较为普遍。
3.2 设施栽培显著改变了细菌群落组成和功能本研究发现变形菌门、酸杆菌门、放线菌门、拟杆菌门、绿弯菌门是大田和设施土壤优势细菌门(图 4a),这些细菌门在前人[22-24]研究中也被认为是优势物种,表明大田和设施土壤中优势细菌物种组成具有一定的共性。然而,相较大田土壤,设施土壤浮霉菌门和厚壁菌门的相对丰度显著增加,芽单胞菌门和黏球菌门的相对丰度显著降低。已有研究表明,浮霉菌门在厌氧氨氧化脱氮过程中有着重要作用[25],厚壁菌门可参与多种物质和元素的降解和转化[26],这两个细菌门作为富营养型细菌,设施栽培大量有机肥的投入为它们提供了良好的生长条件,从而使得它们在土壤中富集。芽单胞菌门和黏球菌门在土壤氮素循环的反硝化过程中发挥着重要作用[27-28],这两个类群的习性更有利于它们在贫营养的环境中生存[29]。属水平上,设施栽培显著增加了土壤芽孢杆菌属、假单胞菌属、硝化螺旋菌属等常见有益菌群的相对丰度(图 4b),这可能是有机肥中富含了大量这些有益菌,并对土著有益菌起到了促进作用,从而改善了设施土壤细菌群落的组成,有助于植物的健康生长[21]。
3.3 设施与大田土壤细菌群落的主要驱动因子具有差异性本研究发现,气候因素是决定大田土壤细菌群落的主要因子,而土壤理化性质是决定设施土壤细菌群落的主要因子(图 3),表明驱动大田和设施土壤细菌群落分异的主要影响因子并不相同。具体而言,年降水、年均温和土壤电导率(指示土壤含盐量)等环境要素对大田土壤细菌群落具有较大影响(图 3c)。宁夏地区昼夜温差大、降水少且不均,因此相较于设施内稳定的生长条件,大田土壤细菌群落结构受年均降水、年均温等外界影响因素显著。相较而言,有效磷、速效钾、有机质、硝态氮等土壤养分含量对设施土壤细菌群落的决定作用最强(图 3c)。设施栽培管理方式的不同导致设施土壤养分水平具有较高的变异性。刘书哲[30]研究表明,苏州市设施土壤中有效磷和有效钾的含量分别为大田土壤的8.9倍和1.9倍;冯武焕等[31]研究表明,西安市大棚和日光温室氮肥、磷肥、钾肥施用量均为大田土壤的2倍~5倍。因此,设施土壤养分含量的差异导致了土壤细菌群落的分异,这与前人[19,21]研究结果一致。此外,众多研究表明土壤pH是影响细菌群落最重要的因素[32]。本研究发现大田土壤细菌群落并未受到pH的显著影响(图 3c),其原因在于本研究所调查大田土壤pH介于7.74和8.66之间,均处于碱性且总体差异较小,因此并未对其产生显著影响。
3.4 设施栽培改变了土壤细菌群落互作、功能潜力、距离衰减关系与构建过程本研究发现,设施土壤细菌共现性网络的边数、平均度、模块化程度显著低于大田土壤(图 5),表明设施栽培显著降低了细菌网络的复杂性和模块化程度,与Xue等[23]研究结果一致。细菌共现性网络复杂性和模块化程度的下降指示了微生物间的相互作用简化,土壤生态系统面对外界环境变化的缓冲能力减弱[25]。细菌群落的多功能性对于维持土壤生态系统健康至关重要。本研究发现,设施栽培显著增加了土壤中与碳氮循环、病原菌有关的功能类群(图 6a)。设施栽培中大量有机肥的投入强化了土壤微生物群落在有机碳氮分解方面的功能。较低的地上植物多样性同时也加剧了设施作物细菌性病害的发生[33]。
研究发现,大田与设施土壤细菌群落均存在显著的距离衰减关系(图 6b),与Gao等[34]研究结果一致。然而,设施土壤细菌群落的距离衰减关系弱于大田土壤。不同地区大田土壤的理化性质、气候因子差异较大,因此大田土壤中微生物的差异较大。而设施栽培模式使得土壤的理化性质和环境条件的趋同性增强,因此设施中土壤微生物距离衰减关系弱于大田土壤,表明设施栽培在一定程度上抵消了地理距离所造成的细菌群落分异。一般而言,土壤细菌群落距离衰减关系越强,表明其扩散程度越低,扩散受到的限制越高。然而,本研究通过中性群落模型发现,确定性过程在设施土壤细菌群落装配中占主导作用,其扩散受到的限制高于大田土壤(图 6c,图 6d),表明设施栽培中高度的人为干扰逆转了距离衰减与群落构建之间的关联。Feng等[35]研究发现确定性过程驱动连续施肥20年的玉米田土壤细菌群落构建,陈瑞蕊等[36]研究发现经历了不断施肥、翻耕的农田土壤是由确定性过程控制了细菌群落的构建。这些研究均表明设施栽培中高强度的干扰(如施肥、耕作、管理方式等)会导致细菌类群定向富集,从而强化了其群落组装的确定性过程,本研究结果(图 6d)与之相似。此外,高鹏飞[37]研究发现受确定性过程组装而成的细菌群落网络稳定性较低,本研究结果(图 5b,图 6d)与之一致,表明设施裁培土壤细菌的确定性组装过程是其具有较低网络稳定性的原因之一。
4 结论宁夏地区设施栽培增加土壤细菌α多样性和数量。年降水、年均温和土壤电导率等环境要素对大田土壤细菌群落具有较大影响;相较而言,有效磷、速效钾、有机质、硝态氮等土壤养分含量对设施土壤细菌群落的决定作用更强。设施和大田土壤优势细菌物种组成具有一定的共性。设施栽培显著增加了土壤浮霉菌门和厚壁菌门的相对丰度,以及芽孢杆菌属、假单胞菌属等有益菌群的相对丰度。设施栽培降低了土壤细菌互作网络的复杂性和模块化程度,增加了与碳氮循环及病原菌有关的细菌功能类群,减弱了细菌群落的距离衰减关系,增强了确定性过程在群落组装中的作用。设施和大田土壤细菌差异类群对于缓解土壤养分富集、比例失衡和土壤盐渍化等方面均具有一定贡献,但其具体贡献程度需进一步的深入研究。本研究揭示了宁夏地区设施栽培对土壤细菌群落多维度特征的影响,可为当地设施土壤可持续利用提供理论参考,为促进宁夏设施农业可持续发展提供助力。
| [1] |
Cai Z C. Scientific and technological issues of nutrient management under greenhouse cultivation in China (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(1): 36-43. DOI:10.11766/trxb201805310286 [蔡祖聪. 我国设施栽培养分管理中待解的科学和技术问题[J]. 土壤学报, 2019, 56(1): 36-43.]
(  0) 0) |
| [2] |
Cui H Q, Lu W L. Problems and thoughts on mechanization of vegetable production in Ningxia (In Chinese)[J]. Agriculture Machinery Technology Extension, 2023(8): 7-8. DOI:10.3969/j.issn.1671-3036.2023.08.003 [崔惠琴, 鲁文玲. 宁夏蔬菜生产机械化存在的问题及思考[J]. 农机科技推广, 2023(8): 7-8.]
(  0) 0) |
| [3] |
Ti C P, Luo Y X, Yan X Y. Characteristics of nitrogen balance in open-air and greenhouse vegetable cropping systems of China[J]. Environmental Science and Pollution Research, 2015, 22(23): 18508-18518. DOI:10.1007/s11356-015-5277-x
(  0) 0) |
| [4] |
Ammari T G, Tahhan R, Al Sulebi N, et al. Impact of intensive greenhouse production system on soil quality[J]. Pedosphere, 2015, 25(2): 282-293. DOI:10.1016/S1002-0160(15)60013-3
(  0) 0) |
| [5] |
Wang J, Mi W K, Song P P, et al. Cultivation ages effect on soil physicochemical properties and heavy metal accumulation in greenhouse soils[J]. Chinese Geographical Science, 2018, 28(4): 717-726. DOI:10.1007/s11769-018-0980-4
(  0) 0) |
| [6] |
Wang T T, Zhao W, Wang L M, et al. Microbial community characteristics and its influence under different land types (In Chinese)[J]. Environmental Pollution & Control, 2019, 41(9): 1082-1087. [王甜甜, 赵伟, 王利明, 等. 不同土地利用类型土壤微生物群落特征及其影响因素[J]. 环境污染与防治, 2019, 41(9): 1082-1087.]
(  0) 0) |
| [7] |
Zheng Q, Hu Y T, Zhang S S, et al. Soil multifunctionality is affected by the soil environment and by microbial community composition and diversity[J]. Soil Biology and Biochemistry, 2019, 136: 107521. DOI:10.1016/j.soilbio.2019.107521
(  0) 0) |
| [8] |
Zhu Y G, Peng J J, Wei Z, et al. Linking the soil microbiome to soil health (In Chinese)[J]. Scientia Sinica (Vitae), 2021, 51(1): 1-11. [朱永官, 彭静静, 韦中, 等. 土壤微生物组与土壤健康[J]. 中国科学(生命科学), 2021, 51(1): 1-11.]
(  0) 0) |
| [9] |
Xiao K Q, Ge T D, Wu X H, et al. Metagenomic and 14C tracing evidence for autotrophic microbial CO2 fixation in paddy soils[J]. Environmental Microbiology, 2021, 23(2): 924-933. DOI:10.1111/1462-2920.15204
(  0) 0) |
| [10] |
Fan K K, Delgado-Baquerizo M, Guo X S, et al. Biodiversity of key-stone phylotypes determines crop production in a 4-decade fertilization experiment[J]. The ISME Journal, 2021, 15(2): 550-561. DOI:10.1038/s41396-020-00796-8
(  0) 0) |
| [11] |
Li M, Wei Z, Wang J N, et al. Facilitation promotes invasions in plant‐associated microbial communities[J]. Ecology Letters, 2019, 22(1): 149-158. DOI:10.1111/ele.13177
(  0) 0) |
| [12] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [13] |
Huang X Q, Wen T, Zhang J B, et al. Control of soil-borne pathogen Fusarium oxysporum by biological soil disinfestation with incorporation of various organic matters[J]. European Journal of Plant Pathology, 2015, 143(2): 223-235. DOI:10.1007/s10658-015-0676-x
(  0) 0) |
| [14] |
Dorsch M, Lane D, Stackebrandt E. Towards a phylogeny of the genus Vibrio based on 16S rRNA sequences[J]. International Journal of Systematic Bacteriology, 1992, 42(1): 58-63. DOI:10.1099/00207713-42-1-58
(  0) 0) |
| [15] |
Muyzer G, de Waal E C, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology, 1993, 59(3): 695-700. DOI:10.1128/aem.59.3.695-700.1993
(  0) 0) |
| [16] |
Hu W G, Ran J Z, Dong L W, et al. Aridity-driven shift in biodiversity-soil multifunctionality relationships[J]. Nature Communications, 2021, 12(1): 5350. DOI:10.1038/s41467-021-25641-0
(  0) 0) |
| [17] |
Zhang X, Song S S, Huang Y L, et al. Analysis of bacterial diversity in cultivated soils in middle and southern Hebei Province based on high-throughput sequencing (In Chinese)[J]. Acta Agriculturae Boreali-Sinica, 2018, 33(4): 196-203. [张翔, 宋水山, 黄亚丽, 等. 基于高通量测序分析河北省中南部地区耕地土壤细菌多样性[J]. 华北农学报, 2018, 33(4): 196-203.]
(  0) 0) |
| [18] |
Li Y D, Gu J, Fu Q X, et al. Effects of planting years on soil nutrients and microbial functional diversity in vegetable plastic tunnel in Yunyang, Shaanxi, China (In Chinese)[J]. Journal of Agro-Environment Science, 2014, 33(4): 765-771. [李玉娣, 谷洁, 付青霞, 等. 陕西云阳蔬菜大棚土壤养分及微生物群落功能多样性研究[J]. 农业环境科学学报, 2014, 33(4): 765-771.]
(  0) 0) |
| [19] |
Zhao Y N, Mao X X, Zhang M S, et al. Response of soil microbial communities to continuously mono-cropped cucumber under greenhouse conditions in a calcareous soil of North China[J]. Journal of Soils and Sediments, 2020, 20(5): 2446-2459. DOI:10.1007/s11368-020-02603-5
(  0) 0) |
| [20] |
Huang S W, Tang J W, Li C H, et al. Reducing potential of chemical fertilizers and scientific fertilization countermeasure in vegetable production in China (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2017, 23(6): 1480-1493. [黄绍文, 唐继伟, 李春花, 等. 我国蔬菜化肥减施潜力与科学施用对策[J]. 植物营养与肥料学报, 2017, 23(6): 1480-1493.]
(  0) 0) |
| [21] |
Du S Y, Yu M, Liu F H, et al. Effect of facility management regimes on soil bacterial diversity and community structure (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2017, 25(11): 1615-1625. [杜思瑶, 于淼, 刘芳华, 等. 设施种植模式对土壤细菌多样性及群落结构的影响[J]. 中国生态农业学报, 2017, 25(11): 1615-1625.]
(  0) 0) |
| [22] |
Gao D M, An D M, Liu J Y, et al. Wheat cover crop alters soil microbial community and increases cucumber yield under different potassium regimes[J]. European Journal of Agronomy, 2022, 139: 126567. DOI:10.1016/j.eja.2022.126567
(  0) 0) |
| [23] |
Xue R, Wang C, Zhao L, et al. Agricultural intensification weakens the soil health index and stability of microbial networks[J]. Agriculture, Ecosystems & Environment, 2022, 339: 108118.
(  0) 0) |
| [24] |
Shi G P, Luan L, Zeng Z Y, et al. Effects of long-term fertilization on bacterial diversity and community structure succession in red soil (In Chinese)[J]. Soils, 2024, 56(1): 73-81. [石广萍, 栾璐, 曾昭阳, 等. 不同施肥年限对红壤细菌多样性及群落结构演替的影响[J]. 土壤, 2024, 56(1): 73-81.]
(  0) 0) |
| [25] |
Tang L Q, Su C Y, Fan C P, et al. Long-term effect of perfluorooctanoic acid on the anammox system based on metagenomics: Performance, sludge characteristic and microbial community dynamic[J]. Bioresource Technology, 2022, 351: 127002. DOI:10.1016/j.biortech.2022.127002
(  0) 0) |
| [26] |
Gavande P V, Basak A, Sen S, et al. Functional characterization of thermotolerant microbial consortium for lignocellulolytic enzymes with central role of Firmicutes in rice straw depolymerization[J]. Scientific Reports, 2021, 11(1): 3032. DOI:10.1038/s41598-021-82163-x
(  0) 0) |
| [27] |
Jia L P, Jiang B H, Huang F, et al. Nitrogen removal mechanism and microbial community changes of bioaugmentation subsurface wastewater infiltration system[J]. Bioresource Technology, 2019, 294: 122140. DOI:10.1016/j.biortech.2019.122140
(  0) 0) |
| [28] |
Jia Q S. Research on the efficiency of plant carbon source enhanced wetland-MFC coupling system on tail water nitrogen removal[D]. Nanjing: Nanjing Forestry University, 2023.[贾秋生. 植物碳源强化湿地-微生物燃料电池耦合系统对尾水脱氮效果研究[D]. 南京: 南京林业大学, 2023.]
(  0) 0) |
| [29] |
Hu F, Wang F, Han X Z, et al. Succession of microbial community in typical black soil under different land use pattern (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(5): 1238-1247. DOI:10.11766/trxb202103040128 [胡芳, 王芳, 韩晓增, 等. 不同土地利用方式下典型黑土区土壤微生物群落演替规律[J]. 土壤学报, 2022, 59(5): 1238-1247.]
(  0) 0) |
| [30] |
Liu S Z. Investigation of soil obstacle factors and analysis of influencing factors in facility vegetable areas—A case study of Suzhou City[D]. Nanjing: Nanjing Normal University, 2020.[刘书哲. 设施蔬菜地土壤障碍因子调查与影响因素分析——以苏州市为例[D]. 南京: 南京师范大学, 2020.]
(  0) 0) |
| [31] |
Feng W H, Lü S, Wang H, et al. Investigation and analysis of application status of fertilizer and pesticide in vegetable field of Xi'an (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2016, 32(31): 143-146. [冯武焕, 吕爽, 王虎, 等. 西安市菜田化肥农药施用现状调查与分析[J]. 中国农学通报, 2016, 32(31): 143-146.]
(  0) 0) |
| [32] |
Chen Z, Jin P H, Hu T L, et al. Effects of long-term successive biochar amendment on soil fertility, wheat production and microbial community structure (In Chinese)[J]. Soils, 2023, 55(6): 1230-1236. [陈哲, 靳鹏辉, 胡天龙, 等. 长期连续施用生物质炭对土壤肥力、小麦产量和微生物群落结构的影响[J]. 土壤, 2023, 55(6): 1230-1236.]
(  0) 0) |
| [33] |
Ding J, Zhou J Y, Li Z K, et al. Present situation and high quality development countermeasures of facility vegetables in Zhejiang Province (In Chinese)[J]. Journal of Changjiang Vegetables, 2023(14): 81-84. [丁检, 周佳燕, 李志坤, 等. 浙江省设施蔬菜现状及高质量发展对策建议[J]. 长江蔬菜, 2023(14): 81-84.]
(  0) 0) |
| [34] |
Gao Q, Yang Y F, Feng J J, et al. The spatial scale dependence of diazotrophic and bacterial community assembly in paddy soil[J]. Global Ecology and Biogeography, 2019, 28(8): 1093-1105. DOI:10.1111/geb.12917
(  0) 0) |
| [35] |
Feng Y Z, Guo Z Y, Zhong L H, et al. Balanced fertilization decreases environmental filtering on soil bacterial community assemblage in North China[J]. Frontiers in Microbiology, 2017, 8: 2376. DOI:10.3389/fmicb.2017.02376
(  0) 0) |
| [36] |
Chen R R, Zhang J W, Dong Y, et al. Effects of salinity on soil bacterial diversity and assembly processes in coastal soils (In Chinese)[J]. Chinese Journal of Applied Ecology, 2021, 32(5): 1816-1824. [陈瑞蕊, 张建伟, 董洋, 等. 盐度对滨海土壤细菌多样性和群落构建过程的影响[J]. 应用生态学报, 2021, 32(5): 1816-1824.]
(  0) 0) |
| [37] |
Gao P F. Assembly mechanisms of bacterioplankton community structure and co-occurrence network in urban lakes: A case of Nanchang City[D]. Nanchang: Jiangxi Normal University, 2023.[高鹏飞. 城市湖泊浮游细菌群落结构与共生网络的构建机制——以南昌市为例[D]. 南昌: 江西师范大学, 2023.]
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


