2. 中国科学院沈阳应用生态研究所, 中国科学院森林生态与管理重点实验室, 湖南会同森林生态实验站, 沈阳 110016
2. Huitong Experimental Station of Forest Ecology, CAS Key Laboratory of Forest Ecology and Management, Institute of Applied Ecology, Shenyang 110016, China
土壤是陆地生态系统的第一大有机碳库,全球1米深土壤有机碳(SOC)储量约为1 500~2 400 Pg C[1]。因此SOC库的微小变化会对大气CO2浓度产生显著影响,从而影响气候变化与碳循环[2]。激发效应作为土壤碳循环的关键过程,是指外源碳输入引起的土壤自身有机碳矿化发生变化的现象,其大小和方向影响着SOC的分解和固存[3-4]。激发效应的强度在很大程度上取决于SOC库的稳定性,该稳定性越来越多地被证明受到了土壤中矿物的影响[5]。有机碳与土壤矿物相互作用,形成有机-无机复合物促进SOC的形成和稳定[6]。据报道,全球约有899 Pg碳以矿物结合有机碳的形式储存,其中约20%以铁结合有机碳(Fe-OC)的形式固存在土壤中,这对碳的长期储存起着重要作用[7-8]。然而,已有铁氧化物对SOC影响的研究主要集中在沼泽、湿地和农田等自然或人工水生生态系统,对森林生态系统的研究却十分有限[9]。全球森林生态系统碳储量约为860 Pg,1/2以上的碳与土壤矿物质结合并被保留在土壤中,森林土壤碳库动态研究是当前备受关注的热点问题[10]。因此,了解铁氧化物对森林土壤碳激发效应的影响,有助于更好地认识森林土壤有机碳周转,为进一步认识碳循环机制提供理论依据。
铁氧化物对土壤碳循环的影响已被广泛证实。由于铁氧化物具有比表面积大、吸附亲和力强的特点[11],通过吸附或共沉淀与SOC形成Fe-OC,构成了对SOC特有的矿物保护机制,提高了SOC的稳定性[12]。铁氧化物通过物理化学保护作用可能有效地吸附土壤速效养分,如氮和磷等,导致化学计量失衡和微生物养分限制,同样也会使微生物难以接触碳源,酶活性降低,导致SOC的稳定[13]。然而一些铁氧化物易于被还原溶解,导致SOC释放[14-15]。微生物介导的异化铁还原过程削弱了铁氧化物稳定SOC的作用[16-17]。造成这种现象的原因很大程度上因为铁氧化物的晶体形态。不同的晶体形态导致SOC吸附能力、还原速率的不同,从而影响碳的稳定性[18]。据报道,结晶性较差的水铁矿使SOC矿化提高了2%,而结晶性高的针铁矿使葡萄糖诱导的SOC矿化降低了10%~22%[19]。可见,铁氧化物和SOC之间的关联会随着铁氧化物晶体形态的不同而有所变化。此外,葡萄糖等根系分泌物能够通过与铁氧化物进行溶解等作用将其固持的SOC释放出来,导致铁—碳关系解耦,进一步加剧了土壤的矿化[20]。因此,研究不同晶体形态的铁氧化物如何影响SOC对探究SOC矿化与稳定具有重要意义。
近年来,亚表层土壤(低于20 cm)因为储存了全球1/2以上SOC,在陆地碳固存中起着重要作用,而逐渐受到关注[21]。土壤特性,如SOC来源、微生物群落、有机碳稳定性和养分有效性等随着土壤剖面的变化而变化,因此不同土壤剖面会存在SOC的特定矿化速率。表层SOC主要来源于地上凋落物以及细根,富含土壤养分,而亚表层SOC则主要来源于根系脱落物[22]。在亚表层土壤中,碳可能由于多种因素的组合而积累,包括:微生物底物的缺乏,低温或低pH等环境条件,土壤基质的不可利用性和物理保护以及木质素、酚类物质、单宁或低氮含量导致的有机化合物积累的低化学降解性。亚表层土壤碳库的稳定性一定程度上是由分解SOC的微生物酶所控制。土壤环境条件的不同影响着土壤中微生物的活动,由于影响环境条件的因子沿土壤剖面发生变化,因此酶的活性也随土壤深度发生改变[23-24]。同时,亚表层土壤通常以古老的、缓慢循环的SOC为主,通常难以抵抗微生物矿化且具有独特的碳和养分循环[25]。这些均可能会对不同土层土壤碳积累产生不同的影响。有研究表明,与表层土壤相比,亚表层土壤微生物很容易受到碳和能量限制,外源碳的输入极大缓解了这种限制会导致更大的激发[26-27]。因此,深入研究表层与亚表层土壤碳激发效应对碳循环有重要的作用[28]。此外,矿物质吸附有机碳的潜力以及土壤中与矿物结合的有机碳组分的比例随着土层深度的增加而变大,SOC的化学稳定性也随之增加。受干扰影响较少的亚表层土壤由于物理保护对SOC的保护作用加强[29-31]。铁作为有机碳矿物保护的核心元素之一,铁氧化物的添加使得土壤矿物含量升高从而改变了SOC矿物保护的能力[22],影响土壤有机碳化学稳定性,由于降解亚表层更高化学稳定性的化合物需要更高的活化能,因此推测铁氧化物的添加会对表层和亚表层土壤碳激发效应产生不同影响。
铁氧化物在潮湿土壤中经常发生非生物和生物氧化还原反应[32]。随着新的铁氧化物的加入,在SOC积累速率较高的亚热带森林土壤中,铁氧化物的再沉淀对土壤碳稳定起着重要作用[33]。因此,为比较表层和亚表层土壤碳激发效应的差异以及探索不同晶体形态的铁氧化物是如何影响不同深度SOC的激发效应,本研究制备了不同晶体形态的铁氧化物:针铁矿和水铁矿,并与13C标记的葡萄糖一起添加到不同深度的土壤中。探究铁氧化物以及土壤深度对SOC矿化的影响。本研究假设:(1)由于亚表层土壤微生物很容易受到碳和能量的限制,亚表层土壤碳激发效应大于表层土壤;(2)由于水铁矿结晶性更差易被还原,针铁矿处理的激发效应较水铁矿处理的小;(3)由于亚表层土壤的化学稳定性更强,在亚表层土壤中添加铁氧化物后土壤稳定性进一步加强,使得获取可利用性碳的能量需求变高,导致了更低的激发效应。
1 材料与方法 1.1 研究区概况与样品采集土壤样品采集于安徽省马鬃岭试验站的杉木人工林(31°10′—31°20′N,115°31′—115°50′E)。该地区属亚热带湿润季风气候,年平均气温13℃~15℃,年平均降水量1 510 mm。成土母质主要来自花岗岩风化物质,质地为砂质土,呈酸性。样地育有二十年生杉木人工林,面积超过1 500 hm2。
2022年5月,从采样点选取5个点,每个点之间间隔100 cm,将表层的腐殖质、凋落叶层去除后,用直径为5 cm的土钻按S型路线采集0~10 cm和20~40 cm土壤。最后将收集到的同一土层的土壤混合在一起,形成混合样品。所有的新鲜土壤样品立即装入自封袋中,低温保存,带回室内处理分析。在室内,将样品混合均匀并过筛(< 2 mm)。部分土壤样品自然风干用于理化性质分析,另一部分放入冷藏箱中,用于后期培养试验。表层与亚表层土壤基本理化性质见表 1。
|
|
表 1 不同土层的土壤基本理化性质 Table 1 Properties of soils at different soil depths |
针铁矿的制备:将1 mol·L–1 FeCl3·6H2O溶液与1 mol·L–1 NaOH混合,滴定NaOH溶液至pH为12。在70℃下水浴60 h后,用超纯水洗涤。针铁矿可以通过沉淀、冷冻干燥得到,并在室温下密封保存。
水铁矿的制备:纯水溶解FeCl3·6H2O至0.4 mol·L–1,然后用1 mol·L–1 NaOH滴定至pH 7~8。静置老化2~6 h后,倒出上清液后离心20 min,弃上清液,加入超纯水搅拌均匀,重复离心7次左右。采用沉淀冷冻干燥法得到水铁矿,并在室温下密封保存。
1.3 试验设计与室内培养试验各土层的试验处理均为6个,分别为:无添加(CK)、添加水铁矿(Fh)、添加针铁矿(Goe)、添加葡萄糖(Glu)、添加水铁矿+葡萄糖(Fh-glu)、添加针铁矿+葡萄糖(Goe-glu)。表层与亚表层土壤共计12个处理,每个土层的6个试验处理均重复4次。葡萄糖添加处理是一次性加入13C标记的葡萄糖溶液(δ13C=600‰),在对照土壤中加入等体积的去离子水。葡萄糖的添加量为SOC含量的2%,SOC含量的2%与土壤中的微生物生物量碳(MBC)含量相当,足以刺激微生物活动。添加的针铁矿和水铁矿的含量为土壤全铁含量的5%[34-35]。具体操作如下:
称取相当于80 g干土质量的鲜土放置于梅森瓶中。培养前将土壤与称重后的水铁矿或针铁矿粉末充分混合,将对应的葡萄糖溶液均匀喷洒在土壤样品上。通过添加去离子水,调整瓶内土壤含水量至最大持水量(WHC)的40%,观察梅森瓶内土壤状态,定期补充土壤水分。另外4个空置的梅森瓶作为对照进行培养用于计算来自于空气中的CO2含量。所有梅森瓶置于16±6℃的培养箱中培养101 d。分别于培养的第1、3、5、8、11、14、18、22、26、35、40、45、52、59、66、73、80、87、94、101 d进行气体采样。每次采集气体前,需要将梅森瓶通过空气泵与外界置换气体2 min,然后关闭阀门立即密封梅森瓶,密闭24 h后采集气体,采集完气体后随即打开阀门以保证瓶内气体与外界正常交换,防止形成厌氧环境。利用CO2同位素分析仪测定气体样品的δ13C同位素值和CO2浓度。分别在培养的第3、15、73和101天进行破坏性采样,每个处理的4个重复各取样1次,得到4个重复,然后分析土壤指标。
1.4 CO2源的划分与激发效应的量化采用两源混合模型区分每次采集的CO2总量中土壤来源的碳(CS)和葡萄糖来源的碳(CG),具体公式如下:
| $ {{\text{C}}_{\text{S}}} = {{\text{C}}_{\text{T}}}\left( {{{\text{δ }}_{\text{G}}} - {{\text{δ }}_{\text{T}}}} \right)/\left( {{{\text{δ }}_{\text{G}}} - {{\text{δ }}_{\text{S}}}} \right) $ | (1) |
| $ {{\text{C}}_{\text{G}}} = {{\text{C}}_{\text{T}}} - {{\text{C}}_{\text{S}}} $ | (2) |
式中,CT(CT = CG + CS)为土壤样品释放的CO2的总含量(mg·g–1),δT为气体的同位素值,CG为葡萄糖来源的碳量(mg·g–1),δG为葡萄糖的同位素值,CS为SOC源的碳量(mg·g–1),δS为每次测定气体时,无葡萄糖添加处理的CO2丰度值。
利用经过两源模型区分后的土壤来源CO2量得出其释放速率,进一步进行累加计算出整个培养期间的累积排放量,计算公式如下:
| $ C = \sum {\frac{{{V_i} + {V_{i - 1}}}}{2}} \times \left( {{t_i} - {t_i}_{ - 1}} \right) $ | (3) |
式中,C为CO2的累积排放量(mg·g–1),其中Vi和Vi-1分别为第i次和(i-1)次培养时间的CO2-C的产生速率(mg·g–1·d–1),(ti-ti-1)为第i次和(i-1)次培养时间之间的时间间隔(d)。
葡萄糖添加诱导的累积激发效应(PE,mg·g–1)计算公式为:
| $ {\text{PE}} = {{\text{C}}_{\text{g}}} - {{\text{C}}_{{\text{ng}}}} $ | (4) |
式中,Cg为添加葡萄糖处理下SOC产生CO2-C的累积量(mg·g–1),Cng为未添加葡萄糖的相同土壤中SOC产生的CO2-C的量(mg·g–1)。
1.5 土壤化学性质和微生物特性的分析向土壤样品中以水土比2.5︰1加入去离子水后,用pH计测定pH。土壤样品经酸消化后,采用邻菲罗啉比色法,采用紫外分光光度计测定全铁浓度。采用元素分析仪,用干燃烧法测定有机碳和总氮含量。土壤速效磷是由土壤样品经过碳酸氢钠溶液消化后,用全自动间断化学分析仪测定。用2 mol·L–1KCL溶液提取土壤矿化氮,以测定可交换NH4+-N和NO3–-N浓度。采用氯仿熏蒸萃取法测定土壤MBC和可溶性有机碳(DOC)含量。以熏蒸和未熏蒸提取液中碳含量的差值除以转换系数0.45,计算得到MBC,用未熏蒸的碳浓度计算得到DOC[6]。
铁结合有机碳含量采用二亚硫酸钠-柠檬酸三钠-碳酸氢钠萃取法测定(DCB)[36]。通过测定萃取溶液中铁的浓度,定量测定土壤中游离态铁氧化物(Fed)。分别用草酸铵和焦磷酸钠提取土壤无定形态(Feo)和络合态(Fep)铁氧化物[37]。用火焰原子吸收分光光度计测量所有溶液中铁的浓度,有机碳含量采用元素分析仪测定。铁结合有机碳(Fe-OC,g·kg–1)含量和碳铁摩尔比(C:Fe)的计算公式如下:
| $ {\text{Fe - OC}} = {\text{O}}{{\text{C}}_{{\text{NaCl}}}}{\text{ - O}}{{\text{C}}_{{\text{DCB}}}} $ | (5) |
| $ {\text{C: Fe = }}\left( {{\text{Fe - OC/MC}}} \right)/\left( {{\text{mFed}}/{\text{MFe}}} \right) $ | (6) |
式中,OCNaCl和OCDCB分别为NaCl和DCB提取的土壤残留物中有机碳含量,mFed为游离态铁氧化物的质量,MC代表碳的摩尔质量,MFe代表铁的摩尔质量。
采用96孔酶标板法测定土壤碳、氮、磷循环中β-葡萄糖苷酶(BG)、木聚糖酶(Xyl)、N-乙酰氨基肽酶(NAG)、亮氨酸氨基肽酶(Leu)和磷酸酶(Phos)的活性。参照German等[38]的方法进行提取测定。酶活性(nmol·g–1·h–1)动力学参数由Michaelis-Menten方程确定:
| $ V = {V_{\max }}[S]/({K_m} + [{\text{S}}]) $ | (7) |
式中,V为反应速率,[S]为底物浓度。Vmax为饱和底物浓度下的分解速率。Km(半饱和常数)与酶对底物的亲和力有关。
为了测量土壤微生物碳和养分限制的程度,采用了土壤酶化学计量学载体分析方法[39]。向量长度(相对碳限制)和向量度(相对磷和氮限制)计算公式如下:
| $ {\text{VectorLength = }}\sqrt {{x^2} + {y^2}} $ | (8) |
| $ {\text{VectorDegree}} = {\text{DEGREES}}({\text{ATAN}}2(x, y)) $ | (9) |
式中,x为碳和氮获取的相对酶活性,即(BG +Xyl)/(BG +Xyl + Leu + NAG);y表示碳和磷获取的相对酶活性,即(BG + Xyl)/(BG + Xyl + Phos)。
1.6 数据分析采用单因素方差分析不同深度土壤理化性质的差异,并进行T检验。采用重复测量方差分析方法分析培养期间铁氧化物和土壤深度对激发效应的影响,并在P = 0.05水平上检验差异的显著性。使用SPSS Version 23.0对数据进行统计分析。采用Pearson相关性分析激发效应与矿物保护和微生物活性之间的关系。相关性分析使用R4.0.2版本的“corrplot”软件包进行,在P=0.05的水平上确定显著差异。图表中数据为平均值±标准误。
2 结果 2.1 土壤有机碳的矿化与激发效应添加葡萄糖后,表层和亚表层的SOC累积矿化量均显著增加,且表层高于亚表层(P < 0.05,图 1a和图 1b)。此外,Fh-glu处理下的累积土壤来源CO2量在表层和亚表层均最高。
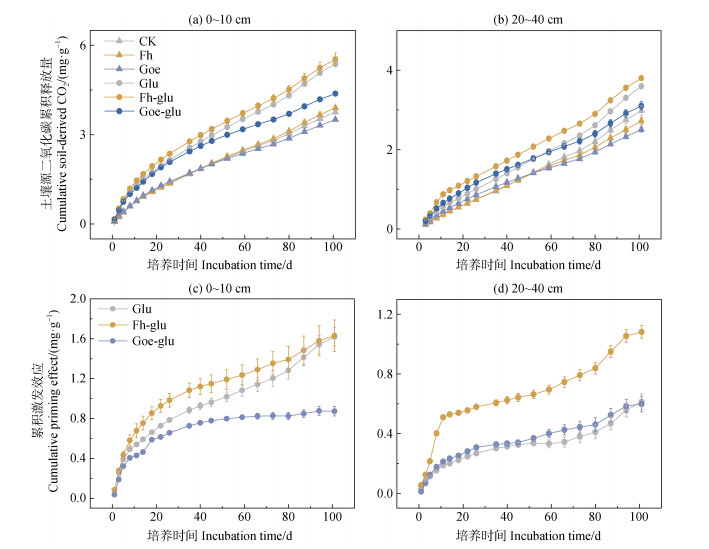
|
注:CK,无添加;Fh,水铁矿;Goe,针铁矿;Glu,葡萄糖;Fh-glu,水铁矿+葡萄糖;Goe-glu,针铁矿+葡萄糖。 Note: CK, no addition; Fh, ferrihydrite; Goe, goethite; Glu, glucose; Fh-glu, ferrihydrite + glucose; Goe-glu, goethite + glucose. 图 1 0~10 cm(a)和20~40 cm(b)土壤中累积的土壤源CO2以及在101天的培养过程中添加葡萄糖(Glu)、水铁矿和葡萄糖(Fh-glu)以及针铁矿和葡萄糖(Goe-glu)在0~10 cm(c)和20~40 cm(d)土壤中的累积激发效应 Fig. 1 Cumulative soil-derived CO2 in 0~10 cm(a)and 20~40 cm(b)soils and cumulative priming effect for CO2 in 0~10 cm(c)and 20~40 cm(d)of soils over the 101-day incubation under the treatments of Glu, Fh-glu, and Goe-glu |
添加葡萄糖显著促进了不同深度土壤的矿化,产生正激发效应。两层土壤中Fh-glu处理的激发效应强度均高于Goe-glu处理。表层土和亚表层土壤碳累积激发效应值分别为1.63和0.61 mg·g–1 SOC(表 2)。在表层土壤中,针铁矿的添加抑制了激发效应,水铁矿添加未改变激发效应的强度(图 1c)。在亚表层土壤中,水铁矿的添加促进了激发效应(P < 0.05)。Glu和Goe-glu处理之间的累积激发效应没有差异(图 1d)。
|
|
表 2 不同土层土壤培养后的累积激发值 Table 2 Cumulative priming effect values of different soil depth after incubation under the same treatment/(mg·g–1) |
MBC和DOC的含量随着土壤深度的增加而降低(图 2a和图 2b)。葡萄糖的添加显著增加了表层土壤CK和Fh处理的MBC及DOC含量。表层土壤中的Fh-glu处理的DOC含量显著低于Glu处理(P < 0.05),而对于亚表层土壤而言,在葡萄糖添加后仅仅Fh处理的MBC含量显著增加了20.3%(P < 0.05,图 2a和图 2b)。亚表层土壤中Fh-glu处理的MBC含量较Glu处理高11.2%(P < 0.05)。
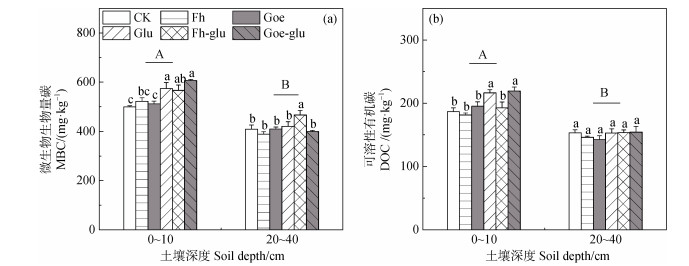
|
注:不同大写字母代表不同土壤深度上差异显著,不同小写字母表示在同一土壤深度上不同处理间差异显著。显著性水平设为P < 0.05。 Note: Different capital letters represent significant differences between soil depths. Different lowercase letters represent significant differences among treatments within the same soil depths at P < 0.05. 图 2 培养结束后不同深度土壤微生物生物量碳(MBC)(a)和可溶性有机碳(DOC)(b)的含量 Fig. 2 The content of microbial biomass C(MBC)(a)and dissolved organic C(DOC)(b)of soils within different depths at the end of incubation |
表层土壤中,培养第3天和第15天的土壤微生物碳限制显著高于培养第73天及培养结束后。与Glu处理相比,Goe-glu处理显著降低了表层土壤的微生物碳限制,提高了微生物磷限制(P < 0.05,图 3a和图 3c)。在亚表层土壤中,Fh-glu处理的土壤微生物碳限制显著高于Fh处理(P < 0.05)。Goe-glu处理的土壤微生物磷限制显著高于Glu处理(图 3d)。
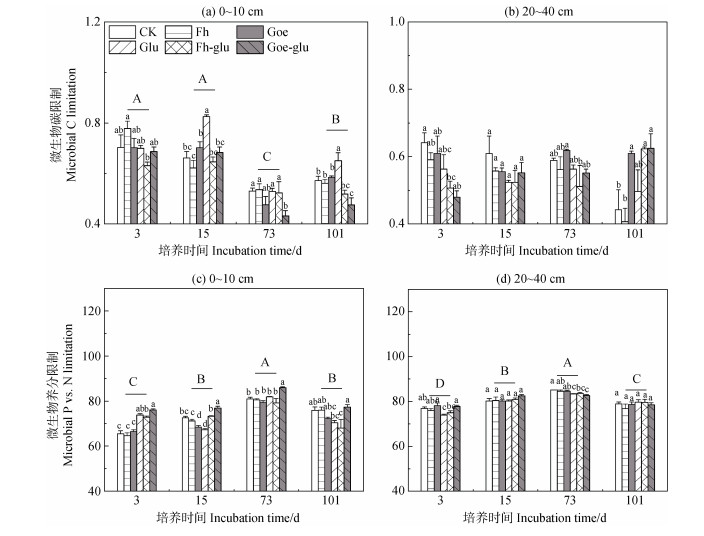
|
注:不同大写字母代表不同时间差异显著。不同小写字母表示同一时间不同处理间差异显著。显著性水平设为P < 0.05。 Note: Different capital letters represent significant differences between periods. Different lowercase letters represent significant differences among treatments within the same period. Significance levels are set at P < 0.05. 图 3 不同处理下4个时间点土壤0~10 cm(a,c)和20~40 cm(b,d)微生物碳和养分限制。土壤微生物碳限制以向量长度表示,土壤微生物养分限制以向量角度表示(角度 > 45表示磷限制,角度 < 45表示氮限制) Fig. 3 Soil microbial carbon and nutrient limitations in 0~10 cm(a、c)and 20~40 cm(b、d)of soils under each treatment at four sampling time points. Soil microbial carbon limitation is represented by the vector length, and soil microbial nutrient limitation is represented by the vector degrees(degrees > 45 denote P limitation and < 45 denote N limitation) |
无论表层还是亚表层,Fed含量随培养时间增加而增加(图 4a和图 4b)。在表层土壤中,与单独添加葡萄糖的土壤相比,Goe-glu和Fh-glu处理分别显著提高了Fed和Feo的含量(P < 0.05,图 4a和图 4c)。此外,与Glu处理相比,铁氧化物与葡萄糖的共同添加在培养第3天时提高了Fep的含量(图 4e)。在亚表层土壤中,Fh-glu处理的Feo含量高于单纯添加葡萄糖的处理(P < 0.05,图 4d)。
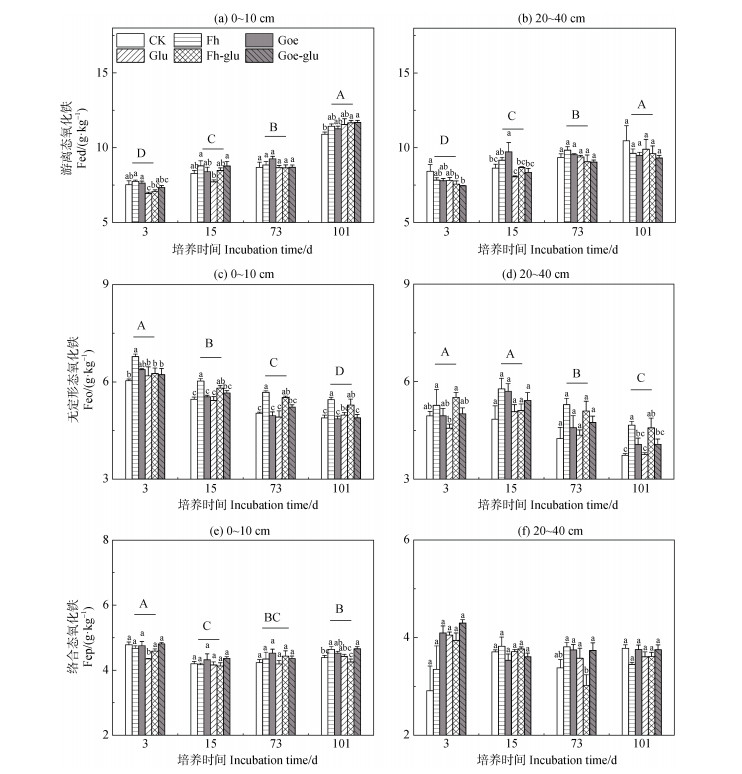
|
注:不同大写字母代表不同时间差异显著。不同小写字母表示同一时间不同处理间差异显著。显著性水平设为P < 0.05。 Note: Different capital letters represent significant differences between periods. Different lowercase letters represent significant differences among treatments within the same period. Significance levels are set at P < 0.05. 图 4 各处理4个时间点0~10 cm(a、c、e)和20~40 cm(b、d、f)土壤的Feo、Feo和Fep含量 Fig. 4 The contents of Fed, Feo and Fep in 0~10 cm(a, c, e)and 20~40 cm(b, d, f)of soils under each treatment at four sampling time points |
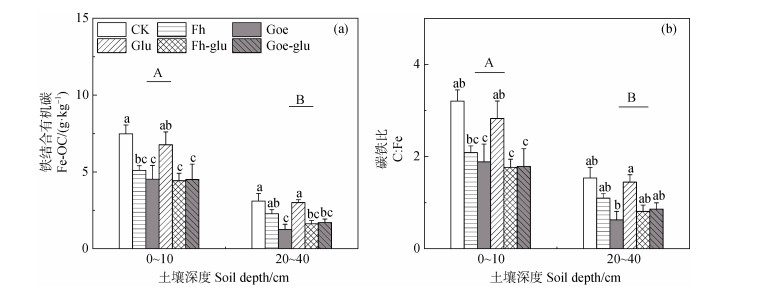
培养结束后,所有处理中表层土壤的Fe-OC含量和C:Fe均大于亚表层土壤。与Glu处理相比,铁氧化物的添加降低了表层和亚表层土壤中的Fe-OC含量(图 5a)。表层土壤中,Fh-glu和Goe-glu处理的C:Fe为1.76~3.2,显著低于Glu处理(P < 0.05,图 5b)。针铁矿与葡萄糖的共同添加显著降低了土壤pH(表 3)。
|
注:不同大写字母代表不同土壤深度上差异显著,柱状图上方不同的小写字母表示在同一土壤深度上不同处理间差异显著。显著性水平设为P < 0.05。 Note: Different capital letters represent significant differences between soil depths. Different lowercase letters above bars represent significant differences among treatments within the same soil depths. Significance levels are set at P < 0.05. 图 5 培养结束时各处理在不同深度土壤Fe-OC含量(a)和C:Fe比(b) Fig. 5 The content of Fe-OC(a)and C: Fe(b)of soils under each treatment of different soil depth at the end of incubation |
|
|
表 3 培养结束后土壤pH Table 3 pH of soils at different soil depths at the end of incubation |
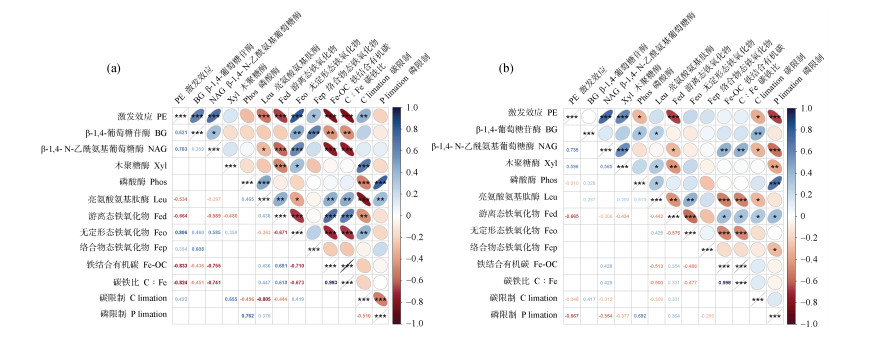
激发效应与两个土层的Fed含量呈显著负相关,与表层土壤Feo、Fep呈显著正相关(P < 0.05,图 6a和图 6b),与Fe-OC、C:Fe呈显著负相关(P < 0.01,图 6a)。此外,Pearson相关结果表明,激发效应与表层和亚表层土壤微生物限制的相关性存在差异。其中,土壤碳限制与表层土壤碳激发效应呈显著正相关。然而,在土壤碳和磷限制较高的亚表层土壤中,激发效应强度较低(P < 0.01,图 6b)。
|
注:*、**和***分别表示在0.05、0.01和0.001水平上差异显著。 Note: *, **, and *** denote significant differences at 0.05, 0.01, and 0.001 levels, respectively. 图 6 0~10 cm(a)和20~40 cm(b)土壤碳激发效应与重要因子的Pearson相关系数矩阵 Fig. 6 Pearson's correlation coefficient matrix of the PE with key important influencing variables in0~10 cm(a)and 20~40 cm(b)soils |
以往研究表明不同土层碳激发效应存在明显差异[25,40]。激发效应随着土壤深度的变化发生改变,但至今无统一结论。有研究发现由于亚表层土壤受到一定的碳和能量的限制,外源有机碳的输入缓解了这种限制,会导致更大的激发效应[26-27]。Paterson和Sim[41]发现由于向深层土壤提供的碳通常被认为是非常有限的,激发是由微生物群落的特定成分介导的,在能够共同利用碳的情况下,矿化SOC的种群未选择分解深层土壤碳,因此深层土壤碳激发效应对外源碳的输入无明显响应。此外,也有研究发现激发效应会随着土壤深度的增加而减小,这归因于表层可利用碳的含量更高[42]。在本研究中,表层土壤碳激发效应强度与亚表层土壤相比更大,这与第一个假设不一致。由于葡萄糖的添加,表层和亚表层的土壤微生物均利用简单基质进行增殖和生长,使胞外酶产量和活性增加,从而产生了正激发效应[43]。表层土壤富含来自植物凋落物的活性碳源,大量易分解有机碳有助于表层SOC的积累,DOC、MBC和矿化氮含量高于亚表层土壤(表 1,图 3a和图 3b),表明了表层土壤中碳和氮的可利用性更高,且由更少的顽固性物质组成[44]。但在亚表层土壤中微生物生物量显著低于表层土壤,说明亚表层土壤对碳的需求较小,葡萄糖添加后微生物生物量增加不明显,可见表层土壤微生物群落对简单基质的利用较亚表层土壤的微生物群落更快。由于亚表层土壤微生物密度普遍较低,会出现葡萄糖的延迟分解或部分分解[45],因此亚表层土壤存在的有机碳不太容易发生激发效应。此外,亚表层土壤碳库通常是古老而惰性的,因为自身的化学稳定性较高,可降解性较弱,物理保护使得获取可利用性有机碳的能量需求变高,导致较低的激发效应[46]。
3.2 不同类型铁氧化物对表层和亚表层土壤碳激发效应的影响在表层土壤中,针铁矿的添加降低了激发效应的强度,但水铁矿的加入对激发效应没有影响,这一结果支持了试验的第二个假设。在本研究中,针铁矿的加入使SOC通过共沉淀过程稳定,矿物保护抑制了SOC的矿化,这一结果可由C:Fe大于1来证实[47]。不稳定的碳输入引发了可能调动铁氧化物的非微生物变化[48],从而发生离子交换,Fed含量增加,调节着碳的固存[49]。针铁矿加入后Fe-OC含量显著低于Glu处理,证实了针铁矿对葡萄糖来源和土壤来源有机碳的稳定作用在施用不久后增强,而SOC与铁矿的结合是动态的,培养结束后Goe-glu处理的pH明显降低(表 3),土壤pH可能通过改变铁形态状态和电荷特性来影响Fe-OC的结合,pH的降低表明了在氧化还原环境中可利用的SOC含量增多[11,50],这可能是因为Fe-OC的结合能力变弱,释放SOC,缓解了土壤碳限制。微生物在土壤中由于碳限制得到缓解后对碳的需求减少了,此时不需要再额外挖掘碳[51]。更多被微生物同化的碳保留在了土壤中供微生物生长,而不是用于呼吸,从而导致较低的激发效应[52]。而与针铁矿不同的是水铁矿的加入对激发效应未产生显著影响。水铁矿与针铁矿相比具有更大的比表面积,是一种弱结晶的铁氧化物,较差的结晶相更容易受到还原性溶解的影响[48]。葡萄糖为铁还原细菌提供电子受体,促进铁的异化还原并释放CO2[53-55]。研究发现,Feo在土壤环境中极易受到微生物还原和溶解的影响[9],这与本研究中Fh-glu处理的Feo含量显著高于Glu处理这一结果相吻合。水铁矿和葡萄糖的加入加速了铁氧化物的还原速率,导致二价铁浓度的增加。此外,C:Fe与激发效应呈负相关表明碳的还原释放依赖于C:Fe,较高的C:Fe导致更大了的稳定性[56],而在本研究中Fh-glu处理的C:Fe显著低于Glu处理,可见Fh-glu处理中的SOC较不稳定。然而,本研究中,并未观察到Fh-glu处理的累积激发效应和对照有显著差异。这一发现可能是因为土壤碳限制缓解导致了激发效应强度的减弱。
与表层土壤的结果不同,在亚表层土壤中,Fh-glu处理增加了激发效应的强度,而Goe-glu处理未改变激发效应的强度。这些发现同时支持了第二个和第三个假设。在亚表层土中,Fh-glu处理的激发效应强度增加主要是由于土壤碳限制和磷限制与激发效应呈显著负相关。葡萄糖起到电子穿梭的作用,增加了水铁矿的还原溶解,降低了铁氧化物对SOC的保护作用,进而增强了SOC矿化。当水铁矿处理的磷限制得到缓解,满足微生物对磷的代谢需求时,微生物生物量有所增加,此时促进了激发效应[57-59]。而针铁矿稳定葡萄糖来源碳的强大能力导致大多数不稳定的碳被固定,葡萄糖的不完全利用使土壤中碳的可利用性降低,导致激发效应未发生显著变化。
3.3 研究局限性本研究在测定累积激发效应时所采用的方法为本研究结果引入了一定的不确定性。本研究采用时间点采样的方法,在为期101天的培养过程中非线性选取了20个采气时间点。在进行室内培养时,为了防止培养期间因为梅森瓶全程封闭而使微生物处于厌氧状态,梅森瓶气体阀门大多时间保持打开状态,以保证瓶内气体能够与外界进行交换。只有在每次采气期间梅森瓶保持密闭24 h,采集完气体再次立刻打开阀门。本研究未捕获培养过程中所释放的全部气体,因此在计算土壤累积CO2排放量时采用了插值法进行计算。由于前期易分解有机碳分解较快,为尽可能减小误差,采集频率较为密集,后期有机碳分解速率降低,采集气体频率也略有降低。本研究通过调整检测频率尽可能降低测定方法所引入的系统误差不确定性。
4 结论本研究探讨了亚热带森林不同土层土壤中铁-碳之间的复杂耦合关系,证实了铁氧化物对SOC的固持和矿化有重要作用。不同土层土壤碳的激发效应不同,铁氧化物对其响应也存在明显差别。表层土壤中针铁矿可通过形成有机矿物结合物提高SOC的稳定性,水铁矿添加却无显著影响;在亚表层土壤中,针铁矿添加无显著影响,而水铁矿的还原反过来会增加SOC的矿化,这归因于土壤条件与矿物自身性质的差异。因此,在研究矿物保护的固碳作用时,应考虑铁氧化物稳定SOC和微生物矿化损失SOC的双重作用,从而进一步明确铁-碳耦合关系对碳循环的影响。
| [1] |
Wang H, Xu W H, Hu G Q, et al. The priming effect of soluble carbon inputs in organic and mineral soils from a temperate forest[J]. Oecologia, 2015, 178(4): 1239-1250. DOI:10.1007/s00442-015-3290-x
(  0) 0) |
| [2] |
Wang Q K, Wang Y P, Wang S L, et al. Fresh carbon and nitrogen inputs alter organic carbon mineralization and microbial community in forest deep soil layers[J]. Soil Biology and Biochemistry, 2014, 72: 145-151. DOI:10.1016/j.soilbio.2014.01.020
(  0) 0) |
| [3] |
Shahzad T, Anwar F, Hussain S, et al. Carbon dynamics in surface and deep soil in response to increasing litter addition rates in an agro-ecosystem[J]. Geoderma, 2019, 333: 1-9. DOI:10.1016/j.geoderma.2018.07.018
(  0) 0) |
| [4] |
Kuzyakov Y, Friedel J K, Stahr K. Review of mechanisms and quantification of priming effects[J]. Soil Biology and Biochemistry, 2000, 32(11/12): 1485-1498.
(  0) 0) |
| [5] |
Kan Z R, Liu W X, Liu W S, et al. Mechanisms of soil organic carbon stability and its response to no-till: A global synthesis and perspective[J]. Global Change Biology, 2022, 28(3): 693-710. DOI:10.1111/gcb.15968
(  0) 0) |
| [6] |
Jeewani P H, Van Zwieten L, Zhu Z K, et al. Abiotic and biotic regulation on carbon mineralization and stabilization in paddy soils along iron oxide gradients[J]. Soil Biology and Biochemistry, 2021, 160: 108312. DOI:10.1016/j.soilbio.2021.108312
(  0) 0) |
| [7] |
Georgiou K, Jackson R B, Vindušková O, et al. Global stocks and capacity of mineral-associated soil organic carbon[J]. Nature Communications, 2022, 13(1): 3797. DOI:10.1038/s41467-022-31540-9
(  0) 0) |
| [8] |
Mu C C, Zhang T J, Zhao Q, et al. Soil organic carbon stabilization by iron in permafrost regions of the Qinghai-Tibet Plateau[J]. Geophysical Research Letters, 2016, 43(19): 10286-10294.
(  0) 0) |
| [9] |
Liu Y L, Dong Y Q, Ge T D, et al. Impact of prolonged rice cultivation on coupling relationship among C, Fe, and Fe-reducing bacteria over a 1000-year paddy soil chronosequence[J]. Biology and Fertility of Soils, 2019, 55(6): 589-602. DOI:10.1007/s00374-019-01370-x
(  0) 0) |
| [10] |
Zhang Z S, Jiang S, Zhao W W, et al. Which is more important in stabilizing soil organic carbon in mountain ecosystems: Molecular features, mineral protection, soil nutrients, or elevation?[J]. Catena, 2023, 232: 107395. DOI:10.1016/j.catena.2023.107395
(  0) 0) |
| [11] |
Song X X, Wang P, Van Zwieten L, et al. Towards a better understanding of the role of Fe cycling in soil for carbon stabilization and degradation[J]. Carbon Research, 2022, 1(1): 5. DOI:10.1007/s44246-022-00008-2
(  0) 0) |
| [12] |
Chen C M, Hall S J, Coward E, et al. Iron-mediated organic matter decomposition in humid soils can counteract protection[J]. Nature Communications, 2020, 11(1): 2255. DOI:10.1038/s41467-020-16071-5
(  0) 0) |
| [13] |
Duan X, Li Z, Li Y H, et al. Iron–organic carbon associations stimulate carbon accumulation in paddy soils by decreasing soil organic carbon priming[J]. Soil Biology and Biochemistry, 2023, 179: 108972. DOI:10.1016/j.soilbio.2023.108972
(  0) 0) |
| [14] |
Mikutta R, Kleber M, Torn M S, et al. Stabilization of soil organic matter: Association with minerals or chemical recalcitrance?[J]. Biogeochemistry, 2006, 77(1): 25-56. DOI:10.1007/s10533-005-0712-6
(  0) 0) |
| [15] |
Du H Y, Yu G H, Sun F S, et al. Iron minerals inhibit the growth of Pseudomonas brassicacearum J12 via a free-radical mechanism: Implications for soil carbon storage[J]. Biogeosciences, 2019, 16(7): 1433-1445. DOI:10.5194/bg-16-1433-2019
(  0) 0) |
| [16] |
Patel K F, Tejnecký V, Ohno T, et al. Reactive oxygen species alter chemical composition and adsorptive fractionation of soil-derived organic matter[J]. Geoderma, 2021, 384: 114805. DOI:10.1016/j.geoderma.2020.114805
(  0) 0) |
| [17] |
Liu Q, Li Y H, Liu S L, et al. Anaerobic primed CO2 and CH4 in paddy soil are driven by Fe reduction and stimulated by biochar[J]. Science of the Total Environment, 2022, 808: 151911. DOI:10.1016/j.scitotenv.2021.151911
(  0) 0) |
| [18] |
Singh M, Sarkar B, Sarkar S, et al. Stabilization of soil organic carbon as influenced by clay mineralogy[M]//Advances in Agronomy. Amsterdam: Elsevier, 2018: 33—84.
(  0) 0) |
| [19] |
Feng X H, Qin S Q, Zhang D Y, et al. Nitrogen input enhances microbial carbon use efficiency by altering plant-microbe-mineral interactions[J]. Global Change Biology, 2022, 28(16): 4845-4860. DOI:10.1111/gcb.16229
(  0) 0) |
| [20] |
Keiluweit M, Bougoure J J, Nico P S, et al. Mineral protection of soil carbon counteracted by root exudates[J]. Nature Climate Change, 2015, 5: 588-595. DOI:10.1038/nclimate2580
(  0) 0) |
| [21] |
Meyer N, Welp G, Rodionov A, et al. Nitrogen and phosphorus supply controls soil organic carbon mineralization in tropical topsoil and subsoil[J]. Soil Biology and Biochemistry, 2018, 119: 152-161. DOI:10.1016/j.soilbio.2018.01.024
(  0) 0) |
| [22] |
Zhou Y X, Lyu M K, Xie J S, et al. Sources, characteristics and stability of organic carbon in deep soil (In Chinese)[J]. Journal of Subtropical Resources and Environment, 2013, 8(1): 48-55. [周艳翔, 吕茂奎, 谢锦升, 等. 深层土壤有机碳的来源、特征与稳定性[J]. 亚热带资源与环境学报, 2013, 8(1): 48-55.]
(  0) 0) |
| [23] |
Dove N C, Arogyaswamy K, Billings S A, et al. Continental-scale patterns of extracellular enzyme activity in the subsoil: An overlooked reservoir of microbial activity[J]. Environmental Research Letters, 2020, 15(10): 1040a1. DOI:10.1088/1748-9326/abb0b3
(  0) 0) |
| [24] |
Chen X, Feng J G, Ding Z J, et al. Changes in soil total, microbial and enzymatic C-N-P contents and stoichiometry with depth and latitude in forest ecosystems[J]. Science of the Total Environment, 2022, 816: 151583. DOI:10.1016/j.scitotenv.2021.151583
(  0) 0) |
| [25] |
Bernal B, McKinley D C, Hungate B A, et al. Limits to soil carbon stability; Deep, ancient soil carbon decomposition stimulated by new labile organic inputs[J]. Soil Biology and Biochemistry, 2016, 98: 85-94. DOI:10.1016/j.soilbio.2016.04.007
(  0) 0) |
| [26] |
Henneron L, Balesdent J, Alvarez G, et al. Bioenergetic control of soil carbon dynamics across depth[J]. Nature Communications, 2022, 13(1): 7676. DOI:10.1038/s41467-022-34951-w
(  0) 0) |
| [27] |
Fontaine S, Barot S, Barré P, et al. Stability of organic carbon in deep soil layers controlled by fresh carbon supply[J]. Nature, 2007, 450(7167): 277-280. DOI:10.1038/nature06275
(  0) 0) |
| [28] |
Kramer S, Marhan S, Haslwimmer H, et al. Temporal variation in surface and subsoil abundance and function of the soil microbial community in an arable soil[J]. Soil Biology and Biochemistry, 2013, 61: 76-85. DOI:10.1016/j.soilbio.2013.02.006
(  0) 0) |
| [29] |
Antony D, Collins C D, Clark J M, et al. Soil organic matter storage in temperate lowland arable, grassland and woodland topsoil and subsoil[J]. Soil Use and Management, 2022, 38(4): 1532-1546. DOI:10.1111/sum.12801
(  0) 0) |
| [30] |
Chen L Y, Fang K, Wei B, et al. Soil carbon persistence governed by plant input and mineral protection at regional and global scales[J]. Ecology Letters, 2021, 24(5): 1018-1028. DOI:10.1111/ele.13723
(  0) 0) |
| [31] |
Han L F, Sun K, Keiluweit M, et al. Mobilization of ferrihydrite-associated organic carbon during Fe reduction: Adsorption versus coprecipitation[J]. Chemical Geology, 2019, 503: 61-68. DOI:10.1016/j.chemgeo.2018.10.028
(  0) 0) |
| [32] |
Zhao Q, Poulson S R, Obrist D, et al. Iron-bound organic carbon in forest soils: Quantification and characterization[J]. Biogeosciences, 2016, 13(16): 4777-4788. DOI:10.5194/bg-13-4777-2016
(  0) 0) |
| [33] |
Zhao Q, Dunham-Cheatham S, Adhikari D, et al. Oxidation of soil organic carbon during an anoxic-oxic transition[J]. Geoderma, 2020, 377: 114584. DOI:10.1016/j.geoderma.2020.114584
(  0) 0) |
| [34] |
Wang Y Q, Li Y H, Zhu Z K, et al. The effect of iron oxides on mineralization, transformation and priming effect of acetate in anoxic paddy soils (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(6): 1683-1694. [王云秋, 李宇虹, 祝贞科, 等. 铁氧化物对厌氧水稻土中乙酸矿化、转化及其激发效应的影响[J]. 土壤学报, 2022, 59(6): 1683-1694.]
(  0) 0) |
| [35] |
Li Y H, Zhu Z K, Wei X M, et al. Sources and intensity of CH4 production in paddy soils depend on iron oxides and microbial biomass[J]. Biology and Fertility of Soils, 2022, 58(2): 181-191. DOI:10.1007/s00374-022-01618-z
(  0) 0) |
| [36] |
Lalonde K, Mucci A, Ouellet A, et al. Preservation of organic matter in sediments promoted by iron[J]. Nature, 2012, 483: 198-200. DOI:10.1038/nature10855
(  0) 0) |
| [37] |
Wan D, Zhang N C, Chen W L, et al. Organic matter facilitates the binding of Pb to iron oxides in a subtropical contaminated soil[J]. Environmental Science and Pollution Research International, 2018, 25(32): 32130-32139. DOI:10.1007/s11356-018-3173-x
(  0) 0) |
| [38] |
German D P, Chacon S S, Allison S D. Substrate concentration and enzyme allocation can affect rates of microbial decomposition[J]. Ecology, 2011, 92(7): 1471-1480. DOI:10.1890/10-2028.1
(  0) 0) |
| [39] |
Moorhead D L, Rinkes Z L, Sinsabaugh R L, et al. Dynamic relationships between microbial biomass, respiration, inorganic nutrients and enzyme activities: Informing enzyme-based decomposition models[J]. Frontiers in Microbiology, 2013, 4: 223.
(  0) 0) |
| [40] |
Tian Q X, Yang X L, Wang X G, et al. Microbial community mediated response of organic carbon mineralization to labile carbon and nitrogen addition in topsoil and subsoil[J]. Biogeochemistry, 2016, 128(1): 125-139.
(  0) 0) |
| [41] |
Paterson E, Sim A. Soil-specific response functions of organic matter mineralization to the availability of labile carbon[J]. Global Change Biology, 2013, 19(5): 1562-1571.
(  0) 0) |
| [42] |
Rukshana F, Butterly C R, Xu J M, et al. Soil organic carbon contributes to alkalinity priming induced by added organic substrates[J]. Soil Biology and Biochemistry, 2013, 65: 217-226.
(  0) 0) |
| [43] |
Zhang Y L, Yao S H, Cao X Y, et al. Structural evidence for soil organic matter turnover following glucose addition and microbial controls over soil carbon change at different horizons of a Mollisol[J]. Soil Biology and Biochemistry, 2018, 119: 63-73.
(  0) 0) |
| [44] |
de Graaff M A, Jastrow J D, Gillette S, et al. Differential priming of soil carbon driven by soil depth and root impacts on carbon availability[J]. Soil Biology and Biochemistry, 2014, 69: 147-156.
(  0) 0) |
| [45] |
Perveen N, Barot S, Maire V, et al. Universality of priming effect: An analysis using thirty five soils with contrasted properties sampled from five continents[J]. Soil Biology and Biochemistry, 2019, 134: 162-171.
(  0) 0) |
| [46] |
Salomé C, Nunan N, Pouteau V, et al. Carbon dynamics in topsoil and in subsoil may be controlled by different regulatory mechanisms[J]. Global Change Biology, 2010, 16(1): 416-426.
(  0) 0) |
| [47] |
Jeewani P H, Ling L, Fu Y Y, et al. The stoichiometric C-Fe ratio regulates glucose mineralization and stabilization via microbial processes[J]. Geoderma, 2021, 383: 114769.
(  0) 0) |
| [48] |
Jilling A, Keiluweit M, Contosta A R, et al. Minerals in the rhizosphere: Overlooked mediators of soil nitrogen availability to plants and microbes[J]. Biogeochemistry, 2018, 139(2): 103-122.
(  0) 0) |
| [49] |
Fang Y Y, Tavakkoli E, Weng Z, et al. Disentangling carbon stabilization in a Calcisol subsoil amended with iron oxyhydroxides: A dual-13C isotope approach[J]. Soil Biology and Biochemistry, 2022, 170: 108711.
(  0) 0) |
| [50] |
Duan X, Li Z, Liu M, et al. Progress of the iron-mediated soil organic carbon preservation and mineralization (In Chinese)[J]. Advances in Earth Science, 2022, 37(2): 202-211. [段勋, 李哲, 刘淼, 等. 铁介导的土壤有机碳固持和矿化研究进展[J]. 地球科学进展, 2022, 37(2): 202-211.]
(  0) 0) |
| [51] |
Xiao Q, Huang Y P, Wu L, et al. Long-term manuring increases microbial carbon use efficiency and mitigates priming effect via alleviated soil acidification and resource limitation[J]. Biology and Fertility of Soils, 2021, 57(7): 925-934.
(  0) 0) |
| [52] |
Cotrufo M F, Ranalli M G, Haddix M L, et al. Soil carbon storage informed by particulate and mineral-associated organic matter[J]. Nature Geoscience, 2019, 12: 989-994.
(  0) 0) |
| [53] |
Adhikari D, Zhao Q, Das K, et al. Dynamics of ferrihydrite-bound organic carbon during microbial Fe reduction[J]. Geochimica et Cosmochimica Acta, 2017, 212: 221-233.
(  0) 0) |
| [54] |
Li H, Bölscher T, Winnick M, et al. Simple plant and microbial exudates destabilize mineral-associated organic matter via multiple pathways[J]. Environmental Science & Technology, 2021, 55(5): 3389-3398.
(  0) 0) |
| [55] |
Islam M R, Singh B, Dijkstra F A. Microbial carbon use efficiency of glucose varies with soil clay content: A meta-analysis[J]. Applied Soil Ecology, 2023, 181: 104636.
(  0) 0) |
| [56] |
Pan W N, Kan J J, Inamdar S, et al. Dissimilatory microbial iron reduction release DOC(dissolved organic carbon)from carbon-ferrihydrite association[J]. Soil Biology and Biochemistry, 2016, 103: 232-240.
(  0) 0) |
| [57] |
Jing X, Chen X, Fang J Y, et al. Soil microbial carbon and nutrient constraints are driven more by climate and soil physicochemical properties than by nutrient addition in forest ecosystems[J]. Soil Biology and Biochemistry, 2020, 141: 107657.
(  0) 0) |
| [58] |
Feng C X, Sun H L, Zhang Y D. The magnitude and direction of priming were driven by soil moisture and temperature in a temperate forest soil of China[J]. Pedobiologia, 2021, 89: 150769.
(  0) 0) |
| [59] |
Cui Y X, Moorhead D L, Wang X X, et al. Decreasing microbial phosphorus limitation increases soil carbon release[J]. Geoderma, 2022, 419: 115868.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


