2. 江西农业大学国土资源与环境学院, 南昌 330045;
3. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所), 南京 211135
2. College of Land Resources and Environment, Jiangxi Agricultural University, Nanchang 330045, China;
3. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China
磷(P)作为植物生长发育必需的营养元素,不仅是植物生长的重要限制因子,同时在维持生态系统平衡中也起着重要作用。植物生长所需要的磷素主要来源于土壤,土壤中磷素的丰缺及供给状况直接影响着植物的生长状况。土壤溶液中的无机正磷酸盐(H2PO– 4、HPO2– 4)是植物和微生物吸收磷的主要来源[1]。同时,土壤中有机磷通常占总磷的30%~65%,在高有机质含量的土壤中可达90%,有机磷经过矿化转化为无机磷后可供给植物和微生物直接吸收利用[2-3]。有机磷矿化在陆地生态系统中起着关键作用,同时也成为环境中磷流失的重要原因(图 1)。因此,深入探究土壤中有机磷的矿化过程、调控途径及其环境效应对评估土壤磷有效性、指导磷肥合理施用和磷污染防控具有重要意义。
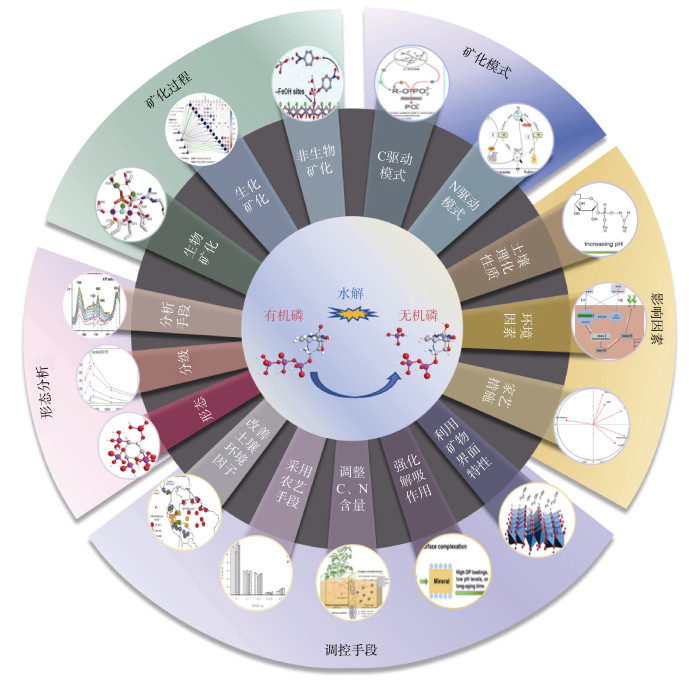
|
图 1 土壤有机磷的矿化及其调控措施研究进展示意图 Fig. 1 Diagram for current research progress on soil organic phosphorus mineralization and its regulation |
土壤有机磷是指以某种方式与碳键结合的磷[4]。植物和微生物从土壤溶液中吸收正磷酸盐后,通过生化途径与碳键结合形成生物有机磷。土壤有机磷主要来源于动植物残体的分解释放,此外,农田土壤中施入的有机肥和农作物残留物的分解也可形成不同形态有机磷[5]。为了更准确地评估土壤磷库的供应情况,有必要对有机磷形态进行细化表征。这将有助于更精确地估算不同形态有机磷的含量以及对土壤有效磷的补充能力,从而调控其在环境中的迁移和转化。
1.1 土壤有机磷的主要形态土壤中有机磷主要包括肌醇磷酸脂、核酸、核苷酸、磷脂、磷酸糖、磷蛋白等多种形式[2,5]。根据磷原子成键的性质,有机磷化合物可分为正磷酸酯、膦酸和有机缩合磷酸酯(磷酸酐)(图 2)。(1)正磷酸酯根据每个正磷酸盐相连的酯基团的数目,可分为磷酸一酯、磷酸二酯、磷酸三酯。正磷酸酯相对稳定,但在pH变化较大以及磷酸酶存在时容易发生水解[1,5];磷酸一酯主要包括磷酸糖、磷蛋白、单核苷酸和肌醇磷酸盐,在大多数土壤中,磷酸一酯是有机磷的主要形态,甚至占据土壤有机磷总量的100%[2-4]。土壤中肌醇磷酸盐是磷酸一酯的主要种类,而磷酸糖、磷蛋白和单核苷酸的含量很低[2];磷酸二酯主要包括核酸、磷脂、磷壁酸等,在农田土壤中通常不超过有机磷总量的10%;核酸(DNA\RNA)由糖分子通过酯键与正磷酸盐连接,其中DNA仅存在于细胞核中,而RNA分布于整个细胞[1-2];磷脂则是含有一个或多个磷酸基团的脂类,是所有生物细胞膜的主要成分[2]。(2)膦酸含有C-P键,与其他土壤有机磷化合物有着显著的结构差异[2]。自然界中主要的膦酸是2-氨基乙基膦酸(AEP),以游离分子形式存在,或存在于脂质或大分子物质中[6]。(3)磷酸酐所包括的二磷酸腺苷(ADP)和三磷酸腺苷(ATP)为最重要的有机磷酸酐,参与能量转移,并含有磷酸一酯和酸酐键[6]。
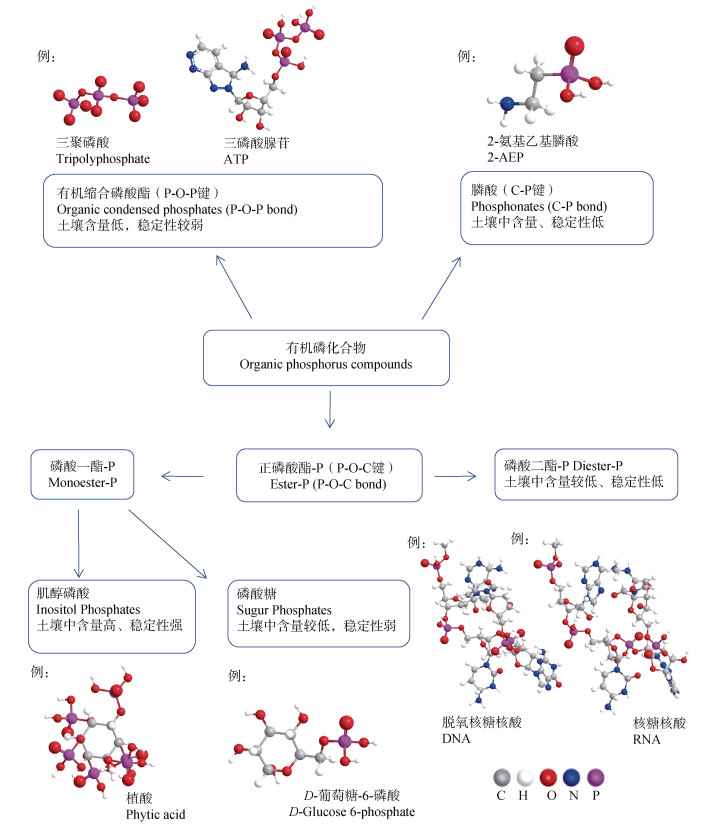
|
图 2 土壤中常见有机磷结构示意图 Fig. 2 Diagram for structures of some common organic phosphorus compounds in soils |
土壤有机磷分级是通过不同方法对土壤中各种有机磷按照其活性及生物有效性进行分级。Bowman和Cole[7]根据土壤有机磷的活性将其分为活性、中等活性、中稳性、高稳性四个等级。然而该方法采取先酸后碱的提取方法,可能会造成中等活性的有机磷含量偏高,而使稳定性有机磷含量偏小。Hedley分级方法则更加全面地区分有机磷组分和无机磷组分,可以更好地反映出土壤中各磷素形态的动态变化,即土壤磷分为树脂-P、NaHCO3-P、微生物量磷、NaOH-P、土壤团聚体内磷、磷灰石型磷以及Residual-P七大类[8],这是目前普遍采用的分类方法。此外,Guppy等[9]进一步简化了Hedley分级,将土壤P分为树脂-P、NaHCO3-P、NaOH-P、HCl-P、Residual-P,该方法通过低速离心不过滤进行固液分离。
1.3 土壤有机磷的分析手段准确测定土壤中有机磷含量的变化是深入研究土壤有机磷矿化过程的必要手段。然而,土壤的复杂性使有机磷难以原位定量分析,因此,表征有机磷的不同形态对于量化其含量至关重要。近年来,现代光谱学、质谱学和色谱学的快速发展,使得研究人员可以在分子水平上表征有机磷的组成和结构。
(1)液相31P核磁共振波谱(NMR)法。高分辨率的液相31P NMR波谱可以用来鉴定和量化土壤中不同形式的有机磷化合物[10]。通过核磁共振峰的特定位置、强度以及化学位移能够更加直观的了解有机磷矿化的转化过程。作为一种非破坏性的测定方法,液相31P NMR法不会引起有机磷的分解与转化。此外,液相31P NMR法还可以分析不同提取方法对磷提取效果的影响。Dai等[11]使用液相31P NMR法发现NaOH-EDTA法提取的有机磷含量较高,原因在于EDTA会优先与土壤中的钙、铁、铝形成络合物。但31P NMR法也存在对小分子量的小分子量有机磷测定不准确等问题。(2)原位衰减全反射-傅里叶变换红外光谱(ATR-FTIR)及二维相关光谱分析(2D-COS)。同样作为一种非破坏性测定方法,其能够提供关于有机磷分子基团的振动频率的实时信息、表面质子化程度以及不同官能团重叠带的反应序列,以揭示有机磷在矿物表面的吸附水解机制[12]。然而,测定样品中含有具有相似结构的复杂化合物,其重叠化的光谱峰常难以区分有机磷的作用过程。(3)X射线光电子能谱(XPS)。通过对光电子能量分析得到样品表面元素相应电子结合能,用于表面元素丰度和化学形态表征。该技术灵敏度高达万亿分之几,使其能够检测到样品中微量元素的存在。在磷酸盐相关研究中,XPS技术可以检测P 2p、O 1s、C 1s和Fe 2p/3p等元素不同能级电子的结合能,从而解析磷酸盐在铁(氢)氧化物或有机质表面的化学状态[13]。(4)磷K-边X射线吸收近边结构光谱(P K-edge XANES)。作为基于同步辐射X射线光源的近边结构分析方法可原位探测矿物表面上磷转化产物的化学形态,并对不同结构有机磷化合物显示出特定的光谱特征,从而提供矿物表面结合磷酸盐的结构信息。例如:Fe-Pi在2 148 eV处的特征边前峰源于P 1s轨道电子向Fe 4p-O 2p反键分子轨道的跃迁,而2 152 eV处的边前峰可归为P 1s轨道电子向P 3p-O 2p反键分子轨道的跃迁[14]。但是,P K-edge XANES技术的局限性是难以区分结构复杂有机磷化合物。(5)傅里叶变换离子回旋共振质谱(FT-ICR MS)。近年来,FT-ICR-MS作为环境科学领域新兴的高端技术,已被用于测定环境样品的有机物的组成与分布、计算分子式和估算结构。该技术可望克服液相31P NMR波谱和P K-edge XANES技术在检测复杂有机磷化合物时的局限[15]。FT-ICR MS技术的超高质量分辨率和质量准确度的特点使其具备进行有机磷形态分析的潜力。在测定过程中,离子回旋运动用于获得电流信号,该信号可帮助确定溶解有机磷的分子荷质比(m/z),从而进一步表征物质的分子组成。通过结合FT-ICR MS和液相31P NMR,可进一步从分子水平阐明有机磷化合物的分布和转化。尽管光谱学、质谱等方法在检测有机磷化合物方面取得了重要进展,但单一方法的局限性可能会导致结果的不准确性和不完整性。因此,未来研究的方向应建立多个组合的分析方法,以从不同的角度来表征土壤有机磷化合物的形态和矿化过程。
2 土壤有机磷矿化过程土壤中有机磷矿化主要由酶促和矿物介导两种途径进行,深入理解生物酶解和非生物矿物催化作用机制对于探究有机磷调控途径具有重要意义。植物和微生物能够分泌多种与细胞功能相关的磷酸酶,包括能量代谢、营养转运、代谢调节和蛋白质活化等方面,而磷酸酶作为一种胞内和胞外酶,具有将有机磷底物去磷酸化的功能[16-17]。土壤有机磷矿化过程可分为两种:(1)由土壤微生物氧化有机质所驱动的生物矿化过程;(2)由磷酸酶介导并受植物等其他生物对磷养分需求所驱动的生化矿化过程[18]。微生物和磷酸酶通过催化磷酸酯键的水解和释放正磷酸盐来实现有机磷的矿化[19]。常见的两种矿化反应(ROPO32-,ROPO3H-)[20]包括磷酸一酯在自然条件以及碱性磷酸酶和酸性磷酸酶作用下的水解机制,分别以式(1)、式(2)、式(3)表示:
| $ {\text{ROPO}}_{\text{3}}^{{\text{2}} - } + {{\text{H}}_2}{\text{O}}\xrightarrow[{}]{{}}{\text{ROH}} + {\text{HOPO}}_{\text{3}}^{{\text{2}} - } $ | (1) |
| $ \begin{array}{l}{\text{E+ROPO}}_{\text{3}}^{\text{2}-}\underset{}{\overset{}{\rightleftharpoons }}\text{E}\cdot {\text{ROPO}}_{\text{3}}^{\text{2}-}\underset{}{\overset{}{\rightleftarrows }}\\ {}^{\nearrow \text{ROH}}\text{E}-{\text{PO}}_{\text{3}}^{-}\underset{}{\overset{}{\rightleftharpoons }}\text{E}\cdot {\text{P}}_{\text{i}}\underset{}{\overset{}{\rightleftharpoons }}{\text{E+P}}_{\text{i}}\end{array} $ | (2) |
| $ \begin{array}{l}{\text{E+ROPO}}_{\text{3}}^{}{\text{H}}^{-}\underset{}{\overset{}{\rightleftharpoons }}\text{E}\cdot {\text{ROPO}}_{\text{3}}^{}{\text{H}}^{-}\underset{}{\overset{}{\rightleftarrows }}\\ {}^{\nearrow \text{ROH}}\text{E}-{\text{PO}}_{\text{3}}^{-}{\underset{}{\overset{}{\rightleftharpoons }}}^{\nearrow {\text{H}}_{\text{2}}\text{O}}{\text{E+P}}_{\text{i}}\end{array} $ | (3) |
式中,E为磷酸酶,Pi为正磷酸盐,E·ROPO3H–、E·ROPO32–与E·Pi表示为非共价酶底物-产物复合物、E-PO3–表示为一种磷酸化的酶中间体。
土壤微生物是有机磷矿化的重要驱动力,大部分磷酸酶也是由微生物产生,因此酶促过程占据重要地位。植酸作为土壤中最丰富的有机磷,植物无法直接吸收利用。Tarafdar等[21]研究表明,与植物根系植酸酶相比,土壤微生物植酸酶具有更强的水解能力。且Belinque等[22]研究显示,微生物通过刺激植物分泌植酸酶提高了植酸的矿化程度。因此,对于有机磷矿化过程中生物矿化和生化矿化两种途径的主导地位,仍需进一步探讨。近年来,非生物过程中矿物表面催化水解备受关注。研究表明[23],矿物作为非生物催化剂与酶解机理相似,能够快速断裂有机磷C-O-P键。尤其是在富含铁、锰氧化物等活性矿物的土壤中,非生物过程占据重要地位。因此,重新审视土壤有机磷非生物矿化过程显得尤为重要。
2.1 生化矿化过程胞外磷酸酶是指被活性细胞释放、附着在死细胞或碎片上、或吸附在黏土或腐殖质胶体上的磷酸酶[24]。生化矿化过程被定义为磷酸酶介导有机磷矿化释放无机养分,由植物及其他生命体对养分的需求驱动,从而在土壤溶液中完成吸收的过程[18]。土壤中有机磷生化矿化的关键酶类包括磷酸一酯酶(包括植酸酶)、磷酸二酯酶、水解含磷酸酐的焦磷酸酶和聚磷酸酶[24]。此外,磷酸酶根据其最佳活性pH不同可分为酸性磷酸酶和碱性磷酸酶。碱性磷酸酶主要来源于部分细菌和真菌,而酸性磷酸酶主要由植物产生和释放[25]。有机磷生化矿化通常与酸性磷酸酶活性密切相关[26]。根际和根表面的酸性磷酸酶活性相比土壤中的酸性磷酸酶活性较高,根际和根表面不稳定的有机磷会通过矿化作用而耗尽。此外,根际土壤中无机磷含量高于非根际土壤,这说明矿化作用的程度大于植物或菌根的吸收能力。在农田土壤中,根-土界面处酸性磷酸酶活性较高,与土壤有机磷浓度一起决定矿化过程的底物供应[26]。生化矿化是植物等其他生命体对磷养分需求所直接驱动的结果,但目前对磷酸酶矿化产物无机磷酸盐(Pi)在土壤界面上的化学行为仍知之甚少,因此未来的研究中需进一步探索相关过程。
2.2 生物矿化过程初级生产者或其相关微生物通过将有机磷矿化为Pi来缓解磷缺乏并提高产量[27-28]。生物矿化过程是指微生物通过氧化有机质来释放无机养分,以满足其能量需求[18]。同位素标记实验(如14C和33P)表明,有机磷矿化是由微生物对碳源的需求所驱动[29]。同时,微生物需要磷来维持其生存、生长和繁殖,因此在土壤Pi受限时,它们会通过表达编码应激反应蛋白的各种基因来适应[30]。依赖于Pi的外膜结合酶(磷酸酶)是微生物将不同形式的土壤有机磷矿化为Pi的关键酶,这使得微生物能够从有机磷矿化过程中同时获取C与P。微生物磷酸酶根据其底物范围、底物偏好及其最适pH的不同而分类[24-25,30]。混杂性碱性磷酸酶是最常见的微生物磷酸酶之一,主要包含phoA、phoD和phoX等三个主要基因组[31]。相关研究表明[32],碱性磷酸酶不仅对磷酸二酯和磷酸三酯具有活性,还扩大其功能范围。这些酶在土壤Pi耗尽时促进有机磷矿化产生Pi。碱性磷酸酶活性和调节受土壤Pi浓度的影响[30]。近期研究发现一种自然环境中十分常见且不受Pi抑制的基因—PafA,广泛存在于拟杆菌的基因组中,为土壤有机磷再矿化提供新途径[30]。研究人员已经开始运用相关基因技术筛选出含有分泌磷酸酶基因的微生物,以促进有机磷的微生物矿化。从功能基因的角度调控有机磷的生物矿化具有长远意义。
2.3 非生物矿化过程有机磷非生物矿化释放正磷酸盐是当前磷研究的前沿热点[14,23,33]。矿物介导的非生物矿化在有机磷水解中发挥关键作用,作为非生物催化剂提供类酶环境,通过断裂C-O-P键促进有机磷快速水解生成Pi(图 3)[14,23,34]。在土壤、沉积物等环境中非生物界面水解速率可以接近磷酸酶酶促水解速率,该过程因此也被认为是维持环境中磷生物有效性的重要途径,其界面反应活性一定程度上影响磷素地球化学行为与生态系统生产力[34]。磷酸酶促进有机磷矿化的机制归因于其结构中的金属活性位点,如碱性磷酸酶含有两个Fe(Ⅲ)、三个Ca(Ⅱ)的活性位点,有机磷末端磷酸基团与Fe(Ⅲ)和Ca(Ⅱ)发生双齿络合反应[35]。此外,土壤中铁(氢)氧化物表面也含有大量的活性位点,有机磷末端磷酸基团可以与铁氧化物表面羟基发生配位体交换反应,进入铁原子的配位壳,形成内圈型络合物。有机磷在铁铝氧化物表面络合构型与磷酸酶水解聚磷酸类似,末端磷酸根与铁铝氧化物表面铁或铝原子形成双齿双核稳定配位结构,矿物表面水化形成或自含的表面羟基可攻击末端磷酸酐键致使末端磷酸根逐级水解,逐个释放正磷酸盐[34]。环境矿物介导有机磷络合-水解与溶液pH、矿物类型、矿物晶型、矿物尺寸、磷酸盐链长显著相关[36-37]。配位络合介导有机磷界面水解,其水解速率与矿物比表面积正相关,即矿物尺寸越小,水解能力越强[34]。土壤中的金属离子也会影响矿物介导过程,在铁氧化物介导的有机磷水解中,Ca2+既可以与矿物表面羟基配位形成三元表面络合物提高矿物表面覆盖率,也能与有机磷末端的磷酸基团形成二元络合物,进一步提高铁氧化物对有机磷的水解反应活性[38]。同时,有机磷也会影响矿物聚集、分散和迁移行为,例如,土壤中植酸钙沉淀形成的网状结构以桥梁作用与赤铁矿纳米颗粒结合,增强其聚集形态[39]。Wan等[34]研究显示,土壤和沉积物中酶和矿物介导有机磷矿化贡献相当。矿物介导有机磷水解过程中,其表面高活性位点内在性质与其催化水解反应的能力之间的关系尚未完全阐明。铁(氢)氧化物羟基结构(≡FeOH、≡Fe2OH、≡Fe3OH)决定了其表面反应性,其作为活性亲核试剂能否进一步攻击有机磷-矿物吸附态络合物,值得进一步探讨研究。因此,重视矿物介导有机磷非生物矿化过程将有助于进一步认识有机磷矿化机理,对磷限制环境中的磷生物地球化学循环具有重要意义。
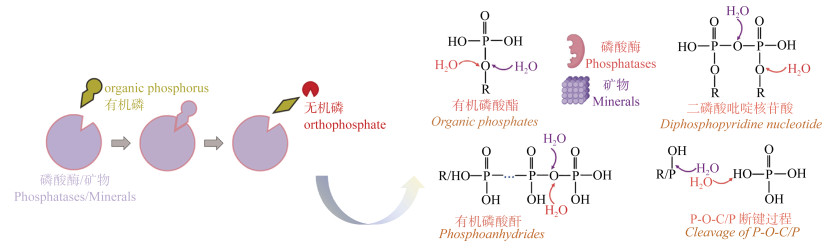
|
图 3 胞外磷酸酶介导与矿物介导有机磷矿化示意图,磷酸酶与矿物通过快速催化磷酸酯(P-O-C)和末端磷酸酐(P-O-P)键的断裂,导致有机磷水解产生正磷酸盐[33-34] Fig. 3 Schematic diagram for extracellular phosphatase-mediated and mineral-mediated organic phosphorus mineralization schematic diagram. Phosphatases and minerals rapidly catalyze the cleavage of phosphate ester(P-O-C)and terminal phosphoanhydride(P-O-P)bonds, resulting in the hydrolysis of organic phosphorus and production of Pi [33-34] |
微生物在有机磷矿化中发挥重要作用,碳(C)和氮(N)作为微生物存活所必需物质和能量,驱动着有机磷的转化过程。因此,从养分因子的角度出发,厘清有机磷矿化驱动模式有助于调控土壤磷库的转化,以更好地理解微生物对有机磷的作用。在施用C或N条件下,土壤有机磷释放模式可分
为两种不同的营养驱动模式[29,40],即:(1)N驱动模式,有机磷矿化由N有效性驱动微生物酶代谢;(2)C驱动模式,有机磷矿化由C有效性驱动微生物磷矿化。N驱动模式通过N刺激微生物产生酶来矿化有机磷,而C驱动模式通过C刺激微生物活性,进而通过生物矿化过程促进有机磷矿化。在自然土壤系统中,两种模式相互作用,共同驱动土壤磷循环。
3.1 N驱动土壤有机磷矿化N、P在土壤微生物的生长发育中都扮演着不可或缺的角色。在农田土壤中,Jing等[41]使用磷酸盐δ18O同位素方法,证明人为添加N显著影响土壤磷的转化过程。在N驱动模式下,磷酸酶在有机磷释放中起到关键作用。研究表明,N的添加显著提高湿地土壤和森林系统中因缺N而受限制的情况下磷酸酶活性[42-43]。随着N添加量的增加,持续刺激微生物酶的代谢活性、增加编码碱性磷酸酶的phoD基因的丰度、提高微生物的生产力,并增强其对磷的需求,导致磷酸酶活性显著变化,从而驱动有机磷矿化过程[44-45]。总体而言,N的添加提高了不同环境体系中磷酸酶活性以及相关酶基因的丰度,从而促进微生物驱动的有机磷矿化。然而,N的添加量与矿化率之间的关系以及N驱动微生物矿化有机磷的详细机制仍需要进一步的研究。
3.2 C驱动土壤有机磷矿化越来越多的研究表明,有机磷矿化与微生物的碳需求密切相关[46],而土壤有机质中通过吸附等界面反应而难以分解。当微生物所需碳受限时,它们会优先促进碳磷比(C︰P)较低的有机磷矿化,以满足自身对能量和碳的需求[47]。研究结果显示,在向森林灰土、弱育土和新成土中添加C源后,刺激了微生物驱动的有机磷矿化过程[29]。此外,土壤中农作物残体的C︰P会影响微生物驱动的有机磷矿化或同化[48]。当C︰P低于200︰1会促进有机磷矿化,而当C︰P高于300︰1促进无机磷向有机磷的转化[49-50]。土壤中C︰P介于200︰1和300︰1之间时,同化作用与矿化作用同时发生,速率相近。然而,在磷受限的土壤中,微生物可能已经适应了缺乏磷的环境,C︰P阈值并不适用。针对不同地区的磷素水平,人为调控土壤C︰P比是有效驱动有机磷矿化的重要方法。最新研究发现[51],植物根际光合碳的输入有效刺激土壤有机碳和有机磷矿化的微生物种群及其代谢功能,未来需要进一步探索C、P耦合过程对有机磷矿化的影响。
4 土壤有机磷矿化影响因素土壤中存在多种形态有机磷,其矿化过程容易受到外界因素的影响。土壤理化性质、环境因素和农田管理措施从不同角度影响着磷酸酶的活性和有机磷含量的变化。因此,深入研究有机磷矿化的影响因素对于更好地调控土壤中磷素的循环至关重要,以避免磷素不足导致植物发育不良或过量造成磷流失。调控有机磷矿化对提高土壤肥力和保护环境具有重要意义。
4.1 土壤理化性质 4.1.1 pH土壤pH是影响有机磷矿化的重要环境因子,其矿化程度随土壤pH的升高而增强[52]。土壤pH变化会影响磷酸酶活性、微生物群落组成和相关基因丰度[52-53],较低pH的土壤中含phoX、phoD、phoA基因的土壤微生物数量显著降低。在特定pH=7.5条件下,含phoX基因的土壤微生物能够促进有机磷矿化[53]。此外,稻田土壤生物膜中,碱性磷酸酶在pH=7~10时对磷酸一酯具有较强的催化作用[54]。另一方面,土壤pH还会影响有机磷的吸附和沉淀过程,从而影响有机磷的矿化。土壤矿物(铁/铝(氢)氧化物)表面电荷及其质子化程度会随着pH改变而发生变化[2],进而影响有机磷的矿化过程。
4.1.2 温度由于参与矿化反应的微生物和磷酸酶对温度十分敏感,土壤有机磷的矿化率随着温度升高而增加[49]。在温带气候区,土壤有机磷浓度在冬季增加,在春季减少。在相同温度条件下,热带森林较温带森林有机磷矿化速率更高。同样,相关研究发现[55],随着年平均气温的增加,土壤中度抗性有机磷逐渐分解,易分解无机磷显著富集。这表明适当提高温度有助于有机磷的矿化过程。
4.1.3 土壤含水量土壤含水量通过影响磷酸酶的产生和土壤微生物的生存影响着有机磷矿化[49,56]。在土壤含水量较高的情况下,酸性磷酸酶活性与土壤含水量呈正相关,有机磷矿化量随之增加[49]。当土壤中的植物残留物和动物粪便含水量较高时,解磷微生物会表现出更强的活性,从而促进有机磷的矿化程度[56]。在干湿交替条件下,森林系统土壤含水量的增加可以促进有机磷矿化[49],而旱季矿化作用较弱导致有机磷浓度较高。然而,当土壤含水量过高时,土壤团聚体的稳定性会受到破坏,从而使土壤中的微生物难以进行有机磷的矿化作用。因此,未来的研究需要进一步确定不同土壤系统中有机磷矿化的最适含水量范围,以获得最佳的有机磷矿化率。
4.1.4 土壤通气状况土壤通气状况对于有机磷矿化过程的影响机理更加复杂。有机磷的矿化可以在好氧和厌氧条件下发生。Bridgham等[57]研究发现,在有氧条件下有机磷矿化程度更高;而Islam和Mandal[58]研究表明,在厌氧条件下有机磷矿化程度更高。此外,长期淹水会导致土壤好氧微生物活性下降,从而降低土壤有机磷的矿化率[59]。土壤通气状况还会影响土壤氧化还原电位,改变土壤中铁(氢)氧化物的形态,进一步影响有机磷的吸附行为。目前对于土壤中氧化还原条件变化对有机磷矿化影响的趋势与机制尚不清楚,有待进一步探究。
4.2 环境因素 4.2.1 土壤环境CO2浓度土壤环境CO2浓度升高是气候变化的主要影响因素之一,这种环境现象会促进土壤有机磷的矿化[60]。植物根际碳能够增强微生物活性,导致微生物群落对磷养分的竞争加剧,进而增加植物对磷的需求[51,61]。植物碳在地下流动过程中的变化会影响植物、土壤、微生物之间的相互作用,导致土壤有机磷矿化的加快。通过构建土壤微生物的全群落遗传图谱及其小麦根际植酸,已经证明了CO2促进有机磷矿化[61]。同时,CO2的增加也导致降解芳香族化合物的细菌属相对丰度增加,这可能有助于根际植酸矿化。因此,当土壤环境CO2浓度升高时,土壤中有机磷的矿化主要发生在土壤微生物与植物碳互作的区域。后续实验需要进行长期的定位观测,以研究土壤环境CO2量与有机磷矿化量之间的变化关系。
4.2.2 土壤微生物生物量土壤有机磷酶活性与土壤中有机磷含量之间并无直接关联,而是取决于土壤中产酶微生物的生物量[62]。在森林土壤中,微生物磷是植物获取磷的重要来源[62]。森林土壤微生物磷的矿化研究显示,微生物磷矿化量占无机磷净增总量的83%。在营养贫乏的热带森林土壤中,旱季矿化率相对较低,但随着雨季的出现,微生物磷的矿化为植物提供了重要的磷源[63]。不同土壤群落中微生物生物量的变化会影响有机磷的矿化过程。在草地土壤中,微生物磷是植物获取磷的重要来源,而农田土壤受作物生长以及施用石灰等人为因素影响,导致微生物磷矿化增强,微生物磷浓度通常低于森林和草原土壤[64-65]。探究微生物磷矿化是有效利用有机磷的重要来源。
4.2.3 植被类型不同植被类型及其与菌根组合在影响土壤有机磷矿化过程中发挥关键作用,从而提高了有机磷的有效利用率。在森林系统中,混交林的引入能够提高微生物活性并形成更强的菌根组合,导致磷酸酶活性相比于单一树种种植高出三倍,从而显著提升有机磷矿化率[66]。此外,不同作物类型也会对有机磷的矿化程度和磷循环产生影响。相较于其他豆科植物和谷类作物,蚕豆以其密集的根系有效地利用土壤中的磷,通过根际有机酸分泌和较高的磷酸酶活性引发微生物活性和物种组成的变化,进而促进有机磷的矿化[26]。不同植被根系形态与菌根类型的差异会影响土壤中碱性磷酸酶活性和微生物生物量。通过丛枝菌根真菌和杉木根系的协同作用,促进易分解态有机磷和原生矿物态磷的转换,从而维持杉木幼苗的生长[67]。深入研究植被、菌根等多物种之间的耦合作用机制将有助于揭示根际有机磷的矿化行为。
4.2.4 污染物污染物的存在会改变土壤中酸性和碱性磷酸酶活性,从而影响有机磷的矿化过程。在添加铜和多酚类物质后,干燥的农业土壤的酸性磷酸酶活性下降[68]。研究发现,Ca2+和Mg2+能够激活酸性磷酸酶和碱性磷酸酶的活性,使其活性分别提高了14.1%和46.7%;而Zn2+、Cu2+、Mn2+、Al3+和Ag+对酸性磷酸酶和碱性磷酸酶活性具有抑制作用。Co2+在低浓度时对酸性磷酸酶和碱性磷酸酶活性有一定的激活作用,但高浓度时变为抑制作用[26]。在原位修复重金属污染土壤7年后,酸性和碱性磷酸酯酶活性均得到恢复[24]。需要注意的是,由于目前磷酸酶分析方法的局限性以及外界因素对磷酸酶造成的直接或间接影响,上述研究结果表明污染物对土壤磷酸酶活性的影响仍存在不确定性问题。
4.3 农艺措施 4.3.1 耕作方式耕作方式可以改变土壤的物理、化学和生物性质,从而对养分循环过程产生直接影响[64]。这些改变直接影响土壤微生物群落,进而影响磷酸酶介导的有机磷矿化过程。土壤耕作(旋耕、深翻、粉垄)通过影响有机磷组分变化,进而对矿化界面反应过程产生影响。在耕作土壤中,中活性、中稳性、高稳性、活性有机磷含量呈递减趋势[69]。旋耕处理各粒径土壤团聚体有机磷组分含量变化影响较小;相比之下,深翻处理和粉垄处理使各粒径土壤团聚体中活性和高稳性有机磷含量增加,而中稳性有机磷含量下降。因此,不同耕作方式通过改变不同粒径土壤团聚体比例,从而影响土壤有机磷的矿化过程。
4.3.2 施肥方式施肥方式主要通过调节磷酸酶活性和解磷微生物群落来影响有机磷矿化。长期施用磷肥会导致土壤中酸性和碱性磷酸酶活性呈现相反的趋势。具体而言,磷肥的施用会抑制酸性磷酸酶活性,同时使碱性磷酸酶活性高于未施用磷肥的对照组[70]。在集约种植系统中,磷肥施用使碱性磷酸酶活性受到土壤碳周转的影响[51,71],此外,农田土壤中解磷微生物群落结构和功能在施用矿物磷肥条件下发生显著变化[51]。有机肥料的施用也对土壤有机磷矿化产生显著影响。添加有机肥料显著增加phoD基因丰度,并且在施用有机肥料培养早期阶段,土壤磷酸酶活性增强[42]。与施用化学肥料相比,施用有机肥料显著提高phoC和phoD解磷基因多样性。不同研究者观测到的结果存在差异,这可能是由于土壤类型、肥料种类以及解磷微生物群落差异所致。因此,不同施肥方式可以直接或间接影响土壤中有机磷矿化过程。
4.3.3 施用生物质炭已有研究表明,生物质炭可以通过改变土壤磷吸附能力释放磷素,或提高碱性磷酸酶活性来促进有机磷矿化直接为作物提供磷素[72-73]。生物质炭导致的土壤磷酸酶活性增强可能是由于土壤微生物生物量和活性的增加所致[74]。研究发现,富含磷的生物质炭可以释放不稳定碳提高微生物的生物量和活性,但对土壤磷酸酶活性的影响并不一致[72],这可能是由于土壤中无机磷含量增加,提高植物根系对磷素的利用率从而抑制了微生物磷酸酶的合成[24]。此外,在低磷输入条件下,施用生物质炭可以促进磷酸酶活性和潜在的磷矿化过程[73]。综上所述,通过向土壤中添加生物质炭也是促进有机磷矿化的重要农艺措施。
5 有机磷矿化调控途径随着农田土壤中全磷的消耗和磷肥的持续施用,调控有机磷矿化变得愈发重要。研究表明,通过增强磷酸酶的活性,改变有机磷的组分以及增加解磷微生物的丰度,可以有效提高有机磷矿化程度。此外,需要深入了解有机磷与矿物界面反应过程,并根据具体土壤条件和外界影响因素进行详细分析。
1)改善土壤理化性质与环境因素。土壤磷酸酶的活性与微生物生物量、温度、pH、CO2含量呈正相关关系,而污染物的存在与之相反。土壤通气状况、含水量以及植被种类对有机磷矿化的影响各不相同。因此,通过调控土壤和环境条件的单一或多种因素的协同作用,有助于提高酶的活性,增强有机磷的矿化程度。
2)采用合理农艺措施。不同的耕作方式、施肥方式以及生物炭的施用均会对土壤物理化学性质产生影响。保护性耕作能够增加有机磷的含量和磷酸酶活性,而旋耕、深翻、粉垄等的耕作方式会影响土壤有机磷各级组分变化,进而影响有机磷矿化。此外,化肥的施用会抑制酸性磷酸酶活性,增强碱性磷酸酶活性,并显著提高phoC和phoD解磷基因的多样性。生物炭的施用可以直接供磷或改变土壤性质以解吸磷,并显著提高碱性磷酸酶活性,促进有机磷矿化。因此,合理农艺措施能够直接提高土壤中磷有效性,进而促进矿化作用。
3)调节N输入以及土壤C:P。C、N作为有机磷矿化驱动模式,N添加能够提高微生物磷酸酶代谢量以及相关酶基因的丰度,促进有机磷的酶解过程。通过控制土壤C:P低于200:1,使微生物保持磷饥饿状态,并在高碳环境下增强其活性,可以实现最佳的有机磷矿化比例。通过增强驱动模式,可以实现合理高效的调控。
4)强化土壤中有机磷解吸作用。不同矿物对有机磷的吸附可能影响矿化作用,有机磷与矿物存在外圈、内圈络合物等多种配位方式以及表面沉淀,能够降低解吸程度。通过明确不同有机磷与矿物的吸附特征,并根据土壤pH以及磷饱和度的不同采用适当手段,可以从矿物表面解吸有机磷,提高磷的利用率和生物有效性。
5)利用有机磷与矿物界面反应特性。有机磷与磷酸酶会共吸附在土壤矿物表面,形成高酶活性的矿物界面环境促进磷的水解过程。矿物也可作为非生物催化剂提供类酶环境,通过断裂C-O-P键快速水解产生正磷酸盐。同时,土壤中存在Ca2+金属离子可以促进有机磷矿物水解过程。综上所述,可向土壤中施用磷酸钙增加有机磷反应位点以及调控土壤pH改善理化性质。利用有机磷与矿物界面反应特性可从微观角度调控有机磷矿化过程。
6 未来研究展望认识到环境中有机磷与土壤中矿物、有机质、微生物等物质之间的相互作用,可以确定对生态系统、生物群落甚至全球磷循环自下而上的调控。尽管有机磷的矿化作用引起了越来越多的全球学者的关注,但在复杂环境条件下,有机磷的反应特征和微观机制仍有待进一步探索。在现有文献的基础上,今后对有机磷矿化的研究可考虑以下几个方面:
1)定量生物、非生物矿化过程及厘清反应机制与贡献。
矿物界面催化水解作为一种非生物矿化过程,已在磷生物地球化学循环中受到广泛关注。然而,现有研究主要集中于单一水解途径,而忽略了真实环境条件下不同矿物和酶促介导矿化过程的相互作用[34]。未来研究应重点探究真实环境条件下不同矿物和酶促介导矿化过程的定量比较;聚焦矿物、酶促水解耦合反应并揭示矿物在不同有机磷水解矿化过程中的作用机制和反应活性,应用P K-edge XANES、流动红外光谱、液相31P核磁共振等界面技术探明有机磷矿化及反应产物无机磷的非生物反应机制,以此评估生物和非生物途径在控制土壤有机磷矿化的相对贡献,进一步探索天然矿物在全球磷循环中的关键作用。
2)精准磷酸酶活性测定并明确有机磷循环过程及驱动矿化模式。磷酸酶活性测定及有机磷固定和矿化循环过程对分析有机磷净矿化率至关重要。然而,土壤中的有机磷可以同时发生同化和矿化作用,致使生物和生化矿化难以区分,这导致了真实的磷酸酶活性往往低于分析值,从而难以确定培养实验与自然生态系统中有机磷净矿化率是否一致。通过结合δ18O-P示踪法[41]和磷酸酶活性测定,以及测定植物和微生物产生磷酸酶相关基因表达,将更准确地估计活性较强磷酸酶在有机磷矿化中的贡献,以此有助于细化微生物C、N驱动模式,从而阐明生物和生化过程在有机磷矿化中的相对重要性,获得最佳调控手段。
3)阐明有机磷矿化对磷有效性、土壤环境的影响及其生态效应。磷素被视为土壤初级生产力的潜在限制性营养元素,在干湿交替条件下,还原态Fe(Ⅱ)与无机、有机磷在矿物表面进行共吸附/矿化作用,促进农业土壤中磷的循环。然而,磷素与矿物之间的界面行为会对矿物的胶体稳定性产生影响,明确其在环境中的迁移、转化过程以揭示矿物表面有机磷界面过程的机制,为缓解土壤磷饥饿提供理论基础。并进一步研究有机磷与环境中有机物、重金属污染物和微量元素的相互作用,开发动力学模型模拟自然土壤养分变化和磷素物理迁移过程,为预测和评估磷的环境行为及其生态效应提供科学工具。
| [1] |
Wang Y T, Zhang T Q, Zhao Y C, et al. Characterization of sedimentary phosphorus in Lake Erie and on-site quantification of internal phosphorus loading[J]. Water Research, 2021, 188: 116525. DOI:10.1016/j.watres.2020.116525
(  0) 0) |
| [2] |
Turner B L, Frossard E, Baldwin D S. Organic phosphorus in the environment[M]. Wallingford, Oxfordshire: CABI Publishing, 2005.
(  0) 0) |
| [3] |
Lu X C, Mahdi A K, Han X Z, et al. Long-term application of fertilizer and manures affect P fractions in Mollisol[J]. Scientific Reports, 2020, 10(1): 14793. DOI:10.1038/s41598-020-71448-2
(  0) 0) |
| [4] |
Yan Y P. Adsorption, desorption and precipitation of several soil organic phosphates on iron and aluminum(oxyhydr)oxides[D]. Wuhan: Huazhong Agricultural University, 2015.[严玉鹏. 几种土壤有机磷在铁铝氧化物表面的吸附、解吸与沉淀[D]. 武汉: 华中农业大学, 2015.]
(  0) 0) |
| [5] |
George T S, Giles C D, Menezes-Blackburn D, et al. Organic phosphorus in the terrestrial environment: A perspective on the state of the art and future priorities[J]. Plant and Soil, 2018, 427(1): 191-208.
(  0) 0) |
| [6] |
Manghi M C, Masiol M, Calzavara R, et al. The use of phosphonates in agriculture. Chemical, biological properties and legislative issues[J]. Chemosphere, 2021, 283: 131187. DOI:10.1016/j.chemosphere.2021.131187
(  0) 0) |
| [7] |
Bowman R A, Cole C V. An exploratory method for fractionation of organic phosphorus from grassland soils[J]. Soil Science, 1978, 125(2): 95-101. DOI:10.1097/00010694-197802000-00006
(  0) 0) |
| [8] |
Hedley M J, Stewart J W B, Chauhan B S. Changes in inorganic and organic soil phosphorus fractions induced by cultivation practices and by laboratory incubations[J]. Soil Science Society of America Journal, 1982, 46(5): 970-976. DOI:10.2136/sssaj1982.03615995004600050017x
(  0) 0) |
| [9] |
Guppy C N, Menzies N W, Moody P W, et al. Analytical methods and quality assurance[J]. Communications in Soil Science and Plant Analysis, 2000, 31(11/12/13/14): 1981-1991.
(  0) 0) |
| [10] |
Cade-Menun B, Liu C W. Solution phosphorus-31 nuclear magnetic resonance spectroscopy of soils from 2005 to 2013: A review of sample preparation and experimental parameters[J]. Soil Science Society of America Journal, 2014, 78(1): 19-37. DOI:10.2136/sssaj2013.05.0187dgs
(  0) 0) |
| [11] |
Dai K H, David M B, Vance G F, et al. Characterization of phosphorus in a spruce-fir spodosol by phosphorus-31 nuclear magnetic resonance spectroscopy[J]. Soil Science Society of America Journal, 1996, 60(6): 1943-1950. DOI:10.2136/sssaj1996.03615995006000060046x
(  0) 0) |
| [12] |
Li X W, Yang P, Zhao W T, et al. Adsorption mechanisms of glyphosate on ferrihydrite: Effects of Al substitution and aggregation state[J]. Environmental Science & Technology, 2023, 57(38): 14384-14395.
(  0) 0) |
| [13] |
Li T, Shi F, Ju Y T, et al. Facet-dependent adsorption of phosphate on hematite nanoparticles: Role of singly coordinated hydroxyl[J]. Water, 2023, 15(23): 4070. DOI:10.3390/w15234070
(  0) 0) |
| [14] |
Klein A R, Bone S E, Bakker E, et al. Abiotic phosphorus recycling from adsorbed ribonucleotides on a ferrihydrite-type mineral: Probing solution and surface species[J]. Journal of Colloid and Interface Science, 2019, 547: 171-182. DOI:10.1016/j.jcis.2019.03.086
(  0) 0) |
| [15] |
Li X L, Guo M L, Wang Y, et al. Molecular insight into the release of phosphate from dissolved organic phosphorus photo-mineralization in shallow lakes based on FT-ICR MS analysis[J]. Water Research, 2022, 222: 118859. DOI:10.1016/j.watres.2022.118859
(  0) 0) |
| [16] |
Bhadouria J, Giri J. Purple acid phosphatases: Roles in phosphate utilization and new emerging functions[J]. Plant Cell Reports, 2022, 41(1): 33-51. DOI:10.1007/s00299-021-02773-7
(  0) 0) |
| [17] |
Wasner D, Prommer J, Zezula D, et al. Tracing 33P-labelled organic phosphorus compounds in two soils: New insights into decomposition dynamics and direct use by microbes[J]. Frontiers in Soil Science, 2023, 3: 1097965. DOI:10.3389/fsoil.2023.1097965
(  0) 0) |
| [18] |
McGill W B, Cole C V. Comparative aspects of cycling of organic C, N, S and P through soil organic matter[J]. Geoderma, 1981, 26(4): 267-286. DOI:10.1016/0016-7061(81)90024-0
(  0) 0) |
| [19] |
Petrović D, Szeler K, Kamerlin S C L. Challenges and advances in the computational modeling of biological phosphate hydrolysis[J]. Chemical Communications, 2018, 54(25): 3077-3089. DOI:10.1039/C7CC09504J
(  0) 0) |
| [20] |
Vincent J B, Crowder M W, Averill B A. Hydrolysis of phosphate monoesters: A biological problem with multiple chemical solutions[J]. Trends in Biochemical Sciences, 1992, 17(3): 105-110. DOI:10.1016/0968-0004(92)90246-6
(  0) 0) |
| [21] |
Tarafdar J C, Yadav R S, Meena S C. Comparative efficiency of acid phosphatase originated from plant and fungal sources[J]. Journal of Plant Nutrition and Soil Science, 2001, 164(3): 279-282. DOI:10.1002/1522-2624(200106)164:3<279::AID-JPLN279>3.0.CO;2-L
(  0) 0) |
| [22] |
Belinque H, Pucheu N, Kerber N, et al. Utilization of organic phosphorus sources by oilseed rape, sunflower, and soybean[J]. Journal of Plant Nutrition and Soil Science, 2015, 178(2): 339-344. DOI:10.1002/jpln.201400301
(  0) 0) |
| [23] |
Huang R X, Wan B, Hultz M, et al. Phosphatase-mediated hydrolysis of linear polyphosphates[J]. Environmental Science & Technology, 2018, 52(3): 1183-1190.
(  0) 0) |
| [24] |
Nannipieri P, Giagnoni L, Landi L, et al. Role of phosphatase enzymes in soil[M]//Phosphorus in action. Berlin, Heidelberg: Springer, 2011: 215—243.
(  0) 0) |
| [25] |
Hu Y J, Xia Y H, Sun Q, et al. Effects of long-term fertilization on phoD-harboring bacterial community in Karst soils[J]. Science of the Total Environment, 2018, 628/629: 53-63. DOI:10.1016/j.scitotenv.2018.01.314
(  0) 0) |
| [26] |
Cai S J, Deng K Y, Li J Y, et al. Effects of metal ions on phosphatase activity of periphytic biofilm in paddy fields (In Chinese)[J]. Soils, 2020, 52(3): 525-531. [蔡述杰, 邓开英, 李九玉, 等. 不同金属离子对稻田自然生物膜磷酸酶活性的影响[J]. 土壤, 2020, 52(3): 525-531.]
(  0) 0) |
| [27] |
Phoenix G K, Johnson D A, Muddimer S P, et al. Niche differentiation and plasticity in soil phosphorus acquisition among co-occurring plants[J]. Nature Plants, 2020, 6(4): 349-354. DOI:10.1038/s41477-020-0624-4
(  0) 0) |
| [28] |
Duhamel S, Diaz J M, Adams J C, et al. Phosphorus as an integral component of global marine biogeochemistry[J]. Nature Geoscience, 2021, 14(6): 359-368. DOI:10.1038/s41561-021-00755-8
(  0) 0) |
| [29] |
Spohn M, Kuzyakov Y. Phosphorus mineralization can be driven by microbial need for carbon[J]. Soil Biology & Biochemistry, 2013, 61: 69-75.
(  0) 0) |
| [30] |
Lidbury I D E A, Scanlan D J, Murphy A R J, et al. A widely distributed phosphate-insensitive phosphatase presents a route for rapid organophosphorus remineralization in the biosphere[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(5): e2118122119.
(  0) 0) |
| [31] |
Wei X M, Hu Y J, Razavi B S, et al. Rare taxa of alkaline phosphomonoesterase-harboring microorganisms mediate soil phosphorus mineralization[J]. Soil Biology & Biochemistry, 2019, 131: 62-70.
(  0) 0) |
| [32] |
Srivastava A, Saavedra D E M, Thomson B, et al. Enzyme promiscuity in natural environments: Alkaline phosphatase in the ocean[J]. The ISME Journal, 2021, 15(11): 3375-3383. DOI:10.1038/s41396-021-01013-w
(  0) 0) |
| [33] |
Huang X L. Hydrolysis of phosphate esters catalyzed by inorganic iron oxide nanoparticles acting as biocatalysts[J]. Astrobiology, 2018, 18(3): 294-310. DOI:10.1089/ast.2016.1628
(  0) 0) |
| [34] |
Wan B, Huang R X, Diaz J M, et al. Rethinking the biotic and abiotic remineralization of complex phosphate molecules in soils and sediments[J]. Science of the Total Environment, 2022, 833: 155187. DOI:10.1016/j.scitotenv.2022.155187
(  0) 0) |
| [35] |
Yong S C, Roversi P, Lillington J, et al. A complex iron-calcium cofactor catalyzing phosphotransfer chemistry[J]. Science, 2014, 345(6201): 1170-1173. DOI:10.1126/science.1254237
(  0) 0) |
| [36] |
Wan B, Huang R X, Diaz J M, et al. Manganese oxide catalyzed hydrolysis of polyphosphates[J]. ACS Earth and Space Chemistry, 2019, 3(11): 2623-2634. DOI:10.1021/acsearthspacechem.9b00220
(  0) 0) |
| [37] |
Wan B, Huang R X, Diaz J M, et al. Polyphosphate adsorption and hydrolysis on aluminum oxides[J]. Environmental Science & Technology, 2019, 53(16): 9542-9552.
(  0) 0) |
| [38] |
Wan B, Yang P, Jung H, et al. Iron oxides catalyze the hydrolysis of polyphosphate and precipitation of calcium phosphate minerals[J]. Geochimica et Cosmochimica Acta, 2021, 305: 49-65. DOI:10.1016/j.gca.2021.04.031
(  0) 0) |
| [39] |
Xu C Y, Li J Y, Xu R K, et al. Sorption of organic phosphates and its effects on aggregation of hematite nanoparticles in monovalent and bivalent solutions[J]. Environmental Science and Pollution Research, 2017, 24(8): 7197-7207. DOI:10.1007/s11356-017-8382-1
(  0) 0) |
| [40] |
Sun H Y, Wu Y H, Zhou J, et al. Microorganisms drive stabilization and accumulation of organic phosphorus: An incubation experiment[J]. Soil Biology & Biochemistry, 2022, 172: 108750.
(  0) 0) |
| [41] |
Jing D D, Yan Y P, Ren T, et al. Effects of nitrogen application rate on phosphorus transformation in an Alfisol: Results from phosphate-oxygen isotope ratios[J]. Applied Geochemistry, 2021, 134: 105094. DOI:10.1016/j.apgeochem.2021.105094
(  0) 0) |
| [42] |
Guan B, Xie B H, Yang S S, et al. Effects of five years' nitrogen deposition on soil properties and plant growth in a salinized reed wetland of the Yellow River Delta[J]. Ecological Engineering, 2019, 136: 160-166. DOI:10.1016/j.ecoleng.2019.06.016
(  0) 0) |
| [43] |
Zeng Q X, Zhang Q F, Lin K M, et al. Enzyme stoichiometry evidence revealed that five years nitrogen addition exacerbated the carbon and phosphorus limitation of soil microorganisms in a Phyllostachys pubescens forest (In Chinese)[J]. Chinese Journal of Applied Ecology, 2021, 32(2): 521-528. [曾泉鑫, 张秋芳, 林开淼, 等. 酶化学计量揭示5年氮添加加剧毛竹林土壤微生物碳磷限制[J]. 应用生态学报, 2021, 32(2): 521-528.]
(  0) 0) |
| [44] |
Cui H Y, Sun W, Delgado-Baquerizo M, et al. Cascading effects of N fertilization activate biologically driven mechanisms promoting P availability in a semi-arid grassland ecosystem[J]. Functional Ecology, 2021, 35(4): 1001-1011. DOI:10.1111/1365-2435.13773
(  0) 0) |
| [45] |
Sinsabaugh R L, Carreiro M M, Repert D A. Allocation of extracellular enzymatic activity in relation to litter composition, N deposition, and mass loss[J]. Biogeochemistry, 2002, 60(1): 1-24. DOI:10.1023/A:1016541114786
(  0) 0) |
| [46] |
Romanyà J, Blanco-Moreno J M, Sans F X. Phosphorus mobilization in low-P arable soils may involve soil organic C depletion[J]. Soil Biology & Biochemistry, 2017, 113: 250-259.
(  0) 0) |
| [47] |
Spohn M, Ermak A, Kuzyakov Y. Microbial gross organic phosphorus mineralization can be stimulated by root exudates–A 33P isotopic dilution study[J]. Soil Biology & Biochemistry, 2013, 65: 254-263.
(  0) 0) |
| [48] |
Achat D L, Augusto L, Bakker M R, et al. Microbial processes controlling P availability in forest spodosols as affected by soil depth and soil properties[J]. Soil Biology & Biochemistry, 2012, 44(1): 39-48.
(  0) 0) |
| [49] |
Dalai R C. Soil organic phosphorus[J]. Advances in Agronomy, 1977, 29: 83-117.
(  0) 0) |
| [50] |
Sharpley A N, Smith S J. Mineralization and leaching of phosphorus from soil incubated with surface-applied and incorporated crop residue[J]. Journal of Environmental Quality, 1989, 18(1): 101-105.
(  0) 0) |
| [51] |
Guo L L, Yu Z H, Li Y S, et al. Stimulation of primed carbon under climate change corresponds with phosphorus mineralization in the rhizosphere of soybean[J]. Science of the Total Environment, 2023, 899: 165580. DOI:10.1016/j.scitotenv.2023.165580
(  0) 0) |
| [52] |
Harrison A F. Labile organic phosphorus mineralization in relationship to soil properties[J]. Soil Biology & Biochemistry, 1982, 14(4): 343-351.
(  0) 0) |
| [53] |
Zaheer R, Morton R, Proudfoot M, et al. Genetic and biochemical properties of an alkaline phosphatase PhoX family protein found in many bacteria[J]. Environmental Microbiology, 2009, 11(6): 1572-1587. DOI:10.1111/j.1462-2920.2009.01885.x
(  0) 0) |
| [54] |
Cai S J, Deng K Y, Tang J, et al. Characterization of extracellular phosphatase activities in periphytic biofilm from paddy field[J]. Pedosphere, 2021, 31(1): 116-124. DOI:10.1016/S1002-0160(20)60061-3
(  0) 0) |
| [55] |
Luo C Y, Wu Y H, He Q Q, et al. Increase of temperature exacerbates the conversion of P fractions in organic horizon[J]. Soil Biology & Biochemistry, 2024, 192: 109368.
(  0) 0) |
| [56] |
Floate M J S. Mineralization of nitrogen and phosphorus from organic materials of plant and animal origin and its significance in the nutrient cycle in grazed upland and hill soils[J]. Grass and Forage Science, 1970, 25(4): 295-302. DOI:10.1111/j.1365-2494.1970.tb01207.x
(  0) 0) |
| [57] |
Bridgham S D, Updegraff K, Pastor J. Carbon, nitrogen, and phosphorus mineralization in northern wetlands[J]. Ecology, 1998, 79(5): 1545-1561. DOI:10.1890/0012-9658(1998)079[1545:CNAPMI]2.0.CO;2
(  0) 0) |
| [58] |
Islam A, Mandal R. Amounts and mineralization of organic phosphorus compounds and derivatives in some surface soils of Bangladesh[J]. Geoderma, 1977, 17(1): 57-68. DOI:10.1016/0016-7061(77)90005-2
(  0) 0) |
| [59] |
Wright R B, Lockaby B G, Walbridge M R. Phosphorus availability in an artificially flooded southeastern floodplain forest soil[J]. Soil Science Society of America Journal, 2001, 65(4): 1293-1302. DOI:10.2136/sssaj2001.6541293x
(  0) 0) |
| [60] |
Jiang M K, Caldararu S, Zhang H Y, et al. Low phosphorus supply constrains plant responses to elevated CO2: A meta-analysis[J]. Global Change Biology, 2020, 26(10): 5856-5873. DOI:10.1111/gcb.15277
(  0) 0) |
| [61] |
Jin J, Wood J, Franks A, et al. Long-term CO2 enrichment alters the diversity and function of the microbial community in soils with high organic carbon[J]. Soil Biology & Biochemistry, 2020, 144: 107780.
(  0) 0) |
| [62] |
Achat D L, Bakker M R, Zeller B, et al. Long-term organic phosphorus mineralization in Spodosols under forests and its relation to carbon and nitrogen mineralization[J]. Soil Biology & Biochemistry, 2010, 42(9): 1479-1490.
(  0) 0) |
| [63] |
Singh J S, Raghubanshi A S, Singh R S, et al. Microbial biomass acts as a source of plant nutrients in dry tropical forest and savanna[J]. Nature, 1989, 338: 499-500. DOI:10.1038/338499a0
(  0) 0) |
| [64] |
Brookes P C, Powlson D S, Jenkinson D S. Phosphorus in the soil microbial biomass[J]. Soil Biology & Biochemistry, 1984, 16(2): 169-175.
(  0) 0) |
| [65] |
Trasar-Cepeda M C, Carballas T, Gil-Sotres F, et al. Liming and the phosphatase activity and mineralization of phosphorus in an andic soil[J]. Soil Biology & Biochemistry, 1991, 23(3): 209-215.
(  0) 0) |
| [66] |
Giardina C P, Huffman S, Binkley D, et al. Alders increase soil phosphorus availability in a Douglas-fir plantation[J]. Canadian Journal of Forest Research, 1995, 25(10): 1652-1657. DOI:10.1139/x95-179
(  0) 0) |
| [67] |
Xie H, Zhang Q F, Chen T T, et al. Interaction of soil arbuscular mycorrhizal fungi and plant roots acts on maintaining soil phosphorus availability under nitrogen addition (In Chinese)[J]. Chinese Journal of Plant Ecology, 2022, 46(7): 811-822. [谢欢, 张秋芳, 陈廷廷, 等. 氮添加促进丛枝菌根真菌和根系协作维持土壤磷有效性[J]. 植物生态学报, 2022, 46(7): 811-822.]
(  0) 0) |
| [68] |
Bourdon K, Fortin J, Dessureault-Rompré J, et al. Mitigating decomposition in agricultural peatlands: Influence of copper and polyphenol on C N P dynamics and enzyme activities in two contrasting soils[J]. Geoderma, 2023, 439: 116694. DOI:10.1016/j.geoderma.2023.116694
(  0) 0) |
| [69] |
Yang Y. Effects of tillage treatments on soil aggregate characteristic and phosphorus components[D]. Harbin: Northeast Agricultural University, 2018.[杨艳. 耕作方式对农田黑土团聚体特征及其磷赋存形态的影响[D]. 哈尔滨: 东北农业大学, 2018.]
(  0) 0) |
| [70] |
Touhami D, Condron L M, McDowell R W, et al. Effects of long-term phosphorus fertilizer inputs and seasonal conditions on organic soil phosphorus cycling under grazed pasture[J]. Soil Use and Management, 2023, 39(1): 385-401. DOI:10.1111/sum.12830
(  0) 0) |
| [71] |
Liu J S, Ma Q, Hui X L, et al. Long-term high-P fertilizer input decreased the total bacterial diversity but not phoD-harboring bacteria in wheat rhizosphere soil with available-P deficiency[J]. Soil Biology & Biochemistry, 2020, 149: 107918.
(  0) 0) |
| [72] |
Khadem A, Raiesi F. Response of soil alkaline phosphatase to biochar amendments: Changes in kinetic and thermodynamic characteristics[J]. Geoderma, 2019, 337: 44-54.
(  0) 0) |
| [73] |
Tian J H, Kuang X Z, Tang M T, et al. Biochar application under low phosphorus input promotes soil organic phosphorus mineralization by shifting bacterial phoD gene community composition[J]. Science of the Total Environment, 2021, 779: 146556.
(  0) 0) |
| [74] |
Liu Z Q, Lan Y, Yang T X, et al. Effect of biochar application pattern on soil fertility and enzyme activity under limited fertilization conditions (In Chinese)[J]. Journal of Agricultural Resources and Environment, 2020, 37(4): 544-551. [刘遵奇, 兰宇, 杨铁鑫, 等. 减肥条件下生物炭施用方式对土壤肥力及酶活性的影响[J]. 农业资源与环境学报, 2020, 37(4): 544-551.]
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


