2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
土壤有机碳库是陆地生态系统中最大的碳库,土壤有机碳(SOC)是影响农田土壤质量优劣,作物产量高低及气候变化的关键指标[1]。秸秆、猪粪等有机物料添加之后,会导致土壤原有SOC分解速率的改变,即“激发效应”,激发效应会受到外源物料质量(C/N)和土壤性质(养分有效性,pH以及土壤质地)等因素驱动[2]。对农田土壤激发效应驱动因素深入研究,有利于高效提升农田土壤碳固持效率,对于应对全球气候变化以及增加农业产收大有裨益。
外源物料C/N被认为是影响激发效应方向和强度,调控有机碳库盈亏平衡的关键因素[3]。Liang等[4]研究发现外源物料C/N越高,土壤正激发效应越小,土壤碳库净增加幅度越大。相反,Zheng等[5]发现即使提高外源物料的氮素有效性,土壤正激发效应并未得到抑制。也有研究表明在不同的生态系统中,激发效应与外源物料C/N无关,并且主要是由土壤水分、土壤质地等土壤性质所影响[6]。由此可见,针对于高低C/N物料添加下激发效应的方向和强度的争论依然存在。目前诸多学者主要从“共代谢”、“养分挖掘”以及“微生物化学计量分解”理论来解释高低C/N物料添加下微生物调控激发效应的机制[7]。“共代谢”理论认为高C/N物料中包含更多的易矿化碳源,可能会诱导出更高的生物量以及酶产物[8]。高C/N物料添加会导致土壤微生物受到严峻的氮素限制,因此微生物提高了氮素转换酶活性,挖掘土壤本底氮素,诱导出了较高的正激发效应,即“养分挖掘”理论[7]。在高C/N物料添加下,增大氮肥使用量,缓解土壤微生物受到的养分限制状态,正激发效应随之降低[9]。“微生物化学计量分解”理论认为当土壤微生物所需养分C/N与土壤环境中C/N相似时,微生物活性升高,从而促进了SOC的矿化[7]。然而,调控激发效应的机制会随着碳源的种类、土壤性质以及培养时间有所变化,因此阐明不同C/N物料添加下激发效应的调控机制将增强对土壤有机碳动态的理解。
四川省紫色土分布面积广,占全国的51%,是我国重要的粮油产地[10]。但区域农田紫色土由于多年的耕作,存在结构差、生物多样性下降、氮素损失量大以及全氮/有机碳储量低等障碍因子[11],即使长期有机肥还田也难以有较大幅度的提升。原因可能是土壤在施用有机肥后激发效应较大,不利于固碳。鉴于此,本研究采集经过长期有机肥还田后的紫色土开展室内培养试验,以探明高低C/N物料添加下的紫色土激发效应特征及其调控机制,明确降低土壤有机碳分解的适宜肥料C/N,为高效提升紫色土肥力并保障粮食安全提供理论参考。
1 材料与方法 1.1 研究区概况实验依托四川省绵阳市盐亭县林山乡中国科学院生态农业实验站(31°16′N,105°27′E)进行。研究区位于四川盆地中部,嘉陵江和涪江分水岭,海拔400~600 m,为典型的亚热带湿润季风气候,平均气温17.3 ℃,年平均降雨量为544.18 mm(2012—2022年),且集中在夏季,无霜期294 d。地形以中深丘为主,砂页岩风化形成多级台地,土壤类型为侏罗纪蓬莱镇组紫色砂岩发育而来的石灰性紫色土,土层较薄,保水保肥能力较差,区域内轮作模式以小麦-玉米为主。
1.2 供试土壤采集于2023年5月小麦收获期在站内紫色土坡耕地养分平衡长期试验场采集经过长期(20年)秸秆配施无机肥处理(秸秆替代20%施氮量)的农田耕层土壤(0~10 cm)样品。除去土壤表层未分解的秸秆,用不锈钢土钻在样地按照五点取样法采集土样,去除砾石及可见的动植物残体,利用干筛法将新鲜土壤样品过2 mm筛,混合均匀。将样品分为两份,一份置于4 ℃条件下恒温储藏,用于室内培养实验。一份风干、磨碎后,用于测定土壤理化性质。供试土壤容重1.37 g·cm–3,砂粒、粉粒和黏粒平均占比20.1%、46.5%和33.7%,田间持水量19.01%,土壤有机碳10.10 g·kg–1,全氮1.18 g·kg–1,全磷1.03 g·kg–1,有效磷16.14 mg·kg–1,速效钾136.36 mg·kg–1。
1.3 室内培养实验葡萄糖是根际分泌物以及凋落物分解物的主要成分,通常能占据到50%以上[12],因此室内培养实验以葡萄糖作为外源碳。利用葡萄糖配施硫酸铵,设置C/N为0、10、50、100,一共4个梯度(CK、CN10、CN50、CN100)的施肥处理,每个处理设置5个重复,分为Ⅰ、Ⅱ两组,每组各20个样品,第Ⅰ组用于测定不同时期CO2排放量以及培养结束进行破坏性取样,测定土壤可溶性有机碳(DOC),可溶性总氮(TDN),微生物生物量碳(MBC)以及土壤酶活性(碳氮转换酶:β-葡糖苷酶(βG)、α-纤维素酶(CBH)、β-乙酰葡糖胺糖苷酶(NAG)、亮氨酸氨基肽酶(LAP));第Ⅱ组用于培养至第14天时进行破坏性取样,测定土壤DOC、TDN、MBC以及土壤酶活性。每组各处理称量等效100 g干重的新鲜土壤置于500 mL广口瓶中。为活化土壤,并将广口瓶置于25 ℃避光条件下预培养一周,并控制含水量为田间持水量的30%[13],以保证微生物适应培养环境。预培养结束之后,用自然丰度的葡萄糖稀释高丰度13C标记的葡萄糖(丰度为99.99 atom%),根据目标C/N与硫酸铵固体配制成溶液(丰度为5.24 atom%),用移液管均匀地滴加在土壤中。氮素的添加量(N 62.5 mg·kg–1)根据当地农田施氮量(150 kg·hm–2·a–1)以及肥料的有效作用深度20 cm计算[14],并调整葡萄糖用量以实现对应的C/N梯度。随后补充蒸馏水使土壤含水量达到最大持水量的60%,以消除水分变化对实验的影响。将所有处理的广口瓶置于25 ℃的避光条件下培养43 d。期间,采用称重法定期补水,以避免水分变化对土壤生物活性的影响。
在培养实验进行的0.5、2、3、5、7、14、43 d定期测定土壤释放的CO2。第Ⅰ组每次采气时,用带有三通阀的橡胶塞将广口瓶密封,放回培养箱继续培养4 h,用50 mL注射器分别采集密封之前和密封之后的CO2。采集之前,来回抽出两三次,以保证瓶内气体混匀。同时第Ⅱ组也密4 h,进行相同的操作。采集气体之后,将橡皮塞拔出,用塑料薄膜密封,直至下一次气体采集。
1.4 样品测定方法气体采集之后,立即利用气相色谱(7890A,GC System,Agilent Technologies,USA)测定气体中CO2浓度,利用质谱仪(Delta Plus,Thermo Fisher Scientific,Germany)测定气体中13C丰度。土壤微生物生物量碳氮采用氯仿熏蒸浸提法[15]。未熏蒸土壤浸提液中有机碳浓度和总氮浓度即为DOC、TDN浓度[16]。采用2100TOC/TIC分析仪(Analytik Jena,Germany)测定浸提液中有机碳浓度,采用流动分析仪(Skalar San++,Holland. Fitted with a TN unit)测定浸提液中总氮浓度。
土壤酶活性采用荧光标记底物法测定[17]。将1 g新鲜土壤样品放入200 mL的灭菌盒中,加入pH为6的50 mmol·L–1醋酸钠缓冲液125 mL,用磁力搅拌器均质混合5 min。使用移液器将250 μL缓冲液、200 μL土壤样品、50 μL标准物质、50 μL底物分别加入到96孔酶标板中。在25 ℃黑暗条件下孵育4 h后,加入10 μL 1 mol·L–1 NaOH停止反应。使用多功能酶标仪(Scientific Fluoroskan Ascent FL,Thermo,USA)测量荧光度。各土壤酶底物见表 1。
|
|
表 1 土壤酶种类、功能及底物信息 Table 1 Information of types, functions, and substrates of soil enzyme |
二氧化碳的排放速率(Rtotal,mg CO2- C·g–1 SOC·d–1)由以下公式计算[18]:
| $ {R_{{\text{total}}}} = \frac{{\Delta C}}{{\Delta t}} \times \frac{{M \times V}}{{W \times {\text{SOC}} \times {\text{M}}{{\text{V}}_{{\text{corr}}}}}} $ | (1) |
式中,(ΔC/Δt)为单位时间内CO2浓度的变化量;M为C的摩尔质量(12 g·mol–1);V为广口瓶的体积(L);W为培养使用干土重(g);SOC为供试土壤的有机碳含量(g·kg–1);MVcorr为温度校正的分子体积(L·mol–1),并且由以下公式计算[19]:
| $ {\text{M}}{{\text{V}}_{{\text{corr}}}} = 22.4 \times \frac{{273.15 + T}}{{273.15}} $ | (2) |
式中,T为培养温度(25 ℃);22.4 L为1个标准大气压和273.15 K时的摩尔体积。在每个采样间期土壤累积CO2排放量(E total,mg CO2- C·g–1 SOC)由以下公式计算[20]:
| $ {{\text{E}}_{{\text{total}}}} = \sum \frac{{{V_{i - 1}} + {V_i}}}{2} \times \left( {{t_i} - {t_{i - 1}}} \right) \times 24 $ | (3) |
式中,Vi、Vi-1是第i次和(i-1)次培养阶段内各自土壤CO2排放量;(ti-ti-1)是两次培养的间隔时间(d)。
外源物料添加后来自于土壤有机碳源的二氧化碳比例(α)采用双源模型计算,公式如下[21]:
| $ \alpha = \left( {{\text{atom}}{{\text{%}}_{\text{t}}} - {\text{atom}}{{\text{%}}_{\text{g}}}} \right)/\left( {{\text{atom}}{{\text{%}}_{\text{c}}} - {\text{atom}}{{\text{%}}_{\text{g}}}} \right) $ | (4) |
式中,atom%t为物料添加后土壤呼吸CO2中13C丰度,atom%;atom%g为添加葡萄糖中13C的丰度,atom%;atom%c为对照组中土壤呼吸产生CO2中13C丰度,atom%。
外源碳诱导产生的累积激发效应(PE,mg CO2- C·g–1 SOC)为添加葡萄糖后的土壤呼吸源于土壤有机碳部分的变化量,绝对激发效应由以下公式计算:
| $ \text{AbsolutePE}=α×E_{t}–E_{c} $ | (5) |
式中,Et为培养期间添加葡萄糖处理中土壤呼吸产生的CO2,mg CO2- C·g–1 SOC;Ec为培养期间未添加葡萄糖处理中CO2排放量,mg CO2- C·g–1 SOC。
所有数据分析与绘图均采用R version 4.2.2完成[22]。采用单因素重复测量方差分析(One-Way repeated-measures ANOVA)来分析培养过程中不同物料C/N对CO2排放速率、激发效应速率、激发效应强度、DOC、TDN、MBC以及土壤酶活性的影响。采用单因素方差分析(One-Way ANOVA)比较不同C/N处理对CO2排放速率、激发效应速率、累积激发效应、DOC、TDN、MBC以及土壤酶活性的影响(P < 0.05),多重比较采用LSD检验。采用Pearson相关性分析来探究培养过程中累积激发效应与土壤性质、土壤酶活性及其化学计量比之间的相关性。分析结果的可视化均采用R中的“ggplot2”包实现。
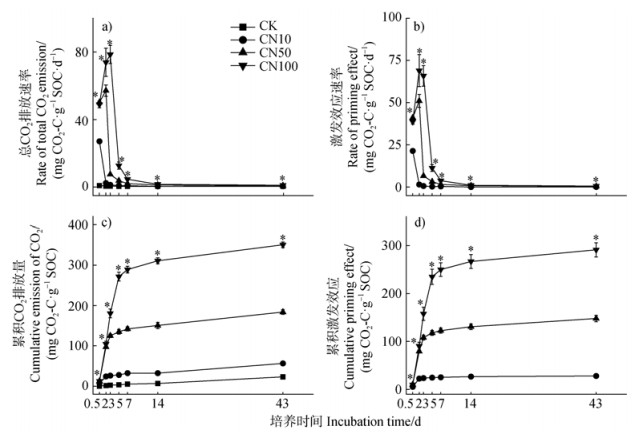
2 结果 2.1 不同C/N物料添加对有机碳矿化和激发效应的影响不同处理、时间及其交互作用均显著影响总CO2排放速率、累积CO2排放量、激发效应速率以及累积激发效应(表 2)。CN100和CN50处理下总CO2排放速率峰值(78.50、57.14 mg CO2-C·g–1 SOC·d–1)分别出现在第2天和第3天,CN100处理下总CO2排放速率峰值显著高于CN50处理下的37.3%;CN10处理下总CO2排放速率峰值(27.09 mg CO2-C·g–1 SOC·d–1)出现在0.5 d,显著低于CN50和CN100处理。14 d后,各处理下总CO2排放呈现稳定状态(图 1a)。培养期间,除0.5 d和2 d外,各处理下累积CO2排放量均呈现CN100 > CN50 > CN10 > CK,且均达显著水平。培养结束后,CN10处理下累积CO2排放量分别较CN50和CN100处理降低69.3%和83.9%(图 1c)。在培养期间各处理均表现为正激发效应(图 1b)。除了0.5 d和2 d外,CN100处理下激发效应速率均显著高于CN10和CN50处理。各处理下激发效应速率在14 d之后趋于稳定。培养2 d,各处理下累积激发效应表现为CN100 > CN50 > CN10,且差异均达到显著水平。培养结束后,CN10处理下累积激发效应较CN50和CN100处理显著降低了87.4%、93.7%(图 1d)。
|
|
表 2 处理、时间及其交互作用对有机碳矿化以及土壤性质的影响 Table 2 The effects of treatment, time, and their interactions on the C mineralization and soil properties |
|
注:*,表示不同处理之间存在显著差异性,P < 0.05。 Note: The colored asterisks are used to indicate statistically significant differences between treatments(P < 0.05). 图 1 不同C/N物料添加对总CO2排放速率(a)、激发效应速率(b)、累积CO2排放量(c)及累积激发效应(d)的影响 Fig. 1 Effects of different C/N substrate ratios on the rate of total CO2 emission (a), the rate of priming effect(b), cumulative emission of CO2 (c), and cumulative priming effect (d) |
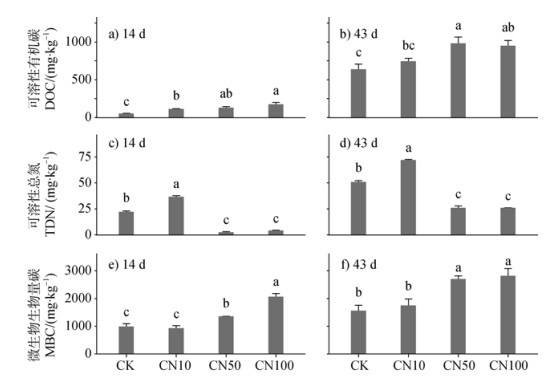
处理、时间均显著影响DOC、TDN、MBC含量(表 2)。14 d时,CN100处理下DOC相较于CN10和CK显著提升了80.5%和245.1%;43 d时,CN100和CN50处理下DOC显著高于CN10的25.2%和29.8%(图 2a和图 2b)。在两次破坏性取样时,各处理之间TDN差异规律表现一致,CN100和CN50处理在14 d时较CN10显著降低了88.9%和93.5%,在43 d时较CN10处理显著降低了63.9%和64.1%(图 2c和图 2d)。相反的是,在培养过程中CN100和CN50处理均相较于CN10显著提升了MBC(图 2e和图 2f)。
|
注:不同小写字母代表同一培养时期内不同处理之间存在显著性差异,P < 0.05。 Note: Different lowercase letters represent significant differences between treatments within the same incubation period, P < 0.05. 图 2 各采样时期(14 d和43 d)不同C/N物料添加对可溶性有机碳(a,b),可溶性总氮(c,d),微生物生物量碳(e,f)的影响 Fig. 2 Effects of different C/N substrate additions on dissolved organic carbon (DOC), total dissolved nitrogen (TDN), and microbial biomass carbon (MBC) at different sampling periods (14 and 43 days) |
不同处理显著影响4种碳氮转化酶活性(表 2)。14 d和43 d时,CN100处理较其余处理分别显著提高了CBH和βG酶活性(表 3)。在14 d和43 d时,与土壤氮循环相关的NAG和LAP酶活性在不同处理之间呈现相似的规律,均表现为CN100处理下较CN10分别显著提升了NAG和LAP酶活性。(βG+CBH)/(NAG+LAP)在两次破坏性取样时呈现相反的规律(表 4)。14 d时CN10处理相较CN100显著提高了(βG+CBH)/(NAG+LAP),然而43 d时CN10处理下(βG+CBH)/(NAG+LAP)却显著低于CN100处理。不同处理之间DOC/TDN在两次采样期间差异显著(表 4)。CN50和CN100处理下DOC/TDN培养结束时较培养14 d时显著降低,然而CN10和CK处理下培养结束时较培养14 d时显著增加。
|
|
表 3 不同取样时期土壤酶活性 Table 3 Soil enzyme activities at different sampling periods |
|
|
表 4 不同取样时期酶化学计量比及可溶性有机碳/可溶性总氮特征 Table 4 The enzymatic stoichiometry and dissolved carbon to dissolved nitrogen ratio at different sampling periods |
培养14 d时,累积激发效应与MBC、CBH、NAG和LAP酶活性呈现显著正相关关系,而与TDN、(βG+CBH)/(NAG+LAP)呈现显著负相关关系,与DOC和βG酶活性不存在显著关系(表 5)。培养43 d时,累积激发效应与MBC、βG、CBH、NAG、LAP酶活性和(βG+CBH)/(NAG+LAP)存在显著正相关关系,而与TDN呈现显著负相关关系,与DOC不存在显著关系。
|
|
表 5 累积激发效应与土壤性质的Pearson相关性分析 Table 5 Pearson correlation between cumulative priming effect and soil properties |
外源养分输入会改变土壤有机质的分解速率,即产生正激发效应或者负激发效应[23]。C、N、P等元素循环高度耦合,高低C/N物料添加会显著影响土壤中养分有效性以及微生物元素利用效率,导致土壤产生激发效应进而影响土壤碳固持效率[23]。本研究中CN100处理较CN50和CN10显著提升了累积CO2排放量和正激发效应(图 1c和图 1d)。表明在三种C/N物料添加下,土壤微生物均加速分解了土壤原有SOC获取营养元素,且在CN100处理下原有SOC的损失量最大。这也说明经长期秸秆配施化肥的紫色土SOC能够被高低C/N物料激发,这可能是其有机物碳库稳定性较低造成的。与之类似,Fang等[24]发现无论是否额外添加氮素,高粱残茬等有机物料的添加均会显著提高2.3%~8.3%的原有有机碳库损失。这可能是因为在不同C/N物料添加之下,参与碳氮周转的酶活性提升,促进了微生物对于土壤原有有机质的分解。在培养两周后尤其是CN100处理,显著提升了MBC、CBH、NAG、LAP酶活性(图 2e;表 3),说明葡萄糖易矿化碳源的添加活化了大量原本处于“睡眠”状态的微生物,加强了对土壤有机质的分解,最终引发了较高的正激发效应[25]。然而,Zheng等[5]研究发现添加葡萄糖和氮素之后,正激发效应强度却随着物料C/N的下降而增加,意味着物料的氮素有效性增加反而诱导出了更高的正激发效应。这可能是由于氮素的添加下土壤中水解细菌数量增加,微生物内部代谢加快,水解酶活性升高,加快了对土壤中难分解有机质的分解[26]。荟萃分析表明供试土壤中原有氮素有效性对激发效应强度起到决定作用[27]。本研究供试土壤为紫色土,由于其结构性较差,保氮能力较弱,土壤微生物本身受到的氮素限制较大,微生物对土壤本底氮挖掘占据主导地位,过量易矿化碳源的输入会引发较高的激发效应[11,27]。此外,高低C/N处理下CO2总排放速率、正激发效应速率均在前两周呈现快速下降,随后保持稳定的趋势,表明在前两周微生物同时快速利用了原有有机质和葡萄糖碳源。当添加易矿化碳源时,一般在培养的初始阶段就能够捕捉到激发效应的峰值,这可能是由于土壤中的细菌(R型策略者)能够迅速反应,将葡萄糖碳作为能量来源以合成更多胞外酶,进而产生了正激发效应[28]。培养结束时,CN10处理较其余两种处理显著降低了80%以上的紫色土正激发效应,土壤微生物对于原有有机质的分解程度降低,这表明C/N为10的肥料添加具有较好的固碳潜力。类似的是,Liang等[4]发现外源养分输入下,有机碳库的盈余与外源物料的C/N成显著负相关,适当提高外源物料的氮素有效性有助于土壤高效固碳。
3.2 不同C/N物料添加下影响紫色土激发效应的主要因子土壤微生物是激发效应产生过程中的主要驱动力,经微生物分解和同化之后形成的产物对土壤中有机碳的贡献能达到60%以上[23]。土壤中元素相对有效性的变化会影响微生物生物量、胞外酶活性以及微生物群落组成,进而调控激发效应[29]。在培养两周后,各处理均引发了正激发效应,CN100处理下正激发效应较CN50、CN10处理显著提高了近2倍和10倍。累积激发效应强度与MBC和碳氮转化酶活性均成显著正相关关系,这意味着土壤微生物在培养初期主要采用了“共代谢机制”来调控正激发效应(表 5)。此时,土壤微生物对葡萄糖的输入快速响应,将葡萄糖作为生长代谢的碳源,在较高C/N处理(CN100,CN50)下微生物提高了碳氮转化酶活性以获取足够的营养元素,最终引发较大的正激发效应[25]。
土壤酶化学计量比可反映微生物正常生长时的养分需求,并在一定程度上能够反映土壤养分有效性[30]。在培养两周时,累积激发效应与TDN,(βG+CBH)/(NAG+LAP)均呈现显著负相关关系(表 5),CN100处理较CN10处理显著降低了(βG+CBH)/(NAG+LAP)(表 4),这表明微生物正常生长代谢对于N素的需求相较于C的需求更为迫切,意味着微生物生长代谢受到了较大的“氮限制”,即此时微生物也通过了“养分挖掘”促进了正激发效应的产生[7]。此外,微生物可以通过分泌胞外聚合物来应对土壤中失衡的养分化学计量比[31]。高碳氮比处理下土壤中的氮有效性相对较低,微生物可能会分泌更多能够提升土壤酶活性的胞外聚合物-蛋白质,从土壤本底有机质中挖掘更多的N[32],进而促进了正激发效应。此外,微生物C/N通常为8~25,肥料C/N为10时更接近微生物C/N,微生物能够优先利用部分外来碳源,从而减少了对原有有机质的分解,进而降低了正激发效应,这也符合类似研究结果[33]。培养结束时,累积正激发效应与(βG+CBH)/(NAG+LAP)呈显著负相关关系,而培养两周后,累积正激发效应与(βG+CBH)/(NAG+LAP)呈现出显著正相关关系。CN100较CN10处理显著提升了(βG+CBH)/(NAG+LAP),这表明此时土壤微生物提高了碳转化酶活性。这可能是经过一个月的培养后,土壤中DOC/TDN较初始阶段显著下降(表 4),这得益于微生物对于本底氮的挖掘作用,氮相对有效性增加,因此在后期微生物生长代谢受到的“碳限制”较大[34]。在两次破坏性取样之间CN50并没有较CN100处理显著降低正激发效应,这可能是因为土壤微生物在前期主要是通过加速矿化土壤中易利用有机碳来提高正激发效应[35],后期碳相对有效性降低,CN100和CN50处理下仍然保持了较高的微生物生物量和碳氮转化酶活性,这暗示着土壤微生物已经适应了土壤中养分有效性,并且开始分解土壤中原有的难分解有机质,最终又促进了正激发效应,即后期主要通过“微生物化学计量分解”理论来调控激发效应[36]。本研究中土壤微生物生长代谢在培养初期受到了较大的“氮限制”,因此微生物提高了氮素转化酶活性,加大了对土壤原有SOC的分解。而在培养实验后期,土壤微生物通过调整碳氮转化酶的分泌策略,来应对微生物对土壤本底养分挖掘导致的土壤养分相对有效性的变化。同时研究也表明了微生物在参与土壤激发效应产生过程中,并不是以单一不变的策略来发挥作用,而是几种机制协同调控激发效应。
4 结论长期秸秆配施无机肥后的紫色土在高低C/N物料添加下均产生了正激发效应,表明长期有机无机肥配施后的紫色土有机碳库稳定性较低,能被高低C/N肥料添加之后诱导分解,但是较低C/N肥料能够显著降低紫色土的正激发效应,具有良好的固碳潜力。CN100和CN50处理较CN10显著提升DOC、MBC以及碳氮转化酶活性,显著降低了TDN。(βG+CBH)/(NAG+LAP)和土壤中碳氮养分相对有效性(DOC/TDN)在培养过程中的变化,导致了土壤微生物酶分泌策略的改变,进而调控激发效应。对高低肥料C/N固碳潜力以及微生物调控激发效应机制的研究,有助于优化区域施肥方案,助力农业绿色发展以及加深对农田生态系统土壤碳固持驱动机制的理解。
| [1] |
Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528(7580): 60-68. DOI:10.1038/nature16069
(  0) 0) |
| [2] |
Blagodatskaya Е, Kuzyakov Y. Mechanisms of real and apparent priming effects and their dependence on soil microbial biomass and community structure: Critical review[J]. Biology and Fertility of Soils, 2008, 45(2): 115-131. DOI:10.1007/s00374-008-0334-y
(  0) 0) |
| [3] |
Shahbaz M, Kuzyakov Y, Sanaullah M, et al. Microbial decomposition of soil organic matter is mediated by quality and quantity of crop residues: Mechanisms and thresholds[J]. Biology and Fertility of Soils, 2017, 53(3): 287-301. DOI:10.1007/s00374-016-1174-9
(  0) 0) |
| [4] |
Liang J Y, Zhou Z H, Huo C F, et al. More replenishment than priming loss of soil organic carbon with additional carbon input[J]. Nature Communications, 2018, 9(1): 3175. DOI:10.1038/s41467-018-05667-7
(  0) 0) |
| [5] |
Zheng Y Y, Jin J, Wang X J, et al. Increasing nitrogen availability does not decrease the priming effect on soil organic matter under pulse glucose and single nitrogen addition in woodland topsoil[J]. Soil Biology & Biochemistry, 2022, 172: 108767.
(  0) 0) |
| [6] |
Luo Z K, Wang E L, Sun O J. A meta-analysis of the temporal dynamics of priming soil carbon decomposition by fresh carbon inputs across ecosystems[J]. Soil Biology & Biochemistry, 2016, 101: 96-103.
(  0) 0) |
| [7] |
Chen R R, Senbayram M, Blagodatsky S, et al. Soil C and N availability determine the priming effect: Microbial N mining and stoichiometric decomposition theories[J]. Global Change Biology, 2014, 20(7): 2356-2367. DOI:10.1111/gcb.12475
(  0) 0) |
| [8] |
Nottingham A T, Turner B L, Chamberlain P M, et al. Priming and microbial nutrient limitation in lowland tropical forest soils of contrasting fertility[J]. Biogeochemistry, 2012, 111(1): 219-237.
(  0) 0) |
| [9] |
Zhang Q F, Cheng L, Feng J G, et al. Nitrogen addition stimulates priming effect in a subtropical forest soil[J]. Soil Biology & Biochemistry, 2021, 160: 108339.
(  0) 0) |
| [10] |
He Y R. Purple soils in China (In Chinese). Beijing: Science Press, 2003. [何毓蓉. 中国紫色土-下篇[M]. 北京: 科学出版社, 2003.]
(  0) 0) |
| [11] |
Zhu B, Yao Z, Hu D, et al. Effects of substitution of mineral nitrogen with organic amendments on nitrogen loss from sloping cropland of purple soil[J]. Frontiers of Agricultural Science and Engineering, 2022, 9(3): 396-406.
(  0) 0) |
| [12] |
Gunina A, Kuzyakov Y. Sugars in soil and sweets for microorganisms: Review of origin, content, composition and fate[J]. Soil Biology & Biochemistry, 2015, 90: 87-100.
(  0) 0) |
| [13] |
Chen H, Li W J, Zheng W N, et al. Linking nitrogen- and straw-sensitive indicator species and their co-occurrences to priming effect in agricultural soil exposed to long-term nitrogen fertilization[J]. Soil Biology & Biochemistry, 2023, 176: 108881.
(  0) 0) |
| [14] |
Daly E J, Hernandez-Ramirez G. Sources and priming of soil N2O and CO2 production: Nitrogen and simulated exudate additions[J]. Soil Biology & Biochemistry, 2020, 149: 107942.
(  0) 0) |
| [15] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology & Biochemistry, 1987, 19(6): 703-707.
(  0) 0) |
| [16] |
Brookes P C, Landman A, Pruden G, et al. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil[J]. Soil Biology & Biochemistry, 1985, 17(6): 837-842.
(  0) 0) |
| [17] |
Bell C W, Fricks B E, Rocca J D, et al. High-throughput fluorometric measurement of potential soil extracellular enzyme activities[J]. Journal of Visualized Experiments, 2013(81): e50961.
(  0) 0) |
| [18] |
van Zwieten L, Kimber S, Morris S, et al. Influence of biochars on flux of N2O and CO2 from Ferrosol[J]. Soil Research, 2010, 48(11): 1043-1046.
(  0) 0) |
| [19] |
[19] Findlay T J V. SI chemical data[M]. Wiley, 1974.
(  0) 0) |
| [20] |
Li X J, Xie J S, Zhang Q F, et al. Substrate availability and soil microbes drive temperature sensitivity of soil organic carbon mineralization to warming along an elevation gradient in subtropical Asia[J]. Geoderma, 2020, 364: 114198. DOI:10.1016/j.geoderma.2020.114198
(  0) 0) |
| [21] |
Pausch J, Zhu B, Kuzyakov Y, et al. Plant inter-species effects on rhizosphere priming of soil organic matter decomposition[J]. Soil Biology & Biochemistry, 2013, 57: 91-99.
(  0) 0) |
| [22] |
Tierney L. The R statistical computing environment[C]//Statistical challenges in modern astronomy V. New York: Springer, 2012.
(  0) 0) |
| [23] |
Kuzyakov Y. Priming effects: Interactions between living and dead organic matter[J]. Soil Biology & Biochemistry, 2010, 42(9): 1363-1371.
(  0) 0) |
| [24] |
Fang Y Y, Singh B P, Farrell M, et al. Balanced nutrient stoichiometry of organic amendments enhances carbon priming in a poorly structured sodic subsoil[J]. Soil Biology & Biochemistry, 2020, 145: 107800.
(  0) 0) |
| [25] |
Perveen N, Barot S, Maire V, et al. Universality of priming effect: An analysis using thirty five soils with contrasted properties sampled from five continents[J]. Soil Biology & Biochemistry, 2019, 134: 162-171.
(  0) 0) |
| [26] |
Blagodatskaya E, Khomyakov N, Myachina O, et al. Microbial interactions affect sources of priming induced by cellulose[J]. Soil Biology & Biochemistry, 2014, 74: 39-49.
(  0) 0) |
| [27] |
Feng J G, Zhu B. Global patterns and associated drivers of priming effect in response to nutrient addition[J]. Soil Biology & Biochemistry, 2021, 153: 108118.
(  0) 0) |
| [28] |
Yin H J, Phillips R P, Liang R B, et al. Resource stoichiometry mediates soil C loss and nutrient transformations in forest soils[J]. Applied Soil Ecology, 2016, 108: 248-257.
(  0) 0) |
| [29] |
Yu G C, Zhao H B, Chen J, et al. Soil microbial community dynamics mediate the priming effects caused by in situ decomposition of fresh plant residues[J]. Science of the Total Environment, 2020, 737: 139708.
(  0) 0) |
| [30] |
Sinsabaugh R L, Hill B H, Follstad Shah J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment[J]. Nature, 2009, 462(7274): 795-798.
(  0) 0) |
| [31] |
Redmile-Gordon M A, Evershed R P, Hirsch P R, et al. Soil organic matter and the extracellular microbial matrix show contrasting responses to C and N availability[J]. Soil Biology & Biochemistry, 2015, 88: 257-267.
(  0) 0) |
| [32] |
Zhang M, Cai P, Wu Y C, et al. Bacterial extracellular polymeric substances: From the perspective of soil ecological functions (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(2): 308-323. DOI:10.11766/trxb202107310271 [张铭, 蔡鹏, 吴一超, 等. 细菌胞外聚合物: 基于土壤生态功能的视角[J]. 土壤学报, 2022, 59(2): 308-323.]
(  0) 0) |
| [33] |
Hicks L C, Leizeaga A, Rousk K, et al. Simulated rhizosphere deposits induce microbial N-mining that may accelerate shrubification in the subarctic[J]. Ecology, 2020, 101(9): e03094.
(  0) 0) |
| [34] |
Sarker J R, Singh B P, Cowie A L, et al. Carbon and nutrient mineralisation dynamics in aggregate-size classes from different tillage systems after input of canola and wheat residues[J]. Soil Biology & Biochemistry, 2018, 116: 22-38.
(  0) 0) |
| [35] |
Knorr M, Frey S D, Curtis P S. Nitrogen additions and litter decomposition: A meta-analysis[J]. Ecology, 2005, 86(12): 3252-3257.
(  0) 0) |
| [36] |
Creamer C A, de Menezes A B, Krull E S, et al. Microbial community structure mediates response of soil C decomposition to litter addition and warming[J]. Soil Biology & Biochemistry, 2015, 80: 175-188.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


