2. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所), 南京 211135;
3. 中国科学院大学, 北京 100049;
4. 江苏省农业科学院经济作物研究所, 南京 210014
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Economic Crops Research Institute, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
土壤是陆地生态系统最大的碳汇载体。农田生态系统作为陆地生态系统重要组成部分,其碳储量达到170 Pg,占全球陆地碳储量的10%以上[1]。同时,农作物呼吸和土壤呼吸向大气中释放CO2,是温室气体重要来源[2]。因此,在农田生态系统中如何平衡CO2释放和土壤有机碳(SOC)固存是实现“碳达峰、碳中和”目标的重要挑战[3]。
花生(Arachis hypogaea L.)是豆科作物并且还是我国重要的油料作物与经济作物,但我国花生仍供不应求,2021年进口比例占全球三成以上,出口量仅占9.9%[4]。间作是在同一地块、同一时期种植两种及以上作物的种植方式[5]。与单作相比,间作通过增加农田作物多样性提升多种生态系统服务,保证粮食产量稳定性[6]。合理的间作方式在减少化学投入的同时可提高土壤固碳潜力[7]。这是因为不同作物种间的根系相互作用通过产生特异性根系分泌物输入影响土壤微生物和胞外酶活性,反之根系分泌物又可以作为C源为微生物提供能量,从而调控C元素等养分转化[8]。另一方面,间作具有更多样的植物凋落物和更大的根生物量,会导致土壤微生物的代谢活性向植物多样性的代谢活性转变,以调控土壤C排放[9]。但是在花生/玉米间作背景下,花生的根际土壤微生物活性及对SOC的贡献还未得到很好的研究。
在农田生态系统中,植物凋落物、根系分泌物和微生物残体是SOC库的主要来源[10-11]。相较于单一作物集约化种植,间作具有更多样的植物凋落物和更大的根生物量,同时产生更丰富多样的根系分泌物,并塑造与之相适应的根际微生物群落,这些多样的有机碳组分通过微生物的分解和转化共同影响了SOC库的稳定性[12-13]。Chen等[14]通过土壤放射性同位素14C标记发现植物源C输入(包括结构性凋落物和溶解性有机碳)是易分解有机碳的主要贡献者。但除植物源C外,由其塑造的根际微生物群落对其下游微生物残体碳(难分解有机碳)的贡献也不可忽视。然而目前,在间作种植模式下,对于微生物群落介导的微生物源C生成及其对SOC固持的贡献与调控机理尚缺乏认知。土壤微生物群落是生物圈中生物多样性最丰富的群落之一[15],其利用植物源C生长繁殖并通过分解代谢活动使SOC以CO2的形式释放到大气中,死亡后又以微生物残体碳的形式贡献超过50%的SOC[16]。这是因为矿物表面的可交换性Ca2+与微生物残体中的化学官能团(如-OH和-COOH)之间的阳离子桥连接所介导形成更稳定的矿物结合态有机碳[17]。因此,提高土壤微生物残体含量是稳定增加SOC库的一种关键方式。氨基糖是微生物细胞壁的重要组成部分,可作为土壤中微生物残体的生物标志物,通常占SOC总量的2%~5%[18]。土壤氨基糖中胞壁酸(MurA)只来源于细菌肽聚糖,而氨基葡萄糖(GlcN)主要来自于真菌几丁质[19]。利用GlcN/MurA以指示土壤中真菌和细菌残体相对比率可衡量土壤中对SOC的贡献。
为了探究间作背景下,邻近不同作物的花生根际土壤微生物群落如何影响SOC积累,假设邻近玉米可以驱动花生根际的土壤微生物活性,改变微生物对有机碳组分代谢能力并调整微生物残体在土壤中的积累。为验证这一假设,依托两行玉米两行花生的间作体系比较与不同作物相邻对花生根际土壤CO2排放和部分常规化学性质的影响,以及对花生根际土壤微生物C源代谢活性和残体碳积累的影响,进一步解析间作对花生根际微生物介导的C动态的影响机制。
1 材料与方法 1.1 研究区概况试验地点位于江苏省农业科学院六合基地(32°36'N,118°83'E)。该地属于北亚热带季风气候,年平均气温15.6 ℃,年平均降水量700~1 900 mm。全年日照时长1 782 h,无霜期254 d,供试土壤为黄棕壤土,适宜作物生长。
1.2 田间试验设计与样品采集花生/玉米间作(PM)试验小区建立于2012年[20],花生和玉米的品种分别为中花16和苏玉24。间作方式为两行玉米两行花生南北向条带种植。花生和玉米在同一行内的株距为0.4 m,行间距为0.5 m,相邻样地间设有宽0.4 m、高0.3 m的田埂,共4组重复样地(图 1)。样地播种前进行施肥和翻耕处理,试验样地在作物生长期进行了良好的田间管理。原始样地土壤pH 7.86,土壤有机碳4.1 g·kg–1,全氮0.9 g·kg–1,全磷0.6 g·kg–1,全钾16.1 g·kg–1,铵态氮6.2 mg·kg–1,硝态氮5.1 mg·kg–1,有效磷19.4 mg·kg–1,速效钾176.3 mg·kg–1。
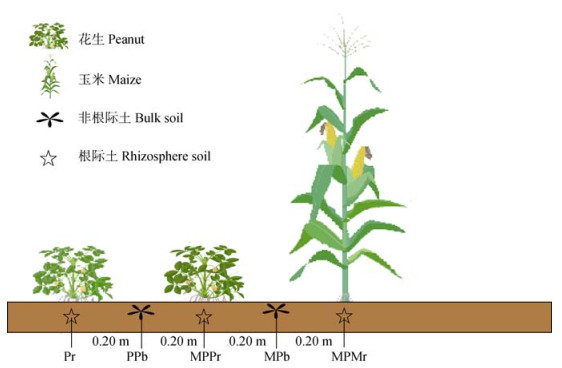
|
注:Pr:远离玉米的花生根际土;PPb:两花生间非根际土;MPPr:邻近玉米的花生根际土;MPb:花生玉米间非根际土;MPMr:邻近花生的玉米根际土。下同。 Note: Pr: Peanut rhizosphere soil away from maize; PPb: Bulk soil between two peanuts; MPPr: peanut rhizosphere soil adjacent to maize; MPb: Bulk soil between peanut and maize; MPMr: Maize rhizosphere soil adjacent to peanuts. The same below. 图 1 花生/玉米间作种植设计及采样点选择 Fig. 1 Peanut-maize intercropping planting design and sampling points selection |
在花生生长盛花期(2022年7月21日)分别在远离玉米的花生根际(Pr)、非根际(PPb),邻近玉米的花生根际(MPPr)、非根际(MPb)以及邻近花生的玉米根际(MPMr)采集土壤样品。采用抖落法收集根际土壤[21],装入保鲜袋,用冰袋低温转移土壤样品至实验室。非根际土采集于作物间耕层土壤(5~20 cm),去除土壤中根系及杂质,暂存方法同根际土壤。每个采集位点收集4个平行重复样品,共5个采集位点,合计20个土壤样品。新鲜土壤样品过2 mm筛,60 g样品保存在4 ℃冰箱,用于土壤呼吸测定、酶活性检测、BIOLOG生态测试板和氨基糖测定,其余土壤风干,用于土壤化学性质检测。
1.3 土壤化学性质测定土壤化学性质测定参考《土壤农业化学分析方法》[22]。用电位计法测定土壤pH,水土比为2.5︰1(m/m);用重铬酸钾氧化法测定SOC;用碳酸氢钠提取土壤AP并且用钼锑抗比色法在700 nm波长下测定含量;用乙酸铵交换法测定土壤阳离子交换量(CEC);用紫外分光光度法在220 nm波长下测定土壤NO3–-N;采用靛酚蓝比色法测定NH4+-N。用静态系统中CO2释放量的测定-滴定法测定土壤呼吸速率[23],具体方法如下:收集25 g土壤样品在25 ℃田间含水量下孵育7 d期间产生的CO2,在10 mL的1 mol·L–1 NaOH溶液中,加入2 mLBaCl2溶液,将CO2以BaCO3的形式沉淀,用0.5 mol·L–1 HCl溶液进行滴定。
1.4 SOC分解酶活性测定称取新鲜土样1 g置于125 mL 50 mmol·L–1的醋酸钠缓冲液(pH = 6.5)中,涡旋震荡5 min后分别吸取200 µL土壤匀浆样品和50 µL底物(β-葡萄糖苷酶为4-甲基伞形酮-β-D-葡萄糖苷,多酚氧化酶为L-3,4-二羟苯丙氨酸)至96孔微孔板,置于25 ℃恒温培养箱黑暗条件下分别培养4 h和20 h用于测定β-葡萄糖苷酶和多酚氧化酶,对样品离心后在450 nm波长下用多功能酶标仪(SynergyH4,BioTek)测定吸光度(OD)值。
1.5 BIOLOG生态测试板测定根据Garland和Mills[24]的改进方法,利用底物产生氧化还原电势的变化导致四氮唑蓝染料颜色发生变化的原理,使用BIOLOG生态测试板(Biolog Inc.,USA)分析土壤微生物群落C代谢特征指纹图谱。微平板C源包括碳水化合物、羧酸、氨基酸、聚合物、酚酸和胺类6大类。称取等量于10 g干土重的新鲜土样加入500 mL 0.85%(m/V)的灭菌NaCl溶液中,振荡30 min后取出以4 000 r·min–1的转速离心1 min,静置30 min。吸取1 mL上清液,用灭菌的0.85% NaCl稀释10倍。吸取150 µL稀释液添加到BIOLOG生态测试板的微孔中。将接种后的BIOLOG生态测试板静置于25 ℃恒温培养箱,每隔24 h将微孔板置于590 nm波长下测定吸光度,持续测定7 d。微生物群落的整体活性指标采用培养过程中微平板每孔颜色平均变化率(Average well color development,AWCD)来描述。
| $ {\text{AWCD}} = \frac{{\sum \left( {{A_i} - {A_1}} \right)}}{{31}} $ |
式中,Ai为第i孔的相对吸光度,A1为对照孔的相对吸光度。
1.6 土壤氨基糖测定用酸水解法测定土壤中氨基葡萄糖(GlcN)、氨基半乳糖(GalN)、甘露糖胺(ManN)和胞壁酸(MurA)的含量[25]。称取0.5 g冷冻干燥的土壤样品过60目筛后加入5 mL的6 mol·L–1 HCl溶液充分混合在105 ℃条件下水解8 h。土壤水解液经过滤后调节pH至6.6~6.8。将样品在50 mL离心管中离心(10 000×g,10 min)去除沉淀。上清液经冷冻干燥后,残留的固体物质用无水甲醇溶解、离心。之后用N2吹扫去除无水甲醇,利用衍生试剂和乙酸酐对纯化后的氨基糖进行衍生,利用二氯甲烷、HCl溶液和蒸馏水进行萃取再次用N2除去二氯甲烷后,将干燥的氮吹残留物溶解在乙酸乙酯-正己烷1︰1(V/V )混合溶剂中进行分析。在配有HP-5气相色谱柱(25 m × 0.32 mm × 0.25 mm)的气相色谱仪(Agilent 7 890,USA)分离氨基糖衍生物。以氢火焰离子化检测器(Flame Ionization Detector,FID)检测,以峰面积内标法定量。真菌和细菌来源的氨基糖C的含量用以下公式计算[26]:
| $ \begin{array}{l}真菌残体碳\text{(g}\cdot {\text{kg}}^{-1}\text{)}\\ =\left(\frac{\text{GlcN}}{179.17}–2\times \frac{\text{MurA}}{251.23}\right)\times 179.17\times 9\end{array} $ |
| $ 细菌残体碳\text{(g}\cdot {\text{kg}}^{-1}\text{)}=\text{MurN}\times 45 $ |
| $ \begin{array}{l}总氨基糖\text{(TAS)}\mathsf{(μg}\cdot {\text{g}}^{-1}\text{)}\\ =\text{GlcN}+\text{GalN}+\text{ManN}+\text{MurA}\end{array} $ |
| $ 真菌残体/细菌残体=\text{GlcN}/\text{Mura} $ |
采用邓肯检验(Duncan's test)的单因素方差分析(One-way ANOVA)检测不同样品间花生土壤化学性质、土壤呼吸速率、土壤C循环相关酶、氨基糖含量以及微生物残体碳的差异显著性。采用配对t检验分析两组花生处理的根际土壤C源利用偏好。使用皮尔森相关性分析(Pearson's correlation analyses)用来检测细菌残体碳和真菌残体碳与SOC之间的相关关系。在GraphPad Prism 8.0软件中完成作图。
2 结果 2.1 不同邻近作物对花生土壤化学性质的影响不同邻近作物改变花生根际土壤理化性质。花生玉米间非根际土(MPb)具有最高的SOC含量,达到4.86 g·kg–1,其次为玉米根际(MPMr)和其他点位,相较于邻近同种花生(Pr),邻近玉米的花生根际(MPPr)SOC含量显著提高12.9%(P < 0.05),与邻近花生的玉米根际(MPMr)SOC含量相当。SOC在非根际土壤的积累有所相似:花生/玉米间的非根际土壤(MPb)SOC含量较花生/花生间的非根际(PPb)高8.4%(P < 0.05)。除了有机碳水平差异,花生根际NO3–-N含量也随邻近植物的更换而变化。邻近玉米的花生根际(MPPr)具有最高的NO3–-N含量达26.18 mg·kg–1,是Pr和MPMr的5.81倍(P < 0.05)和2.26倍(P < 0.05),但在非根际区域(PPb和MPb)有效氮素均无显著差异。相反,AP则在非根际区域差异明显,玉米与花生之间土壤AP含量相比花生与花生之间提高了24.11%(P < 0.05)。不同采集的样品中土壤NH4+-N、PhpH、CEC和含水率均无显著差异(表 1)。
|
|
表 1 不同相邻作物对作物根际及非根际土壤化学性质差异 Table 1 Differences in chemical properties of rhizosphere and bulk soils between different adjacent crops |
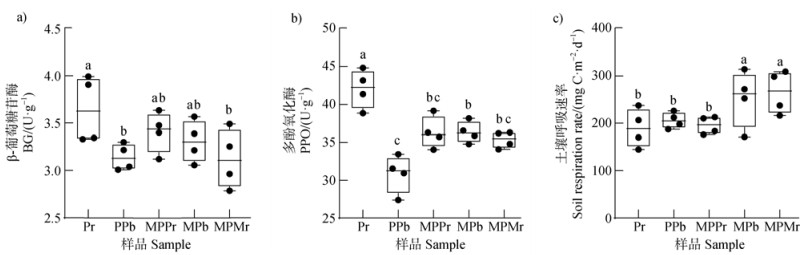
基于邻近玉米增加了花生根际C积累的特性,进一步探究这种沉积对激发花生根际C转化的影响。针对易分解和难分解有机碳的转化,分别测定土壤β-葡萄糖苷酶(BG)和多酚氧化酶(PPO)活性。邻近作物为同物种的花生根际土壤(Pr)PPO活性最高并显著高于其他处理组,较邻近作物为玉米的花生根际(MPPr)增加了19.0%(P < 0.05)。在非根际区域,花生和玉米间土壤PPO活性是花生和花生间土壤的1.19倍,但BG活性没有显著的变化(图 2a、图 2b)。
|
注:a),β-葡萄糖苷酶;b),多酚氧化酶;c),土壤呼吸速率。图上方不同小写字母表示不同处理间差异显著(P < 0.05) Note: a), β-glucosidase; b), polyphenol oxidase; c), soil respiration rate. Different lowercase letters above the figure indicate significant differences among different treatments(P < 0.05). 图 2 不同处理间土壤C分解相关酶活的差异 Fig. 2 Differences in soil C cycle-related enzymes activities among different treatments |
不同于SOC分解酶活性变化规律,花生根际土壤呼吸速率对同种和异源邻近作物的应激未表现出明显的差异,说明花生根际土壤CO2的输出不受邻近植物影响。花生根际土壤呼吸速率最高,其次是花生玉米间非根际土(MPb)和其他点位,在花生玉米共存根际区域,玉米根际土壤(MPPr)相较于花生根际土壤(Pr)提高了35.61%(P < 0.05);在非根际区域,花生和玉米间(MPb)土壤呼吸速率高达271.70 mg C·m–2·d–1,相比两花生间(PPb)土壤呼吸速率提高了43.4%(图 2c,P < 0.05)。
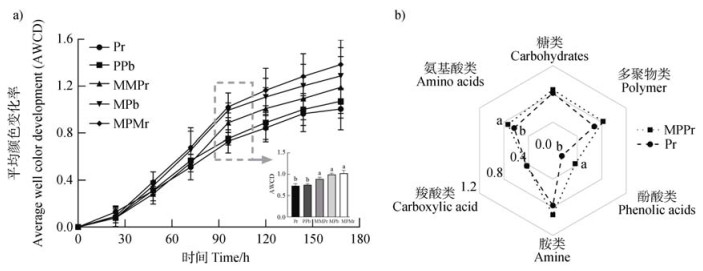
2.3 不同邻近作物对土壤微生物C代谢活性的影响为进一步探究微生物对不同C源利用能力,利用BIOLOG生态测试板分析不同样品间土壤微生物C代谢活性的差异。不同采集的样品对31种C源利用的总平均颜色变化率在前96 h随培养时间的延长而升高,因此采用96 h的吸光值进行分析(图 3a)。总体而言,玉米根际土壤微生物对C源利用能力最强,相较于邻近花生,邻近玉米提高了花生根际和非根际土壤AWCD值(P < 0.05)。在花生与玉米种植区,土壤AWCD表现为从玉米根际到花生根际逐级递减的特性(玉米根际≧非根际 > 花生根际),展现出不同植物根系调控土壤微生物C源利用能力的差异(图 3b)。
|
注:a),平均颜色变化率;b),土壤微生物对六种C源利用情况。 Note: a), average well color development; b), the utilization of six carbon sources by soil microbial. 图 3 不同相邻作物对作物根际及非根际土壤微生物代谢活性的影响 Fig. 3 Effects of different neighboring crops on the metabolic activity of rhizosphere and bulk soil microbial |
显然,花生根际微生物表现出对糖类、氨基酸类、多聚物类及胺类C源利用偏好,但对酚酸类、羧酸类C源代谢效率偏弱。当与玉米相邻时,花生根际微生物对酚酸类和氨基酸类特异性C源代谢活性显著增加,较Pr处理分别提高了149.4%(P < 0.05)和16.1%(图 3c,P < 0.05)。
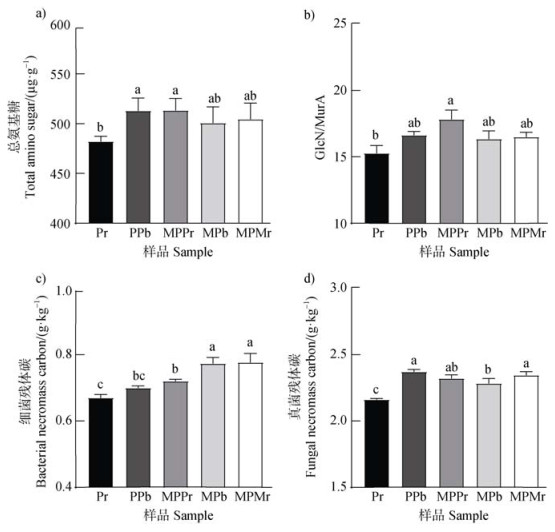
2.4 邻近植物玉米对花生根际微生物残体碳的影响基于土壤氨基糖的检测,分析不同土壤样品中微生物残体碳的分布差异。与邻近玉米改变了花生根际土壤(MPPr)的TAS含量,相比于同种作物(Pr)显著增加了6.45%(图 4a,P < 0.05)。同时,MPPr的GlcN/MurA的比例最高达到17.83,是Pr的1.17倍(图 4b,P < 0.05),增加了真菌残体的相对贡献。MPPr邻近作物的差异也引起了土壤真菌和细菌残体变化。在花生与玉米共存区域,细菌残体碳含量沿玉米根际(MPMr),非根际(MPb)到花生根际(MPPr)逐步递减至0.72 g·kg–1,但仍较远离玉米的花生根际高7.46%(图 4c,P < 0.05)。不同于细菌残体碳,土壤真菌残体碳则在花生区域变化差异最大,PPb含量是Pr的1.11倍。而在花生与玉米共存区域,各位点真菌残体碳高于远离玉米的花生根际7.42%以上(图 4d,P < 0.05)。
|
注:a),总氨基糖(TAS);b),真菌残体/细菌残体(GlcN/MurA);c),细菌残体碳;d),真菌残体碳。 Note: a), total amino sugar; b), fungal necromass /bacterial necromass; c), bacterial necromass carbon; d, fungal necromass carbon. 图 4 不同处理间微生物残体碳及其在SOC占比的差异 Fig. 4 Differences in microbial necromass C and its proportion in SOC among different treatments |
进一步分析发现,SOC含量与细菌残体碳含量呈显著正相关(图 5a,P < 0.05),但与真菌残体碳含量无显著相关(图 5b)。
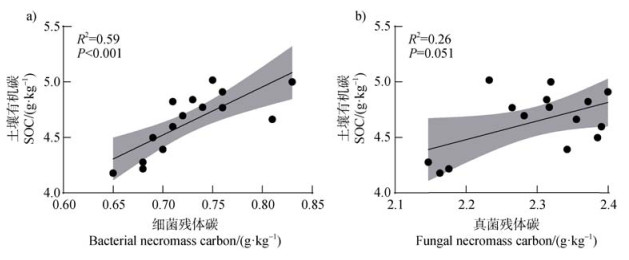
|
注:a),细菌残体碳与SOC的相关性;b),真菌残体碳与SOC的相关性。 Note: a), Correlation of infection rate with bacterial necromass C and SOC; b), Correlation of infection rate with fungal and SOC. 图 5 SOC与微生物残体碳的相关性 Fig. 5 The correlation between SOC and microbial necromass C |
本研究利用花生/玉米长期间作体系,探索了农田旱地低度多样化种植体系对豆科植物根际有机碳固持的影响。当花生邻近玉米时,花生根际有机碳含量显著提高。这与Cong等[7]基于北方玉米/蚕豆间作体系的8年长期试验得到的结果相似,共存的两种作物为竞争有限的地下资源向地下分配了更大的生物量,如更庞大的根系。伴随不同植物根系的加速生长,禾本科/豆科间作体系的地下根系分泌物含量也有所提升[27],这可能是SOC含量升高的原因之一。同时,玉米与花生的互补效应也可通过增强花生N2固定能力以增加土壤氮素养分[28](表 1),并增加作物根生物量和根长,以促进从更深层的土壤中吸取养分并最终积累在土壤表层[29]。不同养分环境下会造成花生对营养物质的吸收策略的改变,当养分限制时,作物根际微生物增加对土壤有机质的分解以吸收N、P、K等养分供作物根际吸收[30],本研究的MPPr处理的NO3–-N含量和AP的含量高于Pr处理,使得间作花生土壤根际BG和PPO活性下降(图 2a、图 2b)。邻近玉米没有改变花生根际土壤呼吸速率,但花生和玉米共存区域的玉米根际土壤呼吸速率高于花生根际土壤呼吸速率。可能是由于玉米比花生拥有更大的生物量[31],需要招募更多的微生物活化足够的养分供根系吸收以满足玉米的生长发育。本研究发现花生/玉米间非根际土的土壤呼吸速率较两花生间土壤呼吸速率高43.4%,可能是玉米具有庞大的根系能有效疏松土壤,促进土壤蓄水保肥能力,并且处于共同生长阶段的两种不同作物的可能存在种间竞争[32],共同增加土壤微生物群落的活性从而提高土壤呼吸速率(图 2c)。
微生物是土壤生态系统中的重要组分,其C代谢活性可以反映土壤生态系统整体的微生物活性。邻近玉米的花生根际微生物对C源利用能力高于邻近同种处理(图 3a、图 3b),这与许振羽等[33]得出的桑树/苜蓿间作体系根际土壤AWCD值显著提高的结论相似。推测邻近玉米改善了花生根际土壤NO3–-N含量提高土壤含水量,为微生物生命活动提供更多能量与更为有利的生存条件[34]。邻近玉米和远离玉米的花生根际土对糖类和胺类的利用率均处于较高水平,但邻近玉米时,花生根际土壤微生物提高了对酚酸类和氨基酸类特异性C源的代谢能力(图 3c)。花生分泌的次级代谢物中,酚酸类化合物是重要的化感物质,易在土壤中积累,限制微生物群落多样化并加剧土传病原菌富集[35]。玉米与花生间作体系中,玉米根系释放的异质性养分资源,扩大了花生根际微生物生存的营养谱[36];而玉米根际富集的有别于花生根际的微生物增加了土壤微生物类群[37]。这些异质性养分与多样的微生物输入可能提高了花生根际微生物对酚酸类和氨基酸类特异性C源的代谢活性。
邻近玉米的花生根际微生物对碳的代谢并未增加土壤CO2的释放,而是增加了土壤总氨基糖、土壤细菌和真菌残体碳含量。一方面,由于禾本科与豆科种间地下资源互补激发土壤微生物合成代谢,从而增加了土壤微生物生物量,更多的微生物生物量和更快的微生物周转率将促进微生物残体的形成[38],这些微生物残体的增加与植物凋落物、根系分泌物等共同贡献于SOC库。另一方面,作物多样性可增加NO3–-N的含量提高土壤氮的可用性[39],由于细菌相较于真菌具有较低的碳氮比,增加土壤氮有效性将减少微生物对微生物残体特别是细菌残体的再利用[19],最终促使作物多样性较高的农田土壤C库中含有更多微生物残体碳(图 4a,图 4c,图 4d)。农田生态系统中,利用地上不同植物轮间套作等模式提高地下多样化资源的输入有利于提高土壤微生物群落活性。在耶拿长期定位实验中,随着植物多样性的显著增加,养分分配驱动植物生物量的变化导致不同植物凋落物中多的木质素、蛋白质等有机化合物的输入,能有效激发土壤真菌的快速繁殖[40],这可能是玉米调控焦点植物(花生)根际更高的真菌/细菌残体比例的原因。此外,真菌细胞壁中的几丁质通过与葡聚糖共价交联形成了细胞壁的三维网状骨架比细菌细胞壁结构更稳定[41](图 4b),由于细菌残体碳相较于真菌残体碳更易分解,所以SOC含量随细菌残体碳的动态变化而变化,这也解释了SOC与细菌残体碳的正相关关系(图 5)。
4 结论在集约化农田的花生与玉米间作生态系统,邻近玉米的花生根际有机碳积累增加并不引起花生根际呼吸强度增强,反而调控β-葡萄糖苷酶和多酚氧化酶的活性下降。花生根际和玉米根际的根系分泌物及根相关微生物在邻近花生区域与花生根际微生物共存,并对更广泛的有机碳组分代谢,促进了土壤微生物残体碳(包括细菌和真菌残体碳)的积累,从而提升了植物根际土壤有机碳的固持。本研究揭示了间作作物地下微生物群落C代谢调控土壤C周转过程,为农田生态系统支持作物多样化提高碳固存提供理论依据。
| [1] |
Schneider U A. Agricultural sector analysis on greenhouse gas emission mitigation in the United States[D]. College Station, USA: Texas A&M University, 2000.
(  0) 0) |
| [2] |
Zhao M Y, Liu Y X, Zhang X Y. A review of research advances on carbon sinks in farmland ecosystems (In Chinese)[J]. Acta Ecologica Sinica, 2022, 42(23): 9405-9416. [赵明月, 刘源鑫, 张雪艳. 农田生态系统碳汇研究进展[J]. 生态学报, 2022, 42(23): 9405-9416.]
(  0) 0) |
| [3] |
Xia L L, Ti C P, Zhu C W, et al. Mitigation strategies of greenhouse gas emissions from crop production in China and the pathways to agricultural carbon neutrality (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(5): 1277-1288. DOI:10.11766/trxb202308040311 [夏龙龙, 遆超普, 朱春梧, 等. 中国粮食生产的温室气体减排策略以及碳中和实现路径[J]. 土壤学报, 2023, 60(5): 1277-1288.]
(  0) 0) |
| [4] |
Chen T T, Wang X Y, Wang Y, et al. Seasonal differences in yield and fertilizer use efficiency of different low-calcium-tolerant peanut varieties in response to the timing and splitting of calcium application in Southern China[J]. European Journal of Agronomy, 2023, 151: 126988. DOI:10.1016/j.eja.2023.126988
(  0) 0) |
| [5] |
Berghuijs H N C, Wang Z, Stomph T J, et al. Identification of species traits enhancing yield in wheat-faba bean intercropping: Development and sensitivity analysis of a minimalist mixture model[J]. Plant and Soil, 2020, 455(1): 203-226.
(  0) 0) |
| [6] |
Qian X, Zhou J, Luo B L, et al. Yield advantage and carbon footprint of oat/sunflower relay strip intercropping depending on nitrogen fertilization[J]. Plant and Soil, 2022, 481(1): 581-594.
(  0) 0) |
| [7] |
Cong W F, Hoffland E, Li L, et al. Intercropping enhances soil carbon and nitrogen[J]. Global Change Biology, 2015, 21(4): 1715-1726. DOI:10.1111/gcb.12738
(  0) 0) |
| [8] |
Risely A. Applying the core microbiome to understand host-microbe systems[J]. Journal of Animal Ecology, 2020, 89(7): 1549-1558. DOI:10.1111/1365-2656.13229
(  0) 0) |
| [9] |
Chen C, Chen H Y H, Chen X L, et al. Meta-analysis shows positive effects of plant diversity on microbial biomass and respiration[J]. Nature Communications, 2019, 10: 1332. DOI:10.1038/s41467-019-09258-y
(  0) 0) |
| [10] |
Kögel-Knabner I, Rumpel C. Advances in molecular approaches for understanding soil organic matter composition, origin, and turnover: A historical overview[J]. Advances in Agronomy, 2018, 149: 1-48.
(  0) 0) |
| [11] |
Prescott C E. Sinks for plant surplus carbon explain several ecological phenomena[J]. Plant and Soil, 2022, 476(1): 689-698.
(  0) 0) |
| [12] |
Liang C, Balser T C. Microbial production of recalcitrant organic matter in global soils: Implications for productivity and climate policy[J]. Nature Reviews Microbiology, 2011, 9: 75.
(  0) 0) |
| [13] |
Sokol N W, Sanderman J, Bradford M A. Pathways of mineral-associated soil organic matter formation: Integrating the role of plant carbon source, chemistry, and point of entry[J]. Global Change Biology, 2019, 25(1): 12-24. DOI:10.1111/gcb.14482
(  0) 0) |
| [14] |
Chen L Y, Fang K, Wei B, et al. Soil carbon persistence governed by plant input and mineral protection at regional and global scales[J]. Ecology Letters, 2021, 24(5): 1018-1028. DOI:10.1111/ele.13723
(  0) 0) |
| [15] |
Guerra C A, Bardgett R D, Caon L, et al. Tracking, targeting, and conserving soil biodiversity[J]. Science, 2021, 371(6526): 239-241. DOI:10.1126/science.abd7926
(  0) 0) |
| [16] |
Dai G H, Zhu S S, Cai Y, et al. Plant-derived lipids play a crucial role in forest soil carbon accumulation[J]. Soil Biology & Biochemistry, 2022, 168: 108645.
(  0) 0) |
| [17] |
Qian Z Y, Li Y N, Du H, et al. Increasing plant species diversity enhances microbial necromass carbon content but does not alter its contribution to soil organic carbon pool in a subtropical forest[J]. Soil Biology & Biochemistry, 2023, 187: 109183.
(  0) 0) |
| [18] |
Joergensen R G. Amino sugars as specific indices for fungal and bacterial residues in soil[J]. Biology and Fertility of Soils, 2018, 54(5): 559-568. DOI:10.1007/s00374-018-1288-3
(  0) 0) |
| [19] |
Ma X S, Zhang W, Zhang X C, et al. Dynamics of microbial necromass in response to reduced fertilizer application mediated by crop residue return[J]. Soil Biology & Biochemistry, 2022, 165: 108512.
(  0) 0) |
| [20] |
Lu J M, Chen Y, Shen Y, et al. Light-driven succession of rhizosphere bacterial community structure and yield enhancement mechanism in peanut intercropping system (In Chinese)[J]. Soils, 2023, 55(6): 1237-1243. [卢居勐, 陈晏, 沈一, 等. 光照驱动花生间作系统根际细菌群落结构演变和产量提升机制的研究[J]. 土壤, 2023, 55(6): 1237-1243.]
(  0) 0) |
| [21] |
Riley D, Barber S A. Salt accumulation at the soybean(Glycine max. (L.)merr.)root-soil interface[J]. Soil Science Society of America Journal, 1970, 34(1): 154-155. DOI:10.2136/sssaj1970.03615995003400010042x
(  0) 0) |
| [22] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [23] |
Wang F H, Zhang Z G, Jia W. Effects of single-factor and combined contamination of triclosan and cadmium on respiration and enzyme activity of soil (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(2): 422-431. DOI:10.11766/trxb201708040345 [王凤花, 张振国, 贾文. 三氯生与镉单一及复合污染对土壤呼吸和酶活性的影响[J]. 土壤学报, 2018, 55(2): 422-431.]
(  0) 0) |
| [24] |
Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology, 1991, 57(8): 2351-2359. DOI:10.1128/aem.57.8.2351-2359.1991
(  0) 0) |
| [25] |
Amelung W. Methods using amino sugars as markers for microbial residues in soil[M]//Assessment methods for soil carbon. Boca Raton: CRC Press, 2000: 251—290.
(  0) 0) |
| [26] |
Engelking B, Flessa H, Joergensen R G. Shifts in amino sugar and ergosterol contents after addition of sucrose and cellulose to soil[J]. Soil Biology & Biochemistry, 2007, 39(8): 2111-2118.
(  0) 0) |
| [27] |
Wang T, Wang Q X, Li Y M, et al. Effect of maize and soybean intercropping on root system and soil aggregate stability (In Chinese)[J]. Journal of Yunnan Agricultural University: Natural Science, 2021, 36(3): 507-515. [王婷, 王强学, 李永梅, 等. 玉米大豆间作对作物根系及土壤团聚体稳定性的影响[J]. 云南农业大学学报: 自然科学版, 2021, 36(3): 507-515.]
(  0) 0) |
| [28] |
Xing Y, Yu R P, An R, et al. Two pathways drive enhanced nitrogen acquisition via a complementarity effect in long-term intercropping[J]. Field Crops Research, 2023, 293: 108854. DOI:10.1016/j.fcr.2023.108854
(  0) 0) |
| [29] |
Furey G N, Tilman D. Plant biodiversity and the regeneration of soil fertility[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(49): e2111321118.
(  0) 0) |
| [30] |
Inselsbacher E, Hinko-Najera Umana N, Stange F C, et al. Short-term competition between crop plants and soil microbes for inorganic N fertilizer[J]. Soil Biology & Biochemistry, 2010, 42: 360-372.
(  0) 0) |
| [31] |
Xiao X W, Han L, Chen H R, et al, et al. Intercropping enhances microbial community diversity and ecosystem functioning in maize fields[J]. Frontiersin in Microbiology, 2023, 38: 2025-2031.
(  0) 0) |
| [32] |
Endlweber K, Scheu S. Effects of Collembola on root properties of two competing ruderal plant species[J]. Soil Biology & Biochemistry, 2006, 38(8): 2025-2031.
(  0) 0) |
| [33] |
Xu Z Y, Li X P, Du Y, et al. Responses of soil microbial communities in mulberry rhizophere to intercropping and nitrogen application (In Chinese)[J]. Chinese Journal of Applied Ecology, 2019, 30(6): 1983-1992. [许振羽, 李学鹏, 杜宇, 等. 桑树根际土壤微生物对间作和施氮的响应[J]. 应用生态学报, 2019, 30(6): 1983-1992.]
(  0) 0) |
| [34] |
Wang D, Zhao P, Xiang R, et al. Nitrogen fertilization overweighs intercropping in promotion of dissolved organic carbon concentration and complexity in potato-cropped soil[J]. Plant and Soil, 2021, 462(1): 273-284.
(  0) 0) |
| [35] |
Liu J G, Li X G, Jia Z J, et al. Effect of benzoic acid on soil microbial communities associated with soilborne peanut diseases[J]. Applied Soil Ecology, 2017, 110: 34-42. DOI:10.1016/j.apsoil.2016.11.001
(  0) 0) |
| [36] |
Zhang J E, Gao A X, Xu H Q, et al. Effects of maize/peanut intercropping on rhizosphere soil microbes and nutrient contents (In Chinese)[J]. Chinese Journal of Applied Ecology, 2009, 20(7): 1597-1602. [章家恩, 高爱霞, 徐华勤, 等. 玉米/花生间作对土壤微生物和土壤养分状况的影响[J]. 应用生态学报, 2009, 20(7): 1597-1602.]
(  0) 0) |
| [37] |
Yin X T, Yang H, Yu R P, et al. Interspecific below-ground interactions driven by root exudates in agroecosys-tems with diverse crops (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2022, 30(8): 1215-1227. [尹晓童, 杨浩, 于瑞鹏, 等. 根系分泌物在作物多样性体系中对种间地下部互作的介导作用[J]. 中国生态农业学报, 2022, 30(8): 1215-1227.]
(  0) 0) |
| [38] |
Prommer J, Walker T W N, Wanek W, et al. Increased microbial growth, biomass, and turnover drive soil organic carbon accumulation at higher plant diversity[J]. Global Change Biology, 2020, 26(2): 669-681. DOI:10.1111/gcb.14777
(  0) 0) |
| [39] |
Zhu Z H, Du H, Gao K, et al. Plant species diversity enhances soil gross nitrogen transformations in a subtropical forest, southwest China[J]. Journal of Applied Ecology, 2023, 60(7): 1364-1375.
(  0) 0) |
| [40] |
Rousk J, Bååth E. Growth of saprotrophic fungi and bacteria in soil[J]. FEMS Microbiology Ecology, 2011, 78(1): 17-30.
(  0) 0) |
| [41] |
Rogg L E, Fortwendel J R, Juvvadi P R, et al. Regulation of expression, activity and localization of fungal chitin synthases[J]. Medical Mycology, 2012, 50(1): 2-17.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


