2. 南京林业大学南方现代林业协同创新中心, 南京 210037;
3. 农业农村部长江下游平原农业环境重点实验室, 南京 210014;
4. 江苏大学环境与安全工程学院, 江苏镇江 212013;
5. 江苏省耕地质量与农业环境保护站, 南京 210036;
6. 江苏省生态环境监测监控有限公司, 南京 210019
2. Co-Innovation Center for Sustainable Forestry in Southern China, Nanjing Forestry University, Nanjing 210037, China;
3. Key Laboratory of Agro-Environment in Downstream of Yangtze Plain, Ministry of Agriculture and Rural Affairs, Nanjing 210014, China;
4. School of the Environment and Safety Engineering, Jiangsu University, Zhenjiang, Jiangsu 212013, China;
5. Jiangsu Cultivated Land Quality and Agricultural Environmental Protection Station, Nanjing 210036, China;
6. Jiangsu Province Ecological Environment Monitoring Co., LTD, Nanjing 210019, China
砷(As)是一种有毒的类金属,进入食物链后严重威胁人体健康。在过去的几十年里,采矿活动、滥用农药、化肥和使用砷污染地表水、地下水进行灌溉导致世界各地农田砷污染问题普遍存在[1]。在淹水条件下,水稻积累的无机砷含量要远高于其他谷物类作物。水稻土中砷主要以亚砷酸盐(As(Ⅲ))和砷酸盐(As(Ⅴ))的无机砷(iAs)形式存在,其中,As(Ⅲ)较As(Ⅴ)具有更强的毒性和迁移性[2]。因此,研发环保高效、低成本的材料吸附、氧化土壤中的As(Ⅲ)是当前的研究热点。
生物质炭(Biochar)作为一种环境友好型材料,具有含碳率高、比表面积大、表面官能团丰富和理化性质稳定等特点,已被广泛应用于土壤和水中污染物的去除[3]。许多研究表明,受到表面电荷、阴离子交换容量和活性位点的影响[4],生物质炭可有效地吸附固定土壤中的阳离子(如镉、铅、锌),但对砷、磷阴离子的吸附能力有限[3]。为提高生物质炭对砷阴离子的吸附能力,开展了酸碱活化、表面官能团修饰和负载金属氧化物(氧化铁、氧化镁、氧化锰)等方法[5]。其中,在生物质炭上负载锰氧化物表现出更好的吸附与氧化能力,但改性方法和条件对As(Ⅲ)吸附和氧化能力影响较大。课题组系统比较了温度、改性方法、锰(Mn)负载量对锰改性生物质炭吸附、氧化As(Ⅲ)的影响,制备出一种对As(Ⅲ)具有高效氧化和吸附能力的锰改性生物质炭[6],在纯溶液培养体系中能将10 mg·L–1的As(Ⅲ)快速氧化吸附,使游离态As(Ⅲ)浓度降至0.01 mg·L–1,对As(Ⅲ)的吸附容量达到了32.06 mg·g–1。而该材料在土壤中对砷的氧化-吸附效果以及作用机制尚待进一步深入研究。
前期已有较多文献通过生物质炭与土壤混合培养试验研究了施用不同类型改性生物质炭对土壤砷转化过程的影响与机制[4,7]。结果表明,添加改性生物质炭后,土壤中As的移动性降低,可能由于改性生物质炭增加了土壤胶体的正电荷,进而增强了土壤对As的静电吸附能力[8],或引起了土壤pH和溶解性有机质(DOM)等的变化[9]。然而,这些混合培养研究未进一步阐明改性生物质炭对As在土壤-生物质炭-土壤溶液中赋存形态变化的直接贡献和具体作用机制。改性生物质炭自身可通过静电吸附、表面络合、沉淀和氧化还原等作用直接影响土壤中As的形态[5];也可释放或吸附Mn、铁(Fe)、可溶性有机碳(DOC)等影响土壤溶液中游离态Mn、Fe和DOC含量,最终影响土壤中As的迁移转化[10-11]。向土壤中添加锰改性生物质炭后,As、Mn、Fe和DOC等可竞争吸附或络合于土壤和生物质炭两种固相界面,这种竞争结合作用可能对As氧化还原反应和赋存形态的变化有重要贡献[11]。因此,在土壤-生物质炭-土壤溶液系统中,解析锰改性生物质炭这一固相界面本身影响As迁移转化的具体贡献和作用机理有着重要的意义,而目前尚缺乏相关报道。
因此,本研究选用生物质炭和锰改性生物质炭两种材料,在炭-土混合培养下,另外设置炭-土分离处理[12],即将生物质炭放入尼龙网袋中与土壤分隔开,该设置是为了采集生物质炭周围溶液和生物质炭固体以分析生物质炭直接引起的土壤溶液-生物质炭性质的动态变化。通过研究生物质炭影响土壤-土壤溶液-生物质炭体系中砷赋存形态的机制,并结合生物质炭、土壤固相与土壤溶液pH、DOC、锰和铁等的动态变化揭示锰改性生物质炭影响砷赋存形态的可能途径,为进一步阐明锰改性生物质炭调控土壤无机砷的转化机制提供理论支撑。
1 材料与方法 1.1 供试土壤试验土壤采自江苏省南京市农业科学院试验基地0~20 cm水稻土,经风干、磨碎、过2 mm筛后,将2.6 g NaAsO2溶解于500 mL超纯水中配置成NaAsO2溶液均匀喷洒在大约15 kg土壤中,通过圆筒混合机(YG-30KG,深圳市进杰工业设备有限公司)不断翻搅使污染物与土壤混合均匀,随后在阴凉处放置风干,经过6星期的老化后再次过2 mm筛,得到模拟高砷污染土壤作为供试土壤备用。供试土壤的基本理化性质根据《土壤农业化学分析方法》[13]测得:pH为7.82,可溶性有机碳DOC为40.73 mg·kg–1,土壤中全锰、全铁、总砷含量分别为423.52、1 3245.48、97.15 mg·kg–1,其中土壤As含量远高于我国土壤环境质量标准(GB 15618-2008)中的风险筛选值(pH > 7.5,总As < 20 mg·kg–1)。
1.2 生物质炭的制备试验小麦秸秆采自江苏省农业科学院试验基地,经过脱穗、清洗、静置、烘干、磨碎并过0.25 mm筛。将秸秆粉末装入石英舟中,放入管式炉(OTF-1200X,合肥科晶材料技术有限公司)内,在连续通氮气的条件下,升温(5 ℃·min–1)至600 ℃并恒温保持2 h,冷却至室温后取出,得到未改性生物质炭,记作BC。根据Huang等[6]的研究结果,选用最佳的制备条件,即将4.0 g BC和1.40 g MnSO4·H2O混合均匀再超声混合1 h,随后将溶解的KMnO4(0.87 g)逐滴加入混合液中,同时搅拌,滴加完后再搅拌1 h,静置24 h后,进行抽滤并用超纯水反复清洗,最后置于65 ℃烘箱中干燥,得到锰改性生物质炭,记作MBC。该方法制备过程简单,根据公式:2MnO– 4 + 3Mn2+ +2H2O → 5MnO2 + 4H+可直接在生物质炭表面生成无定型锰氧化物δ-MnO2(PDF:NO. 18-0802)。BC和MBC的基本性质见表 1。
|
|
表 1 未改性生物质炭(BC)和锰改性生物质炭(MBC)的基本性质 Table 1 Basic properties of unmodified biochar(BC)and Mn-modified biochar(MBC) |
试验采用室内模拟淹水环境培养的方法,称取100 g干土于棕色玻璃瓶(7 cm × 7 cm× 10 cm)中,分别添加1 g未改性生物质炭(BC)和锰改性生物质炭(MBC),设置炭-土混合组和炭-土分离组,并设置未加生物质炭的对照组CK共6个处理(试验处理见图 1a,试验装置见图 1b),每个处理初始设置6组,每组3个重复,加入一定量超纯水使上覆水层高于土壤表层5 cm[14]。将培养瓶置于恒温培养箱(25℃)中培养28 d,分别在1、3、5、7、14、28 d时通过土壤溶液采样器(图 1中A、B、C)收集土壤溶液,每组收集的第1、2、3个重复分别与其他组重复混合得到3组土壤溶液,其中A收集60 mL土壤溶液,B收集30 mL,C1和C2各收集15 mL,每瓶均收集60 mL土壤溶液。分析土壤溶液DOC、As(Ⅲ)、总砷、总锰和总铁浓度,并在7、14、28 d时破坏性采集1组土壤样品和生物质炭样品,冻干后过2 mm筛,测定土壤有效态砷、有效态锰和有效态铁含量,分析土壤砷的形态转化(土壤砷的分级提取)以及生物质炭上的DOC、总砷、总锰和总铁含量(炭-土分离处理)。培养过程中每日添加超纯水,并在抽取土壤溶液后立即添加超纯水,维持各培养瓶上覆水高于土壤表层5 cm。
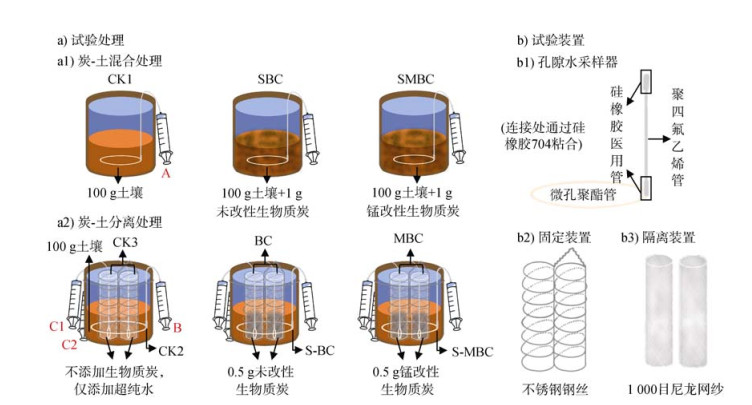
|
注:炭-土混合处理下,CK1为不添加生物质炭的对照处理,SBC为添加未改性生物质炭的处理,SMBC为添加锰改性生物质炭的处理;炭-土分离处理下,CK2为不添加生物质炭隔离袋的外侧对照处理,S-BC为添加未改性生物质炭隔离袋的外侧处理,S-MBC为添加锰改性生物质炭隔离袋的外侧处理,CK3为不添加生物质炭隔离袋内侧的对照处理,BC为添加未改性生物质炭隔离袋内侧的处理,MBC为添加锰改性生物质炭隔离袋内侧的处理。下同。 Note: Under the biochar-soil mix treatments, CK1 is the biochar-free control, SBC is the treatment with unmodified biochar added, and SMBC is the treatment with Mn-modified biochar added; under the biochar-soil separation treatments, CK2 is the control outside the biochar-free nylon bags, S-BC is the treatment outside the nylon bags with unmodified biochar added, S-MBC is the treatment outside the nylon bags with Mn-modified biochar added, CK3 is the control inside the biochar-free nylon bags, BC is the treatment inside the nylon bags with unmodified biochar added, MBC is the treatment inside the nylon bags with Mn-modified biochar added. The same as below. 图 1 土壤培养试验处理(a)和试验装置(b)示意图(a1.炭-土混合处理;a2.炭-土分离处理;b1. 孔隙水采样器;b2. 固定装置;b3. 隔离装置) Fig. 1 Illustration of the soil culture experimental treatments (a) and devices (b) (a1. Biochar-soil mix treatments, a2. Biochar-soil separation treatments, b1. The porewater sampler, b2. Fixture, and b3. Isolation device) |
通过孔隙水采样器抽取的土壤溶液pH用pH计(FE28,梅特勒-托利多国际有限公司,瑞士)测定;DOC用总有机碳/总氮分析仪(Multi N/C 3100,AnalytikJenaAG公司,德国)测定;总砷、总锰、总铁用电感耦合等离子体质谱仪(ICP-MS,LC 1260 MS G6420A,Aglient公司,美国)测定;溶液As(Ⅲ)用高效液相色谱(NexION 2000,PerkinElmer公司,美国)串联电感耦合等离子体发射光谱测定,其中As(Ⅲ)的检测限为0.19 µg·L–1。
1.4.2 土壤重金属形态的测定土壤有效态砷、有效态锰、有效态铁采用碳酸氢铵-二乙三胺五乙酸(AB-DTPA)浸提液[15]提取;土壤砷形态分析采用改进的欧共体物质标准局(BCR)提出的BCR连续法[7]提取,并用ICP-MS进行分析测定。
1.4.3 生物质炭基本性质的测定生物质炭的总砷、总锰、总铁采用HCl-HNO3消煮,ICP-MS测定[16];生物质炭的DOC用超纯水(1︰50炭水比)浸提—总有机碳/总氮分析仪测定[17]。
1.5 数据处理使用Microsoft Excel 2019、SPSS25.0和Origin2021进行数据处理、统计分析和绘图。采用方差分析(ANOVA)和图基(Tukey)多重比较分析不同处理样品之间的差异。在95%置信区间下检验统计学显著性。采用皮尔森(Person)相关分析法对土壤不同性质进行相关性分析。
2 结果 2.1 锰改性生物质炭对土壤溶液无机砷赋存形态的影响不同处理下土壤溶液总砷(As(T))和三价砷(As(Ⅲ))浓度随培养时间的变化如图 2所示。炭-土混合处理下(图 2a),SBC土壤溶液As(T)和As(Ⅲ)浓度随培养时间逐渐升高,其动态变化与CK1基本重合,并在14 d时达到峰值后下降。而SMBC土壤溶液As(T)和As(Ⅲ)浓度虽然也随时间呈不断增加的趋势,但总体上均明显低于其他处理,且As(Ⅲ)浓度在培养期间维持在较低浓度范围内(0.02~0.88 mg·L–1)。在28 d时,与CK1和SBC相比,SMBC土壤溶液As(T)浓度分别降低了1.38 mg·L–1和1.24 mg·L–1,As(Ⅲ)浓度分别降低了2.83 mg·L–1和2.48 mg·L–1。
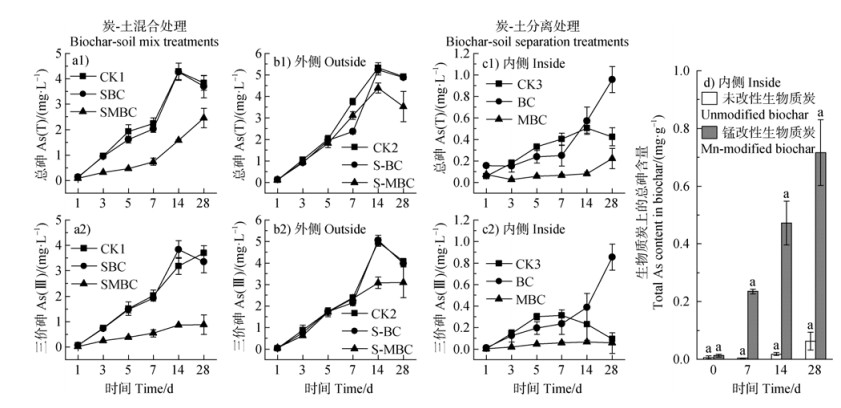
|
注:不同字母表示相同时间不同处理间存在显著差异(P < 0.05)。下同。 Note: Different superscript letters indicate significant differences between different treatments at the same time(P < 0.05). The same as below. 图 2 土壤溶液总砷(As(T))浓度(a1~c1)和三价砷浓度(a2~c2)以及生物质炭上总砷含量(d)的变化(a1~a2. 炭-土混合处理;b1~d. 炭-土分离处理) Fig. 2 Changes in total As (As(T))concentration (a1-c1) and As(Ⅲ) concentration (a2-c2) in soil solution, and total As content in biochar (d)(a1-a2. Biochar-soil mix treatments. b1-d. Biochar-soil separation treatments) |
炭-土分离处理下,隔离袋外侧、内侧土壤溶液As(T)和As(Ⅲ)浓度的变化如图 2b和图 2c所示。由图 2b可知,隔离袋外各处理土壤溶液As(T)和As(Ⅲ)浓度均呈先增加至14 d达到峰值随后降低的趋势,其中,S-MBC溶液As(T)和As(Ⅲ)浓度在1~5 d时与其他处理基本重合,但在14~28 d时明显低于其他处理。而图 2c显示,隔离袋内添加MBC的溶液As(T)和As(Ⅲ)浓度变化幅度较小,As(T)和As(Ⅲ)浓度分别在0.028~0.221 mg·L–1和0.003~0.064 mg·L–1范围内。然而,BC溶液As(T)和As(Ⅲ)浓度随培养时间呈不断增加的趋势,并在14 d时迅速增加,28 d时分别达到了0.957 mg·L–1和0.855 mg·L–1。通过对BC和MBC上As的定量分析(图 2d)可知,BC和MBC吸附的砷随着培养时间逐渐增加,且MBC吸附的砷显著高于BC(P < 0.05),28 d时,MBC的As含量(0.72 mg·g–1)为BC(0.06 mg·g–1)的12倍。
2.2 锰改性生物质炭对土壤无机砷赋存形态的影响如图 3a1所示,炭-土混合处理下,SMBC土壤有效态As含量在不同的培养阶段均显著低于CK1和SBC(P < 0.05),并稳定在5.83~5.90 mg·kg–1范围内。SBC在28 d时的土壤有效态As含量(8.54 mg·kg–1)显著高于CK1处理(7.50 mg·kg–1)(P < 0.05)。炭-土分离处理下(图 3a2),在7 d时,S-BC和S-MBC土壤有效态As含量均高于CK2,随后逐渐降低,而CK2有效态As含量逐渐升高。S-MBC土壤有效态As含量随着培养时间缓慢减少,并在28 d时达到6.13 mg·kg–1,逐渐趋与SMBC相近的值(5.83 mg·kg–1)。此时土壤有效态As含量表现为:CK2 > S-BC > S-MBC。
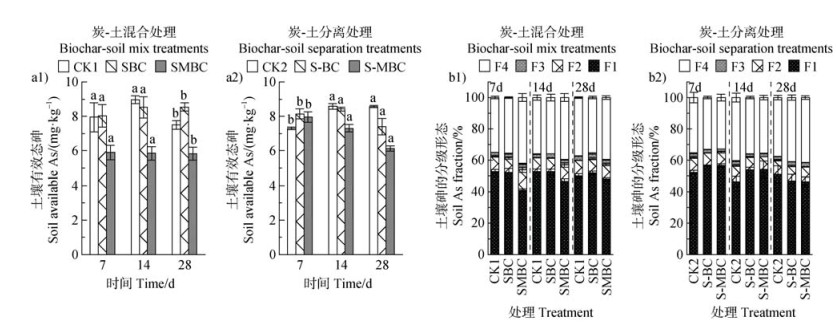
|
注:F1~F4分别为砷的酸可提取态、可还原态、可氧化态和残渣态。 Note: F1-F4 are the acid extractable, reducible, oxidisable and residual states of arsenic, respectively. 图 3 炭-土混合处理(a1、b1)和炭-土分离处理(a2、b2)土壤有效态砷含量(a)和砷形态分级(b) Fig. 3 Available As content in soil (a) and fractionation of arsenic speciation (b) in soils under biochar-soil mix treatments (a1, b1) and biochar-soil separation treatments (a2, b2) |
通过BCR法提取土壤砷分级组分,即酸可提取态As(F1)、可还原态As(F2)、可氧化态As(F3)和残渣态As(F4),其中F1是土壤中砷最活跃的形态,而F2、F3和F4是土壤中相对稳定的砷形态[7]。不同处理下土壤砷形态分级如图 3b所示。炭-土混合处理中(图 3b1),SMBC处理的土壤F1随培养时间增加表现出持续升高的现象,F1增加可能来源于F2的还原溶解,说明在土壤中添加MBC短期内能促进砷与铁锰结合,但随着淹水时间的增加,F2中的部分砷可能会被重新释放出来,导致F1从41.1%增至48.0%,而F2从12.9%降至9.1%。但总体而言,SMBC的F1(41.1%~48.0%)始终低于CK1(50.1%~52.9%)和SBC(52.0%~52.7%),F4(39.7%~42.3%)始终高于CK1(35.1%~37.4%)和SBC(38.7%~38.9%),这说明添加MBC能够进一步促进砷向残渣态转变。而SBC在不同培养时间内土壤砷不同分级组分无明显变化,但在第28天时,SBC的F1(52.0%)要高于CK1(50.1%),且F4(35.7%)低于CK1处理(37.4%),说明添加BC可能会抑制酸可提取态As向相对稳定的砷形态转变。
由图 3b2可知,炭-土分离处理下,S-MBC和S-BC各砷分级组分随培养时间的变化趋势一致,即F1逐渐降低,分别由56.8%、56.5%降至46.3%、47.0%,F4逐渐增加,分别由32.7%、33.2%增至41.5%、41.0%。与土壤有效态As结果类似,CK2的F1在7 d时低于S-BC和S-MBC,但在28 d时F1由高到低分别为CK2、S-BC、S-MBC,F4由高到低分别为S-MBC、S-BC、CK2,说明BC、MBC可通过调节土壤溶液的砷浓度,降低土壤有效态砷含量和酸可提取态As占比,且MBC的效果优于BC。
2.3 锰改性生物质炭对土壤溶液pH与DOC的影响不同处理下土壤溶液pH随培养时间的变化如图 4a所示。炭-土混合处理下(图 4a1),SBC溶液pH与CK1相比无明显差异,而SMBC明显高于其他处理。土壤本身的缓冲能力使各处理间在28 d时的土壤溶液pH差值在0.03~0.08个pH单位之间,差值逐渐趋于稳定。在炭-土分离处理中,S-BC和S-MBC处理土壤溶液pH在不同培养时间内均高于CK2(图 4a2);在隔离袋内的BC和MBC溶液pH也均明显高于CK3,且受到生物质炭原始pH(BC︰10.41;MBC︰6.87)的影响,在1 d时,BC溶液pH大于MBC,但随着培养时间的增加,MBC上锰氧化物的还原导致溶液pH略高于BC(图 4a3)[18]。
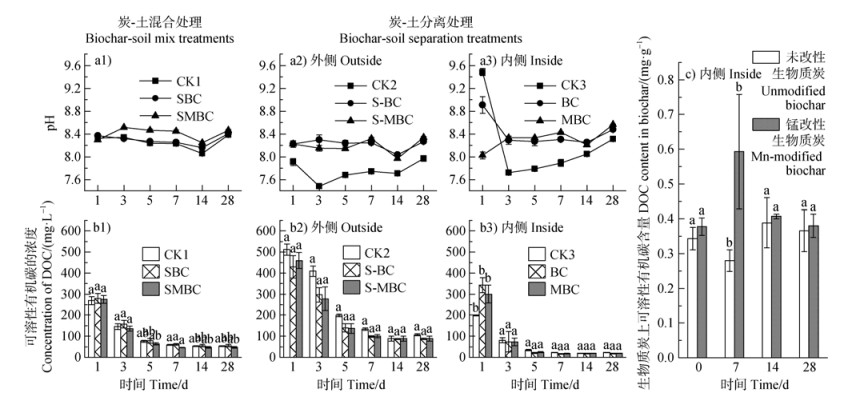
|
图 4 土壤溶液pH(a)和可溶性有机碳(DOC)浓度(b)以及生物质炭上DOC含量(c)的变化(a1、b1. 炭-土混合处理;a2~a3、b2~c. 炭-土分离处理) Fig. 4 Changes in pH (a) and dissolved organic carbon (DOC) concentration (b) in soil solution and DOC content in biochar (c)(a1, b1. Biochar-soil mix treatments. a2-a3, b2-c. Biochar-soil separation treatments) |
不同处理下土壤溶液DOC浓度随着培养时间的动态变化如图 4b所示。总体上,各处理土壤溶液DOC浓度均随培养时间而逐渐降低并趋于稳定。在炭-土混合处理中(图 4b1),培养3 d后各处理DOC浓度基本表现出SBC与CK1处理高于SMBC的趋势。在炭-土分离处理中,BC和MBC溶液DOC浓度在1 d时明显高于CK3(图 4b3),这是由于生物质炭本身含有溶解性有机碳(BC︰0.34 mg·g–1;MBC︰0.38 mg·g–1),并在1 d时快速释放至溶液中,因此SBC和SMBC在1 d时的DOC浓度也高于CK1;但后续培养期内,BC和MBC溶液DOC浓度低于CK3,并且隔离装置外S-BC和S-MBC处理的土壤溶液DOC浓度也始终低于CK2(图 4b2),这可能是由于生物质炭对DOC具有一定的亲和力,能够促进对DOC的吸附[10],通过对BC和MBC上DOC的定量分析(图 4c)也证实了该观点,但长期的培养下生物质炭上吸附的DOC逐渐降低,这可能与DOC的分解有关。
2.4 锰改性生物质炭对锰的影响不同处理下土壤Mn随培养时间的变化如图 5所示。由图 5a1可知,炭-土混合处理下,尽管MBC上负载了大量的锰氧化物,但在1 d时,SMBC土壤溶液总锰(Mn(T))浓度(0.04 mg·L–1)要远低于CK1(0.41 mg·L–1)和SBC(0.33 mg·L–1),在3 d时,CK1、SBC和SMBC溶液Mn(T)浓度均迅速增加,并且在随后的培养时间里,SMBC溶液Mn(T)浓度增加幅度均较大,溶液Mn(T)浓度基本保持着SMBC > CK1 > SBC的趋势。因此,SMBC的土壤有效态Mn含量显著高于其他处理(P < 0.05)(图 5b1),且各处理的土壤有效态Mn含量随培养时间无明显差异,说明Mn在土壤中的变化相对稳定。
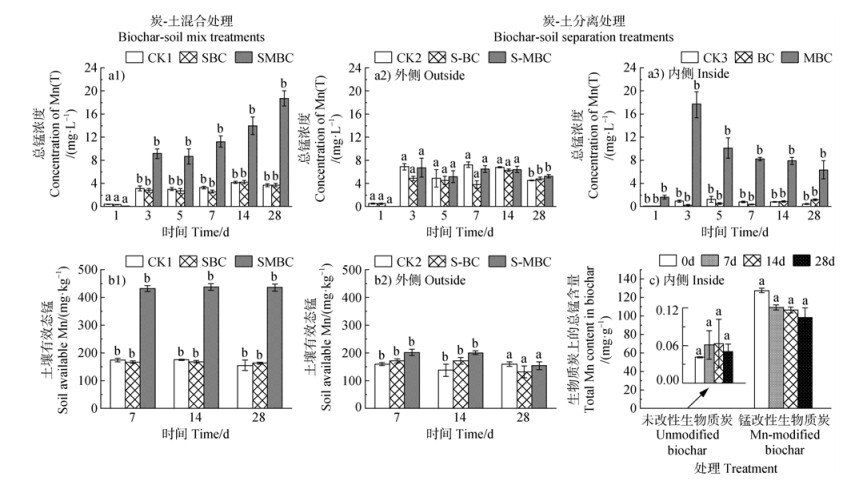
|
图 5 土壤溶液总锰(Mn(T),a)、土壤有效态锰(b)以及生物质炭上总锰含量(c)的变化(a1、b1. 炭-土混合处理;a2~a3、b2~c. 炭-土分离处理) Fig. 5 Changes in total Mn (Mn(T)) concentration in soil solution (a), available Mn content in soil (b), and total Mn content in biochar (c)(a1, b1. Biochar-soil mix treatments. a2-a3, b2-c. Biochar-soil separation treatments) |
在炭-土分离处理中,隔离袋外S-MBC土壤溶液在1 d时的Mn(T)浓度(0.02 mg·L–1)远低于CK2(0.52 mg·L–1)和S-BC(0.48 mg·L–1),该结果与炭-土混合处理一致。在后续培养时间里,S-MBC和CK2的土壤溶液Mn(T)浓度基本无显著差异(P > 0.05),但在28 d时,S-MBC土壤溶液Mn(T)浓度显著高于CK2(P < 0.05)(图 5a2)。此外,由图 5b2知,在7~14 d时,各处理土壤有效态Mn含量从大到小表现出S-MBC > S-BC > CK2的趋势,在28 d时,S-BC和S-MBC的土壤有效态Mn明显降低,但与CK2相比无显著差异(P > 0.05)。然而,隔离袋内添加MBC的溶液在1 d时Mn(T)浓度(1.63 mg·L–1)要远高于CK3(0.04 mg·L–1)和BC(0.04 mg·L–1),并在3 d时快速释放,此时Mn(T)浓度达到峰值(17.74 mg·L–1),随后逐渐降低(图 5a3),说明MBC对溶液中的Mn离子(土壤和MBC共同释放)也处于动态吸附-解吸过程中。但通过对BC和MBC上Mn的定量分析(图 5c)可知,MBC上的Mn含量随着培养时间逐渐降低,说明MBC处理溶液Mn浓度的减少并不是完全再吸附至生物质炭上。
2.5 锰改性生物质炭对铁的影响不同处理下土壤Fe随培养时间的变化如图 6所示。由图 6a1可知,炭-土混合处理下,不同处理土壤溶液总铁(Fe(T))浓度随培养时间呈不断增加的趋势,其中SMBC土壤溶液Fe(T)浓度显著低于其他处理(P < 0.05),且保持着SMBC < SBC < CK1的趋势。由图 6b1也能明显看出SMBC土壤有效态Fe含量显著低于其他处理(P < 0.05),且SBC和SMBC土壤有效态Fe含量随时间呈先降后增的趋势。
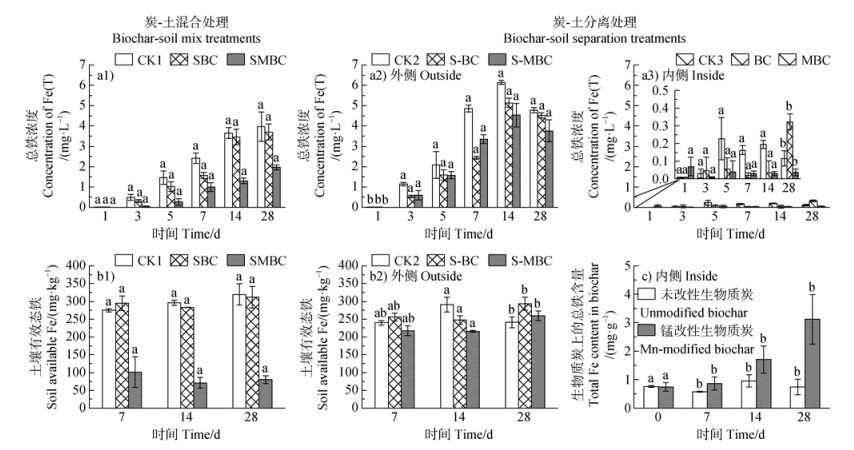
|
图 6 土壤溶液总铁(Fe(T),a)、土壤有效态铁(b)以及生物质炭上总铁含量(c)的变化(a1、b1. 炭-土混合处理;a2~a3、b2~c. 炭-土分离处理) Fig. 6 Changes in total Fe(Fe(T)) concentration in soil solution (a), available Fe content in soil (b), and total Fe content in biochar (c)(a1, b1. Biochar-soil mix treatments. a2-a3, b2-c. Biochar-soil separation treatments) |
炭-土分离处理下,隔离袋内添加BC和MBC的溶液Fe(T)浓度与CK3相比在1~3 d时无显著差异(P > 0.05),在5~14 d时显著降低(P < 0.05),但28 d时BC溶液Fe(T)浓度由0.03 mg·L–1急剧升至0.32 mg·L–1(图 6a3)。通过对BC和MBC上的Fe进行定量分析可知(图 6c),BC上Fe含量在28 d时由0.96 mg·g–1降至0.74 mg·g–1,猜测28 d时BC溶液Fe(T)浓度的升高可能与BC上Fe的释放有关。而MBC上吸附的Fe含量随着时间逐渐增加,在28 d时达到了3.12 mg·g–1。隔离袋外S-MBC土壤溶液Fe(T)浓度在1 d时显著低于其他处理(P < 0.05)(图 6a2),这与炭-土混合处理结果一致。不同处理土壤溶液Fe(T)浓度随着培养时间呈先增加,至14 d时达到峰值随后降低的趋势,并且S-BC和S-MBC土壤溶液Fe(T)浓度均显著低于CK2(P < 0.05)。由图 6b2可知,S-BC和S-MBC土壤有效态Fe含量也呈先降后增的趋势,在28 d时,S-BC土壤有效Fe含量(293.39 mg·kg–1)显著高于CK2(241.09 mg·kg–1)和S-MBC(259.47 mg·kg–1)。
3 讨论锰改性生物质炭与土壤充分混匀后(炭-土混合处理),与对照和施用未改性生物质炭处理相比,显著降低了土壤溶液As(T)、As(Ⅲ)浓度以及土壤有效态As含量,并促进土壤砷向残渣态转变(图 2,图 3)。生物质炭及其改性材料可通过调节土壤溶液无机砷(iAs)的移动性(吸附)、形态(iAs的氧化还原)[19],或改变材料-土壤有效态砷的分配、土壤砷赋存形态来影响整个体系中As的迁移转化[7]。然而,在炭-土混合处理下,土壤系统各性质的变化难以直观地辨析锰改性生物质炭调节土壤溶液As与土壤有效态砷的作用机制。本研究通过设置炭-土分离处理可进一步分析生物质炭直接引起的土壤-生物质炭-土壤溶液性质的动态变化,以深入揭示有关机理。
3.1 锰改性生物质炭调节土壤溶液As移动性与形态的作用机制在炭-土分离处理下,隔离袋内BC和MBC与土壤无直接接触,主要通过与外界进行物质交换吸附、转化土壤溶液中的iAs。隔离袋内与MBC直接接触的溶液As(T)和As(Ⅲ)浓度在整个培养期间保持在较低水平(图 2c),且隔离袋外土壤溶液As(T)和As(Ⅲ)的浓度在培养后期明显降低(图 2b),说明隔离带外侧土壤淹水向内侧液持续还原释放的iAs被MBC有效吸附,并将较难吸附的As(Ⅲ)氧化为易吸附的As(Ⅴ)[6]。MBC具有较大的比表面积、丰富的孔隙结构和含氧官能团,可通过表面络合/沉淀机制促进对土壤溶液中iAs的吸附,MBC上的锰氧化物可与As(Ⅴ)形成双齿桥接复合物,增强其对土壤溶液中iAs的专性吸附作用[6,20]。因此MBC上吸附的As含量随着培养时间逐渐增多(图 2d)。
pH对控制土壤iAs释放起着重要作用,通常iAs在土壤上的吸附随pH的增加而降低[21]。添加MBC会提高土壤溶液pH(图 4a),这与Ehlert等[18]研究结果一致,这是由于厌氧条件下锰氧化物还原会导致土壤溶液pH增加。然而,土壤溶液pH提高可能会增加土壤表面负电荷数量从而抑制砷阴离子的吸附[22]。但从研究结果发现MBC显著促进溶液iAs浓度降低(图 2),通过相关性分析可知所有添加MBC处理的土壤溶液pH与As(T/Ⅲ)浓度之间无显著关系(P > 0.05)(图 7),这与Kim等[17]研究结果一致,说明MBC引起的溶液pH升高并不是解释MBC抑制iAs解吸的唯一因素,pH引起的其他因素的变化,例如较高的土壤pH有利于Fe离子的沉淀和络合,这对于解释MBC降低砷迁移性也至关重要[23]。
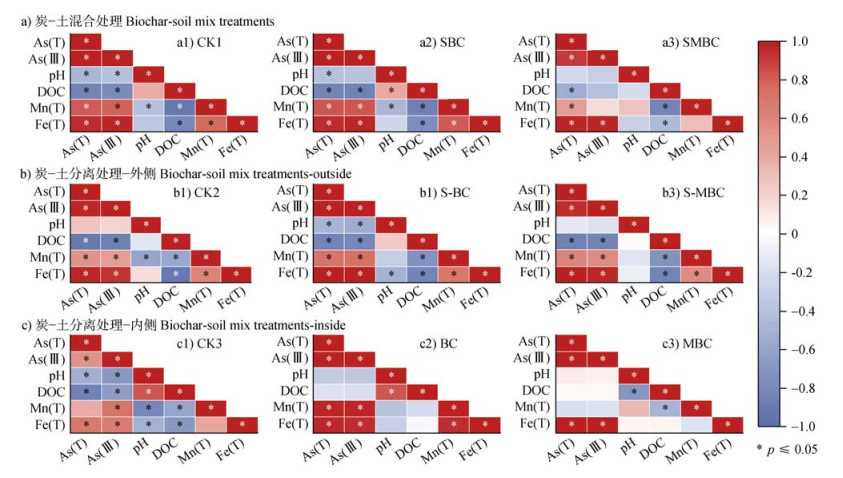
|
注:颜色深浅代表相关性的强弱;红色代表正相关,蓝色代表负相关。 Note: The depth of the color represents the strength of the correlation; red represents a positive correlation, and blue represents a negative correlation. 图 7 炭-土混合处理(a)以及炭-土分离处理外侧(b)和内侧(c)土壤溶液不同性质之间的相关性 Fig. 7 Correlation analysis diagram between different properties of soil solution in the biochar-soil mix treatments (a) and the biochar-soil separation treatments outside (b) and inside (c) |
通过进一步分析发现,添加MBC还显著降低了土壤溶液Fe(T)浓度和土壤有效态Fe含量。生物质炭在水溶液中对Fe离子具有良好的亲和力[24],通过炭-土分离处理检测到隔离袋中MBC在28 d时的Fe含量达到了3.12 mg·g–1(图 6c)。土壤中铁矿物的还原溶解是促进淹水稻田土壤砷释放的重要机制[24],但MBC上的锰氧化物不仅能促进土壤中的As(Ⅲ)向As(Ⅴ)转变,还能促进铁氧化物在厌氧条件下还原溶解产生的Fe(Ⅱ)向FeOOH转变,有助于FeOOH与As(Ⅴ)发生吸附和共沉淀作用[25]。同时,MBC能够促进土壤溶液As(Ⅲ)向As(Ⅴ)转变并释放出大量的Mn(Ⅱ),还原溶解的Mn(Ⅱ)可与As(Ⅴ)形成As(Ⅴ)-Mn(Ⅱ)复合物或重新吸附在MBC或土壤上[26]。此外,Mn(Ⅱ)在固相上的再吸附可增加其表面正电荷,有助于在中性和碱性条件下促进固相对砷阴离子的吸附[27]。McCann等[28]研究还发现Mn(Ⅱ)吸附在材料表面会形成锰氧化物,有助于增加As的吸附位点。先前的研究证实,As(Ⅲ)的氧化在缺氧条件下完全由锰氧化物控制[29],但本研究未添加MBC处理的土壤溶液Mn(T)浓度与As(T/Ⅲ)浓度之间呈正相关(P < 0.05)(图 7),并且其土壤溶液iAs主要以As(Ⅲ)为主(图 2),这说明未添加MBC处理的土壤溶液Mn(T)浓度在3 d时迅速增加可归结于土壤出现厌氧现象后含砷锰矿物的还原溶解,导致固相砷释放至液相中[30]。土壤天然存在的锰氧化物的氧化能力有限,Mn2+、Fe2+和微生物代谢物的积累会使锰氧化物表面迅速钝化,导致锰氧化物氧化As(Ⅲ)的能力受到限制,不能有效地减少As(Ⅲ)的浓度[31]。MBC具有较大的比表面积和丰富的孔隙结构,在淹水的土壤中有助于缓解锰氧化物的钝化、促进As(Ⅲ)的氧化。
此外,大部分处理的土壤溶液DOC与As(T/Ⅲ)浓度之间呈显著负相关(P < 0.05)(图 7),这是由于带负电荷的DOC会与iAs竞争固相土壤的吸附位点,促进砷从土壤固相络合位点中解吸,还会刺激Fe(Ⅲ)还原细菌,促进铁氧化物还原溶解,导致砷释放至土壤溶液中[32]。生物质炭本身含有易于矿化和可提取的可溶性有机碳(图 4c),有研究发现生物质炭通过释放DOC随后与Fe络合来促进土壤中氧化铁的溶解,导致砷迁移性的增加[33]。但就研究结果而言,添加MBC不仅抑制了砷的释放,而且在后续的培养时间里溶液DOC浓度均显著低于CK,这是由于MBC对DOC具有一定的亲和力,可能促进DOC特异性吸附固定砷,或与Fe和As形成DOC-Fe-As三元复合物[16]。
3.2 锰改性生物质炭调节土壤As赋存形态的作用机制从炭-土混合处理可以看出,在持续的淹水培养下,添加锰改性生物质炭MBC可促进土壤有效态As含量保持在稳定的范围内(图 3a1),显著降低土壤有效态As含量。通过炭-土分离处理进一步发现隔离袋外土壤有效态As含量呈逐渐降低的趋势,在28 d时达到了与炭-土混合处理SMBC相近的值(图 3a2),说明MBC可通过吸附-氧化土壤溶液中游离态As使土壤有效态As含量缓慢降低,并达到稳定水平。另一方面,由炭-土混合处理可明显看出添加MBC能显著增加土壤有效态Mn含量(图 5b1),并降低有效态Fe含量(图 6b1),有助于酸可提取态As向相对稳定的As形态转变(图 3b1)。而与CK2相比,未改性生物质炭对土壤有效态Mn、Fe含量无显著影响(P > 0.05),甚至在28 d时有效态As含量显著增加(P < 0.05),且酸可提取态As占比高于CK1,这与大多数研究结果[7,34]一致,即添加BC可能会促进砷在土壤中迁移,导致砷的有效性增加,并抑制酸可提取态As向相对稳定的As形态转变。根据炭-土分离处理进一步分析发现,与CK2相比,BC和MBC在7 d时均显著提高了土壤砷的有效性(P < 0.05)(图 3a2),这可能是由于生物质炭上的可溶态灰分元素如Mn、钾、钙、镁可增加土壤的盐基饱和度导致土壤溶液pH增加(图 4a2),提高了土壤中砷的静电排斥力[11,23]。此外,生物质炭释放DOC至外侧土壤溶液中也很可能与As竞争吸附至土壤颗粒上,从而增强土壤砷的迁移率[17]。然而,随着培养时间延长,BC和MBC均能逐渐降低隔离袋外侧土壤有效态As含量(与CK2相比)(图 3a2),对其他重金属有效性的变化趋势也较为相似(图 5b2,图 6b2)。其中MBC更能促进外侧土壤有效态As、Fe含量的降低,并增加有效态Mn含量。MBC上部分锰氧化物通过氧化还原过程释放出Mn离子由溶液进入土壤中会增加土壤有效态Mn含量,并随着培养时间而逐渐降低(图 5b2),而铁锰结合态As(F2)占比逐渐增多(图 3b2),说明有效态Mn参与并增强了As的固定化。此外,MBC与土壤无直接接触的情况下也能明显降低外侧土壤有效态Fe含量,但在28 d时较CK2略有增加,这可能是由于水铁矿还原转化为磁铁矿的过程中会产生一段时间的As(Ⅲ)滞留,即次生铁相固定As(Ⅲ),但长时间的铁还原和和孔隙水置换过程中化学失衡可能会导致As(Ⅲ)释放[35],这也引起了土壤有效态Fe的增加。通过对比炭-土分离处理下As和Fe在生物质炭上的含量(图 2d,图 6c)可知,负载锰氧化物增强了生物质炭对Fe、As的吸附,且MBC对Fe的亲和力远高于As。很多研究表明锰氧化物可通过对Fe(Ⅱ)和As(Ⅲ)的快速氧化促进As(Ⅴ)吸附至新形成的Fe(Ⅲ)氧化物中来增强As的保留[14],因此,MBC也可通过吸附Fe来促进As的固定。但Fe(Ⅱ)与As(Ⅲ)产生竞争性氧化以及Fe(Ⅲ)、Mn(Ⅱ)对MBC的钝化作用可能会阻碍As(Ⅲ)的氧化[18],由生物质炭上Mn含量的动态变化可知其在7~28 d时无显著性差异(P > 0.05)(图 5c),进一步说明MBC上的锰氧化物可能由于钝化作用而不能完全参与氧化还原过程。
3.3 锰改性生物质炭促进土壤砷固定的潜在路径本研究通过炭-土混合和分离处理对比各自对照,总结MBC调控砷在土壤溶液向土壤固定的主要路径。在淹水条件下,MBC可通过溶液吸附-释放Mn、Fe、DOC等物质,直接或间接引起土壤化学性质变化从而影响土壤溶液和土壤中砷的迁移转化,包括MBC负载的锰氧化物对溶液中As(Ⅲ)和Fe(Ⅱ)的氧化作用,产生的Fe(Ⅲ)以及Mn(Ⅱ)可与As(Ⅴ)形成复合物或吸附在固相上增强对溶液iAs的固定[6];其次,MBC向溶液释放出大量DOC短期内会与iAs对土壤上的吸附位点产生竞争吸附,但长期培养下可能会促进形成DOC-As和DOC-Fe-As复合物[16];此外,MBC自身具有的巨大比表面积和丰富孔隙结构(表 1)也能促进iAs的吸附固定,还能缓解淹水条件下锰氧化物的钝化作用,有助于溶液As(Ⅲ)持续氧化。因此,尽管淹水土壤铁、锰矿物的还原溶解导致固相砷释放至液相中,但添加MBC能抑制铁矿物的还原溶解,降低土壤有效态Fe含量,但增加土壤有效态Mn含量,进而促进固相对As的保留和固定化,并促进土壤有效态As向相对稳定的可还原态、可氧化态和残渣态As转变,从而降低土壤砷的有效性和迁移性。
4 结论本研究采用土壤淹水培养试验,通过炭-土混合和分离处理对比分析锰改性生物质炭(MBC)对土壤液相-固相系统中砷迁移和转化的影响。结果发现,与对照和未改性生物质炭相比,MBC显著提升交换、吸附土壤溶液中iAs的能力。MBC上负载的锰氧化物显著促进溶液As(Ⅲ)氧化为As(Ⅴ),在培养期间始终维持低浓度As(Ⅲ)(0.02~0.88 mg·L–1)。同时,MBC向土壤溶液中释放的Mn离子易与游离态As(Ⅴ)形成沉淀,促进iAs在固相上吸附。此外,MBC上Fe含量随时间不断增加,说明MBC对Fe离子表现出较好的亲和力,并通过MBC上锰氧化物的还原提高土壤溶液pH进而促进Fe离子在固相中沉淀,从而进一步增强固相对溶液iAs的吸附。MBC负载的锰氧化物还能抑制固相铁矿物还原溶解,促进土壤有效态Fe和As含量显著降低(P < 0.05)。因此,添加MBC能促进土壤有效态As向更稳定的铁锰结合态和残渣态As转变,阻碍土壤砷重新分配到土壤溶液中,使土壤有效态As含量稳定在较低的范围内。
| [1] |
An L H, Liu M C, Zhang J Q, et al. Sources of arsenic in soil and affecting factors of migration and release: A review (In Chinese)[J]. Soils, 2020, 52(2): 234-246. [安礼航, 刘敏超, 张建强, 等. 土壤中砷的来源及迁移释放影响因素研究进展[J]. 土壤, 2020, 52(2): 234-246.]
(  0) 0) |
| [2] |
Cao R, Wang Y, Chen S, et al. Research progress on in-situ passivation remediation technology of cadmium and arsenic compound contaminated paddy soil (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(3): 657-672. DOI:10.11766/trxb202112170524 [曹锐, 王悦, 陈爽, 等. 镉砷复合污染水稻土原位钝化修复技术研究进展[J]. 土壤学报, 2023, 60(3): 657-672.]
(  0) 0) |
| [3] |
Tan X F, Liu Y G, Zeng G M, et al. Application of biochar for the removal of pollutants from aqueous solutions[J]. Chemosphere, 2015, 125: 70-85. DOI:10.1016/j.chemosphere.2014.12.058
(  0) 0) |
| [4] |
Gao X, Peng Y T, Guo L L, et al. Arsenic adsorption on layered double hydroxides biochars and their amended red and calcareous soils[J]. Journal of Environmental Management, 2020, 271: 111045. DOI:10.1016/j.jenvman.2020.111045
(  0) 0) |
| [5] |
Zhang K, Yi Y Q, Fang Z Q. Remediation of cadmium or arsenic contaminated water and soil by modified biochar: A review[J]. Chemosphere, 2023, 311: 136914. DOI:10.1016/j.chemosphere.2022.136914
(  0) 0) |
| [6] |
Huang Q, Tong F, Gao Y, et al. Enhanced simultaneous arsenite oxidation and sorption by Mn-modified biochar: Insight into the mechanisms under optimal modification condition[J]. Journal of Environmental Chemical Engineering, 2023, 11(3): 109612. DOI:10.1016/j.jece.2023.109612
(  0) 0) |
| [7] |
Liu M, Sun F X, Lv Y Z, et al. Remediation of arsenic-contaminated soil by nano-zirconia modified biochar[J]. Environmental Science and Pollution Research, 2021, 28(48): 68792-68803. DOI:10.1007/s11356-021-15362-8
(  0) 0) |
| [8] |
Wu C, Cui M Q, Xue S G, et al. Remediation of arsenic-contaminated paddy soil by iron-modified biochar[J]. Environmental Science and Pollution Research, 2018, 25(21): 20792-20801. DOI:10.1007/s11356-018-2268-8
(  0) 0) |
| [9] |
Wang Y K, Liang T, Zhou G P, et al. Cadmium adsorption characteristics of different biochar and their regulatory effects on soil Cd pollution, in Yunnan (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(1): 151-162. DOI:10.11766/trxb202205300286 [王一锟, 梁婷, 周国朋, 等. 不同生物质炭的镉吸附特征及对云南土壤镉污染的调控效应[J]. 土壤学报, 2024, 61(1): 151-162.]
(  0) 0) |
| [10] |
Feng Z J, Fan Z L, Song H P, et al. Biochar induced changes of soil dissolved organic matter: The release and adsorption of dissolved organic matter by biochar and soil[J]. Science of the Total Environment, 2021, 783: 147091. DOI:10.1016/j.scitotenv.2021.147091
(  0) 0) |
| [11] |
Zhang W, Cho Y, Vithanage M, et al. Arsenic removal from water and soils using pristine and modified biochars[J]. Biochar, 2022, 4(1): 55. DOI:10.1007/s42773-022-00181-y
(  0) 0) |
| [12] |
Ren X H, He J Y, Chen Q, et al. Marked changes in biochar's ability to directly immobilize Cd in soil with aging: Implication for biochar remediation of Cd-contaminated soil[J]. Environmental Science and Pollution Research, 2022, 29(49): 73856-73864. DOI:10.1007/s11356-022-21000-8
(  0) 0) |
| [13] |
Lu R K. Analytical methods for soil and agrochemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [14] |
Leksungnoen P, Wisawapipat W, Ketrot D, et al. Biochar and ash derived from silicon-rich rice husk decrease inorganic arsenic species in rice grain[J]. Science of the Total Environment, 2019, 684: 360-370. DOI:10.1016/j.scitotenv.2019.05.247
(  0) 0) |
| [15] |
Abbas M H H, Abdelhafez A A. Role of EDTA in arsenic mobilization and its uptake by maize grown on an As-polluted soil[J]. Chemosphere, 2013, 90(2): 588-594. DOI:10.1016/j.chemosphere.2012.08.042
(  0) 0) |
| [16] |
Li G, Khan S, Ibrahim M, et al. Biochars induced modification of dissolved organic matter (DOM) in soil and its impact on mobility and bioaccumulation of arsenic and cadmium[J]. Journal of Hazardous Materials, 2018, 348: 100-108. DOI:10.1016/j.jhazmat.2018.01.031
(  0) 0) |
| [17] |
Kim H B, Kim S H, Jeon E K, et al. Effect of dissolved organic carbon from sludge, rice straw and spent coffee ground biochar on the mobility of arsenic in soil[J]. Science of the Total Environment, 2018, 636: 1241-1248. DOI:10.1016/j.scitotenv.2018.04.406
(  0) 0) |
| [18] |
Ehlert K, Mikutta C, Kretzschmar R. Effects of manganese oxide on arsenic reduction and leaching from contaminated floodplain soil[J]. Environmental Science & Technology, 2016, 50(17): 9251-9261.
(  0) 0) |
| [19] |
Huang R, Wang X, Xing B S. Removal of labile arsenic from flooded paddy soils with a novel extractive column loaded with quartz-supported nanoscale zero-valent iron[J]. Environmental Pollution, 2019, 255: 113249. DOI:10.1016/j.envpol.2019.113249
(  0) 0) |
| [20] |
Bi L Y, Li Z R, Wang L, et al. Evolution of δ-MnO2 in environment and its interaction with metal ions: A review (In Chinese)[J]. Soils, 2023, 55(5): 935-942. [毕莉艳, 李祖然, 王磊, 等. δ-MnO2在环境中的演化及其与金属离子的相互作用研究进展[J]. 土壤, 2023, 55(5): 935-942.]
(  0) 0) |
| [21] |
Karczewska A, Lewińska K, Siepak M, et al. Transformation of beech forest litter as a factor that triggers arsenic solubility in soils developed on historical mine dumps[J]. Journal of Soils and Sediments, 2018, 18(8): 2749-2758. DOI:10.1007/s11368-018-2031-2
(  0) 0) |
| [22] |
Zheng R L, Cai C, Liang J H, et al. The effects of biochars from rice residue on the formation of iron plaque and the accumulation of Cd, Zn, Pb, As in rice (Oryza sativa L.) seedlings[J]. Chemosphere, 2012, 89(7): 856-862. DOI:10.1016/j.chemosphere.2012.05.008
(  0) 0) |
| [23] |
Xu Q, Xu Q Y, Zhu H, et al. Does biochar application in heavy metal-contaminated soils affect soil micronutrient dynamics?[J]. Chemosphere, 2022, 290: 133349. DOI:10.1016/j.chemosphere.2021.133349
(  0) 0) |
| [24] |
Sorrenti G, Masiello C A, Toselli M. Biochar interferes with kiwifruit Fe-nutrition in calcareous soil[J]. Geoderma, 2016, 272: 10-19. DOI:10.1016/j.geoderma.2016.02.017
(  0) 0) |
| [25] |
Kappler A, Bryce C, Mansor M, et al. An evolving view on biogeochemical cycling of iron[J]. Nature Reviews Microbiology, 2021, 19(6): 360-374. DOI:10.1038/s41579-020-00502-7
(  0) 0) |
| [26] |
Ajith N, Bhattacharyya K, Ipte P R, et al. Interaction of arsenic (Ⅲ) and arsenic (Ⅴ) on manganese dioxide: XPS and electrochemical investigations[J]. Journal of Environmental Science and Health, Part A, 2019, 54(4): 277-285. DOI:10.1080/10934529.2018.1544478
(  0) 0) |
| [27] |
Ociński D, Jacukowicz-Sobala I, Mazur P, et al. Water treatment residuals containing iron and manganese oxides for arsenic removal from water-Characterization of physicochemical properties and adsorption studies[J]. Chemical Engineering Journal, 2016, 294: 210-221. DOI:10.1016/j.cej.2016.02.111
(  0) 0) |
| [28] |
McCann C M, Peacock C L, Hudson-Edwards K A, et al. In situ arsenic oxidation and sorption by a Fe-Mn binary oxide waste in soil[J]. Journal of Hazardous Materials, 2018, 342: 724-731. DOI:10.1016/j.jhazmat.2017.08.066
(  0) 0) |
| [29] |
Ying S C, Kocar B D, Fendorf S. Oxidation and competitive retention of arsenic between iron- and manganese oxides[J]. Geochimica et Cosmochimica Acta, 2012, 96: 294-303. DOI:10.1016/j.gca.2012.07.013
(  0) 0) |
| [30] |
Li B Y, Zhou S, Wei D N, et al. Mitigating arsenic accumulation in rice (Oryza sativa L.) from typical arsenic contaminated paddy soil of southern China using nanostructured α-MnO2: Pot experiment and field application[J]. Science of the Total Environment, 2019, 650: 546-556. DOI:10.1016/j.scitotenv.2018.08.436
(  0) 0) |
| [31] |
Xu X W, Chen C, Wang P, et al. Control of arsenic mobilization in paddy soils by manganese and iron oxides[J]. Environmental Pollution, 2017, 231: 37-47. DOI:10.1016/j.envpol.2017.07.084
(  0) 0) |
| [32] |
Fang W, Yang D X, Williams P N, et al. Distinct response of arsenic speciation and bioavailability to different exogenous organic matter in paddy soil[J]. Chemosphere, 2022, 309: 136653. DOI:10.1016/j.chemosphere.2022.136653
(  0) 0) |
| [33] |
Kim H B, Kim J G, Choi J H, et al. Photo-induced redox coupling of dissolved organic matter and iron in biochars and soil system: Enhanced mobility of arsenic[J]. Science of the Total Environment, 2019, 689: 1037-1043. DOI:10.1016/j.scitotenv.2019.06.478
(  0) 0) |
| [34] |
Wang N, Xue X M, Juhasz A L, et al. Biochar increases arsenic release from an anaerobic paddy soil due to enhanced microbial reduction of iron and arsenic[J]. Environmental Pollution, 2017, 220: 514-522. DOI:10.1016/j.envpol.2016.09.095
(  0) 0) |
| [35] |
Tufano K J, Fendorf S. Confounding impacts of iron reduction on arsenic retention[J]. Environmental Science & Technology, 2008, 42(13): 4777-4783.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


