土壤有机碳(Soil organic carbon,SOC)是陆地生态系统最重要的活性碳库,其碳储量为植被碳库的3倍~4倍、大气碳库的2倍~3倍,SOC库的微小变化就可能对大气二氧化碳浓度产生显著影响[1],从而影响全球气候变暖。近年来,关于SOC形成与稳定机制的认知已逐渐从早期的腐殖质理论转变为由微生物转化和调控[2-4]。微生物可通过“体外修饰”和“体内周转”两条途径调控SOC的积累[2-3],“体外修饰”是指大分子植物来源的碳在微生物或者胞外酶的作用下分解转化,最终导致植物源有机碳在土壤中积累的过程;“体内周转”是指植物源碳被微生物摄取后,经过合成代谢、细胞生长以及细胞死亡等一系列周转,最终以微生物残体碳(Microbial necromass carbon,MNC)的形式在土壤中积累的过程,由于这些通过微生物的“体内周转”而进入稳定SOC库的碳化合物均源自于微生物细胞,所以该过程被形象的称作土壤“微生物碳泵”(Microbial carbon pump,MCP)[2-3]。研究表明,微生物残体通常较难分解,并且常与矿物结合,从而得到保护,它们对SOC的贡献可达50%~80%,在SOC的长期保存中发挥着关键作用[2-4]。近一个多世纪以来,由于工业化的迅速发展和人口的激增,大气中的氮和磷沉降量显著增加,这与SOC以及氮和磷的循环紧密相关[5-6],因此,了解氮和磷输入对MNC的影响及调控机制有助于深入理解微生物介导的碳储存过程及其对全球变化的响应。
氮和磷是植物、微生物生长的限制性养分,氮和磷通过影响微生物残体的产生、改变微生物胞外酶活性、调控土壤矿物含量等,直接影响土壤中MNC的产生、分解及稳定[7-10]。例如,在亚热带森林进行的一项为期5.5年的氮添加实验表明[8],氮添加会增加植物和0~10 cm土层中微生物对磷的需求,这会使得具有较高磷获取能力的真菌丰度增加,并最终增加了0~10 cm土层中的MNC。在亚热带人工林进行的另一项为期12年的氮磷添加实验表明[9],磷添加和氮磷同时添加会降低酸性磷酸酶的活性以及微生物残体受到的矿物保护,从而减少MNC的积累;此外,对于不同土壤深度而言,磷添加和氮磷同时添加时20~40 cm土层中MNC的减少更多,主要是因为在0~20 cm土层中,养分添加导致的微生物生物量增加(MNC的产生增加)减缓了MNC的下降趋势;在亚高山森林进行的一项为期8年的磷添加实验表明[10],磷添加会使土壤氮有效性增加,这会降低氮获取酶的活性,从而减少微生物残体的分解,促进MNC的积累。而在高寒草地进行的一项为期4年的氮磷添加实验表明[11],养分添加对MNC总量无显著影响,但是氮磷添加显著降低了微生物的碳利用效率从而降低了SOC,导致MNC对SOC的贡献增加。由此可见,氮磷添加对MNC的影响已被广泛研究,然而,土壤中的MNC是微生物残体长期积累的产物,在积累过程中也伴随着微生物残体的周转和再利用,单位微生物生物量积累的微生物残体决定了MNC的积累效率,效率高的系统有利于通过微生物转化途径进行土壤碳固持[12]。因此,除MNC之外,还应考虑MNC的积累效率对氮磷添加的响应及调控机制。
尽管微生物生物量碳(MBC)占SOC的比例极小(不足4%),但微生物周转快速,在微生物死亡后,其残体可在土壤中迭代积累[13]。仅有的几项研究利用MNC与MBC的比值(MNC/MBC)、MNC与磷脂脂肪酸(PLFA)的比值(MNC/PLFA)来估算单位微生物生物量积累的微生物残体数量,即微生物残体的积累效率[12,14-15]。由于MBC的数据更易获得,因此MNC/MBC更适合推广至全球尺度对微生物残体积累效率进行研究[12],MNC/MBC高的生态系统表明其可通过微生物体内途径合成更多的MNC并稳定积累在土壤中,有利于SOC固持,反之则不利于SOC积累。Han等[12]将该比值称为微生物残体积累系数(Necromass accumulation coefficient,NAC),他们通过Meta分析计算了不同生态系统的NAC,结果发现森林、农田和草地土壤中NAC的均值分别为26.8、28.2和21.1,同时,NAC与SOC的显著正相关关系验证了土壤MCP在促进SOC积累中的重要作用,文章同时指出微生物丰度和微生物生物量氮(MBN)是NAC的关键驱动因素。Zhang等[15]估算了青藏高原天然草地土壤的NAC,其范围区间为3.9~59.6,进一步的结构方程模型分析发现较低的干旱指数和净初级生产力限制了青藏高原草地土壤微生物残体对SOC的贡献。作为衡量微生物将可利用碳转化为稳定微生物残体碳的关键指标,对比不同生态系统下的NAC并研究其对全球变化的响应对预测SOC动态有直接指导意义。然而,目前尚未有研究关注NAC对氮磷添加的响应。
青藏高原是世界上最高、最大的高原,其高海拔和低温的地理环境使得其对气候变化非常敏感[16]。近年来青藏高原氮沉降明显,并具有逐年增加的趋势,人为活动也导致磷输入大量增加[6]。青藏高原在0.75 m的土层中储存了49 Pg的有机碳,相当于全球土壤碳库的3.6%[17],其动态可能会受到氮磷输入的强烈影响。因此研究该区域NAC对氮磷添加的响应,对理解区域和全球碳平衡具有重要意义。本研究拟依托青海海北高寒草地生态系统国家野外科学观测研究站的高寒草地养分添加实验平台,探讨短期和长期氮磷添加对不同深度土壤中NAC的影响,以期为草甸土壤碳固存提供理论依据。
1 材料与方法 1.1 研究区概况研究区位于青藏高原东北部的海北高寒草地生态系统国家野外科学观测研究站(本文简称“海北站”)。海北站位于祁连山北支冷龙岭东段南麓,大通河河谷的西北部(37°36′ N,101°19′ E,海拔约3 215 m)。气候类型属于典型的高原大陆性气候,一年中无明显的四季之分,按照植物生长周期通常将全年分为非生长季(10月—次年4月)和生长季(5—9月),生长季相对温暖湿润,非生长季寒冷干燥。1982—2014年均温为–1.2℃,其中最冷月(1月)和最热月(7月)的平均气温分别为–14.5℃和10.4℃,年降水量为485 mm,84%的降水集中在每年的生长季,呈现雨热同期的特点[6]。该地区的土壤类型主要为高寒沼泽土、高寒草甸土和高寒灌丛土,土壤平均厚度为65 cm。草地植被以多年生草本植物为主,植物优势种为矮嵩草(Kobresiahumilis)、早熟禾(Poacrymophila)、异针茅(Stipaaliena)、垂穗披碱草(Elymusnutans)等,同时也包含少数灌木,如矮生忍冬(Loniceraminuta)[6]。
1.2 试验设计养分添加实验平台建立于2009年,于2011年正式开始进行养分添加处理。样地共设计6个区组,每个区组包含随机设置的6个养分添加处理(6 m×6 m):对照组(CK,未进行任何处理),三个水平的氮添加处理(N1,25 kg·hm–2·a–1(以N计,下同);N2,50 kg·hm–2·a–1;N,100 kg·hm–2·a–1),磷添加处理(P,50 kg·hm–2·a–1(以P计,下同)),氮磷同时添加处理(NP,100 kg·hm–2·a–1+ 50 kg·hm–2·a–1),共计36个小区。施加的氮肥为尿素,磷肥为磷酸钙。本研究选取了CK、N、P、NP四个处理,每个处理选取三个重复。为避免不同处理之间相互干扰,在区组之间和小区之间分别设置了2 m和1 m的缓冲带(图 1)。施肥前将肥料分为三等份,在每年6—8月的月初由人工均匀播撒在样地内。施肥时间尽量选择在降雨活动前或太阳落山后,以利用雨水或次日的露水溶解肥料,减少肥料挥发并且使其更易渗透至土壤中。

|
图 1 养分添加试验设计 Fig. 1 Experimental design of nutrient addition |
采用样方收获法获取植物地上生物量,样方面积为25 cm×25 cm,样方框位置随机选取。将齐地面收割的植物样品置于烘箱内(65℃,48 h)烘干称重后计算植物地上生物量(AGB)。采用根钻法获取植物根系样品,根钻直径为7 cm,每个处理随机取3孔。使用冲洗法获取土层根系后,置于烘箱内(65℃,48 h)烘干称重,计算植物地下生物量(BGB)。
1.4 土壤样品采集土壤样品采集时间为每年的8月下旬(生长季后期),从每个样方不同深度随机取3个完整的土芯(直径5 cm),并充分混合均匀。本研究选取2012年和2020年的0~10 cm和20~30 cm土层的土壤样品进行分析,2012年的土壤样品从-80℃取出置于4℃解冻进行后续分析,2020年的土壤样品带回实验室后立即进行后续分析,样品均过2 mm土筛并去除可见的根和石砾。
1.5 土壤理化性质测定在测定SOC前先用1 mol·L−1盐酸去除土壤中的无机碳[18],然后采用有机碳和元素碳全自动分析仪(Primacs ATC 100-IC-E,Skalar,荷兰)测定SOC。采用元素分析仪(Vario EL III,Elementar,德国)测定土壤全氮(Total nitrogen,TN)。土壤中的全磷(Total phosphorus,TP)用高氯酸-浓硫酸消解法提取[19],用钼锑抗比色法测定。采用pH计测定土壤的pH(土水比1︰2.5)[19]。使用氯仿熏蒸法测定MBC和MBN[20-21],经0.5 mol·L−1硫酸钾溶液浸提后,利用TOC分析仪(Elementar vario TOC,德国)测定浸提液的有机碳和氮浓度。未熏蒸土壤的有机碳记为可溶性有机碳(Dissolved organic carbon,DOC)[22]。MBC和MBN可通过熏蒸和未熏蒸土壤间有机碳和氮的差计算,校正系数分别为0.45和0.54[23]。土壤无机氮可用氯化钾浸提法测定,首先用2 mol·L−1氯化钾溶液浸提土壤样品(土壤:氯化钾溶液=1︰10),浸提液再利用全自动间断化学分析仪(Smart chem 450,意大利)测得铵态氮(NH4+)[19]。使用激光粒度分析仪(Malvern Mastersizer 2000,英国)测定土壤质地[24]。
1.6 土壤微生物胞外酶活测定本研究测定了参与土壤中碳、氮和磷循环的6种微生物胞外酶活性[25],包括与土壤碳循环有关的α-1,4-葡萄糖苷酶(α-1,4-glucosidase,AG)和β-1,4-葡萄糖苷酶(β-1,4-glucosidase,BG),与土壤氮循环有关的β-1,4-N-乙酰氨基葡葡糖苷酶(β-1,4-Nacetyl-glucosaminnidase,NAG)和亮氨酸氨基肽酶(Leucine aminopeptidase,LAP),与土壤磷循环有关的酸性磷酸酶(Acid phosphatase,AP),以及酚氧化酶(Phenol oxidase,PO)。将200 μL土壤悬浮液和50 μL酶底物分别加入96孔微孔板中。AG、BG和AP的活性以4-甲基伞形酮为底物测定,LAP的活性以7-氨基-4-甲基香豆素为底物测定,NAG的活性以4-甲基香豆素-2-乙酰氨基为底物测定,微孔板在25℃黑暗条件下培养4 h。PO的活性以L-3,4-二羟基苯丙氨为底物进行测定,微孔板在25℃黑暗条件下培养3 h。培养结束后立即借助多功能酶标仪(Synergy Mx,BioTek Instruments Inc,美国)测定土壤胞外酶活性。
1.7 氨基糖含量测定参照Zhang等[26]的方法提取土壤中的氨基糖。(1)水解及纯化:向一定量冻干土中加入10 mL 6 mol·L−1盐酸,105℃下水解8 h,冷却后加入肌醇,过滤后将滤液旋转蒸发至干燥,调pH至6.6~6.8。离心取上清液旋转蒸发至干燥,加入超纯水和N-甲基氨基葡萄糖后冻干。(2)衍生化:依次加入衍生试剂和乙酸酐并分别加热,冷却后加入二氯甲烷。过量试剂通过盐酸和超纯水萃取3次去除,剩余样品经氮吹干燥后溶解于乙酸乙酯和正己烷混合液中,借助气相色谱-质谱联用仪(GC-MS;QP2020,Shimadzu,日本)对氨基糖进行定量。氨基葡萄糖(GluN)和胞壁酸(MurA)用来计算真菌残体碳(FNC)和细菌残体碳(BNC)。FNC、BNC和MNC的计算公式如下[2]:
| $ \mathsf{FNC =(GluN/179.2−2×MurA/251.2)×179.2×9} $ | (1) |
| $ \mathsf{BNC = MurA×45}$ | (2) |
| $ \mathsf{MNC = FNC+BNC} $ | (3) |
式(1)中,179.2和251.2为GluN和MurA的分子量;2为假设细菌细胞壁中GluN和MurA的摩尔比为2:1;9为真菌来源的GluN与FNC的转化系数;式(2)中45为细菌来源的MurA与BNC的转化系数。
参照Han等[12]的方法利用以下公式计算NAC:
| $ \mathsf{NAC = MNC/MBC} $ | (4) |
数据进行统计分析前,首先检验数据是否符合正态分布。如果数据不是正态分布,采用非参数检验(克鲁斯卡尔-沃利斯(Kruskal-Wallis H)或威尔科克森(Wilcoxon))。使用单因素方差分析比较氮、磷添加处理间MNC、MBC以及NAC的差异。使用双因素方差分析检验氮磷添加处理、土壤深度和二者的交互作用对土壤MNC、MBC以及NAC的影响。使用皮尔森相关性分析法对NAC与各因子之间进行相关性分析,在进行相关性分析之前,所有变量均经过lg变换。冗余分析展示了土壤理化性质、微生物胞外酶活性和植物生物量对MNC、MBC以及NAC的影响。随机森林模型用于检验影响NAC的相关因子的重要性,均方误差(Mean squared error,MSE)增加的百分比用于表示变量的相对重要性,每个因子的显著性用“rfpermute”包评估。使用SPSS 24.0和R 4.3.2软件对以上数据进行统计分析和作图,显著性水平为P < 0.05。
2 结果 2.1 短期和长期养分添加对土壤理化性质的影响短期和长期养分添加对土壤理化性质的影响如表 1所示。短期养分添加后,与CK相比,氮添加对不同土壤理化性质均无显著影响,磷添加显著降低了20~30 cm土层的DOC和pH(P < 0.05),氮磷同时添加显著增加了0~10 cm土层的TP(P < 0.05),显著降低了0~10 cm和20~30 cm土层的DOC(P < 0.05)以及20~30 cm土层的pH(P < 0.05)。长期养分添加后,氮添加显著增加了0~10 cm土层的SOC(P < 0.05),显著降低了20~30 cm土层的pH(P < 0.05);磷添加显著增加了0~10 cm土层的TP和黏粒+粉粒(P < 0.05),显著降低了20~30 cm土层的pH(P < 0.05);氮磷同时添加显著增加了0~10 cm土层的SOC和TP(P < 0.05),显著降低了0~10 cm和20~30 cm土层的pH(P < 0.05)。
|
|
表 1 短期和长期氮磷添加下的土壤理化性质 Table 1 Effects of short-term and long-term nitrogen and phosphorus additions on soil physicochemical properties |
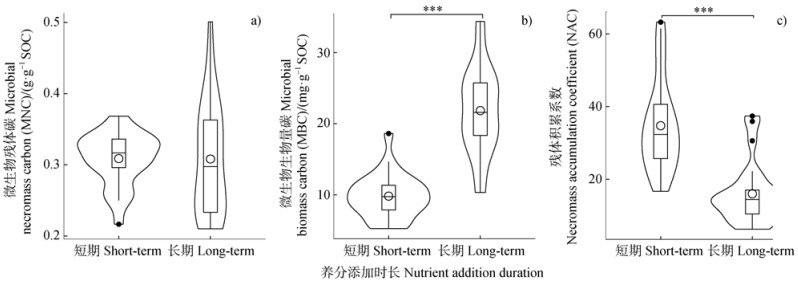
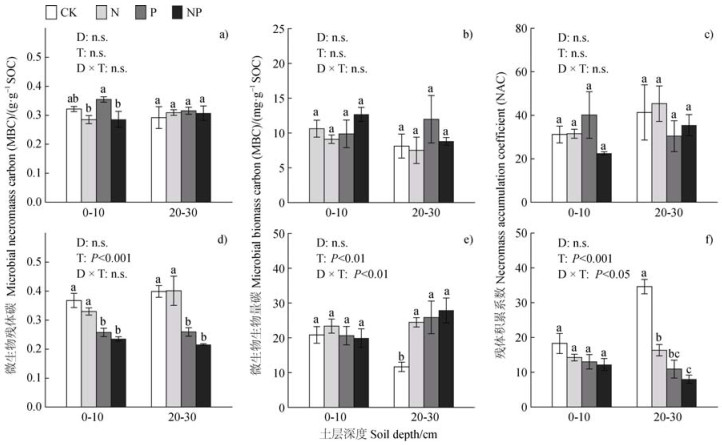
短期和长期养分添加后,MNC的平均含量分别为0.31±0.01和0.31±0.02 g·g–1 SOC,短期和长期养分添加后的MNC无显著差异(图 2a)。其中短期养分添加后0~10 cm和20~30 cm土层的MNC平均含量均为0.31±0.01 g·g–1 SOC,两土层间无显著差异(图 3a)。长期养分添加后0~10 cm和20~30 cm土层的MNC平均浓度分别为0.30±0.02和0.32±0.03 g·g–1 SOC,两土层间无显著差异(图 3d)。短期养分添加后,与CK相比,0~10 cm和20~30 cm土层的MNC均无显著改变(图 3a)。长期养分添加后,与CK相比,磷和氮磷同时添加显著降低了0~10 cm和20~30 cm土层的MNC(P < 0.05;图 3d),氮添加对其无显著影响(图 3d)。
|
注:1)小提琴形状表示数据的频率分布,小提琴的上下须帽分别表示数据中的最大值和最小值。2)小提琴内方框的上端和下端分别表示25%和75%分位数,方框内的实线和圆圈分别表示每组数据的中位数和平均数。3)***表示显著性水平为P < 0.001。 Note: 1)The shape of the violin indicates the frequency distribution of the data, and the upper and lower whiskers of the violin indicate the maximum and minimum values in the data, respectively. 2)The upper and lower ends of the box inside the violin represent the 25% and 75% quantile, respectively, and the solid line and circle inside the box represent the median and mean of each data set, respectively. 3)*** indicates significance level of P < 0.001. 图 2 短期和长期氮磷添加后的微生物残体碳(a)、微生物生物量碳(b)、残体积累系数(c) Fig. 2 Microbial necromass carbon(a), microbial biomass carbon(b), and necromass accumulation coefficient(c)after short- and long-term nitrogen and phosphorus additions |
|
注:图中展示了土层深度(D)、养分添加处理(T)以及二者的交互影响(D × T)。不同小写字母表示指标在相同深度不同处理间的差异显著(P < 0.05)。n.s.表示差异不显著。 Note: The effects of soil depths(D), nutrient addition treatments(T), and their interaction(D × T)are shown. Different lowercase letters indicate significant differences(P < 0.05)between treatments at the same depth for the indicator. n.s. indicates non-significant differences. 图 3 短期(a~c)和长期(d~f)氮磷添加对不同土层微生物残体碳(a,d)、微生物生物量碳(b,e)、残体积累系数(c,f)的影响 Fig. 3 Effects of short-term(a~c)and long-term(d~f)nitrogen and phosphorus additions on microbial necromass carbon(a, d), microbial biomass carbon(b, e), and necromass accumulation coefficients(c, f)in different soil layers |
短期和长期养分添加后,MBC的平均含量分别为9.83±0.63和21.84±1.27 mg·g–1 SOC,长期养分添加后的MBC显著高于短期养分添加(P < 0.001;图 2b)。其中短期养分添加后0~10 cm和20~30 cm土层的MBC平均浓度分别为10.57±0.66和9.10± 1.10 mg·g–1 SOC,两土层间无显著差异(图 3b)。长期养分添加后0~10 cm和20~30 cm土层的MBC平均含量分别为21.20±1.11和22.48±2.33 mg·g–1 SOC,两土层间无显著差异(图 3e)。短期养分添加后,与CK相比,0~10 cm和20~30 cm土层的MBC均无显著改变(图 3b)。长期养分添加后,与CK相比,氮、磷和氮磷同时添加均显著增加了20~30 cm土层的MBC(P < 0.05),0~10 cm土层的MBC对氮磷添加无显著响应(图 3e)。
2.4 短期和长期养分添加对NAC的影响短期和长期养分添加后,NAC分别为34.73±2.60和15.97±1.70,长期养分添加后的NAC显著低于短期养分添加(P < 0.001;图 2c)。其中短期养分添加后0~10 cm和20~30 cm土层的NAC分别为31.33±2.97和38.12±3.90,两土层间无显著差异(图 3c)。长期养分添加后0~10 cm和20~30 cm土层的NAC分别为14.46±1.12和17.49±3.22,两土层间无显著差异(图 3f)。短期养分添加后,与CK相比,0~10 cm和20~30 cm土层的NAC均无显著改变(图 3c)。长期养分添加后,与CK相比,氮、磷和氮磷同时添加均显著降低了20~30 cm土层的NAC(P < 0.05;图 3f),0~10 cm土层的NAC对氮磷添加无显著响应(图 3f)。
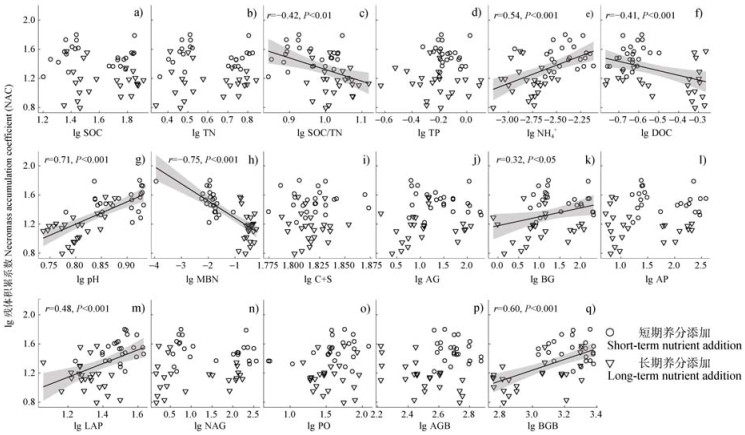
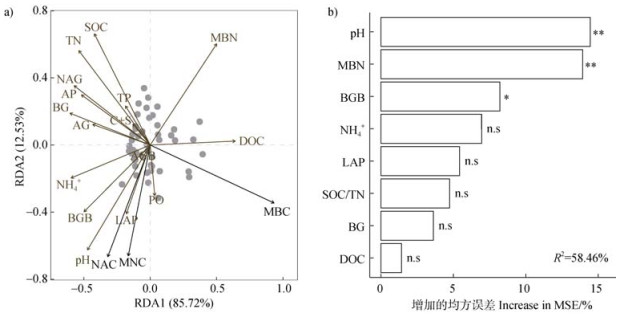
2.5 NAC的影响因素NAC与环境因子的线性相关分析如图 4所示。NAC与NH4+、pH、BG、LAP、BGB显著正相关(P < 0.05),与SOC/TN、DOC、MBN显著负相关(P < 0.05)。冗余分析结果表明,土壤理化性质、微生物胞外酶活性和植物生物量对MNC、MBC和NAC有重要影响(R2=98.25%,图 5a),其中pH、MBN和BGB对NAC有较大影响。随机森林模型对NAC的解释度为58.46%,相对重要性排序结果显示pH为NAC最主要的影响因素,其次为MBN和BGB(图 5b)。
|
注:AG:α-1,4-葡萄糖苷酶;BG:β-1,4-葡萄糖苷酶;AP:酸性磷酸酶;LAP:亮氨酸氨基肽酶;NAG:β-1,4-N-乙酰氨基葡葡糖苷酶;PO:酚氧化酶;AGB:地上生物量;BGB:地下生物量。下同。 Note: AG: α-1, 4-glucosidase; BG: β-1, 4-glucosidase; AP: acid phosphatase; LAP: leucine amino peptidase; NAG: β-1, 4-Nacetyl-glucosaminnidase; PO: phenol oxidase; AGB: above-ground biomass; BGB: below-ground biomass. The same as below. 图 4 残体积累系数与环境因子(a. SOC,b.TN,c. SOC/TN,d. TP,e. NH4+,f. DOC,g. pH,h. MBN,i. C+S,j. AG,k. BG,l. AP,m. LAP,n. NAG,o. PO,p. AGB,q. BGB)间的相关性分析 Fig. 4 Correlation analysis between necromass accumulation coefficient and environmental variables(a. SOC, b.TN, c. SOC/TN, d. TP, e. NH4+, f. DOC, g. pH, h. MBN, i. C+S, j. AG, k. BG, l. AP, m. LAP, n. NAG, o. PO, p. AGB, q. BGB) |
|
注:NAC:残体积累系数;MNC:微生物残体碳;MBC:微生物生物量碳。*表示显著性水平为P < 0.05,**表示显著性水平为P < 0.01,n.s.表示无显著影响。 Note: NAC: necromass accumulation coefficient; MNC: microbial necromass carbon; MBC: microbial biomass carbon. * indicates significance level of P < 0.05, ** indicates significance level of P < 0.01. n.s. indicates non-significant effect. 图 5 残体积累系数与环境因子的冗余分析(RDA,a)和随机森林分析(b) Fig. 5 Redundancy analysis(RDA, a)and random forest analysis(b)of necromass accumulation coefficient with environmental variables |
本研究发现,相较于CK,短期养分添加对0~10 cm和20~30 cm土层的NAC均无显著影响(图 3c),这与短期的养分添加对微生物活体及其残体的影响较弱有关,0~10 cm和20~30 cm土层的MNC和MBC在短期养分添加后也均未观察到显著变化(图 3a,图 3b)。可能由于青藏高原高海拔和低温环境导致土壤中存在普遍的氮磷限制[27],外源氮磷进入土壤后,植物和微生物对有限养分的竞争激烈,而微生物在有限的资源竞争中通常处于劣势[28-29],短期添加的养分倾向于被植物优先利用,因此短期养分添加对微生物活体的影响较弱。此外,微生物残体倾向于与矿物颗粒表面紧密结合而具有较高的稳定性[30-31],因此受短期养分添加的直接影响也较弱。本研究中,短期养分添加后土壤中的NAC为34.73±2.60,显著高于Zhang等[15]对青藏高原土壤中NAC的估算值(16.62±2.19)。Zhang等[15]的研究表明,青藏高原土壤NAC受干旱指数和植物净初级生产力的控制,主要通过影响微生物对水分和能量的利用,影响微生物周转,进而影响微生物残体的积累。本研究站点年均降水(485 mm)显著高于Zhang等[15]估算的青藏高原土壤(均值:318 mm),并且本站点的植物净初级生产力在2001—2010年的平均值为340.16 g·m−2·a−1(以C计,下同)[32],显著高于Zhang等[15]研究的青藏高原样带植物净初级生产力均值(133 g·m−2·a−1),因此,可能是海北站较高的年降水和植物净初级生产力导致了较高的NAC。
研究发现,对于CK土壤而言,长期养分添加后0~10 cm与20~30 cm土层之间的NAC差异显著,而短期养分添加0~10 cm与20~30 cm土层无显著差异(图 3c,图 3f)。由于NAC是单位MBC积累的MNC的量,通过对比分析发现,短期和长期养分添加后MNC对SOC的贡献无显著差异(短期:0.31±0.01 g·g–1 SOC;长期:0.31±0.02 g·g–1 SOC;图 2a)。相比之下,长期养分添加后的MBC(21.8± 1.3 mg·g–1 SOC;图 2b)显著高于短期养分添加(9.83±0.63 mg·g–1 SOC),然而20~30 cm土层CK的MBC变化不显著(短期:8.12±1.72 mg·g–1 SOC;长期11.68±2.31 mg·g–1 SOC;图 3b,图 3e),可能是由于20~30 cm土层受到外界环境的直接影响较小,这也最终导致20~30 cm土层CK的NAC无显著变化(短期:41.31±12.69;长期:34.62±2.07;图 3c,图 3f)。
3.2 养分添加条件下NAC的调控因素氮磷添加可通过改变土壤理化性质、胞外酶活性、微生物生物量和植物生物量来间接或直接影响微生物残体的积累[6-8]。本研究将短期和长期养分添加的数据合并,进一步分析影响氮磷添加后土壤中NAC的主导因素。随机森林结果显示pH是影响NAC的最主要因素(图 5b),并且pH与NAC呈显著正相关关系(图 4g),说明长期氮磷养分添加后土壤pH的降低是NAC降低的最主要影响因素。本研究中长期氮添加、磷添加和氮磷同时添加均显著降低了20~30 cm土层的pH(表 1)。首先,pH可通过影响微生物的活性来影响微生物残体的积累。研究表明,pH降低可能会导致铝和其他重金属(铜、铬等)的溶解和活化[33],从而增加金属毒性,限制微生物的生长和生理活动,最终改变微生物NAC;其次,pH降低可能会使矿物溶解,MNC受到的矿物保护减弱,因此更易被分解[6],进而降低微生物NAC。然而,本研究排除了pH降低导致微生物生长代谢受到抑制的可能性,因为长期氮磷添加处理后,虽然20~30 cm土层的pH显著降低,但MBC显著提高(图 3e)。磷添加和氮磷同时添加时MNC对SOC的贡献显著降低(图 3d),证实了pH降低使得MNC受到的矿物保护减弱、更易分解,从而使得NAC降低的推测。此外,磷和氮磷同时添加除了会导致土壤pH降低外,也向土壤中引入了大量磷酸根离子,磷酸根能够在矿物表面以键桥链接两种或多种金属形成双核或多核复合体,从而占据微生物残体在矿物表面的吸附位点,这也可能会导致更多的微生物残体游离,从而进一步提高微生物残体被分解和利用的可能[6],进而导致在有磷输入时,MNC的损失潜力更大。
此外,结果显示,除了pH外,MBN、BGB、NH4+、pH、BG、LAP、SOC/TN、DOC也在不同程度上影响着NAC。NAC与MBN负相关(图 4h),这与Han等[12]的研究一致,其发现在全球范围内NAC随着MBN的水平升高而降低。一般而言,微生物的代谢熵和周转率会随着MBN的水平提高而显著降低[34],因此,较高的MBN可促进活体微生物的生长而减缓其死亡,从而减少微生物残体的积累。此外,较高的MBN也可通过提高胞外酶的活性加速微生物残体的分解[35],从而导致NAC降低。BGB与NAC呈正相关(图 4q),这与Wang等[36]的研究一致,即较高的地下生物量有利于提高微生物残体的积累,根系可通过增加根系分泌物和凋落物的输入促进微生物代谢,从而促进微生物残体积累。NH4+与NAC显著正相关(图 4e),NH4+作为微生物重要的氮源[37],在适宜的范围内会促进微生物的代谢,从而促进微生物残体的积累。NAC与BG、LAP的正相关关系表明,微生物活性的提高会促进微生物残体的形成,这与Wang等[36]的研究一致。NAC与SOC/TN显著负相关(图 4c),即较低SOC/TN的土壤中NAC更高,这是由于较高的养分环境有利于微生物的合成代谢,从而加速微生物残体的形成和保留[38]。NAC与DOC显著负相关(图 4f),DOC是陆地碳库中最活跃、最具流动性的部分,易被土壤微生物分解,作为一种基础营养物质支持着微生物的生长[39],较高的DOC可能会通过延缓微生物的死亡,进而抑制微生物残体的积累。
4 结论本研究以短期(1年)和长期(10年)氮磷添加的草甸0~10 cm和20~30 cm土层土壤为研究对象,研究了氮磷添加对微生物残体积累系数(NAC)的影响以及驱动因素。研究发现短期氮磷添加未显著改变NAC,而长期氮磷添加显著降低20~30 cm土层的NAC;其中,长期氮磷添加导致的土壤pH降低可能是导致NAC降低的主要原因。土壤pH降低会减弱微生物残体的矿物保护从而增加其分解,最终导致NAC降低。因此,在全球气候变化和人为活动导致氮磷激增的背景下,应密切关注土壤pH的变化,并及时采取相应的措施以维持SOC稳定。
| [1] |
Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528(7580): 60-68. DOI:10.1038/nature16069
(  0) 0) |
| [2] |
Liang C, Amelung W, Lehmann J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology, 2019, 25(11): 3578-3590. DOI:10.1111/gcb.14781
(  0) 0) |
| [3] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2(8): 17105. DOI:10.1038/nmicrobiol.2017.105
(  0) 0) |
| [4] |
Shao P S, Xie H T, Bao X L, et al. Variation of microbial residues during forest secondary succession in topsoil and subsoil (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(4): 1050-1059. [邵鹏帅, 解宏图, 鲍雪莲, 等. 森林次生演替过程中有机质层和矿质层土壤微生物残体的变化[J]. 土壤学报, 2021, 58(4): 1050-1059.]
(  0) 0) |
| [5] |
Finzi A C, Austin A T, Cleland E E, et al. Responses and feedbacks of coupled biogeochemical cycles to climate change: Examples from terrestrial ecosystems[J]. Frontiers in Ecology and the Environment, 2011, 9(1): 61-67. DOI:10.1890/100001
(  0) 0) |
| [6] |
Ma T, Yang Z Y, Shi B W, et al. Phosphorus supply suppressed microbial necromass but stimulated plant lignin phenols accumulation in soils of alpine grassland on the Tibetan Plateau[J]. Geoderma, 2023, 431: 116376. DOI:10.1016/j.geoderma.2023.116376
(  0) 0) |
| [7] |
Lu M Y, Ding X L. Response of soil microbial residue accumulation in paddy soil to straw amendment: A review (In Chinese)[J]. Soils, 2024, 56(1): 10-18. [卢孟雅, 丁雪丽. 稻田土壤微生物残体积累对外源秸秆输入的响应研究进展[J]. 土壤, 2024, 56(1): 10-18.]
(  0) 0) |
| [8] |
Fan Y X, Yang L M, Zhong X J, et al. N addition increased microbial residual carbon by altering soil P availability and microbial composition in a subtropical Castanopsis forest[J]. Geoderma, 2020, 375: 114470. DOI:10.1016/j.geoderma.2020.114470
(  0) 0) |
| [9] |
Fan L J, Xue Y W, Wu D H, et al. Long-term nitrogen and phosphorus addition have stronger negative effects on microbial residual carbon in subsoils than topsoils in subtropical forests[J]. Global Change Biology, 2024, 30(2): e17210. DOI:10.1111/gcb.17210
(  0) 0) |
| [10] |
Luo R Y, Kuzyakov Y, Zhu B, et al. Phosphorus addition decreases plant lignin but increases microbial necromass contribution to soil organic carbon in a subalpine forest[J]. Global Change Biology, 2022, 28(13): 4194-4210. DOI:10.1111/gcb.16205
(  0) 0) |
| [11] |
Luo R Y, Kuzyakov Y, Liu D Y, et al. Nutrient addition reduces carbon sequestration in a Tibetan grassland soil: Disentangling microbial and physical controls[J]. Soil Biology and Biochemistry, 2020, 144: 107764. DOI:10.1016/j.soilbio.2020.107764
(  0) 0) |
| [12] |
Han B B, Yao Y Z, Wang Y N, et al. Microbial traits dictate soil necromass accumulation coefficient: A global synthesis[J]. Global Ecology and Biogeography, 2023, 33(1): 13776.
(  0) 0) |
| [13] |
Jia S X, Liu X F, Lin W S, et al. Tree roots exert greater influence on soil microbial necromass carbon than above-ground litter in subtropical natural and plantation forests[J]. Soil Biology and Biochemistry, 2022, 173: 108811. DOI:10.1016/j.soilbio.2022.108811
(  0) 0) |
| [14] |
Li Y Z, Bao X L, Tang S X, et al. Toward soil carbon storage: The influence of parent material and vegetation on profile-scale microbial community structure and necromass accumulation[J]. Soil Biology and Biochemistry, 2024, 193: 109399. DOI:10.1016/j.soilbio.2024.109399
(  0) 0) |
| [15] |
Zhang X Y, Jia J, Chen L T, et al. Aridity and NPP constrain contribution of microbial necromass to soil organic carbon in the Qinghai-Tibet alpine grasslands[J]. Soil Biology and Biochemistry, 2021, 156: 108213. DOI:10.1016/j.soilbio.2021.108213
(  0) 0) |
| [16] |
He M, Fang K, Chen L Y, et al. Depth-dependent drivers of soil microbial necromass carbon across Tibetan alpine grasslands[J]. Global Change Biology, 2022, 28(3): 936-949. DOI:10.1111/gcb.15969
(  0) 0) |
| [17] |
Wang G X, Qian J, Cheng G D, et al. Soil organic carbon pool of grassland soils on the Qinghai-Tibetan Plateau and its global implication[J]. Science of the Total Environment, 2002, 291(1/3): 207-217.
(  0) 0) |
| [18] |
Carter M R, Gregorich E G. Soil sampling and methods of analysis . Boca Raton, FL: Taylor & Francis Group, 2006.
(  0) 0) |
| [19] |
Lu R K. Analytical methods for soil and agro- chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [20] |
Brookes P C, Landman A, Pruden G, et al. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil[J]. Soil Biology and Biochemistry, 1985, 17(6): 837-842. DOI:10.1016/0038-0717(85)90144-0
(  0) 0) |
| [21] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707. DOI:10.1016/0038-0717(87)90052-6
(  0) 0) |
| [22] |
Wu L, Xu H, Xiao Q, et al. Soil carbon balance by priming differs with single versus repeated addition of glucose and soil fertility level[J]. Soil Biology and Biochemistry, 2020, 148: 107913. DOI:10.1016/j.soilbio.2020.107913
(  0) 0) |
| [23] |
Wu J, Joergensen R G, Pommerening B, et al. Measurement of soil microbial biomass C by fumigation-extraction—An automated procedure[J]. Soil Biology and Biochemistry, 1990, 22(8): 1167-1169. DOI:10.1016/0038-0717(90)90046-3
(  0) 0) |
| [24] |
Chaudhari S K, Singh R, Kundu D K. Rapid textural analysis for saline and alkaline soils with different physical and chemical properties[J]. Soil Science Society of America Journal, 2008, 72(2): 431-441. DOI:10.2136/sssaj2006.0117N
(  0) 0) |
| [25] |
Zhu E X, Cao Z J, Jia J, et al. Inactive and inefficient: Warming and drought effect on microbial carbon processing in alpine grassland at depth[J]. Global Change Biology, 2021, 27(10): 2241-2253. DOI:10.1111/gcb.15541
(  0) 0) |
| [26] |
Zhang X D, Amelung W, Yuan Y, et al. Land-use effects on amino sugars in particle size fractions of an Argiudoll[J]. Applied Soil Ecology, 1999, 11(2): 271-275.
(  0) 0) |
| [27] |
Zhang D Y, Wang L, Qin S Q, et al. Microbial nitrogen and phosphorus co-limitation across permafrost region[J]. Global Change Biology, 2023, 29(14): 3910-3923. DOI:10.1111/gcb.16743
(  0) 0) |
| [28] |
Bardgett R D, Mawdsley J L, Edwards S, et al. Plant species and nitrogen effects on soil biological properties of temperate upland grasslands[J]. Functional Ecology, 1999, 13(5): 650-660. DOI:10.1046/j.1365-2435.1999.00362.x
(  0) 0) |
| [29] |
Liu W X, Xu W H, Han Y, et al. Responses of microbial biomass and respiration of soil to topography, burning, and nitrogen fertilization in a temperate steppe[J]. Biology and Fertility of Soils, 2007, 44(2): 259-268. DOI:10.1007/s00374-007-0198-6
(  0) 0) |
| [30] |
Kopittke P M, Hernandez-Soriano M C, Dalal R C, et al. Nitrogen-rich microbial products provide new organo-mineral associations for the stabilization of soil organic matter[J]. Global Change Biology, 2018, 24(4): 1762-1770. DOI:10.1111/gcb.14009
(  0) 0) |
| [31] |
Sollins P, Swanston C, Kleber M, et al. Organic C and N stabilization in a forest soil: Evidence from sequential density fractionation[J]. Soil Biology and Biochemistry, 2006, 38(11): 3313-3324. DOI:10.1016/j.soilbio.2006.04.014
(  0) 0) |
| [32] |
Zhu, J T. A dataset of net primary productivity of vegetation on the Qinghai-Tibet Plateau(2001-2020)[EB/OL]. A Big Earth Data Platform for Three Poles, 2022. https://data.tpdc.ac.cn/zh-hans/data/ad85719c-73cf-4a7f-b89c-97b517b79ea7.[朱军涛. 青藏高原植被净初级生产力数据集(2001-2020)[EB/OL]. 时空三极环境大数据平台, 2022. https://data.tpdc.ac.cn/zh-hans/data/ad85719c-73cf-4a7f-b89c-97b517b79ea7.]
(  0) 0) |
| [33] |
Lin Y X, Ye G P, Liu D Y, et al. Long-term application of lime or pig manure rather than plant residues suppressed diazotroph abundance and diversity and altered community structure in an acidic Ultisol[J]. Soil Biology and Biochemistry, 2018, 123: 218-228. DOI:10.1016/j.soilbio.2018.05.018
(  0) 0) |
| [34] |
Li Z L, Zeng Z Q, Tian D S, et al. Global variations and controlling factors of soil nitrogen turnover rate[J]. Earth-Science Reviews, 2020, 207: 103250. DOI:10.1016/j.earscirev.2020.103250
(  0) 0) |
| [35] |
Cui J F, Holden N M. The relationship between soil microbial activity and microbial biomass, soil structure and grassland management[J]. Soil and Tillage Research, 2015, 146: 32-38. DOI:10.1016/j.still.2014.07.005
(  0) 0) |
| [36] |
Wang B R, An S S, Liang C, et al. Microbial necromass as the source of soil organic carbon in global ecosystems[J]. Soil Biology and Biochemistry, 2021, 162: 108422. DOI:10.1016/j.soilbio.2021.108422
(  0) 0) |
| [37] |
Pan W K, Zhou J J, Tang S, et al. Utilisation and transformation of organic and inorganic nitrogen by soil microorganisms and its regulation by excessive carbon and nitrogen availability[J]. Biology and Fertility of Soils, 2023, 59(4): 379-389. DOI:10.1007/s00374-023-01712-w
(  0) 0) |
| [38] |
Chen G P, Ma S H, Tian D, et al. Patterns and determinants of soil microbial residues from tropical to boreal forests[J]. Soil Biology and Biochemistry, 2020, 151: 108059. DOI:10.1016/j.soilbio.2020.108059
(  0) 0) |
| [39] |
Cleveland C C, Reed S C, Townsend A R. Nutrient regulation of organic matter decomposition in a tropical rain forest[J]. Ecology, 2006, 87(2): 492-503. DOI:10.1890/05-0525
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


