2. 湖泊与流域水安全重点实验室(中国科学院南京地理与湖泊研究所), 南京 211135
2. State Key Laboratory of Lake and Watershed Science for Water Security, Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 211135, China
山地作为具有特殊结构和功能的复杂生态系统,调节着全球碳、氮和水循环,并在决定全球和区域气候等方面发挥着重要作用[1]。山地生态系统因其具有较高的生境异质性和气候多样性,影响土壤理化性质和植被类型,进而影响土壤微生物群落,因此山地一直被认为是研究微生物生态学的理想场所[2]。随着旅游业发展、农业扩张和集约化以及自然资源开采等人类活动不断上移,高海拔地区生态系统将受到显著影响[3],山地生态系统的微生物等生物多样性面临着极大压力。
微生物群落通常由少数丰富物种和多数稀有物种组成,其中丰富物种的相对丰度较高,而稀有物种的相对丰度较低。稀有物种又被称为“稀有亚群落”,通常被定义为用于解释多样性的丰度等级曲线中的一条长长的“尾巴”。丰富和稀有的微生物群落通常表现出不同的分布模式和功能性状[4]。与丰富物种相比较,稀有物种拥有更高的代谢活性,常是陆地生态系统中的关键物种[5]。在大多数生态系统中,稀有物种是微生物多样性的主要贡献者,在维持整个微生物群落的功能稳定性和结构多样性方面也具有关键作用[6]。此外,稀有物种可作为微生物“种子库”的一部分,在受到环境和生物等因素干扰后可能会成为优势类群,进而影响生态系统功能[6]。
土壤蕴含着地球上最复杂和多样化的微生物群落[7],土壤微生物参与有机质分解,调节碳储量和养分循环,在气候调节、养分保持和病虫害防治等过程中发挥至关重要的作用,是维持多种生态系统功能的关键[8]。山地土壤是由各种地质和生物过程逐渐形成的脆弱资源,全球近60%的山地承受着巨大人类干扰的压力[1],而人类干预土壤自然过程最直接的活动是改变土地利用方式[9]。土地利用类型变化是影响陆地生态系统生物多样性的重要驱动因素之一,就宏观层面而言,它在维持整个陆地生态系统的稳定运转和土壤的多功能性中发挥关键作用[10]。进一步就微观层面而言,这种变化通过改变土壤环境变量,如土壤pH、水分以及养分含量等,对稀有微生物类群的分布和丰度产生显著影响[11]。农田作为受人类活动干扰最为集中和频繁的土地利用类型之一,可通过施肥和耕作等农业措施改变土壤理化性质,进而影响稀有微生物类群[12],而森林作为自然栖息地,受人类干扰程度相对较小,能较好地保留土壤原始状态[13]。因此,研究这两种土地利用类型中的稀有物种有助于进一步理解人类活动对生物多样性保护和生态系统管理的影响。然而,目前关于农田和森林土壤的研究多数集中于整体微生物群落及其丰富物种的变化,有关稀有物种的研究则相对较少,特别是在山地生态系统的高海拔地区。
本研究选择云南老君山的典型农田和森林生态系统,沿高海拔地区1 880~3 010 m的海拔梯度,采集39个农田和61个森林土壤样品,基于土壤理化性质分析和16S rRNA高通量测序,根据细菌物种相对丰度定义稀有物种,研究土壤稀有细菌群落的海拔分布格局及其在农田和森林土壤中的差异,并探讨了这些变化的驱动因素。研究结果对探讨山地生态系统中稀有群落构建与多样性维持等具有重要意义。
1 材料与方法 1.1 研究区概况云南老君山位于云南省西北部,介于26°38’ N—27°15’N、99°07’ E—100°00’E之间,属横断山系云岭主脉。该地区总面积为108 500 hm2,最高海拔为4 515米,包括四个县(玉龙、剑川、兰坪、维西),分别隶属于丽江、大理、怒江、迪庆。该地区是世界生物多样性的“热点”之一,是世界自然遗产“三江并流”(怒江、澜沧江、金沙江)的核心地带[14]。
1.2 土壤样品采集与分析2022年11月,在云南老君山,沿着1 880~3 010 m海拔梯度,共采集100个海拔的表层土壤样品,39个农田位点及与其海拔相似的61个森林位点。在每个海拔,随机选取1处地块。在每个地块设置1个1 m×1 m样方,清除表层凋落物,沿样方四角垂直向下收集0~10 cm的土层样品,将四个角所挖取的土样混合为一个样品,共获得100个土样,其中39个农田土壤样品,61个森林土壤样品。农田属于旱地类型,主要作物为玉米和豆类;森林植被类型随海拔而变化,海拔低于2 500 m主要为阔叶林,超过2 500 m主要为针叶林。采集的土样装入20 mL无菌瓶中密封,保存于车载冰箱中(–20 ℃),用于后续实验处理。在土壤样品中挑出可见的石块、土壤动物和植物残体后,分取其中一部分样品用于DNA提取,其余进行风干研磨等处理,用于测定土壤基础理化指标。土壤含水量采用烘干法测定,土壤pH和电导率(EC)分别采用pH计(SX-610型,精密,上海)和电导率仪(COM-100型,HM,韩国)测定,总有机碳(TOC)和溶解性有机碳(DOC)采用有机碳分析仪(TOC-V CPN型,岛津,日本)测定,全氮(TN)和全磷(TP)采用过硫酸钾氧化—紫外分光光度法进行测定[15]。
1.3 DNA提取及高通量测序使用MoBio Power Soil DNA试剂盒(MoBio,Carlsbad,美国),按照生产商的说明提取冷冻干燥后土壤中的DNA。采用引物515F(5’- GTG YCA GCM GCC GCG GTA A -3’)和806R(5’ – GGA CTA CNV GGG TWT CTA AT-3’)扩增细菌16S rRNA基因的V4区域[16]。在Illumina NovaSeq 6000测序平台进行测序。原始序列使用QIIME2(V2022.8.3)进行分析[15]。
1.4 数据分析本研究基于扩增子序列变体(Amplicon sequence variant,ASV)数量,将农田和森林土壤样本中平均相对丰度低于0.01%的分类群定义为稀有类群[17]。依据文献资料,细菌群落的稀有度可采用两种方法估算:(1)基于筛选的稀有物种计算,该方法采用平均相对丰度小于0.01%的分类群的丰度与总丰度的比值[17];(2)利用稀有丰度指数来计算,该指数估算在50%的流行率下,超过0.2% 检测水平的非核心物种的相对比例[18]。基于上述两种方法的稀有度分析,两者具有类似的趋势,相关性为0.84(P < 0.001)。因此,最终确定以第一种稀有度估算方法为主,开展下述统计分析。首先,计算α多样性指数,即Chao1指数、香农(Shannon)指数和均匀度(Evenness)指数,分别表示物种的丰富度、多样性和均匀度。其次,采用威尔科克森(Wilcoxon)秩和检验及线性模型,对不同土地利用类型中理化性质和稀有细菌群落的α多样性进行显著性检验,以及探究海拔与土壤理化性质和α多样性之间的关系。随后,采用随机森林模型,预测不同土地利用类型中稀有细菌群落的关键环境驱动因素。然后,基于布雷柯蒂斯(Bray-Curtis)距离进行非度量多维尺度分析(Non-metric multidimensional scaling,NMDS)探究不同土地利用类型中稀有细菌群落组成间的差异,并采用相似性分析(Analysis of similarity,ANOSIM)进行检验。最后,基于斯皮尔曼(Spearman)相关性的曼特尔(Mantel)检验分析土壤稀有细菌群落与理化性质的关系,并使用cor.test函数计算优势细菌门与土壤理化性质之间的相关性。以上所有分析均基于R语言(V4.2.1)的vegan、ggplot2、dplyr和ggpubr等程序包来完成。
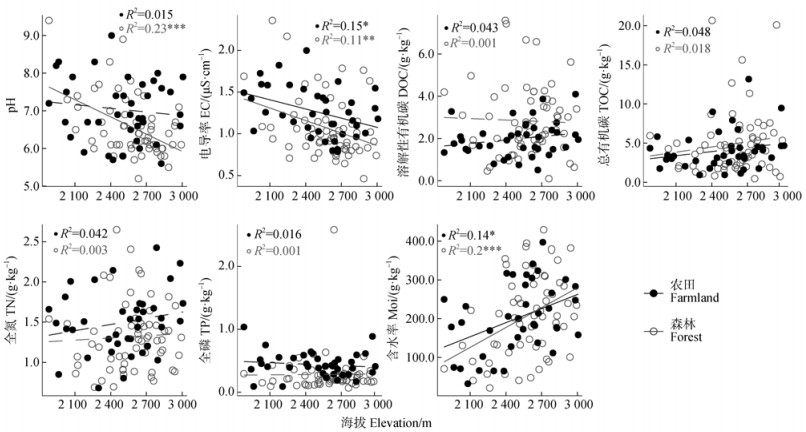
2 结果 2.1 农田和森林土壤理化性质差异及海拔分布模式基于威尔科克森(Wilcoxon)秩和检验,发现农田和森林土壤中的理化性质存在显著差异(表 1)。例如,与森林相比,农田土壤的pH(P < 0.01)、EC(P < 0.001)、TN(P < 0.05)和TP(P < 0.01)显著较高,DOC显著较低(P < 0.001),而总有机碳和含水率在两种土壤类型之间无显著差异。采用线性模型探究农田和森林土壤中理化性质的海拔模式,发现两种土壤的含水率和电导率分别呈现显著增加和下降的海拔模式(P < 0.05),森林土壤的pH随海拔升高也呈现显著下降趋势(P < 0.001)(图 1)。
|
|
表 1 两种土地利用类型下理化性质的差异 Table 1 Differences between physicochemical properties across two land-use types |
|
图 1 两种土地利用类型下理化性质与海拔之间的关系 Fig. 1 Relationships between physicochemical properties and elevation across two land-use types |
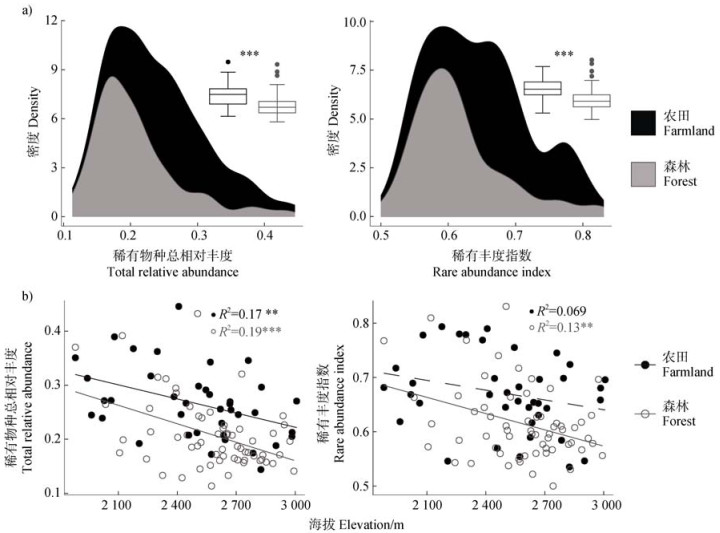
基于两种稀有度估算方法,在农田和森林土壤中发现一致的细菌稀有度差异与海拔分布模式。具体地,农田和森林土壤的稀有度分别为0.266±0.71和0.209±0.064,其中农田土壤细菌群落稀有度显著高于森林土壤21.56%(图 2a)。农田(P < 0.01)和森林土壤(P < 0.001)细菌稀有度均呈现显著下降的海拔模式,分别下降26.28%和8.77%(图 2b)。
|
图 2 两种土地利用类型下细菌群落稀有度(a)及其与海拔(b)之间的关系 Fig. 2 Relationships between the rarity of bacterial communities(a)and elevation(b)across two land-use types |
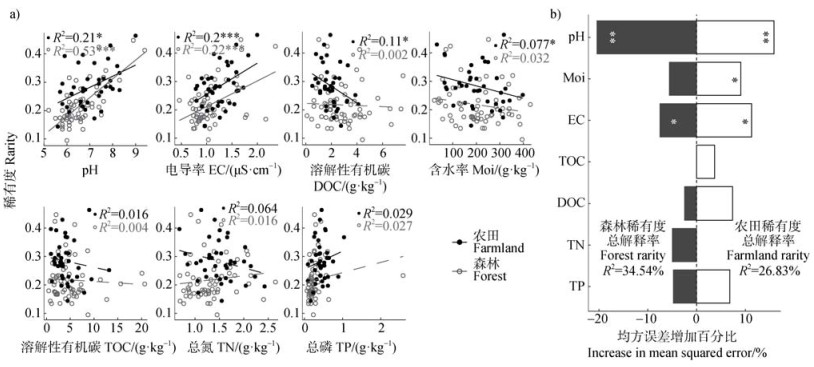
细菌稀有度与土壤理化性质相关性分析结果(图 3a)表明,农田和森林土壤细菌稀有度均随pH(农田:P < 0.05;森林:P < 0.001)和电导率(农田:P < 0.001;森林:P < 0.001)的增大而显著增加,农田土壤细菌稀有度还因含水率和溶解性有机碳的增加而显著下降(P < 0.05)。此外,随机森林模型结果(图 3b)表明,农田和森林土壤细菌稀有度的总解释率分别为26.83%和34.54%。在所有土壤理化性质中,农田和森林土壤细菌稀有度均受pH(P < 0.01)和电导率(P < 0.05)的关键驱动,前者还受含水率的影响(P < 0.05)。
|
图 3 两种土地利用类型下细菌群落稀有度与不同理化性质之间的关系(a)和相对重要性(b) Fig. 3 Relationships(a)and relative importance(b)of bacterial community rarity with different physicochemical properties across two land-use types |
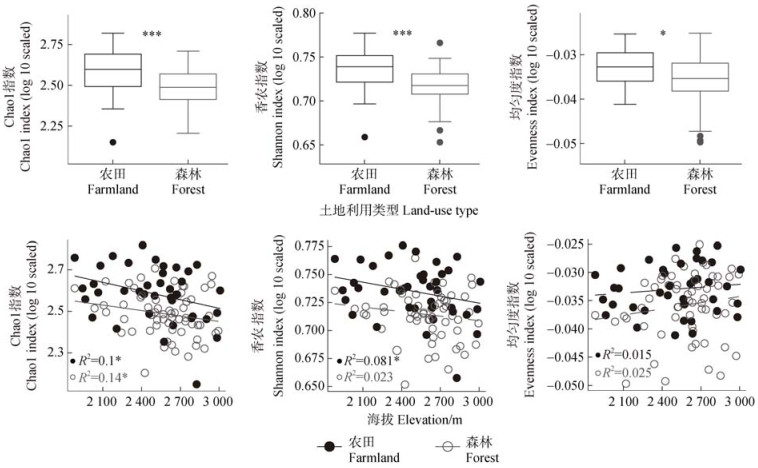
基于威尔科克森(Wilcoxon)秩和检验及线性相关分析表明,土壤稀有细菌群落的α多样性受到不同土地利用类型和海拔梯度的影响(图 4)。农田土壤中稀有细菌群落的Chao1指数(P < 0.001)、香农(Shannon)指数(P < 0.0001)和均匀度(Evenness)指数(P < 0.05)均显著高于森林土壤,分别增加19.99%、4.43%、0.64%。此外,农田和森林土壤稀有细菌的Chao1指数均呈现显著下降的海拔模式(P < 0.05),分别下降31.39%和34.40%。农田土壤稀有细菌的香农(Shannon)指数也随海拔增加而显著下降4.93%(P < 0.05)。
|
图 4 两种土地利用类型下稀有细菌α多样性及其与海拔的关系 Fig. 4 Relationships between alpha diversity of the rare bacterial community and elevation across two land-use types |
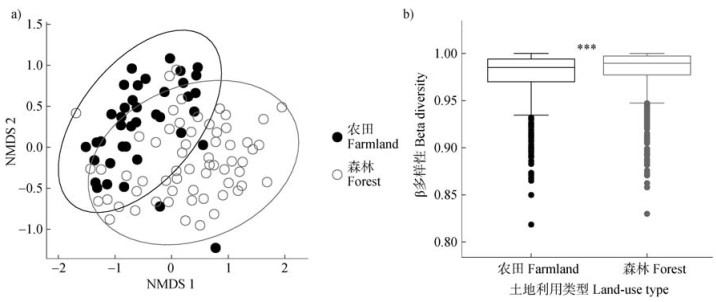
与土地利用类型、海拔及其交互作用对土壤稀有细菌群落结构存在显著的影响,且土地利用类型影响最大(R2 = 0.019,P < 0.001)(表 2)。基于布雷柯蒂斯(Bray Curtis)距离在扩增子序列变体(ASV)水平上进行非度量多维尺度(NMDS)分析,结果表明,农田和森林土壤稀有细菌群落结构存在一定差异(图 5a),且农田土壤的β多样性显著低于森林土壤(P < 0.001)(图 5b)。
|
|
表 2 海拔和土地利用类型及其交互影响与稀有细菌群落结构的关系 Table 2 The associations of elevation and land-use type and their interactions with the composition of rare bacteria |
|
图 5 两种土地利用类型下稀有细菌群落的非度量多维尺度分析(NMDS,a)和β多样性分析(b) Fig. 5 Non-metric multidimensional scaling(NMDS, a)and beta diversity(b)analysis of rare bacterial community in two land- use types |
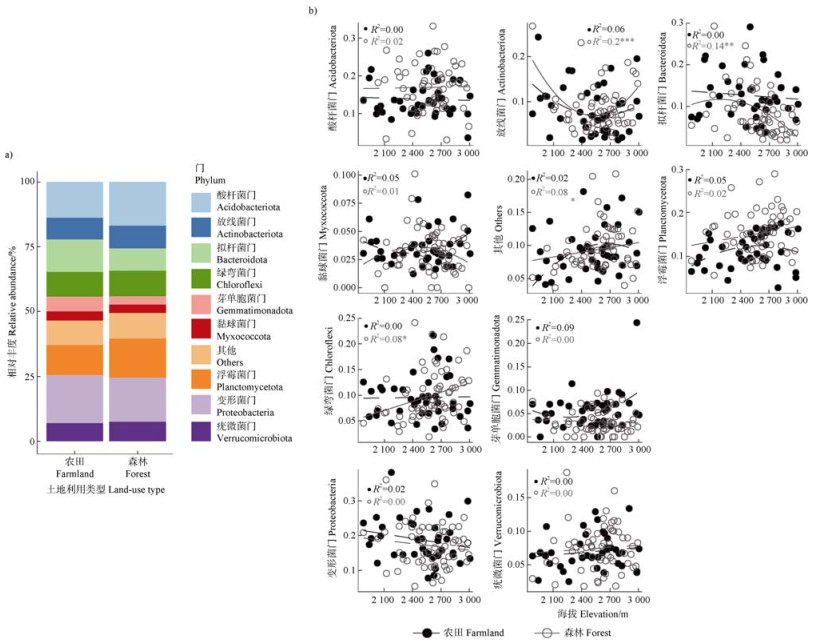
进一步筛选出土壤稀有细菌群落中相对丰度大于3%的优势菌门,主要为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)、浮霉菌门(Planctomycetota)、拟杆菌门(Bacteroidota)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteriota)、疣微菌门(Verrucomicrobiota)、芽单胞菌(Gemmatimonadota)和黏菌门(Myxococcota)(图 6a)。其中,森林土壤的放线菌门呈现显著U形海拔模式(R2 = 0.20,P < 0.001),拟杆菌门(R2 = 0.14,P < 0.01)和绿弯菌门(R2 = 0.08,P < 0.05)分别呈现显著减少和增加的海拔模式,而农田土壤的所有优势菌门均无显著海拔模式(图 6b)。
|
图 6 两种土地利用类型下优势细菌门的相对丰度(a)及其与海拔(b)之间的关系 Fig. 6 Relative abundance(a)and relationships between relative abundanceand elevation(b)of dominant bacterial phyla across two land-use types |
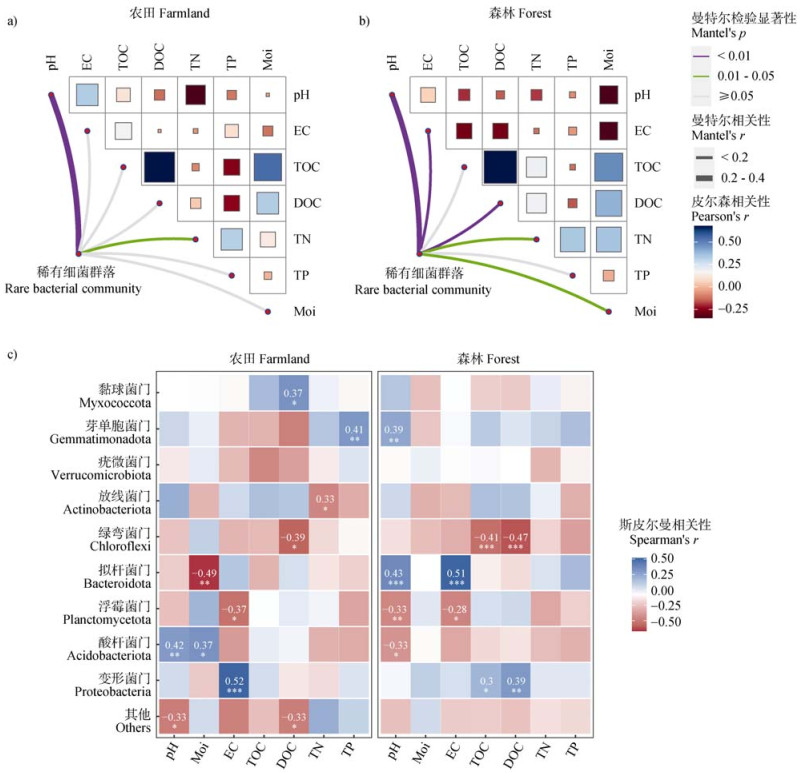
曼特尔(Mantel)分析结果显示,与农田相比,森林土壤稀有细菌群落与土壤理化性质的相关性更显著(图 7a,图 7b)。例如,农田和森林土壤的稀有细菌群落均与下述理化参数相关:pH(农田:Mantel’s r = 0.39,P = 0.001;森林:Mantel’s r = 0.38,P = 0.001)和全氮(农田:Mantel’s r = 0.09,P = 0.035;森林:Mantel’s r = 0.08,P = 0.022)。此外,森林土壤稀有细菌群落与电导率(Mantel’s r = 0.15,P = 0.003)、溶解性有机碳(Mantel’s r = 0.13,P = 0.003)和含水率(Mantel’s r= 0.06,P = 0.041)等也具有显著相关性。在所有理化参数中,农田和森林土壤的稀有细菌群落均与pH相关性最强。基于斯皮尔曼(Spearman)相关性分析,进一步探究其优势菌门与土壤理化性质的关联,结果(图 7c)表明,农田土壤的酸杆菌门与pH呈显著正相关(P < 0.01),森林的则呈显著负相关(P < 0.05);农田和森林土壤的浮霉菌门均与电导率呈显著负相关(P < 0.05);森林土壤的拟杆菌门与pH和电导率均呈显著正相关(P < 0.001)。
|
图 7 两种土地利用类型下稀有细菌群落(a,b)及其优势细菌门(c)与理化性质之间的关系 Fig. 7 Relationships between rare bacterial communities(a, b)and dominant bacterial phyla(c)and physicochemical properties across two land-use types |
在高海拔地区,农田土壤pH、电导率和氮磷含量均高于森林土壤,而溶解性有机碳含量低于森林土壤(表 1)。该现象在其他山地系统中也有所发现,比如在土耳其的一项山地研究表明,沿着1 200~1 846 m的海拔梯度,农田土壤pH显著高于森林,而有机质含量较低[19]。在中国东南部的山地,农田的电导率和氮磷含量显著高于森林[20]。该现象可归于下述两点原因:第一,部分农业耕作方式可改变土壤pH和电导率,例如施用石灰中和土壤,导致钙离子等碱性阳离子的积累;使用磷酸铵和尿素等基本化肥,也会导致电导率和氮磷升高[21]。第二,农田土壤耕作可引发土壤侵蚀,破坏土壤团聚体,进而加速土壤有机质的流失。相较而言,森林土壤具有大量的凋落物和广泛的根系,因而有机质输入较高,损失较低[22]。在本研究中,随着海拔增加,森林土壤电导率和pH呈显著下降趋势,而含水率呈显著增加趋势(图 1)。这与印度喜马偕尔邦西南部森林研究[23]一致,即高海拔地区土壤含水量显著较高,而pH和电导率较低。该现象可能是由于降水和硝化作用会随海拔增加而增强,导致土壤中可溶性盐分流失和碱性阳离子浸出,进而含水量增大,pH和电导率减小[23-24]。此外,植物和地衣的酸性根际效应也可导致pH降低[24]。
3.2 土地利用类型和海拔对稀有细菌群落的影响与森林相比,农田土壤稀有细菌群落及其α多样性显著较高(图 2a和图 4a)。该结果与欧洲的一项研究相似:与受干扰较少的森林相比,高度干扰的农田环境含有更高的细菌丰富度和多样性[25]。这是由于农田土壤扰动或存在不同植物物种的异质环境导致局部范围内的生态位可用性增加。与此相反,森林土壤环境竞争激烈,生态位较少,能持续存在的稀有微生物类群也较少[25]。进一步的解释是,稀有细菌群落更偏向于在中性或微碱性条件下于生长,其丰度和多样性可能会随着pH的降低而减少,而本研究中森林土壤的pH显著低于农田土壤[26]。此外,农田和森林土壤稀有细菌群落及其α多样性均随海拔呈现显著下降的趋势(图 2b和图 4b)。该现象与阿尔卑斯山海拔梯度2 700~3 500 m范围内的研究结果[27]相似,该现象可归因于以下两点:首先,土壤酸性随海拔增加而增大,进而抑制稀有细菌群落活性[26]。其次,随着海拔增加,土壤环境变得更为恶劣(例如低温),这导致高海拔地区稀有细菌群落的活性和多样性降低,其生态位宽度也随之变窄[2]。
然而,农田的β多样性显著低于森林,表明农田稀有细菌群落具有同质化现象(图 5b)。这主要是因为农田土壤中强烈的人类活动干扰使得资源均质化(如土壤养分),进而降低生态位的异质性,导致稀有细菌群落结构相似性增大[28]。此外,土地利用类型对稀有微生物类群的影响也可能与耕作模式和植被类型有关。例如,黑龙江地区的一项研究发现,轮作模式下土壤稀有细菌丰富度高于单作模式[29]。中国东部的大尺度农田研究和山东中部的山地森林研究分别发现,水稻田的土壤稀有真菌丰度高于玉米田[4];阔叶林的土壤稀有细菌丰度高于针叶林[30]。因此,未来可针对山地农田中特定耕作模式、作物类型和森林植被类型开展研究,以提供更多关于土地利用类型对高海拔地区稀有微生物群落影响的证据。
3.3 土壤理化性质与稀有细菌群落之间的联系本研究表明,农田和森林土壤细菌稀有度均随pH和电导率增加而增大(图 3a)。该结果与贡嘎山海螺沟冰川土壤研究相似,即土壤稀有类群与pH呈正相关[31]。这是因为随着土壤环境酸碱度和可溶性离子的变化可能会出现更多独特的生态位,从而促进更多不同稀有细菌群落的共同发生[31]。农田和森林土壤稀有细菌群落的主要驱动因素为pH(图 3b和图 7)。该结果也在其他山地研究中发现,比如一项北美和南美的山地土壤研究发现,解释局部尺度细菌群落丰富性和多样性最主要的因素为土壤pH [26]。另一项将实验室分析与荟萃分析相结合的山地研究发现,大陆和全球尺度的细菌多样性也受pH的关键驱动[32]。此外,一篇有关全球山区不同生态系统类型和微生物类群的综述报道,山地微生物多样性和群落组成的海拔变化模式受pH的主导影响,特别是对于细菌群落而言[1]。该现象可归因为以下三点:首先,土壤pH是细菌群落组成的最佳预测指标[26],这种模式既适用于细菌群落的整体组成,也适用于稀有细菌群落的组成,并进一步适用于各种空间尺度,包括大尺度、特定尺度以及亚米级尺度[33]。其次,土壤pH与稀有细菌群落之间的密切联系可能是与土壤其他因素相结合的结果,例如,pH可在凋落物分解过程中调节胞外酶活性,进而影响稀有细菌群落[26]。最后,大多数微生物细胞内的pH接近中性,生存环境中pH的变化也可能会引起稀有细菌类群的适应性响应或灭绝[26]。此外,海拔变化可引起温度和降水的差异,影响土壤呼吸,并进一步影响土壤稀有细菌类群活动[23]。这表明今后在研究海拔对不同土地利用类型稀有细菌类群的影响时,可能不仅要考虑土壤理化性质的影响,还应考虑其他气候因素如土壤温度和降水量等的影响。
与农田相比,森林土壤稀有细菌群落与土壤理化性质的关系更密切(图 7),表明其对环境变化更敏感。该现象主要归因于两点:第一,森林生态系统具有较高的稳定性且干扰相对较少,这有助于在土壤环境中形成一个“功能最优”的稀有细菌群落[34]。然而,这种“功能最优”的土壤稀有细菌群落可能更容易受到土壤理化性质等关键因子的影响,因为其需要迅速调整生态位,最大限度地维持原始的“功能最优”群落结构[34]。相比之下,农田生态系统由于频繁的人为干扰和植被单一化,其土壤稀有细菌群落可能更习惯于快速变化的环境[12]。第二,森林土壤表层能够积累较多的凋落物和腐殖质,提供丰富的有机质支持微生物的生长代谢。农田土壤凋落物覆盖较少且存在多种耕作方式,使得土壤侵蚀加剧,进而导致土壤有机质大量流失[22]。在富含有机质的土壤环境中,稀有细菌群落能够快速移动并高速生长,生长和死亡速率变化较大,丰度波动也较大。与此相反,在有机质含量较低的土壤环境中,稀有细菌群落的生长速度可能较为缓慢,生长速率和丰度的变化也相对较小[35]。
4 结论基于云南老君山典型土地利用类型(农田和森林)在连续海拔梯度下的土壤理化性质和稀有细菌群落分析,发现农田大多数理化参数(例如pH、电导率、全氮和全磷)、细菌稀有度和α多样性均显著高于森林,但表现出同质化现象;森林稀有细菌群落更易受到理化性质的影响,表明其对环境响应更敏感,且这两类土壤的细菌稀有度和α多样性均随海拔升高而显著下降。此外,农田和森林土壤细菌稀有度均受pH和电导率的显著影响,且两类土壤稀有细菌群落均与pH的相关性最强,表明pH可能是农田和森林土壤稀有细菌群落沿海拔变化的关键驱动因子。本研究结果有助于进一步了解山地生态系统土壤稀有细菌在不同土地利用类型的海拔分布模式和驱动机制,对高海拔地区的生物多样性保护和生态系统管理至关重要。
| [1] |
Wang J J, Hu A, Meng F F, et al. Embracing mountain microbiome and ecosystem functions under global change[J]. New Phytologist, 2022, 234(6): 1987-2002. DOI:10.1111/nph.18051
(  0) 0) |
| [2] |
Sun Y Y, Xu M, Li Y F, et al. Elevational distribution pattern of fungal diversity and the driving mechanisms at different soil depths in mount segrila (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(4): 1169-1182. [孙媛媛, 徐梦, 李月芬, 等. 色季拉山不同深度土壤真菌多样性的海拔分布格局及其影响机制[J]. 土壤学报, 2023, 60(4): 1169-1182.]
(  0) 0) |
| [3] |
Che M, Nian Y, Chen S, et al. Spatio-temporal characteristics of human activities using location big data in Qilian Mountain National Park[J]. International Journal of Digital Earth, 2023, 16(1): 3794-3809. DOI:10.1080/17538947.2023.2259926
(  0) 0) |
| [4] |
Jiao S, Lu Y. Abundant fungi adapt to broader environmental gradients than rare fungi in agricultural fields[J]. Global Change Biology, 2020, 26(8): 4506-4520. DOI:10.1111/gcb.15130
(  0) 0) |
| [5] |
Xue M D, Guo Z Y, Gu X Y, et al. Rare rather than abundant microbial communities drive the effects of long-term greenhouse cultivation on ecosystem functions in subtropical agricultural soils[J]. Science of the Total Environment, 2020, 706: 136004. DOI:10.1016/j.scitotenv.2019.136004
(  0) 0) |
| [6] |
Li H, Hong Y W, Gao M K, et al. Distinct responses of airborne abundant and rare microbial communities to atmospheric changes associated with Chinese New Year[J]. iMeta, 2023, 2(4): e140. DOI:10.1002/imt2.140
(  0) 0) |
| [7] |
Shi G P, Luan L, Zeng Z Y, et al. Effects of long-term fertilization on bacterial diversity and community structure succession in red soil (In Chinese)[J]. Soils, 2024, 56(1): 73-81. [石广萍, 栾璐, 曾昭阳, 等. 不同施肥年限对红壤细菌多样性及群落结构演替的影响[J]. 土壤, 2024, 56(1): 73-81.]
(  0) 0) |
| [8] |
Kong Y L, Qin H, Zhu C Q, et al. Research progress on the mechanism by which soil microorganisms affect soil health (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(2): 331-347. [孔亚丽, 秦华, 朱春权, 等. 土壤微生物影响土壤健康的作用机制研究进展[J]. 土壤学报, 2024, 61(2): 331-347.]
(  0) 0) |
| [9] |
Liu X L, He Y Q, Li C L, et al. Distribution and physical properties of soil water-stable aggregates in red soils different in land use and soil fertility (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(3): 459-465. [刘晓利, 何园球, 李成亮, 等. 不同利用方式和肥力红壤中水稳性团聚体分布及物理性质特征[J]. 土壤学报, 2008, 45(3): 459-465.]
(  0) 0) |
| [10] |
Yin J Z, Tang J, Pan F F, et al. Effects of land use changes on soil aggregates and associated organic carbon in urban suburbs (In Chinese)[J]. Soils, 2024, 56(1): 49-55. [殷金忠, 唐蛟, 潘飞飞, 等. 城市近郊土地利用变化对土壤团聚体及其结合有机碳的影响[J]. 土壤, 2024, 56(1): 49-55.]
(  0) 0) |
| [11] |
Li J J, Muhammad A, Li C X. Rare methanotrophs adapt to broader environmental gradients than abundant methanotrophs in the riparian zone of the Three Gorges Reservoir[J]. Land Degradation and Development, 2023, 35(1): 249-263.
(  0) 0) |
| [12] |
Chang F, Jia F, Guan M, et al. Responses of soil rare and abundant sub-communities and physicochemical properties after application of different Chinese herb residue soil amendments[J]. Journal of Microbiology and Biotechnology, 2022, 32(5): 564-574. DOI:10.4014/jmb.2202.02029
(  0) 0) |
| [13] |
Mao C R, Ren Q, He C Y, et al. Assessing direct and indirect impacts of human activities on natural habitats in the Qinghai-Tibet Plateau from 2000 to 2020[J]. Ecological Indicators, 2023, 157: 111217. DOI:10.1016/j.ecolind.2023.111217
(  0) 0) |
| [14] |
Zhang Y, Zhou D Q, Zhao Q, et al. Diversity and ecological distribution of macrofungi in the Laojun Mountain region, southwestern China[J]. Biodiversity and Conservation, 2010, 19(12): 3545-3563. DOI:10.1007/s10531-010-9915-9
(  0) 0) |
| [15] |
Hu A, Jang K S, Tanentzap A J, et al. Thermal responses of dissolved organic matter under global change[J]. Nature Communications, 2024, 15(1): 576. DOI:10.1038/s41467-024-44813-2
(  0) 0) |
| [16] |
Caporaso J G, Lauber C L, Walters W A, et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(Suppl 1): 4516-4522.
(  0) 0) |
| [17] |
Kurm V, van der Putten W H, Weidner S, et al. Competition and predation as possible causes of bacterial rarity[J]. Environmental Microbiology, 2019, 21(4): 1356-1368. DOI:10.1111/1462-2920.14569
(  0) 0) |
| [18] |
Romano S, Savva G M, Bedarf J R, et al. Meta-analysis of the Parkinson's disease gut microbiome suggests alterations linked to intestinal inflammation[J]. NPJ Parkinson's Disease, 2021, 7(1): 27. DOI:10.1038/s41531-021-00156-z
(  0) 0) |
| [19] |
Kizilkaya R, Dengiz O. Variation of land use and land cover effects on soil some physico-chemical characteristics and soil enzyme activity[J]. Zemdirbyste-Agriculture, 2010, 97: 15-24.
(  0) 0) |
| [20] |
Yan X, Yang W, Muneer M A, et al. Land-use change affects stoichiometric patterns of soil organic carbon, nitrogen, and phosphorus in the red soil of Southeast China[J]. Journal of Soils and Sediments, 2021, 21(7): 2639-2649. DOI:10.1007/s11368-021-02953-8
(  0) 0) |
| [21] |
Seifu W, Elias E, Gebresamuel G, et al. The effects of land use and landscape position on soil physicochemical properties in a semiarid watershed, northern Ethiopia[J]. Applied and Environmental Soil Science, 2020, 2020(1): 8816248.
(  0) 0) |
| [22] |
Liu X, Li L, Wang Q, et al. Land-use change affects stocks and stoichiometric ratios of soil carbon, nitrogen, and phosphorus in a typical agro-pastoral region of Northwest China[J]. Journal of Soils and Sediments, 2018, 18(11): 3167-3176. DOI:10.1007/s11368-018-1984-5
(  0) 0) |
| [23] |
Bhutia P L, Gupta B, Yadav R, et al. Soil physico-chemical and biological properties as affected by vegetation systems and elevation in western Himalayas[J]. Range Management and Agroforestry, 2021, 42: 86-94.
(  0) 0) |
| [24] |
Smith J L, Halvorson J J, Bolton H. Soil properties and microbial activity across a 500m elevation gradient in a semi-arid environment[J]. Soil Biology and Biochemistry, 2002, 34(11): 1749-1757. DOI:10.1016/S0038-0717(02)00162-1
(  0) 0) |
| [25] |
Labouyrie M, Ballabio C, Romero F, et al. Patterns in soil microbial diversity across Europe[J]. Nature Communications, 2023, 14(1): 3311. DOI:10.1038/s41467-023-37937-4
(  0) 0) |
| [26] |
Fierer N, Jackson R B. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626-631.
(  0) 0) |
| [27] |
Hofmann K, Lamprecht A, Pauli H, et al. Distribution of prokaryotic abundance and microbial nutrient cycling across a high-alpine altitudinal gradient in the Austrian central Alps is affected by vegetation, temperature, and soil nutrients[J]. Microbial Ecology, 2016, 72(3): 704-716. DOI:10.1007/s00248-016-0803-z
(  0) 0) |
| [28] |
Rodrigues J L, Pellizari V H, Mueller R, et al. Conversion of the Amazon rainforest to agriculture results in biotic homogenization of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(3): 988-993.
(  0) 0) |
| [29] |
Zhou Z B, Zhang Y J, Zhang F G. Abundant and rare bacteria possess different diversity and function in crop monoculture and rotation systems across regional farmland[J]. Soil Biology and Biochemistry, 2022, 171: 108742. DOI:10.1016/j.soilbio.2022.108742
(  0) 0) |
| [30] |
Qiu Z, Li J, Wang P, et al. Response of soil bacteria on habitat-specialization and abundance gradient to different afforestation types[J]. Scientific Reports, 2023, 13(1): 18181. DOI:10.1038/s41598-023-44468-x
(  0) 0) |
| [31] |
Jiang Y, Song H, Lei Y, et al. Distinct co-occurrence patterns and driving forces of rare and abundant bacterial subcommunities following a glacial retreat in the eastern Tibetan Plateau[J]. Biology and Fertility of Soils, 2019, 55(4): 351-364. DOI:10.1007/s00374-019-01355-w
(  0) 0) |
| [32] |
Luan L, Jiang Y, Dini-Andreote F, et al. Integrating pH into the metabolic theory of ecology to predict bacterial diversity in soil[J]. Proceedings of the National Academy of Sciences of the United States of America, 2023, 120(3): e2207832120.
(  0) 0) |
| [33] |
Rousk J, Bååth E, Brookes P C, et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. The ISME Journal, 2010, 4(10): 1340-1351. DOI:10.1038/ismej.2010.58
(  0) 0) |
| [34] |
Huang R, Crowther T W, Sui Y, et al. High stability and metabolic capacity of bacterial community promote the rapid reduction of easily decomposing carbon in soil[J]. Communications Biology, 2021, 4(1): 1376. DOI:10.1038/s42003-021-02907-3
(  0) 0) |
| [35] |
Tian T, Li D M, Dai S K, et al. Culture methods of the oligotrophic marine microbe (In Chinese)[J]. Microbiology China, 2009, 36(7): 1031-1039. [田甜, 李冬梅, 戴世鲲, 等. 海洋环境中难培养微生物的寡营养培养[J]. 微生物学通报, 2009, 36(7): 1031-1039.]
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


