2. 中国科学院大学, 北京 100049;
3. 南京师范大学环境学院, 南京 210023;
4. 中国地质大学地球科学与资源学院, 北京 100083
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. School of Environment, Nanjing Normal University, Nanjing 210023, China;
4. School of Earth Sciences and Resources, China University of Geosciences, Beijing 100083, China
汞是一种无处不在的有毒元素,主要以单质汞、二价汞和甲基汞等多种形态存在于环境中。汞具有持久性、迁移性、高毒性和生物累积性,尤其是甲基汞具有神经毒性,可通过食物链和食物网进行生物积累。汞污染稻田中水稻富集甲基汞正成为一个严重的环境问题,摄食大米为汞矿区内陆居民甲基汞暴露的主要途径,严重危害人类健康,而稻田湿地生态系统淹水过程通过改变土壤的氧化还原电位,为汞甲基化提供厌氧环境,影响汞的生物地球化学循环[1-2]。一般认为,溶解性有机质(DOM)由于含有大量羟基、羧基及巯基等官能团,通过络合作用与汞形成有机-金属配合物(DOM-Hg),从而影响了汞的活性,可通过被动扩散或者主动运输等途径进入微生物体内参与氧化还原及甲基化反应,在淹水湿地等厌氧环境中多种厌氧微生物会使无机汞转化为零价汞或甲基汞,表明微生物和有机质是参与厌氧条件中汞形态转化的两个主要因素[3-5]。
环境中多种微生物参与汞的吸附/吸收、氧化/还原和甲基化等反应,在决定环境中汞形态转化方面发挥着关键作用[3]。硫酸盐还原菌、铁还原菌和产甲烷菌是常见的汞甲基化微生物[6],这归因于其具有hgcA和hgcB双基因簇,双基因簇可介导产生类咕啉蛋白和2[4Fe-4S]铁氧化还原蛋白,这两种蛋白质可在汞甲基化过程中分别作为甲基载体和类咕啉辅助因子还原的电子供体。汞甲基化功能微生物地杆菌(Geobacter sulfurreducens PCA,缩写G. sulfurreducens PCA)具有hgcA和hgcB双基因簇,是一种严格厌氧汞甲基化模式微生物,它在厌氧条件下能产生甲基汞,同时也拥有汞还原的能力[5,7-8]。G. sulfurreducens PCA将汞甲基化受多种环境因素(Hg(Ⅱ)浓度、有机质、温度、pH和盐度等)影响,例如一些硫醇分子(如半胱氨酸)因其巯基官能团强烈络合Hg(Ⅱ)离子,形成的半胱氨酸络合态汞(Cysteine-Hg(Ⅱ))配体可通过主动转运方式进入细胞,提高了G. sulfurreducens PCA微生物汞甲基化效率[8-9]。快速营造还原环境的希瓦氏菌(Shewanella putrefaciens CN32,缩写S. putrefaciens CN32)是一种兼性厌氧金属还原模式微生物,可参与汞在内的多种金属的微生物还原,S. putrefaciens CN32可分泌黄素等物质调节细胞外电子转移,具有强还原能力,可与有机质共同作用于汞的还原[10]。环境中微生物之间通过竞争、合作、共生等方式相互作用,联合培养微生物相互接触、近距离交换信号分子化学物质和代谢产物。Yu等[11]在研究微生物互养的汞甲基化途径时发现,两种汞甲基化微生物相互作用,可通过建立种间氢和乙酸盐转移的互养条件刺激和增强汞甲基化。在稻田湿地中,淹水使得微生物群落结构和多样性发生改变[12],兼性微生物和厌氧微生物大量共存,兼性微生物S. putrefaciens CN32快速营造缺氧环境,共培养微生物间的相互作用可能是甲基汞的主要来源,这两种微生物共培养条件下如何影响汞形态转化[13-14],其生物地球化学循环过程尚不明确,这制约了对汞污染稻田湿地中汞形态转化过程的认识,因此探究兼性微生物和厌氧微生物共培养状态下对汞形态转化的影响很有必要。
汞迁移转化受天然有机质的影响,这通常被认为是限制了汞的流动性和生物利用率[15-16]。DOM(包括低分子量硫醇配体)是稻田湿地中常见的竞争络合剂,通过影响环境中汞的赋存形态,进而影响微生物对汞的吸附/吸收、氧化/还原和甲基化过程[8,17-19]。已有研究表明半胱氨酸、谷胱甘肽和黄腐酸等DOM在汞形态转化中起重要作用[7-9,20-21]。Schaefer等[8]在研究汞甲基化过程中发现,某些硫醇络合态汞如Cysteine-Hg(Ⅱ)配体可能通过主动摄取机制优先被细胞摄取和甲基化,Hg(Ⅱ)与硫醇的络合作用是控制汞甲基化的重要因素,中等浓度(10~500 µmol·L–1)的半胱氨酸可促进硫铁还原菌G. sulfurreducens PCA生成甲基汞,而其他硫醇如2,3-二巯基丙磺酸(DMPS)则可去甲基化;谷胱甘肽则表现为促进D. desulfuricans ND132汞甲基化,却对G. sulfurreducens PCA无影响。DOM相关的硫醇官能团(DOM-RSH)的不同浓度决定了汞的形态和微生物的可利用度。环境中DOM对汞的络合和还原的双重作用将显著影响汞的化学和生物转化。S. putrefaciens CN32可利用DOM作为电子供体,将氧化态DOM转变为还原态DOM[22],DOM的性质在此过程中发生了显著变化。在淹水的稻田湿地中,DOM长期处于还原状态,还原态腐殖酸(包括胡敏酸和黄腐酸)含有丰富的供电子基团,能够介导汞的还原。而DOM介导下S. putrefaciens CN32和G. sulfurreducens PCA共培养如何影响汞的形态转化有待进一步研究。
本研究旨在探究DOM介导下兼性微生物(S. putrefaciens CN32)与汞甲基化微生物(G. sulfurreducens PCA)共培养对汞形态转化过程的影响。通过兼性微生物和厌氧微生物培养批处理试验,阐明DOM与微生物共培养对汞形态转化的影响,尤其是对汞在胞内胞外分配、还原和甲基化过程的影响,为稻田湿地厌氧环境中汞污染治理提供理论指导。
1 材料与方法 1.1 供试材料试验选用的Geobacter sulfurreducens PCA菌株由中国地质大学(北京)地质微生物实验室提供,Shewanella putrefaciens CN32菌株购于美国菌种保藏中心(ATCC)。实验选用的L-半胱氨酸(L-Cysteine,99%)购于Aladdin试剂公司,还原型谷胱甘肽(Glutathione,99%)购于Macklin试剂公司,黄腐酸(Fulvic acid,90%)购于源叶试剂公司。氯化甲基汞标准液(100 mg·L–1,溶于甲醇)购于德国标准品公司Dr. Ehrenstorfer,硝酸汞标准液(1 000 mg·L–1,3% HNO3)购于国家有色金属与电子材料分析检测中心(GSB 04-1729-2004),标准品均在4℃避光保存。其他主要化学试剂均为分析纯级别。实验用水均为超纯水(18 ΩM)。实验所用高纯气体纯度不小于99.99%(体积分数)。所用仪器包括:恒温水浴摇床(SHZ-28A,江苏太仓),生化培养箱(SHP-750,上海精宏),紫外-可见分光光度计(UV 8100 B,LabTech,北京莱伯泰科),厌氧手套箱(Plas-Labs controlled atmosphere chamber,美国,气体氛围为N2︰CO2︰H2= 8︰1︰1(v/v)),测汞仪(MERX-M,Brooks Rand Model Ⅲ,美国),原子荧光光度计(BSA-100A型,北京宝德仪器)。
1.2 微生物培养与还原态DOM(Reduced DOM)的制备地杆菌培养基ATCC 1957 Geobacter用混合气N2︰CO2 = 8︰2(v/v)曝气除氧2 h,然后胶塞密封;肉汤培养基LB(Luria-Bertani)培养基,透气膜封口;将两种培养基在高温高压条件下(121℃,20 min)灭菌处理。G. sulfurreducens PCA接种于ATCC 1957 Geobacter培养基,在生化培养箱恒温(30℃)静置避光厌氧培养;S. putrefaciens CN32接种于LB肉汤培养基,在水浴摇床恒温避光有氧培养(30℃,180 r·min–1)。培养至指数生长阶段,将G. sulfurreducens PCA和S. putrefaciens CN32菌液在厌氧手套室中离心20 min(4 000 r·min–1,25℃)。离心后倒出培养液,将细胞重悬于pH约7.4的无氧磷酸盐培养基中。磷酸盐培养基由0.14 mol·L–1 NaCl、3 mmol·L–1 KCl、10 mmol·L–1 Na2HPO4和2 mmol·L–1 KH2PO4组成,将磷酸盐培养基分装于200 mL厌氧瓶(或血清瓶)中,用混合气N2:CO2 = 8:2(v/v)曝气除氧2 h后胶塞密封,高温高压灭菌(121℃)20 min,使用前在手套箱中平衡过夜[18,23]。重复清洗离心操作3次,用磷酸盐培养基重悬菌体沉淀,即为浓缩菌悬液,最终的细胞密度通过在600 nm处测量光密度(OD)来确定,使实验体系中G. sulfurreducens PCA和S. putrefaciens CN32细胞浓度分别为约5.0 × 107 cells·mL–1和约1.0 × 108 cells·mL–1。
在手套箱中,用无氧水溶解3种DOM,并用0.22 μm聚醚砜滤膜过滤去除杂菌,将其分别加入S. putrefaciens CN32浓缩菌悬液,厌氧培养48 h[20]。培养后用0.22 μm聚醚砜滤膜过滤去除微生物,滤液即为还原态DOM,将滤液在厌氧培养瓶中4℃避光保存。此步骤S. putrefaciens CN32处理得到还原态DOM,包括还原态胞外聚合物(Re-EPS)、还原态半胱氨酸(Re-CYS)、还原态谷胱甘肽(Re-GSH)和还原态黄腐酸(Re-FA)溶液。半胱氨酸(CYS)、谷胱甘肽(GSH)浓度为50 μmol·L–1 [8],黄腐酸(FA)浓度为0.4 mmol·L–1(以C计)。
1.3 汞形态转化实验方法在50 mL棕色厌氧瓶中,将G. sulfurreducens PCA浓缩菌悬液接种至磷酸盐培养基中,得到PCA处理组;将S. putrefaciens CN32浓缩菌悬液接种至磷酸盐培养基中,得到CN32处理组;将S. putrefaciens CN32和G. sulfurreducens PCA浓缩菌悬液接种至同一磷酸盐培养基中,得到CN32-PCA处理组;将G. sulfurreducens PCA浓缩菌悬液接种至磷酸盐培养基中,并将半胱氨酸(CYS)、谷胱甘肽(GSH)和黄腐酸(FA)三种DOM溶液和Hg(Ⅱ)溶液预先混合48 h,得到DOM-Hg(Ⅱ)溶液,将其加入菌悬液中分别得到CYS-PCA、GSH-PCA和FA-PCA处理组;将S. putrefaciens CN32和G. sulfurreducens PCA浓缩菌悬液接种至磷酸盐培养基中,并加入预先混合的DOM-Hg(Ⅱ)溶液,分别得到CYS-CN32-PCA、GSH-CN32-PCA和FA-CN32-PCA处理组;将G. sulfurreducens PCA浓缩菌悬液接种至还原态DOM溶液中,分别得到Re-EPS-PCA、Re-CYS-PCA、Re-GSH-PCA和Re-FA-PCA处理组。使所有实验体系总体积为20 mL,Hg(Ⅱ)初始浓度为50 nmol·L–1,半胱氨酸(CYS)、谷胱甘肽(GSH)初始浓度均为50 μmol·L–1,黄腐酸(FA)初始浓度(以C计)为0.4 mmol·L–1。实验以无细胞、无DOM的磷酸盐培养基作为对照组[5]。
在本文描述的所有实验中,每组处理分别制备3个重复样品。在所有图中,误差条表示实验重复样品的测量不确定度(标准差)。
将对照组和实验处理组置于生化培养箱中恒温(30℃)避光培养;培养4 h后,取样测定可吹扫零价汞(Hg(0))、甲基汞(MeHg)、消解总汞(THg)和胞外总汞(Hgsol)。
1.4 样品处理与分析细菌密度的测定:取摇匀菌液,用紫外-可见分光光度计测定波长600 nm时的透光度,计算细胞密度。之后使用磷酸盐培养基将菌液浓缩/稀释至实验所需浓度。
总有机碳(TOC)分析:严格按照标准HJ 615-2011[24]测定黄腐酸中总有机碳TOC。
零价汞、甲基汞的测定:零价汞(Hg(0))和甲基汞(MeHg)使用冷原子荧光光度计(CVAFS,Brooks Rand Model Ⅲ,美国)测定。根据EPA 1631[25]测定方法,零价汞待测样品从厌氧瓶中直接经高纯氮气吹扫至金砂管上富集检测。根据EPA 1630[26]测定方法,取1 mL菌液加入浓HCl(0.4%,v/v)于4℃保存,用于测定甲基汞(MeHg),甲基汞待测样品需经过蒸馏和乙基化处理,再将产生的乙基汞吹扫至Tenax管上富集检测。
总汞的测定:胞外总汞(Hgsol)和消解总汞(THg)使用原子荧光光度计(BSA-100A原子荧光光谱联用仪)测定。取1 mL菌液于消解管中,加入2 mL浓硝酸后于95℃水浴中消解至溶液澄清(6~8 h);冷却后,取1 mL消解液于4℃保存,用于测定THg。取2 mL菌液用0.22 μm聚醚砜滤膜过滤后,加入浓HCl(0.4%,v/v)于4℃保存,用于测定Hgsol。根据EPA1631[25]测定方法,向待测溶液中加入BrCl以实现完全氧化;反应24 h后,加入NH2OH·HCl(300 g·L–1)去除过量BrCl至溶液黄绿色褪去,获得THg和Hgsol上机待测液。
胞内总汞(Hgcell)通过消解总汞(THg)减去胞外总汞(Hgsol)得出,如下式(1)。
| $ {\text{Hg}}_{\text{cell}=}\text{THg-}{\text{Hg}}_{\text{sol}} $ | (1) |
采用Excel 2010软件进行数据处理;为总体比较数据差异性,使用统计分析软件SPSS 22进行单因素方差分析(ANOVA,α=0.05),组间差异选用最小显著差异法(LSD)多重比较检验。
2 结果与讨论 2.1 DOM介导下汞在微生物的胞内胞外分配由图 1a、图 1b可知,G. sulfurreducens PCA细菌对Hg(Ⅱ)的单位细胞吸附/吸收容量为2.9 × 10–12 μg·cell–1,仅为S. putrefaciens CN32细菌的69.0%,这可能是由于S. putrefaciens CN32细菌中的细胞蛋白或含硫醇的细胞成分参与了Hg(Ⅱ)的竞争络合或配体交换,细胞膜特性和水溶液化学条件也可能影响微生物对Hg(Ⅱ)的吸附/吸收[18]。其结果表明,细胞对Hg(Ⅱ)的吸附和吸收是一个复杂的过程,S. putrefaciens CN32(非甲基化细菌)对Hg(Ⅱ)的吸收吸附能力强于G. sulfurreducens PCA(甲基化细菌),该结果可能暗示了非甲基化细菌在吸附/吸收Hg(Ⅱ)时强于汞甲基化细菌的类似共性[18]。将两种细胞菌悬液混合培养对Hg(Ⅱ)的单位细胞吸附/吸收容量为2.8 × 10–12 μg·cell–1,与单一细胞培养相比,两种细胞共培养同时对Hg(Ⅱ)的竞争吸附/吸收可能不利于Hg(Ⅱ)离子进入细胞,这说明两种细胞同时对Hg(Ⅱ)的吸附/吸收不是简单意义上的相加,而是在胞内胞外Hg(Ⅱ)离子渗透压平衡的前提下进行的。
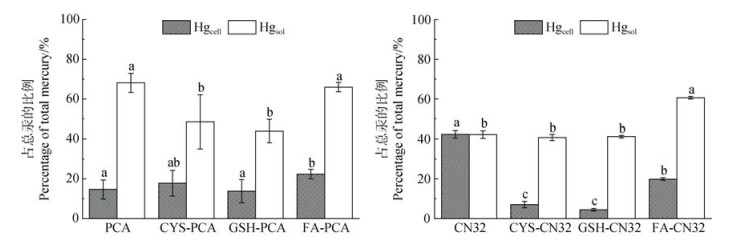
|
注:Hgcell为胞内总汞,Hgsol为胞外总汞。PCA为G. sulfurreducens PCA菌悬液+50 nmol·L–1 Hg(Ⅱ)新鲜输入汞溶液处理组,CYS-PCA、GSH-PCA和FA-PCA分别为G. sulfurreducens PCA菌悬液+预先混合48 h的CYS-Hg(Ⅱ)、GSH-Hg(Ⅱ)和FA-Hg(Ⅱ)有机络合态汞溶液处理组;CN32为S. putrefaciens CN32菌悬液+50 nmol·L–1 Hg(Ⅱ)新鲜输入汞溶液处理组,CYS-CN32、GSH-CN32和FA-CN32分别为S. putrefaciens CN32菌悬液+预先混合48 h的CYS-Hg(Ⅱ)、GSH-Hg(Ⅱ)和FA-Hg(Ⅱ)有机络合态汞溶液处理组。图上不同小写字母表示相同汞形态不同处理间差异显著(P < 0.05)。下同。 Note: Hgcell is total intracellular mercury, Hgsol is total extracellular mercury. PCA treatment was G. sulfurreducens PCA bacterial suspension followed by the addition of 50 nmol·L–1 Hg(Ⅱ) solution. CYS-PCA, GSH-PCA and FA-PCA were treated with cysteine, glutathione and fulvic acid with 50 nmol·L–1 Hg(Ⅱ) organic complex solution pre-mixed for 48 h followed by the addition of G. sulfurreducens PCA bacterial suspension, respectively. CN32 treatment was S. putrefaciens CN32 bacterial suspension followed by the addition of 50 nmol·L–1 Hg(Ⅱ) solution. CYS-CN32, GSH-CN32 and FA-CN32 were treated with cysteine, glutathione and fulvic acid with 50 nmol·L–1 Hg(Ⅱ) organic complex solution pre-mixed for 48 h followed by the addition of S. putrefaciens CN32 bacterial suspension, respectively. Different lowercase letters mean significant difference between different treatments of the same Hg species (P < 0.05). The same as below. 图 1 溶解性有机质(DOM)对G. sulfurreducens PCA(a)或S. putrefaciens CN32(b)细胞培养体系Hg(Ⅱ)胞内胞外分配的影响 Fig. 1 The effects of dissolved organic matter (DOM) on the intracellular and extracellular distribution of Hg(Ⅱ) in G. sulfurreducens PCA (a) or S. putrefaciens CN32 (b) |
DOM对不同微生物培养体系的作用效果有显著差别。如图 1a所示,半胱氨酸和谷胱甘肽对G. sulfurreducens PCA细菌的影响主要表现在体系胞外总汞比例下降,而对胞内总汞比例影响不显著,表明这两种DOM可能促进汞进入细胞发生还原转化,并将零价汞排出细胞逃逸至容器顶空[5]。如图 1b所示,半胱氨酸和谷胱甘肽对S. putrefaciens CN32细菌的影响主要表现在胞内总汞比例上,而对胞外总汞比例无显著影响,其中细胞吸附/吸收Hg(Ⅱ)离子显著下降,说明半胱氨酸和谷胱甘肽络合形态汞Cysteine-Hg(Ⅱ)配体和GSH-Hg(Ⅱ)配体可能不易被S. putrefaciens CN32细胞吸附/吸收并利用,但由于S. putrefaciens CN32分泌胞外聚合物介导体系中电子传递,仍然促进了细胞外汞还原。而黄腐酸未显著影响两种微生物的胞内总汞和胞外总汞含量变化,且黄腐酸处理中胞外总汞比例较大,说明黄腐酸由于其高分子量和复杂结构,对汞以络合作用为主导,未提高汞的生物可利用性。
如图 2所示,两种微生物细胞共培养体系由于细胞数量增加,对Hg(Ⅱ)的吸附/吸收能力较单一细胞培养显著增强,但对Hg(Ⅱ)的单位细胞吸附/吸收容量略有降低,这可能是由于兼性微生物和厌氧微生物共培养后营造的还原环境对汞的还原作用快速增强,迅速降低了体系内汞的生物有效性,从而导致细胞对汞的吸附/吸收量显著下降。半胱氨酸和谷胱甘肽络合态汞对两种微生物细胞共培养体系的影响主要表现在胞外总汞比例上,对胞内总汞比例无显著影响,此时胞内总汞比例下降,是由于两种微生物对汞的吸附/吸收以络合为主,对汞的还原转化主要发生在胞外溶液中。还原态半胱氨酸和谷胱甘肽对G. sulfurreducens PCA细菌的影响主要表现在胞内总汞比例上升,其原因可能是还原态半胱氨酸和谷胱甘肽中的巯基官能团含量高,能够强烈络合Hg(Ⅱ)离子,提高汞对G. sulfurreducens PCA细胞的生物可利用性,促进汞在细胞上吸附/吸收。实验结果突显了DOM的官能团类型和微生物种类对Hg(Ⅱ)胞内胞外分配及后续形态转化的调控机制的差异性。

|
注:CN32-PCA为S. putrefaciens CN32菌悬液和G. sulfurreducens PCA菌悬液混合后+50 nmol·L–1 Hg(Ⅱ)新鲜输入汞溶液处理组,CYS-CN32-PCA、GSH-CN32-PCA和FA-CN32-PCA分别为S. putrefaciens CN32菌悬液和G. sulfurreducens PCA菌悬液混合后+预先混合48 h的CYS-Hg(Ⅱ)、GSH-Hg(Ⅱ)和FA-Hg(Ⅱ)有机络合态汞溶液处理组;Re-EPS-PCA为G. sulfurreducens PCA菌悬液+还原态胞外聚合物+50 nmol·L–1 Hg(Ⅱ)汞溶液处理组,Re-CYS-PCA、Re-GSH-PCA和Re-FA-PCA分别为G. sulfurreducens PCA菌悬液+还原态半胱氨酸、谷胱甘肽和黄腐酸溶液+50 nmol·L–1 Hg(Ⅱ)汞溶液处理组。下同。 Note: CN32-PCA treatment was the mixture of S. putrefaciens CN32 and G. sulfurreducens PCA bacterial suspension, followed by the addition of 50 nmol·L–1 Hg(Ⅱ) solution. CYS-CN32-PCA, GSH-CN32-PCA and FA-CN32-PCA treatments were mixed with S. putrefaciens CN32 and G. sulfurreducens PCA bacterial suspension, respectively, and cysteine, glutathione, fulvic acid with 50 nmol·L–1 Hg(Ⅱ) organic complex solution pre-mixed 48 h. Re-EPS-PCA treatment was G. sulfurreducens PCA bacterial suspension followed by the addition of reduced extracellular polymer and 50 nmol·L–1 Hg(Ⅱ) solution. Re-CYS-PCA, Re-GSH-PCA and Re-FA-PCA were treated with G. sulfurreducens PCA bacteria suspension followed by the addition of reduced cysteine, glutathione and fulvic acid solution and 50 nmol·L–1 Hg(Ⅱ) solution, respectively. The same as below. 图 2 氧化态DOM(a)或还原态DOM(b)介导下S. putrefaciens CN32直接或间接对G. sulfurreducens PCA细胞培养体系Hg(Ⅱ)胞内胞外分配的影响 Fig. 2 The effects of S. putrefaciens CN32 directly or indirectly on the intracellular and extracellular distribution of Hg(Ⅱ) in G. sulfurreducens PCA mediated by oxidized DOM (a) or reduced DOM (b) |
G. sulfurreducens PCA和S. putrefaciens CN32均为环境中常见的铁还原菌,其活性和数量直接影响汞的微生物还原。如图 3a、图 3b所示,在无DOM介导的条件下,S. putrefaciens CN32和G. sulfurreducens PCA分别单独培养,两种微生物对汞的还原能力相当;在DOM介导时,半胱氨酸和谷胱甘肽均促进了两种微生物G. sulfurreducens PCA和S. putrefaciens CN32单独培养时对Hg(Ⅱ)的还原,且对S. putrefaciens CN32汞还原的促进作用强于G. sulfurreducens PCA,这与S. putrefaciens CN32分泌还原性胞外聚合物介导电子传递,进而促进汞还原有关;半胱氨酸和谷胱甘肽介导G. sulfurreducens PCA汞还原的比例分别为38.6% ± 5.3%和42.2% ± 1.1%,而介导S. putrefaciens CN32汞还原的比例分别是52.1 % ± 7.6%和58.1% ± 6.6%。黄腐酸抑制了两种微生物对Hg(Ⅱ)的还原,这表明DOM官能团的络合固定作用及DOM:Hg(Ⅱ)的质量比等是影响Hg(Ⅱ)还原的重要因素。含巯基的有机物对汞的亲和能力强,含巯基的半胱氨酸和谷胱甘肽与汞络合形成的Cysteine-Hg(Ⅱ)和GSH-Hg(Ⅱ)极大地提高了Hg(Ⅱ)的生物可利用性,促进了微生物对汞的还原,还原后的Hg(0)被排出胞外,并且大部分零价汞通过挥发等形式离开溶液体系[27]。而黄腐酸与Hg(Ⅱ)络合形成稳定的络合物FA-Hg(Ⅱ),使Hg(Ⅱ)⇋ Hg(0)平衡向生成Hg(Ⅱ)的方向移动,络合作用占主导,从而抑制了汞的还原作用[28]。
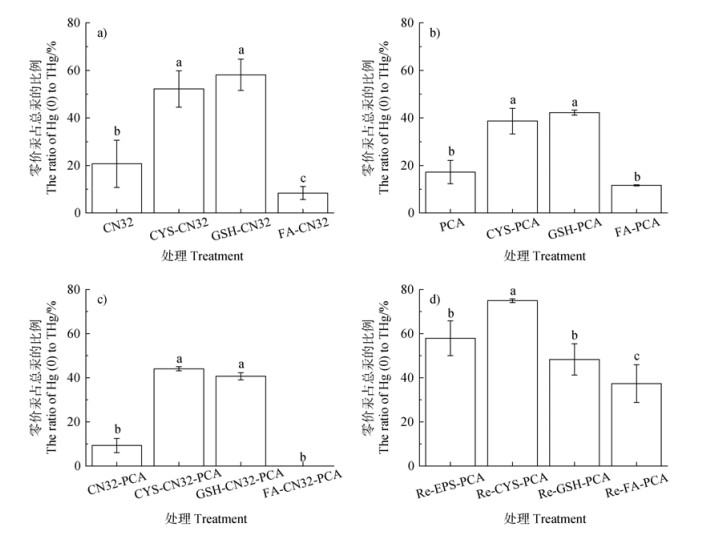
|
注:不同小写字母表示不同处理间差异显著(P < 0.05)。 Note: Different lowercase letters mean significant difference between different treatments(P < 0.05). 图 3 三种DOM对G. sulfurreducens PCA(a)和S. putrefaciens CN32(b)两种微生物分别单独培养、直接共培养(c)和间接共培养(d)体系中Hg(Ⅱ)还原的影响 Fig. 3 Effect of three kinds of DOM on mercury reduction in G. sulfurreducens PCA (a) and S. putrefaciens CN32 b (b) cultured alone, directly co-culture (c) and indirectly co-culture (d), respectively |
微生物的细胞种类和密度等因素也会强烈影响汞还原。如图 3c所示,S. putrefaciens CN32和G. sulfurreducens PCA共培养时,较高的细胞密度直接提高了细胞对Hg(Ⅱ)的吸附/吸收量,细胞的吸附固定作用直接抑制了汞还原作用;也有可能是因为还原产生的Hg(0)被大量存在的细胞吸附固定,从而导致零价汞比例有所下降[5]。半胱氨酸和谷胱甘肽在两种微生物共培养体系中依旧促进了汞的还原,且与微生物单独培养时促进作用相当。而黄腐酸的络合作用与两种细胞的吸附/吸收作用叠加后,显著抑制了汞的还原,基本无零价汞可被检测到。如图 3d所示,由于S. putrefaciens CN32分泌黄素等渗出物介导电子传递,故其还原态胞外聚合物促进了体系内汞的还原;相较于氧化态DOM,还原态DOM均不同程度上促进了体系内汞的还原。这是由于还原态DOM官能团种类、数量和性质等发生改变,在还原状态下,半胱氨酸形成的双硫键结合能力下降,进而断开成巯基,巯基含量升高,半胱氨酸中的巯基络合态汞对G. sulfurreducens PCA细胞有极高的生物可利用性,易通过主动转运进入细胞中,在电子传递链的作用下,促进细胞内发生汞还原;而谷胱甘肽由于无特异性转运蛋白的缘故不能进入G. sulfurreducens PCA细胞[8],仅在细胞外及细胞表面发生汞还原。这两种还原态DOM与还原态胞外聚合物介导汞还原的效果相似;而还原态黄腐酸由于其分子量、与汞高质量比和分子性质等因素对Hg(Ⅱ)的固定作用使汞变成了不能被细胞利用的汞,对微生物汞还原呈抑制作用。
2.3 DOM对汞还原的影响DOM对汞具有络合和还原双重作用,实际稻田湿地长期淹水状态下土壤中DOM处于还原状态,淹水条件下还原态DOM的性质不同于排水条件下氧化态DOM,为查明不同性质DOM对Hg(Ⅱ)的络合和还原作用,分别进行了氧化态DOM和还原态DOM对汞还原的动力学实验。如图 4a所示,氧化态DOM对Hg(Ⅱ)具有络合作用;与对照组(磷酸盐培养基)相比,3种DOM(半胱氨酸、谷胱甘肽和黄腐酸)的还原能力低,其对Hg(Ⅱ)主要表现为络合作用,并且抑制了Hg(Ⅱ)在容器中的还原挥发。如图 4b所示,S. putrefaciens CN32胞外聚合物为还原态对照组(Re-EPS),还原态胞外聚合物在实验初期对Hg(Ⅱ)的还原作用不显著,但随着时间延长,在0~24 h内可持续还原Hg(Ⅱ)离子,这是由于S. putrefaciens CN32细胞分泌黄素等外渗出物调节细胞外电子转移,具有强还原能力。此外,与氧化态DOM相比,还原态DOM对Hg(Ⅱ)的还原能力显著增强,且还原态半胱氨酸和还原态谷胱甘肽对Hg(Ⅱ)的还原作用在前8 h显著,在8 h后零价汞产量趋于零;而还原态黄腐酸对Hg(Ⅱ)的还原作用弱,这与之前的研究[29]有很大区别,可能是由于不同来源的黄腐酸其化学组成和结构具有显著差别,含氧官能团含量不同,故表现出不同性质。此外,还原态黄腐酸与汞的高质量比也是产生强络合结果的原因,络合作用与还原作用竞争有效态汞,故还原作用不显著[20]。

|
注:Ctrl为磷酸盐培养基+50 nmol·L–1 Hg(Ⅱ)新鲜输入汞溶液对照组,CYS、GSH和FA分别为半胱氨酸、谷胱甘肽和黄腐酸溶液+50 nmol·L–1 Hg(Ⅱ)新鲜输入汞溶液处理组;Re-EPS为还原态胞外聚合物+50 nmol·L–1 Hg(Ⅱ)新鲜输入汞溶液对照组,Re-CYS、Re-GSH和Re-FA分别为还原态半胱氨酸、谷胱甘肽和黄腐酸溶液+50 nmol·L–1 Hg(Ⅱ)新鲜输入汞溶液处理组。 Note: Ctrl treatment was phosphate medium with the addition of 50 nmol·L–1 Hg(Ⅱ) solution. CYS, GSH and FA treatments were cysteine, glutathione and fulvic acid solution with the addition of 50 nmol·L–1 Hg(Ⅱ) solution, respectively. Re-EPS treatment was reduced extracellular polymer with the addition of 50 nmol·L–1 Hg(Ⅱ) solution. Re-CYS, Re-GSH and Re-FA treatments were reduced cysteine, glutathione and fulvic acid solution with the addition of 50 nmol·L–1 Hg(Ⅱ) solution, respectively 图 4 氧化态DOM(a)和还原态DOM(b)对Hg(Ⅱ)还原的动力学 Fig. 4 Kinetics of reduction of mercury by oxidized DOM (a) and reduced DOM (b) |
应用假一级动力学拟合还原态DOM对Hg(Ⅱ)还原反应如下式(2):
| $ [\text{Hg}(0)]=[\text{Hg}(\text{II})]_{0}[1–\exp(–k_\text{R}\text{t})] $ | (2) |
式中,kR为速率常数,h–1;[Hg(Ⅱ)]0为Hg(Ⅱ)初始浓度,nmol·L–1;[Hg(0)]为还原的Hg(0)浓度,nmol·L–1;t为反应时间,h。
本实验以不加任何DOM和微生物的磷酸盐培养基作为空白对照(Ctrl)。
如图 4b所示,S. putrefaciens CN32胞外聚合物对汞的还原符合假一级动力学方程,经S. putrefaciens CN32还原制备的有机质中,还原态半胱氨酸对汞的还原基本符合假一级动力学方程,但还原能力低于S. putrefaciens CN32胞外聚合物对汞的还原,说明有机质的络合作用仍然起到一定作用,假一级动力学反应常数如下表 1所示。由于竞争络合作用占主导以及还原态DOM对Hg(0)的诱导性氧化络合作用[28],假一级动力学方程不能描述还原态谷胱甘肽和还原态黄腐酸对汞的还原。
|
|
表 1 汞还原假一级动力学反应常数 Table 1 Pseudo-first-order rate constants for Hg reduction |
G. sulfurreducens PCA和S. putrefaciens CN32不仅影响汞还原,也与汞甲基化息息相关,且不同DOM对微生物汞甲基化影响有显著区别。G. sulfurreducens PCA是一种模式汞甲基化微生物。而S. putrefaciens CN32是非汞甲基化细菌,在有氧条件下有较高丰度,同时具有兼性微生物特性;在厌氧条件下快速营造还原环境,可能强烈影响其他微生物汞甲基化。DOM的络合和还原作用影响汞的活性、流动性和挥发性,进而影响汞对甲基化的可用性。如图 5a所示,在G. sulfurreducens PCA单一培养处理中,细胞对Hg(Ⅱ)的净甲基化比例为9.4% ± 0.3%,而半胱氨酸、谷胱甘肽和黄腐酸介导G. sulfurreducens PCA微生物对Hg(Ⅱ)的净甲基化比例分别为15.9% ± 2.8%、10.8% ± 0.8%、7.8% ± 2.8%。半胱氨酸介导G. sulfurreducens PCA微生物汞形态转化时,促进了甲基汞的产生,这归因于半胱氨酸作为小分子含巯基有机配体,形成高生物可利用性的Cysteine-Hg(Ⅱ)配体分子,促进了G. sulfurreducens PCA以主动吸收的方式吸收溶液中Cysteine-Hg(Ⅱ)配体络合态汞,进而提高甲基汞产量[30],且甲基汞在生成后能较快排出细胞,降低胞内总汞比例,实现解毒[5]。因此,DOM介导汞在G. sulfurreducens PCA培养体系胞内胞外分配的汞含量变化主要体现在胞外总汞上,这表明Hg(Ⅱ)与某些硫醇的络合作用是控制汞胞内胞外分配、还原及甲基化的重要因素[8,18]。谷胱甘肽作为一种分子量较大的含巯基有机配体,对Hg(Ⅱ)有较强的络合能力,易形成GSH-Hg(Ⅱ)配合物,但该配合物不能以主动转运的方式进入G. sulfurreducens PCA细胞,故未促进其汞甲基化,但促进了汞还原,这归因于细胞外表面介导的胞外电子传递诱导汞还原而不能促使胞内发生汞甲基化。黄腐酸处理降低了汞甲基化效率,这是由于大分子黄腐酸含有多种官能团,对汞形成固定包裹,且与Hg(Ⅱ)络合形成的FA-Hg(Ⅱ)配体仅能吸附在细胞表面却不能被细胞吸收转化,降低了汞的生物可利用性,进而抑制了微生物汞甲基化。如图 5b所示,S. putrefaciens CN32在单一培养条件和加入DOM促进条件下均未检出甲基汞,这归因于S. putrefaciens CN32细菌可能缺少汞甲基化代谢途径或仅具备弱甲基化能力[31]。在半胱氨酸和谷胱甘肽介导下S. putrefaciens CN32细菌对Hg(Ⅱ)的还原作用增强,零价汞逃逸出溶液体系,导致溶液中汞的生物可利用性下降,而黄腐酸由于高分子量和与Hg(Ⅱ)高质量比,降低了汞的生物可利用性,3种DOM均降低了发生汞甲基化的可能,故均未表现出对S. putrefaciens CN32汞甲基化的促进作用。

|
注:Hg(0)为零价汞,MeHg为甲基汞。下同。 Note: Hg(0)is zero valent mercury and MeHg is methylmercury. The same as below. 图 5 DOM对G. sulfurreducens PCA(a)或S. putrefaciens CN32(b)单一培养体系中汞的形态分布的影响 Fig. 5 The effects of DOM on the Hg species distribution in G. sulfurreducens PCA (a) or S. putrefaciens CN32 (b) |
如图 6所示,在S. putrefaciens CN32与G. sulfurreducens PCA共培养体系中(CN32-PCA),细菌对Hg(Ⅱ)的吸附/吸收比例为41.7% ± 4.4%,还原比例为7.4% ± 0.7%,净甲基化比例为0.9% ± 0.3%。与G. sulfurreducens PCA单一培养处理相比,加入S. putrefaciens CN32后细胞数量增加,对Hg(Ⅱ)的吸附/吸收量变大,汞还原量略有降低,甲基汞产量显著降低。由于S. putrefaciens CN32的竞争吸附/吸收作用强于G. sulfurreducens PCA,Hg(Ⅱ)对G. sulfurreducens PCA的生物可利用性显著降低。这与之前的研究中发现的Sulfidogens和Methanogens两种汞甲基化微生物间协同生长促进低硫酸盐缺氧淡水沉积物中汞甲基化结果[32]不同,说明了微生物共培养对汞甲基化影响的复杂性。在S. putrefaciens CN32与G. sulfurreducens PCA共培养体系中时,半胱氨酸络合态汞介导微生物对Hg(Ⅱ)的还原比例为36.7% ± 0.8%,净甲基化比例为18.7% ± 2.6%,相较于半胱氨酸介导G. sulfurreducens PCA微生物,其汞甲基化比例显著增加,这种增加不仅是由于细胞膜蛋白主动转运半胱氨酸Cysteine-Hg(Ⅱ)进入细胞,将吸收的Hg(Ⅱ)转化为甲基汞,还因为两种微生物共培养提高了Cysteine-Hg(Ⅱ)对G. sulfurreducens PCA的生物可利用性[33],进而促进了其汞甲基化。而谷胱甘肽对S. putrefaciens CN32与G. sulfurreducens PCA共培养体系的影响,与其对G. sulfurreducens PCA单一培养体系相比,汞甲基化率显著降低,此时仅表现为S. putrefaciens CN32对G. sulfurreducens PCA汞甲基化的抑制作用。在S. putrefaciens CN32与G. sulfurreducens PCA共培养体系中,黄腐酸大分子对Hg(Ⅱ)的固定作用和S. putrefaciens CN32的竞争吸附/吸收作用均阻抑了汞甲基化发生。

|
图 6 不同DOM介导下S. putrefaciens CN32和G. sulfurreducens PCA共培养体系对汞的形态分布的影响 Fig. 6 The effects of S. putrefaciens CN32 and G. sulfurreducens PCA co-culture on the Hg species distribution under different DOM mediations |
G. sulfurreducens PCA单位细胞吸附/吸收汞容量为2.9×10–12 μg·cell–1,远低于S. putrefaciens CN32,不同微生物的单位细胞吸附/吸收汞容量有显著差异,这与细胞蛋白组分和含量等有关。含巯基的半胱氨酸和谷胱甘肽提高了汞的生物可利用性,改变了两种微生物胞内和胞外总汞比例,同时促进了两种微生物单一培养和共培养体系的微生物汞还原,半胱氨酸促进G. sulfurreducens PCA汞还原比例为32.5%,谷胱甘肽促进汞还原比例高达37.7%,但黄腐酸由于形成稳定络合物FA-Hg(Ⅱ),抑制了汞还原。半胱氨酸络合态汞通过提高汞对G. sulfurreducens PCA的生物可利用性,促进了其甲基化,此时汞甲基化比例为15.9%;此外,半胱氨酸络合态汞介导S. putrefaciens CN32和G. sulfurreducens PCA共培养体系进一步增强了汞甲基化,甲基化比例高达18.7%。
致谢 感谢中国地质大学(北京)侯卫国副教授和中国科学院青藏高原研究所张更新研究员在厌氧微生物培养中的指导和帮助!感谢华中农业大学刘玉荣教授和刘琴在甲基汞测定中的指导和帮助!
| [1] |
Feng L, Zhang C C, Liu H H, et al. Impact of low-level mercury exposure on intelligence quotient in children via rice consumption[J]. Ecotoxicology and Environmental Safety, 2020, 202: 110870. DOI:10.1016/j.ecoenv.2020.110870
(  0) 0) |
| [2] |
Zhao L, Meng B, Feng X B. Mercury methylation in rice paddy and accumulation in rice plant: A review[J]. Ecotoxicology and Environmental Safety, 2020, 195: 110462. DOI:10.1016/j.ecoenv.2020.110462
(  0) 0) |
| [3] |
Grégoire D S, Poulain A J. Shining light on recent advances in microbial mercury cycling[J]. Facets, 2018, 3(1): 858-879. DOI:10.1139/facets-2018-0015
(  0) 0) |
| [4] |
Huang H Y, Mitchell C P J. Spatial and seasonal patterns of mercury concentrations, methylation and demethylation in central Canadian boreal soils and stream sediment[J]. Science of the Total Environment, 2023, 891: 164447. DOI:10.1016/j.scitotenv.2023.164447
(  0) 0) |
| [5] |
Hu H Y, Lin H, Zheng W, et al. Oxidation and methylation of dissolved elemental mercury by anaerobic bacteria[J]. Nature Geoscience, 2013, 6: 751-754. DOI:10.1038/ngeo1894
(  0) 0) |
| [6] |
Hsu-Kim H, Kucharzyk K H, Zhang T, et al. Mechanisms regulating mercury bioavailability for methylating microorganisms in the aquatic environment: A critical review[J]. Environmental Science & Technology, 2013, 47(6): 2441-2456.
(  0) 0) |
| [7] |
Schaefer J K, Morel F M M. High methylation rates of mercury bound to cysteine by Geobacter sulfurreducens[J]. Nature Geoscience, 2009, 2: 123-126. DOI:10.1038/ngeo412
(  0) 0) |
| [8] |
Schaefer J K, Rocks S S, Zheng W, et al. Active transport, substrate specificity, and methylation of Hg(Ⅱ) in anaerobic bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(21): 8714-8719.
(  0) 0) |
| [9] |
Liang X J, Johs A, Abernathy M J, et al. High methylation potential of mercury complexed with mixed thiolate ligands by Geobacter sulfurreducens PCA[J]. Geochimica et Cosmochimica Acta, 2023, 342: 74-83. DOI:10.1016/j.gca.2022.12.008
(  0) 0) |
| [10] |
Gu B H, Bian Y R, Miller C L, et al. Mercury reduction and complexation by natural organic matter in anoxic environments[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(4): 1479-1483.
(  0) 0) |
| [11] |
Yu R Q, Reinfelder J R, Hines M E, et al. Syntrophic pathways for microbial mercury methylation[J]. The ISME Journal, 2018, 12(7): 1826-1835. DOI:10.1038/s41396-018-0106-0
(  0) 0) |
| [12] |
Liu H T, Hu T L, Wang H, et al. Community assembly and functional potential of habitat generalists and specialists in typical paddy soils (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(2): 546-557. DOI:10.11766/trxb202105310284 [刘红涛, 胡天龙, 王慧, 等. 典型水稻土细菌亚类群—泛化种、特化种的群落构建及功能潜力[J]. 土壤学报, 2023, 60(2): 546-557.]
(  0) 0) |
| [13] |
Xing Y, Wang J X, Kinder C E S, et al. Rice hull biochar enhances the mobilization and methylation of mercury in a soil under changing redox conditions: Implication for Hg risks management in paddy fields[J]. Environment International, 2022, 168: 107484. DOI:10.1016/j.envint.2022.107484
(  0) 0) |
| [14] |
Zhou Q X, Li R X, Li T, et al. Interactions among microorganisms functionally active for electron transfer and pollutant degradation in natural environments[J]. Eco-Environment & Health, 2023, 2(1): 3-15.
(  0) 0) |
| [15] |
Abdelhafiz M A, Liu J, Jiang T, et al. DOM influences Hg methylation in paddy soils across a Hg contamination gradient[J]. Environmental Pollution, 2023, 322: 121237.
(  0) 0) |
| [16] |
Liu J, Lu B Q, Poulain A J, et al. The underappreciated role of natural organic matter bond Hg(Ⅱ) and nanoparticulate HgS as substrates for methylation in paddy soils across a Hg concentration gradient[J]. Environmental Pollution, 2022, 292: 118321.
(  0) 0) |
| [17] |
Liu J, Chen J, Poulain A J, et al. Mercury and sulfur redox cycling affect methylmercury levels in rice paddy soils across a contamination gradient[J]. Environmental Science & Technology, 2023, 57(21): 8149-8160.
(  0) 0) |
| [18] |
Zhang L J, Kang-Yun C S, Lu X, et al. Adsorption and intracellular uptake of mercuric mercury and methylmercury by methanotrophs and methylating bacteria[J]. Environmental Pollution, 2023, 331: 121790.
(  0) 0) |
| [19] |
Li Z T, Kang Z J, Wang Z H, et al. The traits of microbial sulfur cycling metabolic pathways in two red paddy soils developed from different parent materials (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(2): 562-572. DOI:10.11766/trxb202210090382 [李致同, 亢宗静, 王智慧, 等. 两种母质的红壤性水稻土中微生物硫循环代谢途径特征[J]. 土壤学报, 2024, 61(2): 562-572.]
(  0) 0) |
| [20] |
Bian Y R, Gu B H, Zhu B, et al. Reduction and oxidation of mercury by dissolved organic matter under anaerobic conditions (In Chinese)[J]. Environmental Science, 2018, 39(11): 5036-5042. [卞永荣, 顾宝华, 朱波, 等. 厌氧条件下可溶性有机质对汞的还原与氧化作用[J]. 环境科学, 2018, 39(11): 5036-5042.]
(  0) 0) |
| [21] |
Du S Y, Ding C F, Wang X X. Effects of three kinds of organic materials on mercury methylation in paddy soil and mercury accumulation in brown rice (In Chinese)[J]. Soils, 2022, 54(6): 1219-1224. [杜舒阳, 丁昌峰, 王兴祥. 三种有机物料对稻田土壤汞甲基化及水稻汞积累的影响[J]. 土壤, 2022, 54(6): 1219-1224.]
(  0) 0) |
| [22] |
Lovley D R, Coates J D, Blunt-Harris E L, et al. Humic substances as electron acceptors for microbial respiration[J]. Nature, 1996, 382(6590): 445-448.
(  0) 0) |
| [23] |
Liu Y R, Lu X, Zhao L D, et al. Effects of cellular sorption on mercury bioavailability and methylmercury production by Desulfovibrio desulfuricans ND132[J]. Environmental Science & Technology, 2016, 50(24): 13335-13341.
(  0) 0) |
| [24] |
Ministry of Ecology and Environment of China, Technical Standards Department. Soil-determination of organic carbon-Potassium dichromate oxidation spectrophotometric method: HJ 615-2011[S]. Beijing: China Environmental Science Press, 2011.[中国环境保护部, 科技标准司. 土壤有机碳测定重铬酸钾氧化-分光光度法: HJ 615-2011[S]. 北京: 中国环境科学出版社, 2011.]
(  0) 0) |
| [25] |
United States Environmental Protection Agency, Office of Water(4303). Revision E. Mercury in water by oxidation, purge and trap, and cold vapor atomic fluorescence spectrometry: Method 1631[S]. Washington, D. C. U. S. EPA Sample Control Center, 2002.
(  0) 0) |
| [26] |
United States Environmental Protection Agency, Office of Water(4303). Methyl mercury in water by distillation, aqueous ethylation, purge and trap, and cold vapor atomic fluorescence spectrometry: Method 1630 [S]. Washington, D. C. EPA Sample Control Center, 1998.
(  0) 0) |
| [27] |
Zhang X Y, Guo Y Y, Liu G L, et al. Dark reduction of mercury by microalgae-associated aerobic bacteria in marine environments[J]. Environmental Science & Technology, 2021, 55(20): 14258-14268.
(  0) 0) |
| [28] |
Zhao S B, Sun R G, Wang D Y, et al. Effects of low molecular weight organic acids on redox reactions of mercury (In Chinese)[J]. Environmental Science, 2014, 35(6): 2193-2200. [赵士波, 孙荣国, 王定勇, 等. 低分子有机酸对汞氧化还原反应的影响[J]. 环境科学, 2014, 35(6): 2193-2200.]
(  0) 0) |
| [29] |
Song C X, Sun S Q, Wang J T, et al. Applying fulvic acid for sediment metals remediation: Mechanism, factors, and prospect[J]. Frontiers in Microbiology, 2023, 13: 1084097.
(  0) 0) |
| [30] |
Liang X J, Lu X, Zhao J T, et al. Stepwise reduction approach reveals mercury competitive binding and exchange reactions within natural organic matter and mixed organic ligands[J]. Environmental Science & Technology, 2019, 53(18): 10685-10694.
(  0) 0) |
| [31] |
Kerin E J, Gilmour C C, Roden E, et al. Mercury methylation by dissimilatory iron-reducing bacteria[J]. Applied and Environmental Microbiology, 2006, 72(12): 7919-7921.
(  0) 0) |
| [32] |
Pak K, Bartha R. Mercury methylation by interspecies hydrogen and acetate transfer between sulfidogens and methanogens[J]. Applied and Environmental Microbiology, 1998, 64(6): 1987-1990.
(  0) 0) |
| [33] |
Shi L, Richardson D J, Wang Z M, et al. The roles of outer membrane cytochromes of Shewanella and Geobacter in extracellular electron transfer[J]. Environmental Microbiology Reports, 2009, 1(4): 220-227.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


