镉(Cd)是生物体的非必需金属,由于其高毒性、流动性和潜在的生物蓄积性而受到广泛关注[1]。Cd被作物从土壤中吸收后通过食物链在人体富集,进而对肺、肾、肝、骨、心脏等器官造成损伤,引发肺气肿、肝肾功能障碍、骨质疏松、心血管疾病等多种疾病[2-3]。2014年,《全国土壤污染状况普查报告》显示,全国耕地Cd的点位超标率最高(占7%),Cd污染耕地面积达20万hm2[4]。作为我国第二大粮食作物,小麦对于土壤中的重金属有着较强的积累能力,属于Cd的中积累型作物,对人体健康存在较大威胁[5]。因此,采取安全高效的修复措施来保证受Cd污染农田的安全利用以保障小麦的安全生产刻不容缓。
关于Cd污染农田的安全利用,之前的研究多利用非生物(包括生物质炭、有机肥、黏土矿物等)[6-10]或生物(如具有钝化Cd功能的植物促生菌)[11-12]钝化剂材料通过提高土壤pH促进Cd的吸附、络合和共沉淀,从而降低酸性和弱酸性土壤(尤其是根际土壤)Cd的有效态含量和迁移,降低农作物对Cd的吸收。但是对于广大北方粮食核心生产区的偏碱性污染土壤的修复研究较少。对于弱碱性Cd污染农田土壤而言,增加土壤pH难以降低土壤中重金属有效态含量,还容易造成土壤板结与肥力下降[13]。因此研发适用于碱性土壤重金属污染的稳定修复剂对于实现北方农田的安全利用意义重大。
具有重金属钝化功能的植物促生菌因其成本低廉、环境友好,在重金属污染农田的安全利用中得到了越来越广泛的应用[14]。目前已报道的具有钝化Cd功能的植物促生菌包括芽孢杆菌属(Bacillus)、克雷伯菌属(Klebsiella)、沙雷氏菌属(Serratia)、鞘氨醇单胞菌属(Sphingomonas)和假单胞菌属(Pseudomonas)[15]。这类微生物通过产生吲哚乙酸(IAA)、1-氨基环丙烷-1-羧酸(ACC)脱氨酶、铁载体等物质促进植物生长,同时通过生物吸附、产生硫化氢或多胺类代谢产物与Cd螯合、改变Cd形态进而固定Cd,从而降低作物对Cd的吸收[15]。前期研究从Cd污染农田小麦根内分离筛选到一株高效的具有吸附(沉淀)Cd功能的植物促生菌Pseudomonas Taiwanensis WRS8(美国国立生物技术信息中心NCBI登录号:MK370904),发现该菌株能在扬麦13根表和根内定殖,显著促进小麦幼苗的生长,并通过下调Cd积累吸收的LCT1和HMA2基因的表达水平减少扬麦13幼苗对Cd的吸收[16]。本研究拟以江苏省苏州市太仓汞镉复合污染碱性农田土壤为供试土壤,通过盆栽试验探究菌株WRS8阻控小麦从碱性Cd污染土壤中吸收Cd的作用及其对小麦根际土壤微生物群落的调控规律。预期研究结果能进一步丰富植物-微生物修复碱性土壤重金属污染的原理。
1 材料与方法 1.1 供试材料供试菌株WRS8具有产IAA(435 mg·L−1)、ACC脱氨酶和溶磷的功能,对Cd(8 mmol·L−1)、Pb(9.7 mmol·L−1)、氯霉素(40 mg·L−1)、大观霉素(150 mg·L−1)和氨苄青霉素(200 mg·L−1)表现出较高的耐受性。在添加10 µmol·L-1 Cd2+(CdSO4)的Luria-Bertani(LB)液体培养基中接种菌株WRS8使发酵液Cd2+浓度下降85%~86%[17]。以江苏省内广泛种植的扬麦13为供试植物,以江苏省苏州市太仓弱碱性汞镉复合污染农田土壤为供试土壤,其基本理化性质如下:pH为7.68±0.03,有机质38.12 g·kg–1,土壤有效态Cd含量1.12 mg·kg–1,超过了《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618—2018)中pH 6.5~7.5之间非水田农田土壤0.6 mg·kg–1标准值。
1.2 小麦盆栽试验盆栽试验于2021年11月23日至2022年6月1日在南京信息工程大学农业气象实验站(32°12′N,118°43′E)开展。供试土壤自然风干后过5目筛,称取3.5 kg土壤放入盆中,同时施加复合肥(N︰P︰K=15︰15︰15)拌匀。将小麦种子浸泡在装有体积分数0.5%次氯酸钠溶液的培养皿中进行表面消毒,再将其放置在有湿润纱布的灭菌培养皿中,30℃恒温条件下培育3 d,然后选择生长状况良好、长势均匀的幼苗进行移栽(每盆6株)。设置不接菌处理组(CK)、接灭活菌处理组(D)和接活菌处理组(L)3种处理,每组处理3份重复;分别于拔节期、孕穗期和成熟期进行接菌处理,接菌处理10 d后收集不同生育期小麦植株与根际土壤样品。
接种前将供试菌株于LB培养基活化后,接种于液体LB培养基振荡培养16 h,离心收集细胞并将其重悬于体积分数0.85%的无菌NaCl溶液(细胞浓度为108 CFU·mL–1)[18]。对盆栽小麦松土后在根际接种10 mL菌悬液。
1.3 样品采集与生物量测定采用抖根法收集根表2 mm内根际土壤并分为两份,一份自然风干后过筛测定理化性质,一份–80 ℃冻存用于高通量测序。收集小麦的根和地上部分,105 ℃杀青30 min后60 ℃烘干至恒重后称重记录生物量。成熟期收集小麦籽粒,晾干脱粒后测定千粒重。
1.4 小麦各部分Cd含量的测定小麦地上部分、根和籽粒研磨成粉末状后,分别准确称取0.1~0.2 g(精确至0.000 1 g),使用5 mL硝酸+ 1 mL过氧化氢,经微波消解仪消解后用体积分数2%硝酸定容至10 mL[19],采用电感耦合等离子体质谱仪(ICP-MS,Nex ION,Perkin Elmer,美国)检测上清液中Cd的浓度[20],进而换算出各部位Cd含量。选择GBW10011a(国家标准物质网)作为供试小麦样品Cd含量的质量控制标准,标准物质的回收率为91%~102%。
1.5 盆栽土壤pH、有机质和有效态Cd含量的测定取1.0 g根际土壤,按1︰10的土水比例加入无菌水,离心取上清液后用pH计(PHS-3CT,上海)测定其pH。采用重铬酸钾-油浴法测定不同处理盆栽土壤根际土壤有机质含量[21]。采用乙二胺四乙酸二钠(EDTA-2Na)提取土壤有效态Cd:称取小麦根际土壤2.00 g,按1︰4的土水比加入EDTA-2Na提取液,振荡离心后,利用ICP-MS测定上清液中Cd含量[22]。
1.6 土壤微生物群落结构分析采用FastDNA SPIN kit DNA试剂盒(MP bio,CA,美国)提取土壤中的总DNA,并使用分光光度计(NanoDrop N-D-1000,美国)检测DNA的质量。利用特异引物515FmodF/806RmodR对细菌16S rRNA基因的V3~V4区进行特异性扩增。最后,采用Illumina Miseq PE300测序平台(美吉生物,上海)对扩增后的PCR产物进行高通量测序。测序得到的PE reads首先根据overlap关系进行拼接,质控去接头后获得优化序列。最终共获得优化序列2 492 151,平均序列长度为252 bp。基于优化序列进行操作分类单元(OTU)聚类分析和物种分类学分析。聚类方式采用USEARCH11-uparse算法,将97%序列相似度定义为一个OTU。
1.7 数据处理与统计分析使用Excel 2016对数据进行基本处理及绘图,使用SPSS Statistics 27.0对各处理数据进行统计分析,使用图基检验(Tukey)(P < 0.05)方法来检验各处理之间是否存在显著性差异。利用QIIME2计算各处理的物种群落结构、α多样性(Chao、香农、覆盖度指数)等指标。利用R语言(version 3.3.1)作群落组成柱形图和群落热图,并利用主坐标分析(PCoA)对不同处理样品进行聚类分析。
2 结果 2.1 菌株WRS8对小麦生物量的影响在生长阶段小麦地上部分生物量呈现出先增加后减少的趋势。在同一生育期内,与对照组相比,接活菌和灭活菌的处理组均显著增加了小麦的生物量。接种活菌处理组促使小麦生物量的增加量大于接灭活菌处理组。与对照相比,接种活菌处理的小麦地上部分和根的生物量分别增加了34%~64%、60%~102%,接灭活菌处理的小麦地上部分和根的生物量分别增加了22%~31%、21%~37%。接活菌处理显著增加了小麦籽粒的生物量(较对照组增加了10%~14%)(表 1)。
|
|
表 1 接种菌株WRS8对小麦各部分生物量的动态影响 Table 1 Effects of inoculation of strain WRS8 on the biomass of different parts of wheat at different growth stages |
成熟期小麦地上部Cd含量较拔节期与抽穗期有所下降;与对照相比,接活菌处理显著降低了小麦地上部分Cd含量(较对照降低了55%~60%)(图 1a)。小麦根Cd含量随生育期的延长呈现出增加的趋势。与对照组相比,接种活菌处理使小麦根内Cd含量下降5%~8%,仅在成熟期达到显著水平(图 1b)。接种活菌处理小麦籽粒Cd含量显著降低了78%~82%(图 1c),接灭活菌处理对小麦Cd含量影响不显著。接种灭活菌处理对小麦在不同生育阶段的地上部和根部Cd含量以及籽粒中Cd含量的影响均不显著。
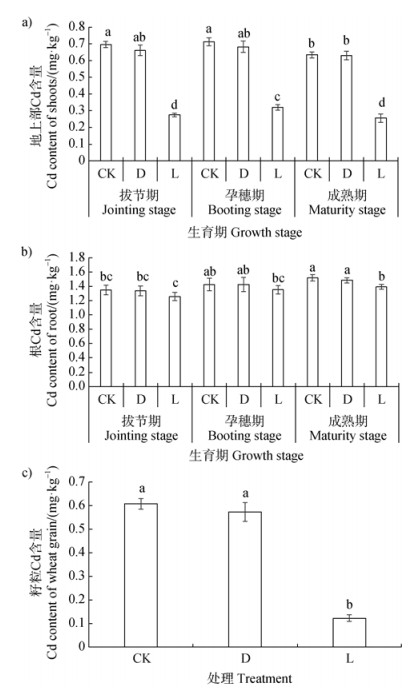
|
注:图中的误差线表示标准差;不同的小写字母表示各处理之间存在显著差异(P < 0.05)。下同。 Note: Error bars represent standard deviation, and the presence of different letters signifies significant differences determined by Tukey's Honestly Significant Difference (HSD) post-hoc test following significant interaction effects (P < 0.05). The same as below. 图 1 接种菌株WRS8对不同生育期小麦地上部(a)和根(b)Cd含量的动态影响以及对籽粒Cd含量(c)的影响 Fig. 1 Dynamic effects of inoculated strain WRS8 on Cd contents in shoot (a) and root (b) at different growth stages as well as on Cd content of wheat grains (c) |
如图 2所示,不接菌对照处理及接灭活菌处理根际土壤Cd含量随着生育期的延长无显著变化。与对照组相比,接种活菌处理使小麦根际土壤有效态Cd含量降低了32%~49%。接种灭活菌处理对小麦根际土壤有效态Cd含量的影响不显著。接种活菌处理成熟期根际土壤Cd含量显著低于拔节期和孕穗期,拔节期至孕穗期根际土壤Cd含量无显著变化。
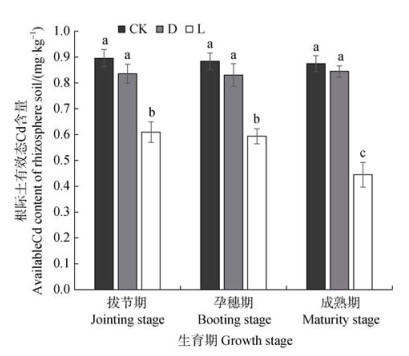
|
图 2 接种菌株WRS8对不同生育期小麦根际土壤有效态Cd含量的动态影响 Fig. 2 Effects of inoculation of strain WRS8 on available Cd content in wheat rhizosphere soil at different growth stages |
如图 3a所示,随着生育期的延长不接菌对照处理和接灭活菌处理根际土壤pH呈现出下降的趋势,接活菌处理组根际土pH在不同生育期无显著变化。尤其成熟期,接活菌处理较不接菌处理使小麦根际土壤pH显著提高5%。在整个生育期中,不同处理间根际土壤的有机质含量无显著差异(图 3b)。
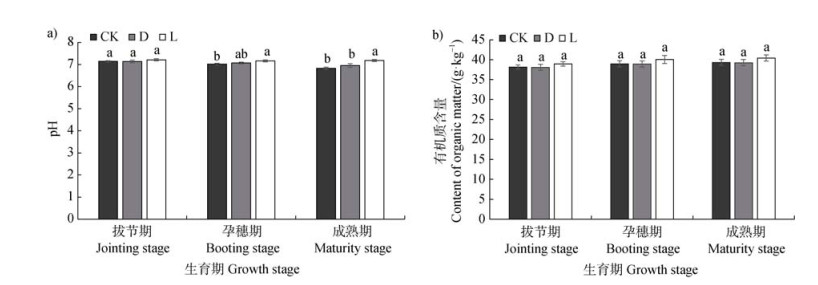
|
图 3 接种菌株WRS8对不同生育期小麦根际土壤pH(a)和有机质含量(b)的影响 Fig. 3 Effects of inoculation of strain WRS8 on pH value (a) and organic matter content (b) of wheat rhizosphere soil at different growth stages |
如表 2所示,各处理样品的细菌群落覆盖度指数(在序列97%相似度水平上)均高于0.95,表明当前的测序深度已经涵盖了大部分细菌群落,能够满足后续序列分析的需要。总体而言,根际土壤细菌群落α多样性较根内细菌群落更丰富。就根际土壤细菌群落结构而言,拔节期和孕穗期接种菌株WRS8使α多样性指数呈现下降趋势,成熟期则无显著影响。接种菌株仅在孕穗期较不接菌处理使根内细菌群落α多样性指数显著降低。拔节期与成熟区均无显著影响。
|
|
表 2 接种菌株WRS8对小麦根际土壤和根内细菌群落α多样性指数的影响 Table 2 Effects of inoculation of strain WRS8 on the alpha diversity indies of bacterial communities inhabiting wheat rhizosphere soil and inside roots |
PCoA分析结果表明在OTU水平上,接灭活菌与接活菌处理均改变了根际土壤和根内生细菌群落结构。且随着生育期的延长,各处理样品根际土壤细菌群落与根内生细菌群落结构均发生显著变化(图 4)。
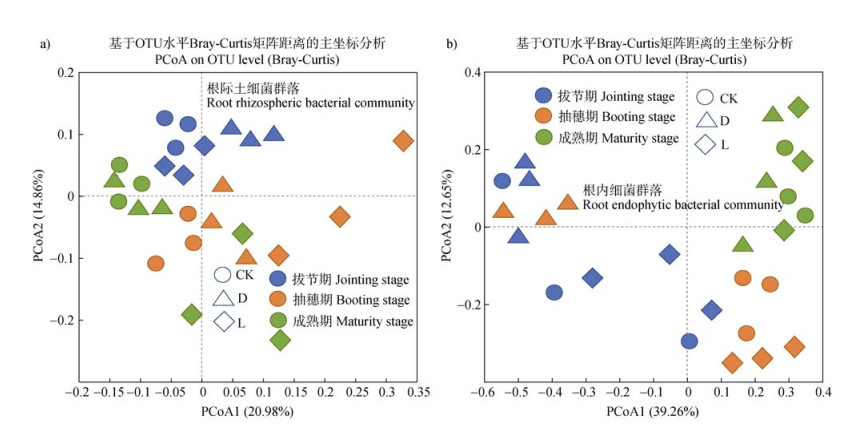
|
图 4 不同处理条件下根际土壤(a)与根内生(b)细菌群落的主坐标分析(PCoA) Fig. 4 Principal coordinate analysis(PCoA)plot depicts the Bray-Curtis distance between rhizosphere soil(a)and root endophytic(b)bacterial communities under different treatment conditions |
在门水平上,小麦根际土壤与根内生细菌群落存在显著差异(图 5)。整个生育期小麦根际土壤细菌群落的优势菌门包括放线菌门(Actinobacteria,相对丰度为26%)、变形菌门(Proteobacteria,21%)、绿弯菌门(Chloroflexi,12%)、厚壁菌门(Firmicutes,10%)、拟杆菌门(Bacteroidota,8%)和酸杆菌门(Acidobacteria,5%)(图 5a)。整个生育期接种菌株WRS8较不接菌对照处理,使根际土壤绿弯菌门(Chloroflexi)和变形菌门(Proteobacteria)相对丰度呈现出下降的趋势。
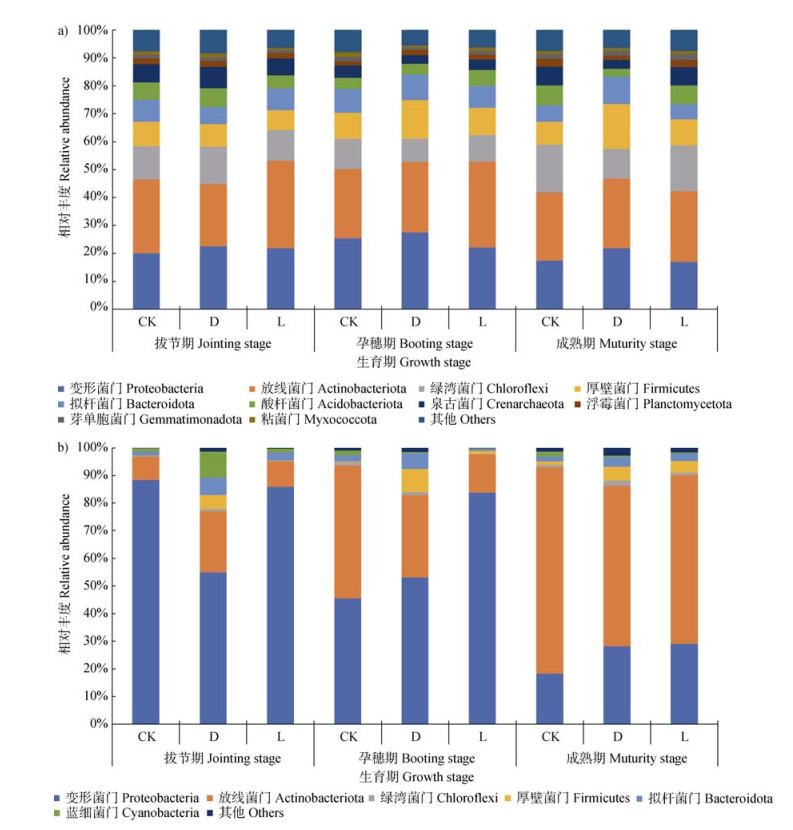
|
图 5 不同处理条件下根际土壤(a)与根内生(b)细菌群落优势菌门相对丰度的变化 Fig. 5 Changes in the relative abundances of abundant phyla of rhizosphere soil(a)and root endophytic(b)bacterial communities under different treatments |
根内生细菌群落中变形菌门(Proteobacteria)则占绝对优势,其相对丰度占比52%,其余的优势菌门按相对丰度高低依次为放线菌门(Actinobacteria,相对丰度为38%)、拟杆菌门(Bacteroidota,3%)、厚壁菌门(Firmicutes,2%)(图 5b);随着生育期的延长,根内生细菌群落中变形菌门(Proteobacteria)和放线菌门(Actinobacteria)呈现出此消彼长的趋势,拔节期和孕穗期变形菌门(Proteobacteria)占比最高,到了成熟期放线菌门(Actinobacteria)的相对丰度最高。孕穗期和成熟期接活菌和接灭活菌处理提高变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝藻门(Cyanobacteria)相对丰度的同时降低了放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi)的相对丰度。综上,接种菌株WRS8对小麦根内细菌群落的优势菌门相对丰度的影响较根际土细菌群落更为显著。
将所有样品中相对丰度前30的属保留制成热图。如图 6所示,根际土壤和根内生细菌群落优势属的分布存在明显的差异。根际土壤细菌群落优势属包括Candidatus_Nitrocosmicus(相对丰度4.3%)、节杆菌属(Arthrobacter,4.2%)、海球菌属(Marmoricola,4.1%)、Defluviicoccus(3.5%)、海洋杆菌属(Pontibacter,2.3%)、芽孢杆菌属(Bacillus,2.0%)等。根内细菌群落优势属则为原小单孢菌属(Promicromonospora,相对丰度6.7%)、谷氨酸杆菌属(Glutamicibacter,6.0%)、链霉菌属(Streptomyces,6.8%)、假单胞菌属(Pseudomonas,4.6%,孕穗期占比16.4%)、微杆菌属(Microbacterium,3.4%)等。对根际土壤细菌群落而言,接种菌株WRS8在小麦整个生育期提高了节杆菌属(Arthrobacter)和芽孢杆菌属(Bacillus)的相对丰度。此外,接种菌株WRS8后,在拔节期和抽穗期根内假单胞菌属(Pseudomonas)相对丰度显著提高,而成熟期不同处理间假单胞菌属(Pseudomonas)相对丰度则无显著差异。
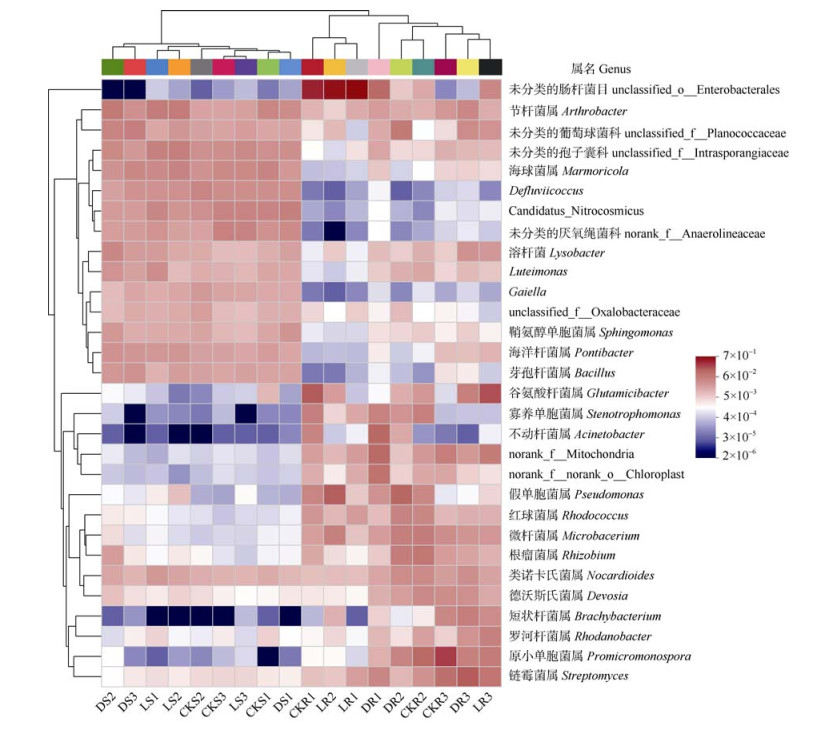
|
注:CK:不接菌对照处理;D:接灭活菌处理;L:接活菌处理;S:根际土壤细菌群落;R:根内生细菌群落;1:拔节期;2:孕穗期;3:成熟期。 Note: CK, control treatment without strain inoculation; D, inoculation with dead bacterial strain; L, inoculation with live bacterial strain; S, rhizospheric bacterial community; R, root endophytic bacterial community; 1, jointing stage; 2, booting stage; 3, maturity stage. 图 6 属水平细菌群落结构热图 Fig. 6 Heatmap of bacterial communities under different treatments at different growth stages on the level of genus |
在之前的研究中发现水培条件下菌株WRS8能稳定定殖于苗期扬麦13的根表与根内,并能显著提高扬麦13的生物量,同时通过下调小麦根中与Cd转运吸收相关的基因LCT1和HMA2的表达降低扬麦13对Cd的吸收[14]。在此基础上,本研究利用盆栽试验将其应用至弱碱性重金属复合污染农田土壤的安全利用中。研究结果显示,盆栽条件下,接种菌株WRS8整个生育期均对扬麦13有显著的促生作用(表 1),其促生机制除了已报道的产IAA、ACC脱氨酶和溶磷作用外,与其在根内的稳定定殖可能也密切相关。除了已报道的水培试验结果,通过对根内细菌群落的高通量测序也发现接种菌株WRS8在拔节期和孕穗期显著提高了根内细菌群落中假单胞菌属(Pseudomonas)相对丰度(图 6)。
3.2 菌株WRS8阻控扬麦13吸收Cd的作用与影响因素Wang等[9]通过盆栽试验,以河南新乡市弱碱性Cd污染麦田土壤为供试土壤,利用沸石负载的锰氧化物使焦麦266籽粒中Cd含量显著降低了65%。而本研究中接种菌株WRS8使扬麦13籽粒Cd含量显著下降78%~82%的同时使小麦千粒重增加10%~14%(图 1,表 1),体现了其在苏州市太仓地区弱碱性土壤安全利用中的不俗前景。当然不同研究下调小麦籽粒Cd含量效果的差异,不仅与所使用钝化材料的特性相关,还与供试土壤理化性质和供试小麦品种是否为Cd低积累品种等性状密切相关。比如,焦麦266对照处理籽粒Cd含量为1.5 mg·kg–1,而本研究使用的扬麦13对照处理籽粒Cd含量则约为0.6 mg·kg–1。由此,高效的钝化材料搭配Cd低积累作物品种才能更有效实现Cd污染农田的安全利用。
3.3 菌株WRS8阻控扬麦13吸收Cd的作用机制根际接种菌株WRS8减少扬麦13对Cd的吸收利用可能的作用机制包括:(1)菌株WRS8对根际土壤Cd的钝化作用,本研究发现接种WRS8使根际土壤中EDTA-提取态的Cd含量下降了39%~42%(图 2)。之前的研究发现溶液条件下菌株WRS8能直接通过细胞表面及Cd诱导产生的絮凝物吸收(沉淀)Cd;且在Cd存在的情况菌株WRS8能产NH4+并显著提高溶液pH[16],而在本研究中发现随着生育期的延长和根生物量的增加,根际土壤pH呈现出不断下降的趋势(可能是由植物根系分泌有机酸造成的),而接种菌株WRS8则显著提高了根际土壤的pH(图 3a),可能因此抑制了由根系分泌有机酸释放造成的Cd活化。此外,部分研究还表明,具有溶磷功能的细菌菌株能通过释放磷酸根离子诱导根际重金属离子沉淀,从而减少植物对重金属的吸收 [23-25]。(2)菌株WRS8抑制扬麦13对Cd的吸收转运。之前的研究发现苗期接种WRS8能通过下调扬麦13根系与Cd吸收转运相关的功能基因LCT1和HMA2的表达丰度而减少小麦幼苗对Cd的吸收。本研究也发现接种菌株WRS8在拔节期、孕穗期和成熟期均使地上部的Cd含量显著下降,且成熟期下调作用最显著(图 1)。本研究尝试对不同生育期根系样品LCT1和HMA2表达丰度进行检测,但因样品数量有限且荧光定量PCR扩增失败,未获得相关数据;后续研究可尝试通过转录组学分析技术解析Cd胁迫条件下接种菌株WRS8对小麦代谢的影响。(3)接种菌株WRS8对扬麦13根际土壤及根内生细菌群落的调控。本研究发现不同生育期接种菌株WRS8均使变形菌门(Proteobacteria)相对丰度显著下降(图 5a),而变形菌门(Proteobacteria)被证明是重要的用于指示土壤Cd污染的细菌生物标志物 [26-27],该门类细菌的减少说明了根际土壤Cd含量的下降。此外,本研究还发现接种菌株WRS8在整个生育阶段中均显著提高了节杆菌属(Arthrobacter)和芽孢杆菌属(Bacillus)的相对丰度(图 6)。其中节杆菌属(Arthrobacter)不仅具有高效吸附Cd功能且能通过产生抗生素类物质帮助植物抵御病原真菌的侵袭 [28-30],同时具有固氮和好氧反硝化的功能,在土壤氮循环的平衡中扮演重要作用 [31-32]。此外,大量Bacillus spp.被报道具有显著的植物促生与钝化重金属(尤其是Cd)的作用 [33-34],同时它们还具备了矿化有机质和协助抵御病原真菌的作用[35]。综上,接种菌株WRS8可能通过招募上述两个属的细菌来促进扬麦13在Cd胁迫下生长的同时,加强根际土壤有效态Cd的固定。
4 结论接种菌株WRS8显著提高扬麦13根、地上部生物量和小麦籽粒千粒重及根际土壤pH的同时,显著降低了地上部、小麦籽粒Cd含量及小麦根际土壤有效态Cd含量,有效减少了扬麦13从弱碱性Cd污染农田土壤吸收Cd。接菌处理及生育期的延长均显著改变了小麦根际土壤和根内生细菌群落结构;接种菌株WRS8在整个生育期降低了根际土壤细菌群落中绿弯菌门(Chloroflexi)和变形菌门(Proteobacteria)的相对丰度,并显著增加具有缓解植物胁迫功能和吸附(沉淀)Cd功能的节杆菌属(Arthrobacter)和芽孢杆菌属(Bacillus)相对丰度。综上,菌株WRS8通过调节根际土壤pH及根际土壤微生物群落来降低扬麦13对Cd的吸收。本研究可为Cd污染碱性土壤的安全利用提供有效技术途径和优质菌种资源。
| [1] |
Li H, Luo N, Li Y W, et al. Cadmium in rice: Transport mechanisms, influencing factors, and minimizing measures[J]. Environmental Pollution, 2017, 224: 622-630. DOI:10.1016/j.envpol.2017.01.087
(  0) 0) |
| [2] |
Chen Y R, Xu X J, Zeng Z J, et al. Blood lead and cadmium levels associated with hematological and hepatic functions in patients from an e-waste-polluted area[J]. Chemosphere, 2019, 220: 531-538. DOI:10.1016/j.chemosphere.2018.12.129
(  0) 0) |
| [3] |
Obeng-Gyasi E. Chronic cadmium exposure and cardiovascular disease in adults[J]. Journal of Environmental Science and Health Part A, Toxic/Hazardous Substances & Environmental Engineering, 2020, 55(6): 726-729.
(  0) 0) |
| [4] |
Yang J, Hu R Q, Zhao C, et al. Challenges and opportunities for improving the environmental quality of cadmium-contaminated soil in China[J]. Journal of Hazardous Materials, 2023, 445: 130560. DOI:10.1016/j.jhazmat.2022.130560
(  0) 0) |
| [5] |
Huang Q Y. Responses of different genotypes of wheat to soil cadmium pollution and effect of bamboo charcoal on cadmium accumulation in wheat[D]. Hangzhou: Zhejiang A & F University, 2015.[黄其颖. 不同基因型小麦对土壤镉污染的反应及竹炭对小麦镉积累的影响[D]. 杭州: 浙江农林大学, 2015.]
(  0) 0) |
| [6] |
Hong M F, Zhang L M, Tan Z X, et al. Effect mechanism of biochar's zeta potential on farmland soil's cadmium immobilization[J]. Environmental Science and Pollution Research, 2019, 26(19): 19738-19748. DOI:10.1007/s11356-019-05298-5
(  0) 0) |
| [7] |
Hu X F, Huang X R, Zhao H H, et al. Possibility of using modified fly ash and organic fertilizers for remediation of heavy-metal-contaminated soils[J]. Journal of Cleaner Production, 2021, 284: 124713. DOI:10.1016/j.jclepro.2020.124713
(  0) 0) |
| [8] |
Li Q, Wang Y H, Li Y C, et al. Speciation of heavy metals in soils and their immobilization at micro-scale interfaces among diverse soil components[J]. Science of the Total Environment, 2022, 825: 153862. DOI:10.1016/j.scitotenv.2022.153862
(  0) 0) |
| [9] |
Wang W H, Lu T, Liu L H, et al. Zeolite-supported manganese oxides decrease the Cd uptake of wheat plants in Cd-contaminated weakly alkaline arable soils[J]. Journal of Hazardous Materials, 2021, 419: 126464. DOI:10.1016/j.jhazmat.2021.126464
(  0) 0) |
| [10] |
Du Z M, Hao J S, Zhou J, et al. Field in situ remediation of cu-cd polluted soil by four amendments (In Chinese)[J]. Acta Pedologica Sinica, 2012, 49(3): 508-517. DOI:10.11766/trxb201012070519 [杜志敏, 郝建设, 周静, 等. 四种改良剂对铜和镉复合污染土壤的田间原位修复研究[J]. 土壤学报, 2012, 49(3): 508-517.]
(  0) 0) |
| [11] |
Cheng C, Wang R, Sun L J, et al. Cadmium-resistant and arginine decarboxylase-producing endophytic Sphingomonas sp. C40 decreases cadmium accumulation in host rice (Oryza sativa Cliangyou 513)[J]. Chemosphere, 2021, 275: 130109. DOI:10.1016/j.chemosphere.2021.130109
(  0) 0) |
| [12] |
Liu C, Guo B, Lin Y C, et al. Impacts of arbuscular mycorrhizal fungus enhancing Abelia grandiflora 'francis mason' Cd uptake on rhizospheric fungal communities (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(2): 495-504. DOI:10.11766/trxb201911090379 [刘琛, 郭彬, 林义成, 等. 丛枝菌根真菌对金叶六道木镉吸收及根际真菌群落结构的影响[J]. 土壤学报, 2021, 58(2): 495-504.]
(  0) 0) |
| [13] |
Xie X L, Yuan C, Zhu X L, et al. In-situ passivation remediation materials in cadmium contaminated alkaline agricultural soil: A review (In Chinese)[J]. Chinese Journal of Soil Science, 2018, 49(5): 1254-1260. [解晓露, 袁毳, 朱晓龙, 等. 中碱性镉污染农田原位钝化修复材料研究进展[J]. 土壤通报, 2018, 49(5): 1254-1260.]
(  0) 0) |
| [14] |
Wen K, Li X G, Huang R, et al. Application of exogenous glutathione decreases chromium translocation and alleviates its toxicity in soybean (Glycine max L.)[J]. Ecotoxicology and Environmental Safety, 2022, 234: 113405. DOI:10.1016/j.ecoenv.2022.113405
(  0) 0) |
| [15] |
Ge Y Y, Wen Z Y, He L Y, et al. Metal-immobilizing Pseudomonas taiwanensis WRS8 reduces heavy metal accumulation in Coriandrum sativum by changing the metal immobilization-related bacterial population abundances[J]. Environmental Science and Pollution Research International, 2023, 30(31): 76911-76922. DOI:10.1007/s11356-023-27967-2
(  0) 0) |
| [16] |
Cheng C, Wang Q, Wang Q X, et al. Wheat-associated Pseudomonas taiwanensis WRS8 reduces cadmium uptake by increasing root surface cadmium adsorption and decreasing cadmium uptake and transport related gene expression in wheat[J]. Environmental Pollution, 2021, 268: 115850. DOI:10.1016/j.envpol.2020.115850
(  0) 0) |
| [17] |
Han H, Wang Q, He L Y, et al. Increased biomass and reduced rapeseed Cd accumulation of oilseed rape in the presence of Cd-immobilizing and polyamine-producing bacteria[J]. Journal of Hazardous Materials, 2018, 353: 280-289. DOI:10.1016/j.jhazmat.2018.04.024
(  0) 0) |
| [18] |
Cheng C. Research on the effect and mechanism of the highly efficient Cd-passivating bacterium Pseudomonas taiwanensis WRS8 in preventing wheat from absorbing Cd[D]. Nanjing: Nanjing Agricultural University, 2020.[程诚. 高效Cd钝化细菌Pseudomonas taiwanensis WRS8阻控小麦吸收Cd的效应与机制研究[D]. 南京: 南京农业大学, 2020.]
(  0) 0) |
| [19] |
Gao Y Y, Peng Z F, Qiu H O, et al. Determination of heavy metal elements in dominant plants from Hubei Zigui Yueliangbao gold mine tailings with ICP-OES (In Chinese)[J]. Chinese Journal of Analysis Laboratory, 2016, 35(5): 521-525. [高媛媛, 彭兆丰, 邱海鸥, 等. ICP-OES测定金矿尾矿区优势植物中的重金属元素[J]. 分析试验室, 2016, 35(5): 521-525.]
(  0) 0) |
| [20] |
Wang Y F, Ying Y Q, Lu S G. Si-Ca-K-Mg amendment reduces the phytoavailability and transfer of Cd from acidic soil to rice grain[J]. Environmental Science and Pollution Research, 2020, 27(26): 33248-33258. DOI:10.1007/s11356-020-09444-2
(  0) 0) |
| [21] |
Bao S D. Soil and agricultural chemistry analysis (In Chinese). 3rd ed[M]. Beijing: China Agriculture Press, 2000. [鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [22] |
Wang T J. Study on the synergistic blocking effect and mechanism of heavy metal-passivated bacteria Enterobacter bugandensis TJ6 combined with calcium peptide on cadmium absorption in wheat[D]. Wuhan: Hubei University, 2020.[王铁军. 重金属钝化细菌Enterobacter bugandensis TJ6与钙多肽联合对小麦吸收镉的协同阻控效应及机理研究[D]. 武汉: 湖北大学, 2020.]
(  0) 0) |
| [23] |
Rawat P, Sharma A, Shankhdhar D, et al. Improvement of phosphorus uptake, phosphorus use efficiency, and grain yield of upland rice (Oryza sativa L.) in response to phosphate-solubilizing bacteria blended with phosphorus fertilizer[J]. Pedosphere, 2022, 32(5): 752-763. DOI:10.1016/j.pedsph.2022.06.005
(  0) 0) |
| [24] |
Marzban A, Ebrahimipour G, Karkhane M, et al. Metal resistant and phosphate solubilizing bacterium improves maize (Zea mays) growth and mitigates metal accumulation in plant[J]. Biocatalysis and Agricultural Biotechnology, 2016, 8: 13-17. DOI:10.1016/j.bcab.2016.07.005
(  0) 0) |
| [25] |
Su N N, Zhao Q Z, Wang F, et al. The effect of passivating heavy metals and blocking the absorption of Cd and Pb in wheat by the phosphorus-solubilizing bacterium Klebsiella sp. M2 (In Chinese)[J]. Environmental Science, 2024, 45(7): 4321-4331. [苏楠楠, 赵庆照, 王芳, 等. 解磷细菌Klebsiella sp. M2钝化重金属及阻控小麦吸收Cd和Pb效应[J]. 环境科学, 2024, 45(7): 4321-4331.]
(  0) 0) |
| [26] |
Li Y T, Gao Y, Chen W, et al. Shifts in bacterial diversity, interactions and microbial elemental cycling genes under cadmium contamination in paddy soil: Implications for altered ecological function[J]. Journal of Hazardous Materials, 2024, 461: 132544. DOI:10.1016/j.jhazmat.2023.132544
(  0) 0) |
| [27] |
Ros M, Pascual J A, Moreno J L, et al. Evaluation of microbial community activity, abundance and structure in a semiarid soil under cadmium pollution at laboratory level[J]. Water, Air, and Soil Pollution, 2009, 203(1): 229-242.
(  0) 0) |
| [28] |
Tsuruta T, Umenai D, Hatano T, et al. Screening micro-organisms for cadmium absorption from aqueous solution and cadmium absorption properties of Arthrobacter nicotianae[J]. Bioscience, Biotechnology, and Biochemistry, 2014, 78(10): 1791-1796. DOI:10.1080/09168451.2014.930321
(  0) 0) |
| [29] |
Zhao F Y, Zhang Y Y, Dong W G, et al. Vermicompost can suppress Fusarium oxysporum f. sp. lycopersici via generation of beneficial bacteria in a long-term tomato monoculture soil[J]. Plant and Soil, 2019, 440(1): 491-505.
(  0) 0) |
| [30] |
Du R Y. Effects of Cd(Ⅱ) on the physico-biochemical behaviors of Arthrobacter sp. and Bacillus sp (In Chinese)[J]. Journal of Safety and Environment, 2012, 12(6): 9-13. [杜瑞英. 镉胁迫对节杆菌(Arthrobacter sp.)和芽孢杆菌(Bacillus sp.)生理生化特性的影响[J]. 安全与环境学报, 2012, 12(6): 9-13.]
(  0) 0) |
| [31] |
Xu J, Kloepper J W, Huang P, et al. Isolation and characterization of N2-fixing bacteria from giant reed and switchgrass for plant growth promotion and nutrient uptake[J]. Journal of Basic Microbiology, 2018, 58(5): 459-471. DOI:10.1002/jobm.201700535
(  0) 0) |
| [32] |
Liu Y, Xin J, Wang Y, et al. Dual roles of dissolved organic nitrogen in groundwater nitrogen cycling: Nitrate precursor and denitrification promoter[J]. Science of the Total Environment, 2022, 811: 151375.
(  0) 0) |
| [33] |
Li X Z, Qin S M, Chen Z J, et al. Polyamine-producing bacteria regulated the community structure of rhizosphere bacteria and reduced the absorption of Cd in wheat (In Chinese)[J]. Environmental Science, 2022, 43(2): 1031-1039. [李晓哲, 覃善梅, 陈兆进, 等. 产多胺细菌调控根际细菌群落阻控小麦Cd吸收效应[J]. 环境科学, 2022, 43(2): 1031-1039.]
(  0) 0) |
| [34] |
Wang Q, Zhang W J, He L Y, et al. Increased biomass and quality and reduced heavy metal accumulation of edible tissues of vegetables in the presence of Cd-tolerant and immobilizing Bacillus megaterium H3[J]. Ecotoxicology and Environmental Safety, 2018, 148: 269-274.
(  0) 0) |
| [35] |
Wang Q, Xie Q D, He L Y, et al. The abundance and mineral-weathering effectiveness of Bacillus strains in the altered rocks and the soil[J]. Journal of Basic Microbiology, 2018, 58(9): 770-781.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


