随着工业化进程的推进,全球人口急剧增加、化石能源大规模开采、森林过度砍伐,导致温室气体排放量增加,全球气候呈现变暖趋势。根据联合国政府间气候变化专门委员会(IPCC)近期发布的第六次评估报告(AR6)预测,2024年全球增温幅度将突破1.5℃,持续升温将导致自然灾害频发、生态系统发生不可逆转的变化[1]。
大量文献通过模拟增温研究农田、森林、草地等各类生态系统对全球变暖直接或者间接的响应[2]。气候变暖影响植物生长发育的同时也影响着地下生态系统土壤各种生物化学过程[3]。土壤微生物(包括细菌、真菌等)在维持土壤功能中发挥着至关重要的作用,包括养分循环和生物修复等。因此,保持土壤中高水平微生物群落多样性对可持续农业至关重要[4]。土壤酶活性主要来源于植物根系分泌物和微生物胞外产物,是土壤中有机质分解和养分循环的重要生物催化剂,通常被用来指征土壤微生物群落的功能与活性[5]。
微生物复苏、生长、繁殖离不开土壤的养分供给。增温改变了土壤生物和非生物因子(如凋落物输入的质量和数量、植物群落、土壤水分和养分),影响土壤有机质的分解速率和养分有效性,进而直接或间接提高了土壤微生物群落多样性和物种丰富度,改变了土壤微生物的群落结构[6]。值得注意的是,不同生态系统土壤微生物群落对增温的响应规律存在差异,比如在增温条件下,草地生态系统土壤碳(C)、氮(N)、磷(P)的酶化学计量显著高于农田生态系统;而变暖引起的土壤脲酶活性的增加幅度在森林生态系统中高于草地生态系统[7]。因此进一步量化分析和比较增温对不同生态系统土壤微生物群落的影响,挖掘关键因素,对于丰富陆地生态系统对增温的响应规律与原理具有重要意义。
本文采用整合分析(Meta分析)的方法,从206篇已发表的国内外论文中共收集到1 020组数据,研究实验增温对三种不同生态系统(农田生态系统、草地生态系统、森林生态系统)的土壤微生物群落(土壤微生物生物量、土壤微生物群落多样性、土壤酶活性)的影响;同时发掘主要影响因子,为理解全球气候变暖背景下植物-土壤生态系统过程的变化提供理论依据。
1 材料与方法 1.1 文献选择与数据收集本研究文献中的数据均来自于Web of Science、中国知网等中英文期刊数据库,搜索的关键词包括:增温(warming)、温度升高(temperature increase)、温度(temperature)、土壤(soil)、微生物(microorganisms)、酶活性(enzyme activity)、酶(enzyme)等中英文。共收集到相关已发表的国内外文献206篇,其中英文文献111篇,中文文献95篇(包括了1 020对配对的观测值(包括对照和增温处理))用于整合分析。所选用的文献需要符合以下标准:(1)提取的每个变量均包含平均值、标准差(或标准误)和样本量。(2)所有对照组和处理组属于同一个生态系统并具有相同的环境、生长条件。(3)对于研究中包括实验增温处理的多因素控制实验,仅选择对照组和实验增温的处理组数据。(4)实验增温是基于土壤温度或者冠层以上的空气温度进行温度的增加。
基于以上筛选标准,将所有文献按照不同生态系统分类,农田、草地、森林生态系统文献量分别占比22.33%、40.78%和36.89%。就增温幅度而言,本文将与对照相比增温小于2℃定义为低幅度增温,2℃~4℃定义为中幅度增温,大于等于4℃定义为高幅度增温;低、中、高增温幅度占比分别为31.07%、37.86%和31.07%。将与对照相比增温年限小于0.5 a定义为短期增温,将0.5~2 a定义为中期增温,将大于等于2 a定义为长期增温;短、中、长期增温占比分别为16.02%、38.35%和45.63%。按照不同增温方式分,主动加热方式:红外线辐射增温、电子加热器增温、人工室增温和电缆增温分别占比33.98%、5.83%、10.19%和13.59%;被动加热方式:开顶式气室(OTC)增温、降低海拔、热水加温、覆盖薄膜、土位置换分别占比25.73%、2.43%、2.43%、5.34%和0.49%。按不同种植方式分,田间试验、OTC种植、盆栽试验、人工生长室分别占比53.40%、29.13%、13.59%和3.88%。
本研究文献收集的变量有土壤微生物生物量、土壤微生物群落多样性、土壤酶活性以及环境因子(年平均气温、年降水量、平均海拔)。其中微生物生物量指标有采用磷脂脂肪酸法(PLFAs)测定的微生物总量以及真菌、细菌、放线菌、革兰氏阳性菌、革兰氏阴性菌、丛枝菌根真菌微生物量,采用稀释培养计数法(MPN法)测定的氨化细菌、硝化细菌、反硝化细菌数量以及采用氯仿熏蒸法测定的微生物生物量碳(MBC)、微生物生物量氮(MBN)、微生物生物量磷(MBP)。土壤微生物群落多样性指数包括Mclntosh指数(Mclntosh index)、香农指数(Shannon index)、Pielou指数(Pielou index)、碳源利用指数(Carbon source utilization index)、Chaol指数(Chaol index)、辛普森指数(Simpson Index)、物种丰富度(Plant species richness)、物种均匀度(Evenness)、物种多样性(Community diversity)。土壤酶活性包括土壤抗氧化类酶活性(苯酚氧化酶、超氧化物歧化酶、多酚氧化酶、过氧化氢酶、过氧化物酶)、土壤C转化相关酶活性(N-乙酰葡糖胺糖苷酶、α-葡萄糖苷酶、β-N-乙酰氨基葡萄糖苷酶、β-纤维素苷酶、β-木糖苷酶、β-葡萄糖苷酶、淀粉酶、碱性蛋白酶、纤维素酶、蔗糖酶)、土壤N转化相关酶活性(脲酶)、土壤P转化相关酶活性(碱性磷酸酶、磷酸酶、酸性磷酸酶、中性磷酸酶)。
所有发表文献表格中数据直接提取,图中数据使用Get Data2.2图形数字化仪或者Web Plot Digitizer4.6图形获取工具提取。
1.2 数据整合分析本文运用Meta-Win2.0软件对数据进行效应分析,采用反应比的自然对数(lnRR)作为效应值,将其转换为上下95%置信区间(CI)来评估实验增温对土壤微生物和酶活性的影响。根据数据分析需要,部分文献的标准误(SE)需要转换为标准差(SD),其计算方法为[8]:
| $ {\text{SD = SE}} \times \sqrt {\text{n}} $ | (1) |
| $ \mathsf{\ln R R=\ln \left(\frac{\bar{X}_t}{\bar{X}_t}\right)} $ | (2) |
效应值的方差为:
| $ \operatorname{var}(\operatorname{lnRR})=\frac{S_{\mathrm{t}}^2}{n_{\mathrm{t}} \bar{X}_{\mathrm{t}}{ }^2}+\frac{S_{\mathrm{c}}{ }^2}{n_{\mathrm{c}} \bar{X}_{\mathrm{c}}{ }^2} $ | (3) |
式中,
| $ {\text{CI}} = \left( {{{\text{e}}^{{\text{lnRR}}}} - 1} \right) \times 100\% $ | (4) |
数据处理采用Excel 2016;利用Meta-Win2.0软件进行数据效应分析;利用SPSS 26进行环境因子与土壤微生物生物量、土壤微生物群落多样性和土壤酶活性的相关性分析;利用GraphPad Prism8软件进行绘图。
2 结果 2.1 土壤微生物和土壤酶活性对实验增温的响应如图 1所示,与不增温对照相比,实验增温使土壤微生物生物量和群落多样性降低,但土壤酶活性却呈现出增加的趋势。实验增温使土壤微生物生物量显著降低了6.7%(P < 0.05)。实验增温使抗氧化类酶、C转化相关酶、N转化相关酶分别显著提高了7.5%、10.8%、19.7%(P < 0.05)。
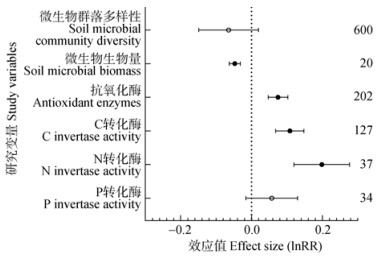
|
注:右侧数字表示样本量,误差线表示95%置信区间。实心圆表示增温处理效应达到显著水平(P < 0.05)。下同。 Note: The numbers on the right represent the sample size and the error bars represent the 95% confidence interval. The solid circle indicated that the effect of heating treatment reached a significant level (P < 0.05). The same as below. 图 1 实验增温对土壤微生物群落多样性、微生物生物量和土壤酶活性的影响。 Fig. 1 Effects of experimental warming on the biomass, diversity, and enzyme activity of soil microbial communities |
总体而言,土壤微生物生物量与群落多样性对实验增温的响应相对一致,实验增温降低了上述两种指标(图 1,图 2);且土壤微生物生物量对增温响应的相关研究更系统。
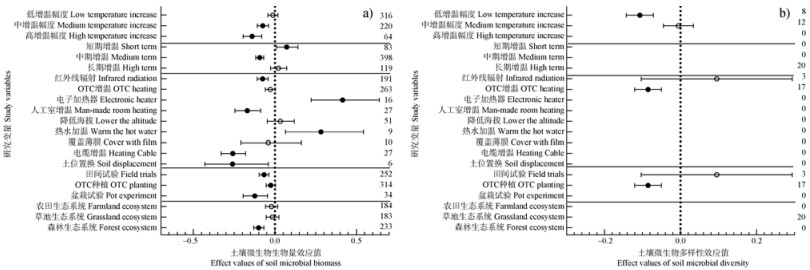
|
图 2 土壤微生物生物量(a)和群落多样性(b)对实验增温的响应效应值与增温模式、种植方式和生态系统类型的关系 Fig. 2 Effect values of soil microbial biomass (a)and community diversity (b)in response to experimental warming in relation to warming patterns, cropping practices and ecosystem types |
如图 2a所示,高幅度增温使土壤微生物生物量显著降低了14.0%。低幅度增温使土壤微生物群落多样性较对照处理显著下降10.8%(P < 0.05)(图 2b)。短、中期增温对土壤微生物生物量的影响截然不同,短期增温使其提高7.2%,中期增温则使其降低了9.4%。目前短期和中期增温对土壤微生物群落多样性的影响尚未见报道。
在增温方式上,OTC增温对土壤微生物群落多样性的影响较红外线辐射增温更显著(图 2b)。电子加热器、热水加温使土壤微生物生物量显著增加了41.6%和6.5%(P < 0.05)。而红外线辐射增温、人工室增温、电缆增温、土位置换则分别使其降低了7.6%、17.0%、25.9%和26.1%。
就种植方式而言,田间试验对土壤微生物生物量的影响较微生物群落多样性更为显著,使土壤微生物生物量显著降低了6.7%(P < 0.05)。与之相反的是,OTC种植使土壤微生物群落多样性显著降低了8.6%(P < 0.05)。盆栽种植条件下,增温使土壤微生物生物量显著降低了12.4%(P < 0.05)(图 2)。实验增温使森林生态系土壤微生物生物量显著降低了10.0%(P < 0.05),而增温对土壤微生物群落多样性的研究仅集中于草地生态系统。
2.3 土壤酶活性对不同增温模式和种植方式的响应就增温幅度而言,中幅度增温对抗氧化类酶活性的影响较其他酶更为显著;而低、高幅度增温则对C转化酶的影响最为显著,使其分别增加了10.3%和17.9%(P < 0.05)(图 3)。就不同增温年限而言,中期增温使抗氧化酶、C转化酶、N转化酶和P转化酶分别显著增加了6.4%、7.1%、21.4%和11.5%(P < 0.05)。长期增温处理对抗氧化酶和C转化酶的影响最显著,分别使其增加了10.0%和17.8%(P < 0.05)。短期增温对P转化酶的影响尚尚未见报道。
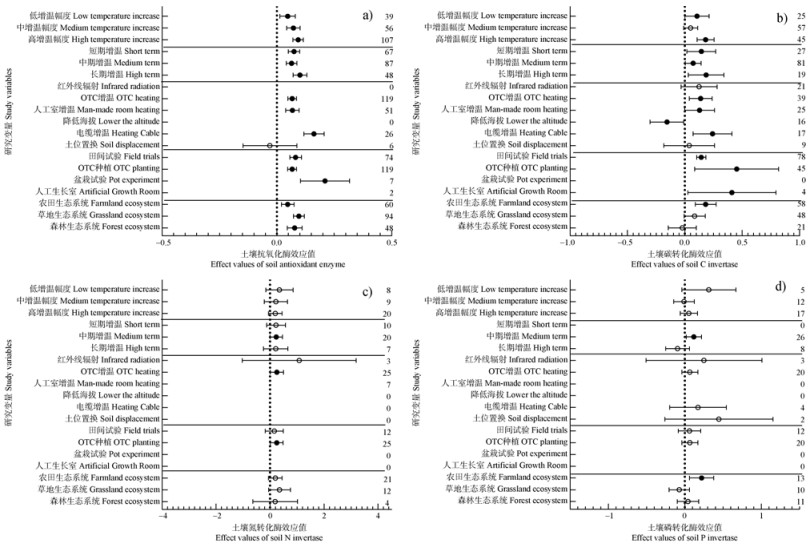
|
图 3 土壤抗氧化酶(a)、碳转化相关酶(b)、氮转化酶(c)、磷转化酶(d)对实验增温的响应效应值及与增温模式、种植方式和生态系统类型的关系 Fig. 3 Effect values of soil antioxidant enzymes (a), C-conversion-related enzymes (b), N-converting enzymes (c), and P-converting enzymes (d)in response to experimental warming and their relationship to warming patterns, cropping practices, and ecosystem types |
就不同增温方式而言,电缆增温对抗氧化酶和C转化酶的影响最显著,使其分别显著增加了16.1%、23.4%(P < 0.05)。降低海拔显著降低了16.5%的土壤C转化酶活性(P < 0.05),而OTC增温显著增加了23.2%的N转化酶活性(P < 0.05)(图 3)。
比较不同种植方式对于土壤酶活性影响发现,盆栽试验增温使抗氧化酶活性显著增加了20.7%(P < 0.05);人工生长室增温使C转化酶活性显著增加了16.6%(P < 0.05);OTC种植增温使N转化酶活性显著增加了23.2%(P < 0.05)。增温分别使农田生态系统、草地生态系统和森林生态系统抗氧化酶活性显著增加了4.7%、9.6%和7.7%(P < 0.05)。在农田生态系统中,增温分别使C转化酶和P转化酶活性显著增加了17.9%和21.2%(P < 0.05)(图 3)。
2.4 不同基础温度条件下的土壤微生物对增温幅度的响应将低于10℃基础温度定义为低基温,高于20 ℃定义为高基温,10℃~20℃定义为中基温。如图 4,在低基础温度的条件下,低、中增温幅度使土壤微生物生物量显著降低了6.7%、6.6%(P < 0.05);而在中基础温度的条件下,中、高增温幅度显著降低了13.0%、26.0%的土壤微生物生物量(P < 0.05)。
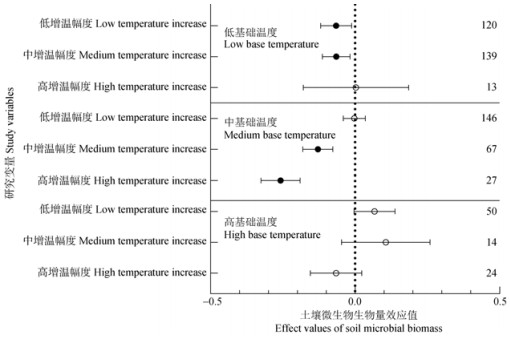
|
图 4 土壤微生物生物量在不同基础温度条件下对不同增温幅度的响应效应值 Fig. 4 Effect values of soil microbial biomass in response to different amplitudes of warming under different base temperature conditions |
对土壤酶活性而言(图 5),在低基础温度条件下,低、中、高增温幅度显著增加了4.6%、12.4%、12.6%土壤抗氧化酶活性(P < 0.05);中增温幅度却显著降低了25.6%P转化酶活性(P < 0.05)。在中基础温度条件下,低、中、高增温幅度使土壤P转化酶分别显著增加了32.8%、22.2%、27.0%(P < 0.05);高增温幅度分别使土壤抗氧化酶、C转化酶显著增加了19.3%、57.7%(P < 0.05)。
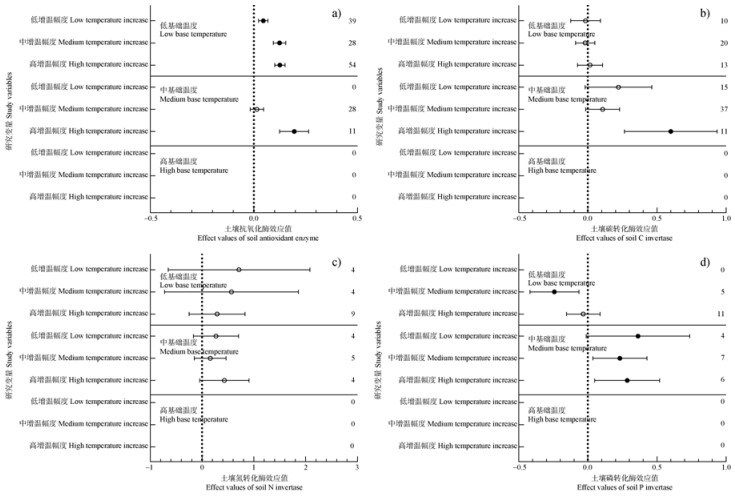
|
图 5 不同基础温度条件下土壤抗氧化酶(a)、碳转化酶(b)、氮转化酶(c)、磷转化酶(d)对不同增温幅度的响应 Fig. 5 Response of soil antioxidant enzymes (a), enzymes related to C (b), N (c), and P conservation to warming magnitude under different base temperature conditions |
由图 6可以看出,土壤微生物群落多样性对增温的响应与平均气温、年降水量和平均海拔呈显著负相关关系(P < 0.05)。土壤C、P转化酶对增温的响应与年降水量呈显著正相关,土壤P转化酶对增温的响应与年平均气温呈显著正相关关系。
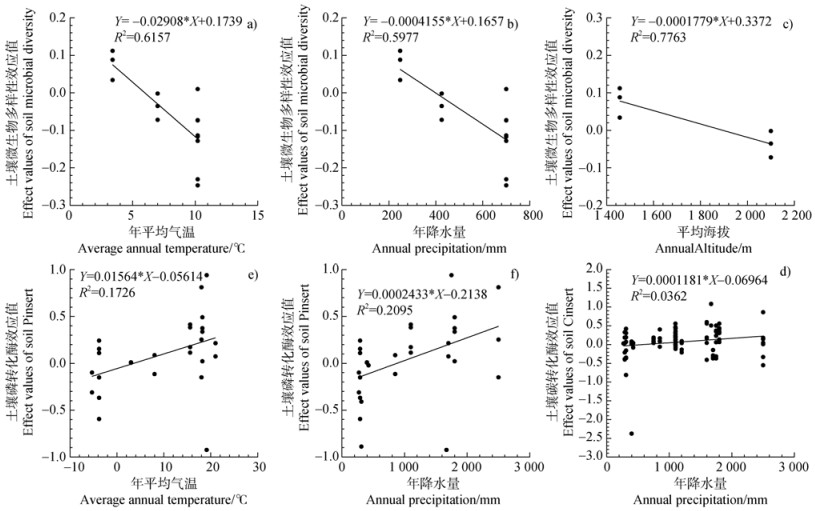
|
图 6 土壤微生物群落多样性对增温的响应与年平均气温(a)、年降水量(b)、平均海拔(c)的关系,土壤碳转化酶与降水量(d)的关系以及土壤磷转化酶与年平均气温(e)、年降水量(f)的关系 Fig. 6 Effects of experimental warming on soil microbial diversity related to annual average temperature (a), annual precipitation (b), and average altitude (c); effects of experimental warming on soil enzymes related to C conservation related to annual precipitation (d); as well as effects of experimental warming on soil enzymes related to P conservation related to annual average temperature (e)and annual precipitation (f) |
土壤微生物在陆地C循环与气候变暖之间有着非常重要的中介作用,气候变暖对土壤微生物群落产生了强烈的影响,从而影响陆地C循环[9]。本研究发现增温降低了土壤微生物的群落多样性(图 1),Zhang等[10]也发现变暖显著降低了耕地土壤细菌和真菌的物种丰富度。随着气温的增加,微生物群落总丰度的降低可能减缓土壤C的积累,因为微生物衍生的C是土壤有机质的主要来源[11]。但也有研究发现年限少于2 a的增温实验能显著增加西藏农田生态系统中的真菌α多样性,并有效改变土壤真菌群落,从而维持、稳定、改善耕地质量。气候变暖还能加速土壤细菌和真菌群落的时间周转速率,增加土壤的群落多样性,因此温度在塑造微生物群落多样性方面起着主要作用[12]。
相较于土壤微生物群落多样性,本研究发现实验增温显著降低了土壤微生物生物量(图 1)。Dai等[13]发现全球尺度下,升温显著降低了陆地生态系统的MBC、MBN含量,这可能是由于升温降低了土壤微生物的C、N利用率,导致微生物从外界获取C、N养分的能力降低。变暖加强了植物群落和土壤微生物对土壤养分的竞争,引发土壤对微生物的养分限制,使土壤微生物生物量减少[14]。然而也有研究指出,实验增温可通过改善土壤养分条件来提高土壤微生物活性、增加土壤微生物生物量,进而达到促进植物生长、提高植物生产力的作用[15]。有研究发现,OTC增温能加速高寒草甸土壤有机C的矿化,增加了C的有效性,从而增强微生物活性并加速其繁殖速度,增加土壤中MBC、MBN含量[16]。关于草地生态系统的研究也同样表明实验增温显著增加了土壤MBC、MBN含量[17]。Zosso等[18]发现在森林生态系统中,增温4℃虽使土壤微生物总生物量降低了28%,却增加了放线菌的含量,并促进放线菌对C源的代谢。而Yu等[19]利用Meta分析发现实验增温后土壤微生物C:N比无显著变化,这可能是由于大型的陆地C库会有一定的自我调节能力,来保持微生物C︰N和C︰P比率不变。
本研究发现实验增温使土壤酶活性增加,尤其是抗氧化酶及C、N转化相关酶活性(图 1)。温度一方面通过影响酶动力指数来直接影响酶活性;另一方面通过影响土壤微生物数量、土壤养分含量来间接影响土壤酶活性[20]。增温显著增加了土壤C转化酶和脲酶活性,提高了土壤有机层微生物活性和养分有效性,同时能促进植物的光合作用[21]。有研究指出,温度升高0.5℃可增强与C、N转化相关酶活性,加速土壤物质循环[22]。然而也有部分研究统计发现增温引起土壤酶活性降低,原因可能是温度升高加强了土壤表面的蒸腾作用,降低土壤含水量,从而抑制了微生物的活性和酶的产生[23]。
上述研究结论的不一致可能与不同的基础温度、增温幅度、增温年限、增温方式、种植方式以及生态系统类型相关。
3.2 不同基础温度、增温幅度、增温年限、增温方式和生态系统类型对土壤微生物的影响增温促进部分微生物的活性,导致土壤中的C损失,从而减少了土壤微生物生物量C,即增温对土壤微生物具有抑制作用[24]。夏璟钰等[25]在西藏那曲高寒草地生态系统通过设置不同底边长的OTC增温梯度实验,发现增温降低了土壤平均含水量和土壤养分的有效性,进而抑制了土壤微生物代谢能力和酶活性。Wang等[26]也发现增温降低了内蒙古草地生态系统土壤微生物活性和生物量,增温通过改变土壤有机C组分和提高有机C分解速率来调节土壤酶活性。植物通过根、叶等凋落物的分解以及根系分泌物向土壤微生物提供C源,而土壤微生物活动会释放植物所需的养分,并影响了土壤C呼吸和C稳定之间的平衡。增温幅度较低时,增温对植物生物量的积累有促进作用,能提高土壤微生物的代谢活性;当增温幅度过高或增温时间过长,这种促进作用会逐渐减弱甚至变成抑制作用[27-28]。因此,在发掘增温对土壤微生物群落的影响规律时,可能要结合植物根系综合考虑。此外,本研究还发现在低、中基温条件下,不同增温幅度对土壤微生物生物量和抗氧化酶的影响显著;而在高基温条件下,不同增温幅度对土壤微生物生物量及酶活无显著影响(图 4,图 5)。土壤酶活性有最适温度(比如土壤脱氢酶、过氧化氢酶在10~15℃时活性最高,磷酸酶在15~20℃)[29],因此高基温(> 20℃)条件下增温会进一步抑制酶活性。
由于研究地区的地理环境、植物类型和研究目标的不同,在增温实验中会运用到很多不同的增温装置,来达到不同的增温效果,目前大致分为增加太阳辐射的被动增温和依赖人工电力的主动增温两种方式[30]。其中OTC作为被动增温的典型代表,在野外实验中应用最为广泛,它类似于温室,能减少空气流动、形成较为稳定的增温环境,且对植物的生长环境影响较小,能更好适应高海拔地区电力及交通不便的情况[31]。本研究发现不同的增温方式对土壤微生物具有相反的影响,红外线辐射增温、电缆增温和土位置换显著降低了土壤微生物生物量,而电子加热器和热水加温则显著提高了该指标(图 2)。这可能是由于红外线辐射增温和电缆增温均直接作用于土壤,增温效果较其他增温方式更为显著[32];而电子加热器和热水增温均无法使温度保持稳定。Zhang等[33]也发现,使用电子加热器(电阻加热)处理后细菌丰度增幅达108%,且土壤微生物群落多样性和丰富度也显著提高;这可能是增温使草酸等有机酸和相关土壤酶活性增加,改善了细菌的生长环境或提供了细菌生长所需物质,从而间接导致细菌丰度升高。
本研究还发现,农田生态系统和草地生态系统对增温的响应较森林生态系统更显著(图 2,图 3)。这可能是由于木本植物的支撑结构要高于草本和禾本科植物,能更好地储存利用养分,因此增温对林木植物的作用可能在养分的转化中流失了[34]。
3.3 土壤微生物对实验增温的响应与本底环境条件的关系本文的研究发现土壤微生物多样性与海拔呈显著负相关(图 6)。一般地,海拔越高,温度越低,从而降低了微生物活性。部分研究结果得出,低基温条件下酶活性对温度的敏感性更高[35]。比如在青藏高原等高海拔地区,OTC增温能改善草地生态系统的环境因子,增加土壤养分可利用性,进而促进草本植物的生长[36]。降低海拔能提高土壤C、P转化相关酶活性,但当海拔降低到一定阈值,土壤酶活性却随温度的增加而降低。这可能是因为随着海拔的降低土壤中C、N含量不断损失,微生物通过增加酶活性来提高C、N利用率以维持植物的正常生长代谢;但当C、N养分含量损失超过一定范围后,微生物就会丧失该调节能力[37]。
本研究还发现平均气温与土壤微生物群落多样性呈显著负相关(图 6),这可能是由于年平均温度的增加,促进了作物生长,加剧作物根系与土壤微生物的养分竞争,进而抑制土壤微生物活动。然而P转化酶对温度的敏感性较低[38],平均气温小于30 ℃时温度的增加能提高其活性[39]。短时期内降水量适量增加可减缓较高气温对土壤微生物的抑制作用,并有利于土壤有机质的保持[40]。降水量会直接影响土壤水分含量,从而间接影响土壤微生物的活性[41]。
4 结论实验增温对土壤微生物生物量和群落多样性产生了负效应,对土壤酶活性产生了正效应。实验增温对土壤微生物的影响取决于基础温度、增温幅度、增温年限和增温方式。中基础温度条件下土壤微生物对增温的响应更显著;土壤微生物群落多样性、N转化酶和P转化酶对低增温幅度的响应更敏感,而土壤微生物生物量、抗氧化酶和C转化酶则对高增温幅度更敏感。长期增温显著提高了土壤抗氧化酶和C转化酶活性,而中期增温则显著提高了N转化酶和P转化酶的活性;电子加热器、热水增温显著增加了土壤微生物生物量,而红外线辐射增温、人工室增温、电缆增温、土位置换使其显著降低;OTC增温显著降低了土壤微生物多样性。农田生态系统中P转化酶对实验增温的响应更显著,而森林生态系统中微生物生物量对增温的响应更显著。
| [1] |
Kikstra J S, Nicholls Z R J, Smith C J, et al. The IPCC Sixth Assessment Report WGIII climate assessment of mitigation pathways: From emissions to global temperatures[J]. Geoscientific Model Development, 2022, 15(24): 9075-9109. DOI:10.5194/gmd-15-9075-2022
(  0) 0) |
| [2] |
Way D A, Oren R. Differential responses to changes in growth temperature between trees from different functional groups and biomes: A review and synthesis of data[J]. Tree Physiology, 2010, 30(6): 669-688. DOI:10.1093/treephys/tpq015
(  0) 0) |
| [3] |
Cai M K, Zhao G, Zhao B, et al. Climate warming alters the relative importance of plant root and microbial community in regulating the accumulation of soil microbial necromass carbon in a Tibetan alpine meadow[J]. Global Change Biology, 2023, 29(11): 3193-3204. DOI:10.1111/gcb.16660
(  0) 0) |
| [4] |
Sun R B, Zhang X X, Guo X S, et al. Bacterial diversity in soils subjected to long-term chemical fertilization can be more stably maintained with the addition of livestock manure than wheat straw[J]. Soil Biology and Biochemistry, 2015, 88: 9-18. DOI:10.1016/j.soilbio.2015.05.007
(  0) 0) |
| [5] |
Bilyera N, Zhang X C, Duddek P, et al. Maize genotype-specific exudation strategies: An adaptive mechanism to increase microbial activity in the rhizosphere[J]. Soil Biology and Biochemistry, 2021, 162: 108426. DOI:10.1016/j.soilbio.2021.108426
(  0) 0) |
| [6] |
Preusser S, Marhan S, Poll C, et al. Microbial community response to changes in substrate availability and habitat conditions in a reciprocal subsoil transfer experiment[J]. Soil Biology and Biochemistry, 2017, 105: 138-152. DOI:10.1016/j.soilbio.2016.11.021
(  0) 0) |
| [7] |
Guan P T, Yang J J, Yang Y R, et al. Land conversion from cropland to grassland alleviates climate warming effects on nutrient limitation: Evidence from soil enzymatic activity and stoichiometry[J]. Global Ecology and Conservation, 2020, 24: e01328. DOI:10.1016/j.gecco.2020.e01328
(  0) 0) |
| [8] |
Du Z Y, Cong N. Responses of vegetation and soil characteristics to degraded grassland under different degrees on the Qinghai-Tibet Plateau (In Chinese)[J]. Acta Ecologica Sinica, 2024, 44(6): 2504-2516. [杜志勇, 丛楠. 植被与土壤特征对青藏高原不同程度退化草地的响应[J]. 生态学报, 2024, 44(6): 2504-2516.]
(  0) 0) |
| [9] |
Lu M Y, Ding X L. A meta-analysis of soil microbial necromass accumulation in response to climate warming (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(5). DOI:10.11766/trxb202303200109 [卢孟雅, 丁雪丽. 基于Meta分析的增温对土壤微生物残体积累影响[J]. 土壤学报, 2024, 61(5).]
(  0) 0) |
| [10] |
Zhang Y, Dong S K, Gao Q Z, et al. Climate change and human activities altered the diversity and composition of soil microbial community in alpine grasslands of the Qinghai-Tibetan Plateau[J]. Science of the Total Environment, 2016, 562: 353-363. DOI:10.1016/j.scitotenv.2016.03.221
(  0) 0) |
| [11] |
Purcell A M, Hayer M, Koch B J, et al. Decreased growth of wild soil microbes after 15 years of transplant-induced warming in a montane meadow[J]. Global Change Biology, 2022, 28(1): 128-139. DOI:10.1111/gcb.15911
(  0) 0) |
| [12] |
Zhong Z M, Zhang G Y, Fu G. Effect of experiment warming on soil fungi community of Medicago sativa, Elymus nutans and Hordeum vulgare in Tibet[J]. Journal of Fungi, 2023, 9(9): 885. DOI:10.3390/jof9090885
(  0) 0) |
| [13] |
Dai Z M, Yu M J, Chen H H, et al. Elevated temperature shifts soil N cycling from microbial immobilization to enhanced mineralization, nitrification and denitrification across global terrestrial ecosystems[J]. Global Change Biology, 2020, 26(9): 5267-5276. DOI:10.1111/gcb.15211
(  0) 0) |
| [14] |
Hodge A, Robinson D, Fitter A. Are microorganisms more effective than plants at competing for nitrogen?[J]. Trends in Plant Science, 2000, 5(7): 304-308. DOI:10.1016/S1360-1385(00)01656-3
(  0) 0) |
| [15] |
van der Heijden M G A, Bardgett R D, van Straalen N M. The unseen majority: Soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems[J]. Ecology Letters, 2008, 11(3): 296-310. DOI:10.1111/j.1461-0248.2007.01139.x
(  0) 0) |
| [16] |
Walker T W N, Kaiser C, Strasser F, et al. Microbial temperature sensitivity and biomass change explain soil carbon loss with warming[J]. Nature Climate Change, 2018, 8(10): 885-889. DOI:10.1038/s41558-018-0259-x
(  0) 0) |
| [17] |
Liu W L, Xu G, Bai J W, et al. Effects of warming and oxalic acid addition on plant–microbial competition in Picea brachytyla[J]. Canadian Journal of Forest Research, 2021, 51(3): 357-364. DOI:10.1139/cjfr-2020-0019
(  0) 0) |
| [18] |
Zosso C U, Ofiti N O E, Soong J L, et al. Whole-soil warming decreases abundance and modifies the community structure of microorganisms in the subsoil but not in surface soil[J]. Soil, 2021, 7(2): 477-494. DOI:10.5194/soil-7-477-2021
(  0) 0) |
| [19] |
Yu Z K, Zhang C, Liu X W, et al. Responses of C: N: P stoichiometric correlations among plants, soils and microorganisms to warming: A meta-analysis[J]. Science of the Total Environment, 2024, 912: 168827. DOI:10.1016/j.scitotenv.2023.168827
(  0) 0) |
| [20] |
Li N, Wang G X, Gao Y H, et al. Effects of simulated warming on soil nutrients and biological characteristics of alpine meadow soil in the headwaters region of the Yangtze River (In Chinese)[J]. Acta Pedologica Sinica, 2010, 47(6): 1214-1224. [李娜, 王根绪, 高永恒, 等. 模拟增温对长江源区高寒草甸土壤养分状况和生物学特性的影响研究[J]. 土壤学报, 2010, 47(6): 1214-1224.]
(  0) 0) |
| [21] |
Sinsabaugh R L, Lauber C L, Weintraub M N, et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters, 2008, 11(11): 1252-1264. DOI:10.1111/j.1461-0248.2008.01245.x
(  0) 0) |
| [22] |
Feng R F, Yang W Q, Zhang J, et al. Effects of simulated elevated atmospheric CO2 concentration and temperature on soil enzyme activity in the subalpine fir forest (In Chinese)[J]. Acta Ecologica Sinica, 2007, 27(10): 4019-4026. [冯瑞芳, 杨万勤, 张健, 等. 模拟大气CO2浓度和温度升高对亚高山冷杉(Abies faxoniana)林土壤酶活性的影响[J]. 生态学报, 2007, 27(10): 4019-4026.]
(  0) 0) |
| [23] |
Hagerty S B, van Groenigen K J, Allison S D, et al. Accelerated microbial turnover but constant growth efficiency with warming in soil[J]. Nature Climate Change, 2014, 4: 903-906. DOI:10.1038/nclimate2361
(  0) 0) |
| [24] |
Yuan S, Cuiting W, Han Y H C, et al. A global meta-analysis on the responses of C and N concentrations to warming in terrestrial ecosystems[J]. Catena, 2022, 108: 105762.
(  0) 0) |
| [25] |
Xia J Y, Zhang Y J, Zheng Z T, et al. Asynchronous response of plant phenology to warming in a Kobresia pygmaea meadow in Nagqu, Qingzang Plateau (In Chinese)[J]. Chinese Journal of Plant Ecology, 2023, 47(2): 183-194. [夏璟钰, 张扬建, 郑周涛, 等. 青藏高原那曲高山嵩草草甸植物物候对增温的异步响应[J]. 植物生态学报, 2023, 47(2): 183-194.]
(  0) 0) |
| [26] |
Wang H H, Huang W D, He Y Z, et al. Effects of short-term warming and precipitation reduction on soil microbial biomass carbon, nitrogen and enzyme activity in sandy grassland[J]. Journal of Desert Research, 2022, 42(3): 274-281.
(  0) 0) |
| [27] |
Gao K, Mao Z B, Meng E X, et al. Effects of elevated CO2 and warming on the root-associated microbiota in an agricultural ecosystem[J]. Environmental Microbiology, 2022, 24(12): 6252-6266. DOI:10.1111/1462-2920.16246
(  0) 0) |
| [28] |
Gunn L H, Martin Avila E, Birch R, et al. The dependency of red Rubisco on its cognate activase for enhancing plant photosynthesis and growth[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(41): 25890-25896.
(  0) 0) |
| [29] |
Borowik A, Wyszkowska J. Impact of temperature on the biological properties of soil[J]. International Agrophysics, 2016, 30(1): 1-8. DOI:10.1515/intag-2015-0070
(  0) 0) |
| [30] |
Li J X, Zhang Y J, Zhu J T, et al. Responses of community characteristics and productivity to a warming gradient in a Kobresia pygmaea meadow of Tibetan Plateau (In Chinese)[J]. Acta Ecologica Sinica, 2019, 39(2): 474-485. [李军祥, 张扬建, 朱军涛, 等. 藏北高山嵩草草甸群落特征及生产力对模拟增温幅度的响应[J]. 生态学报, 2019, 39(2): 474-485.]
(  0) 0) |
| [31] |
Gan Q J, Liu J L, Chen H. Progress in research on field warming methods (In Chinese)[J]. Chinese Journal of Applied and Environmental Biology, 2021, 27(4): 1092-1101. [甘琦杰, 刘建亮, 陈槐. 野外增温方法研究进展[J]. 应用与环境生物学报, 2021, 27(4): 1092-1101.]
(  0) 0) |
| [32] |
Zhu B, Chen Y. Techniques and methods for field warming manipulation experiments in terrestrial ecosystems (In Chinese)[J]. Chinese Journal of Plant Ecology, 2020, 44(4): 330-339. [朱彪, 陈迎. 陆地生态系统野外增温控制实验的技术与方法[J]. 植物生态学报, 2020, 44(4): 330-339.]
(  0) 0) |
| [33] |
Zhang C C, Yang L Q, Han Z Y, et al. Effects of low-temperature electrical resistance heating on soil polycyclic aromatic hydrocarbons removal and microorganisms[J]. Chinese Journal of Environmental Engineering, 2023, 17(6): 1937-1946.
(  0) 0) |
| [34] |
Jiao H Z, Li H, Chen H, et al. Effects of soil warming and nitrogen addition on soil dissolved organic matter of Cunninghamia lanceolata plantations in subtropical China (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(5): 1249-1258. [焦宏哲, 李欢, 陈惠, 等. 增温、施氮对中亚热带杉木林土壤可溶性有机质的影响[J]. 土壤学报, 2020, 57(5): 1249-1258.]
(  0) 0) |
| [35] |
Wang M R, Dungait J A J, Wei X M, et al. Long-term warming increased microbial carbon use efficiency and turnover rate under conservation tillage system[J]. Soil Biology and Biochemistry, 2022, 172: 108770. DOI:10.1016/j.soilbio.2022.108770
(  0) 0) |
| [36] |
Meng C, Tian D S, Zeng H, et al. Global meta-analysis on the responses of soil extracellular enzyme activities to warming[J]. Science of the Total Environment, 2020, 705: 135992. DOI:10.1016/j.scitotenv.2019.135992
(  0) 0) |
| [37] |
Zhao Y C, Chen L T. Soil nutrients modulate response of aboveground biomass to warming in alpine grassland on the Qingzang Plateau (In Chinese)[J]. Chinese Journal of Plant Ecology, 2023, 47(8): 1071-1081. [赵艳超, 陈立同. 土壤养分对青藏高原高寒草地生物量响应增温的调节作用[J]. 植物生态学报, 2023, 47(8): 1071-1081.]
(  0) 0) |
| [38] |
Wan D M, Wang Y, Du X L, et al. Effect of root isolation on soil enzyme activity and its temperature sensitivity (In Chinese)[J]. Journal of Forest and Environment, 2024, 44(1): 28-34. [万冬梅, 王云, 杜旭龙, 等. 根系隔离对土壤酶活性及其温度敏感性的影响[J]. 森林与环境学报, 2024, 44(1): 28-34.]
(  0) 0) |
| [39] |
Schindlbacher A, Schnecker J, Takriti M, et al. Microbial physiology and soil CO2 efflux after 9 years of soil warming in a temperate forest - no indications for thermal adaptations[J]. Global Change Biology, 2015, 21(11): 4265-4277. DOI:10.1111/gcb.12996
(  0) 0) |
| [40] |
Cao C, Ruan C Y, Ren Y B, et al. Effects of stimulating warming on surface soil carbon, nitrogen and its enzyme activities across a subtropical elevation gradient in Wuyi Mountain, China (In Chinese)[J]. Acta Ecologica Sinica, 2020, 40(15): 5347-5356. [曹聪, 阮超越, 任寅榜, 等. 模拟增温对武夷山不同海拔森林表层土壤碳氮及酶活性的影响[J]. 生态学报, 2020, 40(15): 5347-5356.]
(  0) 0) |
| [41] |
Li G L, Kim S, Han S H, et al. Precipitation affects soil microbial and extracellular enzymatic responses to warming[J]. Soil Biology and Biochemistry, 2018, 120: 212-221. DOI:10.1016/j.soilbio.2018.02.014
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


