2. 中国科学院大学, 北京 100049;
3. 中国科学院大学南京学院, 南京 211135;
4. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所), 南京 211135;
5. 安徽理工大学空间信息与测绘工程学院, 淮南 232001
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. University of Chinese Academy of Sciences, Nanjing, Nanjing 211135, China;
4. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China;
5. School of Geomatics, Anhui University of Science and Technology, Huainan 232001, China
土壤盐渍化威胁全球粮食安全[1]。我国盐渍化耕地面积为920.9×104 hm2,占全国耕地总面积的6.6%[2]。盐渍化耕地产能低,据报道,内蒙古黄河灌区盐渍化耕地玉米产量较非盐渍化耕地低30%以上[3]。要提高其产能,首先要解决盐渍反复、水分约束强的问题。然而,优化水盐管理措施后,若是不提升土壤养分含量,盐渍化耕地产量提升仍会受到限制。我国盐渍化农田氮磷肥利用率明显低于普通耕地,氮肥利用率10%~25%,较常规农田平均氮肥利用率低20%~25%;磷肥利用率6%~15%,较常规农田平均磷肥利用率低4%~10%[4-5]。可见,盐渍化耕地养分问题非常突出,改善土壤肥力是提升盐渍化耕地产能的必要途径。
土壤中的碳(C)、氮(N)、磷(P)是农田生态系统作物生长发育过程所必需的重要元素,也是衡量土壤肥力水平的重要指标[6]。研究表明,目前我国盐渍化耕地土壤有机质含量不足10 g·kg–1的面积已达到26%[7]。李红强等[8]发现当土壤盐分 > 3 g·kg–1时,氮矿化作用受到明显抑制,土壤有效氮库降低。Xie等[9]指出盐分是影响滨海盐渍土壤有效磷库的重要环境因子。此外,土壤微生物作为有机质腐殖矿化和氮磷等养分循环的主要驱动者,其代谢状态直接决定了土壤养分状况。而土壤微生物的代谢活动主要取决于微生物生物量和酶活性,盐分会抑制微生物活动并且改变其生存策略。这是由于盐渍化过程可以通过形成迥异于常规农田的物理、化学、生物环境改变土壤养分元素的迁移转化规律从而影响养分库容量[10-11]。因此,明确不同盐渍程度下针对于C、N、P元素的土壤养分、微生物生物量、胞外酶活数量的变化规律,对评估和改善盐渍化土壤肥力具有重要意义。
C、N、P三元素作为植物生理过程必需的大量元素,其平衡性决定了土壤-微生物-植物系统的养分利用与循环,也是土壤肥力质量的重要评价标准[6]。土壤生态化学计量学常被用于研究C、N、P元素在土壤、有机质和微生物间的相互作用关系,以明确生物与非生物过程中三元素之间的相互作用与平衡[12],是确定土壤养分限制性元素判定的重要方法[13]。内稳性是生态化学计量学理论的前提,当土壤中可利用资源计量比改变时,微生物会通过改变生态酶计量比来维持自身生物量比的稳定[14],最终使土壤-微生物整体系统趋于稳定。前人已有研究发现,我国土壤C︰N︰P摩尔计量比值约为134︰9︰1[15],全球土壤微生物生物量C、N、P摩尔计量比均值约为42︰6︰1[16],全球尺度表层土壤碳获取酶活:氮获取酶活:磷获取酶活趋向于1︰1︰1[17]。但是当土壤环境条件发生变化时,生态化学计量比也会随之改变从而影响土壤底物限制与微生物代谢限制[18]。目前仍缺乏对盐胁迫下土壤养分资源与微生物代谢资源限制共同特征的充分认识,更未明确资源限制特征与盐渍化土壤中环境因子的关系,这阻碍了盐渍土改良利用过程中更为精准高效的养分管理措施的制定。因此了解土壤C、N、P养分、微生物生物量、胞外酶活化学计量特征对土壤盐渍化的响应规律可以用来明确农田生态系统中不同盐渍状况下的能量和养分限制程度。
鉴于此,本研究通过采集我国典型盐渍化区域不同盐渍化程度土壤作为研究对象,采用生态化学计量学方法,分析土壤盐渍障碍对土壤碳氮磷养分元素、微生物生物量、胞外酶活计量及各自生态化学计量比的影响,探讨土壤碳氮磷养分的限制性及微生物对代谢限制的反馈机制,以期为盐渍化土壤养分健康管理与扩容调蓄、地力产能提升提供理论依据。
1 材料与方法 1.1 样点选择与采样2023年4—7月在新疆尉犁、新疆玛纳斯、甘肃武威、甘肃酒泉、内蒙古五原、宁夏青铜峡、河北海兴、山东乐陵、山东武城、山东东营、江苏东台、浙江慈溪等典型土壤盐渍化地区按照“S”形采样随机五点混合方式共采集147个不同盐渍化程度的耕层土壤样品(0~20 cm)。样品带回实验室后分为两份:一份风干过筛后用于测定土壤基本理化性质;另一份于4℃保存,过筛去除植物根系等杂质,测定土壤微生物生物量碳氮磷和碳氮磷胞外酶活。样点地区的年均气温(MAT)、年均降雨量(MAP)、年均潜在蒸散发量(MAV)数据来源于国家青藏高原科学数据中心(https://data.tpdc.ac.cn),年均蒸降比(MAV/MAP)由月均潜在蒸散发量与月均降雨量的比值计算而来。
1.2 测定指标及方法供试土壤测定指标包括质量含水量(WC)、pH、阳离子交换量(CEC)、碱化度(ESP)、钠吸附比(SAR)、颗粒组成、可溶性八大离子(K+、Ca2+、Na+、Mg2+、Cl–、SO42–、HCO3–、CO32–)、土壤总盐分含量(TS)、有机碳(SOC)、全氮(TN)、全磷(TP)、全钾(TK)、有效磷(AP)、速效钾(AK)、微生物生物量碳(MBC)、微生物生物量氮(MBN)、微生物生物量磷(MBP)、β-1,4-葡萄糖苷酶(BG)、β-D-纤维二糖水解酶(CBH)、β-1,4-N-乙酰氨基葡萄糖苷酶(NAG)、L-亮氨酸氨肽酶(LAP)、碱性磷酸酶(ALP)。测定方法参照《土壤农化分析》[19],简述如下:
土壤WC采用烘干法测定;土壤pH采用pH计测定(SG78,Mettler Toledo,瑞士);土壤CEC采用乙酸钠—火焰光度法测定;ESP通过交换性钠与CEC的比值得到;SAR通过土水比1:5振荡提取的溶液中Na+浓度与Ca2+、Mg2+浓度平均值的平方根的比值得到;土壤颗粒组成采用激光粒度仪测定(LS13320,贝克曼库尔特,美国);土壤可溶性八大离子中K+、Ca2+、Na+、Mg2+采用ICP-MS测定(Avio 200,PerkinElmer,美国),Cl–、SO42–采用离子色谱仪测定(ICS-5000+,Thermo Fisher Scientific,美国),HCO3–、CO32–采用双指示剂-中和滴定法测定;TS通过可溶性八大离子含量加和得到。
SOC、TN、TP、TK、AN、AP和AK含量的测定分别采用重铬酸钾容量法(外加热)、碳氮分析仪干烧法(PRIMACS SNC90-IC-E,Skalar,荷兰)、HClO4-H2SO4消煮—钼锑抗比色法、氢氧化钠熔融—火焰光度计法、碱解扩散法、碳酸氢钠提取—钼锑抗比色法和乙酸铵提取—火焰光度计法。MBC、MBN、MBP含量的测定采用氯仿熏蒸浸提法。土壤BG、CBH、LAP、NAG和ALP酶活性采用酶活性试剂盒(艾迪生)微孔板荧光法进行测定。
土壤养分元素碳氮比、碳磷比和氮磷比分别通过SOC:TN、SOC:TP和TN:TP计算得到。微生物生物量计量比分别通过MBC:MBN、MBC:MBP、MBN:MBP计算得到。Enzyme C/N通过(BG+CBH):(NAG+LAP)计算得到,Enzyme C/P通过(BG+CBH):ALP计算得到,Enzyme N/P通过(NAG+LAP):ALP计算得到。参照Moorhead的方法通过酶化学矢量模型计算矢量长度(Vector Length)、矢量角度(Vector Angle)来表征不同盐渍化程度土壤微生物代谢特征的差异[20],其中,Vector Length表示土壤微生物相对碳的限制程度,Vector Length越大代表微生物的代谢受碳限制越大。Vector Angle表示土壤微生物相对氮/磷的限制程度。当向量角度大于45°表示微生物代谢受磷限制,而向量角度小于45°表示微生物受土壤氮限制,偏离45°程度越大,限制越强。鉴于此,以(45°-Vector Angle)来表示土壤微生物相对氮限制程度,值越大,微生物的代谢受氮限制越大。
1.3 土壤盐渍化程度划分与养分等级评估结合本研究的土壤样本特点,按照土壤总盐分含量(TS)将所有样本划分为三类,具体为:(1) < 3 g·kg–1(S1,n=60);(2)3~10 g·kg–1(S2,n=45);(3) > 10 g·kg–1(S3,n=42)。按照全国第二次土壤普查养分分级指标对不同盐渍化程度的土壤养分等级进行评估[21]。
1.4 数据处理与分析运用SPSS 23.0(Chicago,IL,USA)统计分析软件对数据进行单因素方差分析(One-way ANOVA)和Duncan多重比较检验,探究不同盐渍障碍程度下土壤碳氮磷养分元素、微生物生物量和胞外酶活及其计量比的显著性差异;结合本研究土壤性质差异,将TS、ESP、pH、SAR、WC、CEC、Sand、可溶性八大离子、MAT、MAP、MAV、MAV/MAP作为环境因子变量,通过Pearson相关性分析环境因子与土壤碳氮磷养分元素、微生物生物量和胞外酶活及其计量比的相关关系,可视化通过Origin 2021完成。采用冗余分析判断影响土壤养分、微生物碳氮磷和胞外酶活计量比的关键环境因素与解释度,可视化通过Canoco 5完成;采用随机森林回归模型分析土壤环境因子对向量长度及向量角度的相对重要性,通过R 4.2.0软件的Random forest包完成。统计分析前,进行数据的正态分布检验,如不符合正态分布则将试验数据进行对数转换,使数据服从正态分布。
2 结果 2.1 盐渍土壤的基本理化性质S1、S2、S3盐度土壤总盐分含量分别为1.39 g·kg–1、5.20 g·kg–1、27.87 g·kg–1。土壤ESP、SAR均随盐渍化等级增加显著提高(P < 0.05),但CEC呈现明显下降趋势(P < 0.05)。三种盐渍化程度土壤均呈弱碱性。S3土壤质量含水量显著低于S1和S2土壤。S3土壤粉粒显著低于S1和S2土壤,砂粒显著高于S1与S2土壤。土壤可溶性八大离子中除HCO3–+CO32–外,Cl–、SO42–、Na+、Mg2+、Ca2+、K+均随着盐渍化程度增加而显著增加(P < 0.05)。其中,Cl–、SO42–、Na+变化最为显著(表 1)。
|
|
表 1 盐渍化土壤的基本理化性质 Table 1 Basic physical and chemical properties of different salt-affected soils |
随盐渍化程度增加,耕层土壤SOC、TN、TP含量均不断降低,TK呈增加趋势(表 2)。S3土壤SOC、TN含量较S1和S2土壤均下降了一个等级,处于五级缺乏水平。随盐渍化程度增加土壤TP逐渐下降,但S3土壤TP丰缺程度仍处于四级较适宜水平。三种盐渍化程度土壤的TK无显著性差异,均处于三级最适宜水平。就速效养分而言(表 2),土壤AN的变化趋势与TN结果相似,均随盐渍化程度增加明显下降,且S3土壤AN处于五级缺乏水平。S3土壤的AP含量较S1、S2土壤呈显著下降趋势(P < 0.05),但养分等级仍处于三级最适宜水平。三种盐渍化程度土壤的AK养分等级均在丰富到极丰富水平。
|
|
表 2 不同盐渍化程度土壤碳氮磷钾含量及丰缺程度 Table 2 Carbon, nitrogen, phosphorus, and potassium contents and nutrient grading of soils with different salinity levels |
S3土壤的MBC显著高于S1和S2土壤(P < 0.05)。S1、S2、S3盐度土壤的MBN、MBP无显著差异,但S3土壤的MBN、MBP含量均有所下降。随着盐渍化程度增加,BG+CBH、NAG+LAP、ALP酶活均显著降低(P < 0.05)。其中,土壤BG、LAP、ALP酶活随盐渍化程度增加显著降低(P < 0.05),而土壤CBH和NAG变化幅度较小(表 3)。
|
|
表 3 不同盐渍化程度土壤微生物生物量碳氮磷含量与胞外酶活性 Table 3 Microbial biomass carbon, nitrogen and phosphorus content and extracellular enzyme activity in soils with different salinity levels |
不同盐渍化程度土壤C、N、P养分化学计量比特征如图 1a、图 1b、图 1c所示,S3土壤C:N分别较S1和S2土壤显著增加了9.2%和10.3%(P < 0.05)。S1、S2、S3盐度土壤C:P分别为12.02、11.46、9.93,彼此间差异不显著。S3土壤N:P均值为1.05,较S1和S2土壤显著下降(P < 0.05)。如图 1d、图 1e、图 1f,S3土壤的MBC:MBN平均值为54.21,显著高于S1和S2土壤,分别为两者的6.4倍和5.5倍(P < 0.05)。S3土壤的MBC:MBP显著高于S1土壤(P < 0.05),但S2土壤与其余两种盐渍化程度土壤无显著性差异(P > 0.05)。S3土壤MBN:MBP平均值为1.99,显著低于S1土壤(2.72)和S2土壤(4.30)(P < 0.05)。如图 1g、图 1h、图 1i,三种盐渍化程度土壤的Enzyme C/N均小于1。其中,S3土壤Enzyme C/N显著低于S1和S2土壤。S3土壤的Enzyme C/P(1.09)显著高于S2土壤(0.59)和S1土壤(0.56)(P < 0.05)。S1、S2、S3盐度土壤Enzyme N/P比值均大于1,且随盐渍化程度增加其数值显著增加(P < 0.05)。
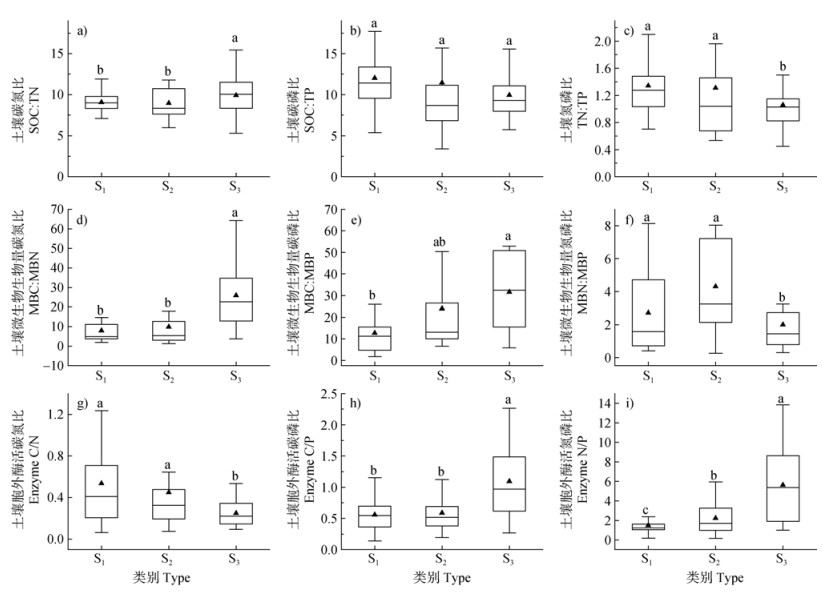
|
注:不同小写字母表示不同盐渍化程度土壤间差异显著(P < 0.05);中间实线代表中位数,实心三角形“▲”为平均值;上下两条线分别代表75%和25%的置信区间;上下两个短线分别代表95%和5%的置信区间。下同。 Note: The different lowercase letters indicate significant differences between soils with different levels of salinity(P < 0.05). The solid line in the box represents the median value, and the solid triangle "▲" represents the average value. The upper and lower line represent 75% and 25% confidence intervals, respectively. The upper and lower dots represent 95% and 5% confidence intervals, respectively. The same as below. 图 1 不同盐渍化程度土壤的碳、氮、磷养分元素-微生物生物量-胞外酶活性的化学计量比特征 Fig. 1 Characterization of carbon, nitrogen, and phosphorus nutrient element-microbial biomass-extracellular enzyme activity stoichiometric ratios in soils with different salinity levels |
图 2a反映了土壤盐分对土壤微生物养分获取与限制特征的影响。大部分数据点均分布在1:1对角线附近及右下方,且随着盐渍化程度增加,数据点表征的向量夹角明显减小。如图 2b和图 2c,结果表明,S3土壤向量长度(0.52)显著大于S1土壤(0.47)和S2土壤(0.46)的向量长度(P < 0.05);同时S3土壤的向量角度(23.37°)显著低于S1土壤(39.91°)和S2土壤(35.16°)的向量角度(P < 0.05)。
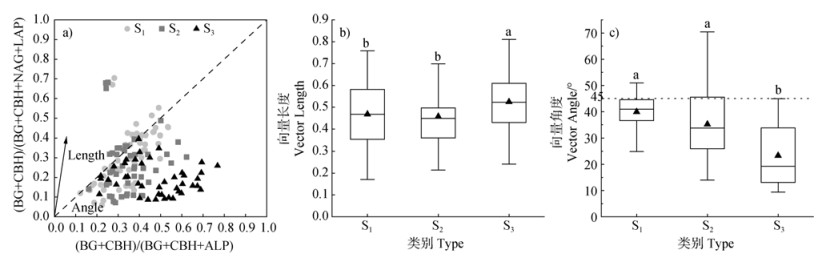
|
注:BG,β-1,4-葡萄糖苷酶;CBH,β-D-纤维二糖水解酶;NAG,β-1,4-N-乙酰氨基葡萄糖苷酶;LAP,L-亮氨酸氨肽酶;ALP,碱性磷酸酶。 Note: BG, β-1, 4-glucosidase; CBH, β-D-cellobiosidase; NAG, β-1, 4-N-acetylglucosaminidase; LAP, L-leucine aminopeptidase; ALP, alkaline phosphatase. 图 2 不同盐渍化程度土壤的C、N、P胞外酶活性的相对计量关系(a),矢量长度(b),矢量角度(c) Fig. 2 Relative stoichiometric relationships of C, N, and P extracellular enzyme activity(a), vector length(b), and vector angle(c)in soils with different salinity levels |
冗余分析结果表明(图 3a),土壤养分-微生物生物量-胞外酶活性化学计量特征存在57.42%的变异(P < 0.01)。土壤Na+、K+、Cl–、Ca2+、ESP、TS、MAV/MAP是解释度相对较高的环境因子(P < 0.05)。进一步使用皮尔逊相关性分析(图 3c),土壤SOC:TN与ESP、pH、SAR、Sand、Ca2+、MAV/MAP呈显著正相关;土壤SOC:TP和TN:TP均与ESP、pH、SAR、K+、Na+、Cl–呈显著负相关关系。土壤MBC:MBN与TS、ESP、SAR、K+、Ca2+、Na+、Cl–、SO42–呈极显著正相关;MBC:MBP与ESP呈显著正相关;MBN:MBP与TS、ESP、SAR、Na+、SO42–呈显著负相关。土壤酶活计量比均与TS呈极显著相关性,其中土壤Enzyme C/N与TS、ESP、SAR、Sand、K+、Mg2+、Cl–呈显著负相关,与CEC、HCO3–+CO32–呈显著正相关关系;而Enzyme C/P、Enzyme N/P与Enzyme C/N截然相反,与TS、ESP、SAR、Sand、K+、Ca2+、Na+、Mg2+、Cl–、SO42–、MAV/MAP均呈显著正相关,与WC、CEC、HCO3–+CO32–呈显著负相关。
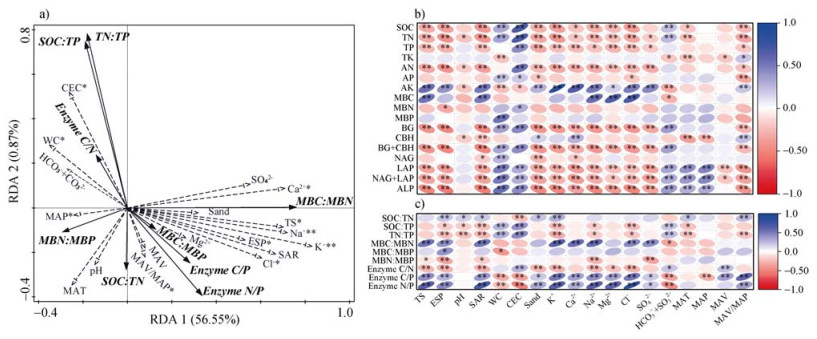
|
注:冗余分析中虚线为解释变量,实线为响应变量;*和**分别表示5%和1%显著水平,下同。 Note: The dashed line in the redundancy analysis represents the explanatory variables and the solid line represents the response variables. * and ** represents a significance at 5% and 1% level, respectively. The same as below. 图 3 环境因子与土壤碳氮磷养分-微生物生物量-胞外酶活性化学计量比特征的冗余分析(a);环境因子与养分含量、微生物生物量、胞外酶活性的皮尔逊相关性(b);环境因子与养分含量、微生物生物量、胞外酶活性化学计量比的皮尔逊相关性(c) Fig. 3 Redundancy analysis of environmental factors and characterization of soil carbon, nitrogen and phosphorus nutrient-microbial biomass-extracellular enzyme activity stoichiometric ratios (a); Pearson's correlation between environmental factors and nutrient content, microbial biomass, and extracellular enzyme activity (b); Pearson's correlation between environmental factors and stoichiometric ratios of nutrient content, microbial biomass, and extracellular enzyme activity (c) |
由图 3b可知,土壤SOC、TN、TP、AN与TS、ESP、SAR呈极显著负相关性(P < 0.01),但AP与其无显著相关性。八大离子中K+、Na+、Mg2+、Cl–与SOC、TN、TP、AN呈极显著负相关(P < 0.01)。此外,土壤TK受离子影响不显著,但AK与土壤六大离子(除HCO3–+CO32–)呈显著正相关(P < 0.05)。MBC与TS、SAR、Na+、Mg2+、Cl–呈极显著正相关(P < 0.01),与HCO3–+CO32–呈显著负相关;但MBN、MBP与TS间无显著相关性。BG+CBH、NAG+LAP、ALP与TS、ESP、SAR、K+、Ca2+、Na+、Mg2+、Cl–、SO42–、MAV/MAP呈极显著负相关,与WC、CEC、HCO3–+CO32–呈极显著正相关(P < 0.01)。
土壤微生物养分限制相对碳限制(向量长度)、相对氮限制(向量角度)和盐渍环境因子的皮尔逊相关关系如图 4a所示,微生物相对碳限制(Relative C limitation)与TS、Cl–、K+、Ca2+、MAV、MAV/MAP呈显著正相关,与WC、MAP呈显著负相关;微生物氮限制(Relative N limitation)与TS、ESP、SAR、Sand、K+、Na+、Mg2+、Cl–、MAV/MAP呈极显著正相关,与CEC、HCO3–+CO32–呈极显著负相关。进一步采用随机森林分析判别盐渍环境因子对微生物C、N限制的贡献程度(图 4b、图 4c),发现微生物相对碳限制的环境因子重要性排序为MAV > Ca2+ > MAP > HCO3–+CO32– > Mg2+ > Cl– > MAV/MAP;微生物相对氮限制的环境因子重要性排序为CEC > ESP > SAR > Cl– > Na+ > MAV/MAP > TS。
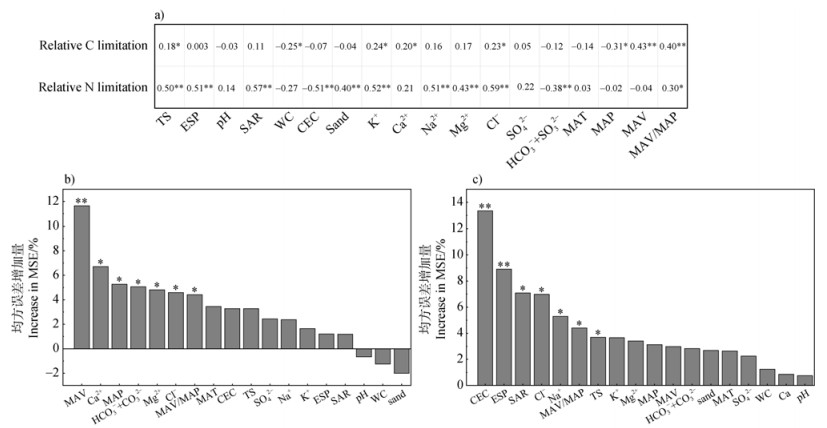
|
图 4 盐渍环境因子与土壤微生物相对碳限制、氮限制的皮尔逊相关性(a);随机森林分析盐渍环境因子对向量长度的相对贡献(b);随机森林分析盐渍环境因子对向量角度的相对贡献(c) Fig. 4 Pearson's correlation between environmental factors and relative carbon and nitrogen limitation of soil microorganisms (a); the relative contribution of environmental factors to the length of the vector (b); the relative contribution of environmental factors to the angle of the vector (c) |
对比第二次全国土壤普查耕层有机质平均含量(19.8 g·kg–1)发现[22],盐渍化显著降低了土壤有机质含量,且含盐量 > 10 g·kg–1的土壤有机质平均含量已低至9.84 g·kg–1,已低至全国第二次土壤普查养分分级标准中的五级缺乏等级(表 2)。土壤总盐分含量(TS)与有机碳含量呈显著负相关性(图 3b)。这一现象主要归因于盐渍化导致土壤有机质合成受阻和有机质加速分解。在土壤有机质合成受阻方面,首先,土壤盐渍化可以通过高盐渗透胁迫和Na+、Mg2+、Cl–等过量离子毒害抑制作物生长,导致土壤中来自作物的有机物质输入量减少[23-24];其次,高盐土壤中盐基离子产生的渗透压也会抑制土壤微生物活性,且过量Na+、Cl–等盐基离子还会破坏土壤微生物细胞膜和菌体内的酶活性,进而阻碍微生物合成腐殖物质[25],本研究中微生物分泌的碳获取酶活(BG+CBH)受到盐分的明显抑制进一步证明了这一观点(表 3)。在有机质加速分解方面,盐渍化土壤矿化增强和流失增加,土壤胶体颗粒带负电荷,单价阳离子尤其是Na+浓度升高伴随着ESP和SAR的增加引起的土壤颗粒的崩解、膨胀和分散作用导致土壤团聚结构被破坏[26],既增加了团聚体内受保护的有机碳被矿化的风险,也增加了有机碳通过风蚀和水蚀损失的风险[11]。这也可以从Na+、ESP、SAR与土壤有机碳含量呈极显著负相关结果中得到佐证(图 3b)。
在盐渍化条件下,盐分成为影响土壤各氮库容量变化和氮素迁移转化的重要因素[8]。本研究中土壤全氮和碱解氮含量均随盐渍化程度增加而显著降低,均低于第二次全国土壤普查耕层全氮平均含量(1.05 g·kg–1)和碱解氮平均含量(114 mg·kg–1)[22],且含盐量 > 10 g·kg–1的土壤全氮和碱解氮养分均已降到了缺乏水平(表 2)。这与盐渍化土壤有机氮难累积、氮矿化受抑制、有效氮损失风险高等有关。盐渍化可以通过抑制微生物活性改变有机氮合成过程,进而降低土壤总氮库容量[27]。此外,盐渍化还会抑制微生物驱动的氮矿化过程,减少土壤有效氮数量[8,28];本研究结果也表明,土壤氮获取酶活随盐渍化程度增加而显著降低(表 3、图 3b)。此外,盐渍化还会增加土壤氨挥发等气态氮损失和硝态氮径流、淋溶等溶质运移损失风险。本研究中盐渍土pH处于弱碱性(表 1);且盐分阳离子Na+、K+、Ca2+、Mg2+与NH4+竞争吸附位点降低土壤对铵态氮的吸附以及在高盐土壤中硝化作用受到的抑制[29],使得铵态氮累积从而增加了氨挥发。此外,盐度(以Na+、Cl–为主导的高盐分组成)也可能抑制反硝化作用增加硝态氮累积和流失风险,提高了溶质运移损失风险[30-31]。
土壤全磷和有效磷含量虽然也随盐渍化程度增加而下降,但即使在含盐量 > 10 g·kg–1的土壤中两者的丰缺程度也均在较适宜及以上等级(表 2),说明盐渍化土壤中磷库容虽然减小但尚未降到农田生产力明显受限的状态。这可能是因为盐渍化耕地磷肥利用率低导致磷肥投入过量且土壤在碱性条件下磷素易与Ca2+、Mg2+结合从而被固定,不易淋失,使得土壤中全磷较丰富[32]。含盐量 > 10 g·kg–1的土壤有效磷含量较含盐量 < 3 g·kg–1、3 g·kg–1~10 g·kg–1的土壤降低了约25%~36%(表 2),主要是由于Ca-P、Mg-P等难溶态磷增加,以及土壤碱性磷酸酶活减弱制约了有机磷矿化分解(表 3、图 3b)。然而,即使在含盐量 > 10 g·kg–1的土壤中有效磷也并未降低到缺乏状态。其原因可能在于:(1)盐渍土壤中的土著解磷菌具有良好的盐碱耐受性,通过分泌有机酸溶解难溶性磷源,增加了土壤有效磷数量[33];(2)盐度可能对磷有效性的影响有限。综上,盐渍土需注重有机磷库、无机无效态磷库的活化与有效化。
本研究发现盐渍土钾素含量丰富,三种盐渍化程度土壤的全钾和速效钾均处于最适宜及以上等级。其原因可能是土壤盐渍化区域通常处于较干旱地带,风力、水力侵蚀较弱导致矿物钾难于释放且K+易被矿物晶格吸附、固定不利于流失;盐渍土壤钾充足与生物学过程密切相关。Ashfaq等[34]从盐渍条件下生长的水稻根际土壤中分离出的溶钾细菌菌株在7% NaCl胁迫下仍能够溶解钾。此外,除了生物过程,Gul等[35]还发现NaCl浓度的增加改变了土壤钾动力学过程,使土壤矿物质中释放出不可交换的钾,增加了土壤溶液中的有效钾浓度。综上可知,除钾元素外,土壤碳氮磷养分库受盐渍胁迫后均有明显的退化趋势。
3.2 盐渍化对土壤碳氮磷-微生物生物量-胞外酶活化学计量特征的影响盐渍化虽然降低了土壤碳、氮、磷库容量,但是否会导致这三种关键元素之间出现失衡的情况尚待确认。并且如发生失衡状况,土壤、微生物是否会出现一致的养分限制性特征?本研究从土壤养分、微生物生物量、胞外酶活碳氮磷元素的化学计量比角度联结土壤养分与微生物代谢活动,有利于系统探索盐渍障碍土壤关键元素限制性变化。研究发现,S1、S2、S3盐度土壤的养分C:N:P比值分别为11.5︰1.289︰1,10.493︰1.197︰1,9.678︰1.034︰1,明显差别于我国土壤C:N:P平均比值(51.87︰4.06︰1);S1、S2、S3盐度土壤的微生物生物量碳氮磷化学计量比分别为10.42︰1.81︰1、15.18︰3.33︰1、40.90︰1.54︰1,显著差别于全球土壤微生物生物量碳氮磷计量比均值(16.26︰2.71︰1);S1、S2、S3盐度土壤的酶活生态化学计量比分别为1︰2.21︰1.85、1︰2.73︰2.01、1︰4.23︰1.35,区别于全球土壤酶活生态化学计量比(1︰1︰1)。可以看出,盐渍化土壤养分-微生物生物量-胞外酶活计量比均处于不同程度的失衡状态,并且初步反映出土壤碳氮磷养分资源-微生物代谢均处于氮限制状态的共同特点,同时土壤养分、微生物生物量还表现出了碳限制状态。
土壤C:N是衡量碳氮养分平衡的重要指标,与有机质的分解速率成反比[36];土壤C︰P被认为是表征土壤微生物矿化或释放环境中有机磷或固定态磷潜力的重要指标[37];土壤N:P是判断氮磷养分相对限制的有效指标[13]。进一步观察生态化学计量比在不同盐渍化程度土壤的变化规律发现(图 1),土壤C︰N(9.05、8.96、9.88)、C:P(12.02、11.46、9.93)、N︰P(1.34、1.31、1.05)均分别低于中国农田表层土壤均值12.34、52.64、4.2[15],且随着盐渍化程度的增加,土壤C︰N增加,C︰P、N︰P逐渐降低。说明盐渍化土壤有机碳矿化速率较高,碳损失,但在高盐分环境下,有机碳矿化速率有所减缓,此时有机碳数量的缺乏可能是微生物活性受限致有机质合成受阻和有机质分解快速的双重作用导致的;低C︰P有利于促进土壤有效磷的增加,这可能是盐渍土壤磷库较充足的重要原因;盐渍土壤养分氮限制大于磷限制,并且高SAR、ESP、pH以及高浓度的可溶性Na+、Cl–、K+更可能加重土壤氮限制(图 3c)。
土壤MBC︰MBN、MBC︰MBP、MBN︰MBP可以判断微生物代谢活动的方向和生物体内元素内稳性特征[38]。本研究中S1、S2、S3盐度土壤MBC:MBN(7.94、9.90、25.86),明显高于我国农田土壤均值(6.51)[16];S3土壤MBN︰MBP(1.99)明显低于我国农田土壤均值(2.53)[16]。可见,盐渍化会导致微生物体内氮素严重缺乏,TS、ESP、SAR、可溶性Na+主要影响控制微生物生物量氮限制(图 3c),其中Na+是关键制约因子。Amini等[39]研究也发现,土壤Na+毒性会显著影响微生物细胞的渗透胁迫和脱水胁迫导致细胞膜有效性氮的转运效率从而抑制微生物对氮素的吸收。
土壤酶活比值可以衡量微生物在碳氮磷三元素之间的权衡与相对限制,反映了微生物生长代谢过程中能量与养分需求情况,从而促使微生物提高分泌具有限制性养分酶的能力,以满足其在环境中获取限制性养分的需求[40]。本文不同盐渍化程度土壤Enzyme C/N(0.53、0.45、0.25),Enzyme C/P(0.56、0.59、1.09),Enzyme N/P(1.48、2.23、5.61)均不同程度地偏离1︰1。其中Enzyme C/N和Enzyme N/P值随盐渍化程度的增加分别降低和提高,且逐渐远离1︰1平衡点,证明了盐渍障碍加重了微生物养分资源氮限制。进一步使用酶化学计量矢量模型,以向量长度、向量角度表征的微生物能量与养分资源限制情况也体现出了高盐土壤微生物资源趋于相对碳限制和相对氮限制(图 2)。综上所述,盐渍化土壤养分、微生物生物量、胞外酶活计量比的失衡情况基本一致,即土壤养分与微生物资源代谢活动在盐渍障碍逐渐加重的情况下均有显著的碳、氮限制的变化趋势。
值得关注的是,气候因素是盐渍化发生与形成的关键因素,决定了土壤水盐平衡状态,而土壤盐渍化导致的土壤溶液渗透势的改变又会明显影响微生物对土壤水分的利用效率,从而加剧土壤养分与微生物资源代谢的相对限制程度,因此土壤水热状况是控制盐渍土养分状况的重要因素[7]。本研究发现随着土壤盐度的增加,土壤质量含水量确有明显的下降趋势(表 1)。相较于MAT、MAP、MAV,WC、MAV/MAP更容易影响土壤养分库容与养分-微生物生物量-酶活化学计量比特征,其中,土壤SOC、TN、TP、AN、AP与MAV/MAP呈显著负相关,与WC呈显著正相关(图 3b)。可见,年均蒸降比的增加加剧了土壤盐渍化程度,并降低了土壤中的碳、氮、磷的库容量,而提高土壤含水量可以缓解这一现象[41]。此外,高蒸降比还进一步加剧了土壤氮限制与微生物相对碳、氮共同限制,而增加土壤含水量则产生恰恰相反的效果(图 3c、图 4a)。本研究的采样点涉及到多个盐碱区域,其中东部滨海区域水资源丰富、年均蒸降比较低、土壤水分含量较高,而中西部区域年降水量低、年均蒸降比高、土壤含水量低。因此在盐渍土养分改良过程中,中西部盐碱区可注重通过秸秆/地膜覆盖、滴灌等人为管理措施降低土壤水分蒸散发量并且加强耕层水分的利用效率,而滨海盐碱区更应关注养分通过径流、淋溶、挥发的损失途径的阻控。
应当指出,本文仅着重于探究不同盐渍障碍程度下土壤碳氮磷养分及微生物资源限制特征,明确了受盐分影响土壤的碳、氮限制特征以及这种限制特征与盐渍环境因子的密切联系。然而,我国盐渍土壤类型多样且盐渍区域气候差别较大,盐基离子组成结构、离子耦合互作关系模糊不清,尤其是盐、碱障碍之间的单作、耦合互作关系错综复杂,难以拎清关键致障因素;其次本文并未深入挖掘土壤养分与微生物代谢活动之间的互作机制。因此今后应注重于:(1)分类分级研究盐分、碱及两者交互障碍对土壤养分库容的影响与机制;(2)注重盐渍土壤生物信息分析,挖掘盐渍土壤的微生物群落组成与结构、碳氮磷循环功能性基因等方面的变化规律,紧密联系土壤养分-微生物-作物整个农田生产系统。以期为盐渍耕地土壤养分扩容调蓄、提升盐渍化农田生产力提供更牢固的理论基础和技术支撑。
4 结论盐渍化障碍显著影响了土壤养分状况、微生物生物量、胞外酶活及各自化学计量学特征。盐渍化土壤碳、氮、磷养分库容均有所下降,其中土壤有机质、全氮、碱解氮在高盐渍障碍下已经降到缺乏等级,严重威胁了土地生产能力,而磷、钾养分库容仍相对充足。生态化学计量学特征显示,土壤养分-微生物生物量-胞外酶活碳氮磷计量比在盐渍条件下逐渐失衡,整体稳定性主要受到Na+、K+、Cl–、TS、ESP、MAV/MAP等的影响。相较于磷元素,盐渍土壤养分与微生物代谢更易受到碳、氮限制。且随着盐渍障碍增加,土壤碳氮限制程度更加明显。因此,未来盐渍化耕地地力与产能提升研究应更聚焦土壤有机调控和氮素科学管理。
致谢 感谢中国科学院新疆生态与地理研究所赵振勇老师,中国科学院东北地理与农业生态研究所杨帆老师和张铁毅同学,中国科学院遗传与发育生物学研究所孙宏勇老师和郭凯老师,中国农业科学院农业资源与农业区划研究所李玉义老师、张怀志老师和温延臣老师,中国科学院南京土壤研究所张新老师,内蒙古五原县农牧业技术推广中心土肥站温晓亮老师,宁夏农垦集团张敏老师,甘肃省农业科学院郭全恩老师,黑龙江省农业科学院任翠梅老师等对土样采集工作给予的帮助。
| [1] |
Hassani A, Azapagic A, Shokri N. Predicting long-term dynamics of soil salinity and sodicity on a global scale[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(52): 33017-33027.
(  0) 0) |
| [2] |
Yang J S. Development and prospect of the research on salt-affected soils in China (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(5): 837-845. [杨劲松. 中国盐渍土研究的发展历程与展望[J]. 土壤学报, 2008, 45(5): 837-845.]
(  0) 0) |
| [3] |
Zhang H. Effects of deep straw return on growth and yield of maize in saline-alkali land[D]. Hohhot: Inner Mongolia Agricultural University, 2023.[张皓. 深翻秸秆还田对盐碱地玉米生长发育及产量的影响[D]. 呼和浩特: 内蒙古农业大学, 2023.]
(  0) 0) |
| [4] |
Zhang F S, Wang J Q, Zhang W F, et al. Nutrient use efficiencies of major cereal crops in China and measures for improvement (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(5): 915-924. [张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915-924.]
(  0) 0) |
| [5] |
Gao S. Study on soil phosphorus availability and its synergistic regulation in coastal saline farmland in northern Jiangsu Province[D]. Beijing: University of Chinese Academy of Sciences, 2019.[高珊. 苏北滨海盐渍农田土壤磷素有效性及其增效调控研究[D]. 北京: 中国科学院大学, 2019.]
(  0) 0) |
| [6] |
van der Ploeg R R, Böhm W, Kirkham M B. On the origin of the theory of mineral nutrition of plants and the law of the minimum[J]. Soil Science Society of America Journal, 1999, 63(5): 1055-1062. DOI:10.2136/sssaj1999.6351055x
(  0) 0) |
| [7] |
Yang J S, Yao R J, Wang X P, et al. Research on salt-affected soils in China: History, status quo and prospect (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(1): 10-27. DOI:10.11766/trxb202110270578 [杨劲松, 姚荣江, 王相平, 等. 中国盐渍土研究: 历程、现状与展望[J]. 土壤学报, 2022, 59(1): 10-27.]
(  0) 0) |
| [8] |
Li H Q, Yao R J, Yang J S, et al. Influencing mechanism of soil salinization on nitrogen transformation processes and efficiency improving methods for high efficient utilization of nitrogen in salinized farmland (In Chinese)[J]. Chinese Journal of Applied Ecology, 2020, 31(11): 3915-3924. [李红强, 姚荣江, 杨劲松, 等. 盐渍化对农田氮素转化过程的影响机制和增效调控途径[J]. 应用生态学报, 2020, 31(11): 3915-3924.]
(  0) 0) |
| [9] |
Xie W P, Yang J S, Gao S, et al. The effect and influence mechanism of soil salinity on phosphorus availability in coastal salt-affected soils[J]. Water, 2022, 14(18): 2804. DOI:10.3390/w14182804
(  0) 0) |
| [10] |
Sun B, Zhu A N, Yao R J, et al. Research progress on barrier remediation technology and productivity enhancement model for fluvo-aquic soil, red soil, and saline-alkali soil (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(5): 1231-1247. DOI:10.11766/trxb202307210286 [孙波, 朱安宁, 姚荣江, 等. 潮土、红壤和盐碱地障碍消减技术与产能提升模式研究进展[J]. 土壤学报, 2023, 60(5): 1231-1247.]
(  0) 0) |
| [11] |
Dong X L, Wang J T, Tian L, et al. Review of relationships between soil aggregates, microorganisms and soil organic matter in salt-affected soil (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2023, 31(3): 364-372. [董心亮, 王金涛, 田柳, 等. 盐渍化土壤团聚体和微生物与有机质关系研究进展[J]. 中国生态农业学报, 2023, 31(3): 364-372.]
(  0) 0) |
| [12] |
de Souza Oliveira Filho J, Vieira J N, Ribeiro da Silva E M, et al. Assessing the effects of 17 years of grazing exclusion in degraded semi-arid soils: Evaluation of soil fertility, nutrients pools and stoichiometry[J]. Journal of Arid Environments, 2019, 166: 1-10. DOI:10.1016/j.jaridenv.2019.03.006
(  0) 0) |
| [13] |
Elser J J, Sterner R W, Gorokhova E, et al. Biological stoichiometry from genes to ecosystems[J]. Ecology Letters, 2000, 3(6): 540-550. DOI:10.1111/j.1461-0248.2000.00185.x
(  0) 0) |
| [14] |
Ning Y F, Wei L, Wei X M, et al. Response of extracellular enzyme activities to substrate availability in paddy soil with long-term fertilizer management (In Chinese)[J]. Environmental Science, 2020, 41(6): 2852-2860. [宁玉菲, 魏亮, 魏晓梦, 等. 长期施肥稻田土壤胞外酶活性对底物可利用性的响应特征[J]. 环境科学, 2020, 41(6): 2852-2860.]
(  0) 0) |
| [15] |
Tian H Q, Chen G S, Zhang C, et al. Pattern and variation of C: N: P ratios in China's soils: A synthesis of observational data[J]. Biogeochemistry, 2010, 98(1): 139-151.
(  0) 0) |
| [16] |
Xu X F, Thornton P E, Post W M. A global analysis of soil microbial biomass carbon, nitrogen and phosphorus in terrestrial ecosystems[J]. Global Ecology and Biogeography, 2013, 22(6): 737-749. DOI:10.1111/geb.12029
(  0) 0) |
| [17] |
Sinsabaugh R L, Hill B H, Follstad Shah J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment[J]. Nature, 2009, 462(7274): 795-798. DOI:10.1038/nature08632
(  0) 0) |
| [18] |
Qin J F, Zhang J P, Sang L, et al. Effects of water-salt environment on freshwater wetland soil C, N, and P ecological stoichiometric characteristics in the Yellow River Estuary wetland (In Chinese)[J]. Environmental Science, 2023, 44(8): 4698-4705. [秦纪法, 张佳彭, 桑娈, 等. 水盐环境对黄河口淡水湿地土壤碳、氮、磷生态化学计量特征的影响[J]. 环境科学, 2023, 44(8): 4698-4705.]
(  0) 0) |
| [19] |
Bao S D. Soil agrochemical analysis (In Chinese). 3rd ed[M]. Beijing: China Agriculture Press, 2000. [鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [20] |
Moorhead D L, Sinsabaugh R L, Hill B H, et al. Vector analysis of ecoenzyme activities reveal constraints on coupled C, N and P dynamics[J]. Soil Biology and Biochemistry, 2016, 93: 1-7. DOI:10.1016/j.soilbio.2015.10.019
(  0) 0) |
| [21] |
National Soil Survey Office. Provisional technical regulations for the second national soil survey (In Chinese). Beijing: China Agriculture Press, 1979. [全国土壤普查办公室. 全国第二次土壤普查暂行技术规程[M]. 北京: 农业出版社, 1979.]
(  0) 0) |
| [22] |
National Soil Survey Office. China soil survey data (In Chinese). Beijing: Beijing: China Agriculture Press, 1997. [全国土壤普查办公室. 中国土壤普查数据[M]. 北京: 中国农业出版社, 1997.]
(  0) 0) |
| [23] |
Daliakopoulos I N, Tsanis I K, Koutroulis A, et al. The threat of soil salinity: A European scale review[J]. Science of the Total Environment, 2016, 573: 727-739. DOI:10.1016/j.scitotenv.2016.08.177
(  0) 0) |
| [24] |
Nelson P N, Ladd J N, Oades J M. Decomposition of 14C-labelled plant material in a salt-affected soil[J]. Soil Biology and Biochemistry, 1996, 28(4/5): 433-441.
(  0) 0) |
| [25] |
Yang L S, Zhang Y T, Huang X C, et al. Effects of long-term application of chloride containing fertilizers on the biological fertility of purple soil under a rice-wheat rotation system (In Chinese)[J]. Scientia Agricultura Sinica, 2016, 49(4): 686-694. [杨林生, 张宇亭, 黄兴成, 等. 长期施用含氯化肥对稻-麦轮作体系土壤生物肥力的影响[J]. 中国农业科学, 2016, 49(4): 686-694.]
(  0) 0) |
| [26] |
de la Paix M J, Lanhai L, Xi C, et al. Physicochemical properties of saline soils and aeolian dust[J]. Land Degradation & Development, 2013, 24(6): 539-547.
(  0) 0) |
| [27] |
Sun H, Qu J, Wang X W, et al. The response of soil organic nitrogen fractions and nitrogen availability to salinity in saline soils of the Yellow River Delta (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2021, 29(8): 1397-1404. [孙瀚, 屈杰, 王晓雯, 等. 黄河三角洲盐渍土有机氮组成及氮有效性对土壤含盐量的响应[J]. 中国生态农业学报, 2021, 29(8): 1397-1404.]
(  0) 0) |
| [28] |
Min W, Hou Z A, Liang Y C, et al. Effects of soil salinity level and nitrogen rate on urea-N transformation in grey desert soil (In Chinese)[J]. Chinese Journal of Soil Science, 2012, 43(6): 1372-1379. [闵伟, 侯振安, 梁永超, 等. 土壤盐度和施氮量对灰漠土尿素N转化的影响[J]. 土壤通报, 2012, 43(6): 1372-1379.]
(  0) 0) |
| [29] |
Dendooven L, Alcántara-Hernández R J, Valenzuela-Encinas C, et al. Dynamics of carbon and nitrogen in an extreme alkaline saline soil: A review[J]. Soil Biology and Biochemistry, 2010, 42(6): 865-877. DOI:10.1016/j.soilbio.2010.02.014
(  0) 0) |
| [30] |
Pan Y C, She D L, Shi Z Q, et al. Salinity and high pH reduce denitrification rates by inhibiting denitrifying gene abundance in a saline-alkali soil[J]. Scientific Reports, 2023, 13(1): 2155. DOI:10.1038/s41598-023-29311-7
(  0) 0) |
| [31] |
Sun Y P, Zhang X, Xian J T, et al. Saline–alkaline characteristics during desalination process and nitrogen input regulation in reclaimed tidal flat soils[J]. Sustainability, 2023, 15(5): 4378. DOI:10.3390/su15054378
(  0) 0) |
| [32] |
Xian J T, Chen X B, Wang S, et al. Phosphorus availability in saline soil: A review (In Chinese)[J]. Soils, 2023, 55(3): 474-486. [咸敬甜, 陈小兵, 王上, 等. 盐渍土磷有效性研究进展与展望[J]. 土壤, 2023, 55(3): 474-486.]
(  0) 0) |
| [33] |
Jiang H H. Effect and mechanism of improving saline-alkali soil by combining salt-tolerant phosphate-solubilizing bacteria with phosphogypsum[D]. Harbin: Harbin Institute of Technology, 2019.[姜焕焕. 耐盐碱解磷菌与磷石膏联用改良盐碱土的效果与机制[D]. 哈尔滨: 哈尔滨工业大学, 2019.]
(  0) 0) |
| [34] |
Ashfaq M, Hassan H M, Ghazali A H A, et al. Halotolerant potassium solubilizing plant growth promoting rhizobacteria may improve potassium availability under saline conditions[J]. Environmental Monitoring and Assessment, 2020, 192(11): 697. DOI:10.1007/s10661-020-08655-x
(  0) 0) |
| [35] |
Gul M, Wakeel A, Saqib M, et al. Effect of NaCl-induced saline sodicity on the interpretation of soil potassium dynamics[J]. Archives of Agronomy and Soil Science, 2016, 62(4): 523-532. DOI:10.1080/03650340.2015.1065972
(  0) 0) |
| [36] |
Baddeley J A, Edwards A C, Watson C A. Changes in soil C and N stocks and C: N stoichiometry 21years after land use change on an arable mineral topsoil[J]. Geoderma, 2017, 303: 19-26. DOI:10.1016/j.geoderma.2017.05.002
(  0) 0) |
| [37] |
DeForest J L, Moorhead D L. Effects of elevated pH and phosphorus fertilizer on soil C, N and P enzyme stoichiometry in an acidic mixed mesophytic deciduous forest[J]. Soil Biology and Biochemistry, 2020, 150: 107996. DOI:10.1016/j.soilbio.2020.107996
(  0) 0) |
| [38] |
Heuck C, Weig A, Spohn M. Soil microbial biomass C: N: P stoichiometry and microbial use of organic phosphorus[J]. Soil Biology and Biochemistry, 2015, 85: 119-129. DOI:10.1016/j.soilbio.2015.02.029
(  0) 0) |
| [39] |
Amini S, Ghadiri H, Chen C R, et al. Salt-affected soils, reclamation, carbon dynamics, and biochar: A review[J]. Journal of Soils and Sediments, 2016, 16(3): 939-953. DOI:10.1007/s11368-015-1293-1
(  0) 0) |
| [40] |
Burns R G, DeForest J L, Marxsen J, et al. Soil enzymes in a changing environment: Current knowledge and future directions[J]. Soil Biology and Biochemistry, 2013, 58: 216-234. DOI:10.1016/j.soilbio.2012.11.009
(  0) 0) |
| [41] |
Guo J, Wang W, Ye H, et al. Analysis on spatial and temporal dynamic variations and their impact factors of salinization land in Hetao Plain (In Chinese)[J]. South-to-North Water Transfers and Water Science & Technology, 2014, 12(3): 59-64. [郭娇, 王伟, 叶浩, 等. 河套平原盐渍化土地时空动态变化及影响因子[J]. 南水北调与水利科技, 2014, 12(3): 59-64.]
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


