2. 中国科学院大学, 北京 100049;
3. 华中农业大学农业微生物资源发掘与利用全国重点实验室/资源与环境学院, 武汉 430070;
4. 中国环境科学研究院, 环境标准与风险评价国家重点实验室, 北京 100012
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. National Key Laboratory of Agricultural Microbiology/College of Resource and Environment, Huazhong Agricultural University, Wuhan 430070, China;
4. State Key Laboratory of Environmental Standards and Risk Evaluation, China Academy of Environmental Sciences, Beijing 100012, China
全球气候变暖是当代面临的最严峻的环境问题之一,土壤作为陆地生态系统最大的碳库,其微小的碳收支变化就会对全球气候变化造成显著影响[1]。在全球变化背景下,阐明土壤有机碳(Soil organic carbon,SOC)的形成、转化以及稳定机制,对于优化和提升陆地碳循环预测模型的准确性和可靠性具有至关重要的意义。相较于传统的以植物输入为主导的腐殖质理论,近十年的相关研究对SOC转化与稳定机制提出了新的视角,即SOC的转化与稳定很大程度上受到微生物和矿物的调控[2]。微生物通过利用植物来源的小分子化合物合成自身生物量,并通过其生命周期(生长、繁殖和死亡)将这些物质转化为更复杂的微生物残体碳[3],从而显著促进了SOC的积累。基于此,Liang等[2]提出了聚焦土壤微生物同化代谢过程的土壤微生物碳泵(Microbial carbon pump,MCP)概念框架。与此同时,矿物质在土壤环境中具有较强的反应活性,通过物理化学反应与包括微生物残体碳在内的SOC相结合,形成稳定的矿物-有机复合体[4-5]。这类复合体可以保护SOC免受微生物的快速分解,减缓SOC的周转速率,进而提高其在土壤中的稳定性[6-8]。因此,基于最新的矿物固碳理论,探究SOC的稳定机制,是深入认识土壤碳汇功能以及应对未来气候变化的关键,也为实现我国“双碳”目标提供重要科学依据。
1 土壤矿物碳泵(Mineral carbon pump,MnCP)概念 1.1 土壤矿物碳泵(MnCP)概念的提出Xiao等[9]研究人员在2023年提出了土壤矿物碳泵(mineral carbon pump,MnCP)概念框架,旨在探究土壤矿物如何通过非生物过程稳定SOC,并解释了土壤矿物如何在固存与积累碳过程中增强SOC的稳定性(图 1),为深入理解SOC的转化与稳定机制提供了新的视角。MnCP是指土壤矿物通过吸附、封闭、聚集、催化聚合和氧化还原等非生物反应,稳定并积累SOC,防止其被微生物降解,从而增强SOC在土壤中持久性的过程(图 2)。矿物通过将SOC吸附至其表面,降低了土壤溶液中可溶性SOC的浓度,并进一步通过物理封闭和聚集作用限制水解酶对SOC的分解,形成有机无机复合体,这一过程促使土壤中的活性SOC转移至土壤稳定碳库。同时,黏土矿物和金属氧化物能够驱动SOC发生聚合反应[10-11],将易分解的小分子SOC聚合成复杂的难降解的大分子物质。在此过程中,土壤矿物与SOC结合时还可能伴随着氧化还原反应的发生,其中一部分SOC会被转变为CO2,另一部分SOC与矿物反应产生自由基。这些自由基能够促进SOC的聚合反应,从而提高其在土壤中的稳定性[12]。
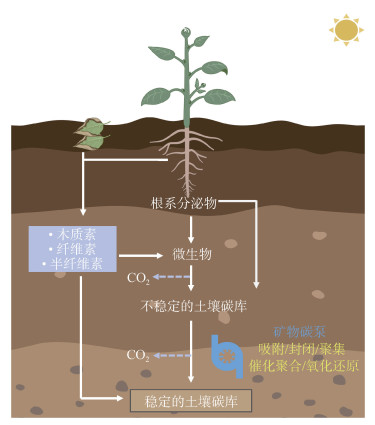
|
图 1 土壤矿物碳泵介导的陆地生态系统土壤碳循环示意图[9] Fig. 1 Schematic diagram of carbon cycling in terrestrial ecosystems mediated by soil mineral carbon pump[9] |
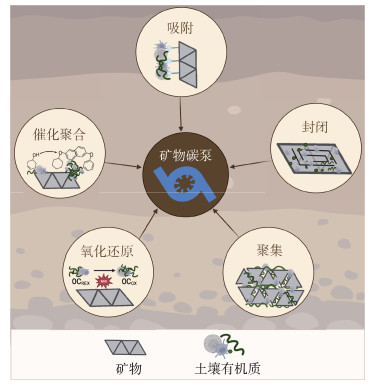
|
图 2 土壤矿物碳泵的固碳机制 Fig. 2 Carbon sequestration mechanism of soil mineral carbon pump |
随着工业化进程的加速和人类活动强度的不断增加,大气中的CO2浓度持续上升,加剧了全球气候变化问题。在这一背景下,土壤固碳作为一种自然机制,能够吸收并储存大量的碳,对于减缓气候变化具有至关重要的作用。事实上,高达20%的人类碳排放被土壤所吸收,凸显了土壤固碳在维持全球不同生态系统中碳循环的重要地位[13]。土壤有机质与矿物质的相互作用是土壤固碳的重要机制之一。最近的研究估算,如果将地球表面1%的岩石转化为镁铁质岩石,SOC储量可以翻倍,进而促使大气中CO2含量减少4倍[14]。
根据SOC的来源、功能和稳定性的差异,将SOC分为颗粒态有机碳(Particulate organic carbon,POC)和矿物结合态有机碳(Mineral-associated organic carbon,MAOC)已逐渐成为学术界共识[4,15]。POC是指存在于土壤中的较大有机质颗粒,主要由未完全分解的植物残体及其分解副产物组成,易于被微生物分解,其平均停留时间在小于十年至数十年之间,因而稳定性较低。MAOC主要来源于难分解的微生物残体组分,周转时间在数十年至数百年之间。在土壤MnCP的作用下,SOC与矿物之间存在强化学键合作用,并且受到土壤团聚体的物理保护,更有助于长期的土壤碳固持[16]。在全球尺度上,MAOC平均约占SOC总量的65%[17-19],以温带耕作土壤为例,高达50%~75%的SOC以黏粒大小的有机矿物复合体的形式存在[20]。同时,MAOC的平均周转时间通常超过100年[21],在细质地土壤中的周转时间甚至可以长达1 000年[22]。Wattel-Koekkoek等[23]利用14C技术研究发现,稀树草原土壤中蒙脱石结合的SOC可存续1 000年,高岭石结合的SOC也能达到360年。MAOC具有较低的微生物可利用性,并且其对土壤碳储量有着巨大的贡献,这凸显了土壤MnCP在调控长期碳储存和稳定中的重要性。
1.3 土壤MnCP在应对全球气候变化中的作用探究基于MnCP概念框架下的MAOC对全球气候变化的响应机制,有助于提高对SOC应对全球变化的正确理解和策略管理。当前,以温暖化为特征的全球气候变化已成为公认事实,其中CO2作为最主要的温室气体,对全球变暖贡献率达60%以上。自工业革命以来,空气中CO2的体积分数从1958年的315×10–6增加至1998年的367×10–6,预计到21世纪中叶空气中CO2的体积分数将达到720×10–6[24]。同时,IPCC预测降水的不确定性将在21世纪继续扩大,极端降水事件增多和干旱频发已成为重要的气候变化事件[24-25]。基于野外调查实验的研究结果表明北极和高寒草甸等地区表层矿质土壤的POC和MAOC含量与年平均温度呈现负相关关系,预示温度升高可能促进土壤有机碳分解以及向大气中释放CO2,这将进一步加剧全球气候变暖[26]。通过对控制性增温实验进行Meta分析,研究发现与温暖区域相比,寒冷区域的SOC更容易受到增温的影响,其中增温引起POC的更大损失,而MAOC没有显著响应[26]。由于MAOC被封闭在微团聚体中和/或与矿物表面结合,限制了微生物对MAOC的接触与利用,该结果支持了MnCP在增温下能够减缓SOC分解,进而缓解全球气候变暖。中国内蒙古半干旱草地生态系统的一项降水控制实验发现,MAOC在增加降水处理下其含量显著提高[27]。美国高草草原的一项研究发现,维持30年的增雨处理也显著提高了MAOC含量[28]。这些研究结果表明土壤水分有效性的改善有助于提高MAOC以及SOC含量,并有利于减缓极端降水对SOC的负面作用[28]。目前,关于极端干旱对MAOC影响的实验研究极少。一方面,干旱可能通过降低植物地上生物量、根系生物量和微生物生物量使得土壤有机碳的总投入降低,进而限制MAOC的形成;另一方面,在干旱条件下,植物根系可以生成更多的次生代谢物和复杂的有机酸,这可能有助于MAOC的解吸[19]。然而,在干旱胁迫环境下,土壤细菌和真菌会产生更多的渗透物质或胞外多糖。在干燥的土壤中,不断增加的水分张力使有机质和矿物表面更接近,这些渗透物质或胞外多糖可以积累为MAOC,这将会增强MAOC的长期持久性[19]。因此,关于MnCP在驱动SOC应对极端干旱方面还亟需进一步的探索。
2 土壤MnCP的固碳机制 2.1 吸附吸附作用是指有机质与土壤矿物之间发生紧密结合的过程(图 2)。这一机制在有机碳的初始捕获中起到关键作用,为后续的相互作用奠定基础。此过程中,有机质粘附于矿物表面,使其更能抵抗微生物矿化作用,从而增强了SOC的稳定性和土壤长期碳存储的能力。矿物对有机质的吸附并非简单的单一化学机制,而是由配体交换、阳离子桥接、范德华力、氢键以及疏水作用等多种机制共同作用的结果[29-32]。
配体交换过程涉及有机物中的羧基或酚羟基与矿物表面的羟基相结合,这一过程主要发生在酸性土壤和富含氧化物的土壤中,是铁铝氧化物吸附SOC的关键机制之一[33]。阳离子桥接作用是指黏土矿物表面或溶液中二价或多价金属阳离子(如Ca2+和Mg2+等)充当离子桥,将带负电荷的有机质官能团连接到矿物表面[34]。对于不带电基底表面的黏土矿物(例如高岭石等),氢键和范德华力是其吸附有机质中的关键相互作用力。1︰1型黏土矿物由硅氧四面体片与铝氧八面体片构成,其八面体片表面裸露的活性顶端氧易于形成氢键[35],范德华力存在于黏土矿物的疏水表面与有机质的非极性基团之间[36]。有机质在矿物表面的吸附过程由这些机制共同作用,并且决定了有机质在矿物表面的稳定性和长期保存能力。土壤中的矿物质组成复杂且类型众多,次生黏土矿物和铁铝氧化物对有机质的吸附起到主要作用[37-38]。
2.2 封闭矿物对有机质的封闭作用是指当土壤溶液中存在矿物晶体生长的局部过饱和条件时,有机质将会在矿物晶体生长过程中被封闭在晶体内部(图 2)。与封闭前相比,封闭后的晶体内部有机质的可降解比例与生物降解速率会显著降低[39-40]。在封闭过程中,吸附在晶体表面的有机质随着晶体内部螺旋结构的持续生长被压缩,这导致了空腔或间隙的形成并产生了局部晶格应变。随后,这些有机质被嵌入到晶体表面的孔隙和晶格层之间。当这些空腔和孔隙最终闭合时,有机质便被封闭在矿物结构内部[41-43]。例如在碱性土壤中,碳酸钙晶体生长过程可以捕获有机质形成闭合复合物,尤其是在方解石等矿物中封闭作用较为显著[43]。Rae Cho等[44]通过直接观察方解石晶体与有机质的封闭过程,验证了方解石与有机质之间的相互作用会导致晶格应变,改变晶体排列,使得有机质被封存于晶体内部,从而增强有机质的抗分解能力[45]。
在土壤溶液中,当某些矿物的溶解度达到饱和或过饱和状态时,矿物晶体的生长过程会被触发,使得有机质的封闭作用更为显著。在富含碳酸钙的钙质土壤中,碳酸钙在过饱和条件下容易结晶形成方解石[46-47]。土壤的温度和压力条件也影响晶体的形成。火山灰土中的矿物在高温高压条件下容易形成复杂的晶体结构,通过其较高的比表面积和表面活性,有效地捕获并稳定有机质,从而在封闭有机质方面起到重要作用[47]。
2.3 聚集聚集作用是指矿物和有机质相互胶结凝聚形成团聚体的过程(图 2)。随着有机质与矿物颗粒发生聚集,有机质被包裹在矿物颗粒内部,形成具有不同大小和稳定性的有机矿物聚集体[48-50]。在微观尺度上,团聚体的形成实现了SOC的物理闭蓄,限制了微生物和胞外酶对SOC的可及性,也减少了有机质与氧气的接触程度,这对于提高SOC的稳定性具有显著影响。有机质在聚集过程中被矿物颗粒包被,两者的胶结作用促进矿物颗粒聚集形成团聚体,使得物理孔隙减小以及碳分解速率降低。在表层土壤中,近90%的SOC储存在团聚体内[51]。土壤矿物颗粒能够为团聚体提供结构框架,并且具有较强的有机质吸附结合能力。土壤团聚体按粒径大小分为大团聚体(> 250 μm)和微团聚体(< 250 μm)。其中,70%以上的SOC存在于微团聚体中,这些微团聚体(即MAOC)主要由土壤矿物质颗粒在有机质和金属离子等胶结作用下形成。
有机质可以作为胶结剂与土壤颗粒粘合,提升土壤团聚体的稳定性。团聚体中的有机质主要包括团聚体内外部的有机胶结物质、黏土矿物片层结构间的有机质以及被胶结物质包裹的颗粒有机质[49,52]。土壤中易分解的有机质(如多糖和含氮化合物等)可以通过与黏土矿物的紧密结合和团聚体中的物理隔离,进而避免被土壤微生物和胞外酶快速分解[53]。在富含有机质和黏土矿物的草地、森林和泥炭地土壤中,这种聚集作用尤为显著。Denef和Six[54]研究发现在富含黏土矿物的农田土壤中,黏土矿物(如蒙脱石和伊利石等)通过聚集作用稳定有机质。此外,由于受到翻耕和施肥等农作活动的机械扰动,耕作土壤中的矿物和有机质更易混合和凝聚,从而形成稳定的土壤团聚体[55]。
2.4 氧化还原氧化还原作用是通过电子转移在有机质与矿物之间发生的反应,这一过程能够促进有机质的分解或转化[56],进而影响有机碳的循环和长期固存(图 2)。矿物与有机质之间的氧化还原反应机制包括直接电子转移和通过内源性电子穿梭分子发生的间接转移[10]。直接电子转移涉及有机质与矿物之间的电子直接交换,无需中介物的参与。与之对比,通过内源性电子穿梭分子的间接转移则依赖于特定的小分子或离子(如铁离子Fe(Ⅱ)/Fe(Ⅲ))充当电子传递媒介,进而在矿物与有机质之间实现电子交换,促成氧化还原反应的发生。铁是地壳中含量第四的元素,其氧化还原性质活跃,并且土壤团聚体中OC-Fe成分占总OC的30%~50%[57]。富含二价铁(Fe(Ⅱ))的矿物可在多种元素循环中扮演着关键角色,它们可以直接与有机质发生电子转移反应,以及间接通过形成活性氧化物或与微生物相互作用来促进氧化还原反应[58]。氧化还原机制在SOC固存过程中起着重要作用,尤其是在湿地、泥炭地和水稻田等长期处于缺氧或周期性缺氧环境的土壤中[59]。此外,在热带雨林和沿海潮滩等受到频繁氧化还原循环影响的土壤中,氧化还原机制通过调节微生物活性和矿物转化,有效控制着SOC的分解速率和稳定性,从而显著影响SOC的固存能力[60]。
2.5 催化聚合催化聚合作用是指金属氧化物或黏土矿物可作为聚合反应的催化剂,驱动还原糖或游离的氨基酸聚合成复杂的芳香烃类大分子化合物[11],使之转化为微生物较难代谢的形态,从而促进有机碳在土壤中的长期稳定储存(图 2)。铁锰氧化物在催化有机质聚合方面表现出显著效果。Shindo和Huang [61]的研究指出,锰氧化物能有效催化有机碳的聚合过程,尤其是氧化锰(Ⅳ)。通过对苯二酚和甘氨酸在氧化锰(Ⅳ)存在条件下的相互作用进行研究,研究人员发现氧化锰(Ⅳ)作为一种非生物氧化剂,能够加速土壤中对苯二酚的氧化聚合反应。这一反应导致酚类化合物转化为耐高温和耐碱提取的腐殖质,从而对SOC的循环和长期稳定性产生影响。在此基础上,Shindo和Huang [62]进一步探索了在富含水钠锰矿等Mn(Ⅳ)氧化物的土壤中,锰氧化物对有机氮络合物形成的催化作用。Wang和Huang[63]研究了绿脱土中腐殖质大分子的层间结构以及与苯酚单体的相互作用,研究结果证实了氧化锰(Ⅳ)在加速含氮聚合物的非生物合成过程中起着关键作用,揭示了矿物基质在催化苯酚单体非生物聚合过程中的重要途径,这为理解SOC的形成和稳定机制提供了新的视角。Moore等[11]近期研究了铁和锰氧化物通过美拉德反应对有机碳聚合的催化作用,从而增强了海洋沉积物中有机碳的长期保存。这项研究为了解海洋条件下有助于稳定和保存沉积有机碳的非生物过程提供了新的见解,强调了铁和锰作为关键催化剂的重要作用。
2.6 不同机制间的相互作用MnCP的不同机制在土壤碳循环中通过共同作用增强SOC的稳定性和固存效率。吸附作用增强了有机质与矿物的初步结合,为其他机制的作用奠定了基础;封闭作用和聚集作用通过物理隔离和结构稳定性提高了有机碳的长期持久性;氧化还原和催化聚合作用通过电子转移和化学转化,进一步提高有机碳的化学稳定性[9]。这些机制的共同作用能够有效减少碳的流失和分解,从而增强土壤的碳汇功能,对全球碳循环和气候调节具有重要意义。然而,目前有关MnCP框架中五种固碳机制之间相互作用的研究仍十分匮乏,未来应加强探索不同固碳机制之间的相互影响及其在不同环境条件下的反馈机制,进而不断完善和丰富MnCP的理论框架。
3 土壤MnCP介导有机碳固存的影响因素 3.1 矿物的固有性质矿物的固有性质是影响其与有机质相互作用强度的关键因素,包括比表面积、晶体结构、电荷特性以及化学组成。首先,矿物的比表面积决定了其提供给有机质吸附的有效表面积,具有更大比表面积的矿物在吸附、固存和稳定有机碳方面均展现出更大的潜力[64-65]。相较于主要由1︰1型层状硅酸盐矿物(如高岭石等)构成的土壤,以2︰1型层状硅酸盐矿物(包括蒙脱石、伊利石和云母等)为主的土壤具有更高的比表面积,进而吸附的SOC含量通常更高[66-67]。相比于硅酸盐矿物,金属氧化物具有更大的比表面积和更高密度的表面官能团,因此具有更高的有机质吸附潜力[68-70]。其次,矿物的晶体结构影响其对有机质的吸附模式和稳定性。例如,层状结构的矿物如蒙脱石,因其层间可为有机物提供保护空间而能有效地稳定有机质。再次,矿物的电荷特性直接影响其与有机质的静电相互作用,正电荷的矿物更易于吸附带负电的有机分子。最后,土壤矿物的化学组成也影响着SOC的固存潜力。含铁和铝的矿物可以通过形成配位键等方式与有机质发生更稳定的结合作用。
3.2 SOC的特性SOC的特性是指其分子大小、功能团的种类和分布以及化学组成。分子大小直接影响有机分子的空间构型和其在矿物表面的吸附情况。较大的分子或高分子量的有机物因其结构复杂,更可能在矿物表面形成稳定的结合体。功能团的种类和分布决定了有机碳与矿物的相互作用方式。数量丰富的官能团例如羧基和酚羟基会增加有机质与矿物之间形成氢键或配位键的可能性,从而增强有机质的稳定性。此外,有机质的化学组成也会影响其与矿物之间相互作用的亲和力,进而影响其在土壤中的稳定固存。芳香族和脂肪族的有机质是土壤有机质的重要组分。富含芳香族的有机质优先吸附在铁铝氧化物上[71-72],而脂肪族组分则优先被黏土矿物吸附[73]。脂肪族组分主要来自微生物和植物残体[74],其主要存在于土壤表层,并且与矿物质的作用紧密且难以解吸[74]。
3.3 土壤环境条件MnCP对有机质的固存作用并非静态的,其动态变化过程与土壤环境条件紧密相关。氧化还原状态的波动可能引发与弱结晶态矿物结合的SOC再释放。例如,在氧化还原条件波动起伏的条件下,由于铁氧化物的反应活性与其结晶程度成反比,弱结晶态矿物易向高结晶度矿物转化,进而引起与弱结晶态矿物结合的SOC发生失稳行为[75]。Chen等[12]发现由于强烈的氧化还原波动条件,水稻土中铁氧化物对SOC的矿化作用远大于保护稳定作用,仅有5.2%~7.1%的SOC与高结晶态的铁氧化物结合而最终稳定。同时,Chen等[76]还发现铁氧化物对SOC的保护作用受到土壤湿度和氧气含量的调控,在高湿度和厌氧环境下铁氧化物的添加反而促进土壤中32%~41%的有机碳发生矿化作用。
土壤pH的变化是影响矿物-有机质结合的关键因素之一,通过多种方式影响着矿物和有机质之间的相互作用和动态平衡。首先,pH的变化会改变铁铝矿物的亲水性和zeta电位,进而影响其与有机质的络合能力。在酸性环境下,铁铝矿物容易发生水解并吸附有机质。其次,在碱性或弱酸性的土壤环境中,钙离子和钙/铝氧化物通过与SOC进行离子交换,进而增强SOC与矿物之间的吸附作用来提高SOC的稳定性[77-78]。相比于金属氧化物,黏土矿物在pH波动条件下表现出相对较高的稳定性。然而,黏土矿物通常含有少量金属氧化物杂质而发生同晶替代,通过离子交换、氢键等机制与黏土矿物结合的SOC的稳定性也会受到pH波动的影响。
土壤温度和湿度也是调节MnCP的重要因素。增温条件下,由于温度升高加速了SOC分子的运动,增加了脱附的可能性;同时也促进了SOC化学键的断裂,削弱了矿物与SOC的结合,导致矿物对SOC的吸附能力通常降低。此外,温度升高也通过增强微生物活性从而加速SOC的分解[79]。对于土壤湿度,湿润土壤中矿物表面的水化作用增强,促进了SOC的吸附和结合。例如,高岭石在水分充足的环境中能形成更稳定的矿物-有机复合体[80]。高湿度也有助于微生物代谢产物(如胞外聚合物)与矿物结合,形成稳定的矿物-有机复合体,进一步提高SOC的稳定性[81]。Doetterl等[82]研究表明相比于干旱地区,湿润地区的生物化学风化速率较高,SOC组分以矿物结合态为主,导致SOC储量更高。最新的一项研究表明环境温度和湿度会影响POC向MAOC的转化过程[83]。相对较高的温度(35 ℃)促进了POC分解和CO2排放,而较高的土壤湿度(40%和60%的田间土壤持水量)促进POC分解以及MAOC的形成。POC的降解机制主要是温度升高驱动了溶解性有机质中其他组分向芳香族组分的转化,而MAOC的形成主要是土壤水分有效性的增加驱动了木质素组分向脂肪族/多肽和脂质物质的转化。
3.4 人类活动人类活动正深刻影响着MnCP介导下SOC与矿物之间的相互作用。土地利用变化不佳和/或管理措施不善通常会导致土壤退化并降低MAOC。例如,相比于自然/管理较少的森林和草地生态系统的土壤平均MAOC饱和度为46%,全球农业系统的土壤平均MAOC饱和度仅为31%[17],这主要与长期集约化的农业措施降低了有机质与矿物质之间的关联程度有关[84]。合理的农业实践或土壤改良能够提高MAOC库的大小和稳定性,这对于应对气候变化和维护生态系统健康具有重要意义。研究表明,优化放牧强度、维持多营养级或恢复植物多样性均可以有效改变草地根际沉积物和POC的数量和质量,通过直接吸收溶解有机物和前体库POC的生物转化,进而促进MAOC的形成[85-88]。位于美国中北部威斯康星州长达29年的定位试验研究发现,轮牧多年生草地可以显著增加土壤MAOC和总SOC含量,让表层土壤转化为吸收大气CO2的碳汇。然而,一年生谷物和半年生牧草系统中优化管理措施如免耕、轮作、引入豆科作物和有机肥施用尽管可以提升土壤健康,但还不足以提升土壤MAOC和总SOC含量[88]。此外,基于MnCP概念机理,向土壤中添加黏土矿物(如蒙脱石、高岭石和伊利石等)或金属氧化物(如水铁矿和水铝英石等)有望增加SOC的长期封存能力[89]。因此,修复已经退化或高度风化的土壤时,科学探索使用富含这些矿物质的土壤改良剂,增强被改良土壤中有机碳的封存效能,有望显著提升土壤的健康状况和固碳能力。
4 土壤MnCP与MCP的互联过程 4.1 MnCP与MCP的认知过程早期研究将植物源有机碳视为SOC库中最直接且主要的贡献者[90]。随着研究手段的进步与分析技术的发展,近十年来学术界对于SOC来源的认识经历了巨大的变革。SOC的形成理论从早期认为由植物源腐殖质大分子占主导的经典腐殖质理论[91]逐步发展为以土壤微生物为核心的调控理论[92-93]。研究从植物残体逐级分解的经典模型起步[94],发展至描述SOC形成过程的连续体模型[92],进而扩展到探讨土壤微生物“碳泵”在体内周转与体外修饰路径上调控机制的差异[11],以及“续埋效应”对SOC积累的贡献程度[2]。
SOC的稳定化始于植物通过光合作用捕获大气CO2并将其转换为有机物质形式,是一个复杂的生物地球化学过程。MCP是指微生物主要通过同化作用将植物源碳和大气中的CO2转化成自身生物量与代谢产物,进一步以微生物残体的形式贡献于SOC库的过程[2,95]。微生物残体及胞外代谢物容易与土壤矿物发生紧密结合,从而在MnCP作用下通过矿物保护作用形成周转较慢的有机碳库[19],并在微生物群落的世代繁衍中不断迭代积累,最终以更为稳定的MAOC形式封存于土壤碳库[96-97]。这一系列理论的引入不仅拓宽了对SOC固存机制的研究视角,更深化了对土壤碳循环的复杂性和生物/非生物学机制的认识,从而有助于制定土壤碳库的有效科学管理策略。
4.2 MnCP与MCP共同作用SOC的稳定与固存MCP和MnCP的交互作用在SOC的形成和稳定过程中扮演着重要角色。微生物代谢过程主要在矿物表面的活性位点上进行,微生物残体也易于受到矿物保护而得以长期保存。此外,MnCP通过吸附、封闭、聚集等机制增强了SOC的稳定性,这些机制对MCP产物的稳定化至关重要。例如,胞外聚合物等微生物代谢产物可通过黏合作用促进矿物颗粒与SOC的聚集形成团聚体[98],进一步延长SOC的周转时间。矿物表面SOC氧化生成的CO2可以作为潜在碳源,受到土壤自养微生物的有效利用,进一步通过MCP途径保留在土壤碳库中。
对于SOC的稳定和固存,MCP和MnCP构成了一个互联互补的系统(图 3)。MCP通过土壤微生物的同化代谢活动将外源碳转化为SOC,为SOC库的初步构建提供原料,而MnCP则强调矿物对SOC的稳定作用,通过固定这些新形成的SOC产生更为稳定的MAOC形式。这两个过程不仅顺序发生,还在功能上并行作用:MCP驱动的SOC包括微生物残体和某些化学性质难以分解的代谢产物,这些成分可直接增加土壤碳库;MnCP也能直接作用于部分未经MCP转化的SOC,将其稳定和固存于土壤碳库中[99]。这种相互作用和功能并行展示了SOC固存的连续性和动态性,对于维持土壤碳库的平衡和稳定至关重要,进而潜在影响着全球碳循环和气候变化。
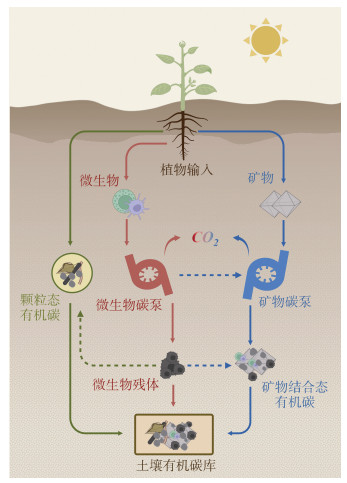
|
图 3 SOC的稳定机制 Fig. 3 Mechanisms for stabilizing soil organic carbon |
综上所述,土壤MnCP不仅能独立作为一个关键的概念框架来研究SOC的稳定性,也能进一步深化土壤MCP概念框架中对续埋效应的内在机理解析。理解和利用MCP与MnCP的协同作用,可以为土壤碳封存和应对全球气候变化提供新的管理策略和理论支持。
5 MnCP相关研究技术手段的发展 5.1 传统比色表征手段随着电镜、质谱和光谱技术的不断发展,人们对土壤矿物在SOC固存中的作用有了更深刻的理解。矿物中金属含量(如铁、铝和锰等)和矿物结构是MAOC保存的基础,普遍认为矿物中铁铝等金属元素含量越高,对SOC的固存越有利[100-102]。过去常依赖比色法来测定土壤中的铁、铝和锰含量[103],例如使用邻菲啰呤比色法测铁,二甲酚橙比色法测铝,以及高碘酸钾比色法测锰。然而,比色法存在灵敏度不足和对样品要求苛刻的局限性。技术革新使得新一代仪器在土壤金属含量测定领域崭露头角,当前应用的相关仪器技术已尽可能详尽地列举在表 1中 [104-106]。同时,土壤中还含有大量的黏土矿物,未来需要开发能够高效提取并定量分析不同矿物对SOC固存贡献程度的试验方法与技术。
|
|
表 1 MnCP相关研究的技术手段 Table 1 The main characterization methods for MnCP research |
科学技术的更新发展推动了土壤MAOC研究的深入。研究者们不再满足于简单的含量测定,而是转向利用扫描电子显微镜(SEM)、透射电子显微镜(TEM)以及场发射扫描电子显微镜(FESEM)结合能谱仪(EDS)等尖端技术。这些技术不仅揭示了MAOC的表面形貌特征,还实现了表面元素组成的定量分析[107],从而帮助研究者们更深刻地理解MAOC的微观结构和化学性质以及土壤矿物与有机质之间的结合机理。近年来,球差校正透射电子显微镜(Cs-STEM)技术的迅猛发展,已经使得科学界能够在纳米乃至原子级别上观察化学反应过程[108-109]。此外,傅立叶红外变换光谱(FT-IR)、X射线衍射(XRD)、拉曼光谱(RM)、X射线光电子能谱(XPS)、穆斯堡尔谱、中子衍射和同步辐射精细吸收谱(XAS)等方法也被广泛用于MAOC的表征,这些技术的综合应用能够深入解析MAOC的复杂性,有助于对SOC与矿物之间结合机制的深入探究。
5.2 现代分析技术的发展二次离子质谱(SIMS)是一种离子微探针技术,将显微镜观测与同位素分析联系起来,可以提供材料分子和同位素组成的空间分布信息[110-111]。纳米二次离子质谱技术(NanoSIMS),作为SIMS技术的最新发展成果,能够在低至50 nm的尺度上对元素和同位素进行含量精准且空间明确的分析。NanoSIMS还允许同时分析多达七种离子种类,为纳米和亚微米尺度上理解土壤微团聚体表面有机质与矿物的复杂空间分布提供了有力的技术支持[112]。Wu等[113]曾利用NanoSIMS技术在微米和纳米尺度上解析了尾矿有机质的形成、分子特征和稳定性。
傅立叶变换离子回旋共振质谱(FT-ICR-MS)是一种高分辨率质谱技术。基于其高质量分辨率、质量精度和动态范围,FT-ICR-MS能够识别溶解性有机质(Dissolved organic matter,DOM)中单个分子的元素组成和特性,并可对复杂有机混合物中特定组分进行元素分配[114]。利用FT-ICR-MS可以根据吸附前后DOM分子组分的变化来确定DOM在水–矿物界面处的分子分馏。Zeng等[115]对矿物–有机复合物的研究发现,具有芳香结构、羧基和大分子量的有机化合物更难从矿物表面解吸和被微生物氧化。Hu等[116]将FT-ICR-MS技术用于探究了不同溶解度矿物吸附分馏对DOM分子结构的影响。
近边X射线吸收精细结构光谱(Near-Edge X-ray Absorption Fine Structure,NEXAFS),也称为XANES(X-ray Absorption Near Edge Structure),是一种基于同步辐射光源的先进光谱技术。当NEXAFS与扫描透射X射线显微镜(STXM)结合使用时,可以获得30 nm分辨率的空间元素形态信息[117],所以STXM-NEXAFS是一种在纳米和亚微米尺度上分析土壤MAOC中C形态分布的强大方法[118]。
穆斯堡尔谱图(Mössbauer Spectroscopy)是一种基于穆斯堡尔效应的核共振吸收技术,能够精确地测量原子核能级的微小变化[119]。在土壤矿物介导下SOC固存的研究中,该技术常被用于鉴定和区分土壤中不同形态的铁矿物以及土壤矿物中铁离子氧化还原状态的测定,进一步揭示有机质与铁矿物之间的相互作用,比如有机质如何影响铁矿物的形成、转化和稳定性[120-121]。
6 MnCP研究展望MnCP概念框架的提出在土壤科学领域引起了广泛的关注与深入的讨论。这一创新性的理论体系不仅凸显了土壤矿物在增强SOC稳定性和积累中的核心地位,更从全新的视角揭示了土壤矿物与微生物在SOC固存过程中的紧密协作与相互依赖关系。MnCP概念还为我们提供了一个全新的研究框架,可以更加系统地探究矿物与SOC之间的互作关系。通过综合运用现代分析技术和实验方法,可以更加精确地揭示这些相互作用的具体机制和发生过程,从而为土壤碳循环和土壤生态系统的科学管理提供更加全面的依据和指导。
展望未来,针对MnCP的研究应在以下几个方面进行:
1)机制深化:虽然MnCP的基本框架已经建立,但是各个机制之间的相互作用及其对SOC稳定性的综合影响还需进一步明确,尤其是催化聚合和氧化还原反应在不同土壤环境中的具体作用机理,仍然是当前研究的重点。
2)表征技术创新:随着新型表征技术的不断发展,如NanoSIMS、FT-ICR-MS和NEXAFS等,有助于在更精细的尺度上理解MnCP的作用机制。这些技术的进一步应用和创新,将为矿物-有机质相互作用的认识提供更为深刻的洞见。
3)模型建立与优化:建立和优化能够综合反映MnCP各项机制作用的数学模型和模拟平台,对于预测和评估不同环境条件下SOC的固存能力及其对全球碳循环的贡献具有重要意义。
4)环境变化影响研究:考虑到气候变化及人类活动对土壤环境的影响,研究不同环境条件下MnCP作用的变化及其对SOC固存能力的影响,将有助于更准确地理解和预测土壤碳库的未来变化趋势。
5)MCP与MnCP的互动研究:深入研究MCP与MnCP之间的协作关系,将为更加全面地揭示SOC稳定与固存的机制提供新的见解。
针对“双碳”战略背景以及日益严峻的气候变化,增强土壤碳汇的需求愈发迫切。土壤作为陆地生态系统最大的碳库,其有机碳的形成、转化和稳定机制对于维持全球碳平衡和减缓气候变暖具有关键作用。MnCP概念体系的提出,提供了一个全新的视角来审视和理解土壤碳汇的形成与维持。通过深入研究MnCP相关的科学问题,可以更加深入地揭示土壤矿物与有机碳之间的互作关系,理解其如何共同影响SOC的稳定和积累,也为制定有效的碳管理策略提供科学依据。基于MnCP理论进行有效管理和利用土壤矿物资源、优化土地利用方式和改善土壤管理措施,从而切实提高土壤碳汇能力以及应对全球气候变化的能力,致力于实现经济效益与生态效益的双赢。
| [1] |
Trumbore S E. Potential responses of soil organic carbon to global environmental change[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(16): 8284-8291.
(  0) 0) |
| [2] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2: 17105. DOI:10.1038/nmicrobiol.2017.105
(  0) 0) |
| [3] |
Liang C, Amelung W, Lehmann J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology, 2019, 25(11): 3578-3590. DOI:10.1111/gcb.14781
(  0) 0) |
| [4] |
Cotrufo M F, Ranalli M G, Haddix M L, et al. Soil carbon storage informed by particulate and mineral-associated organic matter[J]. Nature Geoscience, 2019, 12: 989-994. DOI:10.1038/s41561-019-0484-6
(  0) 0) |
| [5] |
Heckman K A, Possinger A R, Badgley B D, et al. Moisture-driven divergence in mineral-associated soil carbon persistence[J]. Proceedings of the National Academy of Sciences of the United States of America, 2023, 120(7): e2210044120.
(  0) 0) |
| [6] |
Benbi D K, Boparai A K, Brar K. Decomposition of particulate organic matter is more sensitive to temperature than the mineral associated organic matter[J]. Soil Biology & Biochemistry, 2014, 70: 183-192.
(  0) 0) |
| [7] |
Eusterhues K, Neidhardt J, Hädrich A, et al. Biodegradation of ferrihydrite-associated organic matter[J]. Biogeochemistry, 2014, 119(1): 45-50.
(  0) 0) |
| [8] |
Kalbitz K, Schwesig D, Rethemeyer J, et al. Stabilization of dissolved organic matter by sorption to the mineral soil[J]. Soil Biology & Biochemistry, 2005, 37(7): 1319-1331.
(  0) 0) |
| [9] |
Xiao K Q, Zhao Y, Liang C, et al. Introducing the soil mineral carbon pump[J]. Nature Reviews Earth & Environment, 2023, 4: 135-136.
(  0) 0) |
| [10] |
Jokic A, Frenkel A I, Vairavamurthy M A, et al. Birnessite catalysis of the Maillard reaction: Its significance in natural humification[J]. Geophysical Research Letters, 2001, 28(20): 3899-3902. DOI:10.1029/2001GL013839
(  0) 0) |
| [11] |
Moore O W, Curti L, Woulds C, et al. Long-term organic carbon preservation enhanced by iron and manganese[J]. Nature, 2023, 621(7978): 312-317. DOI:10.1038/s41586-023-06325-9
(  0) 0) |
| [12] |
Chen N, Fu Q L, Wu T L, et al. Active iron phases regulate the abiotic transformation of organic carbon during redox fluctuation cycles of paddy soil[J]. Environmental Science & Technology, 2021, 55(20): 14281-14293.
(  0) 0) |
| [13] |
Yang Y Y, Shen Z F, Bissett A, et al. Estimating soil fungal abundance and diversity at a macroecological scale with deep learning spectrotransfer functions[J]. Soil, 2022, 8(1): 223-235. DOI:10.5194/soil-8-223-2022
(  0) 0) |
| [14] |
Murray J, Jagoutz O. Clay minerals store organic carbon and cool Earth's climate over millions of years[J]. Nature Geoscience, 2024, 17: 8-9. DOI:10.1038/s41561-023-01353-6
(  0) 0) |
| [15] |
Lavallee J M, Soong J L, Cotrufo M F. Conceptualizing soil organic matter into particulate and mineral-associated forms to address global change in the 21st century[J]. Global Change Biology, 2020, 26(1): 261-273. DOI:10.1111/gcb.14859
(  0) 0) |
| [16] |
Wang J X, Wilson R S, Aristilde L. Electrostatic coupling and water bridging in adsorption hierarchy of biomolecules at water-clay interfaces[J]. Proceedings of the National Academy of Sciences of the United States of America, 2024, 121(7): e2316569121.
(  0) 0) |
| [17] |
Georgiou K, Jackson R B, Vindušková O, et al. Global stocks and capacity of mineral-associated soil organic carbon[J]. Nature Communications, 2022, 13(1): 3797. DOI:10.1038/s41467-022-31540-9
(  0) 0) |
| [18] |
Rumpel C, Kögel-Knabner I. Deep soil organic matter—A key but poorly understood component of terrestrial C cycle[J]. Plant and Soil, 2011, 338(1): 143-158.
(  0) 0) |
| [19] |
Sokol N W, Whalen E D, Jilling A, et al. Global distribution, formation and fate of mineral-associated soil organic matter under a changing climate: A trait-based perspective[J]. Functional Ecology, 2022, 36(6): 1411-1429. DOI:10.1111/1365-2435.14040
(  0) 0) |
| [20] |
Christensen B T. Physical fractionation of soil and structural and functional complexity in organic matter turnover[J]. European Journal of Soil Science, 2001, 52(3): 345-353. DOI:10.1046/j.1365-2389.2001.00417.x
(  0) 0) |
| [21] |
Angst G, Mueller K E, Eissenstat D M, et al. Soil organic carbon stability in forests: Distinct effects of tree species identity and traits[J]. Global Change Biology, 2019, 25(4): 1529-1546. DOI:10.1111/gcb.14548
(  0) 0) |
| [22] |
Torres-Sallan G, Schulte R P O, Lanigan G J, et al. Clay illuviation provides a long-term sink for C sequestration in subsoils[J]. Scientific Reports, 2017, 7: 45635. DOI:10.1038/srep45635574-6941.2011.01106.x
(  0) 0) |
| [23] |
Wattel-Koekkoek E J W, Buurman P, van Der Plicht J, et al. Mean residence time of soil organic matter associated with kaolinite and smectite[J]. European Journal of Soil Science, 2003, 54(2): 269-278. DOI:10.1046/j.1365-2389.2003.00512.x
(  0) 0) |
| [24] |
Intergovernmental Panel on Climate Change. Climate change 2021 – The physical science basis . Cambridge, UK: Cambridge University Press, 2023.
(  0) 0) |
| [25] |
Werner C, Meredith L K, Ladd S N, et al. Ecosystem fluxes during drought and recovery in an experimental forest[J]. Science, 2021, 374(6574): 1514-1518. DOI:10.1126/science.abj6789
(  0) 0) |
| [26] |
García-Palacios P, Bradford M A, Benavente-Ferraces I, et al. Dominance of particulate organic carbon in top mineral soils in cold regions[J]. Nature Geoscience, 2024, 17: 145-150. DOI:10.1038/s41561-023-01354-5
(  0) 0) |
| [27] |
Qin W K, Wang Y H, Yuan X, et al. Responses of soil carbon dynamics to precipitation and land use in an Inner Mongolian grassland[J]. Plant and Soil, 2023, 491(1): 85-100.
(  0) 0) |
| [28] |
Rocci K S, Bird M, Blair J M, et al. Thirty years of increased precipitation modifies soil organic matter fractions but not bulk soil carbon and nitrogen in a mesic grassland[J]. Soil Biology & Biochemistry, 2023, 185: 109145.
(  0) 0) |
| [29] |
Feng X J, Simpson A J, Simpson M J. Chemical and mineralogical controls on humic acid sorption to clay mineral surfaces[J]. Organic Geochemistry, 2005, 36(11): 1553-1566. DOI:10.1016/j.orggeochem.2005.06.008
(  0) 0) |
| [30] |
Kaiser K, Zech W. Competitive sorption of dissolved organic matter fractions to soils and related mineral phases[J]. Soil Science Society of America Journal, 1997, 61(1): 64-69. DOI:10.2136/sssaj1997.03615995006100010011x
(  0) 0) |
| [31] |
Kleber M, Bourg I C, Coward E K, et al. Dynamic interactions at the mineral–organic matter interface[J]. Nature Reviews Earth & Environment, 2021, 2: 402-421.
(  0) 0) |
| [32] |
Mikutta R, Mikutta C, Kalbitz K, et al. Biodegradation of forest floor organic matter bound to minerals via different binding mechanisms[J]. Geochimica et Cosmochimica Acta, 2007, 71(10): 2569-2590. DOI:10.1016/j.gca.2007.03.002
(  0) 0) |
| [33] |
Gu B, Schmitt J, Chen Z, et al. Adsorption and desorption of natural organic matter on iron oxide: Mechanisms and models[J]. Environmental Science & Technology, 1994, 28(1): 38-46.
(  0) 0) |
| [34] |
Lützow M V, Kögel-Knabner I, Ekschmitt K, et al. Stabilization of organic matter in temperate soils: Mechanisms and their relevance under different soil conditions–A review[J]. European Journal of Soil Science, 2006, 57(4): 426-445. DOI:10.1111/j.1365-2389.2006.00809.x
(  0) 0) |
| [35] |
Chen M D, Cui X Y. Mechanisms and influencing factors of soil organic carbon sequestration by minerals (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2022, 30(2): 175-183. [陈梦蝶, 崔晓阳. 土壤有机碳矿物固持机制及其影响因素[J]. 中国生态农业学报, 2022, 30(2): 175-183.]
(  0) 0) |
| [36] |
Smith B J, Rawal A, Funkhouser G P, et al. Origins of saccharide-dependent hydration at aluminate, silicate, and aluminosilicate surfaces[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(22): 8949-8954.
(  0) 0) |
| [37] |
Mayes M A, Heal K R, Brandt C C, et al. Relation between soil order and sorption of dissolved organic carbon in temperate subsoils[J]. Soil Science Society of America Journal, 2012, 76(3): 1027-1037. DOI:10.2136/sssaj2011.0340
(  0) 0) |
| [38] |
Wilson M J. Weathering of the primary rock-forming minerals: Processes, products and rates[J]. Clay Minerals, 2004, 39(3): 233-266. DOI:10.1180/0009855043930133
(  0) 0) |
| [39] |
Chi J L, Zhang W J, Wang L J, et al. Direct observations of the occlusion of soil organic matter within calcite[J]. Environmental Science & Technology, 2019, 53(14): 8097-8104.
(  0) 0) |
| [40] |
Duchaufour P. Dynamics of organic matter in soils of temperate regions: Its action on pedogenesis[J]. Geoderma, 1976, 15(1): 31-40. DOI:10.1016/0016-7061(76)90068-9
(  0) 0) |
| [41] |
Chi J L, Fan Y K, Wang L J, et al. Retention of soil organic matter by occlusion within soil minerals[J]. Reviews in Environmental Science and Bio/Technology, 2022, 21(3): 727-746. DOI:10.1007/s11157-022-09628-x
(  0) 0) |
| [42] |
Orme C A, Noy A, Wierzbicki A, et al. Formation of chiral morphologies through selective binding of amino acids to calcite surface steps[J]. Nature, 2001, 411(6839): 775-779. DOI:10.1038/35081034
(  0) 0) |
| [43] |
Teng H H, Dove P M, Orme C A, et al. Thermodynamics of calcite growth: Baseline for understanding biomineral formation[J]. Science, 1998, 282(5389): 724-727. DOI:10.1126/science.282.5389.724
(  0) 0) |
| [44] |
Rae Cho K, Kim Y Y, Yang P C, et al. Direct observation of mineral-organic composite formation reveals occlusion mechanism[J]. Nature Communications, 2016, 7: 10187. DOI:10.1038/ncomms10187
(  0) 0) |
| [45] |
Herman A, Addadi L, Weiner S. Interactions of sea-urchin skeleton macromolecules with growing calcite crystals—A study of intracrystalline proteins[J]. Nature, 1988, 331: 546-548. DOI:10.1038/331546a0
(  0) 0) |
| [46] |
Nancollas G H, Reddy M M. The crystallization of calcium carbonate. Ⅱ. Calcite growth mechanism[J]. Journal of Colloid and Interface Science, 1971, 37(4): 824-830. DOI:10.1016/0021-9797(71)90363-8
(  0) 0) |
| [47] |
Tribble J S, Arvidson R S, Lane M Ⅲ, et al. Crystal chemistry, and thermodynamic and kinetic properties of calcite, dolomite, apatite, and biogenic silica: Applications to petrologic problems[J]. Sedimentary Geology, 1995, 95(1-2): 11-37. DOI:10.1016/0037-0738(94)00094-B
(  0) 0) |
| [48] |
Six J, Bossuyt H, Degryze S, et al. A history of research on the link between(micro)aggregates, soil biota, and soil organic matter dynamics[J]. Soil & Tillage Research, 2004, 79(1): 7-31.
(  0) 0) |
| [49] |
Tisdall J M, Oades J M. Organic matter and water-stable aggregates in soils[J]. Journal of Soil Science, 1982, 33(2): 141-163. DOI:10.1111/j.1365-2389.1982.tb01755.x
(  0) 0) |
| [50] |
Tan W F, Xu Y, Shi Z H, et al. The formation process and stabilization mechanism of soil aggregates driven by binding materials (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(5): 1297-1308. [谭文峰, 许运, 史志华, 等. 胶结物质驱动的土壤团聚体形成过程与稳定机制[J]. 土壤学报, 2023, 60(5): 1297-1308.]
(  0) 0) |
| [51] |
Jastrow J D. Soil aggregate formation and the accrual of particulate and mineral-associated organic matter[J]. Soil Biology & Biochemistry, 1996, 28(4): 665-676.
(  0) 0) |
| [52] |
Elliott E T. Aggregate structure and carbon, nitrogen, and phosphorus in native and cultivated soils[J]. Soil Science Society of America Journal, 1986, 50(3): 627-633. DOI:10.2136/sssaj1986.03615995005000030017x
(  0) 0) |
| [53] |
Blanco-Canqui H, Lal R. Mechanisms of carbon sequestration in soil aggregates[J]. Critical Reviews in Plant Sciences, 2004, 23(6): 481-504. DOI:10.1080/07352680490886842
(  0) 0) |
| [54] |
Denef K, Six J. Clay mineralogy determines the importance of biological versus abiotic processes for macroaggregate formation and stabilization[J]. European Journal of Soil Science, 2005, 56(4): 469-479. DOI:10.1111/j.1365-2389.2004.00682.x
(  0) 0) |
| [55] |
Jiao Y, Whalen J K, Hendershot W H. No-tillage and manure applications increase aggregation and improve nutrient retention in a sandy-loam soil[J]. Geoderma, 2006, 134(1-2): 24-33. DOI:10.1016/j.geoderma.2005.08.012
(  0) 0) |
| [56] |
Soma Y, Soma M. Chemical reactions of organic compounds on clay surfaces[J]. Environmental Health Perspectives, 1989, 83: 205-214. DOI:10.1289/ehp.8983205
(  0) 0) |
| [57] |
Duan X, Li Z, Liu M, et al. Progress of the iron-mediated soil organic carbon preservation and mineralization (In Chinese)[J]. Advances in Earth Science, 2022, 37(2): 202-211. [段勋, 李哲, 刘淼, 等. 铁介导的土壤有机碳固持和矿化研究进展[J]. 地球科学进展, 2022, 37(2): 202-211.]
(  0) 0) |
| [58] |
Sander M, Hofstetter T B, Gorski C A. Electrochemical analyses of redox-active iron minerals: A review of nonmediated and mediated approaches[J]. Environmental Science & Technology, 2015, 49(10): 5862-5878.
(  0) 0) |
| [59] |
Hanke A, Cerli C, Muhr J, et al. Redox control on carbon mineralization and dissolved organic matter along a chronosequence of paddy soils[J]. European Journal of Soil Science, 2013, 64(4): 476-487. DOI:10.1111/ejss.12042
(  0) 0) |
| [60] |
Mueller P, Granse D, Nolte S, et al. Top-down control of carbon sequestration: Grazing affects microbial structure and function in salt marsh soils[J]. Ecological Applications, 2017, 27(5): 1435-1450. DOI:10.1002/eap.1534
(  0) 0) |
| [61] |
Shindo H, Huang P M. Role of Mn(Ⅳ)oxide in abiotic formation of humic substances in the environment[J]. Nature, 1982, 298(5872): 363-365. DOI:10.1038/298363a0
(  0) 0) |
| [62] |
Shindo H, Huang P M. Significance of Mn(Ⅳ)oxide in abiotic formation of organic nitrogen complexes in natural environments[J]. Nature, 1984, 308(5954): 57-58. DOI:10.1038/308057a0
(  0) 0) |
| [63] |
Wang M C, Huang P M. Humic macromolecule Interlayering in nontronite through interaction with phenol monomers[J]. Nature, 1986, 323(6088): 529-531. DOI:10.1038/323529a0
(  0) 0) |
| [64] |
Rakhsh F, Golchin A, Beheshti Al Agha A, et al. Effects of exchangeable cations, mineralogy and clay content on the mineralization of plant residue carbon[J]. Geoderma, 2017, 307: 150-158. DOI:10.1016/j.geoderma.2017.07.010
(  0) 0) |
| [65] |
Six J, Conant R T, Paul E A, et al. Stabilization mechanisms of soil organic matter: Implications for C-saturation of soils[J]. Plant and Soil, 2002, 241(2): 155-176. DOI:10.1023/A:1016125726789
(  0) 0) |
| [66] |
Saidy A R, Smernik R J, Baldock J A, et al. Effects of clay mineralogy and hydrous iron oxides on labile organic carbon stabilisation[J]. Geoderma, 2012, 173/174: 104-110. DOI:10.1016/j.geoderma.2011.12.030
(  0) 0) |
| [67] |
Zhang J, Loynachan T E, Raich J W. Artificial soils to assess temperature sensitivity of the decomposition of model organic compounds: Effects of chemical recalcitrance and clay-mineral composition[J]. European Journal of Soil Science, 2011, 62(6): 863-873. DOI:10.1111/j.1365-2389.2011.01394.x
(  0) 0) |
| [68] |
Kaiser K, Eusterhues K, Rumpel C, et al. Stabilization of organic matter by soil minerals—Investigations of density and particle-size fractions from two acid forest soils[J]. Journal of Plant Nutrition and Soil Science, 2002, 165(4): 451-459. DOI:10.1002/1522-2624(200208)165:4<451::AID-JPLN451>3.0.CO;2-B
(  0) 0) |
| [69] |
Kaiser K, Guggenberger G, Zech W. Sorption of DOM and DOM fractions to forest soils[J]. Geoderma, 1996, 74(3/4): 281-303.
(  0) 0) |
| [70] |
Kaiser K, Zech W. Release of natural organic matter sorbed to oxides and a subsoil[J]. Soil Science Society of America Journal, 1999, 63(5): 1157-1166. DOI:10.2136/sssaj1999.6351157x
(  0) 0) |
| [71] |
Chorover J, Amistadi M K. Reaction of forest floor organic matter at goethite, birnessite and smectite surfaces[J]. Geochimica et Cosmochimica Acta, 2001, 65(1): 95-109. DOI:10.1016/S0016-7037(00)00511-1
(  0) 0) |
| [72] |
Kaiser K. Sorption of natural organic matter fractions to goethite(α-FeOOH): Effect of chemical composition as revealed by liquid-state 13C NMR and wet-chemical analysis[J]. Organic Geochemistry, 2003, 34(11): 1569-1579. DOI:10.1016/S0146-6380(03)00120-7
(  0) 0) |
| [73] |
Wang K J, Xing B S. Structural and sorption characteristics of adsorbed humic acid on clay minerals[J]. Journal of Environmental Quality, 2005, 34(1): 342-349. DOI:10.2134/jeq2005.0342
(  0) 0) |
| [74] |
Adhikari D, Yang Y. Selective stabilization of aliphatic organic carbon by iron oxide[J]. Scientific Reports, 2015, 5: 11214. DOI:10.1038/srep11214
(  0) 0) |
| [75] |
Song X X, Liu T X. Effects of soil iron mineral transformation on organic carbon sequestration: A review (In Chinese)[J]. Acta Ecologica Sinica, 2021, 41(20): 7928-7938. [宋旭昕, 刘同旭. 土壤铁矿物形态转化影响有机碳固定研究进展[J]. 生态学报, 2021, 41(20): 7928-7938.]
(  0) 0) |
| [76] |
Chen C M, Hall S J, Coward E, et al. Iron-mediated organic matter decomposition in humid soils can counteract protection[J]. Nature Communications, 2020, 11(1): 2255. DOI:10.1038/s41467-020-16071-5
(  0) 0) |
| [77] |
Rowley M C, Grand S, Verrecchia É P. Calcium-mediated stabilisation of soil organic carbon[J]. Biogeochemistry, 2018, 137(1): 27-49.
(  0) 0) |
| [78] |
Shabtai I A, Wilhelm R C, Schweizer S A, et al. Calcium promotes persistent soil organic matter by altering microbial transformation of plant litter[J]. Nature Communications, 2023, 14(1): 6609. DOI:10.1038/s41467-023-42291-6
(  0) 0) |
| [79] |
Wang D, He N P, Wang Q, et al. Effects of temperature and moisture on soil organic matter decomposition along elevation gradients on the Changbai Mountains, Northeast China[J]. Pedosphere, 2016, 26(3): 399-407. DOI:10.1016/S1002-0160(15)60052-2
(  0) 0) |
| [80] |
Singh M, Sarkar B, Biswas B, et al. Relationship between soil clay mineralogy and carbon protection capacity as influenced by temperature and moisture[J]. Soil Biology & Biochemistry, 2017, 109: 95-106.
(  0) 0) |
| [81] |
Jiang X, Wright A L, Wang J, et al. Long-term tillage effects on the distribution patterns of microbial biomass and activities within soil aggregates[J]. Catena, 2011, 87(2): 276-280. DOI:10.1016/j.catena.2011.06.011
(  0) 0) |
| [82] |
Doetterl S, Stevens A, Six J, et al. Soil carbon storage controlled by interactions between geochemistry and climate[J]. Nature Geoscience, 2015, 8: 780-783. DOI:10.1038/ngeo2516
(  0) 0) |
| [83] |
Niu Y L, Li Y, Lou M X, et al. Microbial transformation mechanisms of particulate organic carbon to mineral-associated organic carbon at the chemical molecular level: Highlighting the effects of ambient temperature and soil moisture[J]. Soil Biology & Biochemistry, 2024, 195: 109454.
(  0) 0) |
| [84] |
Hernandez-Soriano M C, Dalal R C, Warren F J, et al. Soil organic carbon stabilization: Mapping carbon speciation from intact microaggregates[J]. Environmental Science & Technology, 2018, 52(21): 12275-12284.
(  0) 0) |
| [85] |
Kristensen J A, Svenning J C, Georgiou K, et al. Can large herbivores enhance ecosystem carbon persistence?[J]. Trends in Ecology & Evolution, 2022, 37(2): 117-128.
(  0) 0) |
| [86] |
Lange M, Eisenhauer N, Sierra C A, et al. Plant diversity increases soil microbial activity and soil carbon storage[J]. Nature Communications, 2015, 6: 6707.
(  0) 0) |
| [87] |
Mosier S, Apfelbaum S, Byck P, et al. Adaptive multi-paddock grazing enhances soil carbon and nitrogen stocks and stabilization through mineral association in southeastern U. S. grazing lands[J]. Journal of Environmental Management, 2021, 288: 112409.
(  0) 0) |
| [88] |
Rui Y C, Jackson R D, Cotrufo M F, et al. Persistent soil carbon enhanced in Mollisols by well-managed grasslands but not annual grain or dairy forage cropping systems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(7): e2118931119.
(  0) 0) |
| [89] |
Wu S L, Konhauser K O, Chen B D, et al. "Reactive Mineral Sink" drives soil organic matter dynamics and stabilization[J]. NPJ Materials Sustainability, 2023, 1: 3.
(  0) 0) |
| [90] |
Rasse D P, Rumpel C, Dignac M F. Is soil carbon mostly root carbon? Mechanisms for a specific stabilisation[J]. Plant and Soil, 2005, 269(1): 341-356.
(  0) 0) |
| [91] |
Burdon J. Are the traditional concepts of the structures of humic substances realistic?[J]. Soil Science, 2001, 166(11): 752-769.
(  0) 0) |
| [92] |
Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528(7580): 60-68.
(  0) 0) |
| [93] |
Feng X J, Wang Y Y, Liu T, et al. Biomarkers and their applications in ecosystem research (In Chinese)[J]. Chinese Journal of Plant Ecology, 2020, 44(4): 384-394. [冯晓娟, 王依云, 刘婷, 等. 生物标志物及其在生态系统研究中的应用[J]. 植物生态学报, 2020, 44(4): 384-394.]
(  0) 0) |
| [94] |
Cotrufo M F, Wallenstein M D, Boot C M, et al. The Microbial Efficiency-Matrix Stabilization(MEMS)framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter?[J]. Global Change Biology, 2013, 19(4): 988-995.
(  0) 0) |
| [95] |
Liang C, Zhu X F. The soil microbial carbon pump as a new concept for terrestrial carbon sequestration (In Chinese)[J]. Scientia Sinica: Terrae, 2021, 51(5): 680-695. [梁超, 朱雪峰. 土壤微生物碳泵储碳机制概论[J]. 中国科学: 地球科学, 2021, 51(5): 680-695.]
(  0) 0) |
| [96] |
Sokol N W, Sanderman J, Bradford M A. Pathways of mineral-associated soil organic matter formation: Integrating the role of plant carbon source, chemistry, and point of entry[J]. Global Change Biology, 2019, 25(1): 12-24.
(  0) 0) |
| [97] |
Witzgall K, Vidal A, Schubert D I, et al. Particulate organic matter as a functional soil component for persistent soil organic carbon[J]. Nature Communications, 2021, 12(1): 4115.
(  0) 0) |
| [98] |
Lünsdorf H, Erb R W, Abraham W R, et al. 'Clay hutches': A novel interaction between bacteria and clay minerals[J]. Environmental Microbiology, 2000, 2(2): 161-168.
(  0) 0) |
| [99] |
Zhu X F, Kong W D, Huang Y M, et al. Soil microbial carbon pump conceptual framework 2.0 (In Chinese)[J]. Chinese Journal of Applied Ecology, 2024, 35(1): 102-110. [朱雪峰, 孔维栋, 黄懿梅, 等. 土壤微生物碳泵概念体系2.0[J]. 应用生态学报, 2024, 35(1): 102-110.]
(  0) 0) |
| [100] |
Faust J C, Tessin A, Fisher B J, et al. Millennial scale persistence of organic carbon bound to iron in Arctic marine sediments[J]. Nature Communications, 2021, 12(1): 275.
(  0) 0) |
| [101] |
Han L F, Sun K, Jin J, et al. Some concepts of soil organic carbon characteristics and mineral interaction from a review of literature[J]. Soil Biology & Biochemistry, 2016, 94: 107-121.
(  0) 0) |
| [102] |
Kleber M, Eusterhues K, Keiluweit M, et al. Mineral–organic associations: Formation, properties, and relevance in soil environments[M]//Advances in Agronomy. Amsterdam: Elsevier, 2015: 1—140.
(  0) 0) |
| [103] |
Sharma S, Jaiswal A, Uttam K N. Determination of chromium(Ⅵ), chromium(Ⅲ), arsenic(Ⅴ), aluminum(Ⅲ), iron(Ⅱ), and manganese(Ⅱ)by colorimetry and surface-enhanced Raman scattering(SERS)using ferulic acid functionalized silver nanoparticles[J]. Analytical Letters, 2022, 55(5): 715-727. DOI:10.1080/00032719.2021.1963269
(  0) 0) |
| [104] |
Gelting J, Breitbarth E, Stolpe B, et al. Fractionation of iron species and iron isotopes in the Baltic Sea euphotic zone[J]. Biogeosciences, 2010, 7(8): 2489-2508. DOI:10.5194/bg-7-2489-2010
(  0) 0) |
| [105] |
Ma W W, Zhu M X, Yang G P, et al. Iron geochemistry and organic carbon preservation by iron(oxyhydr)oxides in surface sediments of the East China Sea and the South Yellow Sea[J]. Journal of Marine Systems, 2018, 178: 62-74. DOI:10.1016/j.jmarsys.2017.10.009
(  0) 0) |
| [106] |
Sirois M, Couturier M, Barber A, et al. Interactions between iron and organic carbon in a sandy beach subterranean estuary[J]. Marine Chemistry, 2018, 202: 86-96. DOI:10.1016/j.marchem.2018.02.004
(  0) 0) |
| [107] |
Lalonde K, Mucci A, Ouellet A, et al. Preservation of organic matter in sediments promoted by iron[J]. Nature, 2012, 483(7388): 198-200. DOI:10.1038/nature10855
(  0) 0) |
| [108] |
Ling L, Zhang W X. Enrichment and encapsulation of uranium with iron nanoparticle[J]. Journal of the American Chemical Society, 2015, 137(8): 2788-2791. DOI:10.1021/ja510488r
(  0) 0) |
| [109] |
Xu Z X, Chen Y X, Wu Z, et al. Bacterial mineralization of chromium-copper spinel with highly performance in electroplating effluent[J]. Water Research, 2023, 242: 120229. DOI:10.1016/j.watres.2023.120229
(  0) 0) |
| [110] |
Herrmann A M, Ritz K, Nunan N, et al. Nano—scale secondary ion mass spectrometry—a new analytical tool in biogeochemistry and soil ecology: A review article[J]. Soil Biology & Biochemistry, 2007, 39(8): 1835-1850.
(  0) 0) |
| [111] |
Li Q, Chang J J, Li L F, et al. Research progress of nano-scale secondary ion mass spectrometry(NanoSIMS)in soil science: Evolution, applications, and challenges[J]. Science of the Total Environment, 2023, 905: 167257. DOI:10.1016/j.scitotenv.2023.167257
(  0) 0) |
| [112] |
Mueller C W, Kölbl A, Hoeschen C, et al. Submicron scale imaging of soil organic matter dynamics using NanoSIMS–From single particles to intact aggregates[J]. Organic Geochemistry, 2012, 42(12): 1476-1488. DOI:10.1016/j.orggeochem.2011.06.003
(  0) 0) |
| [113] |
Wu S L, Bougoure J, Wang J, et al. Nitrogen-rich organic matter formation and stabilization in iron ore tailings: A submicrometer investigation[J]. Environmental Science & Technology, 2023, 57(33): 12325-12338.
(  0) 0) |
| [114] |
Smith D F, Podgorski D C, Rodgers R P, et al. 21 tesla FT-ICR mass spectrometer for ultrahigh-resolution analysis of complex organic mixtures[J]. Analytical Chemistry, 2018, 90(3): 2041-2047. DOI:10.1021/acs.analchem.7b04159
(  0) 0) |
| [115] |
Zeng Q, Huang L Q, Ma J Y, et al. Bio-reduction of ferrihydrite-montmorillonite-organic matter complexes: Effect of montmorillonite and fate of organic matter[J]. Geochimica et Cosmochimica Acta, 2020, 276: 327-344. DOI:10.1016/j.gca.2020.03.011
(  0) 0) |
| [116] |
Hu Z, McKenna A M, Wen K, et al. Controls of mineral solubility on adsorption-induced molecular fractionation of dissolved organic matter revealed by 21 T FT-ICR MS[J]. Environmental Science & Technology, 2024, 58(5): 2313-2322.
(  0) 0) |
| [117] |
Solomon D, Lehmann J, Harden J, et al. Micro- and nano-environments of carbon sequestration: Multi-element STXM–NEXAFS spectromicroscopy assessment of microbial carbon and mineral associations[J]. Chemical Geology, 2012, 329: 53-73. DOI:10.1016/j.chemgeo.2012.02.002
(  0) 0) |
| [118] |
Lv J T, Huang Z Q, Luo L, et al. Advances in molecular and microscale characterization of soil organic matter: Current limitations and future prospects[J]. Environmental Science & Technology, 2022, 56(18): 12793-12810.
(  0) 0) |
| [119] |
Jilbert T, Asmala E, Schröder C, et al. Impacts of flocculation on the distribution and diagenesis of iron in boreal estuarine sediments[J]. Biogeosciences, 2018, 15(4): 1243-1271. DOI:10.5194/bg-15-1243-2018
(  0) 0) |
| [120] |
Murad E. Mössbauer spectroscopy of clays, soils and their mineral constituents[J]. Clay Minerals, 2010, 45(4): 413-430. DOI:10.1180/claymin.2010.045.4.413
(  0) 0) |
| [121] |
Notini L, Schulz K, Kubeneck L J, et al. A new approach for investigating iron mineral transformations in soils and sediments using 57Fe-labeled minerals and 57Fe mössbauer spectroscopy[J]. Environmental Science & Technology, 2023, 57(27): 10008-10018.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


