2. 贵州省农科院农业资源与环境研究所, 贵阳 550006
2. Institute of Agricultural Resources and Environment, Guizhou Academy of Agricultural Sciences, Guiyang 550006, China
土壤动物是指生活中有一段时间定期在土壤中渡过,并且对土壤有一定影响的动物[1],它们主要生活在枯枝落叶下以及土壤表层,其数量庞大且在全球各地广泛分布,是土壤生物多样性的重要组成部分,在土壤生态系统功能中发挥着重要的作用[2-4]。土壤动物主要通过取食、掘穴移动和排泄等方式实现其生态系统功能[5],它们摄食微生物会影响土壤微生物群落结构,进而影响有机质的分解、碳氮循环和植物生长[6-7],破碎并摄食有机残留物会促进有机残留物的分解并间接影响微生物群落结构[8];在土壤中掘穴活动等行为会改变土壤孔隙结构,增强土壤的透气性和保水能力[9-10];土壤动物排泄的粪便也会对土壤理化性质产生影响[11]。土壤动物对环境变化和毒性物质很敏感,通过监测土壤动物群落结构和多样性等指标,可以评估土壤生态系统的健康状况以及毒物的风险程度。目前,已有多种土壤动物被作为模式物种用于土壤环境风险评价中(如跳虫和线蚓)[12-13]。
政府间气候变化专门委员会(Intergovernmental Panel on Climate Change,IPCC)第六次报告预估在今后几十年全球气候变化将持续加剧,地表平均温度将升高,极端高温事件发生的频率和强度以及温度波动的幅度将增加[14]。土壤动物大多属于变温动物,其体温主要受环境温度影响,高温会对土壤动物造成伤害,影响它们的个体表现和健康状况,进而影响种群、群落结构和地理分布,最终改变它们在土壤生态系统中的功能[15-16]。
疏水性有机化合物(Hydrophobic organic compounds,HOCs)是环境中广泛存在的一类化合物,主要来源于化石燃料的不完全燃烧、工业污水和污泥灌溉,常见的HOCs包括多环芳烃和多氯联苯等[17]。众多研究表明,HOCs具有致癌和致突变的特性[18-19]。它们在自然界中降解缓慢,会随着雨水和大气沉降等方式进入土壤,由于其亲脂性,HOCs会吸附在土壤有机质上,进而在土壤中长期积累,土壤正逐渐成为HOCs的汇[20-21]。土壤中的HOCs从有机质上解吸下来,被土壤动物吸收并在体内积累,对它们产生毒害作用,影响它们的生命活动,导致土壤动物的生态功能受到影响,并通过食物链的富集和放大作用对整个土壤生态系统的稳定造成危害[22-23]。
在自然界中,土壤动物会受到高温和HOCs的胁迫,这两者通常会以联合作用的方式对土壤动物产生影响。然而,大部分有关HOCs环境风险评价的研究并未考虑温度的影响,导致HOCs环境风险评价结果偏高或偏低[24-26]。近年来,越来越多的学者意识到这一点,并开展了温度和HOCs对土壤动物的联合效应研究,但目前研究集中在对供试土壤动物个体、种群水平的影响,例如供试物种的生长发育和繁殖,对土壤动物体内代谢变化与响应机理等鲜有报道。因此,本文详细综述了高温与HOCs对土壤动物影响的研究,尤其关注在不同温度场景下HOCs对土壤动物的作用,以及这两种应激源对土壤动物联合作用的机制,同时还探讨了这些研究对于环境风险评价的意义及重要性,旨在提升对自然界中HOCs的认知,为改进现有的环境风险评价方法提供依据,这对于更好地评估土壤生态系统健康状况以及人类活动对生态系统的潜在风险具有重要意义,有助于在全球气候变化背景下制定更加科学有效的土壤保护和管理策略。
1 高温对土壤动物的影响温度是影响生态系统中变温动物的主要因子之一,动物体内的生化反应、代谢活动和生理功能等都受到温度的影响。当温度升高超过动物体的最适宜温度(Thermal optimum,Topt)范围时,动物体会受到温度胁迫并对其产生损伤,包括膜损伤、线粒体损伤等。然而,动物体能调节体内的代谢来抵御温度升高带来的热损伤,如热激蛋白的上调表达,但这会消耗动物体额外的能量,导致用于动物体生长繁殖的能量减少,动物体生长繁殖受阻[27]。
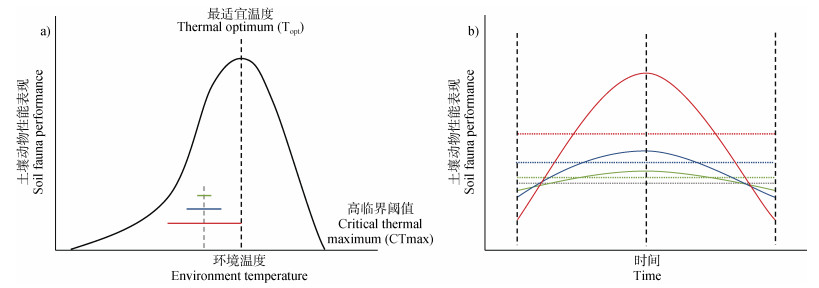
1.1 平均温度升高对土壤动物的影响温度是影响土壤动物表现的重要因子。土壤动物的综合性能表现(如生长发育、繁殖能力和代谢速率等)与环境温度的关系可以用温度表现曲线(Temperature performance curves,TPCs,图 1a)来描述:当环境温度低于动物体的Topt时,土壤动物的综合性能表现会随着温度的升高逐渐升高,在Topt时达到最大值,之后随着温度升高,综合性能表现将急剧下降,当环境温度超过高临界阈值(Critical thermal maximum,CTmax)时,土壤动物的综合性能表现降至零点,此时,过高的温度将导致死亡率超过繁殖或发育的速度[28-29]。因此,高温对土壤动物的影响主要取决于物种的Topt以及环境温度在TPCs上的位置。
|
注:a)图彩色线代表相同平均温度不同波动幅度的波动温度,灰色线代表恒定温度;b)图彩色实线代表不同幅度的波动温度下土壤动物性能表现,彩色虚线代表对应温度状态下土壤动物性能表现均值,灰色虚线代表恒定温度下土壤动物性能表现,不同颜色代表的温度状态均与a)图对应,波动温度由波动低温升至波动高温再降至波动低温为一个完整循环。 Note: a)The color line represents the fluctuating temperature of the same average temperature with different fluctuations, and the gray line represents the constant temperature; b)The solid color line represents the performance of soil fauna under fluctuating temperatures of different amplitude, the dashed color line represents the average performance of soil animals under corresponding temperature conditions, and the dashed gray line represents the performance of soil fauna under constant temperature conditions. The temperature states represented by different colors are all corresponding to Figure a, and the fluctuating temperature is a complete cycle from fluctuating low temperature to fluctuating high temperature and then decreasing to fluctuating low temperature. 图 1 土壤动物温度表现曲线(据Colinet等[39]修改) Fig. 1 Temperature performance curve of soil fauna(Modified from Colinet et al[39]) |
由于全球变暖加剧,环境温度可能会高于Topt甚至达到CTmax,此时高温会对土壤动物造成热损伤,导致综合性能表现急剧下降甚至死亡。首先,高温会引起细胞膜的热扰动,细胞膜的磷脂双分子层会从液晶状态变为倒六边形,导致细胞膜的流动性和通透性增加[30]。同时,热扰动会导致膜蛋白的变性失活,使其失去原有的功能,其中包括离子通道和受体的失活[31]。这一过程会使细胞内外离子和分子的交换失衡,影响细胞的正常功能。细胞膜通透性的增加则会加剧离子的外泄,对神经系统产生不良影响[32]。此外,由于细胞内离子和营养物质运输通道的功能受损,细胞能量供应会减少,线粒体的功能将受到影响[33],这一过程会干扰细胞内的生物电位传导,最终影响细胞信号传递和调节。这些复杂的热损伤过程相互作用,导致细胞代谢和内部稳态被破坏,进而造成细胞甚至个体死亡[34]。然而,土壤动物会通过调控体内代谢活动来抵御高温胁迫。某些蛋白合成通道将被关闭,以便将能量分配用于合成热休克蛋白(Heat shock proteins,HSPs)修复损伤,个体用于保持健康所需要的能量供应将减少,生长繁殖等将受到负面影响。
高温导致的热损伤会影响个体的生存发育和繁殖,这些影响最终会转化为种群特征和群落结构的变化[15,35]。Xie等[36]将5种土壤跳虫暴露于32~36 ℃的恒定高温后发现所有跳虫都出现了繁殖延迟现象,且其中2种跳虫繁殖率下降了40%左右;Dai等[37]比较了7种恒定温度条件对土壤线蚓(Enchytraeus albidus,Topt 19.2 ℃)种群增长速率的影响,当温度低于Topt时,生物量随温度升高呈指数增长,在19 ℃左右达到峰值,之后在22~25 ℃时迅速下降;Cole等[38]的研究也证实,高温条件下蚯蚓的死亡率将上升70%左右,且几乎不会进行繁殖活动,进而导致蚯蚓的种群密度显著降低。总体而言,高温环境下,繁殖率会降低,导致年轻个体数量减少,成年个体存活率也会降低,进而导致物种数量减少甚至局部地理区域灭绝。处于同一生态位或营养级的不同物种间耐热性差异会改变物种间的相对优势和种间竞争,导致生态位分配变化[15]。这些变化最终会导致土壤生态系统的多样性和稳定性变化,进而影响土壤生态系统的功能和健康,对农业生产与发展产生不良影响(如土壤动物对植物生长的促进作用降低、作物减产,病虫害爆发等)。
1.2 热浪对土壤动物的影响虽然平均温度升高和热浪均与气候变暖有关,但它们的时间尺度和影响范围不同。平均温度升高是对几十年的气温数据统计而得到的,是全球气候变暖的主要表现之一,热浪则是指局部地区在较短时间内出现的极端高温事件。根据IPCC第六次评估报告显示,当全球平均温度升高1.5、2和4 ℃时,热浪的频率将分别增加4.1倍、5.6倍和9.4倍,强度将分别增加1.9、2.6和5.1 ℃[14]。热浪没有一个通用的严格定义,常被描述为温度高于某一阈值的一段极端高温时期[40-41]。该定义描述的是单一热浪,然而,自然条件下,热浪发生时环境温度会不规则的波动,伴有多次极端高温,因此,土壤动物通常暴露在一系列热浪下而不是单一的热浪中,并且热浪对土壤动物的影响通常是负面的,这是因为热浪的温度几乎都会超过土壤动物的Topt[42]。
如前文所述,温度通过对细胞膜的热扰动以及消耗能量等方式对土壤动物造成损伤。土壤动物将启动包括合成HPS70在内的防御机制来修复损伤,并通过减少非必要的活动来维持体内的能量供求平衡[43]。然而,如果温度异常高或高温持续时间过长,土壤动物的防御机制可能无法完全抵消高温带来的负面影响,导致热损伤的积累。而在相邻热浪的间隔期,为土壤动物提供了一个关键的恢复窗口。在这段时间里,土壤动物可以通过减少代谢活动、加强细胞修复机制或调整行为模式等方式来减轻高温造成的生理压力,从而恢复热浪引起的损伤。这种恢复过程对土壤动物来说至关重要,因为这使它们能够修复由上一次热浪引起的损伤,并为可能到来的下一次热浪做好准备[44-45]。因此,热浪对土壤动物的影响不仅取决于温度的极值和持续时间,还受到热浪间隔期长度的显著影响[46]。在两次热浪间隔期足够长时,土壤动物的恢复能力可以有效地修复热损伤,避免了负面影响的积累。然而,如果恢复时间不足,热损伤无法及时修复,可能导致个体死亡,甚至造成群落结构和功能的长期变化[44]。
Ma等[47]通过室内试验、田间试验和田间观测相结合的方式,探究了极端高温对三种蚜虫的影响,结果显示极端高温出现的频率和幅度变化均会导致蚜虫群落结构发生显著变化,而这些变化是由高温对不同蚜虫种群影响差异导致的;进一步的研究通过模拟试验控制极端高温(20~35 ℃)和正常温度(13~20 ℃)出现的顺序和比例,探究不同热浪场景对蚜虫的影响,发现当高温天气持续时间增加时,成虫寿命显著减少了33%,繁殖率也显著降低了24%,而当高温天气持续时间不变时,增加正常天气持续时间则会减少热浪对蚜虫的负面影响,并且当高温天气被较长的正常天气间隔开时,高温天气的负面影响会显著降低[44]。在当前气候变化加剧的背景下,可供土壤动物从热损伤中恢复的时间将变得更短,因此,可以预见今后这一极端高温事件将对土壤动物和土壤生态系统造成更加严重的危害。
1.3 日温度波动对土壤动物的影响目前,大多数相关研究集中在恒定高温场景,然而自然条件下温度变化通常具有很强的变异性[48]。日温度波动(即一天内温度的规律性自然变化)的幅度因季节和地理位置而异,如在南极等高纬度地区,波动幅度最大可达15 ℃[49]。炎热季节的沙漠地区气温则始终保持在某些物种的Topt以上[50]。而在温带地区,日温度波动的幅度通常在5 ℃以内。由于TPCs不对称和非线性的特点,当环境温度低于Topt时,在波动温度条件下,土壤动物的综合性能高于与其相同平均温度的恒温条件,且温度波动幅度越大这种差异越显著(如图 1b所示),而环境温度高于Topt时则出现相反的情况,这些差异可以用詹森不等式解释[51-53]。因此,日温度波动对土壤动物的影响取决于日温度均值、波动范围和土壤动物的Topt[54]。
在自然条件下,土壤动物经历的日温度波动可以分为升温和降温两个阶段。在升温阶段,环境温度可能会超过Topt,对土壤动物造成热损伤,土壤动物将主动激活防御机制,如合成热激蛋白等,这些是消耗能量的过程,生物体会通过减少一些非必要的活动来维持体内的能量供求平衡[43]。在升温阶段之后,生物体将经历降温恢复阶段,这可能为它们提供了一个补充高能磷酸盐的机会,并可能使生物体完全恢复到正常状态,这一点与热浪对土壤动物的影响机制相似[44,54]。
在动物个体可耐受范围内的波动温度可能会提高土壤动物的表现,波动幅度过大时则可能对土壤动物造成负面影响。Uvarov[55]采用土壤甲螨进行了为期14周的试验,对比了2种日温度波动条件与恒温条件对土壤甲螨(Nothrus silvestris,Topt约22 ℃)的影响,结果显示,与恒定温度(15 ℃)相比,适当的温度波动(15 ℃±5 ℃)使甲螨繁殖率提高了80%左右,而当温度波动幅度较大时(15 ℃±10 ℃),几乎不存在繁殖行为;Calazans等[56]探究了日温度波动对热带山地蚂蚁群落结构的影响,结果显示温度对蚂蚁物种丰富度有显著影响,日温度波动变化导致耐热物种与不耐热物种在觅食模式上的差异,当温度波动超过可以耐受的临界值时,低耐热性物种的生长和生存将受到负面影响,后代生理性能显著降低[56-57]。随着气候变化加剧,日温度均值和波动幅度会增大,可以预测土壤动物将受到的更严重的热损伤,个体生长繁殖等将受到负面影响,土壤动物种群、群落甚至土壤生态系统也会受到影响[39]。此外,在极端高温条件下的波动可能达到不可逆阈值,造成无法修复的热损伤,一些研究表明,当温度波动至不可逆阈值附近时,即使持续时间很短或者只发生一次,也可能对土壤动物的表现和生存造成极大的负面影响[48,53]。
2 HOCs对土壤动物的影响人类工业活动产生的各种HOCs被排放到环境中,通过雨水和大气沉降等途径在土壤中汇集并在土壤有机质上吸附,在某些污染严重的地区,土壤中HOCs最高浓度可超过2600 mg·kg-1[58]。土壤动物可以通过土壤孔隙水、空气或与土壤颗粒直接接触三种途径吸收土壤中的HOCs,其吸收途径取决于化合物的疏水性强弱、生物体的脂质含量以及土壤含水率,但最主要的吸收途径是通过土壤孔隙水[59-61]。首先,土壤中的HOCs会从土壤有机质上解吸下来并溶解在土壤孔隙水中,之后通过被动扩散的方式经由表皮进入土壤动物体内,这个过程可以看作是土壤有机质与孔隙水以及孔隙水与土壤动物有机组分(主要是脂类组分)之间HOCs浓度的平衡分配(图 2)[59,62]。

|
图 2 HOCs进入土壤动物体内过程(据Spurgeon等[72]修改) Fig. 2 Process of HOCs enters soil faunas(Modified from Spurgeon et al[72]) |
由于其亲脂性,HOCs进入土壤动物体内后它们会在脂质、膜磷脂等组织中富集,造成组织损伤、代谢紊乱和神经损伤,这种不与特定受体结合的毒害机制也被称作“麻醉”[63-64]。此外,HOCs还会诱导细胞内的氧化应激反应,导致细胞内活性氧水平上升,对细胞和组织造成氧化损伤[65]。这些不良影响会阻碍土壤动物的活动,影响土壤生态系统功能。为减少这些毒害作用,土壤动物会激活自身的防御机制,主要包括解毒和抗氧化过程。动物体内的细胞色素P450加氧酶会将HOCs代谢为毒性较小的水溶性代谢物,谷胱甘肽S-转移酶会与这些代谢物共轭,通过转运蛋白将其排出动物体外,这是土壤动物的解毒过程[66-67]。动物体内的超氧化物歧化酶和过氧化氢酶等抗氧化酶会利用氧化还原作用将过氧化物转化为毒害较低或无害的物质,从而使土壤动物免受氧化应激损伤,这是土壤动物的抗氧化过程[64]。然而,解毒和抗氧化过程都需要消耗额外的能量,土壤动物需要在防御机制与生长繁殖之间进行能量权衡[68]。
不同HOCs对土壤动物的毒害效应因其作用器官不同而有所不同,例如:芘和芴会在土壤跳虫细胞膜中积累,导致细胞膜的流动性和通透性增加,从而影响其生理代谢功能[69];多氯二苯并对二噁英和二苯并呋喃(PCDD/Fs)在蚯蚓体内脂质结构中积累,导致活性氧增加,引起氧化应激,导致肠道内壁和相邻组织的损伤[70];菲也会诱导蚯蚓体内活性氧的生成,导致脂质过氧化,使蚯蚓的总抗氧化能力降低,从而引起细胞毒性[71]。
3 高温与HOCs对土壤动物的联合作用HOCs对土壤动物的毒性会受到高温的影响,土壤动物耐高温的能力也会因为HOCs的毒性而降低[25,73]。当温度高于Topt时,HOCs的毒性会因为高温而被放大,这被称为气候诱导的毒物敏感性(Climate-induced toxicant sensitivity,CITS)[25]。其内在机制包括以下几点:首先,HOCs在土壤有机质与孔隙水以及孔隙水与土壤动物之间存在两个平衡分配过程,且这两个过程均受温度影响。高温会加快HOCs在土壤有机质上的解吸速率,使孔隙水中HOCs浓度增大,高温还会加快孔隙水中的HOCs向土壤动物体内扩散的速率,最终导致更多的HOCs由外界进入土壤动物体内[74-75]。其次,对动物体内而言,高温会加快土壤动物的基础代谢速率,增加细胞膜的流动性和通透性,进一步导致动物体内更高的HOCs浓度[15,34]。最后,高温下土壤动物的代谢能量成本会增加,维持功能的能量需求会增加,如高温会降低线粒体膜的功能,导致合成三磷酸腺苷的效率降低,合成HSP70修复损伤也会消耗额外的三磷酸腺苷,这些会减少用于应对HOCs的能量分配[33,76]。在全球气候变暖的背景下,土壤动物应对气候变化的能量成本将更高,气候引起的毒物敏感性会较预计的更强[39,48]。HOCs可能会降低土壤动物的耐热性,这被称为毒物诱导的气候敏感性(Toxicant-induced climate sensitivity,TICS)[25]。其机制可以用以下两点解释:首先,生理防御机制应对任何类型的应激源都需要能量成本,这会减少用于应对额外应激源的能量[77]。例如激活防御机制对HOCs进行解毒和转移需要消耗额外的能量,这将减少用于应对高温胁迫的HSP70合成的能量。此外,土壤动物耐高温的能力还取决于细胞膜流动性变化的能力,而HOCs会进入到细胞膜中,改变其流动性,使土壤动物的耐热性下降[30,34,78]。如前文所述,气候变暖导致的一系列气温变化会使土壤动物对HOCs更加敏感,这会导致用于应对HOCs的能量需求增大,土壤动物应对高温的能量需求和供应之间的不平衡会更早发生,进一步导致耐热性降低。这一点与CITS的能量机制相似,即CITS与TICS通常与应对不同应激源的能量分配权衡有关,并且它们存在耦合作用的关系[77]。
不同高温场景和HOCs对土壤动物的联合作用结果可能不同,可以使用零模型来判断高温和HOCs对土壤动物联合作用的结果。当预测组合效应等于预测单个效应之和时,定义为加和作用(即两应激源之间无联合作用)。当预测组合效应大于单个效应之和时,则定义为协同作用,相反则是拮抗作用[79-80]。通常采用简单加法模型、乘积模型等零模型来预测两种应激源之间的组合效应,选择正确的零模型对于预测准确性非常重要,乘积模型通常被用来预测具有不同作用方式的两应激源组合对动物体的影响[80-81]。
目前,有关高温与HOCs对土壤动物影响的研究多集中在恒温场景(表 1)。Lima等[82]比较了不同恒温条件下(12~26 ℃)西维因对安德爱胜蚓(Eisenia Andrei,Topt约20 ℃)的毒性作用,结果显示高温增强了西维因的毒性作用,其原因可能与高温促进了蚯蚓代谢,进而导致蚯蚓表皮吸收西维因增多有关;Pontes等[83]将线虫(Diplolaimelloides,Topt约25 ℃)暴露于30和32 ℃恒温与不同浓度的菲时,菲对线虫的负面作用随着温度的升高而增大,这种协同作用被认为与线虫体内酶活性、分子或细胞内通道的变化有关;Bandow等[84]对比了不同恒温与氯氟氰菊酯对两种跳虫(Folsomia candida,Topt 15~21 ℃;Sinella curviseta,Topt 30 ℃)繁殖的影响,发现在暴露于较高的温度时,F. candida对氯氟氰菊酯的反应更加敏感,相比之下,S. curviseta则观察到相反的反应,这可能是由于两种跳虫的Topt不同导致的;Römbke等[85]研究了在不同恒温条件下苯菌灵对蚯蚓(Eisenia fetida)的影响,最终观察到高温条件下苯菌灵的平均毒性低于低温条件下,这可能是苯菌灵或其代谢产物在较高的温度下降解速率增加导致的。
|
|
表 1 高温与HOCs之间联合作用 Table 1 Overview of interaction between high temperature and HOCs |
随着全球气候变化加剧,人们逐渐开始将研究重点转移到热浪与日温度波动对土壤动物的影响上[39,86]。Jensen等[87]将蚯蚓暴露于壬基酚与模拟单一热浪下,使用乘积模型预测其对蚯蚓的综合影响,结果表明壬基酚和热浪对蚯蚓的生存和繁殖存在协同作用,这可能是由于壬基酚在高温期间破坏膜的稳定性以及蚯蚓体内HSP70耗尽所致;Dai等[88]使用乘积模型研究了菲和热浪对土壤跳虫的综合影响,结果表明菲和连续热浪对跳虫生长和繁殖存在负面协同作用,其主要原因是菲和高温均会对跳虫细胞膜造成损害;Johannesen等[89]比较了热浪与两种多环芳烃对线蚓的影响,但结果显示两种多环芳烃与高温之间并无联合作用。Dai等[90]进一步的研究发现,日温度波动的幅度增大与菲对线蚓的繁殖具有协同作用,繁殖的半数影响浓度随着波动幅度的增加而降低,这可能与暴露在高温和化学胁迫下线蚓体内能量分配的权衡有关;Dahl等[91]对比了氯氟氰菊酯与每日温度波动对黑菌虫的影响,结果显示,与恒定温度相比,波动温度与氟氯氰菊酯使成虫行动障碍增加,但高温与氟氯氰菊酯之间没有对黑菌虫表现出显著的联合作用。
将不同温度场景与HOCs对土壤动物联合作用的研究进行了汇总(表 1)。总结而言,高温和HOCs通常会对土壤动物产生协同作用,其潜在机制包括高温改变动物体对HOCs的吸收分布、细胞膜的流动性和功能受到干扰、氧化应激损伤与能量供应失衡等,也有少部分研究观察到相反的结果,即拮抗作用或者无影响,这种差异通常与高温加快了土壤动物体内的代谢解毒速率或较高的温度导致污染物降解加快有关[85,92]。然而,根据最近的一些研究,无法确定污染物与高温之间预期的协同作用也可能与选择了错误的零模型导致对联合作用的识别错误有关[79-80,93]。
4 在环境风险评价中的意义土壤环境风险评价是预测风险源对土壤生态系统产生风险的方法体系,可为风险管控与修复治理提供参考和依据[99]。而土壤动物作为评价土壤状况的指示生物受到学者们的广泛关注,目前已有多种土壤动物被作为模式生物应用到污染土壤环境风险评价中[9,100-101]。常规的风险评价需要根据污染物特性对危害进行识别,一旦发现危害,就需要对污染物在环境中的暴露进行表征,即估算污染物在环境中的预测浓度(Predicted environmental concentrations,PECs)。同时需要对污染物的危害进行表征,这一步需要将受试生物暴露于污染物的一系列浓度,确定污染物的不同浓度可能在生物体中引起的有害影响,即剂量–效应关系,最终推导预测无影响浓度(Predicted no-effect concentrations,PNECs),如果PECs高于PNECs,则认为该污染物存在风险,需要采取降低风险的措施[102]。相关的毒理学试验通常将受试生物在最佳条件下(如温度)暴露于化学污染物,以优化不同处理间的数据结果[101]。高温会改变HOCs对土壤动物的毒性,忽略温度因素得到的结果可能会高估或低估HOCs在自然界的毒性,进而影响环境风险评价结果。为降低这种不确定性,可以搜集更多有关毒物与不同暴露场景的数据,对现有环境风险评价进行补充与改进[102]。因此,开展不同温度场景下HOCs对土壤动物影响的研究,有助于进一步了解HOCs对土壤生态系统的影响,并为HOCs污染土壤的风险评价方法优化提供科学依据。
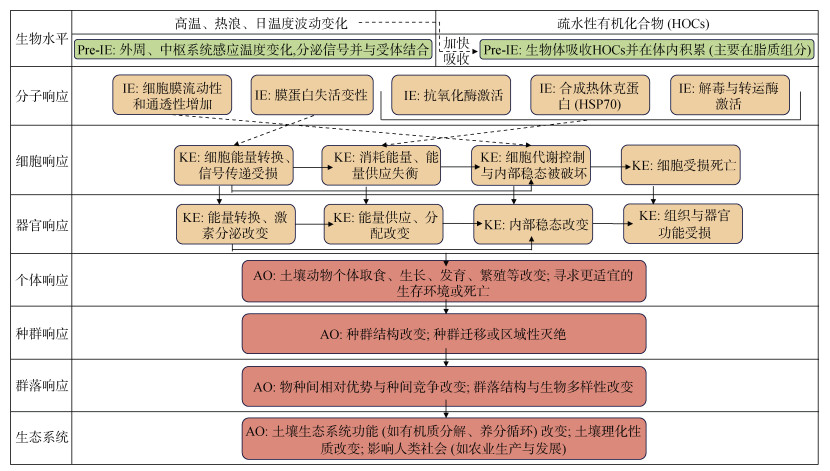
目前研究主要关注高温与HOCs对土壤动物个体生活史特征的影响(如死亡率和繁殖率等),由于不同物种对HOCs和温度的敏感性不同,且受到其他环境因素的影响,难以将这些研究结果统一并应用,但开展所有温度场景和HOCs对所有土壤动物联合作用的研究显然是不现实的。相比之下,机制方面的研究可以更好地解决当前风险评价中的不确定性问题并应用到其他物种[103-104]。随着基因组学和代谢组学等技术的发展,已经能够在细胞和分子水平上了解HOCs和高温对土壤动物的影响,但将这些机制研究的数据用于风险评价过程中存在的一个问题是缺乏通用的模型或工具将低生物水平(如分子、生物化学与细胞反应等)的数据与动物体生活史特征以及更高生物水平(如种群、群落)的变化联系起来并转化为对风险评价有意义的数据[25,68,103]。因此,有必要发展普适性更强的模型和工具,例如:将压力源的影响描述为能量分配变化,将个体变化与分子过程、种群甚至生态系统变化联系起来的动态能量预算(Dynamic Energy Budget,DEB)模型以及基于DEB理论开发的毒代-毒效动力学(Toxicokinetics and toxicodynamics,TK-TD)模型等[105-107]。其中,有害结局路径(Adverse outcome pathways,AOP)是一种将分子启动事件与风险评价相关的不同水平上的负面效应联系起来的概念性机制框架[108]。结合前文所述以及现有研究,将高温与HOCs对土壤动物的影响以有害结局路径的形式进行总结(图 3),这将有助于理解高温与HOCs对土壤动物的联合作用并为风险评价提供参考。
|
IE:启动事件initiating event;KE:关键事件key event;AO:有害结局adverse outcome。 图 3 高温与HOCs对土壤动物的有害结局路径 Fig. 3 Adverse outcome pathways of high temperature and HOCs on soil fauna |
如前文所述,高温会增加土壤动物体内HOCs浓度,加剧HOCs引起的细胞膜流动性和通透性增加,造成热损伤和氧化损伤,土壤动物体内的能量供应将无法同时满足应对高温和HOCs的能量需求,动物体内稳态将被破坏,导致组织和器官损伤。这些负面影响会以协同作用的方式改变土壤动物的生存、生长和繁殖,严重时会导致个体死亡,这些影响会转变为种群与群落结构的影响,最终对土壤生态系统功能造成影响。
5 结论与展望人类活动不断向自然界释放大量化学污染物,其中,疏水性有机化合物(HOCs)因其降解缓慢和潜在毒性备受关注。HOCs在土壤中的强吸附性使其成为最持久广泛的污染物之一。在全球变暖不断加剧的背景下,高温与HOCs通常以协同作用的方式对土壤环境中的生物造成危害,严重威胁土壤动物的多样性及生态功能。高温不仅加速HOCs在土壤中的释放,提高土壤动物的暴露水平,还会影响土壤动物对HOCs的吸收转化,加剧HOCs对土壤动物的毒性效应,导致氧化应激与能量供应失衡,进而影响土壤动物的生存、生长和繁殖。HOCs会削弱土壤动物的耐热性,因为应对HOCs毒性的生理防御机制需要消耗大量能量,导致用于应对高温的能量减少,使其更易受高温伤害。HOCs进入细胞膜后会改变其流动性,进一步降低土壤动物的耐热性。由于忽略温度因素,HOCs对土壤生态系统的风险被低估。为了更准确地了解全球气候变化下HOCs对土壤生态系统的影响,未来的研究需要着重从以下几个方面展开:
1)在当前气候变化的背景下,对土壤中HOCs的风险评价时考虑温度变化的影响尤为必要。温度会直接影响HOCs在土壤动物体内的迁移、转化和生物毒性,缺乏对温度因素的全面了解可能导致对环境风险的低估或误判。因此,迫切需要将温度纳入风险评价框架。目前大多数研究集中在恒定温度场景下,忽略了现实条件的热变异性,进而错误估计了HOCs在自然界中的风险。未来研究应当进一步深入对温度影响机制的解析,尤其是现实温度场景(如热浪和日温度波动)。此外,其他关键因素也应当被重视,如土壤含水率、酸碱度和盐分等,这将有助于更全面地理解环境中HOCs的影响。同时还需考虑土壤动物在不同生存空间中的差异,如土壤表层和深层的差异,表层土壤动物暴露于更高的温度波动和污染物浓度,而深层土壤动物则可能面临更稳定但持续的污染环境。总体而言,多因素综合考虑应成为未来环境风险评价的主要趋势,因为气候变化不仅仅表现为温度的升高,还包括极端天气事件、水资源变化等多方面因素。通过深入研究这些联合作用,可以更准确地预测和评估环境污染物的风险,为制定更有效的环境管理政策提供科学依据。这也将为人类社会在不断变化的气候条件下维护生态平衡提供有力支持。
2)目前,有关现实温度场景和HOCs对土壤动物影响的研究主要集中在个体水平上(如个体生长、发育和繁殖等),但由于不同物种对温度变化和HOCs的敏感性差异,导致难以将现有的数据进行统一并外推到其他未经测试的物种。今后的研究应将重点转移到分子水平的变化(如基因组学和代谢组学变化),这将为解释高温与HOCs的联合作用提供证据,有助于从中推断出通用的理论或模型,进而为环境风险评价提供依据。另一方面,高温和HOCs对更高生物水平的联合作用效果也应当受到重视(如种群、群落等),已有少量研究证实,与个体水平相比,在种群、群落和生态系统水平上,气候变化和化学污染物的协同作用可能更加明显[109-110]。因此,在更高的生物水平上研究高温和HOCs的联合作用也十分重要,这可能揭示比在个体水平上更多的不利影响。
3)有关生态毒理学模型的研究应当受到重视。现有的研究已经从多个层面探究了高温与HOCs对多物种的联合作用,但仍缺乏通用的理论工具和模型将这些数据联系起来进而转化为可用于生态风险评价的数据,需要开发更具普适性的模型或工具(如AOP或TK-TD模型),以整合目前过于多元化的研究结果(如不同温度场景、不同物种、不同污染物),这将有助于更好地理解在全球气候变化条件下HOCs对土壤生态系统的影响。
| [1] |
Yin W Y. Soil fauna in China (In Chinese). Beijing: Science Press, 2000. [尹文英. 中国土壤动物[M]. 北京: 科学出版社, 2000.]
(  0) 0) |
| [2] |
Moradi J, John K, Vicentini F, et al. Vertical distribution of soil fauna and microbial community under two contrasting post mining chronosequences: Sites reclaimed by alder plantation and unreclaimed regrowth[J]. Global Ecology and Conservation, 2020, 23: e01165. DOI:10.1016/j.gecco.2020.e01165
(  0) 0) |
| [3] |
van den Hoogen J, Geisen S, Routh D, et al. Soil nematode abundance and functional group composition at a global scale[J]. Nature, 2019, 572(7768): 194-198. DOI:10.1038/s41586-019-1418-6
(  0) 0) |
| [4] |
Phillips H R P, Guerra C A, Bartz M L C, et al. Global distribution of earthworm diversity[J]. Science, 2019, 366(6464): 480-485. DOI:10.1126/science.aax4851
(  0) 0) |
| [5] |
Fu S L, Liu M Q, Zhang W X, et al. A review of recent advances in the study of geographical distribution and ecological functions of soil fauna diversity (In Chinese)[J]. Biodiversity Science, 2022, 30(10): 150-167. [傅声雷, 刘满强, 张卫信, 等. 土壤动物多样性的地理分布及其生态功能研究进展[J]. 生物多样性, 2022, 30(10): 150-167.]
(  0) 0) |
| [6] |
de Deyn G B, Raaijmakers C E, Zoomer H R, et al. Soil invertebrate fauna enhances grassland succession and diversity[J]. Nature, 2003, 422(6933): 711-713. DOI:10.1038/nature01548
(  0) 0) |
| [7] |
Shen C C, He J Z, Ge Y. Seasonal dynamics of soil microbial diversity and functions along elevations across the treeline[J]. Science of the Total Environment, 2021, 794: 148644. DOI:10.1016/j.scitotenv.2021.148644
(  0) 0) |
| [8] |
Sun X, Li Q, Yao H F, et al. Soil fauna and soil health (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(5): 1073-1083. [孙新, 李琪, 姚海凤, 等. 土壤动物与土壤健康[J]. 土壤学报, 2021, 58(5): 1073-1083.]
(  0) 0) |
| [9] |
Lehman R, Cambardella C, Stott D, et al. Understanding and enhancing soil biological health: The solution for reversing soil degradation[J]. Sustainability, 2015, 7(1): 988-1027. DOI:10.3390/su7010988
(  0) 0) |
| [10] |
Fu S L, Zhang W X, Shao Y H, et al. Soil ecology: Soil food web and its ecological function (In Chinese). Beijing: Science Press, 2019. [傅声雷, 张卫信, 邵元虎, 等. 土壤生态学: 土壤食物网及其生态功能[M]. 北京: 科学出版社, 2019.]
(  0) 0) |
| [11] |
Wu P F, Wang C T. Differences in spatiotemporal dynamics between soil macrofauna and mesofauna communities in forest ecosystems: The significance for soil fauna diversity monitoring[J]. Geoderma, 2019, 337: 266-272. DOI:10.1016/j.geoderma.2018.09.031
(  0) 0) |
| [12] |
Menta C, Remelli S. Soil health and arthropods: From complex system to worthwhile investigation[J]. Insects, 2020, 11(1): 54. DOI:10.3390/insects11010054
(  0) 0) |
| [13] |
George P B L, Keith A M, Creer S, et al. Evaluation of mesofauna communities as soil quality indicators in a national-level monitoring programme[J]. Soil Biology & Biochemistry, 2017, 115: 537-546.
(  0) 0) |
| [14] |
IPCC. Contribution of working group i to the sixth assessment report of the intergovernmental panel on climate change//Climate change 2021: The physical science basis[R]. Switzerland, 2021.
(  0) 0) |
| [15] |
Ma C S, Ma G, Pincebourde S. Survive a warming climate: Insect responses to extreme high temperatures[J]. Annual Review of Entomology, 2021, 66: 163-184. DOI:10.1146/annurev-ento-041520-074454
(  0) 0) |
| [16] |
Jørgensen L B, Ørsted M, Malte H, et al. Extreme escalation of heat failure rates in ectotherms with global warming[J]. Nature, 2022, 611(7934): 93-98. DOI:10.1038/s41586-022-05334-4
(  0) 0) |
| [17] |
Fan Y. Uptake and accumulation of hydrophobic organic contaminants into two plants during the whole life[D]. Guangzhou: University of Chinese Academy of Sciences(Guangzhou Institute of Geochemistry, Chinese Academy of Sciences), 2021.[樊芸. 两种植物生命周期内对疏水性有机污染物的吸收及累积[D]. 广州: 中国科学院大学(中国科学院广州地球化学研究所), 2021.]
(  0) 0) |
| [18] |
Rehman M Y A, Taqi M M, Hussain I, et al. Elevated exposure to polycyclic aromatic hydrocarbons(PAHs)may trigger cancers in Pakistan: An environmental, occupational, and genetic perspective[J]. Environmental Science and Pollution Research, 2020, 27(34): 42405-42423. DOI:10.1007/s11356-020-09088-2
(  0) 0) |
| [19] |
Zhan Y, Wei T T, Ye H B, et al. Distribution, source, and ecological risk evaluation of the PAHs and PCBs in the sediments from Sanya River (In Chinese)[J]. Environmental Science, 2021, 42(4): 1830-1838. [詹咏, 韦婷婷, 叶汇彬, 等. 三亚河沉积物PAHs和PCBs的分布、来源及风险评价[J]. 环境科学, 2021, 42(4): 1830-1838.]
(  0) 0) |
| [20] |
Trellu C, Pechaud Y, Oturan N, et al. Remediation of soils contaminated by hydrophobic organic compounds: How to recover extracting agents from soil washing solutions?[J]. Journal of Hazardous Materials, 2021, 404: 124137. DOI:10.1016/j.jhazmat.2020.124137
(  0) 0) |
| [21] |
Heywood E, Wright J, Wienburg C L, et al. Factors influencing the national distribution of polycyclic aromatic hydrocarbons and polychlorinated biphenyls in British soils[J]. Environmental Science & Technology, 2006, 40(24): 7629-7635.
(  0) 0) |
| [22] |
Armitage J M, Gobas F A P C. A terrestrial food-chain bioaccumulation model for POPs[J]. Environmental Science & Technology, 2007, 41(11): 4019-4025.
(  0) 0) |
| [23] |
Vermeulen F, Covaci A, D'Havé H, et al. Accumulation of background levels of persistent organochlorine and organobromine pollutants through the soil–earthworm–hedgehog food chain[J]. Environment International, 2010, 36(7): 721-727. DOI:10.1016/j.envint.2010.05.006
(  0) 0) |
| [24] |
Holmstrup M, Bindesbøl A M, Oostingh G J, et al. Interactions between effects of environmental chemicals and natural stressors: A review[J]. Science of the Total Environment, 2010, 408(18): 3746-3762. DOI:10.1016/j.scitotenv.2009.10.067
(  0) 0) |
| [25] |
Hooper M J, Ankley G T, Cristol D A, et al. Interactions between chemical and climate stressors: A role for mechanistic toxicology in assessing climate change risks[J]. Environmental Toxicology and Chemistry, 2013, 32(1): 32-48. DOI:10.1002/etc.2043
(  0) 0) |
| [26] |
Wang M P, Hou J, Deng R. Co-exposure of environmental contaminants with unfavorable temperature or humidity/moisture: Joint hazards and underlying mechanisms[J]. Ecotoxicology and Environmental Safety, 2023, 264: 115432. DOI:10.1016/j.ecoenv.2023.115432
(  0) 0) |
| [27] |
Jager T. Making sense of chemical stress: Applications of dynamic energy budget theory in ecotoxicology and stress ecology[M]. 2023.
(  0) 0) |
| [28] |
Dell A I, Pawar S, Savage V M. Systematic variation in the temperature dependence of physiological and ecological traits[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(26): 10591-10596.
(  0) 0) |
| [29] |
Angilletta M J. Estimating and comparing thermal performance curves[J]. Journal of Thermal Biology, 2006, 31(7): 541-545. DOI:10.1016/j.jtherbio.2006.06.002
(  0) 0) |
| [30] |
Hazel J R. Thermal adaptation in biological membranes: Is homeoviscous adaptation the explanation?[J]. Annual Review of Physiology, 1995, 57: 19-42. DOI:10.1146/annurev.ph.57.030195.000315
(  0) 0) |
| [31] |
King A M, MacRae T H. Insect heat shock proteins during stress and diapause[J]. Annual Review of Entomology, 2015, 60: 59-75. DOI:10.1146/annurev-ento-011613-162107
(  0) 0) |
| [32] |
O'Sullivan J D B, MacMillan H A, Overgaard J. Heat stress is associated with disruption of ion balance in the migratory locust, Locusta migratoria[J]. Journal of Thermal Biology, 2017, 68: 177-185. DOI:10.1016/j.jtherbio.2016.04.001
(  0) 0) |
| [33] |
Waagner D, Heckmann L H, Malmendal A, et al. Hsp70 expression and metabolite composition in response to short-term thermal changes in Folsomia candida(Collembola)[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2010, 157(2): 177-183.
(  0) 0) |
| [34] |
Bowler K. Heat death in poikilotherms: Is there a common cause?[J]. Journal of Thermal Biology, 2018, 76: 77-79. DOI:10.1016/j.jtherbio.2018.06.007
(  0) 0) |
| [35] |
Casey G, Shayegh S, Moreno-Cruz J, et al. The impact of climate change on fertility[J]. Environmental Research Letters, 2019, 14(5): 054007. DOI:10.1088/1748-9326/ab0843
(  0) 0) |
| [36] |
Xie L Y, Slotsbo S, Holmstrup M. Tolerance of high temperature and associated effects on reproduction in euedaphic Collembola[J]. Journal of Thermal Biology, 2023, 113: 103439. DOI:10.1016/j.jtherbio.2022.103439
(  0) 0) |
| [37] |
Dai W C, Slotsbo S, Holmstrup M. Thermal optimum for mass production of the live feed organism Enchytraeus albidus[J]. Journal of Thermal Biology, 2021, 97: 102865. DOI:10.1016/j.jtherbio.2021.102865
(  0) 0) |
| [38] |
Cole L, Bardgett R D, Ineson P, et al. Relationships between enchytraeid worms(Oligochaeta), climate change, and the release of dissolved organic carbon from blanket peat in northern England[J]. Soil Biology & Biochemistry, 2002, 34(5): 599-607.
(  0) 0) |
| [39] |
Colinet H, Sinclair B J, Vernon P, et al. Insects in fluctuating thermal environments[J]. Annual Review of Entomology, 2015, 60: 123-140. DOI:10.1146/annurev-ento-010814-021017
(  0) 0) |
| [40] |
Mazdiyasni O, AghaKouchak A, Davis S J, et al. Increasing probability of mortality during Indian heat waves[J]. Science Advances, 2017, 3(6): e1700066. DOI:10.1126/sciadv.1700066
(  0) 0) |
| [41] |
Meehl G A, Tebaldi C. More intense, more frequent, and longer lasting heat waves in the 21st century[J]. Science, 2004, 305(5686): 994-997. DOI:10.1126/science.1098704
(  0) 0) |
| [42] |
Bailey L D, van de Pol M. Tackling extremes: Challenges for ecological and evolutionary research on extreme climatic events[J]. Journal of Animal Ecology, 2016, 85(1): 85-96. DOI:10.1111/1365-2656.12451
(  0) 0) |
| [43] |
Ritchie M E. Reaction and diffusion thermodynamics explain optimal temperatures of biochemical reactions[J]. Scientific Reports, 2018, 8: 11105. DOI:10.1038/s41598-018-28833-9
(  0) 0) |
| [44] |
Ma C S, Wang L, Zhang W, et al. Resolving biological impacts of multiple heat waves: Interaction of hot and recovery days[J]. Oikos, 2018, 127(4): 622-633. DOI:10.1111/oik.04699
(  0) 0) |
| [45] |
Folguera G, Bastías D A, Caers J, et al. An experimental test of the role of environmental temperature variability on ectotherm molecular, physiological and life-history traits: Implications for global warming[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2011, 159(3): 242-246.
(  0) 0) |
| [46] |
Zhang W, Rudolf V H W, Ma C S. Stage-specific heat effects: Timing and duration of heat waves alter demographic rates of a global insect pest[J]. Oecologia, 2015, 179(4): 947-957. DOI:10.1007/s00442-015-3409-0
(  0) 0) |
| [47] |
Ma G, Rudolf V H W, Ma C S. Extreme temperature events alter demographic rates, relative fitness, and community structure[J]. Global Change Biology, 2015, 21(5): 1794-1808. DOI:10.1111/gcb.12654
(  0) 0) |
| [48] |
Paaijmans K P, Heinig R L, Seliga R A, et al. Temperature variation makes ectotherms more sensitive to climate change[J]. Global Change Biology, 2013, 19(8): 2373-2380. DOI:10.1111/gcb.12240
(  0) 0) |
| [49] |
Sinclair B J, Terblanche J S, Scott M B, et al. Environmental physiology of three species of Collembola at Cape Hallett, North Victoria Land, Antarctica[J]. Journal of Insect Physiology, 2006, 52(1): 29-50. DOI:10.1016/j.jinsphys.2005.09.002
(  0) 0) |
| [50] |
Gibbs A G, Perkins M C, Markow T A. No place to hide: Microclimates of Sonoran Desert Drosophila[J]. Journal of Thermal Biology, 2003, 28(5): 353-362. DOI:10.1016/S0306-4565(03)00011-1
(  0) 0) |
| [51] |
Ruel J J, Ayres M P. Jensen's inequality predicts effects of environmental variation[J]. Trends in Ecology & Evolution, 1999, 14(9): 361-366.
(  0) 0) |
| [52] |
Vafeiadou A M, Moens T. Effects of temperature and interspecific competition on population fitness of free-living marine nematodes[J]. Ecological Indicators, 2021, 120: 106958. DOI:10.1016/j.ecolind.2020.106958
(  0) 0) |
| [53] |
Vasseur D A, DeLong J P, Gilbert B, et al. Increased temperature variation poses a greater risk to species than climate warming[J]. Proceedings Biological Sciences, 2014, 281(1779): 20132612.
(  0) 0) |
| [54] |
Vajedsamiei J, Melzner F, Raatz M, et al. Cyclic thermal fluctuations can be burden or relief for an ectotherm depending on fluctuations' average and amplitude[J]. Functional Ecology, 2021, 35(11): 2483-2496. DOI:10.1111/1365-2435.13889
(  0) 0) |
| [55] |
Uvarov A V. Effects of diurnal temperature fluctuations on population responses of forest floor mites[J]. Pedobiologia, 2003, 47(4): 331-339. DOI:10.1078/0031-4056-00197
(  0) 0) |
| [56] |
Calazans E G, da Costa F V, Cristiano M P, et al. Daily dynamics of an ant community in a mountaintop ecosystem[J]. Environmental Entomology, 2020, 49(2): 383-390. DOI:10.1093/ee/nvaa011
(  0) 0) |
| [57] |
Kinzner M C, Gamisch A, Hoffmann A A, et al. Major range loss predicted from lack of heat adaptability in an alpine Drosophila species[J]. Science of the Total Environment, 2019, 695: 133753. DOI:10.1016/j.scitotenv.2019.133753
(  0) 0) |
| [58] |
Eom I C, Rast C, Veber A M, et al. Ecotoxicity of a polycyclic aromatic hydrocarbon(PAH)-contaminated soil[J]. Ecotoxicology and Environmental Safety, 2007, 67(2): 190-205. DOI:10.1016/j.ecoenv.2006.12.020
(  0) 0) |
| [59] |
Belfroid A C, Sijm D T H M, Van Gestel C A M. Bioavailability and toxicokinetics of hydrophobic aromatic compounds in benthic and terrestrial invertebrates[J]. Environmental Reviews, 1996, 4(4): 276-299. DOI:10.1139/a96-015
(  0) 0) |
| [60] |
Mayer P, Holmstrup M. Passive dosing of soil invertebrates with polycyclic aromatic hydrocarbons: Limited chemical activity explains toxicity cutoff[J]. Environmental Science & Technology, 2008, 42(19): 7516-7521.
(  0) 0) |
| [61] |
Wang Y, Slotsbo S, Damgaard C F, et al. Influence of soil moisture on bioaccumulation, growth, and recruitment of Folsomia candida exposed to phenanthrene-polluted soil[J]. Environmental Science & Technology, 2023, 57(8): 3085-3094.
(  0) 0) |
| [62] |
Løkke H, Ragas A M J, Holmstrup M. Tools and perspectives for assessing chemical mixtures and multiple stressors[J]. Toxicology, 2013, 313(2/3): 73-82.
(  0) 0) |
| [63] |
Muijs B, Jonker M T O. Temperature-dependent bioaccumulation of polycyclic aromatic hydrocarbons[J]. Environmental Science & Technology, 2009, 43(12): 4517-4523.
(  0) 0) |
| [64] |
Di Toro D M, McGrath J A, Hansen D J. Technical basis for narcotic chemicals and polycyclic aromatic hydrocarbon criteria. I. Water and tissue[J]. Environmental Toxicology and Chemistry, 2000, 19(8): 1951-1970. DOI:10.1002/etc.5620190803
(  0) 0) |
| [65] |
Bernard F, Brulle F, Dumez S, et al. Antioxidant responses of Annelids, Brassicaceae and Fabaceae to pollutants: A review[J]. Ecotoxicology and Environmental Safety, 2015, 114: 273-303. DOI:10.1016/j.ecoenv.2014.04.024
(  0) 0) |
| [66] |
Roelofs D, Bicho R C, de Boer T E, et al. Mechanisms of phenanthrene toxicity in the soil invertebrate, Enchytraeus crypticus[J]. Environmental Toxicology and Chemistry, 2016, 35(11): 2713-2720. DOI:10.1002/etc.3433
(  0) 0) |
| [67] |
van Gestel C A M, van Belleghem F G A J, van den Brink N W, et al. Environmental toxicology, an open online textbook . Amsterdam: Vrije University Amsterdam, 2019.
(  0) 0) |
| [68] |
Ashauer R, Jager T. Physiological modes of action across species and toxicants: The key to predictive ecotoxicology[J]. Environmental Science Processes & Impacts, 2018, 20(1): 48-57.
(  0) 0) |
| [69] |
Sørensen T S, Holmstrup M. A comparative analysis of the toxicity of eight common soil contaminants and their effects on drought tolerance in the collembolan Folsomia candida[J]. Ecotoxicology and Environmental Safety, 2005, 60(2): 132-139. DOI:10.1016/j.ecoenv.2004.02.001
(  0) 0) |
| [70] |
Roubalová R, Dvořák J, Procházková P, et al. The effect of dibenzo-p-dioxin- and dibenzofuran-contaminated soil on the earthworm Eisenia andrei[J]. Environmental Pollution, 2014, 193: 22-28. DOI:10.1016/j.envpol.2014.05.026
(  0) 0) |
| [71] |
He F L, Liu Q, Jing M Y, et al. Toxic mechanism on phenanthrene-induced cytotoxicity, oxidative stress and activity changes of superoxide dismutase and catalase in earthworm(Eisenia foetida): A combined molecular and cellular study[J]. Journal of Hazardous Materials, 2021, 418: 126302. DOI:10.1016/j.jhazmat.2021.126302
(  0) 0) |
| [72] |
Spurgeon D J, Jones O A H, Dorne J L C M, et al. Systems toxicology approaches for understanding the joint effects of environmental chemical mixtures[J]. Science of the Total Environment, 2010, 408(18): 3725-3734. DOI:10.1016/j.scitotenv.2010.02.038
(  0) 0) |
| [73] |
Orr J A, Vinebrooke R D, Jackson M C, et al. Towards a unified study of multiple stressors: Divisions and common goals across research disciplines[J]. Proceedings Biological Sciences, 2020, 287(1926): 20200421.
(  0) 0) |
| [74] |
Haftka J J H, Govers H A J, Parsons J R. Influence of temperature and origin of dissolved organic matter on the partitioning behavior of polycyclic aromatic hydrocarbons[J]. Environmental Science and Pollution Research, 2010, 17(5): 1070-1079. DOI:10.1007/s11356-009-0263-9
(  0) 0) |
| [75] |
Dai W C, Slotsbo S, van Gestel C A M, et al. Temperature-dependent toxicokinetics of phenanthrene in Enchytraeus albidus(Oligochaeta)[J]. Environmental Science & Technology, 2021, 55(3): 1876-1884.
(  0) 0) |
| [76] |
Sørensen J G, Kristensen T N, Loeschcke V. The evolutionary and ecological role of heat shock proteins[J]. Ecology Letters, 2003, 6(11): 1025-1037. DOI:10.1046/j.1461-0248.2003.00528.x
(  0) 0) |
| [77] |
Verheyen J, Delnat V, Theys C. Daily temperature fluctuations can magnify the toxicity of pesticides[J]. Current Opinion in Insect Science, 2022, 51: 100919. DOI:10.1016/j.cois.2022.100919
(  0) 0) |
| [78] |
Holmstrup M, Bouvrais H, Westh P, et al. Lipophilic contaminants influence cold tolerance of invertebrates through changes in cell membrane fluidity[J]. Environmental Science & Technology, 2014, 48(16): 9797-9803.
(  0) 0) |
| [79] |
Schäfer R B, Piggott J J. Advancing understanding and prediction in multiple stressor research through a mechanistic basis for null models[J]. Global Change Biology, 2018, 24(5): 1817-1826. DOI:10.1111/gcb.14073
(  0) 0) |
| [80] |
Delnat V, Janssens L, Stoks R. Whether warming magnifies the toxicity of a pesticide is strongly dependent on the concentration and the null model[J]. Aquatic Toxicology, 2019, 211: 38-45. DOI:10.1016/j.aquatox.2019.03.010
(  0) 0) |
| [81] |
Bliss C I. The toxicity of poisons applied jointly 1[J]. Annals of Applied Biology, 1939, 26(3): 585-615. DOI:10.1111/j.1744-7348.1939.tb06990.x
(  0) 0) |
| [82] |
Lima M P R, Cardoso D N, Soares A M V M, et al. Carbaryl toxicity prediction to soil organisms under high and low temperature regimes[J]. Ecotoxicology and Environmental Safety, 2015, 114: 263-272. DOI:10.1016/j.ecoenv.2014.04.004
(  0) 0) |
| [83] |
Pontes L P, Vafeiadou A M, de França F J L, et al. Toxic effects of phenanthrene intensify with an increase of temperature for the populations of a free-living nematode[J]. Ecological Indicators, 2021, 120: 106868. DOI:10.1016/j.ecolind.2020.106868
(  0) 0) |
| [84] |
Bandow C, Coors A, Karau N, et al. Interactive effects of lambda-cyhalothrin, soil moisture, and temperature on Folsomia candida and Sinella curviseta(Collembola)[J]. Environmental Toxicology and Chemistry, 2014, 33(3): 654-661.
(  0) 0) |
| [85] |
Römbke J, Garcia M V, Scheffczyk A. Effects of the fungicide benomyl on earthworms in laboratory tests under tropical and temperate conditions[J]. Archives of Environmental Contamination and Toxicology, 2007, 53(4): 590-598. DOI:10.1007/s00244-006-0219-8
(  0) 0) |
| [86] |
Dillon M E, Woods H A. Introduction to the symposium: Beyond the mean: Biological impacts of changing patterns of temperature variation[J]. Integrative and Comparative Biology, 2016, 56(1): 11-13. DOI:10.1093/icb/icw020
(  0) 0) |
| [87] |
Jensen D, Bayley M, Holmstrup M. Synergistic interaction between 4-nonylphenol and high but not low temperatures in Dendrobaena octaedra[J]. Ecotoxicology and Environmental Safety, 2009, 72(1): 10-16. DOI:10.1016/j.ecoenv.2008.03.002
(  0) 0) |
| [88] |
Dai W C, Slotsbo S, Damgaard C, et al. Synergistic interaction between effects of phenanthrene and dynamic heat stress cycles in a soil arthropod[J]. Environmental Pollution, 2019, 254: 113071. DOI:10.1016/j.envpol.2019.113071
(  0) 0) |
| [89] |
Johannesen S T, Holmstrup M, Sorensen J G. High temperature tolerance and heat hardening ability in Enchytraeus albidus Henle, 1837(Oligochaeta)show no interaction with lipophilic organic pollutants[J]. Soil Organisms, 2013, 85(2): 75-83.
(  0) 0) |
| [90] |
Dai W C, Slotsbo S, Xie L Y, et al. Increased daily temperature fluctuations exacerbate the toxicity of phenanthrene in Enchytraeus albidus(Enchytraeidae)[J]. Science of the Total Environment, 2023, 873: 162403. DOI:10.1016/j.scitotenv.2023.162403
(  0) 0) |
| [91] |
Dahl J E, Marti S L, Colinet H, et al. Thermal plasticity and sensitivity to insecticides in populations of an invasive beetle: Cyfluthrin increases vulnerability to extreme temperature[J]. Chemosphere, 2021, 274: 129905. DOI:10.1016/j.chemosphere.2021.129905
(  0) 0) |
| [92] |
Khan M A Q, Ahmed S A, Salazar A, et al. Effect of temperature on heavy metal toxicity to earthworm Lumbricus terrestris(Annelida: Oligochaeta)[J]. Environmental Toxicology, 2007, 22(5): 487-494. DOI:10.1002/tox.20288
(  0) 0) |
| [93] |
Côté I M, Darling E S, Brown C J. Interactions among ecosystem stressors and their importance in conservation[J]. Proceedings of the Royal Society B: Biological Sciences, 2016, 283(1824): 20152592. DOI:10.1098/rspb.2015.2592
(  0) 0) |
| [94] |
Mikkelsen N, Mikkelsen G H, Holmstrup M, et al. Recovery period of Folsomia candida influence the impact of nonylphenol and phenanthrene on the tolerance of drought and heat shock[J]. Environmental Pollution, 2019, 254: 113105. DOI:10.1016/j.envpol.2019.113105
(  0) 0) |
| [95] |
Velki M, Ečimović S. Changes in exposure temperature lead to changes in pesticide toxicity to earthworms: A preliminary study[J]. Environmental Toxicology and Pharmacology, 2015, 40(3): 774-784. DOI:10.1016/j.etap.2015.09.009
(  0) 0) |
| [96] |
de Silva P M C S, Pathiratne A, van Gestel C A M. Influence of temperature and soil type on the toxicity of three pesticides to Eisenia andrei[J]. Chemosphere, 2009, 76(10): 1410-1415. DOI:10.1016/j.chemosphere.2009.06.006
(  0) 0) |
| [97] |
Bednarska A J, Portka I, Kramarz P E, et al. Combined effect of environmental pollutants(nickel, chlorpyrifos)and temperature on ground beetle, Pterostichus Oblongopunctatus(Coleoptera: Carabidae)[J]. Environmental Toxicology and Chemistry, 2009, 28(4): 864-872. DOI:10.1897/08-286R.1
(  0) 0) |
| [98] |
Dai W C, Holmstrup M, Slotsbo S, et al. Heat stress delays detoxification of phenanthrene in the springtail Folsomia candida[J]. Chemosphere, 2023, 311: 137119. DOI:10.1016/j.chemosphere.2022.137119
(  0) 0) |
| [99] |
Li Y J, Xu Q Y, Ke L J, et al. Research on the technical system of ecological risk assessment of soil contamination in Anglo-American and its enlightenments (In Chinese)[J]. Journal of Ecology and Rural Environment, 2024, 40(1): 1-10. [李奕杰, 许秋云, 柯玲杰, 等. 英美土壤污染生态风险评估技术体系研究及启示[J]. 生态与农村环境学报, 2024, 40(1): 1-10.]
(  0) 0) |
| [100] |
Bhowmik A, Kukal S S, Saha D, et al. Potential indicators of soil health degradation in different land use-based ecosystems in the Shiwaliks of northwestern India[J]. Sustainability, 2019, 11(14): 3908.
(  0) 0) |
| [101] |
OECD. Test No. 317: Bioaccumulation in Terrestrial Oligochaetes, OECD guidelines for the testing of chemicals . Paris: OECD Publishing, 2010.
(  0) 0) |
| [102] |
Amiard J C, Amiard-Triquet C. Conventional risk assessment of environmental contaminants[M]//Aquatic Ecotoxicology. Amsterdam: Elsevier, 2015.
(  0) 0) |
| [103] |
Villeneuve D L, Garcia-Reyero N. Vision & strategy: Predictive ecotoxicology in the 21st century[J]. Environmental Toxicology and Chemistry, 2011, 30(1): 1-8.
(  0) 0) |
| [104] |
Mangold-Döring A, Huang A N, van Nes E H, et al. Explicit consideration of temperature improves predictions of toxicokinetic-toxicodynamic models for flupyradifurone and imidacloprid in Gammarus pulex[J]. Environmental Science & Technology, 2022, 56(22): 15920-15929.
(  0) 0) |
| [105] |
Nisbet R M, Muller E B, Lika K, et al. From molecules to ecosystems through dynamic energy budget models[J]. Journal of Animal Ecology, 2000, 69(6): 913-926.
(  0) 0) |
| [106] |
Bart S, Jager T, Short S, et al. Modelling the effects of the pyrethroid insecticide cypermethrin on the life cycle of the soil dwelling annelid Enchytraeus crypticus, an original experimental design to calibrate a DEB-TKTD model[J]. Ecotoxicology and Environmental Safety, 2023, 250: 114499.
(  0) 0) |
| [107] |
Martin T, Thompson H, Thorbek P, et al. Toxicokinetic- toxicodynamic modeling of the effects of pesticides on growth of Rattus norvegicus[J]. Chemical Research in Toxicology, 2019, 32(11): 2281-2294.
(  0) 0) |
| [108] |
Ankley G T, Bennett R S, Erickson R J, et al. Adverse outcome pathways: A conceptual framework to support ecotoxicology research and risk assessment[J]. Environmental Toxicology and Chemistry, 2010, 29(3): 730-741.
(  0) 0) |
| [109] |
Galic N, Grimm V, Forbes V E. Impaired ecosystem process despite little effects on populations: Modeling combined effects of warming and toxicants[J]. Global Change Biology, 2017, 23(8): 2973-2989.
(  0) 0) |
| [110] |
Galic N, Sullivan L L, Grimm V, et al. When things don't add up: Quantifying impacts of multiple stressors from individual metabolism to ecosystem processing[J]. Ecology Letters, 2018, 21(4): 568-577.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


