2. 江苏省农业科学院农业资源与环境研究所/农业农村部长江下游平原农业环境重点实验室, 南京 210014;
3. 江苏大学环境与安全工程学院, 江苏镇江 212001;
4. 南京农业大学资源与环境科学学院, 南京 210014
2. Institute of Agricultural Resource and Environment, Jiangsu Academy of Agricultural Sciences, Key Agricultural Environment Laboratory of the Lower Yangtze River Plain of Ministry of Agriculture and Rural Affairs, Nanjing 210014, China;
3. School of the Environment and Safety Engineering, Jiangsu University, Zhenjiang, Jiangsu 212001, China;
4. College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210014, China
氮是水稻主要的营养元素之一,在水稻的生长发育过程中发挥着重要作用[1]。在人工合成氨发明之前,生物固氮是土壤氮素的重要来源并支撑了作物氮素营养需求。事实上,大气中N2含量高达79%,但以惰性状态存在,难以被植物直接利用,而稻田生物固氮是指固氮微生物利用固氮酶将大气中的分子态氮(N2)还原成氨供植物吸收利用。据估算,生物固氮每年向稻田提供约16%~21%的氮素,是稻田生态系统可持续发展的关键[2-3]。
水稻根际是根系、土壤和微生物相互作用的场所,是农田土壤微生物最为活跃的区域。根系分泌物进入根际环境可能激发一系列物理化学生物反应,导致其固氮微生物与非根际土壤具有显著差异[4]。Wang等[5]基于田间试验发现,根际区土壤中固氮微生物的丰度显著高于非根际区。这可能是由于根际区大量的根系分泌物为微生物生长提供足够碳源和氮源,刺激固氮微生物的生长[6]。然而,根际区土壤固氮微生物功能活性并不一定显著高于非根际区。固氮是一个极端耗能的厌氧微生物过程,根系分泌的氧气会抑制固氮微生物活性,同时,在非根际土壤中,缺氧条件下可能刺激反硝化过程导致硝态氮耗竭进而促进固氮活性[7]。因此,根际与非根际区土壤氧气浓度是影响其土固氮微生物群落结构和功能活性的重要因子。
除氧气之外,碳氮比(C/N)也是影响固氮微生物活性的重要因子[8]。碳氮比越高,土壤氮匮乏越严重,微生物会为了满足自身生长的氮需求进行生物固氮,而秸秆碳氮比约为60︰1至100︰1[9],土壤碳氮比常在10︰1至13︰1之间[10],秸秆还田后通常导致土壤氮匮乏并引发固氮效应。据估算,我国每年秸秆产生量约为8.56 t,还田量约为7.22 t [11]。例如,田间试验表明,与单施化肥相比,秸秆还田配施化肥可以显著提高土壤固氮酶活性[12];与秸秆不还田相比,秸秆还田显著提高了土壤固氮菌的多样性,同时也改变了固氮微生物群落结构[13]。然而,也有报道表明,秸秆还田可有效提高水稻土固氮微生物丰度,但并未显著改变固氮微生物群落多样性[14]。而根际与非根际区作为水稻土壤生物固氮的主要区域,其对不同量秸秆还田的响应规律仍需深入研究。
因此,本研究基于水稻盆栽试验,利用实时荧光定量PCR和高通量测序技术分析不同量秸秆还田条件下水稻根际与非根际区土壤固氮微生物丰度、组成、多样性以及固氮酶活性的变化,旨在揭示水稻根际固氮微生物及其酶活性对秸秆还田的响应规律,从而为农田生态系统中合理秸秆还田提高生物固氮潜力提供理论依据。
1 材料与方法 1.1 供试材料供试土壤为采自江苏省泰州市和江苏省宜兴市的长期稻麦轮作土壤,其中江苏泰州农田属于低肥力的高砂土(GS),是发育于长江冲积层及其古河道沉积的潮土;江苏宜兴农田属于高肥力的黄泥土(HN),是发育于黄土状湖积母质的水稻土。取表层土壤(0~20 cm),室内风干过2 mm筛后装入塑料桶内备用。高砂土、黄泥土基本理化性质分别为:pH 6.79、7.03,有机碳(TOC)10.7、22.9 g·kg–1,全氮(TN)1.15、1.83 g·kg–1,碳氮比9.3、12.5,碱解氮(AN)36.7、168 mg·kg–1,有效磷(AP)27.4、42.2 mg·kg–1,速效钾(AK)260、291 mg·kg–1。供试秸秆为江苏省农业科学院基地成熟小麦秸秆,其碳氮含量分别为475 g·kg–1和4.9 g·kg–1,碳氮比96.9。
1.2 试验设计试验设置3种不同量秸秆还田处理:①秸秆不还田,S0;② 1%秸秆还田(10 g·kg–1,相当于12 t·hm–2),S1;③ 2%秸秆还田(20 g·kg–1,相当于24 t·hm–2),S2,其中秸秆不还田作为对照。每种秸秆还田处理下土壤区域通过根际袋划分为根际区(R)与非根际区(B),处理名称分别为BS0、RS0、BS1、RS1、BS2、RS2,每个处理3个重复。
具体操作过程如下:称取两种类型风干土壤6.0 kg,按以上处理加入相应的秸秆混合均匀。其中1.5 kg装入网孔直径为30 μm的根际袋(直径7.5 cm、高23 cm)内,将根际袋置于PVC桶(内径15 cm、高23 cm)内,同时根际袋外装入4.50 kg的风干土壤。将在珍珠岩上生长1周左右的水稻苗(南梗46)移栽至根际袋中,每袋1株。所有处理施加等量的氮肥(尿素,N 250 mg·kg–1)、磷肥(P2O5 60 mg·kg–1)和钾肥(K2O 100 mg·kg–1),磷肥和钾肥作为基肥一次性施入,氮肥按4﹕3﹕3的比例以基肥、蘖肥、穗肥分3次施入。
1.3 土壤样品采集与测定在水稻成熟期(生长122 d)进行破坏性采样,根际袋内的土壤混合均匀后作为根际土,根际袋外土壤混合均匀后作为非根际土。土壤一部分风干,用于土壤基本理化性质和固氮酶活性的测定;另一部分–80 oC冷冻保存,用于固氮微生物丰度、群落组成与多样性的测定与分析。
土壤pH采用电位法测定(水土比2.5﹕1),TOC采用重铬酸钾氧化法测定,TN采用凯氏定氮法测定,AN采用碱解扩散法测定,AP采用碳酸氢钠浸提—钼锑抗比色法测定,AK采用醋酸铵浸提—火焰光度计法测定[15]。
1.4 土壤总DNA提取及nifH丰度测定根据FastDNA® Spin Kit for Soil试剂盒说明书提取土壤微生物总DNA,用1%琼脂糖凝胶电泳检测提取的DNA片段的大小,并用核酸蛋白测定仪(NanoDrop 2000)测定DNA浓度和质量。采用荧光定量PCR仪(ABI 7500,American),对nifH基因片段进行扩增,每个样品进行三个重复实验。引物为nifH-F(5'-AAAGGYGG WATCGGYAARTCCA CCAC-3')和nifH-R(5'-TTGTTS GCSGCRTACATS GCCATCAT-3')。PCR反应体系为:2×Taq Master Mix 12.5 μL,上、下游引物(10 mol·L–1)各1.0 μL,DNA模板1.0 μL,ddH2O补至25 μL。PCR反应条件:95 ℃预变性2 min;95 ℃ 45 s,55 ℃ 30 s,72 ℃ 60 s,35个循环;72 ℃ 10 min;4 ℃条件下结束。用试剂盒构建克隆文库,筛选阳性克隆子,按照Poly[16]的方法提取重组质粒,以10倍梯度稀释质粒样本构建标准曲线,反应效率从90%到110%,R2值大于0.99,样品与标准曲线的溶解曲线均为单峰。通过标准曲线计算nifH基因拷贝数。
1.5 固氮微生物的高通量测序将提取的土壤微生物总DNA送至上海凌恩生物有限公司,用于Illumina Miseq测序,固氮功能微生物高通量测序所用引物与功能基因定量一致。高通量测序所得原始序列首先经拼接和过滤后去除含错误接头、漏测核苷酸(N)或者连续出现10次以上碱基的序列;再次过滤低质量的序列(含20个以上低质量的碱基),并去除引物。所得的序列随后在凌恩云平台进行分析,计算物种群落组成和多样性。
1.6 土壤固氮酶活性测定土壤固氮酶活性的测定采用酶联免疫吸附测定(ELISA)试剂盒,具体操作如下:往预先包被固氮酶(nitrogenase)抗体的包被微孔中,依次加入标本、标准品、辣根过氧化物酶(HRP)标记的检测抗体,经过温育并彻底洗涤。采用底物四甲基联苯胺(TMB)显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的固氮酶(nitrogenase)呈正相关。利用酶标仪在450 nm波长下测定吸光度(OD值),计算样品浓度。
1.7 统计分析所有数据用Excel记录和整理;采用SPSS 26.0对所测数据进行单因素方差分析,基于Duncan法进行处理间的多重比较和显著性检验(P < 0.05),基于成对样本t检验分析根际效应对3种秸秆还田下nifH基因拷贝数和固氮酶活性的影响;利用R软件(version 4.3.1)基于vegan包进行主坐标分析和典型相关分析,基于pheatmap包绘制固氮微生物优势属与环境因子的相关性热图,基于rfPermute包、randomForest包和A3包进行环境因子影响固氮酶活性的随机森林模型分析;利用STAMP软件分析固氮微生物属水平在根际与非根际之间物种组间差异性。图形绘制采用orgin 2023。
2 结果 2.1 稻田根际与非根际区土壤理化性质两种类型稻田根际与非根际区土壤理化性质对秸秆还田的响应见表 1。由表 1可知,无论根际区还是非根际区,与秸秆不还田相比,秸秆还田显著提高了两种类型稻田土壤TOC和TN含量(P < 0.05),并且随着秸秆还田量的增大,这些性质也逐渐增加了5.42%~32.1%和0.96%~18.3%;同时,秸秆还田显著提高了高砂土C/N,其增幅为1.66%~17.4%(P < 0.05),但并未显著提高黄泥土C/N,而不同量秸秆还田之间稻田根际和非根际区C/N并无显著性差异。研究还发现,秸秆不还田条件下高砂土根际区与非根际区之间TOC和TN含量并无显著性变化,而与非根际相比,黄泥土根际区TOC含量显著降低,但其TN含量显著提高,不过两种类型土壤根际区C/N均显著低于非根际区;秸秆还田条件下,与非根际相比,2%秸秆还田(S2)下高砂土根际区TN含量显著提高,1%秸秆还田(S1)下黄泥土根际区TOC和C/N均显著降低,而S2处理下黄泥土根际与非根际区TOC并无显著性变化,同时,秸秆还田条件下,高砂土根际区TOC和C/N,以及黄泥土根际区TN与非根际区之间也并无显著性变化。
|
|
表 1 秸秆还田对两种类型稻田根际与非根际区土壤理化性质的影响 Table 1 Effect of different amounts of straw returning on physical and chemical properties of rhizosphere and bulk of two types of paddy soils |
对于土壤有效养分(AN、AP和AK)而言,与秸秆不还田相比,无论根际还是非根际区,随着秸秆还田量的增加,两种类型稻田AK含量逐渐增加了24.0%~197%;类似地,两种类型稻田非根际区AN含量显著增加了21.4%~28. 8%,而秸秆还田并未显著改变高砂土根际区AN,但黄泥土根际区AN在S2处理显著增加了约15.7%;同时,秸秆还田也并未显著改变高砂土非根际和根际区AP含量,但S2处理显著提高了黄泥土根际区AP含量,其增加量约33.3%。研究还发现,与非根际区土壤相比,无论秸秆还田与否,两种类型稻田土壤根际区AN和AP并无显著性变化,而根际区AK均有所降低。
对于土壤酸碱度,秸秆还田显著增加了高砂土非根际和根际区土壤pH,以及黄泥土根际区土壤pH,但显著降低了黄泥土非根际区土壤pH。研究还发现,与非根际区相比,高砂土根际区土壤pH均有所增加,但秸秆还田后其增加效应并不显著,而黄泥土根际区pH均低于非根际区,但S2处理下根际与非根际区差异并不显著。
2.2 稻田根际与非根际区土壤固氮微生物丰度两种类型稻田根际与非根际区土壤固氮功能基因nifH丰度对秸秆还田的响应见图 1a。由图 1a可知,与秸秆不还田相比,S1处理并未显著改变两种类型土壤根际区与非根际区nifH丰度,随着秸秆还田量的增加,S2处理下仅高砂土非根际区nifH基因丰度显著增加了约86.2%,而两种类型土壤根际区nifH基因丰度均显著增加了154%~179%(P < 0.05);研究还发现,与非根际区土壤相比,3种不同量秸秆还田下两种类型稻田根际区nifH基因丰度均有所提高,而S2处理下,高砂土和黄泥土根际区nifH基因丰度显著增加了68.3%~101%(P < 0.05)。以上研究结果表明,与非根际土壤相比,两种类型稻田根际区固氮微生物丰度均有所提高,随着秸秆还田量的增加,2%秸秆还田可显著提高根际区固氮微生物丰度。
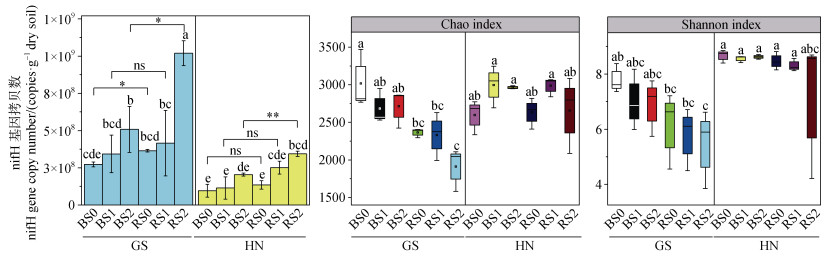
|
注:*表示P < 0.05水平差异显著,**表示P < 0.01水平差异显著,***表示P < 0.001水平差异显著,ns表示P > 0.05。下同。 Note: * indicates a significant difference at P < 0.05, ** indicates a significant difference at P < 0.01, and *** indicates a significant difference at P < 0.001, ns indicates P > 0.05. The same below. 图 1 秸秆还田对两种类型稻田根际与非根际区土壤nifH丰度(a)、α多样性(b、c)的影响 Fig. 1 Effects of straw returning on the abundance of nifH(a)and α diversity(b, c)of nitrogen-fixing bacterias in soil in the rhizosphere and bulk of two types of paddy fields |
秸秆还田对两种类型稻田根际与非根际区土壤固氮微生物α多样性的影响见图 1b、图 1c。由图可知,无论秸秆还田与否,两种类型稻田根际和非根际区土壤固氮微生物α多样性(Chao和Shanno指数)均无显著性变化。与非根际区土壤相比,高砂土根际区固氮微生物Chao 1指数在S0和S2处理下显著降低,Shannon指数则并无显著性变化;而黄泥土根际区土壤固氮微生物α多样性与非根际区之间也不存在显著性变化。以上结果表明,秸秆还田并未显著改变两种类型稻田根际与非根际区固氮微生物α多样性,同时总体而言根际与非根际区固氮微生物α多样性并无显著性差异,仅高砂土根际区Chao 1指数显著低于非根际区。
2.4 稻田根际与非根际区土壤固氮微生物群落组成秸秆还田条件下两种类型稻田土壤的固氮微生物群落组成见图 2。由图 2可知,两种类型稻田土壤固氮微生物在门水平上主要优势物种为厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria),其相对丰度分别为8.12%~36.4%、6.73%~33.4%、11.8%~23.9%、9.21%~24.0%、2.27%~5.36%、1.25%~7.36%,占nifH基因分类群的85.3%。与秸秆不还田相比,秸秆还田提高了两种类型稻田土根际与非根际区Firmicutes相对丰度16.8%~96.9%。(图 2a)。
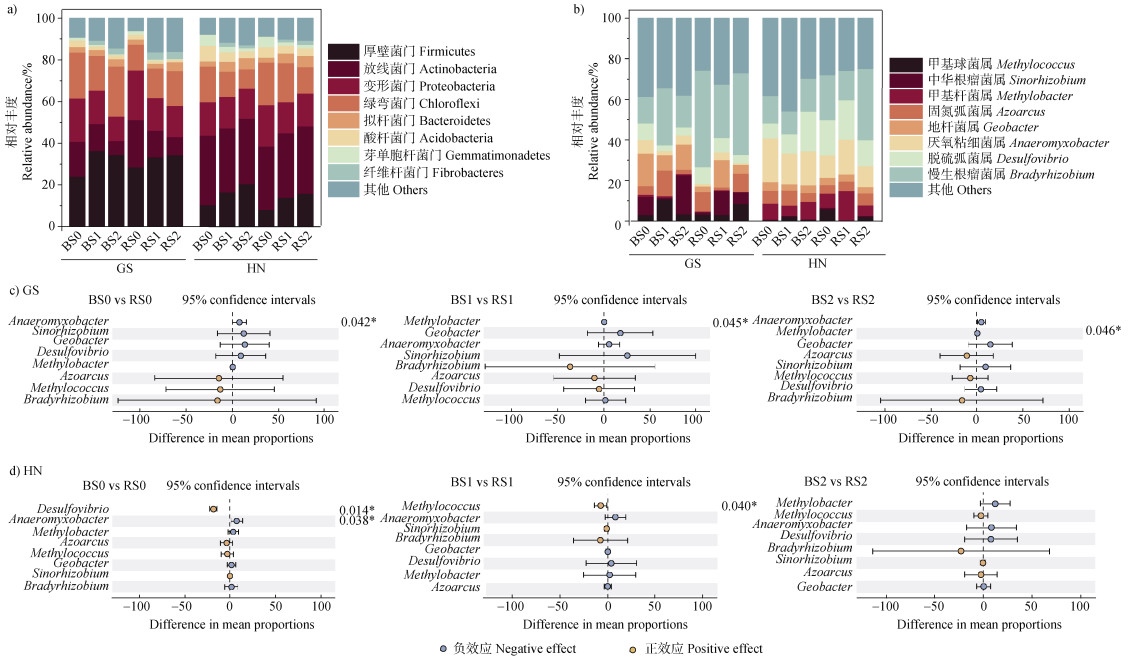
|
图 2 两种类型稻田根际与非根际区土壤固氮微生物门水平(a)和属水平(b)君群落组成以及属水平基于根际效应的差异分析(c、d) Fig. 2 Community composition ofnitrogen-fixing bacteria phyum levels (a) and genus levels (b) betwen rhizosphere and bulk of two types of paddy soil, and analysis of intergroup differences in the genus levels based on rhizosphere effect (c, d) |
在属水平上,两种类型稻田土壤固氮微生物优势属为慢生根瘤菌属(Bradyrhizobium)、脱硫弧菌属(Desulfovibrio)、厌氧粘细菌属(Anaeromyxobacter)、地杆菌属(Geobacter)、固氮弧菌属(Azoarcus)、甲基杆菌属(Methylobacter)、中华根瘤菌属(Sinorhizobium)和甲基球菌属(Methylococcus),其相对丰度分别为11.2%~47.6%、2.83%~19.7%、0.67%~21.5%、2.65%~16.0%、1.38%~12.6%、0.17%~14.4%、0.14%~19.2%、0.33%~10.9%(图 2b)。与秸秆不还田相比,秸秆还田提高了两种类型稻田根际与非根际区Bradyrhizobium和Desulfovibrio相对丰度(砂土非根际区除外)。此外,S2处理显著提高了高砂土根际区Sinorhizobium相对丰度。然而,Anaeromyxobacter、Azoarcus和Geobacter相对丰度随着秸秆还田量的增加呈现降低的趋势(图 2b)。
为明确不同量秸秆还田下根际效应对两种类型稻田土相对丰度的影响,进行两两比较的组间差异分析(图 2c、图 2d)。由此发现,与非根际区土壤相比,3种秸秆还田下两种类型稻田根际区Bradyrhizobium和Azoarcus相对丰度增加,但差异并不显著,同时高砂土根际区Anaeromyxobacter在S0和S2处理下分别显著降低了69.9%和82.2%。此外,黄泥土根际区Methylococcus相对丰度在S1处理和Desulfovibrio相对丰度在S0处理下较非根际区分别显著增加了662%和29.4%(图 2)。
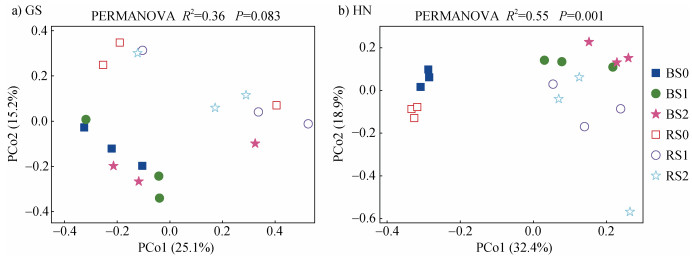
为进一步区别秸秆还田下水稻土壤固氮微生物群落分布特征,对不同量秸秆还田条件下根际和非根际区土壤固氮微生物群落组成进行了主坐标分析(图 3)。结果显示,无论秸秆还田与否,两种类型稻田根际与非根际之间土壤固氮微生物群落具有明显的迁移。然而,无论根际还是非根际土壤,秸秆还田与秸秆不还田条件下高砂土固氮微生物群落均有所重合;对于黄泥土,秸秆还田与秸秆不还田条件下土壤固氮微生物群落出现了明显的分离,但是1%和2%两种不同量秸秆还田处理之间土壤固氮微生物群落组成并无明显迁移。以上结果表明,两种类型稻田根际区土壤固氮微生物群落组成显著不同于非根际区,而秸秆还田显著改变了黄泥土根际区固氮微生物群落组成,并未显著改变高砂土根际区固氮微生物群落组成。
|
图 3 两种类型稻田根际与非根际区土壤固氮微生物主坐标分析(PCoA) Fig. 3 principal coordinate analysis(PCoA)analysis of nitrogen-fixing bacterias(a, b)in soil in the rhizosphere and bulk of two types of paddy fields |
应用典型相关分析(CCA)进一步探究土壤中固氮微生物群落迁移的主要驱动因子,结果见图 4a、图 4b。由图可以看出,土壤pH和TN是显著影响不同秸秆还田条件下高砂土固氮微生物群落迁移的重要因子,第一轴和第二轴的解释量分别为63.8%和36.2%;而TOC、TN、AK是显著影响不同秸秆还田条件下黄泥土固氮微生物群落迁移的重要因子,第一轴和第二轴的解释量分别为53.4%和30.2%。由土壤性质与主要优势属相关性分析(图 4c)发现,Desulfovibrio、Anaeromyxobacter、Methylobacter与TOC、TN、AN、AK、C/N显著正相关(P < 0.05),与pH和AP显著负相关(Desulfovibrio除外);Sinorhizobium与TOC、TN、AN、AK、C/N显著负相关(P < 0.05),与AP显著正相关;Geobacter与TOC、TN呈显著负相关,与AP显著正相关(P < 0.05)。
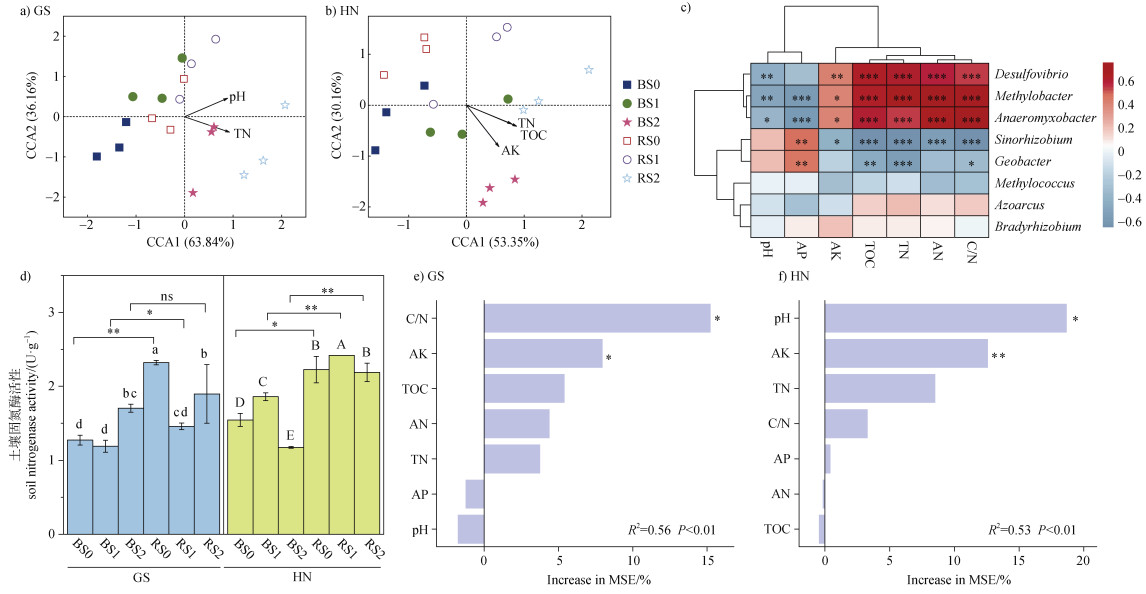
|
图 4 秸秆还田条件下两种类型稻田根际与非根际区土壤固氮微生物典型相关性分析(CCA)分析(a、b),固氮微生物属水平群落组成与环境因子的相关性热图(c),固氮酶活性(d)和随机森林模型分析(e、f) Fig. 4 Canonical correlation analysis (CCA) of soil nitrogen-fixing bacterias in the rhizosphere and bulk of two types of paddy soils under straw returning conditions (a, b), correlation heatmap of genus-level community composition and environmental factors ©, soil nitrogenase activity (d) and random forest model analysis (e, f) |
秸秆还田对两种类型稻田根际与非根际土壤固氮酶活性的影响见图 4d。由图 4d可知,与秸秆不还田(S0)相比,S1处理并未显著改变高砂土非根际区固氮酶活性,S2处理则显著提高了高砂土非根际区固氮酶活性,其比例达33.4%,而两种秸秆还田模式下高砂土根际区固氮酶活性显著降低了约18.3%~37.2%(P < 0.05)。与高砂土所不同,S1处理下黄泥土非根际和根际区固氮酶活性显著提高了8.69%~20.4%(P < 0.05),而S2处理下黄泥土非根际区和根际区固氮酶活性均有所降低。
研究还发现,与非根际区相比,3种不同量秸秆还田模式下两种类型稻田土根际区固氮酶活性均有所提高,仅高砂土S2处理下根际区固氮酶活性升高效应并不显著(P > 0.05)。以上研究表明,与非根际土壤相比,两种类型稻田根际区固氮酶活性均有所提高;秸秆还田显著降低高砂土根际区固氮酶活性,而低量秸秆还田会显著提高黄泥土根际区固氮酶活性,但秸秆还田量过高时,黄泥土根际区固氮酶活性也会有所降低。
采用随机森林模型分析探究土壤环境因子对固氮酶活性的影响(图 4e、图 4f)。可以看出,土壤C/N(15.2%,P < 0.05)和AK(7.95%,P < 0.05)是高砂土固氮酶活性主要影响因子,而土壤pH(18.7%,P < 0.05)和AK(12.6%,P < 0.01)是黄泥土固氮酶活性主要影响因子。
3 讨论 3.1 根际效应对稻田土壤固氮微生物与固氮酶活性的影响根际是土壤和植物根系能量流动和物质交换的直接界面,也是农田土壤微生物最为活跃的区域[17]。已有研究表明,与非根际区相比,根际区土壤具有更高的固氮微生物丰度及其酶活性 [18-19]。本研究也发现,无论秸秆还田与否,两种类型稻田根际区nifH基因丰度和固氮酶活性均有一定程度的提高(图 1a、图 4d)。根际能产生这种效应可能主要有以下两方面原因:一方面,植物根系不断地分泌着各种代谢产物,包括有机酸、糖类、氨基酸、黄酮、生长素、核苷酸、酚酸类、脂肪酸和渊醇、酶类等,为微生物生长提供营养[20-21];另一方面,根表组织陆续地死亡和脱落,改良着周围土壤的物理性质和化学性质,丰富了土壤有机质,从而为微生物的大量增殖创造了条件,使植物根际具有很高的生物活性[19,22]。因此,根际效应通过改善土壤环境和土壤养分含量,提高了固氮微生物丰度及其酶的分泌,进而促进生物固氮。
由于根际效应,根际土壤固氮微生物群落组成也显著不同于非根际区土壤[5]。根际区土壤在根系分泌物的介导下从非根际土壤中招募特定的固氮微生物在根际定殖,可以导致根际土壤固氮微生物多样性有所降低[23]。类似地,本研究发现高砂土根际区Chao 1指数显著低于非根际区,同时,研究还发现Bradyrhizobium、Desulfovibrio、Anaeromyxobacter、Geobacter、Azoarcus是稻田土壤固氮微生物重主要优势属,根际效应显著改变了两种类型稻田固氮微生物群落组成(图 1d、图 1e),其中两种类型稻田根际区土壤Bradyrhizobium和Azoarcus的相对丰度较非根际区是有所增加的。Bradyrhizobium隶属于α-变形菌纲,已被观察到是水稻根系中活跃的固氮细菌,可以促进水稻的生长[24],同时有研究表明Azoarcus的菌株BH72能够大量定殖于水稻根部进行内生固氮[25]。此外,Anaeromyxobacter是Fe(Ⅲ)还原过程的重要参与者,广泛存在于水稻土中,适宜生活在pH 7.0的环境[26]。本研究中,相关性分析显示Anaeromyxobacter相对丰度与pH显著负相关,表明根际效应引起的土壤pH变化可能是调控Anaeromyxobacter生长的主要因素之一。因此,与非根际区相比,高砂土根际区Anaeromyxobacter相对丰度在秸秆不还田和2%秸秆还田下显著降低很可能是由于高砂土根际pH的增加不利于Anaeromyxobacter的生存。
3.2 秸秆还田对稻田土壤固氮微生物的影响农业管理措施是影响土壤中固氮微生物丰度、群落组成和多样性的重要因子[27]。已有研究表明,秸秆还田可以提高土壤固氮微生物丰度[28-29]。本研究中,2%秸秆还田可提高水稻根际和非根际区nifH基因丰度(图 1a)。这很可能是由于秸秆施用增加了土壤有机碳含量,可为土壤微生物生长提供足够的碳源,进而提高了土壤固氮微生物丰度。同时秸秆降解导致土壤中氧气耗竭,形成缺氧厌氧环境,从而影响反硝化过程,刺激固氮的发生[30]。然而,由于作物与微生物对氮素的竞争,与非根际区相比,根际区对氮素需求更高。因此,本研究也发现2%秸秆还田下两种类型稻田根际区nifH基因丰度较非根际区提高更为显著。
虽然两种类型稻田土nifH基因丰度对秸秆还田均有积极的响应,但是高砂土是一种低肥力土壤,没有足够的碳源和氮源,因此,需要更多的固氮微生物来固氮,而黄泥土是一种高肥力土壤,碳源和氮源比较充足,对固氮的需求不如高砂土。因此,高砂土nifH基因丰度整体显著高于黄泥土,而且秸秆还田显著提高了高砂土非根际区nifH基因丰度,但对黄泥土非根际区nifH基因提高效应并不显著。
两种类型稻田土壤中固氮微生物群落组成对秸秆还田的响应也存在差异性。本研究发现,秸秆还田并未改变稻田根际和非根际区土壤中固氮微生物群落α多样性,也并未改变高砂土根际和非根际区固氮微生物群落组成,但显著改变了黄泥土根际和非根际区固氮微生物群落组成。这可能是由于不同类型土壤中微生物可利用的养分含量各不相同,其中土壤可利用氮(如碱解氮)已经被报道是影响微生物群落的重要因子。对于黄泥土,土壤中较高的可利用氮有利于秸秆腐解,可为土壤固氮微生物生长提供碳源和氮源,因此秸秆还田显著改变了黄泥土固氮微生物群落组成。然而,由于高砂土具有较低的可利用氮不利于秸秆腐解,进而秸秆施用后也无法为固氮微生物的生长提供充足的养分,因此秸秆施用并未显著影响高砂土固氮微生物群落组成。
大量研究显示土壤性质是调控土壤固氮微生物丰度与群落结构的重要因素[31-32]。本研究发现,土壤pH和TN是影响秸秆还田条件下高砂土固氮微生物群落分布的重要因子,TOC、TN和AK则是影响黄泥土固氮微生物群落分布的重要因子(图 4a、图 4b)。其中,pH已经被证明是调控土壤固氮微生物群落多样性的重要因子[33-34],TOC、TN和AK等养分作为土壤微生物生长的重要碳源和养分,其含量是影响土壤固氮微生物的重要因子[35-36],此外,由于秸秆具有较高的C/N比值,秸秆还田初期腐烂分解可提高两种类型稻田土TOC,进而引起土壤C/N的提高,导致土壤氮素比较匮乏,可激发土壤生物固氮,影响土壤固氮微生物群落的分布。本研究中土壤C/N与固氮微生物如Desulfovibrio、Anaeromyxobacter、Methylobacter、Sinorhizobium、Geobacter显著相关也进一步表明土壤C/N是秸秆还田后土壤固氮微生物的重要调控因子。
3.3 秸秆还田对稻田土壤固氮酶活性的影响已有研究表明,秸秆施用可通过改变固氮微生物丰度和群落组成,进而调控土壤固氮酶活性,促进土壤生物固氮[37]。本研究发现,1%秸秆还田显著提高了黄泥土非根际和根际区土壤固氮酶活性(图 3d)。这很可能是由于秸秆施用增加了土壤有机碳含量,可为含氮量较高的黄泥土中微生物生长提供足够的碳源,提高固氮微生物丰度(图 1a),进而促进了固氮酶的分泌,提高了土壤固氮酶活性。
然而,土壤固氮酶活性对秸秆还田的响应与固氮微生物丰度并不总是一致。已有研究显示,土壤固氮微生物组成与土壤固氮酶活性更相关[38]。由于固氮基因nifH表达并不一定转化为实际的酶活性,其转录过程受到严格的调节。一些固氮微生物,如Desulfovibrio、Methylobacter这类自养型细菌,因与nifH基因存在同源序列而检测出nifH基因,但一般不参与固氮过程[39]。此外,根瘤菌(Sinorhizobium)只有在与豆科植物共生时才能建立高效的生物固氮体系,而在非豆科植物体系中固氮能力不强[40]。因此,这些微生物属于无效或低效固氮微生物。本研究中2%秸秆还田显著提高了黄泥土非根际区Desulfovibrio和高砂土根际区Sinorhizobium相对丰度,而Desulfovibrio不具有固氮能力,Sinorhizobium固氮能力也不强,因而秸秆还田尽管可提高土壤固氮微生物丰度,但并未提高其固氮酶活性。
研究还发现,尽管2%秸秆还田显著提高了水稻根际和非根际区nifH基因丰度,而其固氮酶活性反而显著降低。已有研究显示土壤性质是调控土壤固氮酶活性的重要因子[41]。本研究也发现,pH和AK是影响黄泥土固氮酶活性的主要贡献因子,2%秸秆还田显著提高了黄泥土非根际和根际区土壤AK含量,而K在维持酶活性和细胞渗透压方面有重要作用[16],K元素的过高可能反而会抑制固氮酶活性。与黄泥土所不同,土壤C/N是高砂土固氮酶活性的最重要贡献因子。对于高砂土,无论秸秆还田量是1%还是2%均显著降低了根际区土壤固氮酶活性(图 4d),这很可能是由于高砂土含氮量较低,高C/N比秸秆还田可造成土壤可利用氮十分匮乏,进而可能会抑制土壤固氮酶的分泌,降低土壤固氮酶活性。
4 结论土壤pH和养分是调控稻田土壤固氮微生物与酶活性的重要因子。水稻根际区通过改善土壤环境和养分含量,提高了固氮微生物丰度、改变了固氮微生物群落组成,进而提高土壤固氮酶活性,促进了稻田土壤生物固氮。秸秆还田主要通过提高土壤有机碳含量,提高土壤C/N,提高了固氮微生物丰度,并改变了固氮微生物群落组成。而土壤固氮酶活性对秸秆还田的响应与固氮微生物丰度并不一致,仅适量秸秆还田可提高高肥力土壤固氮酶活性,秸秆还田量过大或秸秆还田土壤肥力较低时土壤固氮酶活性反而会有所降低。下一步研究可结合水稻整个生育期内固氮微生物及其酶活性的动态变化,进一步揭示秸秆还田对稻田土壤生物固氮的调控机制。
| [1] |
Lee S. Recent advances on nitrogen use efficiency in rice[J]. Agronomy, 2021, 11(4): 753. DOI:10.3390/agronomy11040753
(  0) 0) |
| [2] |
Xie Z B, Zhang Y H, Wang H. Advances and perspectives in paddy biological nitrogen fixation (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(3): 540-546. DOI:10.11766/trxb201912060662 [谢祖彬, 张燕辉, 王慧. 稻田生物固氮研究进展及方向[J]. 土壤学报, 2020, 57(3): 540-546.]
(  0) 0) |
| [3] |
Dai X L, Song D L, Guo Q K, et al. Predicting the influence of fertilization regimes on potential N fixation through their effect on free-living diazotrophic community structure in double rice cropping systems[J]. Soil Biology & Biochemistry, 2021, 156: 108220.
(  0) 0) |
| [4] |
Ding N, Lin H, Zhang X H, et al. Interaction mechanism between root secretion and rhizosphere microorganisms: A review (In Chinese)[J]. Chinese Journal of Soil Science, 2022, 53(5): 1212-1219. [丁娜, 林华, 张学洪, 等. 植物根系分泌物与根际微生物交互作用机制研究进展[J]. 土壤通报, 2022, 53(5): 1212-1219.]
(  0) 0) |
| [5] |
Wang S, Pablo G P, Ye J, et al. Abundance and diversity of nitrogen-fixing bacteria in rhizosphere and bulk paddy soil under different duration of organic management[J]. World Journal of Microbiology & Biotechnology, 2012, 28(2): 493-503.
(  0) 0) |
| [6] |
Hakim S, Naqqash T, Nawaz M S, et al. Rhizosphere engineering with plant growth-promoting microorganisms for agriculture and ecological sustainability[J]. Frontiers in Sustainable Food Systems, 2021, 5: 617157. DOI:10.3389/fsufs.2021.617157
(  0) 0) |
| [7] |
Arth I, Frenzel P. Nitrification and denitrification in the rhizosphere of rice: The detection of processes by a new multi-channel electrode[J]. Biology and Fertility of Soils, 2000, 31(5): 427-435. DOI:10.1007/s003749900190
(  0) 0) |
| [8] |
Zhang Y H, Hu T L, Wang H, et al. Nitrogen content and C/N ratio in straw are the key to affect biological nitrogen fixation in a paddy field[J]. Plant and Soil, 2022, 481(1): 535-546. DOI:10.1007/s11104-022-05654-4?utm_source=xmol&utm_content=meta
(  0) 0) |
| [9] |
Hu J, Guan X J, Liang X H, et al. Optimizing the nitrogen fertilizer management to maximize the benefit of straw returning on early rice yield by modulating soil N availability[J]. Agriculture, 2024, 14(7): 1168. DOI:10.3390/agriculture14071168
(  0) 0) |
| [10] |
Gaudel G, Xing L, Raseduzzaman M, et al. Soil microbes, carbon, nitrogen, and the carbon to nitrogen ratio indicate priming effects across terrestrial ecosystems[J]. Journal of Soils and Sediments, 2024, 24(1): 307-322. DOI:10.1007/s11368-023-03609-5
(  0) 0) |
| [11] |
Sun N, Gao C Y, Ding Y H, et al. Five-dimensional straw utilization model and its impact on carbon emission reduction in China[J]. Sustainability, 2022, 14(24): 16722. DOI:10.3390/su142416722
(  0) 0) |
| [12] |
Tang H M, Li C, Shi L H, et al. Effect of different long-term fertilizer managements on soil nitrogen fixing bacteria community in a double-cropping rice paddy field of Southern China[J]. PLoS One, 2021, 16(9): e0256754. DOI:10.1371/journal.pone.0256754
(  0) 0) |
| [13] |
Liu X Q, Tu S H, Sun X F, et al. Effect of different fertilizer combinations and straw return on microbial biomass and nitrogen-fixing bacteria community in a paddy soil (In Chinese)[J]. Acta Ecologica Sinica, 2013, 33(17): 5210-5218. [刘骁蒨, 涂仕华, 孙锡发, 等. 秸秆还田与施肥对稻田土壤微生物生物量及固氮菌群落结构的影响[J]. 生态学报, 2013, 33(17): 5210-5218.]
(  0) 0) |
| [14] |
Zhang M M, LiuY, Sheng R, et al. Effects of rice straw returning on the community structure and diversity of nitrogen-fixing gene(nifH)in paddy soil (In Chinese)[J]. Chinese Journal of Applied Ecology, 2013, 24(8): 2339-2344. [张苗苗, 刘毅, 盛荣, 等. 稻草还田对水稻土固氮基因(nifH)组成结构和多样性的影响[J]. 应用生态学报, 2013, 24(8): 2339-2344.]
(  0) 0) |
| [15] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [16] |
Poly F, Ranjard L, Nazaret S, et al. Comparison of nifH gene pools in soils and soil microenvironments with contrasting properties[J]. Applied and Environmental Microbiology, 2001, 67(5): 2255-2262. DOI:10.1128/AEM.67.5.2255-2262.2001
(  0) 0) |
| [17] |
Xiong Q Q, Hu J L, Wei H Y, et al. Relationship between plant roots, rhizosphere microorganisms, and nitrogen and its special focus on rice[J]. Agriculture, 2021, 11(3): 234. DOI:10.3390/agriculture11030234
(  0) 0) |
| [18] |
Jin X T, Hu W G, He S B, et al. Diversity of soil nitrogen-fixing microorganisms in Salicornia europaea community of Ebinur Lake wetland during different periods (In Chinese)[J]. Acta Microbiologica Sinica, 2019, 59(8): 1600-1611. [靳希桐, 胡文革, 贺帅兵, 等. 不同时期艾比湖湿地盐角草群落土壤固氮微生物的多样性分析[J]. 微生物学报, 2019, 59(8): 1600-1611.]
(  0) 0) |
| [19] |
Bürgmann H, Meier S, Bunge M, et al. Effects of model root exudates on structure and activity of a soil diazotroph community[J]. Environmental Microbiology, 2005, 7(11): 1711-1724. DOI:10.1111/j.1462-2920.2005.00818.x
(  0) 0) |
| [20] |
Chen H, Tang H Y, Guo J H, et al. Root exudates' roles and analytical techniques progress (In Chinese)[J]. Soils, 2023, 55(2): 225-233. [陈虹, 唐昊冶, 郭家欢, 等. 根系分泌物主要作用及解析技术进展[J]. 土壤, 2023, 55(2): 225-233.]
(  0) 0) |
| [21] |
Huang X F, Chaparro J M, Reardon K F, et al. Rhizosphere interactions: Root exudates, microbes, and microbial communities[J]. Botany, 2014, 92(4): 267-275. DOI:10.1139/cjb-2013-0225
(  0) 0) |
| [22] |
Wu L K, Lin X M, Lin W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates (In Chinese)[J]. Chinese Journal of Plant Ecology, 2014, 38(3): 298-310. [吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3): 298-310.]
(  0) 0) |
| [23] |
Fu X H, Huang Y, Fu Q, et al. Critical transition of soil microbial diversity and composition triggered by plant rhizosphere effects[J]. Frontiers in Plant Science, 2023, 14: 1252821. DOI:10.3389/fpls.2023.1252821
(  0) 0) |
| [24] |
Liu J Y, Peng M J, Li Y G. Phylogenetic diversity of nitrogen-fixing bacteria and the nifH gene from mangrove rhizosphere soil[J]. Canadian Journal of Microbiology, 2012, 58(4): 531-539. DOI:10.1139/w2012-016
(  0) 0) |
| [25] |
Krause A, Ramakumar A, Bartels D, et al. Complete genome of the mutualistic, N2-fixing grass endophyte Azoarcus sp. strain BH72[J]. Nature Biotechnology, 2006, 24(11): 1385-1391.
(  0) 0) |
| [26] |
Li L N, Qu Z, Jia R, et al. Succession of metabolically active Anaeromyxobacter community in flooded paddy soil owing to organic carbon input[J]. Soil Science Society of America Journal, 2022, 86(5): 1169-1181. DOI:10.1002/saj2.20455
(  0) 0) |
| [27] |
Tang H M, Li C, Cheng K K, et al. Effect of different short-term tillage management on nitrogen-fixing bacteria community in a double-cropping paddy field of Southern China[J]. Journal of Basic Microbiology, 2021, 61(3): 241-252. DOI:10.1002/jobm.202000608
(  0) 0) |
| [28] |
Fan H S, Jia S Q, Yu M, et al. Long-term straw return increases biological nitrogen fixation by increasing soil organic carbon and decreasing available nitrogen in rice–rape rotation[J]. Plant and Soil, 2022, 479(1): 267-279. DOI:10.1007/s11104-022-05515-0?utm_source=xmol&utm_content=meta
(  0) 0) |
| [29] |
Duan F Y, Peng P, Yang K P, et al. Straw return of maize and soybean enhances soil biological nitrogen fixation by altering the N-cycling microbial community[J]. Applied Soil Ecology, 2023, 192: 105094. DOI:10.1016/j.apsoil.2023.105094
(  0) 0) |
| [30] |
Yang Y, Long Y, Li S W, et al. Straw return decomposition characteristics and effects on soil nutrients and maize yield[J]. Agriculture, 2023, 13(8): 1570. DOI:10.3390/agriculture13081570
(  0) 0) |
| [31] |
Zhu C, Friman V P, Li L, et al. Meta-analysis of diazotrophic signatures across terrestrial ecosystems at the continental scale[J]. Environmental Microbiology, 2022, 24(4): 2013-2028. DOI:10.1111/1462-2920.15984
(  0) 0) |
| [32] |
Hu J L, Richwine J D, Keyser P D, et al. Nitrogen fertilization and native C4 grass species alter abundance, activity, and diversity of soil diazotrophic communities[J]. Frontiers in Microbiology, 2021, 12: 675693. DOI:10.3389/fmicb.2021.675693
(  0) 0) |
| [33] |
Fan K K, Weisenhorn P, Gilbert J A, et al. Soil pH correlates with the co-occurrence and assemblage process of diazotrophic communities in rhizosphere and bulk soils of wheat fields[J]. Soil Biology and Biochemistry, 2018, 121: 185-192. DOI:10.1016/j.soilbio.2018.03.017
(  0) 0) |
| [34] |
Wang Y S, Li C N, Kou Y P, et al. Soil pH is a major driver of soil diazotrophic community assembly in Qinghai-Tibet alpine meadows[J]. Soil Biology and Biochemistry, 2017, 115: 547-555. DOI:10.1016/j.soilbio.2017.09.024
(  0) 0) |
| [35] |
Li C Y, Li X L, Yang Y W, et al. Degradation reduces the diversity of nitrogen-fixing bacteria in the alpine wetland on the Qinghai-Tibet Plateau[J]. Frontiers in Plant Science, 2022, 13: 939762. DOI:10.3389/fpls.2022.939762
(  0) 0) |
| [36] |
Zheng Y, Liu X Z, Cai Y J, et al. Combined intensive management of fertilization, tillage, and organic material mulching regulate soil bacterial communities and functional capacities by altering soil potassium and pH in a Moso bamboo forest[J]. Frontiers in Microbiology, 2022, 13: 944874. DOI:10.3389/fmicb.2022.944874
(  0) 0) |
| [37] |
Chen K, Li M, Gao M H, et al. Effects of applying maize stover on soil diazotroph community diminish with depth[J]. Applied Soil Ecology, 2022, 179: 104573. DOI:10.1016/j.apsoil.2022.104573
(  0) 0) |
| [38] |
Shiau Y J, Lin Y T, Yam R S W, et al. Composition and activity of N2-fixing microorganisms in mangrove forest soils[J]. Forests, 2021, 12(7): 822. DOI:10.3390/f12070822
(  0) 0) |
| [39] |
Zehr J P, Turner P J. Nitrogen fixation: Nitrogenase genes and gene expression[J]. Methods in Microbiology, 2001, 30: 271-286.
(  0) 0) |
| [40] |
Saikia S P, Jain V. Biological nitrogen fixation with non-legumes: An achievable target or a dogma?[J]. Current Science, 2007, 92(3): 317-322.
(  0) 0) |
| [41] |
Liu Y H, Xu Z H, Bai S H, et al. Non-targeted effects of nitrification inhibitors on soil free-living nitrogen fixation modified with weed management[J]. Science of the Total Environment, 2024, 912: 169005. DOI:10.1016/j.scitotenv.2023.169005
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


