2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
近30年来,高强度农业生产和化肥农药大量施用等不合理的管理措施,导致黑土层下降,中厚层黑土向薄层黑土转变,平均厚度由50~60 cm下降至30 cm左右[1-2]。一般认为,以秸秆还田为核心的保护性耕作可以通过增加外源碳输入保护及提高土壤有机质含量。但随着外源碳的不断输入,氮胁迫导致的土壤有机碳固持能力变弱、土壤有机质加速退化等问题亟需关注[3]。研究黑土有机碳的周转机制及其氮素约束特征具有重要意义。
土壤呼吸是土壤碳库向大气碳库转化的主要途径,也是土壤碳循环中重要过程。外源碳的输入能够增强土壤呼吸及速率[4],并且引发激发效应,强烈影响土壤原有有机碳的矿化[5-6]。大量研究表明,添加葡萄糖等简单化合物所引发的激发效应最为强烈,但其持续时间较短[7-8]。同时,不同类型土壤对外源碳的响应不同,甚至同一土壤不同剖面深度对外源碳的响应也不相同[9-10]。值得注意的是,已知表层土壤本身矿化程度已经远高于底层土壤,但全球碳循环研究中,大多忽视了底层土对外源碳的响应导致全球碳储量和稳定性估算的不确定性[11]。
有机碳固持也是土壤碳循环的关键过程,外源碳输入影响原有土壤有机碳(SOC)的矿化的同时,也会影响土壤SOC的积累,其净效应则反映在土壤有机碳含量变化。有研究表明,外源碳添加导致SOC含量显著下降[12-13],其可能原因是碳添加导致SOC的矿化量大于土壤碳固持。但是,也有研究发现碳输入可能导致SOC急剧增加,尤其以表层SOC的增加最为明显[14-15]。这些不同的结论可归结于不同的机理过程,包括土壤类型差异、碳源有效性,环境变化及微生物群落组成等。研究土壤矿化与固持的平衡点是目前农业固碳减排研究的重要内容[16]。
已有研究认为,氮素添加对土壤碳周转具有重要影响,其可能机制是外源氮素可改变土壤性质、微生物活性与群落组成,进而影响土壤碳周转。事实上,氮素添加对激发效应及土壤有机碳矿化的影响机制极为复杂[17-19]。例如,N矿化理论认为,高碳氮比有利于有机碳矿化,低碳氮比抑制有机碳矿化,这是因为土壤中氮缺乏可能诱导微生物通过矿化有机质来获得无机氮生长的同时促进有机碳矿化[20]。然而,化学计量分解理论认为N添加使土壤碳和氮的输入更符合微生物需求,在适宜化学计量比条件下,微生物活性最高,土壤呼吸增强[21-22]。此外,氮素添加在一定程度上可以促进碳的封存[23],但可能会降低土壤碳库的养分密度、周转时间和抗干扰能力[24]。值得注意的是,也有研究表明,氮含量升高可能降低土壤碳储量[25]。这些相互矛盾的结果很大程度上归因于土壤特性、实验条件、环境因素等差异。
土壤剖面代表了在相当长时间内较为稳定的土壤发生发育过程。微生物的同化(微生物生物量增加)和分解代谢(CO2排放)被认为是土壤有机碳周转的发动机引擎,但随着土壤剖面深度增加有机碳通常显著下降,氮素胁迫下剖面土壤微生物碳代谢过程机制尚不清楚。本研究利用13C标记葡萄糖与硝酸铵培养实验,通过分析土壤呼吸13CO2通量(异化分解)和土壤13C-有机碳(微生物合成代谢)的变化,结合土壤微生物丰度和群落组成的变化,研究典型黑土不同土层微生物碳代谢的氮素限制机制,为微生物碳泵介导的土壤有机碳固持和转化提供科学依据。
1 材料与方法 1.1 样点描述和土壤样本采集土壤样品于2021年7月采自中国科学院梨树试验站保护性耕作研发基地,位于吉林省梨树县大房身乡高家村(43°19’N,124°14’E)。采样点经历多年传统耕作,黑土层下降为薄层黑土(< 30 cm),种植作物以玉米连坐为主。气候属于温带半湿润大陆性季风气候,年平均气温5.8 ℃,年降水量为577 mm,且主要集中在6—8月。
在该地典型的薄层黑土,选择3个采样点,挖掘深1.2 m的土壤剖面,观察土壤剖面,按土壤发生层自下而上每隔10 cm采取每层土层中央的土壤样品。所有采集的样品装袋并在袋内外各备一张标签,注明采样地点、采样深度、编号等信息。采集的样品保存于4 ℃冷藏室备用。从采集的0~100 cm剖面的新鲜土壤样品中选择了0~10 cm(表层,SL)、30~40 cm(中层,ML)、90~100 cm(深层,DL)深度的土壤用于本次实验研究。具体处理如下:收集三个不同层次的新鲜土壤,除去植物根系,石块等杂质,将3个重复样点的土壤等量混合均匀形成一个样品,研磨过2 mm筛后保存于4 ℃冷藏室供土壤培养使用。土壤基本理化性质如表 1所示。
|
|
表 1 不同深度土壤理化性质 Table 1 Characteristics of soil from different layers |
对所采集的三层土壤进行微宇宙培养[26-28],称取8 g土壤于120 mL血清瓶中,设置4个处理:①只添加水(CK);②只添加硝酸铵(N);③只添加葡萄糖(Glu);④添加葡萄糖和硝酸铵(Glu+N)。每个处理设置3个重复,其中葡萄糖为13C6H12O6(13C全标:99%丰度),添加量0.8 mg·g–1;NH4NO3添加量为0.1 mg·g–1。
用蒸馏水配置葡萄糖(0.36 mol·L–1)和硝酸铵(0.1 mol·L–1)溶液,每个样品中加入100 μL对应溶液,使土壤样品保持湿润松散但不结块的状态。添加完成后,瓶口使用橡胶塞和铝盖密封,抽真空3次后充入人工合成空气(79% N2和21% O2),28 ℃培养14 d。分别在3、5、7、14 d监测瓶中CO2浓度变化。需要说明的是,第7天测定CO2浓度后,抽真空以去除瓶中积累的CO2,然后充入人工合成空气。第7天与第14天的气体样本同时用于测定CO2中的13C相对丰度。培养结束后进行破坏性采样,收集土壤样品用于下游分析。
1.3 土壤理化性质测定土壤的pH用水溶液浸提(土︰水=1︰5),pH计测定。CO2含量使用气相色谱测定。土壤样品冷冻干燥,研磨过100目筛,使用CNS元素分析仪(Thermo Fisher Scientific,德国)测定土壤有机碳,使用元素分析–同位素质谱分析联用仪(Thermo Fisher Scientific,德国)测定土壤有机碳13C原子丰度(13C-atom%),使用稳定同位素比值质谱仪(Thermo Fisher Scientific,德国)测定13CO2的13C原子丰度。
1.4 土壤DNA提取与实时荧光定量采用FastDNA® Spin Kit for Soil试剂盒提取土壤微生物总DNA,详细操作步骤参考试剂盒说明书。通过微量紫外分光光度计(NanoDrop ND-1000)测定DNA浓度和纯度,DNA保存于-20 ℃待下游分析。
采用Bio-Rad CFX96实时荧光定量PCR仪进行16S rRNA基因定量。定量反应体系为:10 μLSYBR Premix Ex Taq(Takara),正反向引物各0.5 μL,1 μL DNA模板,8 μL无菌水。定量PCR引物为515F:GTGCCAGCMGCCGCGG;907R:CCGTCAATTCMTTTRAGTTT。反应条件为:95 ℃ 3 min;40×(95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s);72 ℃,5 min[29]。
1.5 高通量测序与测序数据分析将提取的DNA样本进行PCR扩增,得到扩增子用于高通量测序。针对细菌16S rRNA基因,通用引物为515F/907R。PCR反应体系为:2 μL DNA模板,正反向引物各1 μL,25 μL Premix Ex TaqTM(Takara,大连),21 μL灭菌的去离子水。PCR反应程序为:95℃ 3 min,30×(95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s),72 ℃ 10 min。扩增产物使用Cycle Pure Kit试剂盒(Omega,USA)纯化,并用1.2 %的琼脂糖凝胶电泳检测扩增产物,利用Illumina NovaSeq测序平台对16S rRNA基因进行高通量测序。测序数据上传至NCBI Sequence Read Archive中,可通过序列号“PRJNA1085218”获取。
下机数据首先使用QIIME(version 1.9.1)软件将得到的原始测序数据进行拼接、过滤,去除干扰数据,得到有效数据;使用QIIME2(version 2021.4)软件对有效数据通过DADA2流程进行降噪分析,构建特征表feature-table,并统计代表序列rep-sequences,使用Silva138.1数据库进行朴素贝叶斯(Naive Bayes)分类训练,在99%置信度水平下聚类,最终将得到的特征表和代表序列分类和注释分析,得到不同水平下的物种分类信息OTU表。对微生物多样性分析的主要是进行Shannon指数计算与PCoA分析,探究不同样本或组别间群落结构的差异。为进一步挖掘分组样本间的群落结构差异,选用T-test统计分析方法对分组样本的物种组成和群落结构进行差异显著性检验,以火山图形式展示。
1.6 数据处理绝对激发效应(Primed C,mg·kg–1):葡萄糖添加处理中土壤有机碳分解产生的12CO2-C(Cs)与对照处理土壤有机碳分解产生的12CO2-C(Cc)差值:
| $ \text{Primed C= Cs–Cc} $ | (1) |
相对激发效应(PE,%):绝对激发效应与对照处理土壤有机碳分解产生的12CO2-C(Cc)的比值:
| $ \text{PE= primed C/Cc×100%} $ | (2) |
利用Microsoft Excel 2019和IBM SPSS Statistics 24完成基础数据处理,处理之间的差异采用单因素方差分析(one-way ANOVA),P<0.05表示差异显著,平均值采用“平均值±标准差”的形式表示。图表通过Origin软件(OriginPro 2021,美国)进行绘制。
2 结果 2.1 外源碳氮输入对典型黑土剖面土壤有机碳周转的影响土壤有机碳周转主要来自于微生物分解代谢和合成代谢,主要体现在剖面深度和葡萄糖添加是影响黑土微生物呼吸的主要因素。室内培养两周后,微生物呼吸CO2累积排放量(图 1)由高到低分别为表层土壤(192.1 mg·kg–1)、中层土壤(57.8 mg·kg–1)、深层土壤(42.1 mg·kg–1);无机氮添加对黑土剖面微生物呼吸几乎未有任何影响,表层、中层、深层分别为204.5、61.3、43.9 mg·kg–1。与CK对照相比,葡萄糖添加后土壤呼吸显著增加,表层、中层、深层增幅分别为3.2倍、11.3倍、14.5倍;进一步添加无机氮后,表层、中层、深层土壤呼吸分别为839.1、650.0、645.6 mg·kg–1,增幅为3.4倍、10.2倍、14.3倍。
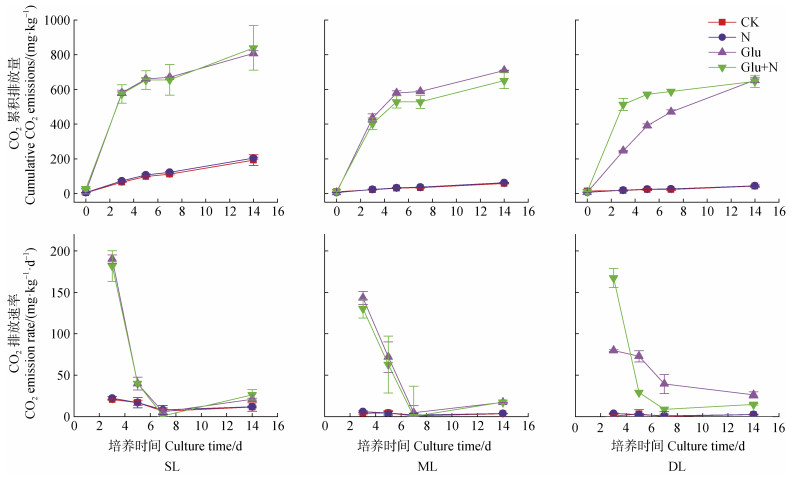
|
图 1 不同土层CO2累积排放量与排放速率 Fig. 1 Cumulative CO2 emissions and emission rates in different soil layers |
值得注意的是,葡萄糖添加条件下,土壤微生物呼吸的氮限制具有明显的剖面分异特征。针对表层土壤,室内两周培养期间均未观测到氮素对土壤呼吸的显著影响;针对中层土壤,无机氮添加似乎抑制了土壤呼吸,降幅范围为7.6%~10.2%(第3天~第14天),但无统计显著差异。深层土壤则出现相反规律,与单一添加葡萄糖相比,氮素添加培养3、5、7 d后,微生物呼吸量显著增加,增幅分别为109.9%、46.0%、25.3%;但是培养14 d的微生物呼吸CO2累积排放量未有显著差异。
进一步计算土壤有机碳矿化速率也得到类似结果。0~3、3~5、5~7、7~14 d的矿化速率如图 1。单一氮素添加对不同深度土壤的有机碳矿化速率均未有显著影响,有机碳矿化速率随培养时间的变化趋势均为0~7 d内降低,7~14 d内略有上升。例如,针对表层土壤,其矿化速率变化为:22.3 mg·kg–1·d–1(0~3 d)、16.8 mg·kg–1·d–1(3~5 d)、8.0 mg·kg–1·d–1(5~7 d)、11.7 mg·kg–1·d–1(7~14 d)。葡萄糖添加后,矿化速率显著增加,氮素添加对表层土壤有机碳矿化速率未有显著影响;抑制了中层土壤有机碳矿化速率(无统计显著性);但对深层土壤规律明显不同,0~3 d内,氮素添加显著促进了有机碳矿化速率,但在随后培养过程中,均呈显著降低趋势。
氮素添加对土壤微生物分解13C-葡萄糖未产生显著影响。如图 2a所示,单一添加葡萄糖培养表层、中层、深层土壤0~7 d内累积CO2的13C百分数别为75.3%、87.3%、88.7%;培养7~14 d则显著下降为28.9%、65.5%、74.7%;结合CO2浓度计算得到13CO2的净排放量(图 2b)分别为530.4、584.3、544.8 mg·kg–1,其中0~7 d排放量分别占0~14 d总排放量的92.3%、86.8%和75.5%。然而,氮素添加对三个土壤剖面的13C-CO2原子百分超均未产生显著影响;并且仅在深层土壤发现,氮素添加显著抑制13CO2净排放量,降幅为44.3%。
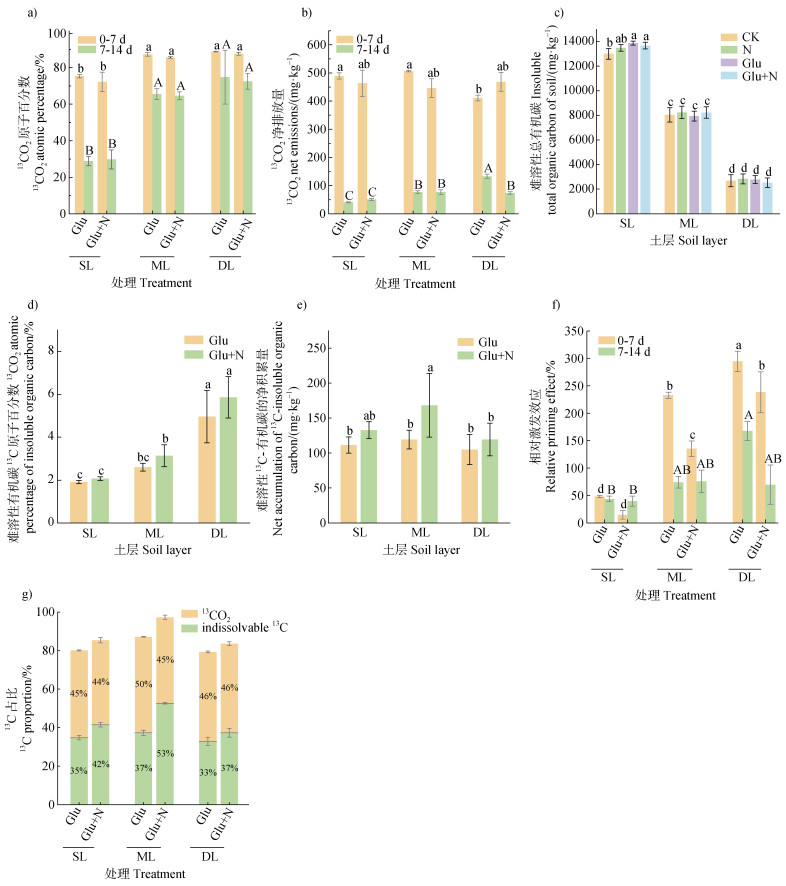
|
图 2 外源碳氮输入下土壤外源有机碳的矿化和固定规律 Fig. 2 Mineralization and fixation of exogenous organic carbon in soil under exogenous carbon and nitrogen input |
氮素添加对土壤微生物利用13C-葡萄糖合成难溶解性有机物13C-SOC也未产生显著影响。13C-SOC特指微生物通过合成代谢繁殖生长并产生的新13C-细胞(13C-有机碳)。如图 2c所示,针对表层土壤,与对照CK相比,葡萄糖Glu和葡萄糖与无机氮Glu+N添加处理,均显著增加了土壤有机碳。但是,无论中层土壤还是深层土壤,所有处理均未对土壤有机碳产生显著影响。单一添加葡萄糖培养14 d后,表层、中层、深层土壤难溶解性13C-SOC原子百分数(图 2d)分别为1.9%、2.6%、5.0%;类似地,氮素添加并未显著影响13C-SOC原子百分数,进一步结合土壤有机碳含量(图 2e),发现单一添加葡萄糖后表层、中层、深层土壤13C-SOC净产生量分别为111.6、119.5、105.2 mg·kg–1,氮素添加后13C-SOC尽管呈上升趋势,但未有统计显著差异。
13C-葡萄糖添加条件下微生物剧烈生长,同时也会利用本底有机碳并产生激发效应。如图 2f所示,随着土壤深度增加,激发效应显著增强。培养0~7 d内,单一添加葡萄糖条件下,土壤相对激发效应由低到高分别为表层土壤48.5%、中层土壤233.0%、深层土壤295.0%。氮素添加则显著抑制了激发效应,降为表层土壤15.0%、中层土壤135.5%、深层土壤238.5%。随着培养时间延长至14 d,相对激发效应显著降低,但仍随土壤深度增加而增加。例如,单一添加葡萄糖的7~14 d相对激发效应分别为表层土壤44.0%、中层土壤74.5%、深层土壤168.0%,氮素添加仅在深层土壤表现出明显的抑制效应,降为表层土壤40.0%、中层土壤76.0%、深层土壤70.0%。
进一步计算土壤微生物将13C-葡萄糖转化为难溶性有机碳13C-SOC和无机13C-CO2的效率(百分比),图 2g结果表明,氮素添加提高了土壤微生物合成代谢,提升了土壤对外源碳的固持能力。例如,与单一添加葡萄糖相比,氮素添加后土壤13C-SOC显著增加,表层土壤从34.9%提升至41.6%;中层土壤从37.3%至52.7%;深层土壤则从32.9%至37.4%。然而,值得注意的是,剖面三种土壤的分解代谢效率(CO2产生)整体略高于合成代谢(13C-SOC合成)。例如,33%~42%的葡萄糖被微生物固持并以13C-SOC的形式存在于土壤,而44%~50%左右的葡萄糖被微生物异化代谢为13CO2。
2.2 外源碳氮输入对典型黑土剖面土壤微生物群落的影响剖面深度和葡萄糖添加是影响黑土微生物群落的主要因素(图 3a)。采用土壤16S rRNA基因数量评价土壤微生物数量,发现表层高于中层高于深层,分别为4.43×108、2.13×108、0.72×108 copies·g–1干土;仅添加氮素时对三层土壤的细菌数量无显著性影响;添加葡萄糖显著刺激了微生物数量,表层和中层土壤增幅约为85.0%,深层土壤增幅高达184.9%。然而,进一步添加氮素后,表层和中层土壤的细菌数量降低,深层土壤的细菌数量增加,但不显著。
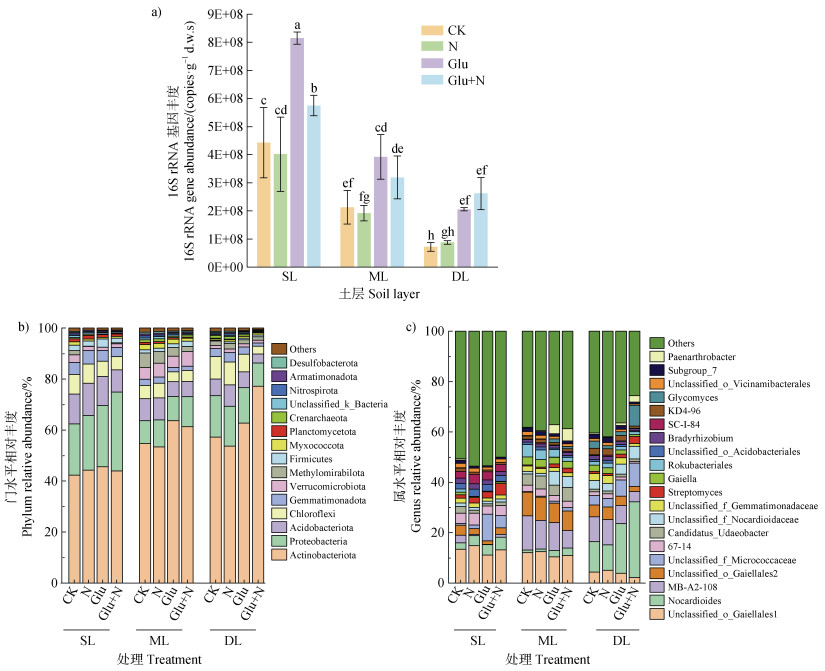
|
图 3 外源碳氮输入下微生物数量与群落组成变化 Fig. 3 Changes in microbial quantity and community composition under external carbon and nitrogen input |
高通量测序16S rRNA基因的物种分类(图 3b,图 3c)表明,仅添加外源无机氮土壤细菌群落组成变化不显著;而仅添加葡萄糖改变了土壤细菌群落组成,且对中层和底层较为显著,表层改变不明显。进一步添加氮素对对底层土壤微生物类群影响较大。在微生物分类门水平(图 3b),添加葡萄糖后表层土壤放线菌门(Actinobacteria)相对丰度从42.4%增至45.5%,变形菌门(Proteobacteria)则从20.1%增至24.1%,酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)相对丰度降低,但这些微生物门变幅均较小。葡萄糖和无机氮同时添加后,物种群落组成几乎不受影响,仅变形菌门显著增至30.9%。针对中层土壤,添加葡萄糖后,仅放线菌门从54.7%显著增至63.7%;葡萄糖和无机氮同时添加对物种群落组成无显著影响。针对深层土壤,添加葡萄糖后放线菌门相对丰度从57.3%增至62.7%,变形菌门、酸杆菌门、绿弯菌门略微降低;葡萄糖和无机氮同时添加后,放线菌门显著增至77.1%,变形菌门、酸杆菌门、绿弯菌门进一步降低。进一步如图 3c所示,在微生物属水平的分析表明,针对表层土壤,葡萄糖添加仅导致放线菌门微球菌科(Unclassified_f_Micrococcaceae)显著增加,相对丰度从0.7%剧增至10.6%,增幅高达14.1倍,但葡萄糖和无机氮同时添加,其丰度显著降低至4.9%。针对中层土壤,无论葡萄糖或葡萄糖+无机氮添加,均未对微生物群落组成产生显著影响。针对深层土壤,葡萄糖添加后放线菌门的类诺卡氏菌属(Nocardioides)相对丰度从12.1%显著增至19.7%,葡萄糖和无机氮添加后则进一步增至30.1%,同时微球菌科(Unclassified_f_ Micrococcaceae)和糖霉菌属(Glycomyces)也发生显著增加。
葡萄糖和无机氮添加显著影响黑土剖面微生物群落结构。如图 4a所示,Alpha多样性香农指数表层9.35、中层8.68、深层8.10,随土壤深度增加显著降低。氮素添加对香农指数未有一致性的影响规律。与CK对照相比,葡萄糖添加后,土壤多样性显著下降,分别为8.35、8.34、7.97。同时添加葡萄糖和无机氮后,表层土壤香农指数略有增加,变为8.78,但深层土壤香农指数显著降至6.85。而进一步通过加权Unifrac分析黑土微生物系统发育Beta多样性指数,如图 4b所示,PCoA分析表明,表层、中层和深层土壤微生物群落分别独立成簇。这些结果暗示了剖面是决定土壤微生物系统发育多样性的第一因素,而外源碳氮添加则是次要因素。
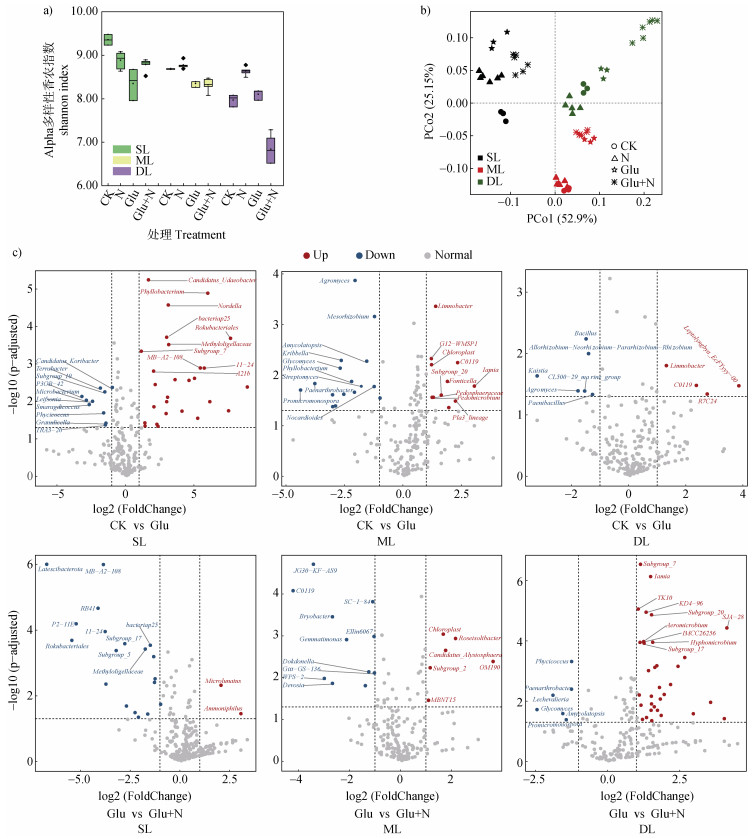
|
图 4 外源碳氮输入下微生物多样性及物种差异分析 Fig. 4 Analysis of microbial diversity and species differences under external carbon and nitrogen input |
物种差异分析则得到类似结果,如图 4c所示,葡萄糖添加后,不同深度土壤显著增加的物种数分别为表层土壤27种、中层土壤10种、深层土壤4种,占CK土壤中微生物物种数量的比例分别为6.03%、2.80%、1.08%。其中,表层土壤特异增加TOP物种为Candidatus_Udaeobacter、Phyllobacterium、Nordella等,中层土壤特异增加TOP物种为Limnobacter、C0119、G12-WMSP1等,深层土壤特异增加TOP物种为Limnobacter、C0119、R7C24等。相反,与葡萄糖处理相比,同时添加葡萄糖和无机氮后不同深度土壤显著增加的物种数分别为表层土壤2种、中层土壤5种、深层土壤33种,占葡萄糖处理土壤中微生物物种数量的比例分别为0.51%、1.52%、9.02%。表层土壤特异增加TOP物种为Microlunatus、Ammoniphilus,中层土壤特异增加TOP物种为Roseisolibacter、Candidatus_ Alysiosphaera等,深层土壤特异增加TOP物种为Subgroup_7、Iamia等。
3 讨论土壤有机碳矿化受到多种因素影响,如土壤理化性质,外源养分添加,土壤微生物活性与群落组成,环境效应等因素影响[11]。本研究发现表层黑土的矿化量与矿化速率显著高于底层黑土,而中层和深层土之间无显著差异;葡萄糖添加能够增加土壤SOC的矿化量及矿化速率,主要原因是葡萄糖显著刺激了土壤呼吸;但是不同深度土壤利用外源葡萄糖合成微生物源难溶性有机碳的潜力基本一致。
已有研究表明氮素添加对土壤有机碳矿化的影响具有不确定性,其正反馈或负反馈效应取决于多种因素。本研究发现,与表层土相比,葡萄糖输入后加剧了深层土壤N限制,进而影响深层土壤碳矿化。氮添加对表层和中层土SOC的矿化量和矿化速率无显著影响,即在C/N较低的情况下,氮素添加对土壤SOC矿化无显著影响,这与已有研究结果基本一致[30];但是,氮素添加提高了深层土壤SOC的矿化速率,其主要原因是:深层土壤长期处于氮匮乏状态,氮素添加可能缓解微生物氮胁迫,激发微生物活性并促进土壤有机碳矿化。
葡萄糖添加导致黑土产生正激发效应,并且深层土的激发效应显著高于表层土。总体而言,两周内深层土壤的激发效应强度(267.0%)显著高于中层土壤(150.5%)和表层土壤(43.5%),这与已有研究结果一致[9,31-32]。其可能机理是:新鲜有机碳输入是深层有机碳稳定性的主要控制因素,缺乏生物有效性碳供应可能阻止深层土壤有机碳库分解[33]。也有研究证明,表层土壤有机碳的稳定性要低于底土[34],并且与不稳定碳库相比,稳定碳库在外源碳输入时更容易被激发[11]。外源氮输入也会对激发效应强度产生影响。高强度人为干扰情景下,全球氮循环发生显著变化,并极有可能影响土壤微生物激发效应。然而,值得关注的是,长期氮沉降对激发作用影响尚无定论。例如,Janssens等[17]研究发现施N抑制激发效应,但也有报道认为N添加对激发效应无显著影响[22]。本研究则发现无机氮添加对黑土激发效应与土壤剖面紧密相关,深层土壤0~3 d表现出强烈的激发效应,随后则表现为抑制效应。其原因可能是当表层和中层土外源输入氮被大量消耗之后,氮素对激发效应刺激效应消失,而抑制作用增强,并随着培养时间抑制效应逐渐减弱直至消失。但总体而言,两周内表层土壤激发效应强度降低为24.7%,中层土壤降低为107.5%,深层土壤降低为155.0%,所以氮素添加表现为抑制东北黑土的正激发效应,且对深层土的抑制作用更加强烈(图 2f)。
土壤微生物对有机碳的固持能力,在一定程度代表了土壤有机碳的稳定性,即不易通过矿化和淋溶等途径释放。有研究也认为SOC稳定性是一种生态系统属性,并可从两个角度进行分析:包括阻力(抵抗扰动的能力)和弹性(从扰动中恢复的能力)[35]。土壤稳定性碳大部分来源于土壤难溶性有机碳,而微生物合成代谢产生的疏水性细胞生物质难降解,被认为是土壤有机碳稳定性的重要组成。本研究发现,外源碳氮加入后显著刺激微生物繁殖生长,产生的土壤难溶性有机碳可能影响土壤有机碳的稳定性。这些结果与已有报道基本一致,外源碳氮加入后,表层土壤净固持了难溶性有机碳,表明在富含有机碳的土壤中添加外源不稳定性有机质比在贫有机碳土壤中更能促进碳固存[36]。值得注意的是,尽管不同剖面黑土对外源碳的固持特征具有显著差异[37-38],但其碳固持总量基本一致。无机氮添加可提升微生物固持外源有机碳能力。
土壤碳氮周转归根结底依赖于微生物生理活动,外源营养物质影响微生物之间的种间合作与竞争,进而决定了土壤微生物群落的演替方向[39]。微生物的生存竞争受到土壤类型、外界环境等众多因素的影响,不同土壤中微生物碳氮循环过程由不同微生物所主导[40]。研究发现,表层黑土中微球菌科对外源碳的响应中占主要优势,而深层土壤中则是由类诺卡氏菌属主导。外源营养物质通过定向刺激特定微生物繁殖生长,加速土壤有机碳氮周转速率,但同时也可能在一定程度降低微生物群落多样性[41]。本研究则发现外源碳氮输入均导致表层黑土微生物多样性降低,但值得注意的是,无机氮单一添加条件下深层土壤微生物多样性增加,而碳氮同时输入时,深层微生物多样性降低,这也侧面证明了深层土壤在微生物生长中受到氮限制,例如,深层土壤碳氮比高达14.8,显著高于表层土壤11.0。此外,一般认为微生物碳利用效率(CUE)与生物多样性呈正相关[42],微生物多样性高则可能促进土壤有机碳分解,而在有机碳分解过程中伴随着有机氮的矿化分解,从而解除氮素胁迫。然而,未来仍需开展更多试验,综合采用稳定性同位素示踪技术与微生物组学手段,准确解析功能微生物群落对复杂土壤环境的适应机制及其对土壤关键元素生物地球化学循环的影响规律。
4 结论葡萄糖添加产生正激发效应,而深层土的激发效应最强;外源氮添加对正激发效应产生抑制作用,深层土壤抑制作用最强。然而,氮素添加有利于提高微生物源有机碳固持,但对微生物利用外源碳呼吸无显著性影响。外源碳输入能够显著增加细菌数量,不同深度土壤碳代谢主导微生物类群不同,表层土壤为微球菌科,深层土壤为类诺卡氏菌属。这些结果表明,微生物长期适应黑土剖面环境分异过程中,逐渐形成了不同类群,表层土壤C/N低,其氮素胁迫适应能力更强,深层土壤尽管微生物数量和多样性较低,但也能利用外源易分解碳快速生长并合成微生物源难溶解性有机碳,典型剖面微生物固碳潜力基本一致,表明土壤微生物群落具有极强的功能可塑性。
| [1] |
Yuan M R, Yang F S, Cai B Y, et al. Research progress of agricultural soil carbon sink (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2023, 39(8): 37-42. [苑明睿, 杨峰山, 蔡柏岩, 等. 农业土壤碳汇研究进展[J]. 中国农学通报, 2023, 39(8): 37-42.]
(  0) 0) |
| [2] |
Zhang Z Y. The thickness changes of ah horizon after the phaeozems cultivated (In Chinese)[J]. Journal of Heilongjiang Bayi Agricultural University, 2010, 22(5): 1-3. DOI:10.3969/j.issn.1002-2090.2010.05.001 [张之一. 黑土开垦后黑土层厚度的变化[J]. 黑龙江八一农垦大学学报, 2010, 22(5): 1-3.]
(  0) 0) |
| [3] |
Zhuge Y P, Zhang X D, Liu Q. Effect of long-term fertilization on respiration process of mollisols (In Chinese)[J]. Chinese Journal of Soil Science, 2005, 36(3): 391-394. DOI:10.3321/j.issn:0564-3945.2005.03.025 [诸葛玉平, 张旭东, 刘启. 长期施肥对黑土呼吸过程的影响[J]. 土壤通报, 2005, 36(3): 391-394.]
(  0) 0) |
| [4] |
Yuan S F, Wang S L, Zhang W D. Effect of external organic carbon and temperature on SOC decomposition (In Chinese)[J]. Chinese Journal of Soil Science, 2015, 46(4): 916-922. [袁淑芬, 汪思龙, 张伟东. 外源有机碳和温度对土壤有机碳分解的影响[J]. 土壤通报, 2015, 46(4): 916-922.]
(  0) 0) |
| [5] |
Kuzyakov Y, Friedel J K, Stahr K. Review of mechanisms and quantification of priming effects[J]. Soil Biology & Biochemistry, 2000, 32(11/12): 1485-1498.
(  0) 0) |
| [6] |
Chen T, Yuan F H, Zhang L M, et al. Effects of addition of leaf litter with different chemical properties on soil organic carbon mineralization and priming effect (In Chinese)[J]. Chinese Journal of Applied Ecology, 2022, 33(10): 2602-2610. [陈甜, 元方慧, 张琳梅, 等. 不同化学性质叶凋落物添加对土壤有机碳矿化及激发效应的影响[J]. 应用生态学报, 2022, 33(10): 2602-2610.]
(  0) 0) |
| [7] |
Don A, Böhme I H, Dohrmann A B, et al. Microbial community composition affects soil organic carbon turnover in mineral soils[J]. Biology and Fertility of Soils, 2017, 53(4): 445-456. DOI:10.1007/s00374-017-1198-9
(  0) 0) |
| [8] |
Reed H E, Martiny J B H. Microbial composition affects the functioning of estuarine sediments[J]. The ISME Journal, 2013, 7(4): 868-879. DOI:10.1038/ismej.2012.154
(  0) 0) |
| [9] |
Liao C, Tian Q X, Wang D Y, et al. Effects of labile carbon addition on organic carbon mineralization and microbial growth strategies in subtropical forest soils (In Chinese)[J]. Chinese Journal of Applied Ecology, 2016, 27(9): 2848-2854. [廖畅, 田秋香, 汪东亚, 等. 外源碳输入对中亚热带森林深层土壤碳矿化和微生物决策群落的影响[J]. 应用生态学报, 2016, 27(9): 2848-2854.]
(  0) 0) |
| [10] |
Liu S R, Wang H, Luan J W. A review of research progress and future prospective of forest soil carbon stock and soil carbon process in China (In Chinese)[J]. Acta Ecologica Sinica, 2011, 31(19): 5437-5448. [刘世荣, 王晖, 栾军伟. 中国森林土壤碳储量与土壤碳过程研究进展[J]. 生态学报, 2011, 31(19): 5437-5448.]
(  0) 0) |
| [11] |
Kan Z R, Liu W X, Liu W S, et al. Mechanisms of soil organic carbon stability and its response to no-till: A global synthesis and perspective[J]. Global Change Biology, 2022, 28(3): 693-710. DOI:10.1111/gcb.15968
(  0) 0) |
| [12] |
Fontaine S, Bardoux G, Abbadie L, et al. Carbon input to soil may decrease soil carbon content[J]. Ecology Letters, 2004, 7(4): 314-320. DOI:10.1111/j.1461-0248.2004.00579.x
(  0) 0) |
| [13] |
Nottingham A T, Griffiths H, Chamberlain P M, et al. Soil priming by sugar and leaf-litter substrates: A link to microbial groups[J]. Applied Soil Ecology, 2009, 42(3): 183-190. DOI:10.1016/j.apsoil.2009.03.003
(  0) 0) |
| [14] |
Kong A Y Y, Six J, Bryant D C, et al. The relationship between carbon input, aggregation, and soil organic carbon stabilization in sustainable cropping systems[J]. Soil Science Society of America Journal, 2005, 69(4): 1078-1085. DOI:10.2136/sssaj2004.0215
(  0) 0) |
| [15] |
He Y L, Qi Y C, Peng Q, et al. Effects of external carbon on the key processes of carbon cycle in a terrestrial ecosystem and its microbial driving mechanism (In Chinese)[J]. Acta Ecologica Sinica, 2017, 37(2): 358-366. [贺云龙, 齐玉春, 彭琴, 等. 外源碳输入对陆地生态系统碳循环关键过程的影响及其微生物学驱动机制[J]. 生态学报, 2017, 37(2): 358-366.]
(  0) 0) |
| [16] |
Yang Y, Dou Y X, Wang B R, et al. Advances in soil organic carbon sequestration mechanisms on the Chinese Loess Plateau (In Chinese)[J]. Quaternary Sciences, 2023, 43(2): 509-522. [杨阳, 窦艳星, 王宝荣, 等. 黄土高原土壤有机碳固存机制研究进展[J]. 第四纪研究, 2023, 43(2): 509-522.]
(  0) 0) |
| [17] |
Janssens I A, Dieleman W, Luyssaert S, et al. Reduction of forest soil respiration in response to nitrogen deposition[J]. Nature Geoscience, 2010, 3: 315-322. DOI:10.1038/ngeo844
(  0) 0) |
| [18] |
Qiu Q Y, Wu L F, Ouyang Z, et al. Priming effect of maize residue and urea N on soil organic matter changes with time[J]. Applied Soil Ecology, 2016, 100: 65-74. DOI:10.1016/j.apsoil.2015.11.016
(  0) 0) |
| [19] |
Tian P, Liu S G, Wang Q K, et al. Organic N deposition favours soil C sequestration by decreasing priming effect[J]. Plant and Soil, 2019, 445(1): 439-451.
(  0) 0) |
| [20] |
Qiao N, Xu X L, Hu Y H, et al. Carbon and nitrogen additions induce distinct priming effects along an organic-matter decay continuum[J]. Scientific Reports, 2016, 6: 19865. DOI:10.1038/srep19865
(  0) 0) |
| [21] |
Chen R R, Senbayram M, Blagodatsky S, et al. Soil C and N availability determine the priming effect: Microbial N mining and stoichiometric decomposition theories[J]. Global Change Biology, 2014, 20(7): 2356-2367. DOI:10.1111/gcb.12475
(  0) 0) |
| [22] |
Feng J G, Tang M, Zhu B. Soil priming effect and its responses to nutrient addition along a tropical forest elevation gradient[J]. Global Change Biology, 2021, 27(12): 2793-2806. DOI:10.1111/gcb.15587
(  0) 0) |
| [23] |
Wan D, Ma M K, Peng N, et al. Effects of long-term fertilization on calcium-associated soil organic carbon: Implications for C sequestration in agricultural soils[J]. Science of the Total Environment, 2021, 772: 145037. DOI:10.1016/j.scitotenv.2021.145037
(  0) 0) |
| [24] |
Tang B, Rocci K S, Lehmann A, et al. Nitrogen increases soil organic carbon accrual and alters its functionality[J]. Global Change Biology, 2023, 29(7): 1971-1983. DOI:10.1111/gcb.16588
(  0) 0) |
| [25] |
Mack M C, Schuur E A G, Bret-Harte M S, et al. Ecosystem carbon storage in Arctic tundra reduced by long-term nutrient fertilization[J]. Nature, 2004, 431(7007): 440-443. DOI:10.1038/nature02887
(  0) 0) |
| [26] |
Jia J X, Li Z P, Che Y P. Effects of glucose addition on nitrogen transformation in black soils different in organic carbon content (In Chinese)[J]. Acta Pedologica Sinica, 2011, 48(1): 207-211. DOI:10.11766/trxb200910140452 [贾俊仙, 李忠佩, 车玉萍. 添加葡萄糖对不同肥力黑土氮素转化的影响[J]. 土壤学报, 2011, 48(1): 207-211.]
(  0) 0) |
| [27] |
Wang M H, Dong L L, Li F C, et al. Effects of different organic: inorganic nitrogen addition ratios on nitrogen distribution and transformation in a grassland soil (In Chinese)[J]. Acta Prataculturae Sinica, 2022, 31(1): 36-46. [汪梦寒, 董利利, 李富翠, 等. 不同有机/无机氮添加对草原土壤氮素分配和转化特征的影响[J]. 草业学报, 2022, 31(1): 36-46.]
(  0) 0) |
| [28] |
Li Q S, Wang D Q, Du C Y, et al. Effects of quantity and type of organic carbon source on nitrogen immobilization in yellow soil planted with tobacco (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2021, 27(6): 1091-1103. [李青山, 王德权, 杜传印, 等. 碳源类型和添加量对植烟黄壤氮素同化的影响[J]. 植物营养与肥料学报, 2021, 27(6): 1091-1103.]
(  0) 0) |
| [29] |
Christner B C, Mosley-Thompson E, Thompson L G, et al. Isolation of bacteria and 16S rDNAs from Lake Vostok accretion ice[J]. Environmental Microbiology, 2001, 3(9): 570-577. DOI:10.1046/j.1462-2920.2001.00226.x
(  0) 0) |
| [30] |
Zhu Y F, Sun Z L, Wang Q K. Effects of biochar and nitrogen additions on soil organic carbon decomposition and balance in a subtropical forest (In Chinese)[J]. Chinese Journal of Ecology, 2020, 39(9): 2851-2859. [朱依凡, 孙兆林, 王清奎. 生物炭和氮添加对亚热带常绿阔叶林土壤有机碳分解与平衡的影响[J]. 生态学杂志, 2020, 39(9): 2851-2859.]
(  0) 0) |
| [31] |
Lyu M K, Noormets A, Ukonmaanaho L, et al. Stability of soil organic carbon during forest conversion is more sensitive in deep soil than in topsoil in subtropical forests[J]. Pedobiologia, 2021, 84: 150706. DOI:10.1016/j.pedobi.2020.150706
(  0) 0) |
| [32] |
Wang Q K, Wang Y P, Wang S L, et al. Fresh carbon and nitrogen inputs alter organic carbon mineralization and microbial community in forest deep soil layers[J]. Soil Biology & Biochemistry, 2014, 72: 145-151.
(  0) 0) |
| [33] |
Fontaine S, Barot S, Barré P, et al. Stability of organic carbon in deep soil layers controlled by fresh carbon supply[J]. Nature, 2007, 450: 277-280. DOI:10.1038/nature06275
(  0) 0) |
| [34] |
Shrestha B M, Certini G, Forte C, et al. Soil organic matter quality under different land uses in a mountain watershed of Nepal[J]. Soil Science Society of America Journal, 2008, 72(6): 1563-1569. DOI:10.2136/sssaj2007.0375
(  0) 0) |
| [35] |
McCann K S. The diversity-stability debate[J]. Nature, 2000, 405(6783): 228-233. DOI:10.1038/35012234
(  0) 0) |
| [36] |
Zhang H J, Ding W X, Luo J F, et al. Temporal responses of microorganisms and native organic carbon mineralization to 13C-glucose addition in a sandy loam soil with long-term fertilization[J]. European Journal of Soil Biology, 2016, 74: 16-22. DOI:10.1016/j.ejsobi.2016.02.007
(  0) 0) |
| [37] |
Zhang P, Li H, Jia Z K, et al. Effects of straw returning on soil organic carbon and carbon mineralization in semi-arid areas of southern Ningxia, China (In Chinese)[J]. Journal of Agro-Environment Science, 2011, 30(12): 2518-2525. [张鹏, 李涵, 贾志宽, 等. 秸秆还田对宁南旱区土壤有机碳含量及土壤碳矿化的影响[J]. 农业环境科学学报, 2011, 30(12): 2518-2525.]
(  0) 0) |
| [38] |
Qiao N, Schaefer D, Blagodatskaya E, et al. Labile carbon retention compensates for CO2 released by priming in forest soils[J]. Global Change Biology, 2014, 20(6): 1943-1954. DOI:10.1111/gcb.12458
(  0) 0) |
| [39] |
Zhou J Z, Ning D L. Stochastic community assembly: Does it matter in microbial ecology?[J]. Microbiology and Molecular Biology Reviews, 2017, 81(4): e00002-e00017.
(  0) 0) |
| [40] |
Ganguly A, Ghosh A. Quantitative Diophantine approximation on affine subspaces[J]. Mathematische Zeitschrift, 2019, 292(3): 923-935.
(  0) 0) |
| [41] |
Yang Y, Chen X L, Liu L X, et al. Nitrogen fertilization weakens the linkage between soil carbon and microbial diversity: A global meta-analysis[J]. Global Change Biology, 2022, 28(21): 6446-6461.
(  0) 0) |
| [42] |
Wang C, Wang X, Zhang Y, et al. Integrating microbial community properties, biomass and necromass to predict cropland soil organic carbon[J]. ISME Communications, 2023, 3(1): 86. DOI:10.1038/s43705-023-00300-1
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


