2. 内蒙古自治区土壤质量与养分资源重点实验室, 呼和浩特 010018;
3. 农业生态安全与绿色发展自治区高等学校重点实验室, 呼和浩特 010018
2. Inner Mongolia Key Laboratory of Soil Quality and Nutrient Resource, Hohhot 010018, China;
3. Key Laboratory of Agricultural Ecological Security and Green Development at Universities of Inner Mongolia Autonomous Region, Hohhot 010018, China
草原生态系统是我国面积最大的陆地生态系统[1],其中荒漠草原是主要草地类型之一,也是内蒙古草原的重要组成部分,因其气候极端干旱,植被种类贫乏、土壤贫瘠,属典型草原向荒漠过渡区[2]。而放牧是内蒙古荒漠草原既简便又经济的草地利用途径之一[3]。放牧主要以动物践踏、啃食和排泄物来损伤牧草、减少凋落物现存量,使植物群落结构简单,低矮稀疏,从而影响草地生态系统的结构和功能[4]。
随着人类对生态环境和生物多样性的关注与保护,放牧对生态系统的影响已经成为土壤生态学研究的热潮[5–6]。放牧方式和放牧强度通过家畜的选择性啃食,使植被群落中劣势植物增多,致使土壤有机物质的分解速度降低[7],使植物群落结构简单、低矮稀疏[8],间接影响土壤原生生物群落特征;另一方面,直接通过家畜践踏损伤牧草,加快有机质循环[9],使凋落物现存量减少,土壤紧实度和容重增加,土壤孔隙度、透水透气性降低[10],进而限制土壤原生生物的生存微环境,从而改变土壤原生生物的种类、数量及生态功能。放牧可改变植物群落组成、结构、生产力和物质循环[11],尤其是在放牧强度超出系统承载力时,草地生物群落发生反向演替,引起土壤生物的协同响应[12];而放牧导致生物群落结构改变却是研究生物群落多样性的先决条件[11]。放牧对植物生物量的作用机制是多方面的;不同环境限制下,对生物群落地下结构的影响也不同[13]。土壤原生生物是陆地生态系统的重要组成部分,也是构成地下微食物网的基础。研究发现,放牧对土壤原生生物群落数量和结构有显著影响。其中,过度放牧使纤毛虫和鞭毛虫数量显著减少,而变形虫丰度在中度放牧时达峰值[7,14],表明其群落结构的改变可以反映放牧效应。但植物和土壤原生生物群落的协同变化是二者相互作用的结果,还是它们对放牧的类似响应的结果,至今尚不明确。放牧强度能改变该地区土壤环境因子,而这些环境因子又会影响土壤原生生物生长繁殖[12,14],故而对土壤原生生物群落组成及多样性产生显著影响,这些变化为评估草原生态系统的环境影响和制定合理的放牧及资源利用策略提供重要的依据。
土壤原生生物在土壤真核生物群落中占据很大比例,作为微生物更高一级的食物链环节[9],其种类丰富、数量庞大,在陆地生态系统的物质循环和能量转换中发挥着极其重要的作用[8]。土壤原生生物群落通过提高土壤碳素转化和矿质营养的有效化、降低植物根际环境中致病菌的丰度和毒性[15]或与植物有益微生物协同作用来抑制病害发生[16]、降解污染物含量[17],从而介导生态系统服务的供应;还可通过分泌植物激素调控农作物的生长[18]。Guo等[19]表明原生生物在激发植物性能中发挥重要作用,可以将其作为微生物因子用于调控和指示植物健康。同时,原生生物是微生物组中对环境变化较敏感的种群[20],具有监测土壤质量的潜力。然而,由于原生生物群落的研究起步较晚,开展土壤原生生物群落影响的相关研究十分必要。草原生态系统地上过程对地下生物、生态系统功能和稳定性均有决定性影响,而草原生态系统植被的时空变异规律又会影响地下生物组成[11,21]。
综上,放牧是影响植物、原生生物和土壤环境变化的重要因素,其相互作用也十分复杂。尽管原生生物在陆地生态系统中起着至关重要的作用,但人们对放牧强度如何影响原生生物群落仍知之甚少。因此,研究放牧对土壤原生生物的影响具有重要的实际意义。短花针茅荒漠草原是我国温带荒漠草原分布最集中、最具代表性的生态系统类型之一[22],对全球变化反应较为敏感。在全球变化背景下,通过模拟放牧试验,分析荒漠草原生态系统放牧强度对土壤原生生物群落的影响,结合放牧强度下荒漠草原植被特征和土壤理化性质分析探究土壤原生生物群落变化的关键驱动因子,以期增进对原生生物在土壤质量变化中的指示作用及其在微食物网中重要性的了解,同时为维护生态系统稳定性,以确保草原畜牧业的可持续发展,为草原生态系统保护和生态恢复建设提供科学依据。
1 材料与方法 1.1 研究区概况试验地位于内蒙古农牧业科学院综合试验示范中心乌兰察布市四子王基地(41°47′ N,111°53′ E,海拔1 450 m),为典型的中温带大陆性季风气候,年平均气温3~4 ℃,试验地点地形平坦,无地表径流,土壤水分补给的唯一方式是降水。年降水量250~280 mm,其中6—9月份约占年降水量的70%以上,蒸发量相当于年降水量的7倍~10倍。土壤类型为淡栗钙土,较为贫瘠;建群种为短花针茅(Stipa breviflora)。
1.2 试验设计试验自2004年开始,由西向东根据李博[23]退化放牧草地分级方法,采用随机区组设计,设置对照样地(CK,Control)、轻度放牧(LG,Light grazing)、中度放牧(MG,Moderate grazing)、重度放牧(HG,Heavy grazing)四个处理组,每个处理3次重复,共12个小区。放牧强度分别为:0 sheep unit·hm–2·a–1(CK)、0.46 sheep units·hm–2·a–1(LG)、0.91 sheep units·hm–2·a–1(MG)、1.46 sheep units·hm–2·a–1(HG)。在地势相对平坦一致的约50 hm2天然草地,从6月初开始放牧,11月末结束放牧;每日早晨6点出牧,傍晚6点归牧。放牧前样地概况基本一致;供试羊为当地成年蒙古揭羊,每3年更换一次。
1.3 研究方法土壤原生生物及土壤样品:于2023年8月中旬用直径3 cm的土钻在各试验小区0~10 cm土层,按南北方向以正反“S”字型分别采集15个点组成一个混合土样,每个小区两份。一部分土样通过2 mm网筛对土壤样品进行筛分,除去杂草、作物根系和碎石等杂质,用于土壤理化性质的测定;另一部分迅速装入无菌封口袋,于-80 ℃冰盒保存并迅速运至实验室处理,用于土壤原生生物的测定。
原生生物物种多样性指数计算:
ACE丰富度指数:Sace=Sabund+Srare/Cace+F1/ Cace·γace2,其中Sabund为高丰度(>低丰度阈值)物种数量,Srare为低丰度(≤低丰度阈值)物种数量,i为第i个物种,F1为只观测到一次的物种数目,Fi为第i个物种的丰度,Cace=1–F1/Nrare,Nrare=
Chao1丰富度指数:SChao1=Sobs+[n1(n1–1)/2(n2+1)],其中SChao1为估计的OUT数,Sobs为观测到的OUT数,n1为只有一条序列的OUT数目,n2为只有两条序列的OUT数目
Simpson均匀度指数(S),公式为S=1-∑Pi2,其中Pi为第i个物种的相对丰度。
植被特征指标:于2023年8月中旬在各小区内随机选择2个1 m×1 m样方,取样方内所有地上部分的植物和地下部分的根系,对植物进行物种分类,记录物种丰度(个体数),并在65 ℃下干燥48 h,测量每个样地的地上、地下生物量。根据Margalef丰富度指数(M)计算植物的丰富度值,公式为M=(S-1)/LnN,其中S为个体数,N为观测到的物种总数;Shannon-Wiener多样性指数(H’)计算植物的多样性值,公式为H’=-Σ(Pi)(LnPi),其中Pi为第i个分类单元中个体所占比例;计算植物的Pielou均匀度指数(E),公式为E= H’/LnS。
1.4 测定方法土壤原生生物:高通量测序(NGS),即使用TGuide S96 Magnetic Soil/Stool DNA Kit(天根生化科技(北京)有限公司,型号:DP812)试剂盒进行土壤原生生物总DNA的提取,提取步骤参照试剂盒操作说明书。以上游引物TAReuk454FWD1(5'-C CAGCA(G/C)C(C/T)GCGGTAATTCC-3')和下游引物TAReukREV3(5'-ACTTTCGTTCTTGAT(C/T)(A/G)A-3')对18S rDNA进行PCR扩增,扩增后PCR产物的完整性使用浓度1.8%的琼脂糖进行电泳检测,并使用NanoDrop 2000(Thermo Scientific,USA)测定DNA浓度和纯度。使用OMEGA DNA纯化试剂盒对PCR扩增子进行纯化,并经ImageJ软件定量后,按照质量比1︰1进行混样,在Illumina NovaSeq 6000平台进行测序,扩增子测序交由北京百迈客生物科技有限公司完成。对原始数据进行拼接(FLASH,version 1.2.11),将拼接得到的序列进行质量过滤(Trimmomatic,version 0.33)并去除嵌合体(UCHIME,version 8.1),得到高质量的Tags序列,在相似性97%的水平上对序列进行聚类(USEARCH,version 10.0),以测序所有序列数的0.005%作为阈值过滤OTU。原始测序数据已提交至美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库,公开序列号为PRJNA1091410。
土壤理化性质:土壤容重(环刀法)、土壤紧实度(TJSD-750-Ⅱ紧实度仪)、土壤总孔隙度(体积换算法)、土壤温度(地温计)、土壤pH(电位法,多参数分析仪DZS-706F-A型(水:土=5:1))、土壤含水量(烘干法)、土壤有机质(重铬酸钾氧化—外加热法)、土壤全氮(半微量凯氏定氮法)、土壤全磷(NaOH熔融—钼锑抗比色法)、土壤有效磷(0.05 mol·L–1 NaHCO3法)、土壤速效钾(NH4OAc浸提—火焰光度法),具体参考《土壤农化分析》[24]进行测定。
1.5 数据处理与分析采用Microsoft Excel 2016、SPSS statistics 20.0进行数据统计分析,并使用Origin 2021软件进行图形处理。对各项指标进行单因素方差分析(One-way ANOVA),并进行Duncan显著性差异检验,P值设置为0.05。皮尔森(Pearson)相关分析采用SPSS 20.0进行。利用基于Bray-Curtis相似度矩阵的主成分分析(PCA)评价不同处理间土壤原生生物群落结构相异性。采用相关性图(Correlation plot)确定驱动土壤原生生物群落组成变化的关键驱动因子。所有数据采用Origin 2021进行可视化处理。
2 结果 2.1 土壤原生生物群落组成本研究通过高通量测序技术,共获得10 763条有效序列。经对比,共得到10 577个OTUs,隶属于21个门51个纲70个目83个科90个属96个种。图 1显示,土壤原生生物群落在门水平上物种组成相对丰度较高的群落分别为未分类-真核生物门(Unclassified_Eukaryota,22%~25%)、隐藻门(Cryptophyta,20%~21%)、绿藻类门(Chlorophyta,13%~14%)、节肢动物门(Arthropoda,0%~11%)、链形植物门(Streptophyta,7%~12%)、毛霉门(Mucoromycota,3%~4%),占总丰度75% 以上;其余物种占比均较小,总占比约13%~25%。随着放牧强度的增加,未分类-真核生物门(Unclassified_Eukaryota)相对丰度逐渐降低,隐藻门(Cryptophyta)、绿藻类门(Chlorophyta)和节肢动物门(Arthropoda)相对丰度均无显著变化,链形植物门(Streptophyta)和丝足虫门(Cercozoa)相对丰度呈先降低后升高的趋势,线虫门(Nematoda)相对丰度呈先增加后降低的趋势。
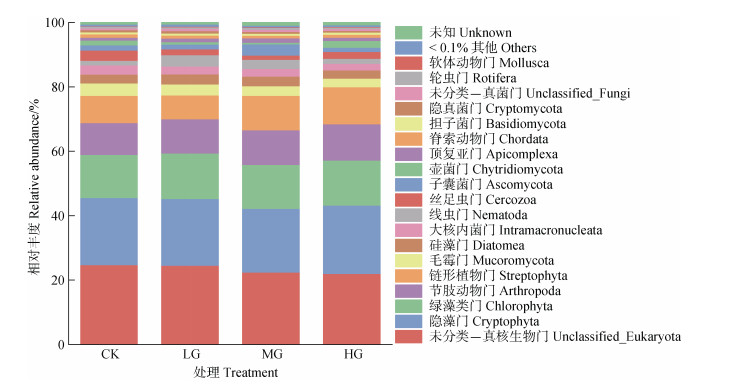
|
图 1 土壤原生生物群落门水平相对丰度 Fig. 1 Relative abundance of soil protist community at the phylum level |
土壤原生生物ACE丰富度指数、Chao1丰富度指数、Shannon-Wiener多样性指数随放牧强度的增加而显著降低(P<0.05),且中度和重度放牧处理间没有显著差异(P>0.05);而Simpson均匀度指数没有显著差异(P>0.05)(图 2)。
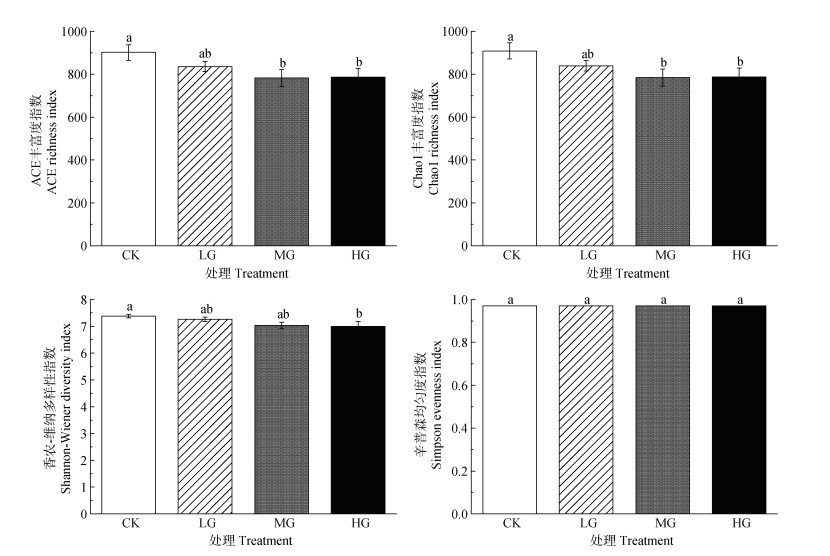
|
注:小写字母表示四个处理之间的差异(P<0.05)。下同。 Note: Lowercase letters indicate the difference between the four treatments(P < 0.05). The same below. 图 2 不同处理土壤原生生物群落Alpha多样性 Fig. 2 Alpha diversity of soil protist communities under different treatments |
采用主成分分析方法对各处理土壤原生生物在OTU水平上进行分析,评估原生生物群落间的差异。如图 3所示,横轴所代表的主成分1(PC1)解释了10.87%的原生生物组分,纵轴所代表的主成分2(PC2)解释了8.68%的原生生物组分。在PC1横轴方向,CK、LG、MG和HG分布较为集中,说明各处理原生生物群落结构基本相同。在PC2纵轴方向,LG和MG处理主要位于负半轴且与CK和HG处理距离较远,表明轻度和中度放牧后土壤原生生物群落结构发生了一定程度的改变;其中,LG和MG处理样品间距离较近,反映其原生生物群落结构比较相似。
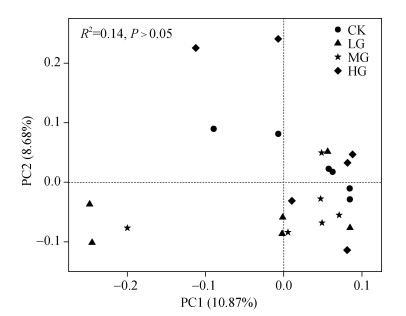
|
图 3 土壤原生生物OTU水平主成分分析 Fig. 3 PCA analysis of soil protists at the OTU level |
短花针茅荒漠草原植被群落Margalef丰富度指数随放牧强度增加而显著增加(P<0.05);随放牧强度的增加,Shannon-Wiener多样性指数和Pielou均匀度指数均逐渐减少;地上生物量随放牧强度的增加而显著减少,其变化具体表现为CK>LG>MG=HG(P<0.05);地下生物量随放牧强度的增加而逐渐减少,重度放牧条件下最低(图 4)。
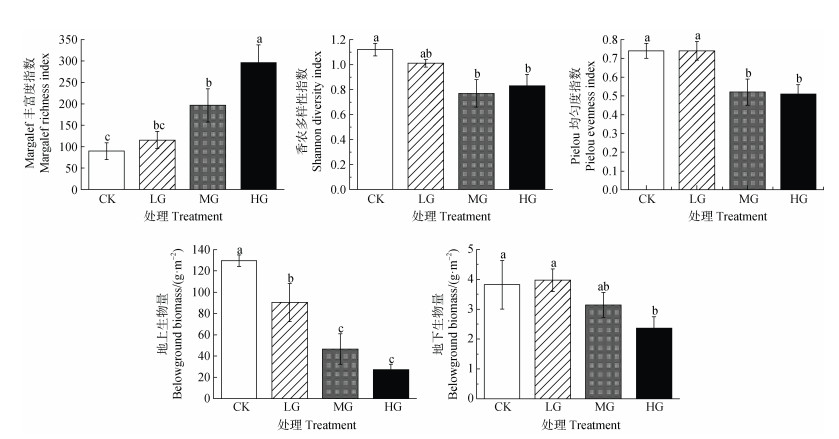
|
图 4 植被特征指标 Fig. 4 Vegetation characteristic index |
如表 1所示,随放牧强度的增加,土壤容重逐渐增加,而土壤总孔隙度逐渐减少,但处理间均没有显著差异(P>0.05);相比于对照,重度放牧区土壤紧实度显著增加(P<0.05)。同时,放牧强度对土壤化学性质产生了一定的影响。放牧强度对土壤含水量、温度影响不大。与对照相比,土壤有机质随放牧强度的增加呈先增加后下降趋势,表现为CK<LG=MG=HG(P<0.05);土壤全氮含量表现为LG>MG=HG=CK(P<0.05);土壤全磷随放牧强度的增加呈先增加后降低趋势,且相比于CK,差异较为明显(P<0.05);土壤有效磷含量表现为CK>LG=HG=MG(P<0.05);与CK相比,土壤速效钾含量显著降低(P<0.05);与对照相比,土壤pH显著增加(P<0.05)。
|
|
表 1 放牧强度对土壤理化性质的影响 Table 1 Effects of grazing intensity on soil physical and chemical properties |
选取各处理门水平相对丰度前10的原生生物门类及其多样性指数与5种植被特征指标和11种土壤特征指标进行分析(图 5)。节肢动物门(Arthropoda)、隐真菌门(Cryptomycota)与植被多样性指数、均匀度指数呈显著负相关(P<0.05)。丝足虫门(Cercozoa)与植被多样性指数呈显著正相关(P<0.05),与速效钾、有效磷呈极显著正相关(P<0.01和P<0.001),但与全氮呈极显著负相关(P<0.01)。绿藻类门(Chlorophyta)与植被多样性指数呈显著负相关(P<0.05),与植被均匀度指数呈极显著负相关(P<0.01)。大核内菌门(Intramacronucleata)与全磷、总孔隙度呈显著正相关(P<0.05),与容重呈显著负相关(P<0.05)。毛霉门(Mucoromycota)与植被多样性指数、地上生物量呈显著正相关(P<0.05),与植被均匀度指数、有效磷、速效钾呈极显著正相关(P<0.01和P<0.001),与植被Margalef丰富度指数、pH呈显著或极显著负相关(P<0.05和P<0.01)。未分类-真核生物门(Unclassified_Eukaryota)与速效钾呈显著正相关(P<0.05),与地下生物量、有效磷呈极显著正相关(P<0.01和P<0.001)。此外,原生生物丰富度指数与植被均匀度指数呈显著正相关(P<0.05),与植被多样性指数、速效钾、有效磷呈极显著正相关(P<0.01和P<0.001),与全氮、有机质、pH呈显著负相关(P<0.05)。原生生物均匀度指数与速效钾、有效磷呈极显著正相关(P<0.01和P<0.001),与全氮呈显著负相关(P<0.05)。原生生物多样性指数与植被多样性指数、速效钾、有效磷呈显著或极显著正相关(P<0.05和P<0.001),与有机质、全氮呈显著负相关(P<0.05)。
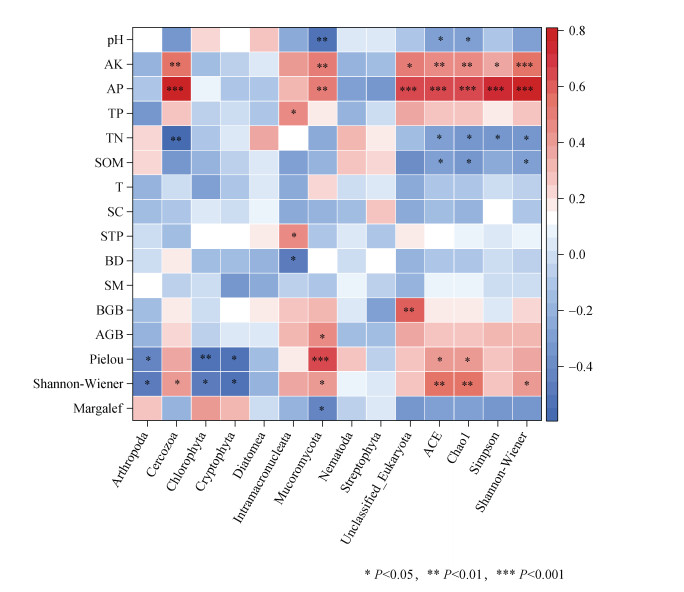
|
注:Margalef:丰富度指数;Shannon-Wiener:多样性指数;Pielou:均匀度指数;AGB:地上生物量;BGB:地下生物量;SM:土壤含水量;BD:容重;STP:土壤总孔隙度;SC:土壤紧实度;T:温度;SOM:土壤有机质;TN:全氮;TP:全磷;AP:有效磷;AK:速效钾。 Note: Margalef: Richness index; Shannon-Wiener: Diversity index; Pielou: Evenness index; AGB: Above-ground biomass; BGB: Below-ground biomass; SM: Soil moisture; BD: Bulk density; STP: Soil total porosity; SC: Soil compactness; T: Temperature; SOM: Soil organic matter; TN: Total nitrogen; TP: Total phosphorus; AP: Available phosphorus; AK: Available potassium. 图 5 土壤原生生物与植被和土壤特征的相关性 Fig. 5 Correlation analysis between soil protists and vegetation and soil characteristics |
放牧是荒漠草原的主要利用方式,通过改变土壤养分状况进而影响土壤原生生物群落。原生生物作为环境变化的指示生物对放牧强度尤为敏感。本研究各放牧处理的土壤原生生物群落优势类群为未分类-真核生物门(Unclassified_Eukaryota)、隐藻门(Cryptophyta)、绿藻类门(Chlorophyta)、节肢动物门(Arthropoda)、链形植物门(Streptophyta)。但其相对丰度受放牧强度的影响各有不同(图 1),说明不同放牧强度形成的异质土壤环境塑造了不同的原生生物群落。本研究中,中度放牧和重度放牧降低了土壤原生生物丰富度指数和多样性指数(图 2),说明对原生生物产生了负面影响。而在轻度放牧条件下原生生物群落Alpha多样性相对较高(图 2),表明轻度放牧形成了有利于原生生物的栖息环境。除此之外,轻度和中度放牧后土壤原生生物群落结构发生了一定程度的改变,这足以证明土壤环境在朝着有利于土壤原生生物的方向发展。
短花针茅荒漠草原植被群落物种丰富度随放牧强度增加而增加,这可能是由家畜的选择性啃食导致的,且放牧引起的丰富度变化主要是由于地理位置的生产力差异,与物种的分化程度无关[25]。多样性指数和均匀度指数随放牧强度的增加呈下降趋势,说明家畜的大量啃食与践踏改变了植物的定植和灭绝速度。生物量作为植物生长的重要指标,对放牧的响应非常敏感。本研究发现,放牧可显著降低荒漠草原植被生物量,这是由家畜活动使植物枝条呈匍匐状生长,植被蓄积量下降所造成的[26];此外,高大植物易被采食,牲畜的啃食使地表裸露面积增加[27],因此植被高度、盖度、密度均下降,地上生物量势必下降。通常认为,随着放牧压力的增加,牲畜对土壤的压实作用日益明显,导致土壤容重逐渐增加,主要是由于土壤容重的增加具有累积效应,这与本研究得出的结果一致。随放牧强度的增加,动物践踏加剧,导致土壤孔隙分布改变,进而使总孔隙减少[28]。本研究中,不同放牧强度土壤有机质含量呈先增加后下降趋势,主要原因可能是由于随着放牧年限的增加,植被覆盖率减少,地下生物量和凋落物也随之减少[29]。而地下生物量和凋落物作为主要的碳源输入[30],从而造成土壤有机质含量减少。这表明,试验样地的生态环境较为脆弱、生态系统承载力低[31],放牧破坏了土壤释放以及固碳的平衡;也可能是由于草地类型不同,所以草地对放牧强度的响应也不相同[32],故土壤有机质含量会随放牧强度的增高而降低。放牧强度增加,土壤全氮呈先升高后降低的状态,表明放牧可促进土壤微生物活性,氮循环加快、减少全氮含量[33]。土壤全磷作为限制陆地生态系统生产力的主要因素之一[34],主要来源为枯落物分解[35]。随放牧强度的增加,土壤全磷含量显著下降,蔡育蓉[36]的研究也证实了这一结果。有研究表明,放牧强度显著影响有效磷含量[37],这是由于有效磷在土壤水分的移动下迅速转移,当表层土壤有效磷含量降低时,土壤下层养分会移动到表层土壤,导致地上植物被家畜采食后进行补偿性生长,增加了对有效磷的需要。而本研究与此不符,原因可能是由于在野外进行采样时,气候无显著变化所导致的。土壤pH是对地上植被群落组成的重要影响因素之一[38],其在放牧地的影响因素可能出现在家畜排泄物输入、微生物生物量及活性等方面。土壤pH对放牧的响应因草地类型和家畜结构而异[39]。本研究中,土壤pH在放牧处理中变化不显著,这说明在一定的放牧条件下,土壤的缓冲性使pH在总体上保持稳定或存在滞后性,此结果也与迟亦成[39]、杨青等[40]的结果一致。
土壤原生生物的生长与繁殖依赖于植物栖息地和基质,植物多样性影响局部气候和土壤微环境[41],并通过凋落物或根系分泌物影响土壤微环境中的养分。植被多样性和生物量显著影响原生生物群落的组成和相对丰度[42–43]。同时,还通过生物量和土壤理化因子来间接促进原生生物群落多样性。原生生物与植物关系非常密切,植物和植被类型可以通过不同的方式影响土壤原生生物群落[41],包括凋落物或根系分泌物的质量差异、小气候的变化等。有研究表明,植物多样性越高,变形虫原生生物的丰度越高[44],在植被演替过程中,随着时间的推移,寄主变形虫物种丰富度同步增加[45]。这证实了本研究得出的结论,即植被丰富度、多样性、均匀度和生物量是原生生物群落组成和结构变化的主要驱动因子。而土壤理化性质中总孔隙度、容重、有机质、全氮、全磷、有效磷、速效钾及pH是影响原生生物群落的关键环境因子。在一定范围内,土壤有机质和总磷含量增加,促进原生生物的多样性和丰度提升[45]。土壤有机碳含量与原生生物功能多样性正相关,高有机碳含量对维持原生生物高功能多样性至关重要[46]。而本研究结果显示,原生生物与有机质呈负相关,这与前人研究不符[47],可能是由于放牧破坏了固碳的平衡,有机质含量未达到促进原生生物多样性的范围。土壤氮素对原生生物的影响较为复杂。随土壤全氮含量的增加,纤毛虫、变形虫和藻类的多样性与丰度逐渐增加。然而,本研究表明,原生生物与全氮呈负相关,这归因于原生生物群落的复杂性和土壤的空间异质性和性质差异,因此,原生生物对养分变化的响应不一致。土壤pH作为土壤中微生物生命活动的关键指标,会显著影响原生生物生命活动所需底物的化学形态、浓度和可利用性[48],进而影响原生生物群落的分布、密度、物种组成以及多样性等[49]。在一定范围内,土壤pH的降低导致多数原生生物的丰度下降[50]。然而,在全球范围内,土壤pH对土壤原生生物群落的丰度和多样性的影响相对较小[51],与细菌群落主要受pH影响不同[52],这可能与其宽泛的pH适应范围有关。本研究发现,原生生物多样性与土壤环境之间具有显著的相关性,这与现有的许多文献一致[53–54]。然而,土壤性质对土壤原生生物的影响并不具有普遍性。Seppey等[55]报道了原生生物群落可能对地形和气候因子较土壤性质更敏感。不同的调查尺度可能导致不同的研究结论。本研究仅在局域尺度上证明了土壤属性对土壤原生生物多样性和组成的驱动作用。
总体而言,土壤原生生物群落结构的变化并不明显,且CK与各放牧处理未形成鲜明的界线,可能是所设定的放牧强度尚未达到分化原生生物群落结构的环境,也许在未来更长时间的重度利用影响下才能表现出明显差异。放牧通过改变环境因子进而影响原生生物的种类及丰度,从而塑造了带有荒漠草原地域性特征的原生生物群落。此外,未来应该从环境适应性和营养级关系来探索原生生物在土壤-植物系统中的关键作用。
4 结论放牧对土壤原生生物群落发展存在阈值效应,轻度放牧能够维持荒漠草原土壤肥力,增强土壤原生生物多样性并导致群落更具结构性,有利于土壤养分的周转和能量的流动,能够改变过度放牧所致的原生生物群落多样性降低的不利影响,而这归因于放牧通过改变植被特征和土壤环境因子,在环境因子的共同作用下进而影响土壤原生生物群落。总之,未来研究应结合土壤微生物群落,分析长期放牧下食物来源与土壤原生生物群落结构的关系,以深入解析原生生物群落变化及其在土壤微食物网营养级关系中的关键作用,并通过调整放牧管理制度加强对有益土壤原生生物功能群的利用以促进植物健康和草原生态系统的可持续发展。
| [1] |
Cheng J W, Ma W H, Hao B H, et al. Divergent responses of nematodes in plant litter versus in top soil layer to nitrogen addition in a semi-arid grassland[J]. Applied Soil Ecology, 2021, 157: 103719. DOI:10.1016/j.apsoil.2020.103719
(  0) 0) |
| [2] |
Yan R R. Effects of different grazing systems on vegetation and soil in Stipa breviflora desert steppe[D]. Hohhot: Inner Mongolia Agricultural University, 2008.[闫瑞瑞. 不同放牧制度对短花针茅荒漠草原植被与土壤影响的研究[D]. 呼和浩特: 内蒙古农业大学, 2008.]
(  0) 0) |
| [3] |
Pan F J, Yan R R, Zhao J L, et al. Effects of grazing intensity on soil nematode community structure and function in different soil layers in a meadow steppe[J]. Plant and Soil, 2022, 471(1): 33-46.
(  0) 0) |
| [4] |
Bai Y F, Cotrufo M F. Grassland soil carbon sequestration: Current understanding, challenges, and solutions[J]. Science, 2022, 377(6606): 603-608. DOI:10.1126/science.abo2380
(  0) 0) |
| [5] |
Nannipieri P, Ascher J, Ceccherini M T, et al. Microbial diversity and soil functions[J]. European Journal of Soil Science, 2017, 68(1): 12-26. DOI:10.1111/ejss.4_12398
(  0) 0) |
| [6] |
Cui J J, Wang L, Han Z J, et al. Research progress on the effects of soil protozoa on plant growth mechanism (In Chinese)[J]. Anhui Agricultural Science Bulletin, 2022, 28(9): 29-32. [崔晶晶, 王丽, 韩卓君, 等. 土壤原生动物对植物生长机制影响的研究进展[J]. 安徽农学通报, 2022, 28(9): 29-32.]
(  0) 0) |
| [7] |
Lin B. Response of soil biological properties to different grazing managements in Damxung alpine meadow[D]. Hefei: University of Science and Technology of China, 2013.[林斌. 当雄高寒草甸草原土壤生物学特性对不同放牧措施的响应[D]. 合肥: 中国科学技术大学, 2013.]
(  0) 0) |
| [8] |
De H S. Effects of different grazing intensities on soil fauna communities in a Stipa breviflora desert steppe[D]. Hohhot: Inner Mongolia Agricultural University, 2016.[德海山. 放牧强度对短花针茅荒漠草原土壤动物群落的影响[D]. 呼和浩特: 内蒙古农业大学, 2016.]
(  0) 0) |
| [9] |
Sun Y X, Lin Q M, Zhao X R, et al. Distribution of four protozoan genera in rhizosphere and non-rhizosphere soil of corn (In Chinese)[J]. Scientia Agricultura Sinica, 2003, 36(11): 1399-1402. DOI:10.3321/j.issn:0578-1752.2003.11.030 [孙焱鑫, 林启美, 赵小蓉, 等. 玉米根际与非根际土壤中4种原生动物分布特征[J]. 中国农业科学, 2003, 36(11): 1399-1402.]
(  0) 0) |
| [10] |
Hou F J, Chang S H, Yu Y W, et al. A review on trampling by grazed livestock (In Chinese)[J]. Acta Ecologica Sinica, 2004, 24(4): 784-789. DOI:10.3321/j.issn:1000-0933.2004.04.020 [侯扶江, 常生华, 于应文, 等. 放牧家畜的践踏作用研究评述[J]. 生态学报, 2004, 24(4): 784-789.]
(  0) 0) |
| [11] |
Qi Y. Influence of grazing on community characteristic and reproduction traits of plant population[D]. Beijing: China Agricultural University, 2005.[祁永. 放牧对草原群落特征及种群繁殖特性的影响[D]. 北京: 中国农业大学, 2005.]
(  0) 0) |
| [12] |
Su C. Response of soil ciliate community to various grazing intensity in Swamp meadow in Maqu, Gannan, Gansu[D]. Lanzhou: Northwest Normal University, 2013.[苏苌. 甘肃甘南玛曲沼泽化草甸土壤纤毛虫群落对不同放牧强度的响应[D]. 兰州: 西北师范大学, 2013.]
(  0) 0) |
| [13] |
Rodríguez M A, Brown V K, Gómez-Sal A. The vertical distribution of below-ground biomass in grassland communities in relation to grazing regime and habitat characteristics[J]. Journal of Vegetation Science, 1995, 6(1): 63-72. DOI:10.2307/3236257
(  0) 0) |
| [14] |
Li Q, Mayzlish E, Shamir I, et al. Impact of grazing on soil biota in a Mediterranean grassland[J]. Land Degradation & Development, 2005, 16(6): 581-592.
(  0) 0) |
| [15] |
Xiong W, Song Y Q, Yang K M, et al. Rhizosphere protists are key determinants of plant health[J]. Microbiome, 2020, 8: 27. DOI:10.1186/s40168-020-00799-9
(  0) 0) |
| [16] |
Zhang S M. The effect of protozoa movement on soil P translocation and transformation[D]. Beijing: China Agricultural University, 2005.[张书美. 原生动物运动对土壤磷运移和转化的作用[D]. 北京: 中国农业大学, 2005.]
(  0) 0) |
| [17] |
Gao Z L, Karlsson I, Geisen S, et al. Protists: Puppet Masters of the rhizosphere microbiome[J]. Trends in Plant Science, 2019, 24(2): 165-176. DOI:10.1016/j.tplants.2018.10.011
(  0) 0) |
| [18] |
Geisen S. The bacterial-fungal energy channel concept challenged by enormous functional versatility of soil protists[J]. Soil Biology and Biochemistry, 2016, 102: 22-25. DOI:10.1016/j.soilbio.2016.06.013
(  0) 0) |
| [19] |
Guo S, Xiong W, Hang X N, et al. Protists as main indicators and determinants of plant performance[J]. Microbiome, 2021, 9(1): 64. DOI:10.1186/s40168-021-01025-w
(  0) 0) |
| [20] |
Zhao Z B, He J Z, Geisen S, et al. Protist communities are more sensitive to nitrogen fertilization than other microorganisms in diverse agricultural soils[J]. Microbiome, 2019, 7(1): 33. DOI:10.1186/s40168-019-0647-0
(  0) 0) |
| [21] |
Bonkowski M. Protozoa and plant growth: The microbial loop in soil revisited[J]. New Phytologist, 2004, 162(3): 617-631. DOI:10.1111/j.1469-8137.2004.01066.x
(  0) 0) |
| [22] |
Zhao X R, Lin Q M, Soil L B G D O, et al. Diversity of phosphate-dissolving microorganisms in corn rhizosphere[J]. Agricultural Sciences in China, 2003, 2(2): 222-228.
(  0) 0) |
| [23] |
Li B. The rangeland degradation in North China and its preventive strategy (In Chinese)[J]. Scientia Agricultura Sinica, 1997, 30(6): 2-10. [李博. 中国北方草地退化及其防治对策[J]. 中国农业科学, 1997, 30(6): 2-10.]
(  0) 0) |
| [24] |
Bao S D. Soil and agricultural chemistry analysis (In Chinese). 3rd ed[M]. Beijing: China Agriculture Press, 2000. [鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [25] |
Osem Y, Perevolotsky A, Kigel J. Grazing effect on diversity of annual plant communities in a semi-arid rangeland: Interactions with small-scale spatial and temporal variation in primary productivity[J]. Journal of Ecology, 2002, 90(6): 936-946. DOI:10.1046/j.1365-2745.2002.00730.x
(  0) 0) |
| [26] |
Wang Y H, Song X H, Wang Z W, et al. Response of plant community diversity and productivity on different stocking rates (In Chinese)[J]. Chinese Journal of Grassland, 2018, 40(6): 107-112. [王悦骅, 宋晓辉, 王占文, 等. 植物群落多样性和生产力对不同载畜率的响应[J]. 中国草地学报, 2018, 40(6): 107-112.]
(  0) 0) |
| [27] |
Wang G J, Wang S P, Hao Y B, et al. Effect of grazing on the plant functional group diversity and community biomass and their relationship along a precipitation gradient in Inner Mongolia Steppe (In Chinese)[J]. Acta Ecologica Sinica, 2005, 25(7): 1649-1656. [王国杰, 汪诗平, 郝彦宾, 等. 水分梯度上放牧对内蒙古主要草原群落功能群多样性与生产力关系的影响[J]. 生态学报, 2005, 25(7): 1649-1656.]
(  0) 0) |
| [28] |
Wheeler M A, Trlica M J, Frasier G W, et al. Seasonal grazing affects soil physical properties of a montane riparian community[J]. Journal of Range Management, 2002, 55(1): 49-56.
(  0) 0) |
| [29] |
Pan J C, Dong Z, Li H L, et al. Multi-fractal characteristics of soil particles and soil physicochemical properties in responses to grazing intensity in desert steppe (In Chinese)[J]. Journal of Arid Land Resources and Environment, 2021, 35(8): 93-99. [潘嘉琛, 董智, 李红丽, 等. 短花针茅荒漠草原土壤颗粒多重分形及理化性质对放牧强度的响应[J]. 干旱区资源与环境, 2021, 35(8): 93-99.]
(  0) 0) |
| [30] |
Feyisa K, Beyene S, Angassa A, et al. Effects of enclosure management on carbon sequestration, soil properties and vegetation attributes in East African rangelands[J]. Catena, 2017, 159: 9-19.
(  0) 0) |
| [31] |
Abdalla M, Hastings A, Chadwick D R, et al. Critical review of the impacts of grazing intensity on soil organic carbon storage and other soil quality indicators in extensively managed grasslands[J]. Agriculture, Ecosystems & Environment, 2018, 253: 62-81.
(  0) 0) |
| [32] |
Li X D, Zhang C P, Fu H, et al. Grazing exclusion alters soil microbial respiration, root respiration and the soil carbon balance in grasslands of the Loess Plateau, Northern China[J]. Soil Science and Plant Nutrition, 2013, 59(6): 877-887.
(  0) 0) |
| [33] |
Luo Y L, Li Q Q, Wang C Q, et al. Spatial variability of soil C/N ratio and its influence factors at a county scale in hilly area of Mid-Sichuan Basin, Southwest China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2015, 26(1): 177-185. [罗由林, 李启权, 王昌全, 等. 川中丘陵县域土壤碳氮比空间变异特征及其影响因素[J]. 应用生态学报, 2015, 26(1): 177-185.]
(  0) 0) |
| [34] |
Harpole W S, Ngai J T, Cleland E E, et al. Nutrient co-limitation of primary producer communities[J]. Ecology Letters, 2011, 14(9): 852-862.
(  0) 0) |
| [35] |
Sun H Y, Wan S B, Li L, et al. Effects of grazing on soil nutrients and microbial biomass in desert steppe (In Chinese)[J]. Bulletin of Soil and Water Conservation, 2015, 35(2): 82—88, 93. [孙海燕, 万书波, 李林, 等. 放牧对荒漠草原土壤养分及微生物量的影响[J]. 水土保持通报, 2015, 35(2): 82—88, 93.]
(  0) 0) |
| [36] |
Cai Y R. Spatial heterogeneity of soil function and its response to grazing in shrub-encroached grassland[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021.[蔡育蓉. 灌丛化草原土壤功能空间异质性及其对放牧的响应[D]. 北京: 中国农业科学院, 2021.]
(  0) 0) |
| [37] |
Wu J H. Response of soil physical and chemical properties and microbe to different grazing intensities in intemperate typical steppe[D]. Hohhot: Inner Mongolia University, 2018.[邬嘉华. 温带典型草原土壤理化性质及微生物对放牧强度的响应[D]. 呼和浩特: 内蒙古大学, 2018.]
(  0) 0) |
| [38] |
Tang L Y, Guo H, Yang Z A. Differences in plant community and soil of alpine meadow under different grazing patterns on the Qinghai–Tibet Plateau (In Chinese)[J]. Pratacultural Science, 2021, 38(7): 1209-1217. [唐刘燕, 国慧, 杨振安. 不同放牧模式下青藏高原高寒草甸植被群落和土壤差异[J]. 草业科学, 2021, 38(7): 1209-1217.]
(  0) 0) |
| [39] |
Chi Y C. Relationship between soil nematode community characteristics and soil fertility in desert steppe with different grazing intensities[D]. Hohhot: Inner Mongolia Agricultural University, 2023.[迟亦成. 不同放牧强度荒漠草原土壤线虫群落特征与土壤肥力的关系[D]. 呼和浩特: 内蒙古农业大学, 2023.]
(  0) 0) |
| [40] |
Yang Q, He G Y, Sun H Z, et al. The response of soil physico-chemical property and microbial biomass to grazing on Tibetan Plateau (In Chinese)[J]. Journal of Gansu Agricultural University, 2013, 48(4): 76-81. [杨青, 何贵永, 孙浩智, 等. 青藏高原高寒草甸土壤理化性质及微生物量对放牧强度的响应[J]. 甘肃农业大学学报, 2013, 48(4): 76-81.]
(  0) 0) |
| [41] |
Acosta-Mercado D, Lynn D H. Soil ciliate species richness and abundance associated with the rhizosphere of different subtropical plant species[J]. Journal of Eukaryotic Microbiology, 2004, 51(5): 582-588.
(  0) 0) |
| [42] |
Yao B M, Zeng Q, Zhang L M. Research progress on the biodiversity and ecological function of soil protists (In Chinese)[J]. Biodiversity Science, 2022, 30(12): 234-245. [姚保民, 曾青, 张丽梅. 土壤原生生物多样性及其生态功能研究进展[J]. 生物多样性, 2022, 30(12): 234-245.]
(  0) 0) |
| [43] |
Zhao J. Characteristics of soil protist and autotrophic community and their drivers in grasslands of the Tibetan Plateau[D]. Hohhot: Inner Mongolia University, 2023.[赵锦. 青藏高原草地土壤原生生物和自养微生物群落特征及其驱动因素[D]. 呼和浩特: 内蒙古大学, 2023.]
(  0) 0) |
| [44] |
Ledeganck P, Nijs I, Beyens L. Plant functional group diversity promotes soil protist diversity[J]. Protist, 2003, 154(2): 239-249.
(  0) 0) |
| [45] |
Bernasconi S M, Bauder A, Bourdon B, et al. Chemical and biological gradients along the damma glacier soil chronosequence, Switzerland[J]. Vadose Zone Journal, 2011, 10(3): 867-883.
(  0) 0) |
| [46] |
Yang Y, Yao J, Hu S, et al. Effects of agricultural chemicals on DNA sequence diversity of soil microbial community: A study with RAPD marker[J]. Microbial Ecology, 2000, 39(1): 72-79.
(  0) 0) |
| [47] |
Xue P P, Minasny B, McBratney A, et al. Land use effects on soil protists and their top-down regulation on bacteria and fungi in soil profiles[J]. Applied Soil Ecology, 2023, 185: 104799.
(  0) 0) |
| [48] |
Kemmitt S J, Wright D, Goulding K W T, et al. pH regulation of carbon and nitrogen dynamics in two agricultural soils[J]. Soil Biology and Biochemistry, 2006, 38(5): 898-911.
(  0) 0) |
| [49] |
Dupont A Ö C, Griffiths R I, Bell T, et al. Differences in soil micro-eukaryotic communities over soil pH gradients are strongly driven by parasites and saprotrophs[J]. Environmental Microbiology, 2016, 18(6): 2010-2024.
(  0) 0) |
| [50] |
Ning Y Z, Shen Y F. Observation on feeding habits of soil protozoa in Chinese six typical zones (In Chinese)[J]. Zoological Research, 1998, 19(5): 62-65. [宁应之, 沈韫芬. 中国典型地带土壤原生动物食性的观察[J]. 动物学研究, 1998, 19(5): 62-65.]
(  0) 0) |
| [51] |
Oliverio A M, Geisen S, Delgado-Baquerizo M, et al. The global-scale distributions of soil protists and their contributions to belowground systems[J]. Science Advances, 2020, 6(4): eaax8787.
(  0) 0) |
| [52] |
Delgado-Baquerizo M, Oliverio A M, Brewer T E, et al. A global atlas of the dominant bacteria found in soil[J]. Science, 2018, 359(6373): 320-325.
(  0) 0) |
| [53] |
Zhang J D, Li S Y, Sun X Y, et al. Sustainability of urban soil management: Analysis of soil physicochemical properties and bacterial community structure under different green space types[J]. Sustainability, 2019, 11(5): 1395.
(  0) 0) |
| [54] |
Grierson J, Flies E J, Bissett A, et al. Which soil microbiome? Bacteria, fungi, and protozoa communities show different relationships with urban green space type and use-intensity[J]. Science of the Total Environment, 2023, 863: 160468.
(  0) 0) |
| [55] |
Seppey C V W, Broennimann O, Buri A, et al. Soil protist diversity in the Swiss western Alps is better predicted by topo-climatic than by edaphic variables[J]. Journal of Biogeography, 2020, 47(4): 866-878.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


