2. 中国科学院大学, 北京 100049;
3. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所), 南京 211135
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China
土壤有机质(Soil Organic Matter,SOM)是指土壤中各种动、植物残体,微生物体及其分解和合成的有机物质[1]。作为碳循环重要组成部分之一,SOM在促进粮食增产和减缓气候变化等重要土壤功能上发挥着关键作用[2]。SOM中包含各种不同类型的有机物,这些有机物在土壤中的平均停留时间从几天到几千年不等[3-4]。根据13C同位素标记计算得到的周转周期显示,土壤中的正构烷烃保存时间相对较长[5]。因此,研究不同成土环境下土壤正构烷烃的变化有助于阐明SOM的来源和转化机制,可为SOM循环提供新的认识[6–8]。
叶蜡正构烷烃是植物表皮蜡质的一部分,它们在植物叶片表面形成保护层,有助于减少水分蒸发并保护植物免受环境压力。在植物死亡和分解后,这些正构烷烃被释放到土壤中,并成为土壤有机质的一部分。作为一类不溶于水的碳氢化合物,正构烷烃不易被降解,通常在沉积物中保存相对完好[9]。因此,土壤中的正构烷烃可以作为植物输入的生物标志物,近年来已被广泛应用于历史植被和古环境重建[10–13],有机质的来源解析[1,7],有机碳的周转与转化评估[8,14]等方面。相较于传统古环境指标(如古地磁、孢粉等),正构烷烃能更好地反映局部地形地貌上沉积环境的变化[15]。将正构烷烃与传统的环境代用指标相结合,能够更加准确地揭示区域环境演变。
在自然界中,由细菌等微生物产生的正构烷烃链长大多小于22,中等链长的正构烷烃主要来源于苔藓类、藻类等水生植物,而长链正构烷烃(C25~C33)是高等植物叶蜡的重要组分[16]。植物体内蜡质合成始于表皮细胞中偶数碳的长链脂肪酸,其通过脱羧作用减少一个碳合成正构烷烃[17–19]。因此正构烷烃碳数表现为强烈的奇数优势,而有机质的降解和矿化过程会使这种奇偶优势降低[20-21]。通常正构烷烃碳数分布衍生出一些指标能帮助推断有机质的来源及降解情况,包括优势主峰(Cmax)、碳优势指数(CPI)[21]、奇偶优势比(OEP)[22]、平均链长(ACL)[23]。长链正构烷烃CPI和OEP值常用来反映土壤有机质的微生物降解程度。也有研究认为,表土长链正构烷烃CPI值受控于气候干湿状况影响。在温暖湿润的环境下,无奇偶优势的微生物长链正构烷烃输入,以及由微生物导致的奇链正构烷烃降解均可能导致沉积物中CPI值降低[24]。ACL通常用于表征叶蜡正构烷烃的链长分布,其大小与温度或环境湿度相关。这是因为植物倾向于在较高的环境温度下生物合成更高分子的蜡质,以保持其叶表面的硬度[25]。在高温干旱地区,土壤正构烷烃ACL值通常较高[23,25]。然而,不同植物种属产生的正构烷烃碳数差异,导致草本植物ACL普遍高于木本植物[26]。因此,沉积物ACL的增加也可能与草本植物输入的增加有关。
不同光合作用途径陆生植物叶蜡碳同位素值不同。以灌木、木本植物和部分草本植物为主的C3植物,δ13Calk值变化范围为-32‰~-39‰;以草本植物及部分灌丛植物为主的C4植物,δ13Calk值的变化范围为–18‰~–22‰[9,27-28]。因此δ13Calk值常用来反映地质历史时期C3/C4植物生物量的变化,进而反映气候变化[29–31]。此外,由于有机物降解会改变有机碳同位素的值[32],相较于土壤有机碳同位素,正构烷烃单体碳同位素指示意义更加明确[33]。
黑土是指具有一定厚度暗黑色腐殖质表层的土壤,自然肥力较高,对全球粮食生产起着重要作用。自Dokuchaev对俄罗斯黑钙土的研究以来,黑土被广泛定义为草原土壤[34]。现有研究普遍认为东北地区黑土主要形成于早全新世至全新世适宜期(9~6 cal ka B.P.)[35-36]。然而近期的研究对于黑土成土时期有机质来源以及成土年龄均出现了新的见解。宋运红等[36]对绥化地区典型黑土剖面的孢粉种类分析得出,黑土发育时期上覆植被以稀树草原为主。Yang等[37]利用3个典型黑土剖面的光释光测年数据及HL剖面黑土层下方埋藏木炭的14C测年数据结果提出东北地区黑土可能形成于16.9~12.6 ka B.P.。基于以上新的认识,必须使用先进的方法去验证相应时期的成土因素是否满足成土条件。脂类生物标志物在指示土壤中植物有机质的来源以及成土环境条件方面具有重要的指示作用。与其他土壤类型相比,黑土中正构烷烃含量较高[38],这一特性提升了脂类生物标志物在黑土中的应用潜力。然而,与环境相对封闭的湖泊沉积物不同,土壤是一个复杂的开放系统,其中物质迁移、转化及扰动等过程不断进行[39]。现阶段关于黑土形成演化过程是否会影响正构烷烃分布的研究还比较有限。本研究旨在评估成土过程对黑土正构烷烃指标的影响,探讨正构烷烃在黑土中的指示意义,为揭示黑土形成过程中有机质来源和成土环境变化提供依据。
1 材料与方法 1.1 研究区概况松嫩平原位于大、小兴安岭及长白山山脉的中部区域,属于温带大陆性季风气候,年均温为–1℃~5℃,全年平均降水量为350~600 mm。研究区地貌主要为漫岗或冲积平原,海拔大约在200 m左右,地形平缓或呈波状起伏,坡度通常小于5°。松嫩平原土壤肥沃,黑土和黑钙土占比超过60%,是世界三大黑土集中分布区之一。
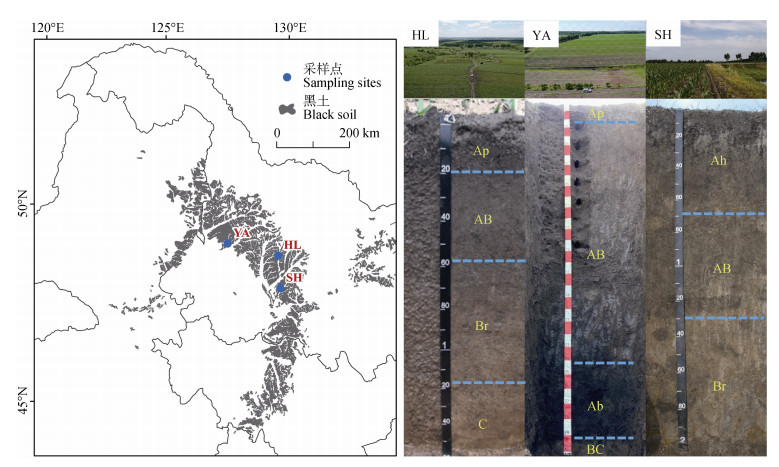
采样点位于海伦、依安和绥化(图 1),前两个地点为农田,种植玉米,绥化样点为荒地,上覆植被为杂草。3个土壤剖面类型均为均腐土,海伦、依安、绥化剖面分别用代码HL、YA和SH表示。其中HL剖面位于岗地上部,坡度约1°,处于相对稳定的地形条件下,剖面层次清晰平滑,黑土层厚度为60 cm,90 cm以下过渡到母质层,母质为黄土状沉积物。YA剖面位于岗地坡中部位,坡度约5°,坡积作用明显,240~290 cm处存在明显埋藏黑土层,290 cm以下为黄土状沉积物。SH剖面所在区域地形平坦,剖面层次渐变平滑,黑土层厚60 cm,70~130 cm可见多处动物活动痕迹,其中120~130 cm处有一个明显的动物通道,颜色呈黑灰色。HL剖面采样间隔为10 cm,共采集16个样品。YA剖面采样间隔为40 cm,270 cm以下部分加密为10 cm间隔采样,共采集10个样品。SH剖面采样间隔为10 cm,100 cm以下部分为20 cm间隔采样,共采集16个样品。
|
注:图中Ap为耕作层、Ah为腐殖质层、AB为腐殖质层与淀积层过渡层、Ab为腐殖质埋藏层、Br为氧化还原层、BC为淀积层与母质层过渡层、C为母质层。HL、YA、SH为位于海伦、依安、绥化的三个剖面。下同。 Note: Ap is the cultivation layer, Ah is the humus layer, AB is the transitional layer of the humus layer and illuvial layer, Ab is the burial layer of humus, Br is the redox layer, BC is the transitional layer of illuvial layer and parent material, C is the parent material layer. HL, YA, and SH are located in Hailun, Yi'an, and Suihua, respectively. The same as below. 图 1 采样点位置及剖面层次 Fig. 1 Sampling sites and profile layers |
(1)基本理化属性测定。采集到的样品自然风干后,剔除可见的植物残体,研磨后分别过2 mm和0.15 mm孔径筛。使用激光粒度分析仪(MastSizer 2000)测定土壤粒度;电位法测定土壤pH,土水比为1︰2.5;多波段有机碳元素分析仪(DRI Model 2015)测定土壤全碳(TC)和全氮(TN)含量。鉴于土壤pH呈中性至弱酸性,无石灰反应,因此可将全碳含量转换为有机碳含量。
(2)正构烷烃及其碳同位素测定。用锡箔纸取5~8 g粉末状样品,加入15 mL二氯甲烷:甲醇(DCM︰MeOH=9︰1,v/v)混合溶液萃取3次,并用超声抽提法加速溶解反应。提取的上层清液在氮气中吹干后加入约3 mL 6% KOH的甲醇溶液,超声10 min后静置过夜,待提取液充分皂化。向提取液中加入1.5 mL正己烷,震荡离心后吸取上层清液至4 mL样品瓶中,重复3次操作。将样品放入通风橱中静置风干。准备活化好的硅胶(马弗炉400℃烧制4 h)装入硅胶柱中(柱高约12 cm),用二氯甲烷和正己烷分别润洗后,少量多次用正己烷润洗样品瓶并加入进硅胶柱中,洗脱出烷烃组分装于4 mL样品瓶中。待样品风干后,转移至2 mL样品瓶,等待上机测试。
待测样用正己烷定容至0.5 mL后使用气相色谱仪(Angilent 7890A GC)进行正构烷烃的量化分析,采用氢火焰电离检测器(FID)。仪器配置为:毛细管柱为HP-5MS型(30 m × 250 μm × 250 μm),初始温度80℃保留2 min,3 ℃·min–1升温至305℃保留20 min。载气为氦气。使用正构烷烃(C10~C40)的混合标准作为外标进行定量,测试结果由正构烷烃峰面积积分得到。
根据正构烷烃含量对样品使用正己烷定容至100 μL。采用稳定同位素质谱仪(Delta V+GC IsoLink)对正构烷烃组分进行单体碳同位素分析。其中,质谱仪为DELTA V Advantage同位素比质谱仪(Thermo Fisher,USA),气相色谱仪为TRACE 1310 GC(Thermo Fisher,USA)。色谱柱型号为DB-5MS(30 m × 0.25 mm × 0.25 μm),载气为氦气,无分流进样1 μL。柱始温为60℃,以10 ℃·min–1升温5 min后再以5 ℃·min–1升温至310℃,终温恒定15 min。正构烷烃单体碳同位素组成按PDB标准进行,仪器分析的误差小于±0.5‰。
1.3 数据分析使用几种常见的正构烷烃指数来描述正构烷烃分布。
正构烷烃浓度(∑C25~35)为单位质量干重的土壤中正构烷烃C25~C35绝对浓度之和,单位为μg·g–1。
碳优势指数(CPI)[21]是反映正构烷烃奇偶碳数相对丰度的指标,可用于确定正构烷烃的来源和降解程度,CPI值越低表明正构烷烃降解作用较强。
| $ \begin{array}{l} {\rm{CPI}} = \frac{{{{\rm{C}}_{27}} + {{\rm{C}}_{29}} + {{\rm{C}}_{31}} + {{\rm{C}}_{33}}}}{{2 \times ({{\rm{C}}_{26}} + {{\rm{C}}_{28}} + {{\rm{C}}_{30}} + {{\rm{C}}_{32}})}} + \hfill \\ \;\;\;\;\;\;\;\;\frac{{{{\rm{C}}_{27}} + {{\rm{C}}_{29}} + {{\rm{C}}_{31}} + {{\rm{C}}_{33}}}}{{2 \times ({{\rm{C}}_{28}} + {{\rm{C}}_{30}} + {{\rm{C}}_{32}} + {{\rm{C}}_{34}})}} \hfill \end{array}$ | (1) |
式中,Ci代表碳链长数为i的正构烷烃浓度。
正构烷烃的平均链长(ACL)是Poynter等[23]计算出来的,用于区分主要来自落叶乔木/灌木的叶蜡(C27和C29;即较低的值),以及主要源自草类/草本植物(C31和C33;即更高的值)。
| $ {\rm{ACL}} = \frac{{25 \times {{\rm{C}}_{25}} + 27 \times {{\rm{C}}_{27}} + 29 \times {{\rm{C}}_{29}} + 31 \times {{\rm{C}}_{31}} + 33 \times {{\rm{C}}_{33}}}}{{{{\rm{C}}_{25}} + {{\rm{C}}_{27}} + {{\rm{C}}_{29}} + {{\rm{C}}_{31}} + {{\rm{C}}_{33}}}} $ | (2) |
式中,Ci代表碳链长数为i的正构烷烃浓度。
正构烷烃长链之间的比值(ratio)同样可用于古植物和古气候的鉴定[40],本研究根据正构烷烃碳链的相对丰度,选取
表 1为3个剖面各发生层基本理化性质。其中,HL剖面SOM在表层最高,向下随深度增加逐渐降低,C/N变化趋势与SOM一致。YA剖面SOM在表层最高,AB层略微下降,Ab层有所增加,达28.3 g·kg–1,BC层降至最低。SH剖面SOM自上而下降低,Br层以下基本无变化。3个剖面的粒度组成均以粉砂为主,黏粒含量次之,其中YA剖面的黏粒组分相对较高,砂粒含量最低且自上而下降低。3个剖面的pH均在表层呈弱酸性,随剖面深度向下逐渐呈中性。
|
|
表 1 剖面基本理化属性 Table 1 Basic physicochemical properties of profiles |
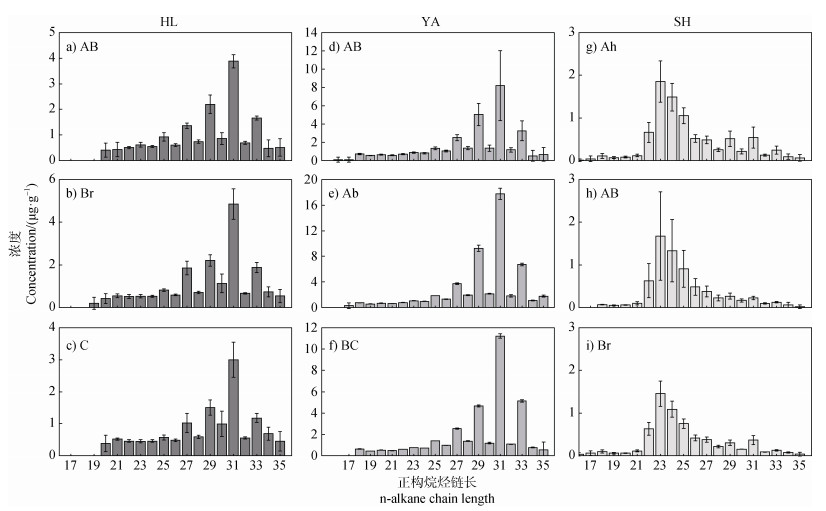
YA、HL和SH剖面的正构烷烃分布特征如图 2所示,样品中正构烷烃碳数范围为C17~C33。HL和YA剖面均为单峰型(图 2a~图 2f),主峰为C31,分布构型在剖面上无明显变化,即中链正构烷烃(C17~C24)浓度较低,长链正构烷烃(C25~C33)浓度较高且具有明显奇偶优势。SH剖面为双峰型(图 2g~图 2i),主峰为C23和C31。前峰为高浓度峰,集中在C22~C25,无奇偶优势,AB层碳峰浓度波动最大,在0.50~2.83 μg·g–1范围内波动。后峰为低浓度峰,集中在C25~C33,部分层位奇偶优势不明显。
|
图 2 黑土正构烷烃碳数分布特征 Fig. 2 Carbon number distribution characteristics of n-alkanes in black soil |
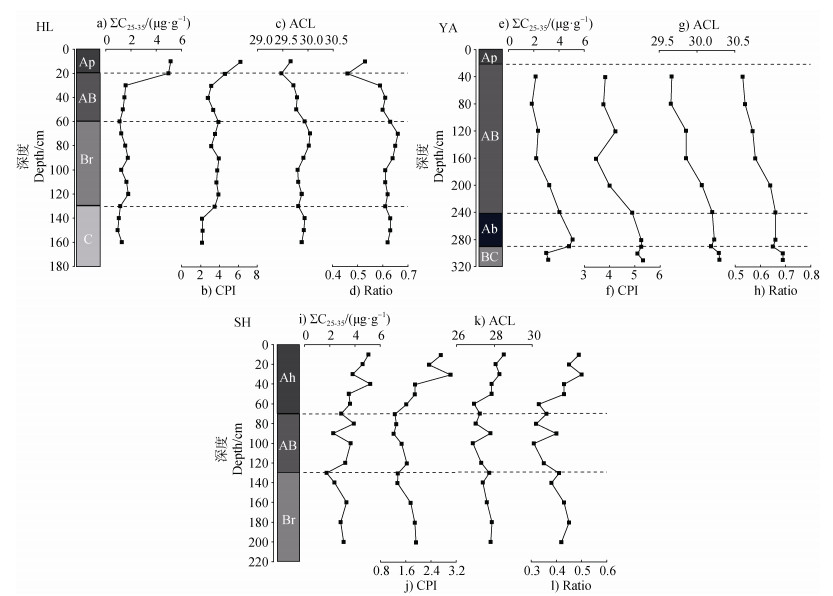
土壤中的长链正构烷烃主要来自高等植物的叶蜡[9,16]。三个剖面的长链正构烷烃浓度及相关参数变化如图 3所示。HL剖面ΣC25~35值自160至30 cm变化较稳定(图 3a),至表层明显增加,达5.2 μg·g–1,说明可提取的游离态正构烷烃在土壤表层富集,而在表层以下趋于稳定。CPI值介于2.2~6.2(图 3b),在母质层稳定在低值,表层有所增加,反映出表层正构烷烃分解程度低、抗分解能力弱,而下部土层游离态正构烷烃分解程度高。ACL和ratio值变化范围分别为29.8~30.4、0.5~0.7,变化趋势均从160~20 cm逐渐降低(图 3c,图 3d)。
|
注:CPI,碳优势指数;ACL,平均链长。 Note: CPI, carbon preference index; ACL, average chain length. 图 3 黑土正构烷烃浓度与参数分布 Fig. 3 Concentration and parameter distribution of n-alkanes in black soil profiles |
YA剖面ΣC25~35值在Ab层明显增加(图 3e),整体变化趋势自310至280 cm逐渐升高至5.1 μg·g–1,从280至40 cm降低至2.2 μg·g–1,表明埋藏层有效保存了较多游离态的正构烷烃。CPI值介于3.5~5.3(图 3f),变化趋势自下而上逐渐降低,表明叶蜡正构烷烃在埋藏层保存较为良好,分解程度较低。ACL和ratio值变化范围分别为30.0~30.6、0.5~0.7(图 3g,图 3h),变化趋势均自下而上逐渐减少。
SH剖面ΣC25~35值自下而上波动升高(图 3i),CPI值介于1.2~3.0(图 3j),AB层最低,反映正构烷烃降解程度相对较大。ACL和ratio值变化范围分别为29.0~29.9、0.3~0.5(图 3k,图 3l),变化趋势自底部至AB层减少,然后至表层增加。
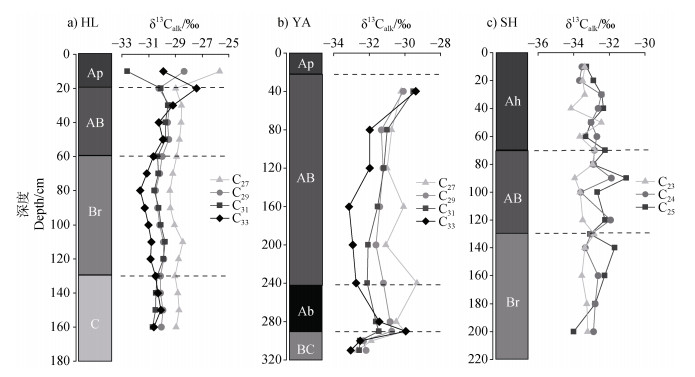
2.3 黑土正构烷烃单体碳同位素分布特征由于3个剖面正构烷烃的浓度均相对较低,因此HL与YA剖面选取测定了含量相对较高的C27、C29、C31和C33这4种化合物的碳同位素组成,同样SH剖面也选取浓度最高的C23、C24、C25。HL与YA剖面整体上δ13Calk值呈C27 > C29 > C31 > C33,且在表层以下不同链长δ13Calk值的变化趋势基本一致。HL剖面在Br层δ13Calk值减少,而在AB层δ13Calk值又增加(图 4a);YA剖面在BC层δ13Calk值偏低,到Ab层δ13Calk值增加,后到AB层δ13Calk值又降低(图 4b);SH剖面整体上同位素值C25 > C24 > C23(图 4c),剖面上有波动但无明显变化趋势。对测得化合物碳同位素值进行加权平均,计算出meanδ13Calk值,剖面HL和YA的meanδ13Calk值范围分别为–29.30‰~–30.27‰和–29.79‰~–32.60‰(图 5a,图 5b),SH剖面C23至C25的meanδ13Calk值为–32.95‰。
|
图 4 黑土正构烷烃的单体碳同位素特征 Fig. 4 Compound-specific carbon isotope characteristics of n-alkanes in black soil profiles |
|
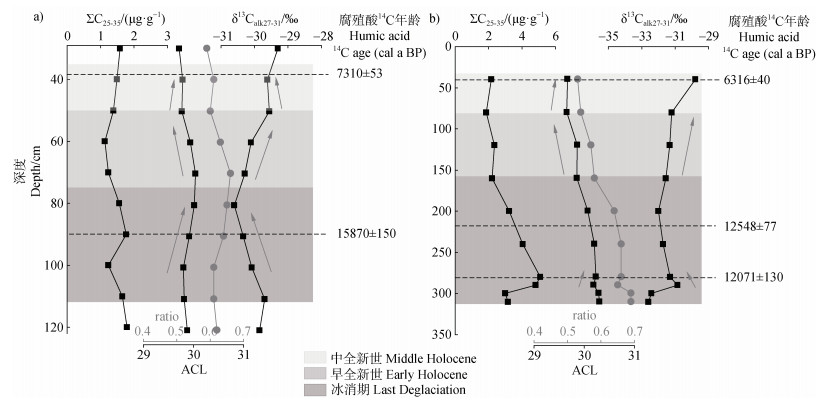
注:a)为HL剖面;b)为YA剖面 Note: a) HL profile; b)YA profile 图 5 正构烷烃参数反映的黑土形成过程中环境变化 Fig. 5 The parameters of n-alkanes reflect the environmental changes during the formation of black soil |
基于Yang等[37]对同一剖面样品测定的腐殖酸14C结果限定年代,结合土壤正构烷烃输入、降解情况以及单体碳同位素指示的古植被变化,可根据指标变化大致划分出年代范围(图 5a,图 5b)。结果显示冰消期ACL和ratio值呈增加趋势,δ13Calk值呈下降趋势;早全新世ACL和ratio值减少,δ13Calk值呈增加趋势;至中全新世ACL和ratio值增加,δ13Calk值呈减少趋势。
3 讨论 3.1 黑土形成过程对正构烷烃分布的影响土壤是处于动态变化的自然体,无论是在凋落物分解袋实验中还是在开放的植物-土壤系统中均已证明,正构烷烃进入土壤后总浓度通常随着剖面深度的增加而减少[7,41-42]。然而在本研究中,选取的3种不同成土模式的黑土剖面展现出不同的正构烷烃浓度及参数的变化趋势。HL和SH剖面为自下而上风积而成,表层的SOM和∑C25~35值最高与新鲜的有机质输入有关,随着深度增加逐渐降低并趋于稳定。YA剖面为坡积成因,Ab层中SOM和∑C25~35具有最大值,且C/N和CPI值也是如此,表明埋藏作用使碳的固存环境处于近封闭状态,不稳定的有机碳得以长期埋藏保存,这与有机质在埋藏层的热稳定性特征研究一致[43]。
大多数研究应用正构烷烃生物标志物方法时,基于叶蜡正构烷烃进入沉积物或土壤有机质后其构型不会发生显著变化这一假设。然而,也有一些人考虑到烷烃在土壤中的矿化和降解过程,建立双端元模型,利用森林和草地覆盖下的凋落物和表土中的长链正构烷烃比例来估计植被分布以及潜在的退化效应[44]。东北地区黑土有机质含量高,加之夏季温度湿度适宜,以及良好的土壤通气性,为微生物活动提供了有利的环境。这些条件共同促进了有机质和烷烃的生物降解过程,使其潜在降解条件非常充分。因此,在利用黑土正构烷烃指示有机质来源时,必须慎重考虑降解可能带来的参数上的变化。
此外SH剖面受动物扰动明显,表现为∑C25~35值随剖面深度增加而波动降低(图 3i),在具有明显扰动痕迹的40 cm、90 cm和120 cm处正构烷烃各项结果波动幅度均显著增加,表明正构烷烃对土壤剖面扰动的响应较为敏感,此时正构烷烃衍生参数的指示意义可能会变得模糊。
3.2 黑土正构烷烃及其碳同位素对有机质来源的指示基于以往对黑土有机质来源的普遍认识,结合黑土长链正构烷烃分布的构型特征,可以得出3个剖面均以草本植物输入为主。许多研究证实,土壤中正构烷烃平均碳链长越接近31,草本植物贡献越多,正构烷烃平均碳链长越接近27,落叶乔木或灌木贡献越多[41,45],因此ACL和ratio值可指示植物类型的变化。3种剖面的ACL和ratio随深度变化趋势均表明,全新世以来松嫩平原黑土发育的过程中木本植物比例逐渐增加。这一结果与绥化地区土壤剖面孢粉组合[35]研究结论相吻合,即中全新世(8200~4200 a B.P.)至晚全新世(4200~ a B.P.)早期,植被类型以蒿属、菊科灌丛为主,并存在少量针阔叶混交林,以松属和落叶榛属为主,其数量逐渐增加。
根据δ13Calk值,三种剖面均显示以C3植物为主。其中HL和YA剖面C27至C33趋势基本一致,且整体呈C27 > C29 > C31 > C33,表明C27~C33来源大致相同并且该地区草本植被占大多数,这与正构烷烃中ACL和ratio值指示结果一致。HL剖面表层δ13C27和δ13C29组成偏正,可能受现代耕种的影响。因为隶属于C4植物的玉米,其δ13C27和δ13C29分别为-19.1‰和-18.4‰,随着土壤中玉米输入的增加,δ13C27与δ13C29组成会逐渐偏正[46]。
3.3 黑土正构烷烃及其碳同位素对成土环境的指示结合图 5划分的年代范围,可对黑土正构烷烃及其碳同位素变化特征的指示意义进行讨论。ACL值的变化受纬度气候带影响[47],Zhou等[48]对东北地区哈尼泥炭正构烷烃记录的气候变化分析认为,正构烷烃中ACL增加可能记录的是温度或干旱增加。Liu等[30]通过分析全球分布的陆生高等植物δ13Calk数据与环境因子的关系后得出,C3植物的δ13Calk值与MAP呈显著负相关(R2=0.30;P < 0.05),且与MAT呈弱负相关(R2=0.09;P < 0.05)。由此可以推测出,冰消期气温整体上升,夏季降水量增多,土壤中输入的生物量增加且草本植物的比例增加。而新仙女木事件期间,气候相对干冷,黑土发育较为缓慢。至早、中全新世,温度上升,夏季降水增多,土壤中输入的生物量增加且木本植物的比例增加,为黑土发育提供最适宜的条件。HL剖面90至80 cm处CPI降低、δ13C达最低值(图 3f,图 5a),可能是因为Bølling-Allerød时期,气候相对温暖湿润,适宜植物生长,为黑土发育提供了充足的有机质来源。因此冰消期可能满足黑土开始发育的气候条件,而早中全新世相对暖湿的气候则更加有利于黑土快速发育。
4 结论本文通过对松嫩平原不同成土模式黑土剖面的正构烷烃及其同位素分析,认为黑土正构烷烃可以记录土壤演变过程与成土环境信息。其中,埋藏层有利于正构烷烃的固存,而扰动可能会干扰正构烷烃原位记录的其他指示意义。黑土正构烷烃及其碳同位素结果指示土壤有机质主要来源于陆生高等植物,以C3植物为主。全新世以来松嫩平原黑土区主要以草本植物占优势,但在黑土发育过程中木本植物比例逐渐增加。结合14C年代数据,推断冰消期的气候条件可能有助于黑土初步发育,而早中全新世相对暖湿的气候则加速了黑土形成。
| [1] |
Kögel-Knabner I. The macromolecular organic composition of plant and microbial residues as inputs to soil organic matter[J]. Soil Biology and Biochemistry, 2002, 34(2): 139-162. DOI:10.1016/S0038-0717(01)00158-4
(  0) 0) |
| [2] |
Cotrufo M F, Lavallee J M. Soil organic matter formation, persistence, and functioning: A synthesis of current understanding to inform its conservation and regeneration[M]//Advances in Agronomy. Amsterdam: Elsevier, 2022: 1—66.
(  0) 0) |
| [3] |
Bol R, Huang Y, Meridith J A, et al. The 14C age and residence time of organic matter and its lipid constituents in a stagnohumic gley soil[J]. European Journal of Soil Science, 1996, 47(2): 215-222. DOI:10.1111/j.1365-2389.1996.tb01392.x
(  0) 0) |
| [4] |
Wang J K, Xu Y D, Ding F, et al. Process of plant residue transforming into soil organic matter and mechanism of its stabilization: A review (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(3): 528-540. DOI:10.11766/trxb201811140559 [汪景宽, 徐英德, 丁凡, 等. 植物残体向土壤有机质转化过程及其稳定机制的研究进展[J]. 土壤学报, 2019, 56(3): 528-540.]
(  0) 0) |
| [5] |
Schmidt M W I, Torn M S, Abiven S, et al. Persistence of soil organic matter as an ecosystem property[J]. Nature, 2011, 478: 49-56. DOI:10.1038/nature10386
(  0) 0) |
| [6] |
Simpson M J, Otto A, Feng X J. Comparison of solid-state carbon-13 nuclear magnetic resonance and organic matter biomarkers for assessing soil organic matter degradation[J]. Soil Science Society of America Journal, 2008, 72(1): 268-276. DOI:10.2136/sssaj2007.0045
(  0) 0) |
| [7] |
Angst G, John S, Mueller C W, et al. Tracing the sources and spatial distribution of organic carbon in subsoils using a multi-biomarker approach[J]. Scientific Reports, 2016, 6: 29478. DOI:10.1038/srep29478
(  0) 0) |
| [8] |
Wu M S, West A J, Feakins S J. Tropical soil profiles reveal the fate of plant wax biomarkers during soil storage[J]. Organic Geochemistry, 2019, 128: 1-15. DOI:10.1016/j.orggeochem.2018.12.011
(  0) 0) |
| [9] |
Eglinton T I, Eglinton G. Molecular proxies for paleoclimatology[J]. Earth and Planetary Science Letters, 2008, 275(1/2): 1-16.
(  0) 0) |
| [10] |
Sun Q, Xie M M, Lin Y, et al. An n-alkane and carbon isotope record during the last deglaciation from annually laminated sediment in Lake Xiaolongwan, northeastern China[J]. Journal of Paleolimnology, 2016, 56(2): 189-203.
(  0) 0) |
| [11] |
Aichner B, Hilt S, Périllon C, et al. Biosynthetic hydrogen isotopic fractionation factors during lipid synthesis in submerged aquatic macrophytes: Effect of groundwater discharge and salinity[J]. Organic Geochemistry, 2017, 113: 10-16. DOI:10.1016/j.orggeochem.2017.07.021
(  0) 0) |
| [12] |
Rach O, Engels S, Kahmen A, et al. Hydrological and ecological changes in western Europe between 3200 and 2000 years BP derived from lipid biomarker δD values in Lake Meerfelder Maar sediments[J]. Quaternary Science Reviews, 2017, 172: 44-54. DOI:10.1016/j.quascirev.2017.07.019
(  0) 0) |
| [13] |
Schwark L, Zink K, Lechterbeck J. Reconstruction of postglacial to early Holocene vegetation history in terrestrial Central Europe via cuticular lipid biomarkers and pollen records from lake sediments[J]. Geology, 2002, 30(5): 463. DOI:10.1130/0091-7613(2002)030<0463:ROPTEH>2.0.CO;2
(  0) 0) |
| [14] |
Wiesenberg G L B, Schwarzbauer J, Schmidt M W I, et al. Source and turnover of organic matter in agricultural soils derived from n-alkane/n-carboxylic acid compositions and C-isotope signatures[J]. Organic Geochemistry, 2004, 35(11/12): 1371-1393.
(  0) 0) |
| [15] |
Buggle B, Zech M. New frontiers in the molecular based reconstruction of Quaternary paleovegetation from loess and paleosols[J]. Quaternary International, 2015, 372: 180-187. DOI:10.1016/j.quaint.2015.02.046
(  0) 0) |
| [16] |
Eglinton G, Hamilton R J. Leaf epicuticular waxes[J]. Science, 1967, 156(3780): 1322-1335.
(  0) 0) |
| [17] |
Li J J, Huang J H, Xie S C. Plant wax and its response to environmental conditions: An overview (In Chinese)[J]. Acta Ecologica Sinica, 2011, 31(2): 565-574. [李婧婧, 黄俊华, 谢树成. 植物蜡质及其与环境的关系[J]. 生态学报, 2011, 31(2): 565-574.]
(  0) 0) |
| [18] |
Yeats T H, Rose J K C. The formation and function of plant cuticles[J]. Plant Physiology, 2013, 163(1): 5-20. DOI:10.1104/pp.113.222737
(  0) 0) |
| [19] |
Wang D Y, Shao S J, Ji N N, et al. Research advances on genes related to plant cuticular wax synthesis and secretion (In Chinese)[J]. Plant Physiology Journal, 2016, 52(6): 789-798. [王东阳, 邵淑君, 季娜娜, 等. 植物表皮蜡质合成与分泌基因研究进展[J]. 植物生理学报, 2016, 52(6): 789-798.]
(  0) 0) |
| [20] |
Zech M, Krause T, Meszner S, et al. Incorrect when uncorrected: Reconstructing vegetation history using n-alkane biomarkers in loess-paleosol sequences–A case study from the Saxonian loess region, Germany[J]. Quaternary International, 2013, 296: 108-116. DOI:10.1016/j.quaint.2012.01.023
(  0) 0) |
| [21] |
Marzi R, Torkelson B E, Olson R K. A revised carbon preference index[J]. Organic Geochemistry, 1993, 20(8): 1303-1306.
(  0) 0) |
| [22] |
Hoefs M J L, Rijpstra W I C, Sinninghe Damsté J S. The influence of oxic degradation on the sedimentary biomarker record I: Evidence from Madeira Abyssal Plain turbidites[J]. Geochimica et Cosmochimica Acta, 2002, 66(15): 2719-2735.
(  0) 0) |
| [23] |
Poynter J G, Farrimond P, Robinson N, et al. Paleoclimatology and paleometeorology: Modern and past patterns of global atmospheric transport . Dordrecht: Springer Netherlands, 1989.
(  0) 0) |
| [24] |
Luo P, Peng P G, Lü H Y, et al. Latitudinal variations of CPI values of long-chain n-alkanes in surface soils: Evidence for CPI as a proxy of aridity[J]. Science China Earth Sciences, 2012, 55(7): 1134-1146.
(  0) 0) |
| [25] |
Bush R T, McInerney F A. Influence of temperature and C4 abundance on n-alkane chain length distributions across the central USA[J]. Organic Geochemistry, 2015, 79: 65-73.
(  0) 0) |
| [26] |
Bush R T, McInerney F A. Leaf wax n-alkane distributions in and across modern plants: Implications for paleoecology and chemotaxonomy[J]. Geochimica et Cosmochimica Acta, 2013, 117: 161-179.
(  0) 0) |
| [27] |
Collister J W, Rieley G, Stern B, et al. Compound-specific δ 13C analyses of leaf lipids from plants with differing carbon dioxide metabolisms[J]. Organic Geochemistry, 1994, 21(6/7): 619-627.
(  0) 0) |
| [28] |
Rieley G, Collister J W, Stern B, et al. Gas chromatography/isotope ratio mass spectrometry of leaf wax n-alkalines from plants of differing carbon dioxide metabolisms[J]. Rapid Communications in Mass Spectrometry, 1993, 7(6): 488-491.
(  0) 0) |
| [29] |
Pang Y, Zhou B, Zhou X, et al. Abundance and δ13C of sedimentary black carbon indicate rising wildfire and C4 plants in Northeast China during the early Holocene[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2021, 562: 110075. DOI:10.1016/j.palaeo.2020.110075
(  0) 0) |
| [30] |
Liu J Z, An Z S. Leaf wax n-alkane carbon isotope values vary among major terrestrial plant groups: Different responses to precipitation amount and temperature, and implications for paleoenvironmental reconstruction[J]. Earth-Science Reviews, 2020, 202: 103081.
(  0) 0) |
| [31] |
Dong H W, Xie M M, Shang W Y, et al. Plant-wax carbon isotopic evidence of Lateglacial and Holocene climate change from lake sediments in the Yin Mountains, Inner Mongolia[J]. Quaternary International, 2022, 622: 10-20. DOI:10.1016/j.quaint.2021.12.017
(  0) 0) |
| [32] |
Feng X H. A theoretical analysis of carbon isotope evolution of decomposing plant litters and soil organic matter[J]. Global Biogeochemical Cycles, 2002, 16(4): 66—1-66—11.
(  0) 0) |
| [33] |
Huang Y, Street-Perrott F A, Metcalfe S E, et al. Climate change as the dominant control on glacial-interglacial variations in C3 and C4 plant abundance[J]. Science, 2001, 293(5535): 1647-1651. DOI:10.1126/science.1060143
(  0) 0) |
| [34] |
Gong Z T, Zhang Z Y, Zhang G L. Grassland soils: Distribution, classification and evolution (In Chinese)[J]. Soils, 2009, 41(4): 505-511. DOI:10.3321/j.issn:0253-9829.2009.04.001 [龚子同, 张之一, 张甘霖. 草原土壤: 分布、分类与演化[J]. 土壤, 2009, 41(4): 505-511.]
(  0) 0) |
| [35] |
Cui J Y, Guo L C, Chen Y L, et al. Spatial distribution of 14C age and depth of mollisol sections in the Songnen Plain during the Holocene (In Chinese)[J]. Quaternary Sciences, 2021, 41(5): 1332-1341. [崔静怡, 郭利成, 陈雨露, 等. 松嫩平原全新世黑土14C年龄-深度关系空间格局[J]. 第四纪研究, 2021, 41(5): 1332-1341.]
(  0) 0) |
| [36] |
Song Y H, Liu K, Dai H M, et al. Palynological assemblages of typical black soil profile in the eastern Songliao Plain and their age and its implication for paleoclimatic (In Chinese)[J]. Geological Bulletin of China, 2022, 41(9): 1528-1538. [宋运红, 刘凯, 戴慧敏, 等. 松嫩平原东部典型黑土剖面孢粉组合、时代及其对古气候的指示[J]. 地质通报, 2022, 41(9): 1528-1538.]
(  0) 0) |
| [37] |
Yang F, Long H, Gong K Y, et al. Onset time and accretionary formation of Mollisols in Northeast China[J]. Science Bulletin, 2023, 68(18): 1999-2002. DOI:10.1016/j.scib.2023.08.008
(  0) 0) |
| [38] |
Liu X Q. Distribution characteristics and significance of n-alkanes in main types of soils in Jilin Province[D]. Changchun: Jilin University, 2013.[刘晓秋. 吉林省主要类型土壤中正构烷烃分布特征及其意义[D]. 长春: 吉林大学, 2013.]
(  0) 0) |
| [39] |
Zhang G L, Long H, Yang F. Understanding the formation time of black soils[J]. The Innovation Geoscience, 2023, 1(1): 100010. DOI:10.59717/j.xinn-geo.2023.100010
(  0) 0) |
| [40] |
Zech R, Zech M, Marković S, et al. Humid glacials, arid interglacials? Critical thoughts on pedogenesis and paleoclimate based on multi-proxy analyses of the loess–paleosol sequence Crvenka, Northern Serbia[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2013, 387: 165-175. DOI:10.1016/j.palaeo.2013.07.023
(  0) 0) |
| [41] |
Schäfer I K, Lanny V, Franke J, et al. Leaf waxes in litter and topsoils along a European transect[J]. Soil, 2016, 2(4): 551-564.
(  0) 0) |
| [42] |
Cui J W, Huang J H, Meyers P A, et al. Variation in solvent-extractable lipids and n-alkane compound-specific carbon isotopic compositions with depth in a Southern China Karst Area soil[J]. Journal of Earth Science, 2010, 21(4): 382-391.
(  0) 0) |
| [43] |
Gong K Y, Yang F, Long H, et al. Vertical variations of thermal stability of soil organic matter in black soils under different pedogenetic modes (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(3): 662-673. DOI:10.11766/trxb202211180627 [龚可杨, 杨飞, 隆浩, 等. 不同成土模式下黑土有机质热稳定性剖面分异特征[J]. 土壤学报, 2024, 61(3): 662-673.]
(  0) 0) |
| [44] |
Zech M, Buggle B, Leiber K, et al. Reconstructing Quaternary vegetation history in the Carpathian Basin, SE-Europe, using n-alkane biomarkers as molecular fossils: Problems and possible solutions, potential and limitations[J]. E&G Quaternary Science Journal, 2010, 58(2): 148-155.
(  0) 0) |
| [45] |
Bliedtner M, Zech R, Kühn P, et al. The potential of leaf wax biomarkers from fluvial soil-sediment sequences for paleovegetation reconstructions - Upper Alazani River, central southern Greater Caucasus(Georgia)[J]. Quaternary Science Reviews, 2018, 196: 62-79.
(  0) 0) |
| [46] |
Lichtfouse É, Elbisser B, Balesdent J, et al. Isotope and molecular evidence for direct input of maize leaf wax n-alkanes into crop soils[J]. Organic Geochemistry, 1994, 22(2): 349-351.
(  0) 0) |
| [47] |
Howard S, McInerney F A, Caddy-Retalic S, et al. Modelling leaf wax n-alkane inputs to soils along a latitudinal transect across Australia[J]. Organic Geochemistry, 2018, 121: 126-137.
(  0) 0) |
| [48] |
Zhou W J, Zheng Y H, Meyers P A, et al. Postglacial climate-change record in biomarker lipid compositions of the Hani peat sequence, Northeastern China[J]. Earth and Planetary Science Letters, 2010, 294(1/2): 37-46.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


