2. 武夷学院生态与资源工程学院, 福建省生态产业绿色技术重点实验室, 福建武夷山 354300;
3. 福建农林大学资源与环境学院, 福建省土壤环境健康与调控重点实验室, 福州 350002
2. College of Ecology and Resources Engineering, Wuyi University, Fujian Provincial Key Laboratory of Eco-Industrial Green Technology, Wuyishan, Fujian 354300, China;
3. College of Resources and Environment, Fujian Agriculture and Forestry University, Fujian Provincial Key Laboratory of Soil Environmental Health and Regulation, Fuzhou 350002, China
硫氧化微生物是驱动海洋沉积硫元素循环的主要参与者。在海洋沉积硫循环过程中,硫氧化微生物通过硫化物的氧化还原反应来维持能量平衡。然而,对于海洋沉积中的硫氧化微生物,其电子供体(硫化物)和电子受体(氧和硝酸盐)通常在空间上分离[1]。根据以往的传统认知,微生物只能进行短距离(微纳米级)氧化还原反应的耦合。在这种情况下,硫氧化微生物究竟是如何克服电子供体和受体在空间上的距离并实现氧化还原耦合,亟待研究。在新近的研究中,研究者们发现了一种能够进行长距离电子传递的硫氧化微生物--电缆细菌(cable bacteria)[2]。这一发现为理解硫氧化微生物电子供体和受体的空间分离提供了突破口。电缆细菌是一种由多细胞拼接而成的长丝状微生物,长度最大能达到厘米级以上[3]。在沉积物中,电缆细菌通过自身厘米长度的导电纤维,将沉积物深处厌氧层硫化物氧化产生的电子向上传输到厘米距离的沉积表面,实现跨空间、距离的硫化物氧化和氧还原的耦联,从而维持生长[3]。电缆细菌在沉积物中具有着较高的物种丰度,在一定程度上影响着海洋生态。2018年,Klier等[4]通过16S 扩增子测序对海洋环境微生物群落组成的研究发现,波罗的海沉积物中的电缆细菌丰度高达0.6%,同年,Otte等[5]发现在奥胡斯湾的沉积物中电缆细菌含量高达4.5%。
电缆细菌的发现最早可追溯至2010年,Nielson等[6]在研究海洋沉积物空间分离的氧化还原过程中发现,电流在该过程中发挥着重要作用,并且推测该电流可能由细菌纳米线与黄铁矿、可溶性电子穿梭体和膜外细胞色素结合传导。2012年Pfeffer等[7]进一步通过实验验证,海洋沉积物中长距离电子传递介导的氧化还原耦联主要由形状结构类似电缆的丝状微生物介导。随后,Schauer等[8]将这类丝状微生物命名为电缆细菌(cable bacteria)。经进一步研究,Marzocchi等[2]发现电缆细菌不仅能利用氧气作为硫化物氧化长距离耦联的电子受体,还能利用硝酸盐作为硫化物氧化的电子受体,从而实现长距离氧化还原的耦联。此外,Risgaard-Petersen等[9]在2015年首次发现,电缆细菌除了能够栖息于海洋环境,在淡水沉积物中也普遍存在。这一发现扩充了对电缆细菌生存环境的认知。之后,Matturro等[10]及Huang等[11]研究发现,电缆细菌除了能够进行硫化物氧化和氧还原的耦合外,还能加速海洋沉积中碳氢化合物以及恶臭水体中有机物如芘的降解,揭示了电缆细菌的潜在生态作用。随着电缆细菌相关研究的增多及逐步深入,电缆细菌的内部结构模型[12]、长距离电子传递[13]及呼吸代谢模式开始明晰[3,14]。为更好地帮助研究者们及时了解电缆细菌的研究现状及未来发展趋势,本文对电缆细菌的分类、栖息环境、长距离电子传递特征、结构和运动特征及其环境效应等进行了综合叙述,同时基于文献计量法,对电缆细菌相关文献进行了聚类及可视化分析。
1 电缆细菌的分类及栖息环境电缆细菌由于分类描述和多样性的不确定性,在很长一段时间没有一个完善的分类体系。直至2016年,Trojan等[15]根据电缆细菌的生存环境,将其划分为两个候选属:一种是生存在海洋沉积环境的Candidatus Electrothrix(包含四个候选种:Ca. E. marina、E. aarhusiensis、E. communis和E. japonica);另一种是生存在淡水沉积环境的Candidatus Electronema(包含两个候选种:Ca. E. nielsenii和E. palustris)。这种分类方式的好处在于,即使没有电缆细菌的具体形态信息,也能快速将电缆细菌归类。然而,近年来随着对电缆细菌研究的逐步深入,该分类体系开始受到了一些质疑。例如,2023年Sereika等[16]通过对多种环境样品进行分析,不仅回收了多种电缆细菌的宏基因组组装基因组,并且发现了两种电缆细菌新种,分别命名为Ca. Electronema halotolerans和Ca. Electrothrix laxa。其中Ca. E. halotolerans按照以往的分类应属于淡水电缆细菌属,但其却是由微咸水中回收得到。此次的命名挑战了当前以淡水-海洋为中心的电缆细菌分类框架,暗示了研究者们需要重新对电缆细菌候选属的分类进行评估。
电缆细菌不仅广泛分布于海洋环境,如波罗的海[17]、奥胡斯湾[18]、格雷弗林根湖[19]等,并且淡水环境中也大量存在,如温榆河[20]、珠江三角洲[21]等。根据当前的研究,电缆细菌的环境分布主要受到盐度、硫化物通量和水质等因素的影响[21-23]。2021年Dam等[22]在研究电缆细菌的栖息环境时发现,Ca. Electronema仅存在于淡水环境,而Ca. Electrothrix更倾向于栖息在咸水和海洋环境中。而较为特殊地是,Ca. E. aarhusiensis和Ca. E. communis这两个物种既能在海洋沉积中生存,又能在淡水沉积物中生活。上述研究表明,盐度是影响电缆细菌分布的重要因素之一。此外,电缆细菌的分布与硫化物通量也密切相关[23]。2019年Hermans等[23]在研究波罗的海沉积物中电缆细菌分布时,发现沉积硫化物通量越大,电缆细菌丰度越高。例如,沉积物中硫化物通量0.77 mmol·m-2·d-1处的电缆细菌密度为121 m·cm–2,而硫化物通量为1.14 mmol·m–2·d–1处的电缆细菌密度达到了150 m·cm–2[23]。以上研究表明,电缆细菌的分布丰度与硫化物的供应呈线性相关。除此之外,电缆细菌的分布还受沉积环境水质的影响[21]。2022年Dong等[21]研究发现,电缆细菌在Ⅴ类和Ⅳ类水体中具有较高的物种丰度和生电硫氧化反应活性,而在Ⅲ类和Ⅵ类水体中,电缆细菌的多样性和生电硫氧化反应活性明显降低。造成这种现象的主要原因在于,Ⅲ类水体中硫化物的缺乏以及Ⅵ类水体的高污染使得电缆细菌的生长受到了抑制。综上,盐度、硫化物通量和水质等是影响电缆细菌生态分布的主要因素。电缆细菌在以上这些不同环境条件下的显著分布差异,可为进一步研究电缆细菌的生态适应机制和环境指示作用提供重要依据。
2 电缆细菌的生物学特性及长距离电子传递机理 2.1 电缆细菌的结构特征及长距离电子传递机理电缆细菌是一种由多个细胞串联而成的丝状微生物,其通过厘米长的细丝,在厌氧沉积环境中耦合硫化物的氧化和沉积表面的氧气还原[24]。尽管单个细胞的长度大约只有3 μm,但通过细胞间的首尾相接,以及每个细胞之间由200 nm宽的间隙分隔,电缆细菌的总长度可延伸至约1.5 cm,这为其进行有效的长距离电子传递提供了条件[7]。电缆细菌的整个长度上分布着规律的脊状结构,这些结构被绝缘性的细胞外膜所覆盖[7]。通过这些脊状隔室的并行排列,形成了细胞的外膜。较大的电缆细菌丝通常由更多这样的并行脊状隔室组成。每个脊状隔室内部含有一根50 nm粗细的纤维,这些纤维嵌入在细胞的周质空间中,并在细胞间的连接点上形成连续的网络(图1a)[25]。
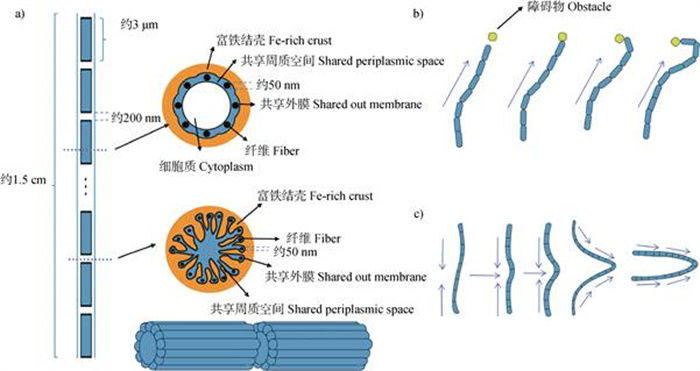
|
图 1 电缆细菌结构图[34](a)和运动示意图[33](b和c) Fig. 1 Structure diagram of cable bacteria[34](a)and schematic diagram of cable bacteria movement[33](b and c) |
目前电缆细菌进行长距离电子传导的分子结构和机制尚未完全清晰,但已经通过共振拉曼显微镜测定了电缆细菌细丝中细胞色素的氧化还原态梯度,确定了细丝在电缆细菌长距离电子传递中的重要作用(图1b)[26]。此外,对电缆细菌进行电化学测量发现,电缆细菌周质纤维的电导率极高,不仅较野生型Geobacter 的菌毛电导率(0.05~1.5 S·cm−1)高,而且较Shewanella纳米导线的电导率(0.03 S·cm−1)高出千倍以上[13],经循环伏安法和差分脉冲伏安法分析发现,电缆细菌的周质纤维具有高导电性并且能够承受高电流密度(6.5× 105 A·m−2)[13]。为深入研究周质纤维的化学结构,2021年Boschker等[27]采用高分辨率显微镜、光谱学和化学成像方法对电缆细菌中导电纤维的化学结构和组成进行了分析。研究发现,电缆细菌周质纤维由一个导电蛋白质核心组成,该核心被绝缘蛋白质外壳层包围。核心蛋白含有硫连接的镍辅因子,当镍被氧化或选择性去除时,电导率会降低。值得注意的是,尽管导电纤维网络可能存在局部损坏,但电子仍能有效沿单纤维轴线传输,这表明其电子传导的韧性[28]。此外,在对电缆细菌进行电导率测定时发现,电缆细菌周质纤维是迄今为止具有最高电导率的天然生物材料(高达79 S·cm–1)[13]。这一高导电性不仅为其在导电材料领域的应用奠定了基础,也为其在催化电极方面的潜力提供了支持。
随后,2024年Digel等[29]研究发现,电缆细菌周质纤维可充当经典的电化学工作电极,或是集成到封闭式双极电化学装置中充当生物电极,用于催化氧和水之间的相互转化。同年,Pankratov等[30]在表征周质纤维网络电导率时发现,导电纤维具有高电导率、高载流子密度和低活化能的特性,类似于金属的非金属有机材料性质[31],区别于以往的微生物长距离电子传递概念(即微生物长距离电子传递过程降低了沉积物表层和深层的电位差,这是源于表层氧化物质还原和深层还原物质氧化产生的极化效应)[31]。然而该研究存在着较大的局限性,因为在提取周质纤维的过程中去除了细胞色素,它仅仅证明了周质纤维的类有机金属特性,并不能解释电子从细胞外膜传递周质纤维上这个过程也不具有氧化还原特性。由此可见,电缆细菌通过含有镍辅因子导电蛋白的周质纤维在厌氧环境中进行长距离电子传递,促进了硫化物氧化与氧还原的耦联。尽管电缆细菌的微观电子传递机制仍需深入研究,但这些发现无疑为理解其在生态系统中的功能提供了重要线索[7,13,30,32]。
2.2 电缆细菌的运动特征2016年Bjerg等[33]利用延时显微镜观察发现,电缆细菌在载玻片表面上的滑动速度能达到(0.5 ± 0.3)μm·s–1,反转时间为(155 ± 108)s,表明其具有运动性。目前发现的电缆细菌运动形式主要有两种[33]:(1)电缆细菌细丝在遇到障碍物时会立即弯曲并保持环形移动(图1b);(2)电缆细菌细丝的两端沿相反方向移动,使得细丝中段弯曲而往垂直于原始运动的方向移动(图1c)。电缆细菌的运动性保障了其电子供体硫化物和电子受体氧气的耦联,造就了其呼吸和生长模式的特殊性。通过运动,电缆细菌不仅能让一端的氧还原细胞(<10%)暴露于氧气中进行氧还原,而且能够将氧还原相关的能量保存并分配给其他不暴露于氧气的细胞,确保90%以上的电缆细菌细胞能够在没有氧化应激的情况下进行代谢,充分利用有氧呼吸能量。
2.3 电缆细菌的代谢特征电缆细菌的碳代谢过程一直存在着争议[35]。早期研究中,大多数学者认为电缆细菌属于异养微生物而不是自养微生物[36]。但在后续研究中,部分学者发现电缆细菌既能异养也能自养生长。例如,2019年Kjeldsen等[32]对电缆细菌基因组进行分析发现,电缆细菌不仅能够通过Wood-Ljungdahl途径进行CO2固定,而且同时还能同化小分子的有机酸和有机醇、固定N2、以及合成多磷酸盐和葡萄糖等。二氧化碳固定具体过程如下[32](图2a):碳酸氢盐在周质碳酸酐酶的作用下转化为CO2,CO2经Wood-Ljungdahl途径和甲酸盐的共同作用下,转化为乙酰辅酶A;然后乙酰辅酶A在醋酸盐和丙酸盐的共同作用下,经三羧酸循环将ADP转化为ATP,为电缆细菌生长提供能量。2020年Geerlings等[37]通过同位素实验发现,电缆细菌在13C-碳酸氢盐和13C-丙酸盐培养中均表现出了明显的13C富集。然而,13C-丙酸盐培养中13C的富集究竟是由电缆细菌引起还是其他成员的同化作用引起仍有待进一步验证[37]。进一步分析13C-碳酸氢盐培养中电缆细菌13C和15N原子组分间的强相关性,发现电缆细菌直接吸收丙酸盐的量仅为无机碳吸收量的7%,表明自养CO2固定和异养丙酸同化在电缆细菌中同时活跃,但自养途径在生物量合成过程中占主导地位。此外,Geerlings等[37]还发现,电缆细菌处于氧气区的细胞与处于缺氧区的细胞具有不同的代谢功能。缺氧区的细胞能够从硫化物的氧化中获取能量并吸收无机碳和氨。然而,处于氧气区的细胞只进行氧气还原但不参与生物合成。值得注意的是,电缆细菌这种细胞之间的分工似乎是可逆的。电缆细菌的细胞功能模式主要取决于外部的氧化还原环境:当暴露于不同的氧化还原条件时,细胞能够在厌氧代谢和好氧代谢之间进行快速切换。这也解释了为何细胞在细丝内没有形态分化[14,37]。
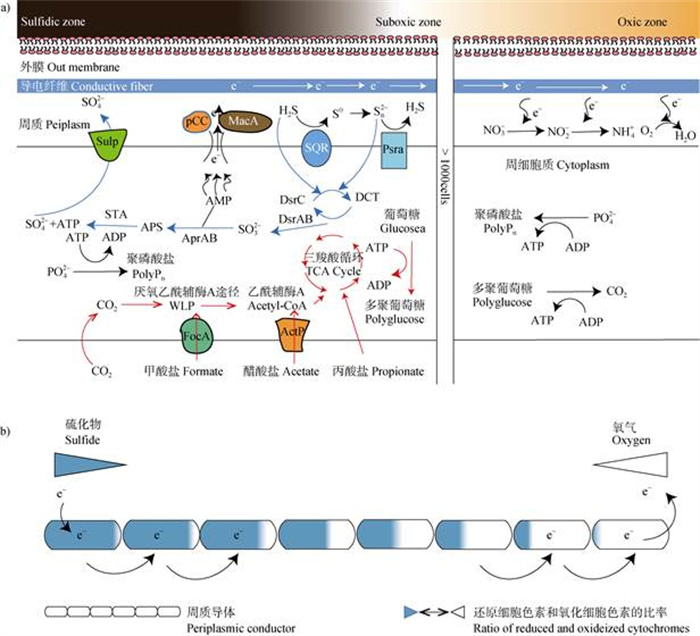
|
图 2 电缆细菌的代谢模式图[32](a)和电子传输概念模型[26](b) Fig. 2 Metabolic pathway diagram of cable bacteria[32](a)and conceptual model of electron transfer in cable bacteria[26](b) |
传统观点认为,微生物氧化还原反应只能在细胞内或通过细胞的短距离胞外电子传递实现耦联[6]。然而,电缆细菌长距离电子传递的发现,打破了关键生物地球化学过程中微生物如何相互作用以及元素如何在自然界中循环的传统认识[6,38]。
电缆细菌的长距离电子传递过程产生的氧化还原梯度,形成了一个复杂的环境交互体系。这一过程能够有效耦联沉积物表层的氧还原反应和深层的硫化物氧化反应。通过这种耦联,电缆细菌促进了沉积物中硫、钙、铁等元素的地球化学循环和营养物质的重新分配,从而增强了沉积物的整体生态稳定性[39-40]。同时,电缆细菌在这一过程中影响了相邻微生物的活性和种群结构,优化了微生物群落的代谢活动[41-42]。这种优化不仅提升了沉积物的营养环境,而且对污染物的去除起到了积极作用[39]。
3.1 改变土壤理化性质电缆细菌跨空间、跨距离的长距离氧化还原耦合,不仅使得土壤的pH发生改变,并且土壤中氧气的含量及侵入深度受到影响。具体而言,电缆细菌的深层硫化物氧化会导致质子的产生,而表层的氧或硝酸盐还原会导致质子的消耗。质子的这种不断产生与消耗,使得沉积物产生了一个典型的pH深度剖面,即沉积物表层pH逐渐变大,而沉积物深处pH逐渐减小[43]。此外,2021年Liu等[44]人通过研究发现,电缆细菌的存在不仅改变了厌氧沉积物的理化性质,而且相邻的微生物群落结构受到影响,最终使得沉积表层溶解氧的影响范围扩大。
3.2 影响微生物群落结构电缆细菌介导的长距离电子传输过程不仅会引起沉积物地球化学变化,同时也影响着周边的微生物群落。2023年Bjerg等[41]发现,当电缆细菌与氧气连接时,其缺氧部分周围聚集有大量的好氧菌。而一旦电缆细菌与氧气失去连接,这些好氧细菌便会立即分散。进一步研究发现,这些好氧菌在电缆细菌的帮助下能够更容易进行氧化代谢。这或许是因为电缆细菌充当了桥梁的作用,帮助好氧菌将电子传给氧气实现远距离氧化还原反应的耦合。此外,值得注意的是,好氧菌在这个过程中极少与电缆细菌直接接触,表明它们之间可能通过某种电子介体实现电子转移。2019年Martin等[42]发现在海草根部存在电缆细菌,并且电缆细菌能够利用海草根部的硫化物进行生电硫氧化,从而帮助海草免受硫化物的侵害。与此同时,电缆细菌也能利用海草根部释放的氧气作为电子受体维持自身的生长代谢。Scholz等[45-47]对四大洲的28种植物进行调查发现,电缆细菌与植物之间的相互作用关系全球普遍存在,既不是强制性的,也不是物种特异性的。植物根际电缆细菌的出现对稻田和湿地植被活力、初级生产力、海岸恢复以及温室气体平衡具有普遍重要性。
3.3 影响甲烷排放电缆细菌作为一种能够介导生电硫氧化(e-SOx)的微生物[48],可以很好地抑制水稻土壤中甲烷的排放(图3)。一方面,电缆细菌氧化沉积物中硫化物会导致硫酸盐化合物的积累[44],硫酸盐化合物的积累会刺激硫酸盐还原菌的生长,抢占产甲烷菌的电子供体如氢和乙酸盐等,进而抑制甲烷的排放[49];另一方面,电缆细菌介导的生电硫反应会降低沉积物的pH,进而阻碍发酵过程以及甲烷的生成[50-51]。2020年Scholz等[45]研究发现,往水稻土壤中接种电缆细菌能够使土壤硫酸盐的库存增加五倍,帮助减少93%的甲烷排放。
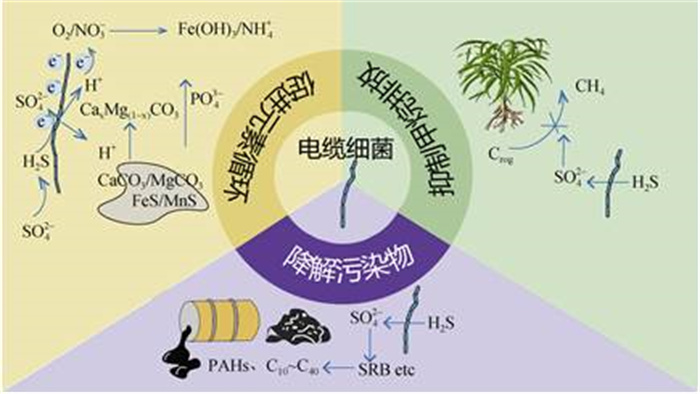
|
图 3 电缆细菌对生物地球化学循环的作用及生态效应 Fig. 3 Diagram of the role of cable bacteria on biogeochemical cycles and their ecological effects |
目前,海洋沉积物中硫氧化主要有两种途径,根据反应发生位置的不同,可分为典型硫氧化(c-SOx)和生电硫氧化(e-SOx)[52]。c-SOx发生在氧-缺氧界面,氧和硫化物直接接触发生氧化反应。而对于e-SOx,氧和硫化物处于远距离分隔的状态,需要在电缆细菌的长距离电子传递作用下才能实现氧化还原反应耦合。根据Malkin等[53]的研究,e-SOx介导的硫化物氧化速率较无e-SOx介导的硫化物氧化速快3倍~10倍,表明电缆细菌介导的e-SOx是海洋沉积物中硫循环的主要组成部分。为更好探究电缆细菌是如何利用沉积物中的硫化物,Kjeldsen等[32]对电缆细菌基因组进行分析,发现形态和代谢上不同的电缆细菌仍然主要具有脱硫球菌科的核心基因组组成,包括几乎完整的典型异化硫酸盐还原(DSR)途径。电缆细菌中具有Ⅲ型SQR(醌氧化还原酶),SQR在周质中产生的硫可以与硫化物发生化学反应,形成溶解的多硫化物,其在PSR(多硫化物还原酶)的作用下,来自细胞质膜中醌池的电子将多硫化物还原为硫化物。随后,硫元素可以通过细胞质DSR途径的逆转被氧化为硫酸盐。这部分的硫可能来源于SQR产生的还原硫,也可能直接来自硫化物。其通过DsrC(异化亚硫酸氢还原酶亚基C)反应形成DCT(DsrC-三硫化物)。然后,DCT被DsrAB(异化亚硫酸氢还原酶亚基AB)氧化,释放亚硫酸盐和DsrC。亚硫酸盐被AprAB(腺苷-5-磷酸硫酸还原酶)和SAT(硫酸腺苷酸转移酶)进一步氧化为硫酸盐,最后,硫酸盐通过SulP(硫酸盐渗透酶)转运出细胞。当然这并不意味着海洋沉积物中硫酸盐的生成完全依赖于e-SOx,因为在电缆细菌生活区域的下层和无e-SOx的沉积物中存在着明显的厌氧硫酸盐生成,这可能是由氧化金属(例如铁、锰)驱动的硫化物氧化造成的。目前的研究认为电缆细菌介导的e-SOx对硫化物的消耗主要发生在缺氧区域。电缆细菌利用硫化物作为电子供体的方式主要有两种(图3)[54]:(1)电缆细菌的代谢活动使得孔隙水具有较高的酸性,从而刺激FeS溶解生成H2S,在低氧区被电缆细菌利用;(2)在厌氧区,一部分硫酸盐会被还原生成硫化物并被电缆细菌氧化生成硫酸盐,形成了隐蔽的硫循环。
3.5 影响铁、锰、钙、磷及痕量元素电缆细菌氧化硫化物产生的质子会促进沉积物中硫化铁的溶解(图3)。溶解形成的Fe2+一部分被输送到含氧区被氧化生成Fe(OH)3沉淀,另一部分沉积在较深层的缺氧区以硫化亚铁的形式存在。同时,硫化亚铁氧化产生的质子会促进沉积物中碳酸盐的溶解,使得Ca2+溶出并在含氧区域以镁方解石的形式析出[39]。此外,海底沉积物中的锰主要以溶解态的状态存在,当电缆细菌的氧还原导致周边环境氧气浓度降低时,溶解态的Mn2+容易逸散到含氧区被氧化生成锰氧化物[17]。2018年Sulu-Gambari等[55]对季节性缺氧沿海海洋盆地沉积物的磷动态进行长达一年的跟踪调查发现,春季表层沉积物中电缆细菌活跃,此时磷被吸附到铁氧化物上;但随着夏季缺氧的开始,Fe(Ⅲ)氧化物在有机物输入增加、温度变化、溶解氧的减少等外部因素的诱导下被转化为硫化铁并伴随着Fe(Ⅲ)氧化物的还原,使得被包裹在其中的磷向孔隙水和上覆水中释放[40,55]。电缆细菌e-SOx形成的Fe(Ⅲ)氧化物层可以很好地抑制沉积物中痕量金属的释放[56-57]。以砷为例,在春季和冬季含氧季节,由于电缆细菌的e-SOx作用,砷会从硫化铁中释放出来,并聚集在沉积物-水界面中的Fe(Ⅲ)氧化物层中,但是在随后到来的缺氧季节中会被再次释放出来,直至含氧季节的到来,电缆细菌e-SOx重新构建从而形成新的Fe(Ⅲ)氧化物层,使得砷被重新捕集[58]。
3.6 参与污染物降解电缆细菌在促进有机污染物降解(包括多环芳烃和石油烃等)方面发挥着重要作用(图3)[11,59]。2022年Huang等[11]研究发现,添加电缆细菌的水样中,芘的降解速率(27.59%)明显较不添加电缆细菌水样的芘降解速率快(13.08%)。以上结果表明,电缆细菌的存在能够有效提高沉积物中芘的去除效率。电缆细菌促进芘降解的主要机制[11]:一是电缆细菌利用e-SOx介导硫化氢的去除,从而保护其他微生物免受硫化氢的毒性影响,有助于优势菌群的富集和生长;二是电缆细菌介导的e-SOx可以释放被矿物质吸附的芘,使其更好地被微生物降解。其后,Huang等[60]进一步探究了电缆细菌对沉积物中多环芳烃迁移的影响,发现电缆细菌可以作为生物载体促进多环芳烃向下移动,不仅使得上层沉积物中多环芳烃的生态风险降低,而且在一定程度上减少了多环芳烃向上覆水体的释放。此外,Liu等[44]发现,曝气环境可以促进电缆细菌的更快发育,并增强其长距离电子传输能力,从而加快沉积物中多环芳烃的原位降解。这可能是由于电缆细菌的硫化物氧化导致的硫酸盐积累有利于促进硫酸盐还原菌的多环芳烃降解活性,从而有效降解多环芳烃。此外,Marzocchi等[59]发现,电缆细菌能够有效促进石油烃的降解。在这个过程中,电缆细菌主要是通过e-SOx反应将矿物中H2S转化成硫酸盐,增强有机物降解微生物(如SRB)的丰度和活性,从而促进石油烃的降解。同时,电缆细菌的生理代谢活动能够全面提高整个微生物群落的烷烃生物降解能力。总体而言,目前电缆细菌的污染物降解研究还处于初步阶段。现有的研究表明电缆细菌对污染物降解具有一定的促进作用,但具体的作用机制还尚不明确。后续的研究需要进一步探究电缆细菌与污染物之间的作用机理,使其能够更好地应用于污染物生物修复工程之中。
4 文献及研究热点分析目前关于电缆细菌的研究十分广泛且种类繁多,为更好地了解电缆细菌的研究进展和热点,通过文献计量法[61]对2014-2023年的电缆细菌文献进行总结,分析电缆细菌的科研发展历程以及未来发展趋势。
4.1 数据收集与分析方法以Web of Science核心合集数据库为数据来源,采用精确检索,检索式为TS=(“cable bacteria”),共检索到155篇有关电缆细菌的论文,包括学术论文、综述、社科材料以及会议摘要等。为进一步减少检索误差并提高精准度,对论文进行筛选,去掉重复的论文、社科材料以及与主题不相关的论文,最终剩余147篇。
运用Origin对检索到的发文数量进行统计,并以图表形式展示。使用Vosviewer对关键词进行分析,制作关键词网络图,进行可视化分析。
4.2 时间发展脉络与研究热点2014-2023年的电缆细菌发文数量呈现一种先上升后下降的趋势,大致上可分为两阶段(图4a):第一阶段是2014-2021年,发文数量稳步上升;第二阶段是2022-2023年,发文数量呈下降趋势。2014年正式以cable bacteria命名的研究开始进入萌芽阶段,发文量逐年上升,同时被引次数也逐步上升。电缆细菌相关论文的被引频次在2016年达到最高,这是由于2016年Shi等在Nature Reviews Microbiology期刊上发表了一篇名为“Extracellular electron transfer mechanisms between microorganisms and minerals”的文章。该文以电缆细菌为长距离电子传输的代表性微生物,首次综合介绍了电缆细菌的结构及长距离电子传递特性,受到大量关注。电缆细菌相关研究的发文量呈现先上升后下降的原因可能是:初期的电缆细菌研究处于空白阶段,具有较大的研究潜力,因此有较多的科研产出;而在2022年之后,电缆细菌相关的基础研究已较为全面,而更深层次的研究因无法获得电缆细菌纯培养物以及研究手段受限等原因,进入了瓶颈期。总体而言,电缆细菌的相关研究仍处于初步阶段,其生态生理特征以及环境效应等仍有待进一步深入研究。
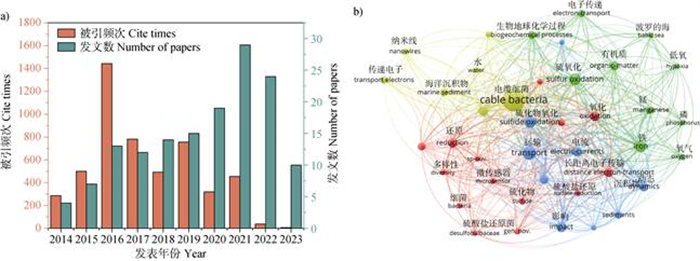
|
图 4 电缆细菌的年度发文数量及被引频次(a)和关键词的共现与聚类分析(b) Fig. 4 Annual publication count and citation frequency of cable bacteria(a)and cooccurrence and cluster analysis of keywords(b) |
关键词是对文章的高度概括,通过对文章关键词进行分析,可以更好地了解到该研究领域的研究热点和趋势[62]。对电缆细菌相关文章进行筛选分析,发现共有40个核心词汇,其中cable bacteria是出现频率最高的关键词(94次)。对关键词进行共现和聚类分析(图4b),发现电缆细菌相关研究主要集中于长距离电子传输及其对生物地球化学循环的影响。电缆细菌长距离电子传输的机制,这涉及到电缆细菌如何在不同环境中有效地传递电子,从而影响其生存与繁殖。其次,这类研究还探讨了电缆细菌对生物地球化学循环的影响,尤其是在生态系统中的物质和能量流动方面。这样的分析不仅揭示了电缆细菌研究的热点问题,也为未来的研究方向提供了指导,帮助研究人员更好地布局和开展相关工作。通过深入理解这些关键词的内涵和相关性,可以更清晰地把握电缆细菌研究领域的发展脉络和前沿动态。
5 结论与展望电缆细菌作为近年来新发现的、可以进行长距离电子传递的微生物,仍具有极大的研究空间。目前对于电缆细菌的研究主要停留在其对各种元素的宏观作用,而对于其微观层面的研究较为空白。目前研究人员尝试了多种方法均无法得到电缆细菌纯培养物[63],使得电缆细菌的长距离电子传递及其环境作用相关的微观机制研究受到限制。新近有研究表明,通过系列操作能够得到单一菌丝[64]。虽然得到的单一菌丝与获得稳定纯培养物存在一定差距,但仍为电缆细菌的进一步研究提供了新可能。在国家鼓励科技成果转化的大背景下,电缆细菌因其优异的电导率、高载流子密度和低活化能特性,以及在环境效应中的作用,展现出广阔的应用前景。未来的研究和应用可以聚焦以下几个方面:(1)解析电缆细菌具有高导电性的根本原因,帮助丰富对导电材料本质的认识,为未来导电材料的研究与开发提供宝贵的借鉴与启示;(2)研究与制作电缆细菌的新型菌剂,以便用于污染物去除等环境治理应用。通过优化电缆细菌的纯种培养方法,使其能够大规模生产,从而为环境治理与生态修复领域创造创新性的解决方案;(3)深入探究电缆细菌在全球范围内对特定元素循环的贡献,以便更全面地理解其生态功能和环境影响。这将有助于加强对电缆细菌在生态系统中的角色的认识,并推动其在环境管理中的应用。
| [1] |
Wasmund K, Mußmann M, Loy A. The life sulfuric: Microbial ecology of sulfur cycling in marine sediments[J]. Environmental Microbiology Reports, 2017, 9(4): 323-344. DOI:10.1111/1758-2229.12538
(  0) 0) |
| [2] |
Marzocchi U, Trojan D, Larsen S, et al. Electric coupling between distant nitrate reduction and sulfide oxidation in marine sediment[J]. The ISME Journal, 2014, 8(8): 1682-1690. DOI:10.1038/ismej.2014.19
(  0) 0) |
| [3] |
Müller H, Marozava S, Probst A J, et al. Groundwater cable bacteria conserve energy by sulfur disproportionation[J]. The ISME Journal, 2020, 14(2): 623-634. DOI:10.1038/s41396-019-0554-1
(  0) 0) |
| [4] |
Klier J, Dellwig O, Leipe T, et al. Benthic bacterial community composition in the oligohaline-marine transition of surface sediments in the Baltic Sea based on rRNA analysis[J]. Frontiers in Microbiology, 2018, 9: 236. DOI:10.3389/fmicb.2018.00236
(  0) 0) |
| [5] |
Otte J M, Harter J, Laufer K, et al. The distribution of active iron-cycling bacteria in marine and freshwater sediments is decoupled from geochemical gradients[J]. Environmental Microbiology, 2018, 20(7): 2483-2499. DOI:10.1111/1462-2920.14260
(  0) 0) |
| [6] |
Nielsen L P, Risgaard-Petersen N, Fossing H, et al. Electric currents couple spatially separated biogeochemical processes in marine sediment[J]. Nature, 2010, 463(7284): 1071-1074. DOI:10.1038/nature08790
(  0) 0) |
| [7] |
Pfeffer C, Larsen S, Song J, et al. Filamentous bacteria transport electrons over centimetre distances[J]. Nature, 2012, 491(7423): 218-221. DOI:10.1038/nature11586
(  0) 0) |
| [8] |
Schauer R, Risgaard-Petersen N, Kjeldsen K U, et al. Succession of cable bacteria and electric currents in marine sediment[J]. The ISME Journal, 2014, 8(6): 1314-1322. DOI:10.1038/ismej.2013.239
(  0) 0) |
| [9] |
Risgaard-Petersen N, Kristiansen M, Frederiksen R B, et al. Cable bacteria in freshwater sediments[J]. Applied and Environmental Microbiology, 2015, 81(17): 6003-6011. DOI:10.1128/AEM.01064-15
(  0) 0) |
| [10] |
Matturro B, Cruz Viggi C, Aulenta F, et al. Cable bacteria and the bioelectrochemical snorkel: The natural and engineered facets playing a role in hydrocarbons degradation in marine sediments[J]. Frontiers in Microbiology, 2017, 8: 952. DOI:10.3389/fmicb.2017.00952
(  0) 0) |
| [11] |
Huang Y D, Hu W Z, Dong M J, et al. Cable bacteria accelerate the anaerobic removal of pyrene in black odorous river sediments[J]. Journal of Hazardous Materials, 2023, 443: 130305. DOI:10.1016/j.jhazmat.2022.130305
(  0) 0) |
| [12] |
Jiang Z X, Zhang S, Klausen L H, et al. In vitro single-cell dissection revealing the interior structure of cable bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(34): 8517-8522.
(  0) 0) |
| [13] |
Meysman F J R, Cornelissen R, Trashin S, et al. A highly conductive fibre network enables centimetre-scale electron transport in multicellular cable bacteria[J]. Nature Communications, 2019, 10(1): 4120. DOI:10.1038/s41467-019-12115-7
(  0) 0) |
| [14] |
Scilipoti S, Koren K, Risgaard-Petersen N, et al. Oxygen consumption of individual cable bacteria[J]. Science Advances, 2021, 7(7): eabe1870. DOI:10.1126/sciadv.abe1870
(  0) 0) |
| [15] |
Trojan D, Schreiber L, Bjerg J T, et al. A taxonomic framework for cable bacteria and proposal of the candidate genera Electrothrix and Electronema[J]. Systematic and Applied Microbiology, 2016, 39(5): 297-306. DOI:10.1016/j.syapm.2016.05.006
(  0) 0) |
| [16] |
Sereika M, Petriglieri F, Jensen T B N, et al. Closed genomes uncover a saltwater species of Candidatus Electronema and shed new light on the boundary between marine and freshwater cable bacteria[J]. The ISME Journal, 2023, 17(4): 561-569. DOI:10.1038/s41396-023-01372-6
(  0) 0) |
| [17] |
Hermans M, Astudillo Pascual M, Behrends T, et al. Coupled dynamics of iron, manganese, and phosphorus in brackish coastal sediments populated by cable bacteria[J]. Limnology and Oceanography, 2021, 66(7): 2611-2631. DOI:10.1002/lno.11776
(  0) 0) |
| [18] |
Damgaard L R, Risgaard-Petersen N, Nielsen L P. Electric potential microelectrode for studies of electrobiogeophysics[J]. Journal of Geophysical Research:Biogeosciences, 2014, 119(9): 1906-1917. DOI:10.1002/2014JG002665
(  0) 0) |
| [19] |
Sulu-Gambari F, Seitaj D, Behrends T, et al. Impact of cable bacteria on sedimentary iron and manganese dynamics in a seasonally-hypoxic marine basin[J]. Geochimica et Cosmochimica Acta, 2016, 192: 49-69. DOI:10.1016/j.gca.2016.07.028
(  0) 0) |
| [20] |
Xu X L, Weng N Y, Zhang H X, et al. Cable bacteria regulate sedimentary phosphorus release in freshwater sediments[J]. Water Research, 2023, 242: 120218. DOI:10.1016/j.watres.2023.120218
(  0) 0) |
| [21] |
Dong M J, Yang S, Yang X N, et al. Water quality drives the distribution of freshwater cable bacteria[J]. Science of the Total Environment, 2022, 841: 156468. DOI:10.1016/j.scitotenv.2022.156468
(  0) 0) |
| [22] |
Dam A S, Marshall I P G, Risgaard-Petersen N, et al. Effect of salinity on cable bacteria species composition and diversity[J]. Environmental Microbiology, 2021, 23(5): 2605-2616. DOI:10.1111/1462-2920.15484
(  0) 0) |
| [23] |
Hermans M, Lenstra W K, Hidalgo-Martinez S, et al. Abundance and biogeochemical impact of cable bacteria in Baltic Sea sediments[J]. Environmental Science & Technology, 2019, 53(13): 7494-7503.
(  0) 0) |
| [24] |
Yang Y G, Wang Z G, Gan C F, et al. Long-distance electron transfer in a filamentous Gram-positive bacterium[J]. Nature Communications, 2021, 12(1): 1709. DOI:10.1038/s41467-021-21709-z
(  0) 0) |
| [25] |
Cornelissen R, Bøggild A, Thiruvallur Eachambadi R, et al. The cell envelope structure of cable bacteria[J]. Frontiers in Microbiology, 2018, 9: 3044. DOI:10.3389/fmicb.2018.03044
(  0) 0) |
| [26] |
Bjerg J T, Boschker H T S, Larsen S, et al. Long-distance electron transport in individual, living cable bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(22): 5786-5791.
(  0) 0) |
| [27] |
Boschker H T S, Cook P L M, Polerecky L, et al. Efficient long-range conduction in cable bacteria through nickel protein wires[J]. Nature Communications, 2021, 12(1): 3996. DOI:10.1038/s41467-021-24312-4
(  0) 0) |
| [28] |
Thiruvallur Eachambadi R, Bonné R, Cornelissen R, et al. An ordered and fail-safe electrical network in cable bacteria[J]. Advanced Biosystems, 2020, 4(7): 2000006. DOI:10.1002/adbi.202000006
(  0) 0) |
| [29] |
Digel L, Mierzwa M, Bonné R, et al. Cable bacteria skeletons as catalytically active electrodes[J]. Angewandte Chemie, 2024, 63(6): e202312647. DOI:10.1002/anie.202312647
(  0) 0) |
| [30] |
Pankratov D, Hidalgo Martinez S, Karman C, et al. The organo-metal-like nature of long-range conduction in cable bacteria[J]. Bioelectrochemistry, 2024, 157: 108675. DOI:10.1016/j.bioelechem.2024.108675
(  0) 0) |
| [31] |
Strycharz-Glaven S M, Snider R M, Guiseppi-Elie A, et al. On the electrical conductivity of microbial nanowires and biofilms[J]. Energy & Environmental Science, 2011, 4(11): 4366-4379.
(  0) 0) |
| [32] |
Kjeldsen K U, Schreiber L, Thorup C A, et al. On the evolution and physiology of cable bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(38): 19116-19125.
(  0) 0) |
| [33] |
Bjerg J T, Damgaard L R, Holm S A, et al. Motility of electric cable bacteria[J]. Applied and Environmental Microbiology, 2016, 82(13): 3816-3821. DOI:10.1128/AEM.01038-16
(  0) 0) |
| [34] |
Geerlings N M J, Zetsche E M, Hidalgo-Martinez S, et al. Mineral formation induced by cable bacteria performing long-distance electron transport in marine sediments[J]. Biogeosciences, 2019, 16(3): 811-829. DOI:10.5194/bg-16-811-2019
(  0) 0) |
| [35] |
Zhang H H, Wang Y, Huang T L, et al. Research progress of cable bacteria in sediment (In Chinese)[J]. China Environmental Science, 2019, 39(7): 3048-3055. DOI:10.3969/j.issn.1000-6923.2019.07.042 [张海涵, 王跃, 黄廷林, 等. 沉积物电缆细菌研究进展[J]. 中国环境科学, 2019, 39(7): 3048-3055.]
(  0) 0) |
| [36] |
Vasquez-Cardenas D, van de Vossenberg J, Polerecky L, et al. Microbial carbon metabolism associated with electrogenic sulphur oxidation in coastal sediments[J]. The ISME Journal, 2015, 9(9): 1966-1978. DOI:10.1038/ismej.2015.10
(  0) 0) |
| [37] |
Geerlings N M J, Karman C, Trashin S, et al. Division of labor and growth during electrical cooperation in multicellular cable bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(10): 5478-5485.
(  0) 0) |
| [38] |
Yang Y G, Li D B, Xu M Y. Research progress in microbial extracellular long-distance electron transport networks (In Chinese)[J]. Acta Microbiologica Sinica, 2020, 60(9): 2072-2083. [杨永刚, 李道波, 许玫英. 微生物胞外长距离电子传递网络研究进展[J]. 微生物学报, 2020, 60(9): 2072-2083.]
(  0) 0) |
| [39] |
Risgaard-Petersen N, Revil A, Meister P, et al. Sulfur, iron-, and calcium cycling associated with natural electric currents running through marine sediment[J]. Geochimica et Cosmochimica Acta, 2012, 92: 1-13. DOI:10.1016/j.gca.2012.05.036
(  0) 0) |
| [40] |
Rozan T F, Taillefert M, Trouwborst R E, et al. Iron-sulfur-phosphorus cycling in the sediments of a shallow coastal bay: Implications for sediment nutrient release and benthic macroalgal blooms[J]. Limnology and Oceanography, 2002, 47(5): 1346-1354. DOI:10.4319/lo.2002.47.5.1346
(  0) 0) |
| [41] |
Bjerg J J, Lustermans J J M, Marshall I P G, et al. Cable bacteria with electric connection to oxygen attract flocks of diverse bacteria[J]. Nature Communications, 2023, 14(1): 1614. DOI:10.1038/s41467-023-37272-8
(  0) 0) |
| [42] |
Martin B C, Bougoure J, Ryan M H, et al. Oxygen loss from seagrass roots coincides with colonisation of sulphide-oxidising cable bacteria and reduces sulphide stress[J]. The ISME Journal, 2019, 13(3): 707-719. DOI:10.1038/s41396-018-0308-5
(  0) 0) |
| [43] |
Sulu-Gambari F, Seitaj D, Meysman F J R, et al. Cable bacteria control iron-phosphorus dynamics in sediments of a coastal hypoxic basin[J]. Environmental Science & Technology, 2016, 50(3): 1227-1233.
(  0) 0) |
| [44] |
Liu F F, Wang Z Y, Wu B, et al. Cable bacteria extend the impacts of elevated dissolved oxygen into anoxic sediments[J]. The ISME Journal, 2021, 15(5): 1551-1563. DOI:10.1038/s41396-020-00869-8
(  0) 0) |
| [45] |
Scholz V V, Meckenstock R U, Nielsen L P, et al. Cable bacteria reduce methane emissions from rice-vegetated soils[J]. Nature Communications, 2020, 11(1): 1878. DOI:10.1038/s41467-020-15812-w
(  0) 0) |
| [46] |
Scholz V V, Martin B C, Meyer R, et al. Cable bacteria at oxygen-releasing roots of aquatic plants: A widespread and diverse plant-microbe association[J]. New Phytologist, 2021, 232(5): 2138-2151. DOI:10.1111/nph.17415
(  0) 0) |
| [47] |
Scholz V V, Müller H, Koren K, et al. The rhizosphere of aquatic plants is a habitat for cable bacteria[J]. FEMS Microbiology Ecology, 2019, 95(6): fiz062. DOI:10.1093/femsec/fiz062
(  0) 0) |
| [48] |
Zhao X M, Yang M H, Mu T Z, et al. Advances in the research on cable bacteria and their mediated electrogenic sulfur oxidation(e-SOx) (In Chinese)[J]. Chinese Journal of Applied and Environmental Biology, 2022, 28(1): 247-253. [赵秀梅, 杨茂华, 穆廷桢, 等. 电缆细菌及其介导的生电硫氧化(e-SOx)过程研究进展[J]. 应用与环境生物学报, 2022, 28(1): 247-253.]
(  0) 0) |
| [49] |
Kristjansson J K, Schönheit P, Thauer R K. Different ks values for hydrogen of methanogenic bacteria and sulfate reducing bacteria: An explanation for the apparent inhibition of methanogenesis by sulfate[J]. Archives of Microbiology, 1982, 131(3): 278-282. DOI:10.1007/BF00405893
(  0) 0) |
| [50] |
Ye R Z, Jin Q S, Bohannan B, et al. pH controls over anaerobic carbon mineralization, the efficiency of methane production, and methanogenic pathways in peatlands across an ombrotrophic–minerotrophic gradient[J]. Soil Biology & Biochemistry, 2012, 54: 36-47.
(  0) 0) |
| [51] |
Habtewold J, Gordon R, Sokolov V, et al. Reduction in methane emissions from acidified dairy slurry is related to inhibition of Methanosarcina species[J]. Frontiers in Microbiology, 2018, 9: 2806. DOI:10.3389/fmicb.2018.02806
(  0) 0) |
| [52] |
Meysman F J R, Risgaard-Petersen N, Malkin S Y, et al. The geochemical fingerprint of microbial long-distance electron transport in the seafloor[J]. Geochimica et Cosmochimica Acta, 2015, 152: 122-142. DOI:10.1016/j.gca.2014.12.014
(  0) 0) |
| [53] |
Malkin S Y, Rao A M F, Seitaj D, et al. Natural occurrence of microbial sulphur oxidation by long-range electron transport in the seafloor[J]. The ISME Journal, 2014, 8(9): 1843-1854. DOI:10.1038/ismej.2014.41
(  0) 0) |
| [54] |
Burdorf L D W, Malkin S Y, Bjerg J T, et al. The effect of oxygen availability on long-distance electron transport in marine sediments[J]. Limnology and Oceanography, 2018, 63(4): 1799-1816. DOI:10.1002/lno.10809
(  0) 0) |
| [55] |
Sulu-Gambari F, Hagens M, Behrends T, et al. Phosphorus cycling and burial in sediments of a seasonally hypoxic marine basin[J]. Estuaries and Coasts, 2018, 41(4): 921-939. DOI:10.1007/s12237-017-0324-0
(  0) 0) |
| [56] |
Riedel G F, Sanders J G, Osman R W. Biogeochemical control on the flux of trace elements from estuarine sediments: Effects of seasonal and short-term hypoxia[J]. Marine Environmental Research, 1999, 47(4): 349-372. DOI:10.1016/S0141-1136(98)00125-1
(  0) 0) |
| [57] |
Wu K X, Zhang J T, Ma C Z, et al. Research progress on growth characteristics of cable bacteria and their effects on material cycling in sediments (In Chinese)[J]. Research of Environmental Sciences, 2022, 35(8): 1854-1863. [吴开心, 张靖天, 马春子, 等. 沉积物电缆细菌的生长特征及其对物质循环影响的研究进展[J]. 环境科学研究, 2022, 35(8): 1854-1863.]
(  0) 0) |
| [58] |
van de Velde S J, Burdorf L D W, Hidalgo-Martinez S, et al. Cable bacteria activity modulates arsenic release from sediments in a seasonally hypoxic marine basin[J]. Frontiers in Microbiology, 2022, 13: 907976. DOI:10.3389/fmicb.2022.907976
(  0) 0) |
| [59] |
Marzocchi U, Palma E, Rossetti S, et al. Parallel artificial and biological electric circuits power petroleum decontamination: The case of snorkel and cable bacteria[J]. Water Research, 2020, 173: 115520. DOI:10.1016/j.watres.2020.115520
(  0) 0) |
| [60] |
Huang Y D, Wang B, Yang Y G, et al. Microbial carriers promote and guide pyrene migration in sediments[J]. Journal of Hazardous Materials, 2022, 424: 127188. DOI:10.1016/j.jhazmat.2021.127188
(  0) 0) |
| [61] |
Shi F Y, Zhang F B, Yang M Y. Research hotspots and progress of soil organic carbon mineralization based on bibliometrics method (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(2): 381-392. [史方颖, 张风宝, 杨明义. 基于文献计量分析的土壤有机碳矿化研究进展与热点[J]. 土壤学报, 2022, 59(2): 381-392.]
(  0) 0) |
| [62] |
Zhang Y T, Xiao H B, Nie X D, et al. Evolution of research on soil erosion at home and abroad in the past 30 years-Based on bibliometric analysis (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(4): 797-810. DOI:10.11766/trxb201906030237 [张宇婷, 肖海兵, 聂小东, 等. 基于文献计量分析的近30年国内外土壤侵蚀研究进展[J]. 土壤学报, 2020, 57(4): 797-810.]
(  0) 0) |
| [63] |
Dong M J, Nielsen L P, Yang S, et al. Cable bacteria: Widespread filamentous electroactive microorganisms protecting environments[J]. Trends in Microbiology, 2024, 32(7): 697-706. DOI:10.1016/j.tim.2023.12.001
(  0) 0) |
| [64] |
Thorup C, Petro C, Bøggild A, et al. How to grow your cable bacteria: Establishment of a stable single-strain culture in sediment and proposal of candidatus electronema aureum GS[J]. Systematic and Applied Microbiology, 2021, 44(5): 126236. DOI:10.1016/j.syapm.2021.126236
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


