土壤胶体具有巨大的比表面积和特殊的双电层结构,是土壤中最活跃的组成部分[1]。水环境体系中的胶体颗粒物质大部分来源于土壤胶体颗粒的分散和迁移[2]。土壤胶体的环境行为是影响许多农业及生态问题的重要因素。吸附着重金属离子和养分离子(氮和磷)的土壤胶体易随水体发生迁移和转化,这是导致农业面源污染、土壤养分流失的重要途径[3]。与此同时,土壤胶体的沉降会引起河流淤积,影响土壤水循环和物质运移;相反,土壤胶体的强烈分散会导致土壤孔隙率和透水性的降低,增加地表径流,加大水土流失的风险[4]。因此,准确、快速地测定不同类型土壤胶体在不同环境条件下的临界聚沉浓度(Critical coagulation concentration),对于从介观尺度上评估土壤抗蚀能力、制定合理的土地利用方式、保护和合理利用水资源、控制邻近地表水地下水中的污染物质具有重要意义。
临界聚沉浓度是胶体颗粒发生慢速凝聚向快速凝聚转折的最低电解质浓度,是衡量电解质对土壤胶体分散体系凝聚能力的一个定量指标[5],其大小直接反映了土壤胶体颗粒对电解质溶液的耐受程度。目前测定临界聚沉浓度的方法主要有粒子计数法、分光光度计法、光谱法、光散射法等。粒子计数法[6]主要是通过在显微镜下对可见的胶体颗粒计数,再分别计算快速与慢速凝聚的速率系数,并通过对数拟合的方式得出临界聚沉浓度的数值,此方法应用范围较窄,只能考察大颗粒胶体悬液且仅限于考察胶体悬液极小的区域;分光光度计法[7]或浊度法是通过监测胶体颗粒凝聚过程的吸光度值,再以吸光度对时间作图并求出每条曲线零时刻的切线斜率,将切线斜率进行线性拟合得到临界聚沉浓度的值,这种方法通常需要连续监测胶体颗粒在较长时段内的吸光度值且拟合步骤繁琐,计算过程复杂;光谱法[8]主要是使用声学和电声学光谱模拟胶粒在不同环境下的形态,进而可视化诱导胶体颗粒发生快速凝聚的电解质浓度,这种方法往往需要控制严苛的试验条件以及使用高精密度的试验仪器进行测定。近年来,光散射技术广泛应用于研究胶体颗粒相互作用及凝聚过程,是测定土壤胶体颗粒临界聚沉浓度的常用手段[9]。然而,通过该技术测定临界聚沉浓度往往需要多操作步骤以及多项测定指标,包括严格监测胶体颗粒在60~120 min时段内的凝聚动力学过程,然后根据凝聚体粒径随时间的变化计算平均凝聚速率,再根据平均凝聚速率随电解质的变化拟合得到临界聚沉浓度[10];或是通过方程计算不同浓度电解质溶液下胶体颗粒的黏结系数,再通过黏结系数与电解质浓度的关系式获得临界聚沉浓度[11]。该技术在测定胶体颗粒临界聚沉浓度过程中普遍存在费时、费力、多步骤及多指标测定、计算和拟合误差较大等不足。探索准确、快速测定胶体颗粒临界聚沉浓度的新技术与新手段成为目前土壤学领域研究亟待解决的问题。
根据经典DLVO理论,胶体颗粒间的相互作用受静电斥力和范德华引力共同支配[12]。环境体系中负电荷数量与颗粒间的静电斥力大小密切相关[13]。zeta电位作为表征胶体颗粒表面电荷性质及周围介质环境的重要参数,是度量胶体颗粒间排斥力或吸引力强弱的指标[14]。zeta电位绝对值的大小表示胶体电势的大小,其数值的变化能够直接反映胶体体系的稳定程度[15]。为此,可利用zeta电位以上特征进一步与电解质浓度进行拟合获得zeta电位与电解质浓度之间的变化关系,进而评估胶体颗粒的临界聚沉浓度。
土壤胶体的化学和矿物学差异是影响其在环境中稳定性的重要因素[16];有研究表明表面电荷密度小的高岭石胶体较表面电荷密度大的蒙脱石胶体更易发生凝聚[17];同时,外部环境因子(如温度、pH、电解质类型及浓度)的作用也会影响胶体颗粒的凝聚/分散过程[18]。本研究以恒电荷胶体—蒙脱石胶体、棕壤胶体及可变电荷胶体—胡敏酸胶体为试验材料,通过测定三种胶体颗粒在不同浓度K+和Ca2+条件下的zeta电位并结合分段线性拟合的方法快速评估胶体颗粒的临界聚沉浓度,进而为下一步构建不同电解质种类与浓度的变化改变土壤胶体颗粒表面电荷性质与凝聚过程规律之间的关联提供方法和理论支撑。
1 材料与方法 1.1 蒙脱石胶体制备称取50 g蒙脱石粉末于500 mL烧杯中,加入适量超纯水,搅拌均匀。用0.5 mol·L–1的KOH溶液将悬液的pH调至7,使用探针型超声波细胞破碎仪(JY92-IIN,宁波新芝,中国)超声分散15 min(功率70%)。然后将悬液转移至5 L沉降桶中并加入超纯水至刻度线,用多孔圆盘上下均匀搅动30次(搅动过程中圆盘不离开液面)后静置。根据Stokes定律计算出 < 200 nm粒径胶体颗粒沉降10 cm所需的时间(室温25 ℃条件下,沉降时间至少30 d),反复虹吸出烧杯中液面下10 cm的胶体,直至悬液清亮[19]。
1.2 胡敏酸胶体制备称取10 g胡敏酸粉末溶解于1 L 0.1 mol·L–1的KOH溶液中,以6 000 r·min–1的速度离心20 min,以去除其中的杂质。经离心获得的胡敏酸悬液用HCl将pH调至1~1.5,静置12 h后离心,弃去上清液,再用KOH溶解沉淀,如此酸碱反复处理3次,收集所有胡敏酸沉淀,并用超纯水清洗3次后移入1 L容量瓶中定容备用。取纯化后的胡敏酸悬液500 mL于烧杯中,用KOH和HCl调pH至7,用探针型超声波细胞破碎仪超声破碎20 min(功率70%),静置24 h备用。
1.3 棕壤胶体制备供试土壤采自沈阳农业大学棕壤长期定位实验站(41°49' N,123°49' E),该地区为温带大陆性季风气候,年平均气温8.0 ℃,年平均降水量705 mm。该长期定位实验始于1987年,长期种植作物为玉米,土壤为发育在黄土母质上的壤质棕壤。选取不施肥处理的0~20 cm耕层土壤为供试材料。土壤基础理化性质为:有机质15.44 g·kg–1,pH 6.12,全氮0.8 g·kg–1,全钾21.1 g·kg–1,阳离子交换量(CEC)23.6 cmol·kg–1,伊利石65.26%,高岭石3.42%,石英11.20%[20]。
棕壤胶体用超声破碎后静水沉降虹吸法提取(具体步骤同1.1蒙脱石胶体制备过程)。将所提取和制备的三种胶体悬液稀释至约1.6 g·L–1后装入广口瓶中在4 ℃条件下密封保存用于后续试验。
1.4 zeta电位法测定三种胶体的临界聚沉浓度采用Zeta Plus(Brookhaven,美国)电位仪测定三种胶体在不同电解质溶液条件下的zeta电位。实验前预热30 min并使用超纯水清洗电极、样品池,工作温度设置为25 ℃。设置胶体悬液pH为7,颗粒密度为160 mg·L–1。按照先加入0.4 mL胶体悬液,再加入一定量的超纯水和电解质溶液的顺序配制待测悬液,确保待测悬液总体积为4 mL。其中电解质溶液以100、1 000 mmol·L–1 KCl和10 mmol·L–1 CaCl2作为母液,参照表 1中所设置的浓度梯度计算母液稀释倍数,将母液和超纯水以不同配比准确加入样品池中。快速将电极插入样品池,使用快速滤纸擦拭溢出的液体,清除样品池内气泡并将导线插入电极上,测定三种胶体在不同类型及浓度的电解质溶液条件下的zeta电位,测定过程重复15次。
|
|
表 1 zeta电位法测定临界聚沉浓度所设置电解质类型和浓度 Table 1 The electrolyte type and concentration used in the zeta potential method |
测完后通过待测胶体的zeta电位与电解质浓度之间的变化进行分段线性拟合,获得拟合线交点处所对应的电解质浓度,并与动态激光光散射法测得的临界聚沉浓度进行比较。
1.5 动态激光光散射法测定三种胶体的临界聚沉浓度采用广角度动态激光光散射仪(BI-200SM,Brookhaven,美国)监测胶体凝聚过程中粒径增长随时间的变化趋势,数字相关器为BI-9000AT。设置悬液pH为7,颗粒密度为160 mg·L–1。实验前预热仪器30 min,散射角度设置为90°,温度设置为25 ℃,仪器功率、狭缝、波长分别设置为200 mV、100 μm、532 nm。凝聚实验中,按照先加入1 mL胶体悬液,再加入一定量的超纯水和电解质溶液的顺序配制待测悬液,确保待测悬液总体积为10 mL。其中电解质溶液以100、1 000 mmol·L–1 KCl和10 mmol·L–1 CaCl2作为母液,参照表 2中所设置的浓度梯度计算母液稀释倍数,将母液和超纯水以不同配比准确加入散射瓶中。将散射瓶充分摇匀后放入样品池,散射仪每隔30 s自动记录一次水动力学直径大小,每次监测时间设置为30 min[21]。
|
|
表 2 动态激光光散射法测定临界聚沉浓度所设置电解质类型和浓度 Table 2 The electrolyte type and concentration used in dynamic laser light scattering method |
根据胶体凝聚过程中凝聚体粒径随时间变化计算平均凝聚速率,计算公式如下:
| $ {\widetilde v_T}({f_0}) = \frac{1}{{{t_0}}}\int_0^{{t_0}} {\widetilde v} (t,{f_0})dt = \frac{1}{{{t_0}}}\int_0^{{t_0}} {\frac{{D(t) - {D_0}}}{t}} dt $ | (1) |
式中,
监测完成后,将相对较低与较高电解质浓度下的平均凝聚速率值分别拟合出两条直线,相交处对应的电解质浓度即为临界聚沉浓度[5]。
1.6 胶体颗粒间DLVO作用力分析根据DLVO理论,长程范德华引力与静电斥力之和即为支配带电胶体凝聚与分散的DLVO作用力,即:
| $ {P_{{\text{DLVO}}}}(d) = {P_{{\text{EDL}}}}(d) + {P_{{\text{VDW}}}}(d) $ | (2) |
假设胶体颗粒间距离为d(nm),则有:
| $ {P_{{\text{VDW}}}}(d) = - \frac{{{A_{{\text{ef}}}}_{\text{f}}}}{{0.6\pi }}{(10d)^{ - 3}} $ | (3) |
式中,
| $ {P_{{\text{EDL}}}}(d) = \frac{2}{{101}}RT{c_0}\left\{ {\cosh \left[ {\frac{{F\varphi ({d \mathord{\left/ {\vphantom {d 2}} \right. } 2})}}{{RT}}} \right] - 1} \right\} $ | (4) |
式中,
| $ \begin{aligned} &\frac{\pi }{{\text{2}}}\left[ {{\text{1 + (}}\frac{1}{2}{{\text{)}}^2}{e^{\frac{{2F\varphi ({d \mathord{\left/ {\vphantom {d 2}} \right. } 2})}}{{RT}}}} + {{(\frac{{1.3}}{{2.4}})}^2}{e^{\frac{{4F\varphi ({d \mathord{\left/ {\vphantom {d 2}} \right. } 2})}}{{RT}}}}} \right] - \hfill \\ &\arcsin {e^{\frac{{F{\varphi _0} - F\varphi ({d \mathord{\left/ {\vphantom {d 2}} \right. } 2})}}{{2RT}}}} = \frac{1}{4}dk{e^{\frac{{ - F\varphi ({d \mathord{\left/ {\vphantom {d 2}} \right. } 2})}}{{2RT}}}} \hfill \\ \end{aligned} $ | (5) |
式中,
| $ k = \sqrt {\frac{{8\pi {F^2}{c_0}}}{{\varepsilon RT}}} $ | (6) |
式中,
三种胶体颗粒在不同浓度K+下的zeta电位值如图 1所示。测定浓度范围内三种胶体颗粒zeta电位均为负值,表明胶体颗粒表面带负电荷。蒙脱石、棕壤、胡敏酸胶体颗粒zeta电位随K+浓度的变化主要分为两个阶段:(1)三种胶体颗粒分别在20~100、10~30和100~200 mmol·L–1范围内zeta电位绝对值随电解质浓度增加而明显降低,说明在此范围内,随着电解质浓度的增加,反离子屏蔽胶体表面负电荷以及压缩胶体双电层的能力逐渐增强,致使静电斥力急剧下降;(2)三种胶体颗粒分别在120~200、40~100和300~600 mmol·L–1范围内zeta电位绝对值随电解质浓度的线性变化斜率较小,随着离子浓度的升高,zeta电位绝对值变化趋缓。将K+条件下蒙脱石胶体、棕壤胶体、胡敏酸胶体zeta电位随电解质浓度的变化进行分段拟合得到的交点处对应的K+浓度为94.45、30.81和225.17 mmol·L–1。
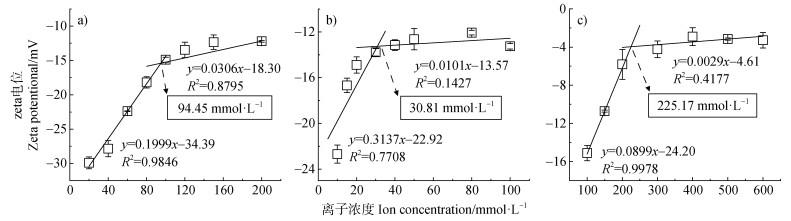
|
注:pH=7,温度:25 ℃,胶体颗粒密度:160 mg·L–1。 Note: pH=7, temperature: 25 ℃, colloid particle density: 160 mg·L–1. 图 1 蒙脱石(a)、棕壤(b)和胡敏酸(c)胶体颗粒在不同浓度KCl溶液中的zeta电位拟合曲线 Fig. 1 Zeta potential fitting curves of montmorillonite(a), brown earth(b)and humic acid(c)colloidal particles in different concentrations of KCl |
三种胶体zeta电位随Ca2+浓度变化趋势如图 2所示。与K+体系相同,三种胶体颗粒zeta电位绝对值随着Ca2+浓度的升高总体呈先下降、后平缓的特征。蒙脱石胶体、棕壤胶体、胡敏酸胶体分别在0.5~2.5、0.3~0.7和0.5~1.5 mmol·L–1范围内zeta电位绝对值变化较大,分别从11.98降至9.23,从23.28降至14.18,从18.58降至15.18,在3~5、1~4和2~5 mmol·L–1范围内zeta电位绝对值变化较小。将三种胶体对应的两段范围zeta电位绝对值随电解质的变化进行线性拟合,得到的交点处对应的Ca2+浓度分别为2.07、0.77和1.81 mmol·L–1。
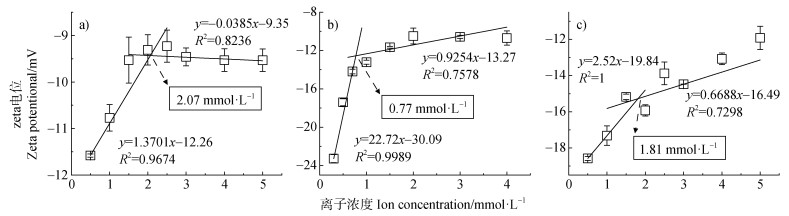
|
注:pH=7,温度:25 ℃,胶体颗粒密度:160 mg·L–1。 Note: pH=7, temperature: 25 ℃, colloid particle density: 160 mg·L–1. 图 2 蒙脱石(a)、棕壤(b)和胡敏酸(c)胶体颗粒在不同浓度CaCl2溶液中的zeta电位拟合曲线 Fig. 2 Zeta potential fitting curves of montmorillonite(a), brown earth(b)and humic acid(c)colloidal particles in different concentrations of CaCl2 |
三种胶体颗粒在不同浓度KCl溶液中的凝聚体粒径随时间的变化如图 3所示。KCl引发了三种胶体颗粒不同程度的凝聚:(1)在较低电解质浓度下,三种胶体颗粒凝聚较为缓慢,当K+浓度为10 mmol·L–1时,蒙脱石凝聚体粒径仅从319.2 nm增长至405.5 nm,棕壤凝聚体粒径从240.9 nm增长至756.5 nm。凝聚体粒径随时间呈线性增长关系,为反应控制团簇凝聚(Reaction-limited cluster aggregation,RLCA)机制[22]下的凝聚速率快速升高阶段,凝聚体主要受电解质浓度影响;(2)在较高电解质浓度下,三种胶体颗粒凝聚较为剧烈,当K+浓度为600 mmol·L–1时,胡敏酸凝聚体粒径从297.0 nm增长至1 951.8 nm,凝聚体粒径随时间呈幂函数增长,此阶段为扩散控制团簇凝聚(Diffusion-limited cluster aggregation,DLCA)机制[23]下凝聚速率平缓阶段,胶体颗粒的凝聚不再受电解质浓度的影响,布朗力是控制凝聚体形态的主要因素。
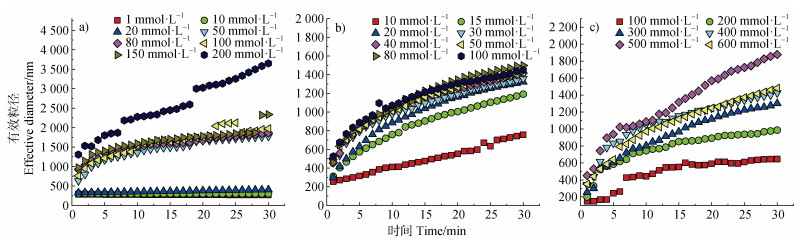
|
注:pH=7,温度:25 ℃,胶体颗粒密度:160 mg·L–1。 Note: pH=7, temperature: 25 ℃, colloid particle density: 160 mg·L–1. 图 3 蒙脱石(a)、棕壤(b)和胡敏酸(c)胶体颗粒在不同浓度KCl溶液中的凝聚动力学过程 Fig. 3 Dynamic aggregation process of montmorillonite(a), brown earth(b), and humic acid(c)colloidal particles in different concentrations of KCl |
三种胶体颗粒在不同浓度CaCl2溶液中的凝聚体粒径随时间的变化如图 4所示。在三种胶体体系中均可以明显观察到RLCA阶段和DLCA阶段。三种胶体颗粒在Ca2+中的凝聚趋势与在K+中一致。结合图 3和图 4可知,K+引发三种胶体颗粒的凝聚能力更弱于Ca2+,例如,K+引发蒙脱石胶体由慢速凝聚到快速凝聚所需的浓度梯度为1~100 mmol·L–1,而Ca2+所需的浓度梯度仅为0.3~2.5 mmol·L–1。造成这种现象的主要原因是二价离子压缩双电层能力较强,导致静电斥力降低,凝聚加强。三种胶体分散稳定性受盐基离子的影响由大到小依次为胡敏酸胶体、棕壤胶体、蒙脱石胶体。
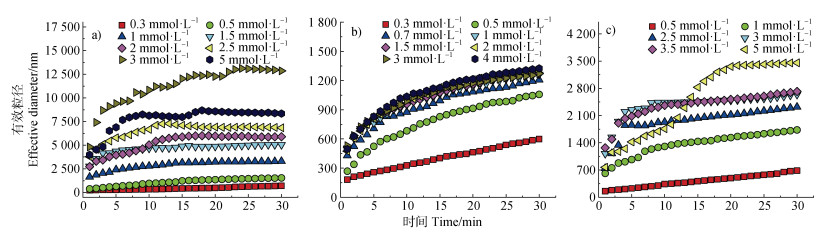
|
注:pH=7,温度:25 ℃,胶体颗粒密度:160 mg·L–1。 Note: pH=7, temperature: 25 ℃, colloid particle density: 160 mg·L–1. 图 4 蒙脱石(a)、棕壤(b)和胡敏酸(c)胶体颗粒在不同浓度CaCl2溶液中的凝聚动力学过程 Fig. 4 Dynamic aggregation process of montmorillonite(a), brown earth(b), and humic acid(c)colloidal particles in different concentrations of CaCl2 |
三种胶体颗粒在KCl中的平均凝聚速率及临界聚沉浓度见图 5,在相同浓度的KCl中,胡敏酸胶体的平均凝聚速率要远远小于棕壤胶体和蒙脱石胶体,表明胡敏酸对K+敏感程度最小。蒙脱石胶体、棕壤胶体、胡敏酸胶体在K+体系中的临界聚沉浓度分别为83.16、29.54和308.05 mmol·L–1,胡敏酸胶体在K+体系中的临界聚沉浓度最高,分别为蒙脱石胶体和棕壤胶体的3.70倍和10.43倍。通常认为,一价阳离子(K+、Na+等)引发胶体凝聚的能力主要来源于电荷中和作用[24]。胡敏酸胶体颗粒表面所带负电荷数量远高于蒙脱石胶体和棕壤胶体,电荷中和作用更强。大量研究中将有机质的高表面电荷数量和空间位阻效应归纳为其提高悬液稳定性的原因[25],因此,在以静电作用力为主导作用的一价离子体系中,胡敏酸的分散稳定性远高于蒙脱石和棕壤胶体。
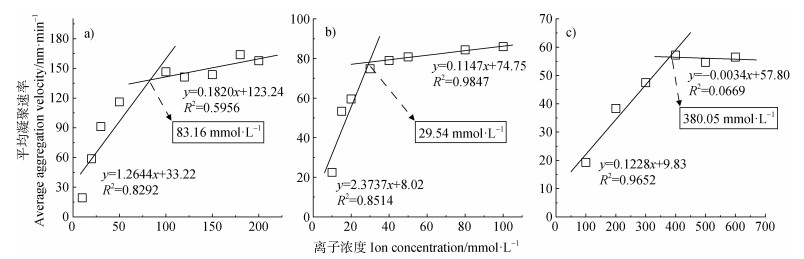
|
注:pH=7,温度:25 ℃,胶体颗粒密度:160 mg·L–1。 Note: pH=7, temperature: 25 ℃, colloid particle density: 160 mg·L–1. 图 5 蒙脱石(a)、棕壤(b)和胡敏酸(c)胶体颗粒在不同浓度KCl溶液中的临界聚沉浓度 Fig. 5 The critical coagulation concentrations of montmorillonite(a), brown earth(b), and humic acid(c)colloidal particles in different concentrations of KCl |
三种胶体颗粒在CaCl2中的平均凝聚速率及临界聚沉浓度见图 6。当Ca2+浓度为0.5和1 mmol·L–1时,蒙脱石胶体的平均凝聚速率分别为69.37和265.47 nm·min–1,棕壤胶体的平均凝聚速率分别为50.77和81.26 mmol·L–1,胡敏酸胶体的平均凝聚速率分别为20.41和79.57 nm·min–1,此时,蒙脱石胶体的凝聚速率明显高于棕壤胶体和胡敏酸胶体。随着电解质浓度的升高,当Ca2+浓度为3 mmol·L–1时,棕壤胶体和胡敏酸胶体的平均凝聚速率分别为84.24和145.31 nm·min–1。此时,胡敏酸胶体的凝聚速率高于棕壤胶体。蒙脱石胶体、棕壤胶体、胡敏酸胶体在Ca2+中的临界聚沉浓度分别为2.45、0.75和3.02 mmol·L–1。胡敏酸胶体在Ca2+中的临界聚沉浓度是蒙脱石胶体和棕壤胶体的1.23倍和4.03倍。
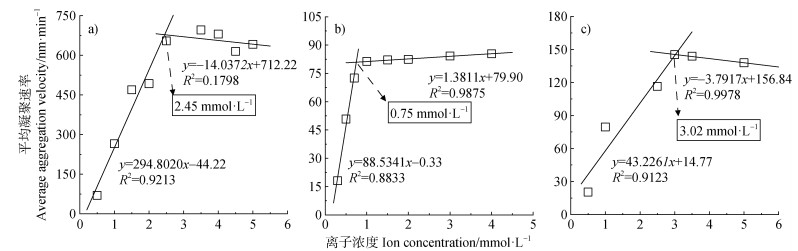
|
注:pH=7,温度:25 ℃,胶体颗粒密度:160 mg·L–1。 Note: pH=7, temperature: 25 ℃, colloid particle density: 160 mg·L–1. 图 6 蒙脱石(a)、棕壤(b)和胡敏酸(c)胶体颗粒在不同浓度CaCl2溶液中的临界聚沉浓度 Fig. 6 The critical coagulation concentrations of montmorillonite(a), brown earth(b), and humic acid(c)colloidal particles in different ccentrations of CaCl2 |
结合图 5和图 6可以看出三种胶体在二价离子体系中的临界聚沉浓度均小于一价离子,说明二价离子对静电作用力的减弱能力远远高于一价离子,且三种胶体间的临界聚沉浓度差异在二价离子体系中被缩小,则说明胶体颗粒在二价离子体系中的凝聚过程不仅受到静电作用力支配还有其他作用。如有报道发现有机物质与Ca2+的桥键作用,有促进二氧化钛纳米颗粒在Ca2+溶液中凝聚的特性[26]。同时,王春丽[27]的研究指出,随着溶液pH升高,Ca2+与胡敏酸等有机胶体表面羧基产生的桥键作用增强,显著加剧胶体颗粒之间的凝聚。Liu等[28]提出对于不同种类的带电胶体颗粒,其所处环境中的离子在颗粒表面附近的强电场中发生的非经典极化作用会显著影响离子对表面电荷的中和作用,从而影响颗粒的凝聚特征。Li等[29]基于量子力学原理提出外层电子不同轨道的非对称杂化是引发非经典极化作用和极化诱导共价作用的关键机制。本研究中,三种胶体的表面附近电场可高达108~109 V·m–1[30],二价离子在电场中的非经典极化作用进一步加剧了其与一价离子聚沉能力的差异。
2.4 不同离子体系下三种胶体颗粒间相互作用力根据三种胶体颗粒的表面电位及凝聚动力学曲线得到蒙脱石、棕壤和胡敏酸胶体在水中的Hamaker常数,并分别计算三种胶体在不同浓度K+下的DLVO合力,见图 7。图中正值表示胶体颗粒间DLVO合力为斥力,负值表示胶体颗粒间DLVO合力为吸引力。随着K+浓度的增加,三种胶体颗粒由相互排斥转向相互吸引,且离子浓度越高,引力作用越强。显见胡敏酸在不同浓度K+下的DLVO合力变化与蒙脱石和棕壤相比具有明显差异。例如,当K+浓度由200增至400 mmol·L–1时,胡敏酸胶体颗粒间的斥力消失,引力增加。这与动态激光光散射法相反且两种方法计算得到的DLVO合力差距较大。zeta电位法测得胡敏酸胶体颗粒的临界聚沉浓度要低于动态激光光散射法,说明低盐基离子浓度并未引起胶体颗粒发生快速凝聚,胶体颗粒间以静电斥力为主,从而证实了使用zeta电位法测定胡敏酸胶体颗粒临界聚沉浓度的不准确性。
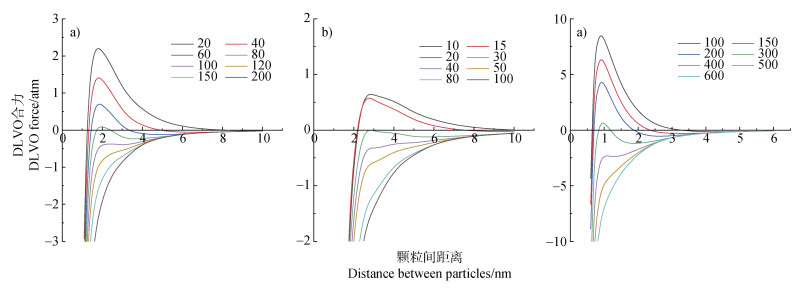
|
图 7 蒙脱石(a)、棕壤(b)和胡敏酸(c)胶体颗粒在不同浓度KCl溶液中的DLVO合力 Fig. 7 The DLVO force of montmorillonite(a), brown earth(b), and humic acid(c)colloidal particles in different concentrations of KCl |
三种胶体在不同浓度Ca2+下的DLVO合力如图 8所示。蒙脱石、棕壤和胡敏酸胶体颗粒间间距分别小于约1.5、3和0.9 nm时,DLVO合力表现为净吸引力;而当颗粒间间距大于约1.5、3和0.9 nm时,DLVO合力表现为净排斥力。这表明1.5、3和0.9 nm分别为蒙脱石、棕壤和胡敏酸与净作用力间的临界颗粒间距离。与蒙脱石、棕壤相比,胡敏酸胶体颗粒在Ca2+中的DLVO合力差异明显缩小,说明对于以可变电荷为主的胡敏酸而言,高负电荷数量以及非DLVO力作用(例如:空间位阻、疏水相互作用和水合力等)可能是影响其稳定性的原因及机制。Thonglerth等[31]发现改性氧化锌纳米颗粒(ZnONPs)在水中的稳定性不仅依赖于静电作用,还依赖于阻碍分散剂的空间位阻效应引起的电位稳定。赵文强等[32]发现在高离子浓度(50~100 mmol·L–1)下,逐渐减弱的短程疏水作用力可能是抑制红壤胶体吸附猪链球菌的作用机制之一。刘新星和胡岳华[33]使用原子力显微镜测定不同浓度盐溶液下SiO2与玻璃球间的相互作用力,发现在颗粒间距离小于3 nm时,DLVO理论的计算的排斥力结果与实测结果相反,说明水合力影响胶体颗粒的凝聚与分散。
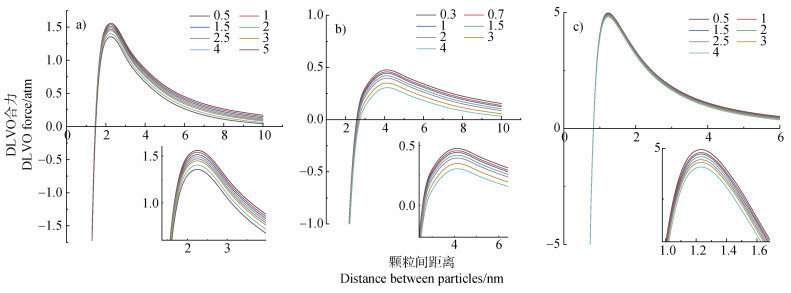
|
图 8 蒙脱石(a)、棕壤(b)和胡敏酸(c)胶体颗粒在不同浓度CaCl2溶液中的DLVO合力 Fig. 8 The DLVO force of montmorillonite(a), brown earth(b), and humic acid(c)colloidal particles in different concentrations of CaCl2 |
将动态激光光散射法测得的临界聚沉浓度与zeta电位法测得的临界聚沉值进行比较,见表 3,无论是在K+还是Ca2+体系中,通过两种方法获得的蒙脱石和棕壤胶体的临界聚沉浓度值接近,而胡敏酸的临界聚沉浓度值相差较大。说明使用zeta电位法可以较为准确地测定恒电荷表面的蒙脱石和棕壤胶体在不同电解质条件下的临界聚沉浓度,而无法准确测定可变电荷表面的胡敏酸胶体的临界聚沉浓度。
|
|
表 3 动态激光光散射法与zeta电位法测得的临界聚沉浓度 Table 3 The critical coagulation concentrations measured by dynamic laser light scattering and zeta potential methods |
有研究指出,对于恒电荷表面的矿物颗粒,其凝聚与分散过程由矿物表面电荷主导[34]。恒电荷土壤由于风化程度较低,其黏土矿物组成以2︰1型矿物为主,且铁铝氧化物含量很低,因此这类土壤表面带大量负电荷,基本不带正电荷,电荷数量随着环境条件的变化比较小[35]。本研究中可以通过zeta电位法实现对恒电荷表面的胶体(蒙脱石、棕壤)临界聚沉浓度的测定,进一步说明zeta电位可以准确反映出恒电荷表面颗粒的表面电荷情况。朱心宇[36]通过测定四种土壤纳米颗粒在不同价态离子中的临界聚沉浓度和zeta电位进而探究天然纳米颗粒的稳定性,结果表明二价和三价离子(Ca2+和La3+)能够更有效地改变纳米颗粒的临界聚沉浓度和zeta电位。同时,土壤纳米颗粒zeta电位的变化与临界聚沉浓度、纳米颗粒稳定性差异的结果具有相似趋势。胡宁等[37]指出zeta电位仪与动态光散射仪测定的结果均可直观反映褐土胶体在不同离子体系中的稳定性差异且两者在一价离子中具有一致性;相反,胶体颗粒表面的可变电荷源于土壤颗粒晶体外表面的断键和边面羟基在不同酸碱条件的离解。其电荷数量取决于溶液体系pH,并且会随着电解质浓度及类型的改变而改变[38]。有研究表明,盐基离子或金属氧化物的加入会使得可变电荷胶体颗粒表面扩散层发生重叠,进而导致胶体颗粒表面有效负电荷数量减少[39]。从上述实验结果可以看出,zeta电位法测定胡敏酸胶体在两种离子中的临界聚沉浓度要远远小于动态激光光散射法,表明可变电荷的zeta电位值仅能反映滑动面处的电势,无法准确反映其真实的表面电荷情况。再者,由于胡敏酸具有组成复杂,分子量、表面官能团不一等特性,导致其颗粒凝聚与分散过程会与表面官能团间的相互作用、离子水合作用、化学键作用、电场-量子涨落、空间位阻及疏水作用等综合效应相关。因此,通过zeta电位法无法准确获得以可变电荷为主的胡敏酸胶体的临界聚沉浓度。在实际研究中,动态激光光散射法表征样品的凝聚过程对胶体体系的均一度要求较高,且监测凝聚过程耗时较长,对凝聚数据的计算和拟合需要一定的过程,而zeta电位法操作简单,样品不需要进行复杂的前处理,样品体系的均一度要求范围宽,相比较具有测定时间短、所需样品数量少和测定效率更高等优势。因此在一定条件下可以优先考虑用此法快速表征胶体颗粒在一定环境中的临界聚沉浓度。
3 结论蒙脱石胶体、棕壤胶体、胡敏酸胶体表面zeta电位受到离子种类和离子浓度的强烈影响,在测定的浓度范围内胶体表面zeta电位均为负值,相同浓度条件下,三种胶体在二价离子体系中的zeta电位绝对值较一价离子体系低;同种离子体系中,离子浓度越高,zeta电位绝对值越低。三种胶体表面zeta电位在较低的离子浓度范围内变化幅度较大,在相对较高的离子浓度范围内变化趋缓,可通过分段线性拟合的方式获得临界聚沉浓度。zeta电位法评估得到的以恒电荷为主的蒙脱石胶体、棕壤胶体的临界聚沉浓度与动态激光光散射法的结果基本一致,可利用zeta电位法快速准确地测定其临界聚沉浓度。而对于以可变电荷为主的胡敏酸胶体颗粒,无法通过zeta电位法精确评估得到其临界聚沉浓度。
| [1] |
Zhang W J, Jiang F Y. Experimental study on effect of dissolved organic matter on mobility of soil colloids (In Chinese)[J]. Chinese Journal of Geotechnical Engineering, 2021, 43(11): 2013-2019. [张文杰, 蒋峰永. 可溶性有机质对土壤胶体可移动性影响试验研究[J]. 岩土工程学报, 2021, 43(11): 2013-2019.]
(  0) 0) |
| [2] |
Kinnell P I A. Raindrop-impact-induced erosion processes and prediction: A review[J]. Hydrological Processes, 2005, 19(14): 2815-2844.
(  0) 0) |
| [3] |
Boardman J, Poesen J. Soil erosion in Europe . London: John Wiley & Sons Ltd Press, 2006: 775-789.
(  0) 0) |
| [4] |
Chen Y L, Ma J, Wu X J, et al. Sedimentation and transport of different soil colloids: Effects of goethite and humic acid[J]. Water, 2020, 12(4): 980.
(  0) 0) |
| [5] |
Gao X D. Specific ion effects on mineral and humus aggregation[D]. Chongqing: Southwest University, 2014.[高晓丹. 矿物/腐殖质凝聚的离子特异性效应[D]. 重庆: 西南大学, 2014.]
(  0) 0) |
| [6] |
Broide M L, Cohen R J. Measurements of cluster-size distributions arising in salt-induced aggregation of polystyrene microspheres[J]. Journal of Colloid and Interface Science, 1992, 153(2): 493-508.
(  0) 0) |
| [7] |
Messai I, Delair T. Adsorption of chitosan onto poly(D, L-lactic acid)particles: A physico-chemical investigation[J]. Macromolecular Chemistry and Physics, 2005, 206(16): 1665-1674.
(  0) 0) |
| [8] |
Burnett S S, Mitchell J W. Acoustic and electroacoustic spectroscopic determination of the critical coagulation concentration for the aggregation of fumed silica[J]. Journal of Sol-Gel Science and Technology, 2015, 74(3): 661-669.
(  0) 0) |
| [9] |
Li B, Li H, Zhu H L, et al. Dynamic light scattering of aggregation of colloids in yellow earth different in pH (In Chinese)[J]. Acta Pedologica Sinica, 2013, 50(1): 89-95. DOI:10.11766/trxb201112270507 [李兵, 李航, 朱华玲, 等. 不同pH条件下黄壤胶体凝聚的动态光散射研究[J]. 土壤学报, 2013, 50(1): 89-95.]
(  0) 0) |
| [10] |
Jia M Y, Li H, Zhu H L, et al. An approach for the critical coagulation concentration estimation of polydisperse colloidal suspensions of soil and humus[J]. Journal of Soils and Sediments, 2013, 13(2): 325-335.
(  0) 0) |
| [11] |
Chen K L, Elimelech M. Relating colloidal stability of fullerene(C60)nanoparticles to nanoparticle charge and electrokinetic properties[J]. Environmental Science & Technology, 2009, 43(19): 7270-7276.
(  0) 0) |
| [12] |
Derjaguin B, Landau L. Theory of the stability of strongly charged lyophobic sols and of the adhesion of strongly charged particles in solutions of electrolytes[J]. Progress in Surface Science, 1993, 43(1/4): 30-59.
(  0) 0) |
| [13] |
Verwey E J W, Overbeek J T G. Theory of the stability of lyophobic colloids[J]. Journal of Colloid Science, 1955, 10(2): 224-225.
(  0) 0) |
| [14] |
Zuo Y, Li S B, Wang T T, et al. Effect of different base ions on zeta potential and aggregation process of black soil colloid (In Chinese)[J]. Chinese Journal of Soil Science, 2020, 51(1): 99-104. [左研, 李少博, 王童彤, 等. 不同盐基离子对黑土胶体zeta电位及凝聚过程的影响[J]. 土壤通报, 2020, 51(1): 99-104.]
(  0) 0) |
| [15] |
Wan L P, Meng Y F. Zeta electric potential of oilfield wastewater in flocculation process (In Chinese)[J]. Chemical Research, 2004, 15(2): 25—27, 34. [万里平, 孟英峰. 油田作业废水絮凝过程中Zeta电位的研究[J]. 化学研究, 2004, 15(2): 25—27, 34.]
(  0) 0) |
| [16] |
Igwe C A, Akamigbo F O R, Mbagwu J S C. Chemical and mineralogical properties of soils in southeastern Nigeria in relation to aggregate stability[J]. Geoderma, 1999, 92(1/2): 111-123.
(  0) 0) |
| [17] |
Tang J, Zhu X, Liu X T, et al. Hofmeister effects of 2︰1 and 1︰1 clay minerals in agglomeration: A comparative study (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(2): 381-391. DOI:10.11766/trxb201809170258 [唐嘉, 朱曦, 刘秀婷, 等. 2︰1和1︰1型黏土矿物胶体凝聚中Hofmeister效应的比较研究[J]. 土壤学报, 2020, 57(2): 381-391.]
(  0) 0) |
| [18] |
Wei X Y, Pan D Q, Xu Z, et al. Colloidal stability and correlated migration of illite in the aquatic environment: The roles of pH, temperature, multiple cations and humic acid[J]. Science of the Total Environment, 2021, 768: 144174.
(  0) 0) |
| [19] |
Xiong Y. Soil colloids -Book 2 - Soil colloids research method[M]. Beijing: Science Press, 1985.[熊毅. 土壤胶体, 第二册: 土壤胶体研究法[M]. 北京: 科学出版社, 1985.]
(  0) 0) |
| [20] |
Ren K L, Zuo Y, Kou Q, et al. Comparative study on colloidal aggregation kinetics of brown earth under long-term fertilization (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(2): 484-494. DOI:10.11766/trxb202208300347 [任凯璐, 左研, 寇琪, 等. 长期不同施肥的棕壤胶体凝聚动力学比较[J]. 土壤学报, 2024, 61(2): 484-494.]
(  0) 0) |
| [21] |
Li S B, Xu Y D, Zhang Y, et al. Effects of Na+, Ca2+and Na+-Ca2+ mixture on the stability of humic acid colloids (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(5): 1240-1248. DOI:10.11766/trxb201906050252 [李少博, 徐英德, 张昀, 等. Na+、Ca2+及Na+-Ca2+混合离子对胡敏酸胶体稳定性的影响[J]. 土壤学报, 2020, 57(5): 1240-1248.]
(  0) 0) |
| [22] |
Lin M Y, Lindsay H M, Weitz D A, et al. Universality in colloid aggregation[J]. Nature, 1989, 339(6223): 360-362.
(  0) 0) |
| [23] |
Zhu H L. Laser scattering study of soil organic/inorganic colloidal particles aggregation[D]. Chongqing: Southwest University, 2009.[朱华玲. 土壤有机\无机胶体颗粒凝聚的激光散射研究[D]. 重庆: 西南大学, 2009.]
(  0) 0) |
| [24] |
Zhu X, Chen H, Li W, et al. Evaluation of the stability of soil nanoparticles: The effect of natural organic matter in electrolyte solutions[J]. European Journal of Soil Science, 2017, 68(1): 105-114.
(  0) 0) |
| [25] |
Chen M, Wang D J, Yang F, et al. Transport and retention of biochar nanoparticles in a paddy soil under environmentally-relevant solution chemistry conditions[J]. Environmental Pollution, 2017, 230: 540-549.
(  0) 0) |
| [26] |
Lin D, Drew Story S, Walker S L, et al. Influence of extracellular polymeric substances on the aggregation kinetics of TiO2 nanoparticles[J]. Water Research, 2016, 104: 381-388.
(  0) 0) |
| [27] |
Wang C L. Effect of organic matter on the suspension stability of loess nanoparticle and its mechanism[D]. Yangling, Shaanxi: Northwest A & F University, 2020.[王春丽. 有机质对黄土纳米颗粒悬浮液稳定性的调节作用及机制[D]. 陕西杨凌: 西北农林科技大学, 2020.]
(  0) 0) |
| [28] |
Liu X M, Li H, Li R, et al. Strong non-classical induction forces in ion-surface interactions: General origin of Hofmeister effects[J]. Scientific Reports, 2014, 4: 5047.
(  0) 0) |
| [29] |
Li Q Y, Shi W Y, Yang Q Y. Polarization induced covalent bonding: A new force of heavy metal adsorption on charged particle surface[J]. Journal of Hazardous Materials, 2021, 412: 125168.
(  0) 0) |
| [30] |
Guo X M. Specific cation/anion effects of soil particle aggregation and aggregates stability[D]. Chongqing: Southwest University, 2023.[郭晓敏. 土粒凝聚与团聚体稳定性的阳/阴离子特异性效应[D]. 重庆: 西南大学, 2023.]
(  0) 0) |
| [31] |
Thonglerth P, Sujaridworakun P, Boondamnoen O. Preparation of ZnO nanoparticles water-based dispersion[J]. Journal of Physics: Conference Series, 2022, 012029.
(  0) 0) |
| [32] |
Zhao W Q, Liu X, Cai P, et al. Mechanisms of bacterial pathogens adsorption on red soil colloids (In Chinese)[J]. Acta Pedologica Sinica, 2013, 50(2): 221-229. DOI:10.11766/trxb201206210246 [赵文强, 刘星, 蔡鹏, 等. 病原菌在红壤胶体上的吸附机制研究[J]. 土壤学报, 2013, 50(2): 221-229.]
(  0) 0) |
| [33] |
Liu X X, Hu Y H. Atomic force microscopy and its application in mineral processing (In Chinese)[J]. Mining and Metallurgical Engineering, 2000, 20(1): 32-35. [刘新星, 胡岳华. 原子力显微镜及其在矿物加工中的应用[J]. 矿冶工程, 2000, 20(1): 32-35.]
(  0) 0) |
| [34] |
Song X Y, Zhou J J, Deng L B. Experimental research of electrolytic effect on fine sediment flocculation (In Chinese)[J]. Yangtze River, 2013, 44(9): 67-71. [宋晓阳, 周晶晶, 邓樑斌. 电解质对细颗粒泥沙絮凝影响的试验研究[J]. 人民长江, 2013, 44(9): 67-71.]
(  0) 0) |
| [35] |
Xu R K, Li J Y, Jiang J. Progresses in research on special chemical phenomena and their mechanisms in variable charge soils (In Chinese)[J]. Acta Pedologica Sinica, 2014, 51(2): 207-215. DOI:10.11766/trxb201311100523 [徐仁扣, 李九玉, 姜军. 可变电荷土壤中特殊化学现象及其微观机制的研究进展[J]. 土壤学报, 2014, 51(2): 207-215.]
(  0) 0) |
| [36] |
Zhu X Y. The stability of natural soil nanoparticles and their changes in paddy soil during pedogenic process[D]. Hangzhou: Zhejiang University, 2017.[朱心宇. 土壤天然纳米颗粒稳定性的表征及其在水稻土成土过程中的变化[D]. 杭州: 浙江大学, 2017.]
(  0) 0) |
| [37] |
Hu N, Xu C Y, Geng Z C, et al. Colloid properties of calcium carbonate nodules in cinnamon soil (In Chinese)[J]. Soils, 2022, 54(5): 1000-1009. [胡宁, 许晨阳, 耿增超, 等. 褐土碳酸钙结核的胶体特性研究[J]. 土壤, 2022, 54(5): 1000-1009.]
(  0) 0) |
| [38] |
Huang C Y, Xu J M. Soil Science (In Chinese). 3rd ed[M]. Beijing: Beijing: China Agriculture Press, 2010. [黄昌勇, 徐建明. 土壤学[M]. 3版. 北京: 中国农业出版社, 2010.]
(  0) 0) |
| [39] |
Xu H C, Houghton E M, Houghton C J, et al. Variations in size and composition of colloidal organic matter in a negative freshwater estuary[J]. Science of the Total Environment, 2018, 615: 931-941.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


