2. 宁夏哈巴湖国家级自然保护区管理局, 宁夏盐池 751501;
3. 北京林业大学水土保持国家林业和草原局重点实验室, 北京 100083;
4. 北京林业大学林业生态工程教育部工程中心, 北京 100083;
5. 北京林业大学林木资源高效生产全国重点实验室, 北京 100083;
6. 林木育种与生态修复国家工程研究中心, 北京 100083
2. Ningxia Habahu National Nature Reserve Administration, Yanchi, Ningxia 751501, China;
3. Key Laboratory of National Forestry and Grassland Administration on Soil and Water Conservation, Beijing Forestry University, Beijing 100083, China;
4. Engineering Research Center of Forestry Ecological Engineering, Ministry of Education, Beijing Forestry University, Beijing 100083, China;
5. State Key Laboratory of Efficient Production of Forest Resource, Beijing Forestry University, Beijing 100083, China;
6. National Engineering Research Center for Tree Breeding and Ecological Restoration, Beijing Forestry University, Beijing 100083, China
土壤有机碳(Soil organic carbon,SOC)是陆地生态系统最大的碳库,其储量分别约为大气和植被碳库的2倍和3倍,显著影响大气CO2浓度和全球碳平衡[1]。因此,提高SOC的储量和稳定性是应对全球气候变化和提高土壤碳汇的关键[2]。荒漠生态系统约占全球陆地面积的20%[3],受降水制约,荒漠区高等维管束植物盖度有限,生物土壤结皮(简称生物结皮,Biological soil crusts,BSCs)常在灌草群落下方及植被间空地广泛发育,盖度可达全球干旱、半干旱地区裸地面积的70%,发挥着极其重要的生态功能。BSCs是由蓝藻、绿藻、地衣、藓类和微生物,以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的地表覆盖体[4]。根据优势物种组成,可将BSCs分为藻结皮、地衣结皮和苔藓结皮[5]。研究表明,BSCs中的固碳微生物、藻类和苔藓植物甚至具有与一些维管植物相当的固碳潜力[6],对表层SOC的积累作用平均提高约70%[7]。Meta分析显示,BSCs在贫营养生境(如荒漠)较富营养生境(如森林)表现出更高的SOC富集效应[8],表明荒漠生态系统分布的BSCs对SOC的积累更为重要。因此,探究BSCs在土壤碳库和碳循环中的贡献和作用对理解荒漠生态系统碳循环具有重要意义。
先前研究表明,BSCs能够通过苔藓类和藻类的光合作用提高SOC含量[9]。同时,BSCs中的固碳微生物根据底物类型和环境条件,可通过有氧环境下的卡尔文-本森-巴斯汉循环(Calvin-Benson- Bassham,CBB)、微氧环境下的还原性三羧酸循环(Reductive tricarboxylic acid,rTCA)循环等碳固定途径将大气中的CO2转化为有机物质[10],进一步提升SOC含量。此外,近年越来越多的研究认为,微生物通过生长、增殖和死亡等连续过程产生的大量细胞残体,在SOC固存过程中同样扮演着至关重要的角色。在全球农田、草地和森林表层(0~20 cm)土壤中,微生物残体对SOC的贡献率分别高达51%、47%和35%[11]。在微生物转化过程较为强烈的土壤中(如草地表层土壤),微生物残体甚至主导SOC的积累[12]。同时,微生物残体作为一种富含氮、磷的优良底物,可被微生物分解利用以满足其养分需求[13]。微生物残体碳的积累和分解过程受到有机质(底物)质量、养分可利用性、土壤矿物保护、土壤理化性质等因素的影响[14]。在干旱、黏土含量及底物可利用性较低的荒漠生态系统中,BSCs的存在显著改善了表层土壤水热状况,提升了养分有效性、酶活性及微生物多样性,为微生物残体的形成提供了良好条件[15]。然而,当前微生物残体碳的研究主要集中于非生物结皮覆盖区[14,16],针对生物结皮覆盖区的研究较为有限,关于荒漠生态系统生物结皮覆盖土壤中微生物残体碳对SOC贡献及其影响因素的研究仍不清楚,亟需进一步的探究。
毛乌素沙地位于我国北方农牧交错带的核心地带,是典型的半干旱荒漠区。得益于近几十年开展的大规模防沙治沙工程,毛乌素沙地生物结皮的总体平均盖度已超30%,部分地区高达80%[17]。因此,本研究以宁夏盐池毛乌素沙地生态系统国家定位观测研究站内广泛分布的藻、地衣和苔藓结皮为研究对象,探究不同类型生物结皮覆盖下结皮层与层下(0~5 cm)土壤微生物残体碳含量(Microbial necromass carbon,MNC)及其对SOC的贡献,结合土壤理化性质,进一步揭示生物结皮覆盖土壤中微生物残体碳的影响因素。本研究结果有助于理解生物结皮覆盖土壤中SOC的重要来源、稳定机制及环境调控作用,为荒漠生态系统固碳策略的制定提供重要的科学参考。
1 材料与方法 1.1 研究区概况试验于毛乌素沙地西南缘宁夏盐池毛乌素沙地生态系统国家定位观测研究站(37°04′—38°10′N,106°30′—107°41′E)站区内开展。研究区处于干旱与半干旱、干草原与荒漠草原的过渡地带,平均海拔1 530 m,属于典型中温带大陆性季风气候,年均气温8.1 ℃,年均无霜期165 d,年均降水量284.8 mm。站区内土壤类型以风沙土为主,植被以沙生、旱生植物为主,主要灌木优势种包括黑沙蒿(Artemisia ordosica)、北沙柳(Salix psammophila)、柠条锦鸡儿(Caragana korshinskii)、蒙古羊柴(Corethrodendron fruticosum var. mongolicum)等,主要伴生草本有赖草(Leymus secalinus)、狗尾草(Setaria viridis)、阿尔泰狗娃花(Aster altaicu)等,植被盖度在30%~70%之间[18]。BSCs是站区内常见的生物地被物,总体盖度达到30%以上,主要类型包括:藻结皮、地衣结皮和苔藓结皮,对应的优势种分别为具鞘微鞘藻(Microcoleus vaginatus)、坚韧胶衣(Collema tenax)和银叶真藓(Bryum argenteum)[19]。在研究站区内,藻结皮厚度3~5 mm,多呈片状分布,地衣结皮厚度4~7 mm,多呈片状分布,苔藓结皮厚度8~20 mm,多成斑块状分布。
1.2 试验设计于2022年7月在站区内进行样品采集,选取藻结皮、地衣结皮、苔藓结皮三种生物结皮分布均匀、地势平坦的区域(植被与BSCs镶嵌分布,植被之间空隙BSCs覆盖率 > 80%),分别设置5个20 m × 20 m的样方,每个样方间隔20 m以上。分生物结皮层和层下0~5 cm土壤层取样。结皮层是指聚集土壤颗粒并形成覆盖地面的那部分黏性层[20],该部分剥离后不易自然脱落。在每个藻、地衣与苔藓结皮覆盖区域的样方内,采用“S”型取样法采集土壤样品,每个样方同层次样品混合均匀后作为1个重复样品,共30个样品(3种生物结皮类型×2个土层×5个重复=30)。所有土壤样品过2 mm筛,去除细根、碎石等杂物后迅速带回实验室。将每份土壤样品分为3份:一份鲜土立即测定土壤含水量(Soil moisture content,SMC);一份保存于-20 ℃冰箱,用于硝态氮(NO-3-N)、铵态氮(NH+ 4-N)以及氨基糖含量的测定;一份置于阴凉通风处自然风干,用于全氮(Total nitrogen,TN)、全磷(Total phosphorous,TP)、pH、电导率(Electrical conductivity,EC)、SOC、颗粒有机碳(Particulate organic carbon,POC)、矿物结合态有机碳(Mineral-associated organic carbon,MAOC)、交换性钙离子(Exchangeable calcium ions,Ex-Ca)、交换性镁离子(Exchangeable magnesium ion,Ex-Mg)及土壤机械组成的测定。
1.3 指标测定采用pH计测定土壤的pH(水土质量比2.5:1.0)。采用电极法测定电导率。采用烘干法测定SMC。采用凯氏定氮法和钼锑抗比色法分别测定土壤TN和TP的含量。利用1 mol·L-1乙酸铵法对土壤样品进行前处理,然后采用ICP电感耦合等离子体光谱仪(Aglient 5100)进行Ex-Ca与Ex-Mg的测定。利用颗粒粒度粒形分析仪(EyeTech)测定土壤机械组成,依据国际土壤质地分类[21]。利用重铬酸钾滴定法测量土壤SOC含量。采用氯化钾浸提—分光光度法测定NH+ 4-N、NO-3-N含量。采用六偏磷酸钠提取法测定POC和MAOC含量[22],具体步骤为:将风干土壤样品(20 g)用60 mL化学分散剂六聚磷酸钠摇匀18 h,然后通过0.053 mm的筛进行彻底冲洗,分离POC组分(> 0.053 mm)和MAOC组分(< 0.053 mm),转移到已知重量的烧杯中,酸化处理后将收集的馏分在65℃干燥,粉碎至0.15 mm,利用总有机碳分析仪(Elementar & ABB)测定含量。
采用Zhang和Amelung[23]的方法,提取和测定氨基葡萄糖(GluN)和胞壁酸(MurA)等氨基糖含量,估算土壤细菌残体碳(Bacterial necromass carbon,BNC)和真菌残体碳(Fungal necromass carbon,FNC)含量。
| $ \mathrm{FNC}=(\mathrm{GluN} / 179.17-2 \times \mathrm{MurN} / 251.23) \times 179.17 \times 9 $ | (1) |
| $ \mathrm{BNC}=\operatorname{MurA} \times 45 $ | (2) |
式中,系数179.17和251.23分别为氨基葡萄糖和胞壁酸的分子量;9和45分别是将GluN换算成真菌残体碳含量以及将MurA换算成细菌残体碳含量的转化系数;2为细菌细胞壁中MurA与GluN的物质的量之比;微生物残体碳含量是真菌和细菌残体碳含量之和[24]。
1.4 数据处理使用Microsoft Excel初步处理数据,利用R4.3.2软件执行单因素方差分析、相关性分析及回归分析,运用Origin 2024软件绘图。对于符合正态性和方差齐性的指标,采用单因素方差分析与LSD法多重比较;不符合的则采用Kruskal-Wallis检验与Nemenyi后续检验(结皮层的NO-3-N与结皮层下的MAOC、TP)。同一类型生物结皮层和结皮层下相关指标的差异性采样配对t检验,不符合条件的采用Wilcoxon秩和检验(苔藓结皮层与层下砂粒、黏粉粒)。采用斯皮尔曼相关系数(Spearman correlation)分析微生物残体碳与土壤理化性质的相关性,并通过回归分析找出显著影响微生物残体碳的环境因子,必要时使用“lmerTest”包中的Box-Cox变换进行正态性转换。
2 结果 2.1 生物结皮对土壤理化性质的影响由图 1可知,藻、地衣、苔藓结皮层与层下土壤的pH、EC、POC和TP含量无显著差异。在结皮层与层下土壤中,SMC、Ex-Mg及Ex-Ca随藻、地衣、苔藓结皮均呈现递增趋势(P≤0.05)。苔藓结皮覆盖土壤中,NO-3-N含量显著高于藻结皮与地衣结皮,TN、NH+ 4-N含量显著高于藻结皮。藻结皮的层下土壤的硝态氮含量最高。苔藓结皮在SMC、Ex-Mg、Ex-Ca以及氮素等养分固存方面表现出显著优势。在结皮层与层下土壤的对比中,POC、TN、NH+ 4-N、NO-3-N、SMC、TP及Ex-Ca在不同类型生物结皮中均表现出显著差异(图 1),而EC和Ex-Mg在三种结皮类型中差异不显著。总体而言,生物结皮覆盖土壤中结皮层土壤理化性质优于结皮层下土壤。
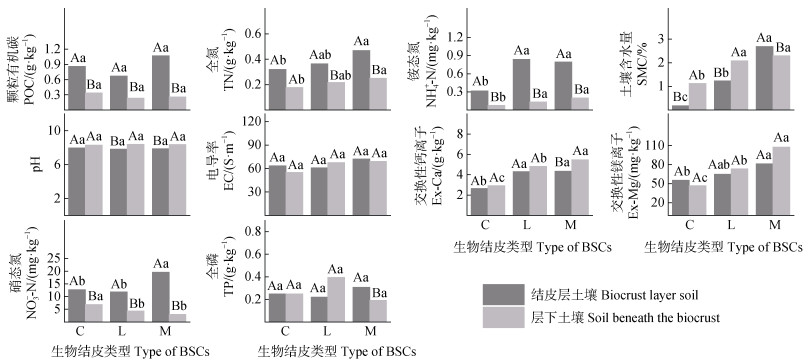
|
注:C代表藻结皮,L代表地衣结皮,M代表苔藓结皮;不同小写字母表示同一土层不同生物结皮间差异性显著(P≤0.05),不同大写字母表示同一生物结皮不同土层间差异性显著(P≤0.05);图中误差线为标准差,n=5。下同。Note:C represents cyanobacterial crust,L represents lichen crust,and M represents moss crust. Different lowercase letters indicate significant differences among different types of biocruts at the same soil depth(P≤0.05),and different uppercase letters indicate significant differences between different types of biocruts(P≤0.05). The error bars in the figure represent the standard deviation,n=5. The same below. 图 1 不同类型生物结皮覆盖土壤中土壤理化性质 Fig. 1 Differences in soil physicochemical properties among different biocrust-covered soils |
由图 2可知,在不同生物结皮土壤之间,结皮层土壤机械组成与层下MAOC含量无显著差异。苔藓结皮层MAOC与层下黏粉粒含量最高,砂粒含量最低。在结皮层与层下土壤的对比中,三种类型结皮层中MAOC的含量均显著大于结皮层下土壤,土壤机械组成均无显著差异。
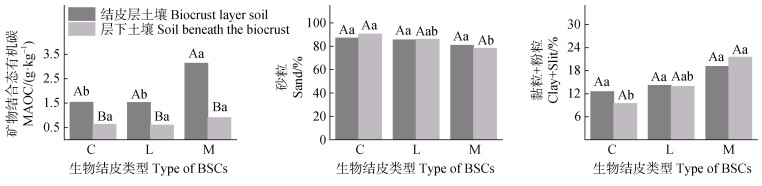
|
图 2 不同类型生物结皮覆盖土壤中矿物结合态有机碳含量和土壤机械组成 Fig. 2 The content of MAOC and soil mechanical composition in different biocrust-covered soils |
由图 3可知,在生物结皮层与层下土壤中,苔藓结皮SOC含量均显著高于藻、地衣结皮(P≤0.05),地衣结皮与藻结皮间则无显著差异。在结皮层土壤中,藻结皮FNC、BNC含量显著高于苔藓结皮,与地衣结皮无显著差异;在结皮层下土壤中,FNC、BNC在三类结皮间均无显著差异。总体而言,苔藓结皮层中SOC含量显著大于藻、地衣结皮,但微生物残体碳含量最低。此外,三种结皮层中的SOC、FNC、BNC含量均显著大于结皮层下,说明结皮层土壤更有利于微生物残体碳的积累。
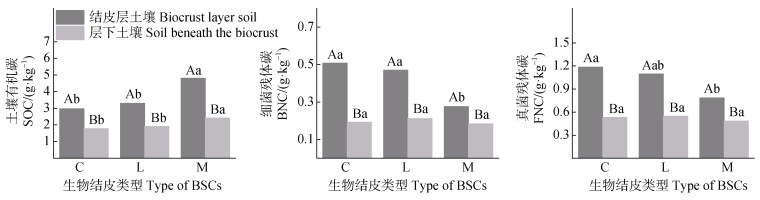
|
图 3 不同类型生物结皮覆盖土壤中土壤有机碳与微生物残体碳含量 Fig. 3 The content of soil organic carbon and microbial necromass carbon in different biocrust-covered soils |
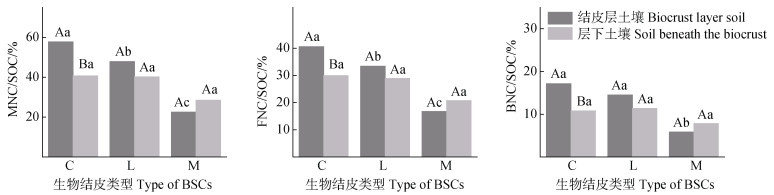
在藻、地衣与苔藓结皮中,MNC占SOC的平均比例分别约为49.19%、44.07%和25.51%;FNC与BNC对SOC的平均贡献度分别约为11.23%和28.36%。在结皮层土壤中,MNC/SOC、FNC/SOC与BNC/SOC均随藻、地衣、苔藓结皮显著降低,藻结皮与地衣结皮的BNC/SOC无显著差异。在结皮层下土壤,三种结皮间MNC/SOC、FNC/SOC及BNC/SOC均无显著差异。在结皮层与层下土壤的对比中,藻结皮层土壤中MNC/SOC、FNC/SOC与BNC/SOC均显著高于结皮层下土壤,地衣结皮、苔藓结皮均无显著差异。
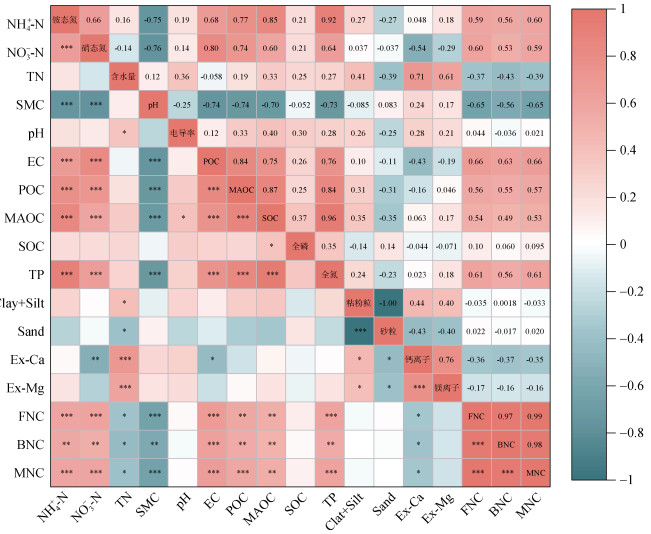
2.3 生物结皮覆盖土壤微生物残体碳变化的驱动因素通过相关性分析发现(图 5),FNC与BNC均与NH+ 4-N、NO-3-N、TN、POC、MAOC、SOC呈显著正相关(P≤0.05),与pH、SMC、Ex-Ca呈显著负相关(P≤0.05)。
|
图 4 不同类型生物结皮覆盖土壤中微生物残体碳对土壤有机碳的贡献 Fig. 4 The contribution of microbial necromass carbon to SOC in different biocrust-covered soils |
|
注:*,P≤0.05,**,P≤0.01,***,P≤0.001。0.9 < |r| < 1,高度相关;0.7 < |r| < 0.9,强相关;0.4 < |r| < 0.7,中度相关;0.2 < |r| < 0.4,弱相关;0 < |r| < 0.2,极弱相关或无相关性。Note:*,P≤0.05,**,P≤0.01,***,P≤0.001. When 0.9 < |r| < 1,it indicates a high degree of correlation;When 0.7 < |r| < 0.9,it indicates a strong correlation;When 0.4 < |r| < 0.7,it indicates a moderate correlation;When 0.2 < |r| < 0.4,it indicates a weak correlation;When 0 < |r| < 0.2,it indicates a very weak correlation or no correlation. 图 5 生物结皮覆盖土壤中微生物残体碳与环境因子的相关性 Fig. 5 The correlation between microbial necromass carbon and environmental factors in biocrust-covered soils |
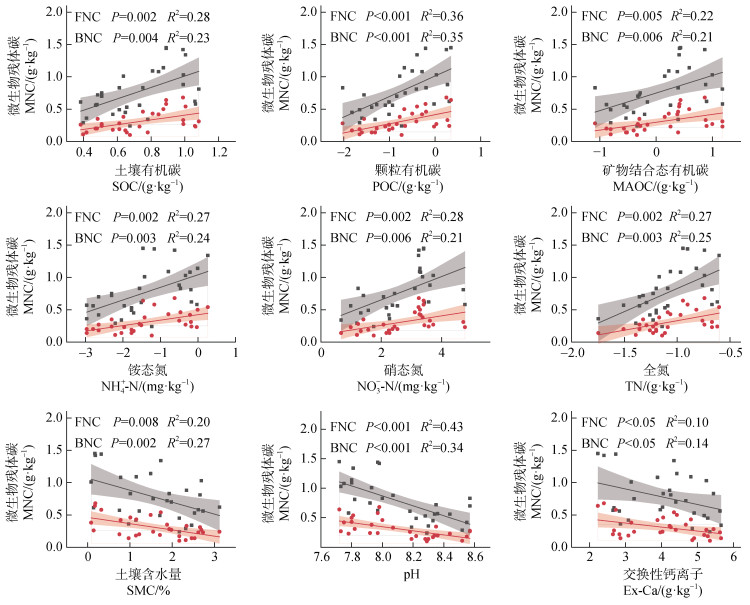
回归分析表明(图 6),FNC、BNC与SOC呈显著正相关(P < 0.01),说明微生物残体对生物结皮中SOC的形成具有重要影响。与MAOC相比,FNC、BNC与POC的关系更为显著(P < 0.001),表明微生物残体碳主要贡献于活性碳库。此外,FNC、BNC与土壤中的NO-3-N、TN、NH+ 4-N均显著正相关,说明土壤中氮含量的升高有利于微生物残体碳的积累;与pH、SMC、Ex-Ca均呈显著负相关,表明土壤pH、SMC、Ex-Ca的升高不利于微生物残体碳的累积。
|
图 6 生物结皮覆盖土壤中微生物残体碳与环境因子的回归分析 Fig. 6 Regression analysis of microbial necromass carbon and environmental factors in biocrust-covered soils |
三类生物结皮覆盖土壤中,微生物残体在SOC形成中起着至关重要的作用(图 6)。FNC对SOC平均贡献度(28.4%±10.7%)显著高于BNC(11.2%±4.8%)(图 4),这与现有研究结果一致[14,22]。这主要与真菌和细菌本身的特性及其生成的残体碳稳定性有关。首先,真菌的抗逆性更强[25]。这使得真菌在底物资源受限的荒漠生态系统中,可利用更难降解的化合物进行合成代谢[11],促进了其残体碳的积累。其次,真菌的生物量是细菌的3倍~4倍[26],生物量上的差异直接影响了微生物残体碳的形成。通常微生物生物量越大,微生物残体碳积累越多[27],因此相同条件下真菌会生成更多的残体。此外,相较于细菌,真菌具有更高的生物量碳氮比和碳利用效率[28],意味着在相同的时间内新生成的真菌残体中碳含量高于细菌残体。最后,真菌在土壤中形成的GluN稳定性高于细菌形成的MurA[14],并且真菌可以利用菌丝将土壤颗粒缠结成团聚体,从而使真菌残体碳获得物理保护[26],进一步增强了真菌残体碳在土壤中的稳定性及其对SOC的贡献。
本研究发现,苔藓结皮覆盖土壤中MNC对SOC的贡献显著低于其他两类结皮,这主要是苔藓结皮广泛的SOC来源和MNC含量的降低共同导致的。与其他两类结皮相比,苔藓结皮增加了地表粗糙度,可以捕获更多富营养颗粒和拦截更多凋落物和水分,有效增加了苔藓结皮中有机质含量[29]。此外,苔藓结皮的叶绿素含量大于其他两类结皮[8],具备更强的光合固碳能力,相同时间下可以形成更多的SOC。同时,苔藓植物残体对SOC的贡献也更显著[30],进一步促进了苔藓结皮中SOC的富集。然而,尽管苔藓结皮层微环境得到了显著改善,促进了土壤中微生物丰度和多样性增加[31],但MNC含量却显著低于藻、地衣结皮(图 4)。在黄土高原类似的研究中,随着藻、地衣与苔藓结皮的发展,微生物生物量逐渐增加,其MNC含量保持稳定[22]。这主要是因为黄土高原结皮层黏粉粒含量低,对微生物残体的保护作用有限,使得微生物残体更多地转化为POC。在养分贫瘠的环境中,微生物可以高效利用POC以满足微生物的养分需求[32],促进了POC的快速循环,从而限制了MNC的积累。因此,生物结皮层土壤中的MNC含量并未随微生物生物量的增加而增加。在本研究中,生物结皮覆盖土壤中的MNC同样主要贡献于POC(图 6)。与黄土高原相比,本研究区不同类型生物结皮覆盖土壤中黏粉粒含量均显著低于黄土高原地区(差异达3倍及以上),黏土矿物对微生物残体碳的保护作用更加有限,进一步促进了微生物残体的分解。同时,与藻、地衣结皮相比,苔藓结皮层土壤微环境的改善使得微生物活动更为活跃。微生物数量的显著增加增强了生物间对资源的竞争,造成相对碳限制的加剧[33]。在底物可利用性较低的环境中,缺乏矿物保护的微生物残体成为重要的养分来源[13],导致MNC的分解,使得苔藓结皮层中MNC含量显著低于藻结皮与地衣结皮。
BSCs能够显著增加土壤表层的养分含量,并对养分具有较强的吸附和固持能力,从而在表层形成“肥岛效应”[34]。随着土壤深度的增加,养分含量逐渐下降,限制了微生物的生长和繁殖,导致生物结皮层下土壤中的MNC含量及贡献度降低(图 3、图 4)。此外,在结皮层下土壤中,三类生物结皮之间的MNC含量和贡献度均未显示显著差异(图 3、图 4)。这是因为随着土壤深度的增加,BSCs对土壤的影响逐渐减弱,微生物群落结构趋于相似[25],导致结皮层下MNC含量在不同结皮之间无显著差异。
3.2 生物结皮覆盖土壤中微生物残体碳影响因素在生物结皮覆盖土壤中,微生物残体可通过形成POC和MAOC促进SOC的积累[22]。已有研究表明,微生物残体的长期保存与土壤矿物粒级的组成和含量密切相关,其中黏粉粒能够与MNC结合,形成稳定的MAOC,是微生物残体积累的主要贮存库[35]。然而,在本研究中,黏粉粒含量与SOC、MAOC及MNC均无显著相关性(图 5)。如前所述,本研究区BSCs覆盖土壤中黏粉粒含量极低,微生物残体在养分贫瘠的环境中不断的再循环,使得MNC与黏土矿物难以结合,导致黏粉粒含量与SOC、MAOC及MNC无显著相关性。
土壤pH与MNC存在显著的负相关关系。这是由于土壤pH升高会在一定程度上减缓土壤中的酸限制,碱性条件有利于微生物活性的提升,促进残体碳的分解[21]。Ex-Ca作为一种碱性阳离子,能够中和土壤中的酸性物质,使得土壤pH升高,间接促进了MNC的分解。此外,土壤水分在调节微生物群的活性和多样性方面起着至关重要的作用[8]。在本研究中,SMC与MNC存在显著的负相关关系(图 6)。当土壤中水分含量极低时,微生物的代谢活动几乎完全停止,此时极少的降水或露水可使微生物迅速恢复生理活性,产生的激发效应会加速原有SOC的分解[36],MNC作为SOC的重要组成部分,进而导致MNC的降低。当SMC适当上升时,微生物的活性与胞外酶的分泌加强,促进了微生物的矿化作用[37],加速了MNC的分解。当SMC过高时会引发土壤中含氧量的下降,微生物的生长和活性受到限制,影响了微生物的合成代谢,造成MNC的减少。
土壤碳和氮是微生物的养分来源,对微生物群落的发展至关重要[10,21-22]。在BSCs发展过程中,细菌和真菌群落对碳循环发挥了不可或缺的作用。在本研究中,BNC、FNC与氮组分、碳组分均呈显著的正相关关系(图 6),这与以往的研究相似[21]。原因在于土壤中充足的养分含量会促进微生物生长代谢过程,进而促进MNC的积累。当土壤中可利用碳足够时,适当范围内氮含量的增加会刺激微生物生长,从而促进微生物生物量的生成,加速微生物残体积累。此外,FNC与土壤中氮含量的相关性相较于BNC更为显著(图 5),这可能与微生物分解特性和对资源的竞争力有关。细菌主要分解土壤中的小分子有机物,而真菌则负责分解难以降解的大分子有机物,在分解复杂大分子有机物时,需要合成关键酶,该过程需要大量的氮元素。同时,在荒漠区,地带性土壤一般为碱性,自养硝化速率高,土壤无机氮以NO-3-N为主,有利于土壤氮保持[38]。与NO-3-N相比,NH+ 4-N向氨基糖的转化效率更高,土壤中的细菌和真菌会强烈竞争易获得的养分。真菌可通过形成菌丝和菌丝体来扩大其空间生态位,桥接空间上离散的资源,使得真菌在竞争养分资源上占据优势[39]。因此,FNC与土壤氮含量相关性更显著。
4 结论在毛乌素沙地生物结皮覆盖土壤中,MNC是SOC的重要来源且主要贡献于POC。随着藻、地衣与苔藓结皮的发展,MNC含量及其对SOC的贡献率逐渐降低,其中FNC对SOC的贡献占据主导地位。在藻、地衣结皮覆盖土壤中,MNC对SOC的平均贡献度约为40%,在苔藓结皮中则相对较低(28.5%)。此外,生物结皮覆盖土壤中微生物残体碳的积累与分解过程受到土壤pH、Ex-Ca、SMC以及氮含量(NH+ 4-N、NO-3-N与TN)的影响。具体而言,pH、Ex-Ca和SMC是促进微生物残体碳分解的重要因素,而氮含量的增加有利于微生物残体碳的积累。
| [1] |
Houghton R A, Skole D L, Nobre C A, et al. Annual fluxes of carbon from deforestation and regrowth in the Brazilian Amazon[J]. Nature, 2000, 403(6767): 301-304.
(  0) 0) |
| [2] |
Yang Y H, Shi Y, Sun W J, et al. Terrestrial carbon sinks in China and around the world and their contribution to carbon neutrality (In Chinese)[J]. Scientia Sinica: Vitae, 2022, 52(4): 534-574. [杨元合, 石岳, 孙文娟, 等. 中国及全球陆地生态系统碳源汇特征及其对碳中和的贡献[J]. 中国科学: 生命科学, 2022, 52(4): 534-574.]
(  0) 0) |
| [3] |
Beer C, Reichstein M, Tomelleri E, et al. Terrestrial gross carbon dioxide uptake: Global distribution and covariation with climate[J]. Science, 2010, 329(5993): 834-838.
(  0) 0) |
| [4] |
Li X R, Tan H J, Hui R, et al. Researches in biological soil crust of China: A review (In Chinese)[J]. Chinese Science Bulletin, 2018, 63(23): 2320-2334. [李新荣, 谭会娟, 回嵘, 等. 中国荒漠与沙地生物土壤结皮研究[J]. 科学通报, 2018, 63(23): 2320-2334.]
(  0) 0) |
| [5] |
Zhang B C, Wu Z F, Li B. Progress and prospect of biological soil crusts in Loess Plateau (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(5): 1123-1131. [张丙昌, 武志芳, 李彬. 黄土高原生物土壤结皮研究进展与展望[J]. 土壤学报, 2021, 58(5): 1123-1131.]
(  0) 0) |
| [6] |
Elbert W, Weber B, Burrows S, et al. Contribution of cryptogamic covers to the global cycles of carbon and nitrogen[J]. Nature Geoscience, 2012, 5: 459-462.
(  0) 0) |
| [7] |
Xu H K, Zhang Y J, Shao X Q, et al. Soil nitrogen and climate drive the positive effect of biological soil crusts on soil organic carbon sequestration in drylands: A Meta-analysis[J]. Science of the Total Environment, 2022, 803: 150030.
(  0) 0) |
| [8] |
Tian C, Bu C F, Wu S F, et al. Lichen biocrusts contribute to soil microbial biomass carbon in the northern temperate zone: A meta-analysis[J]. European Journal of Soil Science, 2024, 75(3): e13517.
(  0) 0) |
| [9] |
Pang J W, Bu C F, Guo Q, et al. Spatial distribution and the influencing factors of organic carbon of biological crusts on regional scale in Mu Us sandy land, China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2022, 33(7): 1755-1763. [庞景文, 卜崇峰, 郭琦, 等. 毛乌素沙地区域尺度生物结皮有机碳空间分布特征及其影响因素[J]. 应用生态学报, 2022, 33(7): 1755-1763.]
(  0) 0) |
| [10] |
Wang Q, Zhang Q Y, Han Y C, et al. Carbon cycle in the microbial ecosystems of biological soil crusts[J]. Soil Biology & Biochemistry, 2022, 171: 108729.
(  0) 0) |
| [11] |
Wang B R, An S S, Liang C, et al. Microbial necromass as the source of soil organic carbon in global ecosystems[J]. Soil Biology & Biochemistry, 2021, 162: 108422.
(  0) 0) |
| [12] |
Feng X J, Dai G H, Liu T, et al. Understanding the mechanisms and potential pathways of soil carbon sequestration from the biogeochemistry perspective (In Chinese)[J]. Scientia Sinica: Terrae, 2024, 54(11): 3421-3432. [冯晓娟, 戴国华, 刘婷, 等. 从生物地球化学视角理解土壤碳封存的机制和潜在途径[J]. 中国科学: 地球科学, 2024, 54(11): 3421-3432.]
(  0) 0) |
| [13] |
Buckeridge K M, La Rosa A F, Mason K E, et al. Sticky dead microbes: Rapid abiotic retention of microbial necromass in soil[J]. Soil Biology & Biochemistry, 2020, 149: 107929.
(  0) 0) |
| [14] |
He M, Qin S Q, Feng X H, et al. Spatial distributions and key drivers of microbial necromass carbon in permafrost deposits across the Tibetan Plateau (In Chinese)[J]. Chinese Science Bulletin, 2024, 69(7): 925-938. [贺美, 秦书琪, 冯雪徽, 等. 青藏高原多年冻土微生物残体碳的分布特征及其驱动因素[J]. 科学通报, 2024, 69(7): 925-938.]
(  0) 0) |
| [15] |
Bowker M A, Reed S C, Maestre F T, et al. Biocrusts: The living skin of the earth[J]. Plant and Soil, 2018, 429(1): 1-7.
(  0) 0) |
| [16] |
Dou Y X, Wang B R, Liao J J, et al. Contributions of microbial necromass carbon to soil organic carbon fractions accumulation and influencing factors under different artificial forest types on the Loess Plateau (In Chinese)[J]. Acta Ecologica Sinica, 2024, 44(13): 5494-5507. [窦艳星, 王宝荣, 廖娇娇, 等. 黄土高原不同人工林型微生物残体碳对土壤有机碳组分的积累贡献及影响因素[J]. 生态学报, 2024, 44(13): 5494-5507.]
(  0) 0) |
| [17] |
Li Y P. Study on characteristics of soil nutrients and carbon storage in biocrusts and underlying soil of Mu Us sandland[D]. Yangling, Shaanxi: Northwest A & F University, 2018.[李宜坪. 毛乌素沙地生物结皮及其下伏土壤的养分特征与碳储量研究[D]. 陕西杨凌: 西北农林科技大学, 2018.]
(  0) 0) |
| [18] |
Jiang X Y, Gao S J, Jiang Y, et al. Species diversity, functional diversity, and phylogenetic diversity in plant communities at different phases of vegetation restoration in the Mu Us sandy grassland (In Chinese)[J]. Biodiversity Science, 2022, 30(5): 18-28. [姜晓燕, 高圣杰, 蒋燕, 等. 毛乌素沙地植被不同恢复阶段植物群落物种多样性、功能多样性和系统发育多样性[J]. 生物多样性, 2022, 30(5): 18-28.]
(  0) 0) |
| [19] |
Wang L. Influence of biological soil crusts on soil moisture in Artemisia ordosica community in the Mu Us Desert[D]. Beijing: Beijing Forestry University, 2017.[王莉. 毛乌素沙地生物土壤结皮对油蒿群落土壤水分的影响[D]. 北京: 北京林业大学, 2017.]
(  0) 0) |
| [20] |
Weber B, Belnap J, Büdel B, et al. What is a biocrust? A refined, contemporary definition for a broadening research community[J]. Biological Reviews of the Cambridge Philosophical Society, 2022, 97(5): 1768-1785.
(  0) 0) |
| [21] |
Ma J P, Wu M Y, Zhang Y Q, et al. Accumulation and influencing factors of soil microbial necromass carbon in different grassland types of Ningxia, China (In Chinese)[J]. Acta Ecologica Sinica, 2024, 44(20): 9300-9313. [马进鹏, 吴梦瑶, 张雅琪, 等. 宁夏不同草地类型土壤微生物残体碳积累特征及其影响因素[J]. 生态学报, 2024, 44(20): 9300-9313.]
(  0) 0) |
| [22] |
Wang B R, Huang Y M, Li N, et al. Initial soil formation by biocrusts: Nitrogen demand and clay protection control microbial necromass accrual and recycling[J]. Soil Biology & Biochemistry, 2022, 167: 108607.
(  0) 0) |
| [23] |
Zhang X D, Amelung W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils[J]. Soil Biology & Biochemistry, 1996, 28(9): 1201-1206.
(  0) 0) |
| [24] |
Liang C, Amelung W, Lehmann J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology, 2019, 25(11): 3578-3590.
(  0) 0) |
| [25] |
Garcia-Pichel F. The microbiology of biological soil crusts[J]. Annual Review of Microbiology, 2023, 77: 149-171.
(  0) 0) |
| [26] |
Cao Y F, Ding J Z, Li J, et al. Necromass-derived soil organic carbon and its drivers at the global scale[J]. Soil Biology & Biochemistry, 2023, 181: 109025.
(  0) 0) |
| [27] |
Liang C, Zhu X F. The soil microbial carbon pump as a new concept for terrestrial carbon sequestration (In Chinese)[J]. Scientia Sinica: Terrae, 2021, 51(5): 680-695. [梁超, 朱雪峰. 土壤微生物碳泵储碳机制概论[J]. 中国科学: 地球科学, 2021, 51(5): 680-695.]
(  0) 0) |
| [28] |
Griepentrog M, Bodé S, Boeckx P, et al. Nitrogen deposition promotes the production of new fungal residues but retards the decomposition of old residues in forest soil fractions[J]. Global Change Biology, 2014, 20(1): 327-340.
(  0) 0) |
| [29] |
Yang Q Y, Zhao Y G, Bao T L, et al. Soil ecological stoichiometry characteristics under different types of biological soil crusts in the hilly Loess Plateau region, China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2019, 30(8): 2699-2706. [杨巧云, 赵允格, 包天莉, 等. 黄土丘陵区不同类型生物结皮下的土壤生态化学计量特征[J]. 应用生态学报, 2019, 30(8): 2699-2706.]
(  0) 0) |
| [30] |
Yang Y, Wang B R, Dou Y X, et al. Advances in the research of transformation and stabilization of soil organic carbon from plant and microbe (In Chinese)[J]. Chinese Journal of Applied Ecology, 2024, 35(1): 111-123. [杨阳, 王宝荣, 窦艳星, 等. 植物源和微生物源土壤有机碳转化与稳定研究进展[J]. 应用生态学报, 2024, 35(1): 111-123.]
(  0) 0) |
| [31] |
He H Y, Liu W, Chang Z Q, et al. Effects of biological soil crust succession on soil nutrients, microbial community composition in desert regions (In Chinese)[J]. Arid Land Geography, 2024, 47(10): 1724-1734. [贺郝钰, 刘蔚, 常宗强, 等. 沙区生物土壤结皮演替对表层土壤养分和微生物群落组成的影响[J]. 干旱区地理, 2024, 47(10): 1724-1734.]
(  0) 0) |
| [32] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2: 17105.
(  0) 0) |
| [33] |
Zhang S P, Wang B Q, Wang X X, et al. Characteristics of nutrient and microbial nutrient limitation of different types of biological soil crusts on the vertical steep slopes of hilly region in the Loess Plateau (In Chinese)[J]. Research of Soil and Water Conservation, 2022, 29(1): 51-57. [张尚鹏, 王百群, 王香香, 等. 黄土丘陵区垂直陡壁表面不同类型生物土壤结皮养分与微生物养分限制特征[J]. 水土保持研究, 2022, 29(1): 51-57.]
(  0) 0) |
| [34] |
Han M M, Luo X W, Su C Q, et al. Research progress on the effect of biological crust on soil nutrients and carbon cycling (In Chinese)[J]. Northern Horticulture, 2023(24): 132-137. [韩梦梦, 罗炘武, 粟春青, 等. 生物结皮对土壤养分及碳循环影响的研究进展[J]. 北方园艺, 2023(24): 132-137.]
(  0) 0) |
| [35] |
Zhang B, Chen Q, Ding X L, et al. Research progress on accumulation, turnover and stabilization of microbial residues in soil (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(6): 1479-1491. DOI:10.11766/trxb202012270705 [张彬, 陈奇, 丁雪丽, 等. 微生物残体在土壤中的积累转化过程与稳定机理研究进展[J]. 土壤学报, 2022, 59(6): 1479-1491.]
(  0) 0) |
| [36] |
Fontaine S, Barot S, Barré P, et al. Stability of organic carbon in deep soil layers controlled by fresh carbon supply[J]. Nature, 2007, 450(7167): 277-280.
(  0) 0) |
| [37] |
Zeng J, Shen J P, Wang J T, et al. Impacts of projected climate warming and wetting on soil microbial communities in alpine grassland ecosystems of the Tibetan Plateau[J]. Microbial Ecology, 2018, 75(4): 1009-1023.
(  0) 0) |
| [38] |
Zhang J B, Zhu T B, Cai Z C, et al. Nitrogen cycling in forest soils across climate gradients in Eastern China[J]. Plant and Soil, 2011, 342(1): 419-432.
(  0) 0) |
| [39] |
Wang C Q, Kuzyakov Y. Mechanisms and implications of bacterial-fungal competition for soil resources[J]. The ISME Journal, 2024, 18(1): wrae073.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


