2. 三峡库区农业面源污染控制工程技术研究中心, 重庆 400715
2. Engineering Research Center of Agricultural Non-point Source Pollution Control in Three Gorges Reservoir Region, Chongqing 400715, China
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一类广泛存在于环境中的持久性有机污染物,主要来源于污水污泥沉积、化石燃料的不完全燃烧以及其他高温工业过程[1]。由于PAHs具有致癌、致畸和致突变的特性,对生态环境和人体健康构成了潜在威胁,已成为环境污染领域的重要研究热点[2-4]。PAHs的化学性质稳定,在自然环境中降解速度缓慢,常通过雨水、大气沉降等途径进入土壤,并由于其对有机质的强吸附性而在土壤中长期积累。这种吸附作用会导致PAHs在土壤中形成持久性的污染,对土壤生态系统构成严重危害[1,5]。研究表明,工业地区土壤中16种PAHs总浓度可超过100 mg·kg–1[6]。PAHs可通过皮肤接触、呼吸等途径被土壤动物吸收,并因其亲脂性在这些动物的脂质组织中积累,造成组织损伤,进而产生毒害效应(也被称作“麻醉”),削弱土壤动物的生态功能[7]。此外,PAHs在食物链中逐级积累与放大,最终可能威胁整个区域的土壤生态系统稳定性,并对周边人类健康构成潜在风险[8-10]。
现有的毒理学研究通常侧重于评估土壤中某一固定时间点下PAHs的生物积累量以及对土壤动物的毒性效应,并以此来评估其对土壤生态系统的环境风险[11-12]。然而,PAHs在土壤动物体内的积累具有时间依赖性,这可能导致不同时间点下毒性效应不同。例如,Jager等[13]发现,PAHs在蚯蚓(Eisenia andrei)体内的积累量在第7天时达到峰值,然后逐渐下降,并认为这种变化可能与土壤孔隙水中PAHs浓度减少有关;类似的,Johnson等[14]的研究表明,PAHs在蚯蚓(Eisenia fetida)体内的积累也具有明显的时间依赖性,PAHs在早期快速积累,随着时间推移,PAHs会与土壤颗粒结合更加紧密,导致其生物可利用性降低,蚯蚓体内积累量逐渐减少。上述研究表明,仅依赖固定暴露时间的数据无法准确反映PAHs对土壤生态系统的长期影响,因此,有必要深入研究PAHs在土壤动物体内的动态积累过程,以更好地评估其生态风险。
毒代动力学模型为毒理学研究提供了一种定量工具,用于描述化学物质在生物体内的动态行为,通过整合化学物质在生物体内的吸收、积累和消除过程,该模型能够将外部暴露与内部浓度联系起来[15]。生物积累(Bioaccumulation)指化学物质通过各种途径进入生物体内并逐渐积聚的过程,该过程可能受到暴露浓度和生物体排出化学物质能力等多种因素影响[16]。毒代动力学模型能够模拟这些因素随时间的变化,从而了解各因素如何影响化学物质在生物体内的积累水平,其优势在于,无论暴露条件或其他环境因素如何,均能够在不同的时间点上量化生物体内的化学物质浓度,从而揭示生物积累的动态模式[17]。目前关于PAHs在土壤无脊椎动物中毒代动力学的研究仍较为有限,例如,Šmídová和Hofman[18]利用毒代动力学模型研究了5种疏水性有机污染物(包括PAHs)在蚯蚓(Eisenia fetida)体内的生物积累过程,结果发现,不同土壤有机质含量下,蚯蚓对PAHs吸收和消除速率存在显著差异,且积累过程具有显著的时间依赖性,模型有效地揭示了这些差异的动态变化,并有助于准确预测不同环境条件下PAHs的生物积累情况,为评估PAHs生态风险提供了重要依据。
线蚓科(Enchytraeids)属于环节动物门寡毛纲,是土壤动物群落的重要组成部分[19]。它们在土壤中数量庞大,在陆地生态系统中具有重要的生态功能,如维持土壤结构,参与有机质的分解、养分循环等[20]。同时,线蚓还是陆地食物网中重要的食物资源,被各种捕食者捕食,因此,PAHs在线蚓体内积累不但会对其本身造成伤害进而影响其生态功能,还会通过食物链对更高级的捕食者构成潜在风险[8,10,21]。由于线蚓生命周期较短、繁殖率高、易于培养、对化学污染物较为敏感的特性,已有多个物种被推荐作为模式物种用于陆地生态毒理学研究和化学污染物环境风险评估(如Enchytraeus crypticus)[20,22]。相关研究显示,相比节肢动物,环节动物对PAHs的解毒代谢能力较低,其中E. crypticus对PAHs的敏感度低于其他土壤无脊椎动物,长期暴露下PAHs在E. crypticus体内可能会积累至相当高的浓度,并通过食物链向更高级捕食者传递,进而对土壤生态系统构成更大威胁[23-26]。而目前尚无PAHs在E. crypticus体内的毒代动力学研究。
基于以上背景,本研究以土壤生态毒理学模式物种线蚓E. crypticus为受试生物,系统探讨一种常见PAHs污染物(菲,多环芳烃研究中常用的模式污染物)在其体内的毒代动力学特征。考虑到不同暴露浓度下,线蚓对菲的吸收、积累和消除过程可能存在差异[13,27],而菲的毒害机制(即“麻醉”效应)在多种PAHs污染物中普遍存在,设计了20、40和80 mg·kg–1三个浓度梯度,以模拟现实土壤环境中多种PAHs叠加的浓度范围[6,28]。本研究旨在了解在不同暴露浓度下线蚓对PAHs吸收和消除的动态变化过程,为PAHs污染物在陆地生态系统中的环境风险评估提供科学依据。
1 材料与方法 1.1 受试生物本试验采用线蚓(Enchytraeus crypticus,属环节动物门寡毛纲线蚓科)作为受试生物。E. crypticus在置于20 ℃黑暗培养箱中的琼脂培养基上进行培养和繁殖。培养基由琼脂和4种不同浓度盐溶液(分别为:1 mmol·L–1 NaHCO3,0.1 mmol·L–1 KCl,2 mmol·L–1 CaCl2,1 mmol·L–1 MgSO4)混合物组成。每周以燕麦为食喂食两次。挑选同一时期繁殖的大小相对一致且头部具有白色生殖环的成虫用于试验。
1.2 供试土壤供试土壤采集自西南大学桑园基地,采集0~20 cm土层的土壤,置于阴凉处自然风干后去除砾石和植物根系等杂质,过2 mm筛后在80 ℃下烘干48 h备用。供试土壤基本理化性质为:pH 6.1,有机碳含量16.5 g·kg–1,阳离子交换量(CEC)25.7 cmol·kg–1,容重1.24 g·cm–3,田间持水量36%。使用激光粒度仪测定粒径分布,砂粒(2 000~50 μm)50.3%,粉粒(50~2 μm)24.4%,黏粒(< 2 μm)25.3%,土壤质地为砂质黏壤土。
以丙酮作为载体溶剂将菲(Sigma Aldrich,CAS#85-01-8,纯度98%)加入供试土壤以得到试验所需浓度的菲污染土壤,将加入菲溶液的土壤多次混合搅拌均匀,放置在通风橱过夜,使丙酮蒸发。随后,使用纯水将土壤含水量调至田间持水量的50%(180 mL·kg–1土壤),并充分混合湿土,保存备用。
1.3 试验设计试验在3个暴露浓度(20、40、80 mg·kg–1)下进行,为期28 d,包括14 d的吸收阶段和14 d的消除阶段。试验开始时,准备了240个100 mL的玻璃瓶,每个瓶中加入10条随机选取的成年线蚓和25 g污染土壤。瓶口用打孔塑料盖密封,以保证气体交换,并将其置于温度设定为20 ℃的黑暗培养箱中。每周通过称重确定水分损失并加入去离子水补充水分。在不同时间点对线蚓进行破坏性取样:在吸收阶段,于第0天(CK)、6小时、12小时、1天、2天、4天、7天、10天和14天进行取样。在第14天的吸收阶段结束后,收集剩余瓶中的线蚓并转移至含有未污染土壤的另一个玻璃瓶中进行消除阶段试验。在消除阶段,于第12小时、1天、2天、4天、7天、10天和14天进行取样。每个浓度和取样时间点均设置5个重复。每次取样时,用轻型镊子从土壤中取出线蚓,用去离子水冲洗三遍。在显微镜下观察确认其存活情况并统计存活率,收集存活的线蚓并将其放置在滤纸上干燥。随后,将线蚓放入冻存管中,立即在液氮中冷冻,并储存在–80 ℃冰箱以供后续分析。同时收集吸收阶段的土壤样品,储存在–20 ℃冰箱用于土壤菲含量分析测定。
1.4 样品前处理与仪器测定利用乙腈超声提取线蚓体内的菲[29]。首先将线蚓组织转移至万分之一天平(LC-FA2004,力辰科技,上海)称重,之后转移至2 mL棕色进样瓶,加入500 µL乙腈。将样品放置在冰上超声处理90 min,室温下放置24 h,之后在–20 ℃下冷冻24 h,再在室温下放置24 h,最后再次将样品超声处理90 min,上清液在–80 ℃下保存待测。利用乙腈振荡提取土壤中的菲[30]。在1 g潮湿土壤中加入4 mL乙腈,室温下以200 r·min–1振荡24 h,之后以3 000 r·min–1离心5 min,收集上清液,保存待测。
线蚓及土壤样品中的菲含量均使用气相色谱质谱联用仪(GCMS-QP2010,Shimadzu岛津,日本)进行分析测定。色谱和质谱条件参考前人[29]研究。使用Supelco Omegawax 320毛细管色谱柱进行分离,进样量为1.0 µL,分流比为10,载气为氦气,总流量22.7 mL·min–1,柱流量1.79 mL·min–1,进样口温度为220 ℃,升温程序设置为初始温度50 ℃下保持2 min,之后以20.0 ℃·min–1的速率上升至240 ℃,保持3.5 min,质谱仪在70 eV的电子电离模式下工作,离子源温度为250 ℃,接口温度为240℃,在单离子监测(SIM)模式下工作。线蚓样品中菲的检出限为0.86~2.17 mg·kg–1,定量限为2.85~7.04 mg·kg–1;土壤样品中菲的检出限为0.09~0.41 mg·kg–1,定量限为0.37~1.47 mg·kg–1。通过向未受污染的土壤和线蚓样品中加入已知浓度的菲,测定回收率进行过程质量控制,线蚓样品中菲的回收率为92.5%~114.5%,土壤样品中菲的回收率为94.3%~115.4%。
1.5 数据分析使用一阶动力学模型计算吸收阶段土壤中菲的降解速率
| $ C\left( t \right) = {C_0}{e^{ - {k_0}t}} $ | (1) |
式中,t为暴露时间,d;
采用一阶单室模型描述菲在线蚓体内的动态积累过程
| $ \frac{{dQ}}{{dt}} = {k_{\text{u}}}C\left( t \right) - {k_{\text{e}}}Q\left( t \right) $ | (2) |
式(2)与式(1)积分,得到
| $ Q\left( t \right) = \frac{{{k_{\text{u}}}}}{{{k_{\text{e}}} - {k_0}}} \times {C_{\exp }} \times \left( {{e^{ - {k_0}{t_{\text{c}}}}} - {e^{ - {k_{\text{e}}}{t_{\text{c}}}}}} \right) $ | (3) |
在消除阶段
| $ Q\left( t \right) = \frac{{{k_{\text{u}}}}}{{{k_{\text{e}}} - {k_0}}} \times {C_{\exp }} \times \left( {{e^{ - {k_0}t}} - {e^{ - {k_{\text{c}}}{t_{\text{c}}}}}} \right) \times {e^{ - {k_{\text{c}}}\left( {t - {t_{\text{c}}}} \right)}} $ | (4) |
式中,
生物富集系数(BAF,bioaccumulation factor)定义为在稳态下线蚓体内的浓度与土壤中浓度的比值,也可表示为吸收速率常数
| $ \text{BAF}=\frac{{C}_{线蚓}}{{C}_{土壤}}\text{=}\frac{{k}_{\text{u}}}{{k}_{\text{e}}} $ | (5) |
使用R 4.1.3拟合毒代动力学模型,使用广义似然比检验(Generalized likelihood ratio test,GLRT)比较各拟合模型参数之间的显著性差异,使用Office 2021和SPSS 23.0软件进行数据统计分析并作图,所有数据结果均以均值±标准差形式表示。
2 结果 2.1 土壤中菲的浓度变化在吸收阶段开始时,20、40和80 mg·kg–1暴露浓度下土壤中菲的浓度为20.27±1.10、41.42±2.33和82.63±3.22 mg·kg–1,均接近标称浓度。在14 d的吸收阶段,土壤中的菲浓度缓慢下降(图 1),不同暴露浓度土壤中菲的平均降解率为17%~25%,一阶动力学模型拟合得到各暴露浓度下土壤中菲的降解速率常数(k0)及半衰期见表 1。
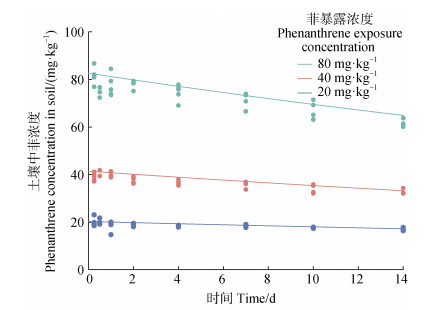
|
注:圆点代表实测浓度,实线代表一阶动力学模型拟合结果。下同。 Note: The dots represent the measured concentrations and the solid lines represent the results of fitting the first-order kinetic model. The same below. 图 1 不同暴露浓度下吸收阶段菲在土壤中的降解 Fig. 1 Decrease of phenanthrene in the soil during the uptake phase at different exposure concentrations |
|
|
表 1 不同暴露浓度下土壤中菲的降解系数(k0)和半衰期 Table 1 Degradation rate (k0) and half-life of phenanthrene in soil at different exposure concentrations |
所有暴露浓度下,在14 d的吸收和14 d的消除阶段,线蚓健康状况良好,均未观察到死亡,在所有采样点,线蚓表现活跃,显微镜观察下无明显的损伤,符合经济合作与发展组织(OECD)质量控制标准[22]。菲在线蚓体内的积累取决于暴露浓度和暴露时间。各时间点线蚓体内菲浓度随暴露浓度的增加而增加(图 2)。各处理下,菲在线蚓体内的积累呈现出先快后慢的趋势,在吸收阶段初期,菲在线蚓体内迅速吸收并积累,随后吸收速率逐渐减缓,体内菲浓度在第4天左右达到稳态平衡(图 2);在吸收阶段结束时,20、40和80 mg·kg–1暴露浓度下线蚓体内菲浓度分别为47.83±11.69、106.8±15.52和364.1±51.11 mg·kg–1。在消除阶段,菲在线蚓体内的消除也呈现出先快后慢的趋势,线蚓体内菲含量在消除阶段初期迅速下降,随后消除速率逐渐减缓,直至消除阶段结束时,各暴露浓度下线蚓体内的菲均已接近完全消除,20、40和80 mg·kg–1暴露浓度下线蚓体内菲含量分别为0.54±0.32、0.32±0.05和1.82±1.65 mg·kg–1(图 2)。
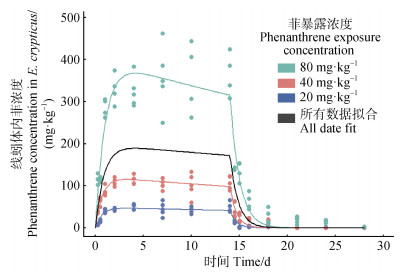
|
注:圆点代表实测浓度,实线代表毒代动力学模型拟合结果。 Note: The dots represent the measured concentrations and the solid lines represent the results of fitting the toxicokinetics model. 图 2 吸收阶段和消除阶段线蚓体内菲浓度 Fig. 2 The concentration of phenanthrene in Enchytraeus crypticus in the uptake and elimination phase |
使用一阶单室模型拟合不同暴露浓度下线蚓体内菲含量随时间的变化,并对所有数据进行综合拟合,拟合结果如图 2所示,毒代动力学参数如表 2所示,各暴露浓度以及综合拟合曲线的决定系数(R2)分别为0.884、0.914、0.905和0.889,表明一阶动力学模型能够准确描述线蚓体内菲含量随时间的变化趋势。吸收速率常数ku随暴露浓度的增加显著上升(GLRT,20 mg·kg–1 vs 40 mg·kg–1,P < 0.05;20 mg·kg–1 vs 80 mg·kg–1,P < 0.05;40 mg·kg–1 vs 80 mg·kg–1,P < 0.05),暴露于20、40和80 mg·kg–1时ku分别为3.63±0.35、4.16±0.28和4.78±0.36 kg·kg–1·d–1,综合拟合的ku值为4.72± 0.28 kg·kg–1·d–1。消除速率常数ke则随着暴露浓度的增加呈现下降趋势(GLRT,20 mg·kg–1 vs 40 mg·kg–1,P > 0.05;20 mg·kg–1 vs 80 mg·kg–1,P < 0.05;40 mg·kg–1 vs 80 mg·kg–1,P < 0.05),暴露于20、40和80 mg·kg–1时ke分别为1.52±0.15、1.43±0.10和1.00±0.07 d–1,综合拟合的ke值为1.15±0.07 d–1。ku和ke随着暴露浓度增加呈现出相反的变化趋势,进而导致BAF值随着暴露浓度增大而增大,BAF值分别为2.39±0.29、2.92±0.29和4.78±0.54,综合拟合的BAF值为4.10±0.41。
|
|
表 2 不同暴露浓度下菲在线蚓体内的毒代动力学参数 Table 2 Toxicokinetic indices of phenanthrene in Enchytraeus crypticus at different exposure concentrations |
本研究探讨了不同暴露浓度下E. crypticus对菲的吸收、积累和消除的动态特征,结果显示,随着暴露浓度升高,菲的吸收速率增加,消除速率下降,导致菲积累量显著增加(图 2)。各浓度下,E. crypticus对菲的积累和消除均呈现出先快后慢的动态变化(图 2)。此外,本研究还对所有数据进行了综合拟合,以期得到一个在现实浓度相关的范围内适用的全局性模型。接下来,本文将讨论上述结果在环境风险评估中的意义。
E. crypticus相较于其他土壤无脊椎动物,对PAHs表现出显著更高的耐受性和生物积累潜力[25-26]。本研究中,暴露于最高浓度80 mg·kg–1下时,E. crypticus在各取样时间点状态良好,整个试验周期均未观察到个体死亡或异常。相比之下,其他物种如线蚓Enchytraeus albidus和蚯蚓Eisenia fetida对菲的耐受性明显较低。已有研究表明,在为期14 d的毒性测试中,E. albidus和E. fetida的半数致死浓度(LC50)分别为135和40.64 mg·kg–1[23,31]。而在两项为期28 d和21 d的测试中,E. crypticus的LC50高达1 708和2 000 mg·kg–1,进一步证明了该物种在长期暴露下表现出显著更高的耐受性[28,32]。目前,关于E. crypticus对PAHs生物积累潜力的相关报道较为有限。Arp等[33]将E. crypticus暴露于PAHs严重污染土壤(16种PAHs含量最高达2 651 mg·kg–1)以测试其生物积累潜力,结果显示,在经历了14 d的吸收阶段和14 d的消除阶段后,超过80%的个体仍保持存活,体内16种PAHs的总含量达到了95.70 mg·kg–1。本研究中,E. crypticus体内菲的积累量同样随着暴露浓度的增加而显著增加,在80 mg·kg–1暴露条件下,吸收阶段结束时E. crypticus体内菲浓度高达364.1±51.11 mg·kg–1(图 2)。这表明,在高污染环境下,E. crypticus可能表现出更显著的生物富集能力。与其他物种相比,E. crypticus在高PAHs暴露条件下的积累效应可能更为突出。上述结果表明,在环境风险评估中,如果仅基于其他物种的数据进行外推,可能会低估E. crypticus在生物放大过程中对生态系统构成的潜在威胁,未来的研究应进一步关注不同物种在毒性耐受性和生物积累能力上的差异,以提高PAHs环境风险评估的准确性。
E. crypticus对菲的吸收和消除表现出典型的先快后慢的动态特征(图 2),这与前人的研究结果[23,34]相似。随着暴露浓度的增加,E. crypticus体内菲清除至较低浓度所需的时间延长。本研究中,20 mg·kg–1暴露水平下,在消除阶段第1天结束时,E. crypticus体内菲已被排出了95%以上,此时体内浓度为1.72±1.11 mg·kg–1;而在40 mg·kg–1暴露水平下,E. crypticus需要更长的时间来排出体内残留的菲,直至消除阶段第7天结束时,体内菲浓度为1.05±0.79 mg·kg–1;暴露于80 mg·kg–1时,E. crypticus体内的菲则需要在消除阶段第14天才能降至一个较低的水平,此时体内菲平均浓度为1.82±1.65 mg·kg–1(图 2)。这表明,随着暴露浓度的增加,菲在E. crypticus体内的长期残留时间延长,将导致更高的生物积累效应,进而增加通过食物链传递的风险。在环境风险评估中,尤其是高暴露PAHs浓度下,应特别关注PAHs的长期残留及其可能对生态系统产生的影响。
本研究对所有暴露浓度的数据进行了综合拟合,旨在构建一个适用于现实条件的全局性模型,以整合不同PAHs暴露浓度下E. crypticus的吸收、消除和积累特征。根据拟合结果,发现综合拟合的ku值接近高浓度条件下的单独拟合值,在80 mg·kg–1暴露下,综合拟合和单独拟合的ku值差异仅为1.3%(表 2),这表明综合拟合模型在高浓度暴露下能较好地反映菲的吸收速率。然而,在低浓度条件下,如20 mg·kg–1暴露下,综合拟合高估了吸收速率,实际数据表明单独拟合的吸收速率更低,综合模型高估了30.1%。另一方面,综合模型的ke值在20 mg·kg–1和40 mg·kg–1暴露下分别低估了24%和20%,而在80 mg·kg–1暴露下则高估了15%。综合模型未能充分反映暴露浓度上升导致的消除速率下降(表 2),可能会导致PAHs不同污染浓度条件下环境风险评估的不准确。尽管综合拟合模型显示出E. crypticus对菲在吸收和消除过程中先快后慢的动态特征,但在高浓度暴露条件下,PAHs的积累水平可能被低估(图 2),尤其是对于长期暴露场景,这可能影响对生态系统的风险预测。综上,虽然综合拟合能够较好地描述整体趋势,但在环境风险评估中,尤其是高污染区域的评估中,建议优先采用单独拟合的结果,以确保对高浓度污染区域的准确预测。
本研究揭示了不同暴露水平下菲在E. crypticus体内的毒代动力学特征,这些发现为PAHs在土壤生态系统中的环境风险评估提供了参考数据。E. crypticus对PAHs表现出的低敏感性使其成为同类中的特例,本研究最高浓度设置为80 mg·kg–1,但在少数污染极端严重的地区,土壤中PAHs总含量可高达2 634 mg·kg–1[35]。已有研究[28,32]表明,E. crypticus在如此极端条件下依然能够保持较高的存活率,因此有必要在更高的暴露水平下测定其生物积累上限,这将有助于在极端污染地区更准确地评估PAHs的环境风险。此外,未来研究还应从机制层面深入探讨E. crypticus对PAHs表现出低敏感性的原因,这不仅有助于解释其特殊的耐受能力,还能为其他类似物种的环境风险评估提供参考。
4 结论E. crypticus在不同PAHs暴露浓度下的毒代动力学表现出浓度依赖性特征。随着土壤中PAHs浓度的增加,E. crypticus对PAHs的吸收速率加快,而消除速率逐渐减缓,导致体内PAHs的生物富集程度显著上升。在高浓度暴露下,PAHs在E. crypticus体内的残留时间延长,表现出持久性残留效应,表明高浓度PAHs污染可能对土壤无脊椎动物构成更大的生态压力,增加生态系统的潜在风险。综合拟合结果虽然能够有效反映整体毒代动力学趋势,但在高污染环境中进行风险评估时应更加谨慎。鉴于E. crypticus对PAHs的低敏感性,未来的土壤环境风险评估应充分考虑这类特例情况,以提高对PAHs污染物潜在生态风险评估的准确性。
| [1] |
Qi R, Pan L, Liu T, et al. Source risk, ecological risk, and bioeffect assessment for polycyclic aromatic hydrocarbons (PAHs) in Laizhou Bay and Jiaozhou Bay of Shandong Peninsula, China[J]. Environmental Science and Pollution Research, 2022, 29(37): 56705-56726. DOI:10.1007/s11356-022-19778-8
(  0) 0) |
| [2] |
Rehman M Y A, Taqi M M, Hussain I, et al. Elevated exposure to polycyclic aromatic hydrocarbons (PAHs) may trigger cancers in Pakistan: An environmental, occupational, and genetic perspective[J]. Environmental Science and Pollution Research, 2020, 27(34): 42405-42423.
(  0) 0) |
| [3] |
Zan Y, Wei T T, Ye H B, et al. Distribution, source, and ecological risk evaluation of the PAHs and PCBs in the sediments from Sanya River (In Chinese)[J]. Environmental Science, 2021, 42(4): 1830-1838. [詹咏, 韦婷婷, 叶汇彬, 等. 三亚河沉积物PAHs和PCBs的分布、来源及风险评价[J]. 环境科学, 2021, 42(4): 1830-1838.]
(  0) 0) |
| [4] |
Liu X L, Dong Z W, Baccolo G, et al. Distribution, composition and risk assessment of PAHs and PCBs in cryospheric watersheds of the eastern Tibetan Plateau[J]. Science of the Total Environment, 2023, 890: 164234.
(  0) 0) |
| [5] |
Trellu C, Pechaud Y, Oturan N, et al. Remediation of soils contaminated by hydrophobic organic compounds: How to recover extracting agents from soil washing solutions?[J]. Journal of Hazardous Materials, 2021, 404: 124137.
(  0) 0) |
| [6] |
Xu Z Y, Wang C H, Li H X, et al. Concentration, distribution, source apportionment, and risk assessment of surrounding soil PAHs in industrial and rural areas: A comparative study[J]. Ecological Indicators, 2021, 125: 107513.
(  0) 0) |
| [7] |
Zhang J, Yu D J, Zhang L W, et al. The effects of polycyclic aromatic hydrocarbons on ecological assembly processes and co-occurrence patterns differ between soil bacterial and fungal communities[J]. Journal of Hazardous Materials, 2025, 484: 136716.
(  0) 0) |
| [8] |
Chakravarty P, Chowdhury D, Deka H. Ecological risk assessment of priority PAHs pollutants in crude oil contaminated soil and its impacts on soil biological properties[J]. Journal of Hazardous Materials, 2022, 437: 129325.
(  0) 0) |
| [9] |
Liu B L, Gao L, Ding L J, et al. Trophodynamics and bioaccumulation of polycyclic aromatic hydrocarbons (PAHs) in marine food web from Laizhou Bay, China[J]. Marine Pollution Bulletin, 2023, 194: 115307.
(  0) 0) |
| [10] |
Tarigholizadeh S, Sushkova S, Rajput V D, et al. Transfer and degradation of PAHs in the soil-plant system: A review[J]. Journal of Agricultural and Food Chemistry, 2024, 72(1): 46-64.
(  0) 0) |
| [11] |
Liu W Y, Wang D, Wang Y K, et al. Improved comprehensive ecological risk assessment method and sensitivity analysis of polycyclic aromatic hydrocarbons (PAHs)[J]. Environmental Research, 2020, 187: 109500.
(  0) 0) |
| [12] |
Bouzekry A, Mghili B, Bottari T, et al. Polycyclic aromatic hydrocarbons in sediments and bivalves along the Moroccan Mediterranean coast: Spatial distribution, sources, and risk assessment[J]. Environmental Pollution, 2024, 363: 125073.
(  0) 0) |
| [13] |
Jager T, Sánchez F A A, Muijs B, et al. Toxicokinetics of polycyclic aromatic hydrocarbons in Eisenia Andrei (Oligochaeta) using spiked soil[J]. Environmental Toxicology and Chemistry, 2000, 19(6): 1702-1702.
(  0) 0) |
| [14] |
Johnson D L, Jones K C, Langdon C J, et al. Temporal changes in earthworm availability and extractability of polycyclic aromatic hydrocarbons in soil[J]. Soil Biology and Biochemistry, 2002, 34(9): 1363-1370.
(  0) 0) |
| [15] |
Mangold-Döring A, Huang A N, van Nes E H, et al. Explicit consideration of temperature improves predictions of toxicokinetic-toxicodynamic models for flupyradifurone and imidacloprid in Gammarus pulex[J]. Environmental Science & Technology, 2022, 56(22): 15920-15929.
(  0) 0) |
| [16] |
Santos F C F, Verweij R A, van Gestel C A M, et al. Toxicokinetics of chromium in Enchytraeus crypticus (Oligochaeta)[J]. Toxics, 2022, 10(2): 82-92.
(  0) 0) |
| [17] |
Mangold-Döring A, Buddendorf W B, van den Brink P J, et al. How relevant are temperature corrections of toxicity parameters in population models for environmental risk assessment of chemicals?[J]. Ecological Modelling, 2024, 498: 110880.
(  0) 0) |
| [18] |
Šmídová K, Hofman J. Uptake kinetics of five hydrophobic organic pollutants in the earthworm Eisenia fetida in six different soils[J]. Journal of Hazardous Materials, 2014, 267: 175-182.
(  0) 0) |
| [19] |
Degtyarev M I, Zaitsev A S, Danilova M A, et al. Population of soil-dwelling enchytraeids (annelida, clitellata, and enchytraeidae) in the European part of Russia[J]. Russian Journal of Ecology, 2024, 55(2): 145-153.
(  0) 0) |
| [20] |
Jänsch S, Römbke J, Didden W. The use of enchytraeids in ecological soil classification and assessment concepts[J]. Ecotoxicology and Environmental Safety, 2005, 62(2): 266-277.
(  0) 0) |
| [21] |
Bruns E, Egeler P, Roembke J, et al. Bioaccumulation of lindane and hexachlorobenzene by the oligochaetes Enchytraeus luxuriosus and Enchytraeus albidus (Enchytraeidae, Oligochaeta, Annelida)[J]. Hydrobiologia, 2001, 463: 185-196.
(  0) 0) |
| [22] |
OECD. Test No. 317: Bioaccumulation in terrestrial Oligochaetes guidelines for the testing of chemicals[S]. Paris, France, 2010.
(  0) 0) |
| [23] |
Amorim M J, Oliveira E, Teixeira A S, et al. Toxicity and bioaccumulation of phenanthrene in Enchytraeus albidus (Oligochaeta: Enchytraeidae)[J]. Environmental Toxicology and Chemistry, 2011, 30(4): 967-972.
(  0) 0) |
| [24] |
Droge S T J, Paumen M L, Bleeker E A J, et al. Chronic toxicity of polycyclic aromatic compounds to the springtail Folsomia candida and the enchytraeid Enchytraeus crypticus[J]. Environmental Toxicology and Chemistry, 2006, 25(9): 2423-2431.
(  0) 0) |
| [25] |
León Paumen M, de Voogt P, van Gestel C A M, et al. Comparative chronic toxicity of Homo- and heterocyclic aromatic compounds to benthic and terrestrial invertebrates: Generalizations and exceptions[J]. Science of the Total Environment, 2009, 407(16): 4605-4609.
(  0) 0) |
| [26] |
Sverdrup L E, Krogh P H, Nielsen T, et al. Relative sensitivity of three terrestrial invertebrate tests to polycyclic aromatic compounds[J]. Environmental Toxicology and Chemistry, 2002, 21(9): 1927-1933.
(  0) 0) |
| [27] |
Roelofs D, Bicho R C, de Boer T E, et al. Mechanisms of phenanthrene toxicity in the soil invertebrate, Enchytraeus crypticus[J]. Environmental Toxicology and Chemistry, 2016, 35(11): 2713-2720.
(  0) 0) |
| [28] |
Kobetičová K, Šimek Z, Brezovský J, et al. Toxic effects of nine polycyclic aromatic compounds on Enchytraeus crypticus in artificial soil in relation to their properties[J]. Ecotoxicology and Environmental Safety, 2011, 74(6): 1727-1733.
(  0) 0) |
| [29] |
Holmstrup M, Bouvrais H, Westh P, et al. Lipophilic contaminants influence cold tolerance of invertebrates through changes in cell membrane fluidity[J]. Environmental Science & Technology, 2014, 48(16): 9797-9803.
(  0) 0) |
| [30] |
Dai W C, Slotsbo S, Damgaard C, et al. Synergistic interaction between effects of phenanthrene and dynamic heat stress cycles in a soil arthropod[J]. Environmental Pollution, 2019, 254: 113071.
(  0) 0) |
| [31] |
Wu S J, Wu E M, Qiu L Q, et al. Effects of phenanthrene on the mortality, growth, and anti-oxidant system of earthworms (Eisenia fetida) under laboratory conditions[J]. Chemosphere, 2011, 83(4): 429-434.
(  0) 0) |
| [32] |
Sverdrup L E, Jensen J, Kelley A E, et al. Effects of eight polycyclic aromatic compounds on the survival and reproduction of Enchytraeus crypticus (Oligochaeta, Clitellata)[J]. Environmental Toxicology and Chemistry, 2002, 21(1): 109-114.
(  0) 0) |
| [33] |
Arp H P, Lundstedt S, Josefsson S, et al. Native oxy-PAHs, N-PACs, and PAHs in historically contaminated soils from Sweden, Belgium, and France: Their soil-porewater partitioning behavior, bioaccumulation in Enchytraeus crypticus, and bioavailability[J]. Environmental Science & Technology, 2014, 48(19): 11187-11195.
(  0) 0) |
| [34] |
Dai W, Slotsbo S, van Gestel C A M, et al. Temperature-dependent toxicokinetics of phenanthrene in Enchytraeus albidus (Oligochaeta)[J]. Environmental Science & Technology, 2021, 55(3): 1876-1884.
(  0) 0) |
| [35] |
Eom I C, Rast C, Veber A M, et al. Ecotoxicity of a polycyclic aromatic hydrocarbon (PAH)-contaminated soil[J]. Ecotoxicology and Environmental Safety, 2007, 67(2): 190-205.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


