2. 中国科学院植物研究所植被与环境变化国家重点实验室, 北京 100093
2. State Key Laboratory of Vegetation and Environmental Change, Institute of Botany, the Chinese Academy of Sciences, Beijing 100093
土壤有机质(Soil organic matter,SOM)是陆地碳循环的基础,其容纳的碳量远超大气和植被中的有机碳总和[1]。土壤有机碳(Soil organic carbon,SOC)的微小波动均可能引起大气中CO2浓度的显著变化,从而加剧或延缓气候变化的趋势[2]。同时,气候变化又会影响SOC的周转[3],导致SOC动态变化和气候变化之间形成复杂的互馈关系。研究表明,SOC分解对增温的响应呈现出正相关[4]、负相关[5]或无显著关系[6],对降雨的响应也存在差异[7-8],这可能与SOC组成及其矿化过程的复杂性有关[9]。因此,需要开展更多的深入研究。
大量研究通过将SOM划分为不同组分来揭示其矿化动态及影响因素[10-12]。早期侧重于采用化学分离的方法,如碱提取腐殖质[13],但近期研究表明,碱液提取的腐殖质可能是人造产物,并不能代表自然环境中的天然有机质[14-15]。近年来越来越多的研究采用基于粒径大小或密度的物理分离方法,将SOM分成不同组分,分别研究其矿化动态[16-17]。其中,颗粒态有机质(Particulate organic matter,POM)和矿物结合态有机质(Mineral-associated organic matter,MAOM)是两种具有不同物理、化学特性和周转速率的组分,在土壤有机碳周转和保护研究中被广泛使用[16,18-20]。
从来源上,POM主要由经过初级分解的植物凋落物组成,而MAOM的形成主要有体内周转和体外修饰两种途径[21-22]。一方面,微生物通过分解植物凋落物、根系分泌物等外源性有机物,将其转化成小分子有机化合物,这些物质可以被微生物细胞吸收并用于合成新的生物分子,这些微生物代谢产物在微生物死亡后会转化为微生物残体碳,与土壤矿物颗粒结合。另一方面,植物凋落物进一步分解后释放的可溶性有机碳(Dissolved organic carbon,DOC)可以直接与土壤矿物质结合,形成MAOM[9,23]。有机质与土壤细颗粒矿物的结合包括物理吸附或化学键结合,以及被封闭在微孔或小型团聚体(< 50~63 μm)中,使分解者(主要为微生物)及蛋白酶难以接触到有机质,进而保护有机质不被降解[24-25]。相比之下,POM缺乏类似的保护机制,更容易被微生物降解[13]。因此,MAOM通常较POM具有更长的存留和周转时间,更利于SOM的保存[26]。综上所述,POM和MAOM物理化学特性的差异导致两种碳库的周转时间以及对气候变化的响应不同,因此,区分POM和MAOM有助于更好地理解和预测SOM对全球变化的影响与响应[13,27]。
大量研究探讨了不同温度和土壤水分条件下SOC的矿化动力学过程[28-29],但大多数研究采用全土培养,并通过概念模型量化不同有机碳组分的差异[30]。也有一些研究探究了SOC不同组分在不同温度条件下的碳动态差异。例如,Benbi等[31]将农田土分成三个组分,在4种温度条件下进行培养试验,结果显示土壤有机碳库中占比最小的粗颗粒有机碳最易分解,而占SOC1/2以上的矿物结合态有机碳(Mineral-associated organic Carbon,MAOC)最不易分解,同时随着温度的升高,粗颗粒有机碳与其他两种组分的矿化速率差异也逐渐扩大。Qin等[32]通过青藏高原土壤不同组分的培养试验发现,POM的Q10显著大于MAOM的Q10,且POM具有更高的微生物多样性。但依然很少有研究直接量化不同组分SOC矿化过程如何响应水分的变化,因此亟需利用POM和MAOM开展培养实验,量化其对环境因子变化的矿化响应差异。
草原生态系统是陆地生态系统的重要组成部分,约占全球陆地面积的40%[33]。全球草地碳库约为520 Pg C(1 Pg=1×1015 g),贡献了陆地生态系统碳库的34%[34]。草地碳库中约90%的有机碳是以根生物量和SOC的形式储存在地下[34],其中MAOC占草地SOC的比例高达70%[35]。因此,草地土壤碳动态过程对全球变化具有重要影响。此外,草地生态系统相对脆弱,易受气候变化和人类活动的影响[36],其SOC如何响应全球变化还存在较大不确定性[34]。因此,深入研究草地土壤有机碳组分含量、矿化速率及其影响因素,对于认知草原SOC动态变化、改善土壤碳模型以及预测未来气候变化具有重要意义。
本研究以内蒙古锡林郭勒草原生态系统国家站草原土壤为研究对象,根据粒径分离法将土壤划分成POM和MAOM两个组分,通过控制温度和水分梯度,探究草原土壤不同有机碳组分的矿化差异,揭示草原土壤颗粒态有机碳(Particulate organic carbon,POC)和MAOC矿化机制。研究结果有助于更好地估算和预测全球变化背景下土壤CO2的排放通量,为制定减少温室气体排放策略提供科学依据。
1 材料与方法 1.1 供试土壤试验用土来自内蒙古锡林郭勒草原生态系统国家野外科学观测研究站(43°37′N,116°42′E),该实验站位于内蒙古锡林郭勒盟(图 1),属典型的半干旱草原气候,年平均气温2.3℃,年均降水量约为350 mm,全年无霜期约100 d,年均蒸发量1 800 mm。土壤类型主要为栗钙土、黑钙土、草甸土等。主要优势种为羊草(Leymus chinensis)、大针茅(Stipa grandis)、糙隐子草(Cleistogenes squarrosa)等[37]。2022年5月在1979年围封的长期实验样地,选择3个1 m×1 m的取样点,在每个样点通过随机多点取样方式采集表层0~15 cm土壤样品,混匀后,剔除可见石块、植物根系和动植物残体。其中,一部分土壤4℃保存备用,剩余土壤过2 mm筛,风干备用。
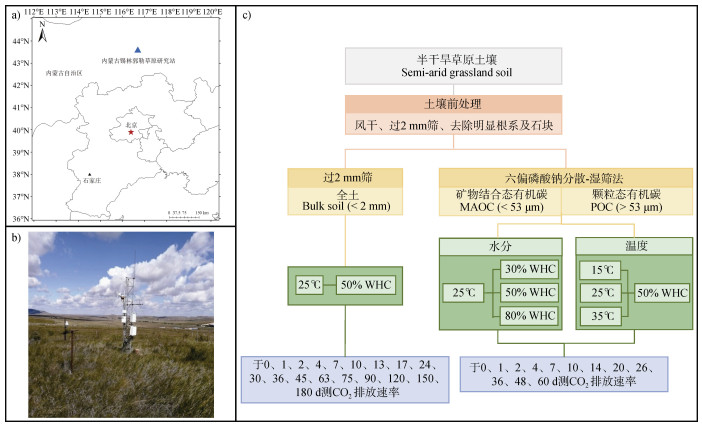
|
注:a)基于自然资源部标准地图服务下载的审图号为GS(2020)4619号的标准地图制作,底图无修改。Note:a)is based on the standard map with review number GS(2020)4619 downloaded from the Standard Map Service of the Ministry of Natural Resources,with no modifications to the base map. WHC:土壤持水量WHC stands for soil water holding capacity. 图 1 内蒙古锡林郭勒草原生态系统国家野外科学观测研究站点位图(a)、锡林郭勒草原通量塔采样点(b)及实验流程图(c) Fig. 1 Location map of the Xilingol Grassland Ecosystem National Field Scientific Observation and Research Station in Inner Mongolia(a), Sampling site of the Xilingol grassland flux tower(b)and Experimental flow chart(c) |
土壤有机碳库的物理分级根据Cambardella和Elliott [16]和Coturfo[27]的方法,分离出颗粒态有机质(POM)和矿物结合态有机质(MAOM)。具体分离方案如下:(1)将风干土壤与0.5%的六偏磷酸钠溶液混合1︰3(m︰v),手动摇匀后在摇床上(180 r·min–1)震荡18 h。(2)将分散的土壤溶液冲洗至53 μm的筛子上,反复用超纯水冲洗,用已知质量的塑料桶收集上下组分,直至水流清澈为止。通过的有机物质定义为MAOM,残留在筛上的有机物质定义为POM。(3)将分离出的组分在室内静置,倒掉上清液,沉淀部分的土壤自然风干后收集到自封袋中备用。
1.3 培养试验(1)全土有机碳矿化试验。取干土80 g加入500 mL的三角玻璃瓶中,湿度调整为50%土壤持水量(Soil water holding capacity,WHC),瓶口盖上封口膜,扎孔保持通气,共有3个重复,放入25℃恒温箱中避光培养。预培养7 d后,正式培养180 d,培养期间每3天称重,用超纯水调节水分含量至初始值。土壤样品于培养0、10、30、90、180 d进行破坏性取样,测定土壤可溶性有机碳(DOC)、颗粒态有机碳(POC)、矿物结合态有机碳(MAOC)、微生物生物量碳(Microbial biomass carbon,MBC)和总有机碳(Total organic carbon,TOC);于0、1、2、4、7、10、13、17、24、30、36、45、63、75、90、120、150、180 d进行气体取样。
(2)POM和MAOM矿化对气候因子响应试验。取干土35 g放入250 mL三角玻璃瓶中,将土壤湿度调整至30%、50%和80% WHC,覆盖有孔封口膜,分别放入15℃、25℃、35℃的培养箱中避光培养,共设置MAOM-25℃+30% WHC、MAOM-25℃+50% WHC、MAOM-25℃+80% WHC、MAOM-15℃+50% WHC、MAOM-35℃+50% WHC、POM-25℃+30% WHC、POM-25℃+50% WHC、POM-25℃+80% WHC、POM-15℃+50% WHC、POM-35℃+50% WHC等10个处理,每个处理设置3个重复。预培养7 d后,正式培养60 d,培养期间每3 d称重,用超纯水调节水分含量至初始值。土壤样品培养0、20、60 d后进行破坏性取样,测定土壤DOC、MBC、TOC;于0、1、2、4、7、10、14、20、26、36、48、60 d进行气体取样。
1.4 指标测定与计算(1)土壤基本理化性质的测定。土壤在105℃条件下烘干至恒重,根据水分变化计算土壤含水率;土壤可溶性有机碳(DOC)采用0.5 mol·L–1 K2SO4浸提土壤(水土比为4︰1),震荡离心后,使用中速定量滤纸过滤,用总有机碳分析仪(OI Analytical 1030W+1088,美国)测定滤液中DOC含量;采集的新鲜土壤风干、研磨过100目筛后,称取1 g土壤样品,加入30 mL 1 mol·L–1的盐酸,震荡放置24 h,去除土壤样品中的无机碳,用碳氮元素分析仪(Elemantar vario EL CUBE,德国)测定总有机碳(TOC)。
(2)土壤排放CO2测定。每次取样前将培养瓶置于实验室空旷场地通风10 min,立即用带有长短气管的螺丝盖拧紧密封瓶子,密闭4 h,每隔1 h采集7 mL顶空气体注入预先抽为真空的3 mL气瓶中,并在取样过程中注入等量的合成空气(成分为21% O2+79% N2)以平衡气压,并计算CO2产生速率与累积排放量。
土壤产生的CO2浓度,利用气相色谱仪(Agilent GC7890B)测定。CO2的产生速率计算公式为:
| $ F = \frac{V}{m} \times \frac{{dc}}{{dt}} \times \frac{{273}}{{22.4 \times (273 + T)}} \times \frac{{24}}{{1000}} $ |
式中,F表示气体产生速率(μmol·g–1·d–1);V为培养瓶体积(mL);m为干重(g);dc/dt为气体在观测时间内浓度随时间变化的直线斜率(μg·g–1·h–1);T为培养温度(℃)。累积排放量采用相邻两次取气CO2产生速率的平均值乘以间隔的时间来计算。
(3)土壤POC和MAOC的测定。将分离出的POC和MAOC在60℃烘箱中烘干至恒重,称量,用球磨机研磨成均质细粉,用1 mol·L–1 HCl溶液酸化去除无机碳酸盐,24 h后进行离心。离心后再加入超纯水清洗,当加入进去的纯水pH接近中性时,离心倒掉上清液,剩下的土置于冷冻干燥机干燥,使用碳氮元素分析仪(Elemantar vario EL CUBE,德国)进行有机碳分析。
(4)土壤微生物生物量碳的测定。微生物生物量碳(MBC)采用氯仿熏蒸-0.5 mol·L–1硫酸钾浸提法测定,通过总有机碳分析仪测定提取液总碳。计算MBC公式为:MBC=ΔEC/KC,式中,ΔEC为熏蒸与未熏蒸土壤浸提液中有机碳含量的差值;KC为MBC的转化系数,为0.45[38]。
1.5 统计分析用Microsoft Excel 2016和IBM SPSS Statistics 25对数据进行处理分析。采用单因素方差分析(One-way ANOVA)检验有机碳不同组分各项指标数据的差异显著性,结合最小显著差异法(LSD),显著性水平设定为P < 0.05。绘图由Origin 2022软件完成,图中所有数据均为平均值±标准误差(n=3)。
2 结果 2.1 全土有机碳矿化速率与不同碳组分动态变化图 2a显示,土壤CO2排放速率在180天内呈波动下降的趋势。在培养90天后,CO2排放速率急速下降,120天后趋于平稳,约为0.27~0.49 μmol·g–1·d–1。与之对应,CO2累积排放量在前90天快速增加,第90天时达到1 990 mg·kg–1,120天后增速变缓,180 d培养结束时累积排放量为2 688 mg·kg–1。从图 2b可以看出,POC和MAOC之和占实测TOC的99.3%~107.9%,其中POC占24%~38%,MAOC占60%~75%。在180天内,POC和MAOC变化不大,而MBC则呈现波动下降的趋势。
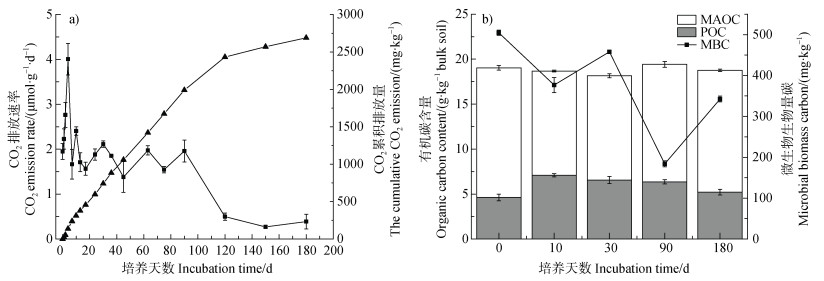
|
图 2 全土培养180 d CO2排放速率、累积排放量(a)以及矿物结合态有机碳(MAOC)、颗粒态有机碳(POC)、微生物生物量碳(MBC)动态变化(b) Fig. 2 CO2 emission rate and cumulative CO2 emissions(a)and the dynamic changes of MAOC, POC and MBC(b)from bulk soil during 180 days of incubation |
从图 3a和图 3b可以看出,MAOM在不同温度和水分条件下CO2排放速率均随着培养时间的增加逐渐降低。在不同温度条件下,35℃时CO2排放速率最大,15℃和25℃时无明显差异;在不同水分含量条件下,CO2排放速率随水分含量的增加而上升。图 3c和图 3d展示了POM的CO2排放速率对温度和水分含量的响应情况。随着温度升高,CO2排放速率增加,而水分含量对POM的CO2排放影响不明显。
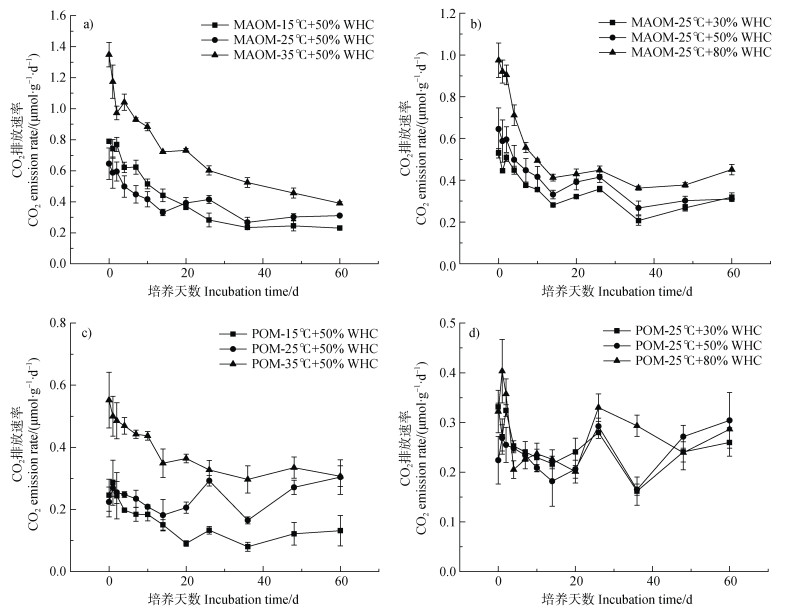
|
图 3 不同温度(a、c)和水分(b、d)条件下矿物结合态有机质(MAOM)(a、b)和颗粒态有机质(POM)(c、d)培养试验中CO2排放速率变化 Fig. 3 Dynamic changes of CO2 emission rate from MAOM(a, b)and POM(c, d)at different temperatures(a, c)and soil moisture conditions(b, d) |
不同温度条件下(图 4a),15℃和25℃下MAOM的单位土壤质量CO2累积排放量差异不显著,35℃时最大,达到458.32 mg·kg–1。POM的CO2累积排放量随着温度的升高而增加,35℃时达到254.38 mg·kg–1,是15℃时的2.66倍。从图 4b可知,MAOM的单位土壤质量CO2累积排放量随着水分含量的增加而升高,而POM在不同水分条件下没有显著差异。对于单位有机碳的CO2累积排放量,MAOM在不同水分条件下差异不显著(图 4d),仅在35℃时最大,达到18.56 g·kg–1(图 4c);而POM单位有机碳CO2累积排放量随着水分和温度的增加而逐渐增加,在35℃时最大,为42.24 g·kg–1。总体而言,不同温度和水分条件下,MAOM和POM的CO2累积排放量均存在显著差异(P < 0.05)。在35℃、50% WHC条件下,MAOM单位土壤CO2累积排放量较POM大203.95 mg·kg–1;而在25℃、30% WHC条件下,MAOM单位土壤CO2累积排放量较POM仅大53.99 mg·kg–1(图 4b)。对于单位有机碳的CO2累积排放量,POM在35℃、50% WHC条件下较MAOM大23.67 g·kg–1;在15℃、50% WHC条件下POM仅较MAOM大6.18 g·kg–1。
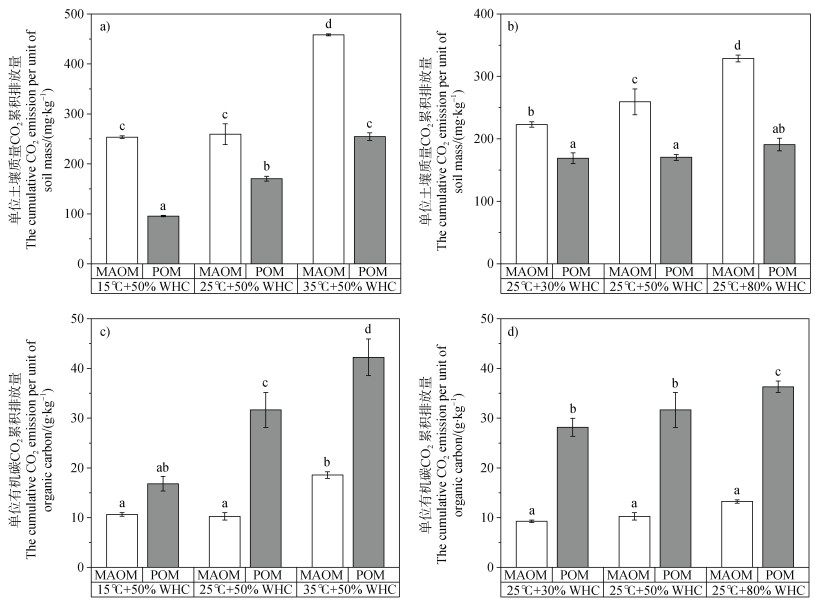
|
注:a和b分别代表不同温度和不同水分条件下单位土壤质量的CO2累积排放量;c和d分别代表不同温度和不同水分条件下单位有机碳的CO2累积排放量;图中不同字母表示不同处理间差异显著(P < 0.05)。Note:a and b represent the cumulative CO2 emission of different temperature and soil moisture conditions based on soil weight;c and d represent the cumulative CO2 emission of different temperature and soil moisture conditions on organic carbon,respectively. In the figure,different letters represent significant differences among treatments at P < 0.05. 图 4 不同温度和水分条件下矿物结合态有机质(MAOM)和颗粒态有机质(POM)培养试验中CO2累积排放量 Fig. 4 The cumulative CO2 emission of MAOM and POM at different temperatures and soil moisture conditions |
由图 5可以看出,在不同条件下,MAOM总有机碳变化趋势基本一致,呈现逐渐下降的趋势,在25℃、30% WHC条件下第20天有较为明显的下降。POM的总有机碳变化不明显。MAOM的MBC呈现逐渐下降趋势,在60天培养试验中,25℃、80% WHC条件下下降幅度最大,下降了98.79 mg·kg–1;25℃、30% WHC条件下MBC下降最少,仅下降了17.43 mg·kg–1。POM的MBC在60天内变化不大,范围为–16.68~33.59 mg·kg–1。MAOM的DOC在60天内均呈下降趋势,其中25℃、50% WHC条件下下降幅度最大,减少了122.63 mg·kg–1。POM的DOC在60天内变化不大,基本呈先上升后下降的趋势,35℃、50% WHC条件下DOC最大。
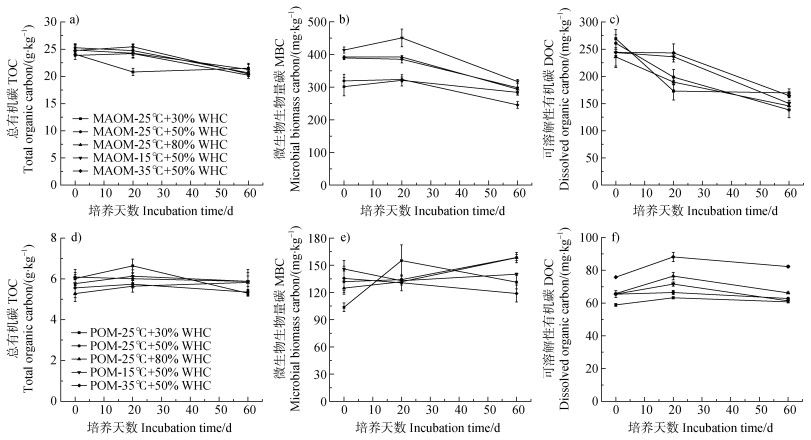
|
图 5 不同温度和水分条件下矿物结合态有机质(MAOM)(a、b、c)和颗粒态有机质(POM)(d、e、f)培养试验中总有机碳(TOC)(a、d)、微生物生物量碳(MBC)(b、e)和可溶性有机碳(DOC)(c、f)的动态变化 Fig. 5 Dynamic changes of TOC(a, d), MBC(b, e), and DOC(c, f)from MAOM(a, b, c)and POM(d, e, f)at different temperatures and soil moisture conditions |
从图 6中可以看出,POM的CO2排放速率只与温度呈极显著的正相关关系(P < 0.01),而MAOM的CO2排放速率与DOC、C︰N呈极显著的正相关关系(P < 0.01),与温度呈显著正相关关系(P < 0.05)。同时,MAOM组分的MBC与温度呈极显著的负相关关系(P < 0.01)。从图 7中可以看出,MAOM的C︰N变化范围很小(7.73~8.82),而POM的C︰N变化范围较大(10.59~21.80)。
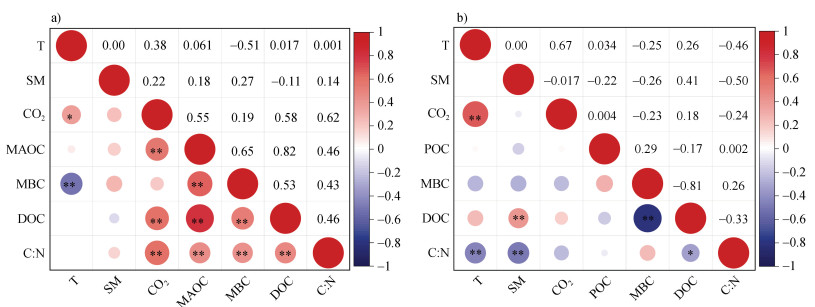
|
注:红色和蓝色分别代表正相关和负相关。*和**分别表示显著相关(P < 0.05)和极显著相关(P < 0.01)。其中,T为温度,SM为土壤水分,CO2为CO2排放速率。Note:Red represents positive correlation,blue represents negative correlation,* and ** represent significant correlation(P < 0.05)and highly significant correlation(P < 0.01),respectively. In the figure,T stands for Temperature,SM stands for Soil Moisture,and CO2 stands for CO2 emission rate. 图 6 矿物结合态有机质(MAOM)(a)和颗粒态有机质(POM)(b)培养试验中CO2排放速率与相关指标的相关性 Fig. 6 Correlation analysis of CO2 emission rate of MAOM(a)and POM(b)and related indicators |
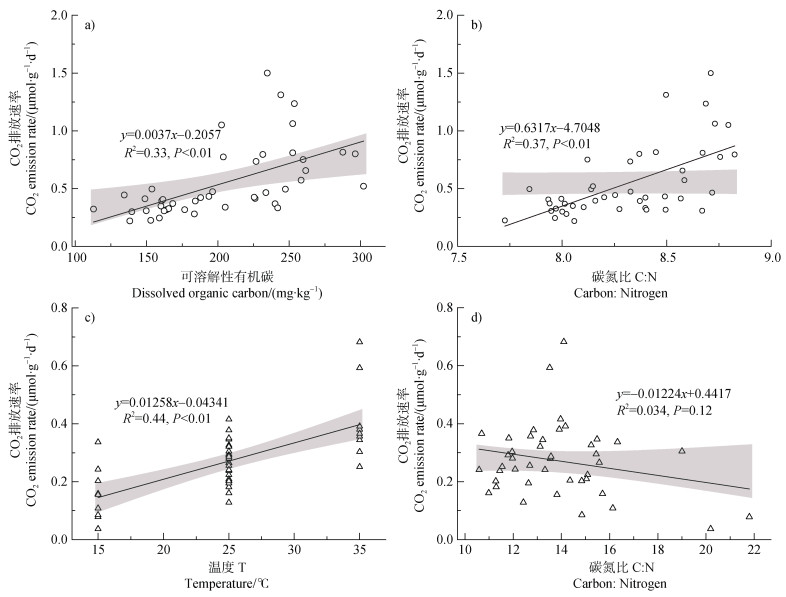
|
图 7 矿物结合态有机质(MAOM)(a、b)和颗粒态有机质(POM)(c、d)培养试验中CO2排放速率与土壤理化性质之间的关系 Fig. 7 The relationship between the CO2 emission rate of MAOM(a, b)and POM(c, d)and soil physicochemical properties |
本研究表明,在最适条件下经过180 d的室内培养实验,草原土壤的CO2累积排放量达到2 688 mg·kg–1(图 2a),草原中更多的碳储存在发达的根系中,较高的有机碳含量和活跃的微生物代谢会导致更多CO2排放[39]。此外,草原土壤中MAOC占土壤TOC的60%~75%(图 2b),这与Bai和Cotrufo [34]在草原生态系统表层土壤中发现50%~75%的SOC为MAOC的结果相一致。草原土壤微生物的生物量较高、活性较强,不仅限制了POM的积累,也促进了MAOM的形成[9]。作为一种与土壤矿物紧密结合的有机质,MAOM在土壤矿物的物理保护下,能够减少微生物的降解,从而提高其在土壤中的持久性[40]。研究还表明,POM较MAOM具有更高的C:N,说明植物来源的有机碳首先积累在POM中,并在分解过程中逐渐转变为MAOM,C︰N随之减小,以上结论与Benbi等[41-42]的观点相一致。
在本研究中,POM和MAOM的碳矿化速率均随着温度升高而增加(图 3a、图 3c)。这主要是由于在水分不受限制的情况下,升温会通过改变微生物功能群落和增强分解代谢能力来促进土壤有机碳的分解[43-44]。与MAOM相比,POM降解产生的CO2排放速率与温度之间存在更高的正相关关系,这与Benbi等[31]和Samal等[45]的结果一致。土壤有机质矿化的温度敏感性通常以温度系数Q10来衡量,其反映了温度每升高10℃时有机碳分解速率的变化。本研究对POM和MAOM的Q10值进行了比较分析,结果表明两组分在不同温度下的温度敏感性明显不同。在15℃时,POM的Q10为1.395,显著高于MAOM的Q10(0.888),表明在较低温度条件下,POM对温度变化的响应更为敏感。Benbi等[31]指出,POM主要由不同分解阶段的植物碎屑和微生物碎片组成,且未受到物理保护,因此该碳库具有较高的温度敏感性(Q10),易被微生物利用而快速分解。相比之下,MAOM的Q10较低,可能与其主要由稳定有机质与矿物结合的复合物构成有关,这些有机质分解的酶促反应受温度变化的限制较小[46]。而在25℃时,POM和MAOM的Q10分别为1.701和1.877,呈现出不同的差异。这可能是因为在较高温度下,促进了未受保护的有机碳溶解,导致土壤溶液中DOC的增加[47],进而刺激CO2释放,因此MAOM中被矿物保护的低分子量有机物变得更易于分解[3]。此外,微生物代谢活性和酶促反应效率在高温下显著增强,也可能促进了MAOM矿化速率的提升[48]。同时,MAOM中的MBC随着温度的升高而显著减少(P < 0.01)(图 6b)。这可能是由于升温降低了微生物碳利用效率(Microbial carbon use efficiency,CUE),即更多的碳以CO2形式释放,而不是用于生物量合成,从而导致MBC减少[49]。
土壤含水量对土壤氧气含量和微生物活性有重要影响,是影响有机质矿化的关键因素。适宜的水分条件可以促进微生物活性,提高有机质分解速率,而过高或过低的水分则会抑制微生物活性,从而减缓矿化速率[44]。草原土壤中POM和MAOM的CO2排放速率对土壤水分的响应存在差异,表明不同有机碳库的矿化机制不同。在本研究中,MAOM的CO2矿化速率与土壤水分呈正相关,但不显著,这与Lützow等[50]的结果一致。有研究指出,在MAOM的形成过程中,DOC含量起着至关重要的作用[22,51]。通过物理分离得到MAOM的过程中破坏了物理保护,使一部分附着在矿物表面的有机质暴露在外,随着土壤含水量的增加,更多的有机质溶解在土壤溶液中,而有机碳的解聚和溶解是其矿化的先决条件[52],导致CO2排放速率随DOC含量增加而显著增大(P < 0.01)。相比之下,POM的CO2排放速率与土壤水分几乎没有显著相关性(P > 0.05)。这可能是因为POC本身含水率较大,土壤水分并非POC矿化的限制因素。由于POC未受到土壤颗粒的物理保护,微生物分解者可轻易接触到POC,使得这部分碳得以快速周转[44]。此外,本研究中POC组分初始碳含量较低,仅为4.50~6.82 g·kg–1,其分解可能更多受基质可获取性及微生物活性的影响。
本研究显示,以单位土壤质量计量时,MAOM的CO2累积排放量大于POM(图 4a);但以单位有机碳计量时,POM的CO2累积排放量则高于MAOM(图 4b)。这一结果表明,MAOM尽管具有较高的单位有机质稳定性,表现出较低的矿化速率,但其在相同条件下含碳量更大,因此碳矿化的总体贡献高于POM。相较之下,POM的单位有机质稳定性较低,矿化速率更快,导致其单位有机碳CO2累积排放量高于MAOM。除此之外,土壤物理分组会破坏部分物理保护,暴露被保护的有机质,从而加速有机碳的释放,这一过程可能降低MAOM的单位有机质稳定性,改变其矿化难易程度以及CO2排放量[40,53]。在结构特性方面,POM通常暴露在大孔隙中或者存在于大团聚体内部,较少受土壤矿物的保护[54],而MAOM主要是不稳定或低分子量的部分与土壤矿物质结合或被保护在微团聚体中[24,55]。因此,尽管MAOM的碳矿化速率较低,但其累积效应使其对CO2排放的总体贡献较大,而POM因较高的单位有机质矿化速率,使其单位有机碳的矿化贡献更高,也就意味着MAOM中的有机碳更能在土壤中长期储存。
土壤碳氮比(C:N)是影响土壤有机碳矿化的重要因素。一般认为,较高的C:N意味着有机质中相对含氮量较低,这可能导致微生物在有机物分解过程中受到氮元素的限制,从而降低矿化速率[56-57]。本研究中POM的CO2排放速率与C:N之间的相关性不显著(P > 0.05),表明C:N对POM矿化速率的影响可能较弱或受其他因素的影响。相较而言,MAOM的CO2排放速率与C:N有显著的正相关关系(P < 0.01),这一现象可能与MAOM中有机碳组分的稳定性和C:N变化范围较小(7.73~8.82)有关。当C:N较低时,微生物对碳和氮的利用达到平衡,碳矿化速率随之提高。但本研究的C:N范围较窄,可能限制了其结果的广泛适用性,因此为探究C:N对土壤有机碳矿化的影响应考虑使用更大C:N变化范围的土壤开展研究。
4 结论研究表明,草原土壤MAOC和POC的矿化对温度和水分条件的响应存在显著差异,这表明控制这两种碳库矿化的机制不同。整体而言,草原土壤在培养初期CO2累积排放量迅速增加,并在后期趋于稳定,最终在180天时达到2 688 mg·kg–1。两种碳库的CO2排放速率均与温度呈显著正相关,其中,累积排放量均在35℃条件下达到最大值,表明温度升高可以显著促进土壤有机碳的矿化过程。MAOM的CO2排放速率与土壤水分呈正相关,尽管相关性不显著,说明随着水分含量的增加,溶解的有机质含量也相应增加,从而导致CO2排放速率增加。相比之下,POM的CO2排放速率则受水分影响较小,说明微生物群落的分解主要受到基质有效性而非水分含量的限制。综上所述,本研究揭示了草原土壤中两类碳库在不同温度和水分条件下的矿化特征及其驱动机制,这对于进一步理解SOC周转、完善土壤有机碳矿化模型提供了科学依据。
| [1] |
Scharlemann J P, Tanner E V, Hiederer R, et al. Global soil carbon: understanding and managing the largest terrestrial carbon pool[J]. Carbon Management, 2014, 5(1): 81-91.
(  0) 0) |
| [2] |
Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528(7580): 60-68.
(  0) 0) |
| [3] |
Schmidt M W I, Torn M S, Abiven S, et al. Persistence of soil organic matter as an ecosystem property[J]. Nature, 2011, 478(7367): 49-56.
(  0) 0) |
| [4] |
Melillo J M, Frey S D, DeAngelis K M, et al. Long-term pattern and magnitude of soil carbon feedback to the climate system in a warming world[J]. Science, 2017, 358(6359): 101-105.
(  0) 0) |
| [5] |
Zhu E X, Cao Z J, Jia J, et al. Inactive and inefficient: Warming and drought effect on microbial carbon processing in alpine grassland at depth[J]. Global Change Biology, 2021, 27(10): 2241-2253.
(  0) 0) |
| [6] |
Carey J C, Tang J W, Templer P H, et al. Temperature response of soil respiration largely unaltered with experimental warming[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(48): 13797-13802.
(  0) 0) |
| [7] |
Hao Y B, Zhou C T, Liu W J, et al. Aboveground net primary productivity and carbon balance remain stable under extreme precipitation events in a semiarid steppe ecosystem[J]. Agricultural and Forest Meteorology, 2017, 240: 1-9.
(  0) 0) |
| [8] |
Chen S P, Lin G H, Huang J H, et al. Dependence of carbon sequestration on the differential responses of ecosystem photosynthesis and respiration to rain pulses in a semiarid steppe[J]. Global Change Biology, 2009, 15(10): 2450-2461.
(  0) 0) |
| [9] |
Sokol N W, Whalen E D, Jilling A, et al. Global distribution, formation and fate of mineral-associated soil organic matter under a changing climate: A trait-based perspective[J]. Functional Ecology, 2022, 36(6): 1411-1429.
(  0) 0) |
| [10] |
Dumale W A Jr, Miyazaki T, Nishimura T, et al. CO2 evolution and short-term carbon turnover in stable soil organic carbon from soils applied with fresh organic matter[J]. Geophysical Research Letters, 2009, 36(1): L01301.
(  0) 0) |
| [11] |
Cheng X R, Xing W L, Liu J W. Litter chemical traits, microbial and soil stoichiometry regulate organic carbon accrual of particulate and mineral-associated organic matter[J]. Biology and Fertility of Soils, 2023, 59(7): 777-790.
(  0) 0) |
| [12] |
Wang Y, Song X S, Wang J, et al. Effect of drying-rewetting alternation on soil carbon pool and mineralization of soil organic carbon (In Chinese)[J]. Acta Pedologica Sinica, 2014, 51(2): 342-350. DOI:10.11766/trxb201304190186 [王苑, 宋新山, 王君, 等. 干湿交替对土壤碳库和有机碳矿化的影响[J]. 土壤学报, 2014, 51(2): 342-350.]
(  0) 0) |
| [13] |
Lavallee J M, Soong J L, Cotrufo M F. Conceptualizing soil organic matter into particulate and mineral-associated forms to address global change in the 21st century[J]. Global Change Biology, 2020, 26(1): 261-273.
(  0) 0) |
| [14] |
Baveye P C, Wander M. The(bio)chemistry of soil humus and humic substances: Why is the "new view" still considered novel after more than 80 years?[J]. Frontiers in Environmental Science, 2019, 7: 27.
(  0) 0) |
| [15] |
Waksman S A. Humus: origin, chemical composition, and importance in nature[M]. Baltimore: The Wiliams & Wilkins Company, 1936.
(  0) 0) |
| [16] |
Cambardella C A, Elliott E T. Particulate soil organic-matter changes across a grassland cultivation sequence[J]. Soil Science Society of America Journal, 1992, 56(3): 777-783.
(  0) 0) |
| [17] |
Sollins P, Spycher G, Glassman C A. Net nitrogen mineralization from light- and heavy-fraction forest soil organic.
(  0) 0) |
| [18] |
Christensen B T. Physical fractionation of soil and structural and functional complexity in organic matter turnover[J]. European Journal of Soil Science, 2001, 52(3): 345-353.
(  0) 0) |
| [19] |
von Lützow M, Kögel-Knabner I, Ekschmitt K, et al. SOM fractionation methods: Relevance to functional pools and to stabilization mechanisms[J]. Soil Biology and Biochemistry, 2007, 39(9): 2183-2207.
(  0) 0) |
| [20] |
[20]Ma H L, Chen C C, Yin Y F, et al. Experimental study on carbon mineralization of different sizes particle in forest soils (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(5): 1247-1259. DOI:10.11766/trxb202303140102 [马红亮, 陈灿灿, 尹云锋, 等. 森林土壤不同粒径颗粒的碳矿化研究[J]. 土壤学报, 2024, 61(5): 1247-1259.]
(  0) 0) |
| [21] |
Sanderman J, Maddern T, Baldock J. Similar composition but differential stability of mineral retained organic matter across four classes of clay minerals[J]. Biogeochemistry, 2014, 121(2): 409-424.
(  0) 0) |
| [22] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2: 17105.
(  0) 0) |
| [23] |
Xue Z J, Li X Y, Jiao L, et al. Advance in the formation and stabilization mechanisms of soil mineral-associated organic carbon (In Chinese)[J]. Journal of Soil and Water Conservation, 2023, 37(5): 12-23. [薛志婧, 李霄云, 焦磊, 等. 土壤矿质结合态有机碳形成及稳定机制的研究进展[J]. 水土保持学报, 2023, 37(5): 12-23.]
(  0) 0) |
| [24] |
Kögel-Knabner I, Guggenberger G, Kleber M, et al. Organo-mineral associations in temperate soils: Integrating biology, mineralogy, and organic matter chemistry[J]. Journal of Plant Nutrition and Soil Science, 2008, 171(1): 61-82.
(  0) 0) |
| [25] |
Totsche K U, Amelung W, Gerzabek M H, et al. Microaggregates in soils[J]. Journal of Plant Nutrition and Soil Science, 2018, 181(1): 104-136.
(  0) 0) |
| [26] |
Poeplau C, Don A, Six J, et al. Isolating organic carbon fractions with varying turnover rates in temperate agricultural soils – A comprehensive method comparison[J]. Soil Biology and Biochemistry, 2018, 125: 10-26.
(  0) 0) |
| [27] |
Cotrufo M F, Ranalli M G, Haddix M L, et al. Soil carbon storage informed by particulate and mineral-associated organic matter[J]. Nature Geoscience, 2019, 12: 989-994.
(  0) 0) |
| [28] |
Fang C M, Smith P, Moncrieff J B, et al. Similar response of labile and resistant soil organic matter pools to changes in temperature[J]. Nature, 2005, 433(7021): 57-59.
(  0) 0) |
| [29] |
Leifeld J, Fuhrer J. The temperature response of CO2 production from bulk soils and soil fractions is related to soil organic matter quality[J]. Biogeochemistry, 2005, 75(3): 433-453.
(  0) 0) |
| [30] |
Saidy A R, Smernik R J, Baldock J A, et al. Effects of clay mineralogy and Hydrous iron oxides on labile organic carbon stabilisation[J]. Geoderma, 2012, 173: 104-110.
(  0) 0) |
| [31] |
Benbi D K, Boparai A K, Brar K. Decomposition of particulate organic matter is more sensitive to temperature than the mineral associated organic matter[J]. Soil Biology and Biochemistry, 2014, 70: 183-192.
(  0) 0) |
| [32] |
Qin S Q, Fang K, Song Y T, et al. Linkage between temperature sensitivity of SOM decomposition and microbial communities depends on soil fractions[J]. Global Change Biology, 2024, 30(8): e17456.
(  0) 0) |
| [33] |
Chen Y J, Fang K, Qin S Q, et al. Spatial patterns and determinants of soil organic carbon component contents and decomposition rate in temperate grasslands of Nei Mongol, China[J]. Chinese Journal of Plant Ecology, 2023, 47(9): 1245-1255.
(  0) 0) |
| [34] |
Bai Y F, Cotrufo M F. Grassland soil carbon sequestration: Current understanding, challenges, and solutions[J]. Science, 2022, 377(6606): 603-608.
(  0) 0) |
| [35] |
Georgiou K, Jackson R B, Vindušková O, et al. Global stocks and capacity of mineral-associated soil organic carbon[J]. Nature Communications, 2022, 13(1): 3797.
(  0) 0) |
| [36] |
Sun Y F, Yang Y H, Zhao X, et al. Global patterns and climatic drivers of above- and belowground net primary productivity in grasslands[J]. Science China Life Sciences, 2021, 64(5): 739-751.
(  0) 0) |
| [37] |
Liu H, Li L H, Ren X M, et al. Effects of enclosure on plant community characteristics in West Ujimqin Grassland (In Chinese)[J]. Journal of Inner Mongolia Forestry Science and Technology, 2022, 48(1): 19-23. [刘欢, 李兰花, 任晓萌, 等. 围封对西乌珠穆沁草原植物群落特征的影响[J]. 内蒙古林业科技, 2022, 48(1): 19-23.]
(  0) 0) |
| [38] |
Joergensen R G. The fumigation-extraction method to estimate soil microbial biomass: Calibration of the kec value[J]. Soil Biology and Biochemistry, 1996, 28(1): 25-31.
(  0) 0) |
| [39] |
Lang M, Cai Z C, Chang S X. Effects of land use type and incubation temperature on greenhouse gas emissions from Chinese and Canadian soils[J]. Journal of Soils and Sediments, 2011, 11(1): 15-24.
(  0) 0) |
| [40] |
Six J, Conant R T, Paul E A, et al. Stabilization mechanisms of soil organic matter: Implications for C-saturation of soils[J]. Plant and Soil, 2002, 241(2): 155-176.
(  0) 0) |
| [41] |
Zimmermann M, Bird M I. Temperature sensitivity of tropical forest soil respiration increase along an altitudinal gradient with ongoing decomposition[J]. Geoderma, 2012, 187: 8-15.
(  0) 0) |
| [42] |
Benbi D K, Toor A S, Kumar S. Management of organic amendments in rice-wheat cropping system determines the pool where carbon is sequestered[J]. Plant and Soil, 2012, 360(1): 145-162.
(  0) 0) |
| [43] |
Bai T S, Wang P, Hall S J, et al. Interactive global change factors mitigate soil aggregation and carbon change in a semi-arid grassland[J]. Global Change Biology, 2020, 26(9): 5320-5332.
(  0) 0) |
| [44] |
Davidson E A, Janssens I A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change[J]. Nature, 2006, 440(7081): 165-173.
(  0) 0) |
| [45] |
Samal S K, Dwivedi S K, Rao K K, et al. Five years' exposure of elevated atmospheric CO2 and temperature enriched recalcitrant carbon in soil of subtropical humid climate[J]. Soil and Tillage Research, 2020, 203: 104707.
(  0) 0) |
| [46] |
Conant R T, Drijber R A, Haddix M L, et al. Sensitivity of organic matter decomposition to warming varies with its quality[J]. Global Change Biology, 2008, 14(4): 868-877.
(  0) 0) |
| [47] |
Kalbitz K, Solinger S, Park J H, et al. Controls on the dynamics of dissolved organic matter in soils: A review[J]. Soil Science, 2000, 165(4): 277-304.
(  0) 0) |
| [48] |
Karhu K, Auffret M D, Dungait J A J, et al. Temperature sensitivity of soil respiration rates enhanced by microbial community response[J]. Nature, 2014, 513: 81-84.
(  0) 0) |
| [49] |
Allison S D, Wallenstein M D, Bradford M A. Soil-carbon response to warming dependent on microbial physiology[J]. Nature Geoscience, 2010, 3: 336-340.
(  0) 0) |
| [50] |
Lützow M V, Kögel-Knabner I, Ekschmitt K, et al. Stabilization of organic matter in temperate soils: Mechanisms and their relevance under different soil conditions–a review[J]. European Journal of Soil Science, 2006, 57(4): 426-445.
(  0) 0) |
| [51] |
Cotrufo M F, Soong J L, Horton A J, et al. Formation of soil organic matter via biochemical and physical pathways of litter mass loss[J]. Nature Geoscience, 2015, 8: 776-779.
(  0) 0) |
| [52] |
Zhao M X, Zhang X, Yang F, et al. Response of organic carbon mineralization of paddy soil with different planting years to temperature in loess area of central of Northern Shaanxi Province (In Chinese)[J]. Agricultural Research in the Arid Areas, 2024, 42(2): 41-52. [赵满兴, 张霞, 杨帆, 等. 陕北中部黄土区不同种植年限水稻田有机碳矿化对温度的响应[J]. 干旱地区农业研究, 2024, 42(2): 41-52.]
(  0) 0) |
| [53] |
Lü H J, He H B, Zhang X D. The options of conditions on ultrasonic dispersion and centrifugal separation in soil particle size fractionation (In Chinese)[J]. Chinese Journal of Soil Science, 2012, 43(5): 1126-1130. [吕慧捷, 何红波, 张旭东. 土壤颗粒分级过程中超声破碎和离心分离的条件选择[J]. 土壤通报, 2012, 43(5): 1126-1130.]
(  0) 0) |
| [54] |
Castellano M J, Mueller K E, Olk D C, et al. Integrating plant litter quality, soil organic matter stabilization, and the carbon saturation concept[J]. Global Change Biology, 2015, 21(9): 3200-3209.
(  0) 0) |
| [55] |
Kleber M, Eusterhues K, Keiluweit M, et al. Mineral–organic associations: Formation, properties, and relevance in soil environments . Advances in Agronomy Amsterdam: Elsevier, 2015: 1-140.
(  0) 0) |
| [56] |
Averill C, Waring B. Nitrogen limitation of decomposition and decay: How can it occur?[J]. Global Change Biology, 2018, 24(4): 1417-1427.
(  0) 0) |
| [57] |
Schimel J P, Weintraub M N. The implications of exoenzyme activity on microbial carbon and nitrogen limitation in soil: A theoretical model[J]. Soil Biology and Biochemistry, 2003, 35(4): 549-563.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


