2. 土壤与农业可持续发展全国重点实验室(中国科学院南京土壤研究所), 南京 211135
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China
土壤有机碳(SOC)是陆地生态系统中最大的碳库[1],其碳储量约为1 500~2 400 Pg,是大气碳储量的两倍[2],对气候变化背景下的全球碳循环有重要影响。在SOC的形成过程中,植物凋落物与根系分泌物进入土壤后,经过微生物分解和合成代谢,部分转化为微生物量碳。在微生物死亡后,细胞碎片、胞外物质等会在下一代微生物利用中幸存下来,与土壤矿物结合,最终形成微生物残体碳[3]。微生物残体碳能够长期储存在土壤中,是土壤稳定碳库重要组成部分,大约占SOC的30%~62%[4],其微小变化可能对大气二氧化碳含量产生持久影响[5]。因此,探讨微生物残体碳稳定性的全球分布规律与调控因素对于理解陆地与大气碳循环和应对气候变化至关重要[6]。
微生物残体碳主要由真菌残体碳(Fungal necromass carbon,FNC)和细菌残体碳(Bacterial necromass carbon,BNC)组成。通常而言,FNC较BNC更加稳定。一方面,真菌残体碳较细菌残体碳拥有更复杂的碳分子结构。例如,真菌菌丝会转化为单宁和黑色素等稳定的复合物,它们更容易与土壤矿物组分相结合,从而促进真菌残体碳在土壤中的固存[7]。另一方面,细菌细胞壁中含有更高比例的肽类等富氮物质[8],导致细菌残体的C/N(平均值为4)远低于真菌残体的C/N(平均值为10)。微生物的生物合成与细胞增殖需要大量氮元素,为了满足其氮需求,微生物倾向于优先分解C/N比低的底物[9],使得BNC较FNC面临更多的微生物分解威胁。因此,FNC与BNC的比例(FNC/BNC)可以作为反映微生物残体碳稳定性的重要指标。一般土壤中FNC/BNC值越高,表明土壤中的微生物残体碳越稳定,对于评估SOC库的稳定性具有重要指征作用。
微生物残体碳稳定性通常会受到多种因素的影响。首先,生态系统类型对微生物残体碳稳定性有直接影响。与农田相比,森林生态系统中的植物残体更丰富,促进了对植物残体分解能力更强的真菌残体积累,导致微生物残体碳稳定性更高[10]。其次,植被变化也会影响微生物残体碳稳定性[11]。例如,将马尾松林改造为混交林后,20~40 cm层土壤中的FNC/BNC值显著降低[12]。气候条件通过影响土壤温度、湿度和养分状况,进而影响微生物群落的组成与功能,在调控微生物残体碳稳定性方面起到关键作用[13]。在湿润气候区,土壤微生物群落一般以真菌为主导,土壤矿物会封存更多的FNC,导致土壤中的微生物残体碳更稳定[14]。最后,人为干预因素,如生物质炭用量的增加,也会引起土壤SOC、TN、TP的变化,使FNC/BNC值从2.56降低至2.26[15]。这些研究多基于站点级别的实验,对全球尺度上微生物残体碳稳定性的理解往往需要从更大空间尺度进行综合分析[16]。因此,综合区域和全球尺度的微生物残体碳稳定性的研究,对于深入理解气候变暖背景下微生物残体碳对土壤碳动态的影响具有重要意义。
本研究利用全球范围内收集的1 791个土壤样本的氨基糖含量数据(微生物残体标志物),结合机器学习和地理信息技术,通过计算FNC/BNC,表征了微生物残体碳稳定性在全球尺度上的分布。通过整合不同区域的土壤样本数据,分析气候条件、土壤养分和微生物生物量对微生物残体碳稳定性的影响,识别了影响微生物残体碳稳定性的潜在驱动因素。本研究促进了对全球微生物残体碳稳定性的理解,为制定基于残体稳定性有机碳的保护与提升土壤管理策略提供了理论支持。
1 材料与方法 1.1 数据收集利用中国国家知识基础设施数据库(http://www.cnki.net)、Web of Science (http://apps.webofknowledge.com)和Google Scholar(https://scholar.Google.com),通过以下关键词:“土壤微生物残体碳”、“土壤氨基糖”检索了2024年10月1日前发表的论文。为了避免选择偏差,根据以下标准对数据进行筛选:(1)论文应同时报道氨基葡萄糖(GlcN)和胞壁酸(MurA)含量;(2)只纳入0~30 cm的表层土壤数据,不涉及凋落物和底层土壤数据;(3)仅选择对照组或未受干扰处理组的数据。最后,从符合标准的215篇论文中提取了1 791个观测值,同时对论文中的以下变量进行提取:地理位置(经度Longitude、纬度Latitude、海拔Elevation)、气候信息(年均温MAT、年降雨量MAP、潜在蒸发量PET)、土壤有机碳(SOC)、全氮(TN)、全磷(TP)、碳氮比(C︰N)、微生物生物量碳(MBC)、微生物生物量氮(MBN)、pH以及土壤质地(砂土Sand、粉土Silt、黏土Clay)。
对于部分研究中未报道的变量,通过以下全球数据库进行数据补充:使用分辨率为0.083°的全球土壤网格数据库(http://globalchange.bnu.edu.cn/research/soilw)补充土壤属性数据;基于ORNL DAAC生物地球化学动力学数据库(https://daac.ornl.gov/)补充MBC和MBN;MAT和MAP来源于GLDAS全球陆地数据同化系统(https://ldas.gsfc.nasa.gov/gldas),分辨率为0.083°。对于文中以图表形式呈现的数据,使用Engauge Digitiser(v11.2)和GetData Graph Digitizer 2.25(http://getdata-graph-digitizer.com)提取并数字化。
1.2 机器学习模型建立本研究对Ecosystem type进行one-hot编码,将每一个分类转变为0~1的向量。由于不同文献使用的土壤表层深度不同,而这些土层的微生物残体碳含量的差异很大,不具有可比性。为了克服这个问题,本研究将采样深度区间的均值,作为连续变量—采样深度(Depth)纳入模型,尽可能避免离散的深度区间带来的影响。最后,本研究将GlcN和MurA作为因变量,将纬度、海拔、MAT、MAP、Depth、PET、SOC、TN、TP,MBC、MBN、pH、C︰N、C︰P、N︰P、Sand、Silt和Clay作为自变量,并以8:2的比例随机将数据分为训练集和测试集。使用7种经典的机器学习模型(Random Forest,CatBoost,LightGBM,XGBoost,Auto-Sklearn,Deep Forest,Multi-Layer Perceptron)和3种神经网络模型(Convolutional Neural Network,Residual Network,FT-Transformer),对MurA和GlcN的训练集进行建模。使用Python的Optuna库中的贝叶斯算法对模型的超参数组合进行优化[17-18],最后从测试集中选择R2最大、均方误差(Mean Squared Error,MSE)最小的模型作为最优模型。
经过验证,本模型能够有效地统一不同深度的数据,并在测试集验证中展现了可靠的预测精度。其中Deep Forest和FT-Transformer的模型分别为预测MurA和GlcN的最优模型,R2分别为0.81和0.94。最后,模型中固定了15 cm的采样深度,并使用该深度进行0~30 cm表层土壤中GlcN与MurA含量的预测,更具体的训练和预测步骤请详见前人的研究[19]。
1.3 微生物残体碳含量与残体碳稳定性计算氨基糖是土壤微生物细胞壁的主要组成部分,具有稳定性和微生物异源性,可作为追踪微生物残体碳的生物标志物。其中,GlcN主要来源于真菌细胞壁的几丁质,同时也在细菌细胞壁中发现,而MurA仅来源于细菌细胞壁的肽聚糖[20]。因此,本研究根据以下经验公式量化BNC和FNC的含量[19]:
| $ C_{\text {Bacterial necromass }}=\text { MurA } \times 31.3 $ | (1) |
| $ C_{\text {Fungal necromass }}=(\mathrm{GlcN}-1.16 \times \mathrm{MurA}) \times 10.8 $ | (2) |
| $ C_{\text {Microbial necromass }}=C_{\text {Bacterial necromass }}+C_{\text {Fungal necromass }} $ | (3) |
| $ \text { 微生物残体碳稳定性 }=C_{\text {Fungal necromass }} / C_{\text {Bacterial necromass }} $ | (4) |
式中,CMicrobial necromass为微生物残体碳含量;CFungal necromass为真菌残体碳含量;CBacterial necromass为细菌残体碳含量;31.3为MurA计算BNC的转化系数;1.16、10.8分别为MurA、GlcN的转化系数。
1.4 数据分析采用R语言(4.2.1;http://www.r-project.org/)进行统计分析。利用R语言中ggplot2包分析并绘制6个生态系统、5个气候带以及5个干旱指数区域中FNC、BNC与微生物残体碳稳定性的差异性对比图。利用R语言中RandomForest包中随机森林模型对生态系统以及气候带分别计算统计,得到各分类中影响因子重要性排序。利用偏最小二乘法路径模型(PLS-PM)构建结构方程模型,以解释各路径中重要性占比,获取各通路解释率R2和拟合优度指数GOF。
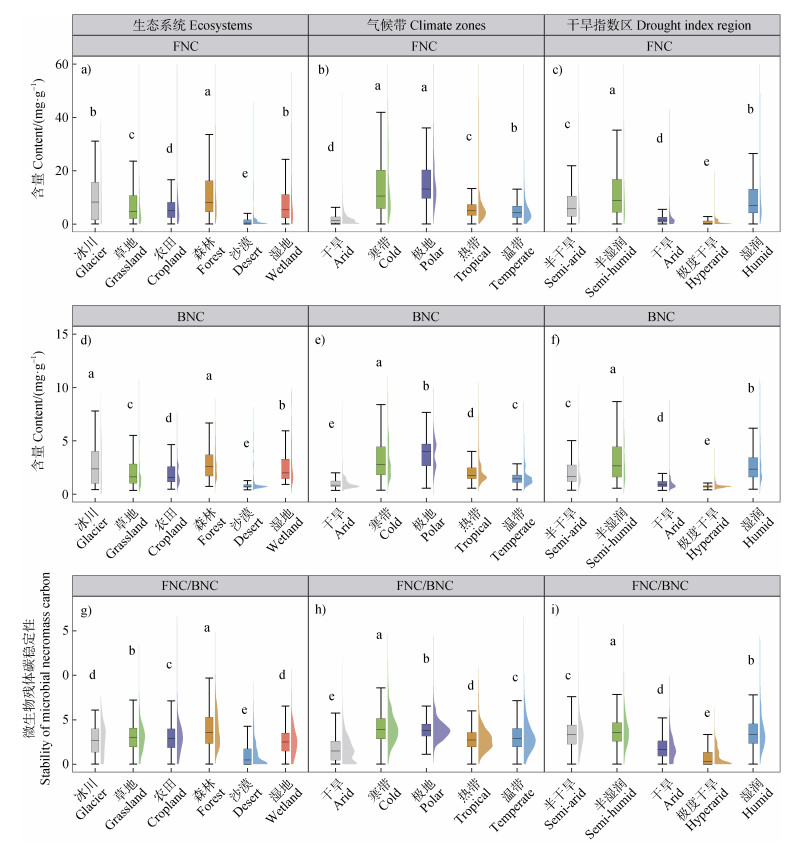
2 结果 2.1 微生物残体碳稳定性的全球分布特征微生物残体碳稳定性的全球平均值为3.09。在生态系统分类中,森林和草地的FNC/BNC平均值分别为3.94和3.12,均高于全球平均值。相对而言,冰川、农田、沙漠和湿地的FNC/BNC平均值分别为2.67、3.03、1.09和2.57,低于全球平均值(表 1,图 1g)。在气候带分类中,温带(3.13)、寒带(4.14)和极地带(3.95)的FNC/BNC平均值也高于全球平均值,而热带(2.83)和干旱带(1.69)的FNC/BNC平均值则低于全球平均值(表 1,图 1h)。在干旱指数区域分类中,半干旱地区(3.40)、半湿润地区(3.77)和湿润地区(3.61)的FNC/BNC平均值也高于全球平均值,而干旱地区(1.84)和极度干旱地区(0.75)的FNC/BNC平均值则低于全球平均值(表 1,图 1i)。研究表明,沙漠等干旱区域中FNC/BNC值受到水分缺失的影响,各分类中均处于最低值(图 1g-图 1i)。FNC差异性最大,是影响微生物残体碳稳定性的重要因素(表 1)。
|
|
表 1 全球尺度微生物残体碳稳定性和含量统计 Table 1 Statistics on the stability and content of microbial necromass carbon at the global scale |
|
注:图中不同字母表示各类别之间差异性关系,相同字母表示两者之间差异性不显著,不同字母表示两者之间差异性显著。 Note:In the figure,different letters indicate significant differences between categories,while the same letters indicate that there is no significant difference between the two. 图 1 不同生态系统、气候带以及干旱指数区微生物残体碳稳定性差异 Fig. 1 The difference in stability and FNC and BNC concentration of microbial necromass carbon in different ecosystems, climatic zones and drought index regions |
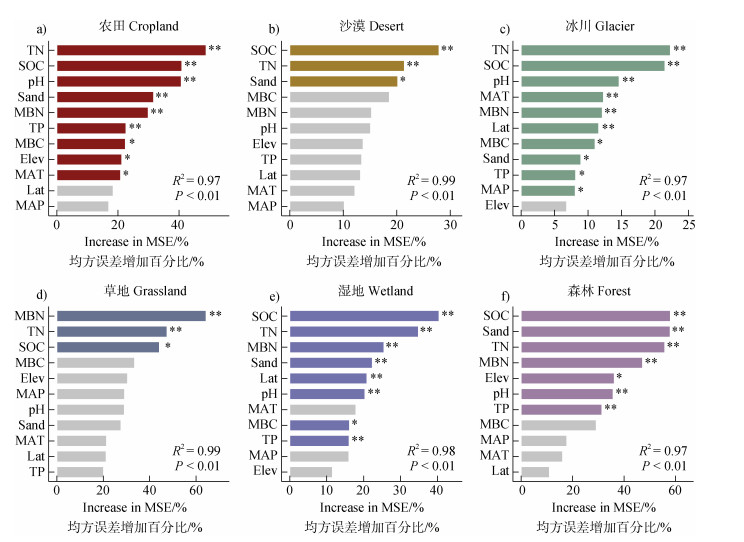
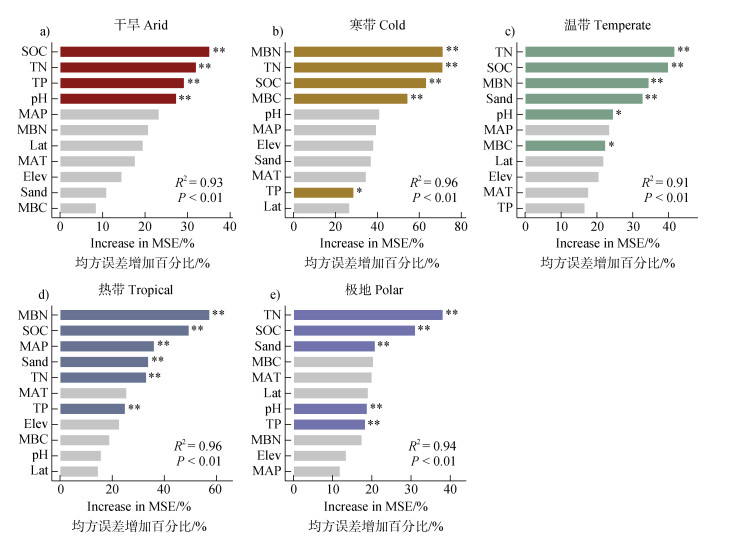
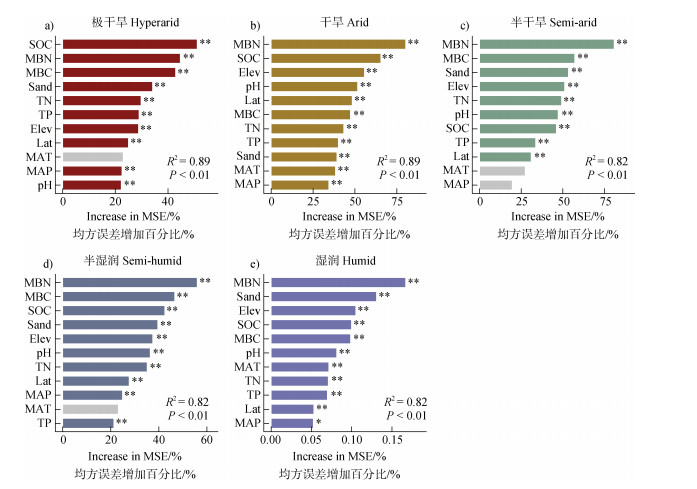
随机森林模型结果显示,微生物残体碳稳定性的主要影响因素在不同生态系统和气候带中存在差异(图 2-图 4)。在所有生态系统中,SOC、TN和MBN是微生物残体碳最重要的驱动因素(图 2a-图 2c,图 2e)。在不同气候带中,SOC、TN以及MBN仍然是微生物残体碳稳定性最重要的驱动因素,且SOC、TN在干旱,极地以及温带气候带中的重要性排在首位(图 3a,图 3c,图 3e)。在不同干旱指数区域中,MBN是影响微生物残体碳稳定性的最主要因素,其次为SOC、TN(图 4b-图 4e)。
|
注:MAT:年均温,MAP:年降雨量,SOC:土壤有机碳,TN:全氮,TP:全磷,MBC:微生物生物量碳,MBN:微生物生物量氮,Sand:砂粒,Lat:纬度,Elev:海拔;**表示P<0.01,*表示P<0.05。下同。 Note:MAT:Mean Annual Temperature,MAP:Mean Annual Precipitation,SOC:Soil Organic Carbon,TN:Total Nitrogen,TP:Total Phosphorus,MBC:Microbial Biomass Carbon,MBN:Microbial Biomass Nitrogen,Sand:Sand Content,Lat:Latitude,Elev:Elevation;** indicates P < 0.01,* indicates P < 0.05. The same below. 图 2 不同生态系统中环境因子对微生物残体碳稳定性的特征重要性排序 Fig. 2 Ranking of feature importance for environmental factors influencing microbial necromass carbon stability across different ecosystems |
|
图 3 不同气候带中环境因子对微生物残体碳稳定性的特征重要性排序 Fig. 3 Ranking of feature importance for environmental factors influencing microbial necromass carbon stability across different climate zones |
|
图 4 不同干旱指数区域中环境因子对微生物残体碳稳定性的特征重要性排序 Fig. 4 Ranking of feature importance for environmental factors influencing microbial necromass carbon stability across different drought index regions |
PLS-PM模型的结果表明,微生物残体碳稳定性受气候属性、土壤养分状况和土壤微生物生物量的共同调控,这三者对微生物残体碳稳定性的总解释率达到了55%(图 5a)。具体而言,MAT、MAP、PET与土壤养分状况和微生物生物量之间存在负相关关系,路径系数分别为–0.47、–0.44;土壤养分状况,如SOC、TN、TP和土壤微生物生物量、土壤微生物残体碳含量呈正相关,路径系数分别为0.83与0.15。土壤微生物残体碳含量与微生物残体碳稳定性也呈正相关关系。总体而言,微生物残体碳稳定性随MAT、MAP、PET的增加而降低,其路径系数为–0.37,而SOC、TN、TP的增加共同提高了微生物残体碳稳定性,总效应达到0.63(图 5b)。
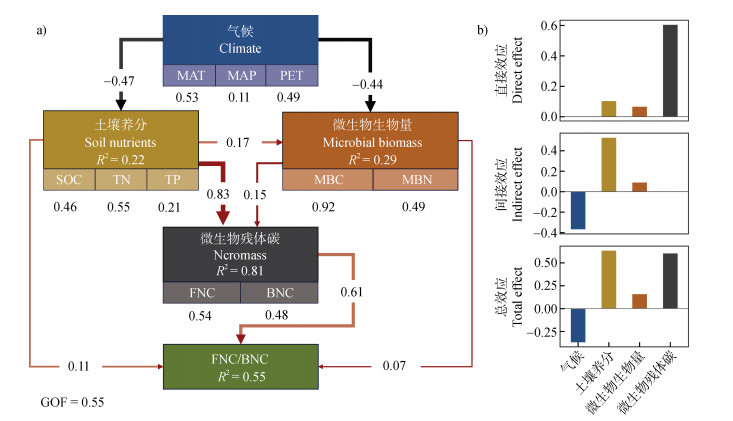
|
注:图中红色箭头代表正效应关系,黑色箭头代表负相关关系。效应越高,其箭头越粗。GOF为评估模型拟合优度。最终标准化总效应结果为直接影响加上间接影响。 Note:In the image,red arrows represent positive effect relationships,while black arrows indicate negative correlations. The thicker the arrow,the higher the effect. The model fit is assessed using the GOF value. The final standardized total effect result is the sum of direct and indirect effects. 图 5 偏最小二乘路径模型和各因子对微生物残体碳稳定性的标准化总效应 Fig. 5 Partial least squares path model and normalized total effects of each factor on the stability of microbial necromass carbon |
在不同生态系统中,微生物残体碳稳定性的分布存在显著差异(图 1g)。沙漠土壤中的平均FNC/BNC比值在所有生态系统中最低(表 1),这可能由多种因素导致。首先,沙漠环境中营养匮乏且土壤含水率低,导致植物细根生物量与根系沉积物偏低[21],直接抑制了FNC的积累。其次,沙漠中周期性降雨能显著改变土壤环境,使土壤中MBC/MBN值变化波动较大,可能促进BNC的累积,使微生物残体碳稳定性整体偏低[22]。最后,由于真菌在资源获取上依赖于菌丝的扩展,而干旱限制了以上过程,导致真菌在养分竞争中处于劣势[23]。因此,在干旱条件下,微生物残体碳稳定性低主要是由于FNC的相对更大损失所致。
在所有生态系统中,森林生态系统不仅FNC和BNC的含量最高,其FNC/BNC比值也是最高的(图 1a,图 1d,图 1g)。这可能是由于真菌对森林中结构较复杂的植物残体碳具有更强的代谢能力。此外,森林生态系统中丰富的SOC、TN、TP和适宜的温度条件也促进了真菌的生长[24]。农田土壤中的FNC/BNC值也相对偏高(图 1g,表 1),这可能是人为因素(例如施肥等活动)所导致。首先,真菌残体具有更高的稳定性以及更长的周转时间。相比之下,尽管细菌能够快速生长,但由于细菌细胞壁成分相对简单,其残体更容易被微生物分解,长期积累来看,BNC积累量仍相对较低[25]。其次,施肥可以改变土壤微生物群落结构,增加真菌的相对丰度。长期施肥后,土壤中真菌的生物量和多样性显著增加,而细菌的相对丰度变化较小[26],提高FNC对SOC的贡献。最后,在施肥条件下,BNC的积累可能受到限制。例如,丛枝菌根真菌(AMF)与植物形成共生关系后,会限制细菌的营养获取[27],导致BNC的积累减少。
寒冷的气候使得土壤微生物呼吸作用较弱,而真菌残体相对于细菌残体更难被微生物分解,因此更容易在土壤中累积,导致FNC比例较高。高纬度地区(如针叶林)的凋落物通常富含木质素、纤维素等难降解的有机物质,而真菌在分解这些复杂化合物方面具有显著优势,能够分泌多种胞外酶(如木质素过氧化物酶、纤维素酶等),从而在凋落物分解中占据主导地位[28]。此外,真菌的广泛菌丝网络使其在低温、低养分条件下表现出更强的适应性,而细菌则更依赖于快速吸收可溶性有机碳,这种生态位分化进一步促进了真菌残体的积累[29]。最后,高纬度地区的低温、低pH和高湿度等环境条件也更有利于真菌的生长和残体积累,导致真菌残体(如几丁质)较细菌残体(如肽聚糖)更难被分解,从而在土壤中长期保存[30]。综上所述,高纬度地区FNC比例较高是凋落物特征、真菌与细菌的生态位分化、环境条件以及微生物残体碳稳定性等多种因素共同作用的结果。
3.2 微生物残体碳稳定性影响因素为整体评估土壤环境因素对微生物残体碳稳定性的影响,本研究构建了以气候,土壤养分与微生物生物量为主要因素的结构方程模型(图 5a)。气候条件与土壤养分、微生物生物量之间的负相关关系可能源于气候条件对土壤生态过程的直接影响。例如,极端气候条件通过减少植被覆盖和根系分泌物输入,间接降低土壤有机质和微生物生物量。川西平原的研究进一步支持了这一发现,MAT增加显著降低了土壤MBC和MBN[31]。微生物残体碳稳定性与MAT,PET呈显著负相关,表明在温度或蒸发量较高的气候条件下,高温和低湿度加速了有机质
分解和微生物活动,降低了微生物残体碳稳定性[32]。微生物残体碳稳定性与土壤养分因素呈显著正相关,表明在养分丰富的土壤中,充足的养分供应促进了微生物群落的稳定性和有机质的积累[33],提高了微生物残体碳稳定性。这与前人研究中SOC、TN、TP和微生物生物量促进微生物残体碳积累的结果相吻合[34]。这可能是因为在养分资源充足的土壤中,微生物营养来源广泛[35],对微生物残体碳的分解相对较少,而在资源匮乏地区,微生物难以获取充分的营养来源,倾向于分解利用土壤中原有的微生物残体碳。因此,土壤底物中的SOC、TN、TP含量可能会影响微生物对微生物残体碳的再次利用,进而影响微生物残体碳稳定性。
基于Meta分析与随机森林,本研究在全球尺度上对微生物残体碳稳定性进行了研究。然而,本研究主要集中在微生物残体碳的总量分析,未深入探讨微生物残体碳中不同的化学组分在土壤中的具体稳定性机制,未充分考虑土壤矿物对微生物残体碳的保护作用对残体稳定性的影响。此外,研究结果依赖于数据质量和变量选择,存在一定的局限性。不同土层的微生物残体碳含量存在差异[36],未来的研究,应更多地收集纳入相同土层数据,以提高数据与模型的准确性,提高结果可信度。
4 结论基于Meta分析与机器学习,微生物残体碳稳定性在不同生态系统、不同气候带以及不同干旱指数区域中存在显著差异。在三种分类方法中水分因素影响很大:在水分缺失的区域,微生物残体碳稳定性较低;而在水分较为充裕的地区,如半湿润地区,FNC的含量明显高于BNC,微生物残体碳的稳定性较高。此外,气候与土壤养分在调控微生物残体碳稳定性方面发挥了关键作用。年均温与蒸发量的增加通过抑制土壤养分和微生物生物量的积累降低了微生物残体碳稳定性,而土壤有机碳、全氮、全磷的增加促进了FNC和BNC的累积,直接或者间接地提高微生物残体碳稳定性。未来,应重点关注年均温,年蒸发量过高导致微生物残体碳稳定性过低的区域,通过合理的施肥以及人工干预降雨等手段提高土壤养分,以促进微生物残体碳的积累,增强土壤碳库对气候变化和环境压力的适应能力。
| [1] |
Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528(7580): 60-68.
(  0) 0) |
| [2] |
Stockmann U, Adams M A, Crawford J W, et al. The knowns, known unknowns and unknowns of sequestration of soil organic carbon[J]. Agriculture, Ecosystems & Environment, 2013, 164: 80-99.
(  0) 0) |
| [3] |
Witzgall K, Vidal A, Schubert D I, et al. Particulate organic matter as a functional soil component for persistent soil organic carbon[J]. Nature Communications, 2021, 12(1): 4115.
(  0) 0) |
| [4] |
Schweigert M, Herrmann S, Miltner A, et al. Fate of ectomycorrhizal fungal biomass in a soil bioreactor system and its contribution to soil organic matter formation[J]. Soil Biology and Biochemistry, 2015, 88: 120-127.
(  0) 0) |
| [5] |
Whalen E D, Grandy A S, Sokol N W, et al. Clarifying the evidence for microbial- and plant-derived soil organic matter, and the path toward a more quantitative understanding[J]. Global Change Biology, 2022, 28(24): 7167-7185.
(  0) 0) |
| [6] |
Zhang B, Chen Q, Ding X L, et al. Research progress on accumulation, turnover and stabilization of microbial residues in soil (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(6): 1479-1491. DOI:10.11766/trxb202012270705 [张彬, 陈奇, 丁雪丽, 等. 微生物残体在土壤中的积累转化过程与稳定机理研究进展[J]. 土壤学报, 2022, 59(6): 1479-1491.]
(  0) 0) |
| [7] |
Fernandez C W, Langley J A, Chapman S, et al. The decomposition of ectomycorrhizal fungal necromass[J]. Soil Biology and Biochemistry, 2016, 93: 38-49.
(  0) 0) |
| [8] |
See C R, Keller A B, Hobbie S E, et al. Hyphae move matter and microbes to mineral microsites: Integrating the hyphosphere into conceptual models of soil organic matter stabilization[J]. Global Change Biology, 2022, 28(8): 2527-2540.
(  0) 0) |
| [9] |
Hu H, Chen J, Zhou F, et al. Relative increases in CH4 and CO2 emissions from wetlands under global warming dependent on soil carbon substrates[J]. Nature Geoscience, 2024, 17(1): 26-31.
(  0) 0) |
| [10] |
Wang B, An S, Liang C, et al. Microbial necromass as the source of soil organic carbon in global ecosystems[J]. Soil Biology and Biochemistry, 2021, 162: 108422.
(  0) 0) |
| [11] |
Zhang Y C, Wang P, Liu Y L, et al. Effects of long-term crop cultivation on soil organic carbon in China's farmland: A meta-analysis (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(6): 1628-1638. DOI:10.11766/trxb202308230339 [张迎春, 王萍, 刘亚龙, 等. 长期种植作物对中国农田土壤有机碳影响的Meta分析[J]. 土壤学报, 2024, 61(6): 1628-1638.]
(  0) 0) |
| [12] |
Qin Z K, Liu R H, He P, et al. Effects of mixed broadleaved tree species with pure Pinus massoniana plantation on soil microbial necromass carbon and organic carbon fractions. Chinese Journal of Applied Ecology, 2024, 35(1): 141—152.[覃振凯, 刘润红, 何鹏, 等. 马尾松纯林混交改造对土壤微生物残体碳和有机碳组分的影响. 应用生态学报, 2024, 35(1): 141—152.]
(  0) 0) |
| [13] |
Huang W G, Ni H W, Huang R L, et al. Driving mechanism of soil organic carbon response to increase hydrothermal conditions in different climatic regimes (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(5): 1260-1270. DOI:10.11766/trxb202305220077 [黄伟根, 倪浩为, 黄瑞林, 等. 不同气候条件下土壤有机碳水热响应驱动机制研究[J]. 土壤学报, 2024, 61(5): 1260-1270.]
(  0) 0) |
| [14] |
Strickland M S, Rousk J. Considering fungal: bacterial dominance in soils – Methods, controls, and ecosystem implications[J]. Soil Biology and Biochemistry, 2010, 42(9): 1385-1395.
(  0) 0) |
| [15] |
Chen Z, He L, Ma J, et al. Long-term successive biochar application increases plant lignin and microbial necromass accumulation but decreases their contributions to soil organic carbon in rice–wheat cropping system[J]. GCB Bioenergy, 2024, 16(6): e13137.
(  0) 0) |
| [16] |
Guerra C A, Heintz-Buschart A, Sikorski J, et al. Blind spots in global soil biodiversity and ecosystem function research[J]. Nature Communications, 2020, 11(1): 3870.
(  0) 0) |
| [17] |
Wu J, Chen X Y, Zhang H, et al. Hyperparameter optimization for machine learning models based on Bayesian optimization[J]. Journal of Electronic Science and Technology, 2019, 17(1): 26-40.
(  0) 0) |
| [18] |
Joy T T, Rana S, Gupta S, et al. Fast hyperparameter tuning using Bayesian optimization with directional derivatives[J]. Knowledge-Based Systems, 2020, 205: 106247.
(  0) 0) |
| [19] |
Hu J, Du M, Chen J, et al. Microbial necromass under global change and implications for soil organic matter[J]. Global Change Biology, 2023, 29(12): 3503-3515.
(  0) 0) |
| [20] |
Joergensen R G. Amino sugars as specific indices for fungal and bacterial residues in soil[J]. Biology and Fertility of Soils, 2018, 54(5): 559-568.
(  0) 0) |
| [21] |
Villarino S H, Pinto P, Jackson R B, et al. Plant rhizodeposition: A key factor for soil organic matter formation in stable fractions[J]. Science Advances, 2021, 7(16): eabd3176.
(  0) 0) |
| [22] |
Xu H, He M Z, Tang L, et al. Response of changes of microbial biomass carbon and nitrogen to precipitation in desert soil (In Chinese)[J]. Acta Ecologica Sinica, 2020, 40(4): 1295-1304. [许华, 何明珠, 唐亮, 等. 荒漠土壤微生物量碳、氮变化对降水的响应[J]. 生态学报, 2020, 40(4): 1295-1304.]
(  0) 0) |
| [23] |
Li W, Liu Y, Guo Z, et al. Divergent control and variation in bacterial and fungal necromass carbon respond to the abandonment of rice terraces[J]. Journal of Environmental Management, 2023, 344: 118617.
(  0) 0) |
| [24] |
Konôpka B, Lukac M. Moderate drought alters biomass and depth distribution of fine roots in Norway spruce[J]. Forest Pathology, 2013, 43(2): 115-123.
(  0) 0) |
| [25] |
Tang Z, Feng J, Chen L, et al. Coupling amendment of microbial and compound fertilizers increases fungal necromass carbon and soil organic carbon by regulating microbial activity in flue-cured tobacco-planted field[J]. European Journal of Soil Biology, 2023, 117: 103518.
(  0) 0) |
| [26] |
Liu D, Zhou Z, Iqbal S, et al. Fungal necromass contribution to carbon sequestration in global croplands: A meta-analysis of driving factors and conservation practices[J]. Science of the Total Environment, 2024, 949: 174954.
(  0) 0) |
| [27] |
Zhou J, Bilyera N, Guillaume T, et al. Microbial necromass and glycoproteins for determining soil carbon formation under arbuscular mycorrhiza symbiosis[J]. Science of the Total Environment, 2024, 955: 176732.
(  0) 0) |
| [28] |
Yang N, Zhou C, Li Y, et al. Microbial specialists in high-altitude forest soils: environmental sensitivity and ecological significance[J]. Frontiers of Environmental Science & Engineering, 2024, 19(3): 30.
(  0) 0) |
| [29] |
Ni H, Jing X, Xiao X, et al. Microbial metabolism and necromass mediated fertilization effect on soil organic carbon after long-term community incubation in different climates[J]. The ISME Journal, 2021, 15(9): 2561-2573.
(  0) 0) |
| [30] |
Zhang Y, Chen J, Du M, et al. Metagenomic insights into microbial variation and carbon cycling function in crop rotation systems[J]. Science of the Total Environment, 2024, 947: 174529.
(  0) 0) |
| [31] |
Wu X L, Zhang S R, Pu Y L, et al. Distribution characteristics and impact factors of soil microbial biomass carbon, nitrogen and phosphorus in western Sichuan plain (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2019, 27(10): 1607-1616. [吴晓玲, 张世熔, 蒲玉琳, 等. 川西平原土壤微生物生物量碳氮磷含量特征及其影响因素分析[J]. 中国生态农业学报, 2019, 27(10): 1607-1616.]
(  0) 0) |
| [32] |
Guo X, Zhou X, Hale L, et al. Climate warming accelerates temporal scaling of grassland soil microbial biodiversity[J]. Nature Ecology & Evolution, 2019, 3(4): 612-619.
(  0) 0) |
| [33] |
Rofner C, Peter H, Catalán N, et al. Climate-related changes of soil characteristics affect bacterial community composition and function of high altitude and latitude lakes[J]. Global Change Biology, 2017, 23(6): 2331-2344.
(  0) 0) |
| [34] |
Jansson J K, Hofmockel K S. Soil microbiomes and climate change[J]. Nature Reviews Microbiology, 2020, 18(1): 35-46.
(  0) 0) |
| [35] |
Dal Bello M, Lee H, Goyal A, et al. Resource–diversity relationships in bacterial communities reflect the network structure of microbial metabolism[J]. Nature Ecology & Evolution, 2021, 5(10): 1424-1434.
(  0) 0) |
| [36] |
Deng S, Wang Q, Wang D, et al. The accumulation capacity of microbial residues in the rhizosphere increased along an elevation gradient[J]. Catena, 2024, 238: 107891.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


