农业生产中,氮素不仅是作物生长所必需的营养元素,更是制约其生产力发展的关键因素[1]。土壤氮素多以有机物形式存在,而作物主要吸收无机氮(硝态氮和铵态氮)。因此,有机氮矿化一直是土壤学和环境科学等领域研究的热点与难点[2]。土壤有机物根据其存在状态可分为颗粒有机物和矿物伴生有机物[3]。作为单一最大的有机氮库,蛋白质对土壤矿物有很强亲和力,能形成矿物伴生有机氮[4]。矿物质可阻碍微生物分泌的胞外酶对伴生有机氮水解,但相比颗粒有机氮,矿物伴生有机氮营养更丰富,分解活化能更低[3-5]。因此,矿物伴生有机氮虽被认为是惰性氮源,但其周转可能是植物所需氮的重要来源[3,6]。
微生物活动一直被认为是影响土壤有机氮矿化的主要因子[2],但非生物作用在有机氮矿化中也做出了不可忽视的贡献[6-7]。大量研究表明,土壤有机物与活性金属氧化物间的吸附反应并不是有机物的最终归宿,而是两者之间进一步反应的条件[8]。锰氧化物广泛存在于土壤中且具有较高吸附与氧化还原活性,其可能是有机质氧化的一个特别重要的驱动因子[9]。大量研究[10-12]发现,在北方和温带土壤中,有机质氧化速率与锰(Mn)含量之间存在很强的正相关关系。在好氧条件下,Mn可在湿地、泥炭地森林、农田等多种土壤系统中介导大分子氧化分解[13]。同时,蛋白质与土壤矿物模拟矿化实验以及分子动力学计算证实,蛋白质能够被锰氧化物解离,形成碎片残基[14-16]。土壤中与矿物结合的有机氮库规模巨大,因此即使小部分矿物伴生有机氮通过非生物作用矿化,也可在作物氮吸收中发挥重要作用[4]。目前尚未系统性研究锰氧化物介导下有机氮非生物矿化的界面反应过程和机制,探明上述问题有利于认识和掌握锰氧化物介导下有机氮的矿化量与矿化速率。
锰氧化物可通过多种途径如直接电子转移、催化以及生成中间产物(如活性氧物种和Mn(Ⅲ))分解有机物[8]。直接氧化过程一般被认为是土壤有机物氧化、转化和矿化的重要途径之一,主要涉及有机物吸附于矿物表面、电子转移至矿物宿主金属、被还原的金属离子和被氧化的有机分子释放至环境中[8]。在催化过程中,锰氧化物可通过直接键合、与有机物表面羟基反应以及氧气存在下的异相氧化来改变有机物的结构和电子态[16-17]。锰氧化物还可通过与矿物表面缺陷位点上吸附的水和氧气反应生成活性氧物种,这是土壤有机物转化中重要但尚未引起足够重视的参与者[18]。上述途径对锰氧化物介导下有机氮非生物矿化过程的影响与贡献仍需进行深入研究。
土壤中与矿物结合的有机态氮储库量巨大,其分解过程在调控陆地生态系统氮素生物有效性方面具有关键作用[4];即使仅有少量矿物结合态有机氮发生非生物矿化,仍能促进作物对氮素的吸收利用。这种非生物转化过程作为土壤氮循环的重要环节,其研究突破将深化对土壤有机氮矿化路径的理解。因此,本研究选取典型锰氧化物,通过模拟矿化实验,探明其影响有机氮矿化的过程与机制;将焦磷酸钠(Na-PP)作为Mn(Ⅲ)捕获剂,探究活性中间体Mn(Ⅲ)对二氧化锰与蛋白胨相互作用的影响;利用电子顺磁共振光谱仪(EPR)等关键技术与检测手段分析反应体系中产生的活性氧物种。本研究结果可为认知土壤有机氮矿化过程提供新的视角,完善对氮素地球化学循环的认识。
1 材料与方法 1.1 试剂与材料大豆蛋白胨(BR)、硫柳汞钠(AR,98%)、焦磷酸钠(AR,99%)、二氧化锰(AR,≥97.5%)均购自国药集团化学试剂有限公司。所有实验体系均使用除氧去离子水(18.2 MΩ·cm)。利用X-射线衍射仪(XRD,LabX XRD-6100,SHIMADZU,日本)对二氧化锰晶型进行定性分析;利用傅里叶变换红外光谱仪(FTIR,VERTEX 70,BRUKER,德国)对其进行表征分析;采用X-射线光电子能谱仪(XPS,VG Multilab2000 X,VG Scientific,英国,Al Kα,1486 eV)对二氧化锰表面Mn、氧(O)和氮(N)的价态和化学键进行表征分析。
1.2 试验设计蛋白质是土壤中单一最大的有机氮库,因此本研究以植物源蛋白质——大豆蛋白胨(SP)作为土壤有机氮代表[4],与土壤中普遍存在的活性矿物——二氧化锰建立实验体系。模拟矿化实验中,所有二氧化锰与蛋白胨的批次实验均在空气氛围,pH 7.0和25 ℃条件下进行磁力搅拌60 h。在一系列的实验中,向经过灭菌的反应瓶(500 mL)中加入0.25 g∙L–1蛋白胨以及0.0~2.0 g∙L–1二氧化锰,同时为了抑制微生物的生长,向所有反应体系中均加入微量抑菌剂(0.2 g∙L–1硫柳汞钠)[15]。然后向反应瓶中加入300 mL无菌超纯水(经过0.22 μm过滤器过滤)。为避免光照的影响,用铝箔纸包裹反应瓶。在预定的时间点,用0.22 μm滤膜过滤20 mL悬浊液,收集液相和固相。利用2 mol∙L–1 KCl对不同时间点收集的固相进行解析试验,在密闭式恒温摇床中振荡1 h,然后离心过滤洗涤,收集液相待测。
活性中间产物(活性氧物种和Mn(Ⅲ))在锰氧化物的氧化还原过程中可能发挥着重要作用。利用电子顺磁共振光谱仪(EPR)分析反应体系中产生活性氧物种的种类[19]。焦磷酸根离子(PP)可捕获Mn(Ⅲ)形成稳定的络合物(Mn(Ⅲ)-PP),且在258 nm处存在特征吸收峰[20]。反应体系中加入10.0 mmol∙L–1焦磷酸钠,研究Mn(Ⅲ)的形成与作用。为确保实验数据的准确性,以上每组实验均进行了三次重复。
1.3 分析方法待测样品中铵态氮(NH4+-N)浓度采用靛酚蓝比色法在波长为625 nm处使用紫外-可见分光光度计检测[21]。待测样品中硝态氮(NO3–-N)同样采用比色法测定其含量。溶解的有机质在220 nm和275 nm处均有吸收,而NO3–在275 nm处无吸收,因此将样品分别在220 nm和275 nm处进行比色测定,最后利用吸光度A=A220-2A275计算NO3–-N的含量[21]。待测样品中Mn(Ⅱ)浓度使用原子吸收光谱仪(PinAAcle 900,PerkinElmer,美国)测定。
为了检验反应过程中活性中间产物如活性氧物种和Mn(Ⅲ)的存在及其作用,采用电子顺磁共振光谱仪(EPR,EMX-PLUS,BRUKER,德国),以5, 5-二甲基-1-吡咯啉N-氧化物(DMPO,100 mmol∙L–1)作为自旋捕获剂,对羟基自由基(·OH)和超氧根自由基(O2·−)进行定性分析[19]。向反应体系中加入10.0 mmol∙L–1焦磷酸钠,利用二极管阵列紫外-可见分光光度计(UV-6000,元析仪器,上海)对反应体系溶液进行紫外-可见全波段扫描,确定反应过程体系中Mn(Ⅲ)-PP络合物的形成[20]。用改进的2, 9-二甲基-1, 10-菲啰啉法在波长为454 nm处使用紫外-可见分光光度计检测在反应过程不同时间点形成的瞬时过氧化氢(H2O2)浓度[22]。
过滤所得固相产物粉末用XRD表征分析。测试条件为:Cu Kα(λ=0.15418 nm)、管压40 kV、管流40 mA、步进扫描(步长为0.02°),扫描速度为4°∙min–1。固相粉末在40 ℃的真空烘箱烘干后进一步用FTIR分析其组分。取适量干燥样品以质量比2:98与干燥KBr一起在玛瑙研钵中碾磨混匀、压片。扫描电子显微镜(SEM,JSM-6700F,JEOL,日本)观察反应前后矿物表面形貌变化。固相产物样品表面中Mn、O和N的价态和化学键用XPS进行表征分析。电荷效应通过调整C 1s峰值的结合能至284.80 eV来进行修正。XPS拟合分析使用Avantage 5.52软件。
1.4 数据处理试验所得数据采用Excel 2019和Origin 2024软件进行处理和图表绘制,数据以平均值±标准误差来表示。
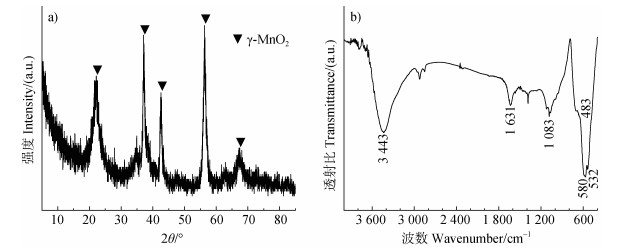
2 结果 2.1 γ-MnO2形态表征图 1a中显示该二氧化锰XRD图谱的特征衍射峰分别为21.9°、37.2°、42.5°、56.0°和67.3°,与六方锰矿(γ-MnO2)的特征衍射峰[23]一致。因此,本研究所用二氧化锰的具体晶型为γ-MnO2(PDF No. 14-0644),为软锰矿与拉锰矿相互有规则交替连生在一起,其有1×1和1×2隧道结构交互生长。利用FTIR对该二氧化锰进行表征分析(图 1b),位于483、532和580 cm−1处特征吸收峰为γ-MnO2结构中Mn–O伸缩振动[24-25]。1 083 cm−1处特征吸收峰为γ-MnO2结构中Mn(Ⅲ)–OH振动[25-26]。3 443 cm−1和1 631 cm−1处吸收峰分别为H2O分子中O−H伸缩振动和H−O−H弯曲振动[26]。
|
图 1 初始二氧化锰的X-射线衍射(XRD)图谱(a)和傅里叶变换红外(FTIR)光谱(b) Fig. 1 X-ray diffractometer (XRD) patterns (a) and Fourier transform infrared spectroscopy (FTIR) spectra (b) of pristine manganese dioxide |
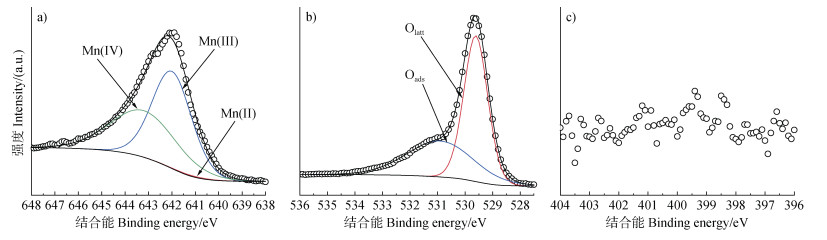
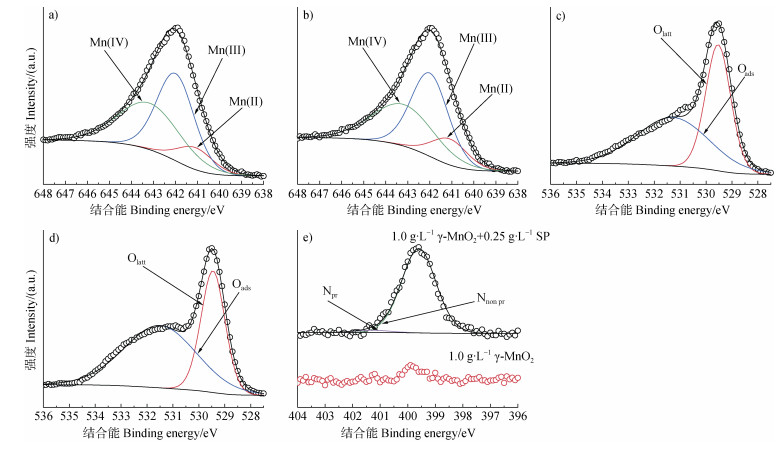
进一步利用X-射线光电子能谱仪对该二氧化锰表面Mn、O和N的价态和化学键进行表征分析(图 2),其Mn、O和N元素拟合的含量百分比结果呈现在表 1中。Mn 2p位于641.10、642.00和643.20 eV处的三个结合能峰可分别归属于Mn(Ⅱ)、Mn(Ⅲ)和Mn(Ⅳ)[27-28]。O 1s位于529.61和530.91 eV的两个结合能峰可分别归属于γ-MnO2中的晶格氧(Olatt)和矿物表面的吸附氧(Oads)[27-29]。
|
注:圆圈表示XPS数据,黑色曲线表示拟合数据。Oads:吸附氧,Olatt:晶格氧。下同。 Note: The circles represent the XPS data and the solid black curves represent the fitted data. Oads: adsorbed oxygen species, Olatt: lattice oxygen. The same below. 图 2 初始γ-MnO2的Mn 2p(a)、O 1s(b)和N 1s(c)X-射线光电子能谱(XPS)光谱图 Fig. 2 X-ray photoelectron spectroscopy (XPS) Mn 2p (a), O 1s (b), and N 1s (c) spectra of pristine γ-MnO2 |
|
|
表 1 初始γ-MnO2的Mn 2p、O 1s和N 1s XPS拟合得到不同化学形态Mn、O和N物种的含量百分比 Table 1 Percentage of Mn, O, and N species derived from the fittings of Mn 2p, O 1s and N 1s XPS spectra of pristine γ-MnO2/(at.%) |
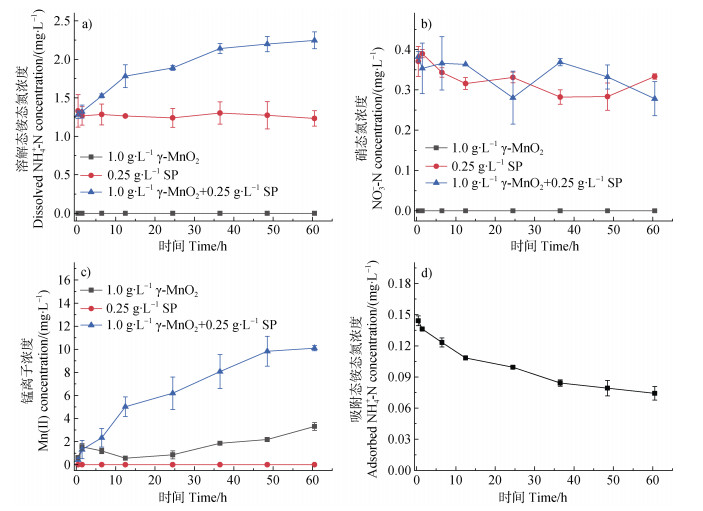
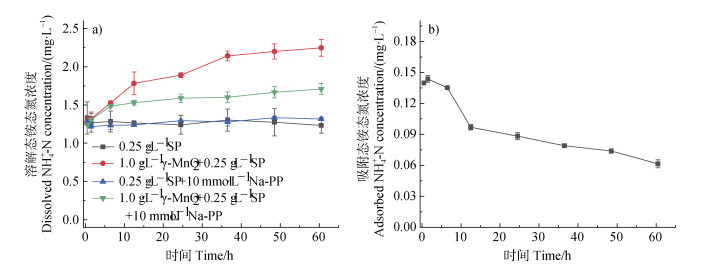
图 3a~图 3c显示为pH 7.0、空气氛围下蛋白胨(0.25 g∙L–1)单一体系、γ-MnO2(1.0 g∙L–1)单一体系以及蛋白胨(0.25 g∙L–1)与γ-MnO2(1.0 g∙L–1)混合体系中溶解态NH4+-N、NO3–-N以及Mn(Ⅱ)浓度。在蛋白胨单一体系中,随着反应进行,NH4+-N和NO3–-N浓度均无明显变化。在蛋白胨与γ-MnO2混合体系中,随反应的进行NH4+-N浓度逐渐增大,而NO3–-N浓度无明显变化。与单一蛋白胨体系相比,反应60 h后,混合体系中NH4+-N浓度增加了82.4%。与此同时,随着反应时间延长,混合体系中释放的Mn(Ⅱ)浓度明显高于γ-MnO2单一体系,且反应60 h后,混合体系中Mn(Ⅱ)浓度相比γ-MnO2单一体系增加了204.9%。上述结果表明γ-MnO2发生了氧化还原反应,且促使了蛋白胨发生非生物矿化。为了进一步了解γ-MnO2与蛋白胨的反应过程,测定了不同时间段矿物表面吸附态NH4+-N浓度(图 3d)。随着反应进行,吸附态NH4+-N浓度逐渐降低,且吸附态NH4+-N最大浓度(0.144 mg∙L–1)远低于反应过程中释放的溶解态NH4+-N最大浓度(0.966 mg∙L–1)。以上结果说明,γ-MnO2与蛋白胨反应过程中矿化产生的无机氮以NH4+-N为主,且主要是被释放至溶液中,仅有极少部分吸附在矿物表面。
|
图 3 在pH 7.0和空气氛围条件下,蛋白胨(SP)(0.25 g∙L–1)单一体系、γ-MnO2(1.0 g∙L–1)单一体系以及SP(0.25 g∙L–1)与γ-MnO2(1.0 g∙L–1)混合体系中溶解态NH4+-N(a)、NO3–-N(b)、Mn(Ⅱ)(c)和混合体系中吸附态NH4+-N(d)浓度 Fig. 3 Concentrations of dissolved NH4+-N (a), NO3–-N (b) and Mn(Ⅱ) (c) in the reaction system of soy peptone (SP) (0.25 g∙L–1), γ-MnO2 (1.0 g∙L–1), and SP (0.25 g∙L–1) + γ-MnO2 (1.0 g∙L–1), and concentrations of adsorbed NH4+-N (d) in the systems of SP (0.25 g∙L–1) + γ-MnO2 (1.0 g∙L–1) at pH 7.0 in air atmosphere |
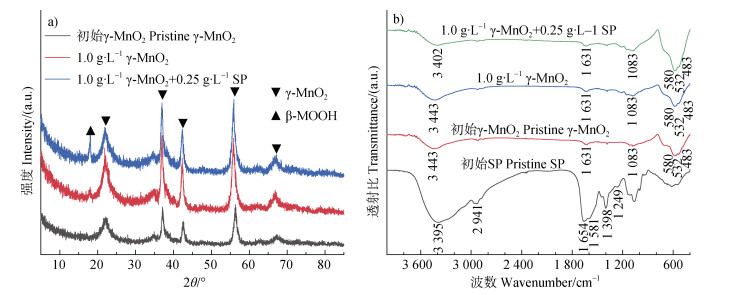
利用XRD、FTIR和XPS确定反应前后γ-MnO2晶体结构及化学组成变化。图 4为反应前后固相XRD图谱和FTIR光谱。XRD图谱显示,γ-MnO2单一体系以及蛋白胨与γ-MnO2混合体系反应60 h后固相产物在18.1°均出现新峰,与六方水锰矿(β-MnOOH)的特征衍射峰[26,30]一致。研究表明在近中性环境下,Mn(Ⅱ)易于氧化生成β-MnOOH,因此可综合判断该新峰归属于β-MnOOH(JCPDS no. 18-0804)[26,30](图 4a)。在初始蛋白胨FTIR光谱中,1 249 cm−1处特征吸收峰可归属于C–C键,1 398、1 581和2 941 cm−1处特征吸收峰可分别归因于C–N伸缩振动、N–H弯曲振动和C–H伸缩振动,1 654 cm−1处特征吸收峰可归因于C=O伸缩振动和H−O−H弯曲振动,3 395 cm−1处特征吸收峰可归因于N–H和O−H的伸缩振动[31](图 4b)。然而,与初始γ-MnO2的FTIR光谱相比,γ-MnO2单一体系以及蛋白胨与γ-MnO2混合体系的FTIR光谱结果显示反应60 h后矿物化学组成无明显变化(图 4b)。
|
图 4 在pH 7.0和空气氛围条件下,SP(0.25 g∙L–1)单一体系、γ-MnO2(1.0 g∙L–1)单一体系以及SP(0.25 g∙L–1)与γ-MnO2(1.0 g∙L–1)混合体系中固相产物的XRD图谱(a)和FTIR光谱(b) Fig. 4 XRD patterns (a) and FTIR spectra (b) of the solid products in the reaction system of SP (0.25 g∙L–1), γ-MnO2 (1.0 g∙L–1), and SP (0.25 g∙L–1) + γ-MnO2 (1.0 g∙L–1) at pH 7.0 in air atmosphere |
图 5为γ-MnO2单一体系以及蛋白胨与γ-MnO2混合体系反应60 h后固相产物表面Mn 2p、O 1s和N 1s的XPS拟合光谱。Mn、O和N元素拟合的含量百分比见表 2。与初始矿物相比,γ-MnO2单一体系中固相产物表面低价形态Mn(Mn(Ⅱ))和吸附形态O(Oads)的百分含量均有所增加。蛋白胨与γ-MnO2混合体系中固相产物表面低价形态Mn(Mn(Ⅱ))和吸附形态O(Oads)的百分含量相比于γ-MnO2单一体系也均有所增加,且混合体系固相产物表面吸附了不同形态的N,主要以非质子化态氮形式(Nnon pr)存在,少量以质子化态氮形式(Npr)存在[32]。
|
注:Nnon pr:非质子化态氮,Npr:质子化态氮。下同。 Note: Nnon pr: non-protonated nitrogen, Npr: protonated nitrogen. The same below. 图 5 在pH 7.0和空气氛围条件下,γ-MnO2(1.0 g∙L–1)单一体系反应60 h后固相产物的Mn 2p(a)、O 1s(c)和N 1s(e)以及SP(0.25 g∙L–1)与γ-MnO2(1.0 g∙L–1)混合体系反应60 h后固相产物的Mn 2p(b)、O 1s(d)、N 1s(e)XPS光谱图 Fig. 5 XPS Mn 2p (a), O 1s (c), N 1s (e) spectra of solid products in the system of γ-MnO2 (1.0 g∙L−1), and XPS Mn 2p (b), O 1s (d), N 1s (e) spectra of solid products in the system of SP (0.25 g∙L–1) + γ-MnO2 (1.0 g∙L–1) after 60 h at pH 7.0 in air atmosphere |
|
|
表 2 在pH 7.0和空气氛围条件下,γ-MnO2(1.0 g∙L–1)单一体系以及SP(0.25 g∙L–1)与γ-MnO2(1.0 g∙L–1)混合体系反应60 h后固相产物的Mn 2p、O 1s和N 1s XPS拟合得到不同化学形态Mn、O和N物种的含量百分比 Table 2 Percentage of Mn, O, and N species derived from the fittings of Mn 2p, O 1s and N 1s XPS of solid products formed in the reaction system of γ-MnO2 (1.0 g∙L−1), and SP (0.25 g∙L–1) + γ-MnO2 (1.0 g∙L–1) at pH 7.0 after 60 h in air atmosphere/(at.%) |
使用扫描电子显微镜观察反应前后γ-MnO2微观形貌特征(图 6)。与初始矿物表面相比,反应60 h后单一体系和混合体系矿物表面粗糙程度增加,颗粒状形貌增大,且出现颗粒团聚现象,在混合体系中,这些改变程度更为突出。由此可见,在矿物表面,大豆源蛋白胨与γ-MnO2在其表面发生了界面反应。

|
图 6 初始γ-MnO2(a)以及pH 7.0和空气氛围条件下γ-MnO2(1.0 g∙L–1)单一体系(b),SP(0.25 g∙L–1)与γ-MnO2(1.0 g∙L–1)混合体系(c)反应60 h后固相产物的扫描电镜图(SEM) Fig. 6 Scanning electron microscope (SEM) images of the pristine γ-MnO2 (a) and solid products formed in the reaction system of γ-MnO2 (1.0 g∙L–1) (b), and SP (0.25 g∙L–1) + γ-MnO2 (1.0 g∙L–1) (c) at pH 7.0 after 60 h in air atmosphere |
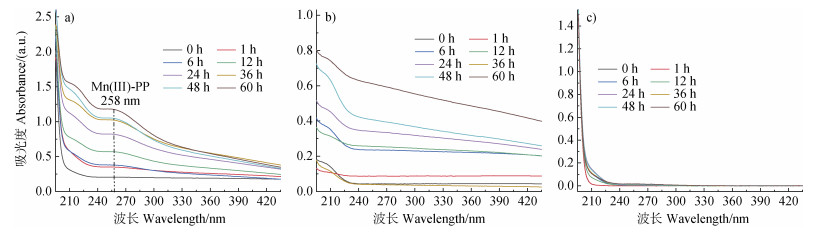
近期研究表明,锰氧化物在氧化溶解过程中可产生活性中间体Mn(Ⅲ)和活性氧物种,这些活性中间体可促使有机质氧化分解[9,28-29]。为了探明Mn(Ⅲ)和活性氧物种在γ-MnO2和蛋白胨相互作用过程中的影响,定性以及定量检测了反应过程中活性中间体的种类与浓度。图 7为pH 7.0、空气氛围条件下,γ-MnO2+焦磷酸钠(Na-PP)、γ-MnO2、Na-PP溶液的紫外-可见全波段扫描光谱。Na-PP能够将反应体系中可能生成的Mn(Ⅲ)络合生成Mn(Ⅲ)-PP,其在258 nm处有特征吸收峰[20]。γ-MnO2+ Na-PP体系在258 nm处有吸收,且吸光度随着时间增加而逐渐增强(图 7a),然而γ-MnO2、Na-PP溶液在258 nm处均未出现特征吸收峰(图 7b和图 7c)。因此,在γ-MnO2氧化溶解过程中有活性中间体Mn(Ⅲ)产生。
|
图 7 在pH 7.0和空气氛围条件下,γ-MnO2+焦磷酸钠(Na-PP)(a),γ-MnO2(b)和Na-PP(c)溶液的紫外-可见(UV-Vis)吸收光谱 Fig. 7 Ultraviolet-Visible (UV-Vis) absorption spectra of the γ-MnO2+Na-PP (a), γ-MnO2 (b), and Na-PP (c) solutions at pH 7.0 in air atmosphere |
进一步在pH 7.0和空气氛围条件下,向蛋白胨单一体系以及蛋白胨与γ-MnO2混合体系中加入10.0 mmol∙L−1 Na-PP作为Mn(Ⅲ)捕获剂,生成的NH4+-N浓度如图 8所示。在蛋白胨单一体系中加入Na-PP后与未加入的单一体系相比,溶解态NH4+-N浓度无明显差异。然而在蛋白胨与γ-MnO2混合体系中加入10.0 mmol∙L−1 Na-PP反应60 h后,与不加Na-PP体系相比,溶解态NH4+-N浓度降低了24.0%(图 8a),且吸附态NH4+-N浓度也降低了17.3%(图 3d和图 8b)。上述结果进一步表明,反应体系中生成了Mn(Ⅲ)并参与了蛋白胨的矿化过程中。
|
图 8 在pH 7.0、空气氛围和添加10.0 mmol∙L−1 Na-PP条件下,SP(0.25 g∙L−1)单一体系以及SP(0.25 g∙L–1)与γ-MnO2(1.0 g∙L–1)混合体系中溶解态NH4+-N浓度(a),混合体系中吸附态NH4+-N浓度(b) Fig. 8 Concentrations of dissolved NH4+-N in the systems of SP (0.25 g∙L–1), and SP (0.25 g∙L–1) + γ-MnO2 (1.0 g∙L–1) (a), concentrations of adsorbed NH4+-N in the systems of SP (0.25 g∙L–1) + γ-MnO2 (1.0 g∙L–1) (b) with the addition of 10.0 mmol∙L−1 Na-PP at pH 7.0 in air atmosphere |
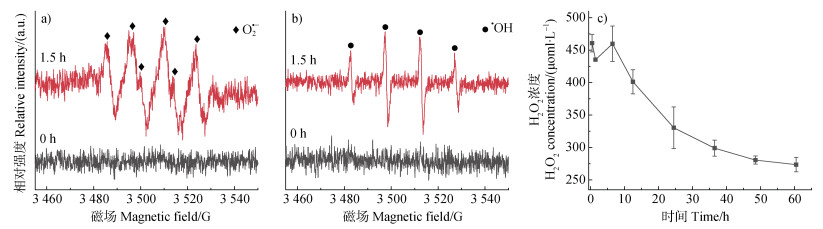
图 9a和图 9b为pH 7.0、空气氛围条件下,利用电子顺磁共振光谱仪(EPR)测定蛋白胨与γ-MnO2混合体系中O2•−和·OH的存在。在反应1.5 h时可明显观察到混合体系中生成了O2•−和·OH。进一步定量检测了γ-MnO2单一体系中瞬时H2O2浓度(图 9c),在反应60 h过程中,瞬时H2O2浓度呈现先增加后降低的趋势,在反应6 h时浓度达到最大值。上述结果表明,在蛋白胨与γ-MnO2混合体系的反应过程中还会产生活性氧物种,影响反应体系中的氧化还原过程。
|
图 9 在pH 7.0和空气氛围条件下,SP(0.25 g∙L–1)与γ-MnO2(1.0 g∙L–1)混合体系中超氧根自由基(O2•−)(a)和羟基自由基(·OH)(b)的电子顺磁共振(EPR)光谱及γ-MnO2(1.0 g∙L–1)单一体系中生成瞬时过氧化氢(H2O2)浓度(c) Fig. 9 Electron paramagnetic resonance (EPR) spectra of superoxide radical (O2•−) (a), and hydroxyl radical (·OH) (b) in the mixed system of SP (0.25 g∙L–1) + γ-MnO2 (1.0 g∙L–1) and instant concentration of hydrogen peroxide (H2O2) (c) in the system of γ-MnO2 (1.0 g∙L−1) at pH 7.0 in air atmosphere |
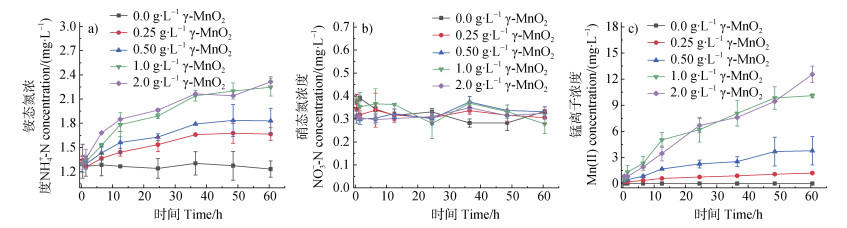
图 10为pH 7.0、空气氛围条件下,蛋白胨(0.25 g∙L−1)与不同初始浓度γ-MnO2(0~2.0 g∙L−1)反应60 h过程中,体系中溶解态NH4+-N、NO3–-N和Mn(Ⅱ)浓度。随着初始γ-MnO2浓度增加,反应体系中生成的溶解态NH4+-N和Mn(Ⅱ)浓度先逐渐增加而后趋于平衡。反应60 h后,各混合体系中溶解态NH4+-N浓度依次为1.232、1.666、1.830、2.247和2.315 mg∙L–1;Mn(Ⅱ)浓度依次为0.0、1.194、3.771、10.097和12.548 mg∙L–1。而各个反应体系中溶解态NO3–-N浓度均无明显变化。上述结果说明,在一定浓度范围内,提高γ-MnO2浓度,可加快蛋白胨非生物氮矿化过程。
|
图 10 在pH 7.0和空气氛围条件下,SP(0.25 g∙L−1)与不同初始浓度γ-MnO2混合体系中溶解态NH4+-N(a)、NO3–-N(b)和Mn(Ⅱ)(c)浓度 Fig. 10 Concentrations of dissolved NH4+-N (a), NO3–-N (b), and Mn(Ⅱ) (c) in the systems of SP (0.25 g∙L–1) with different concentrations of γ-MnO2 at pH 7.0 in air atmosphere |
锰氧化物在土壤中普遍存在,被认为是最强的天然氧化剂之一,能够对大量有机物进行非生物转化[33]。吸附的有机物通过锰氧化物表面高价锰离子的直接电子转移作用而被转化是最广泛接受的机制[34]。然而,目前越来越多的研究结果表明活性中间体如Mn(Ⅲ)以及活性氧物种在锰氧化物转化有机物的过程中也挥发着重要作用[28-29]。隧道状锰氧化物γ-MnO2基本结构单位为MnO6八面体,八面体中普遍存在着Mn(Ⅱ)和Mn(Ⅲ)对Mn(Ⅳ)的同晶替代[35]。以往的研究[36]表明,Mn(Ⅲ)具有氧化多种有机污染物的活性。Mn(Ⅲ)在3d轨道上具有4个电子,它们在eg轨道上分裂为1个能量较高的流动电子,在t2g轨道上分裂为3个能量较低的局域电子。因此,与Mn(Ⅳ)相比,Mn(Ⅲ)–O键更弱,Mn(Ⅲ)活性更高,其更容易通过与有机物直接配位而接受电子[37]。在本研究中,初始γ-MnO2 Mn 2p的XPS拟合结果显示此γ-MnO2表面有Mn(Ⅲ)存在,且在pH 7.0空气氛围下,反应60 h后,γ-MnO2(1.0 g∙L–1)单一体系以及蛋白胨(0.25 g∙L–1)与γ-MnO2(1.0 g∙L–1)混合体系中γ-MnO2矿物表面Mn(Ⅲ)的相对含量分别降低了15.33%和15.46%(图 2和图 5)。而且通过全波段扫描光谱,在γ-MnO2反应过程中检测到Mn(Ⅲ)(图 7);此外在混合体系中加入Mn(Ⅲ)捕获剂反应60 h后,溶解态NH4+-N浓度降低了24.0%(图 8)。因此,在蛋白胨与γ-MnO2反应过程中,有活性中间体Mn(Ⅲ)形成,且参与了蛋白胨的非生物矿化过程。
活性中间体除了Mn(Ⅲ),活性氧物种在蛋白胨的非生物矿化过程也发挥了重要作用。Mn(Ⅱ)和Mn(Ⅲ)对Mn(Ⅳ)的同晶替代,会导致γ-MnO2矿物中电荷失衡。为了维持电荷平衡,矿物表面会出现氧空位,而矿物表面吸附氧通常发生在氧空位上[38]。矿物表面的吸附氧通常被认为较矿物晶格氧的反应活性更高,可参与活性氧物种如超氧根自由基(O2·−)的形成过程中[28-29]。在本研究中,初始γ-MnO2 O 1s的XPS拟合结果显示此γ-MnO2表面有Oads存在(图 2b),这表明矿物表面存在低氧配位缺陷位点,即表面氧空位[27-28]。且在pH 7.0空气氛围下,反应60 h后,γ-MnO2(1.0 g∙L–1)单一体系以及蛋白胨(0.25 g∙L–1)与γ-MnO2(1.0 g∙L–1)混合体系中γ-MnO2矿物表面Oads的相对含量分别升高了29.36%和49.15%(图 2和图 5)。而且在含有γ-MnO2反应体系中定性或者定量检测到O2·−、·OH和H2O2的存在(图 9)。因此,在蛋白胨与γ-MnO2反应过程中,活性氧物种也参与了蛋白胨的非生物矿化过程。
前人通过密度泛函理论(DFT)计算以及实验结果表明吸附在矿物表面氧空位上的氧气是捕获来自Mn(Ⅲ)的一个电子从而形成O2·−[28]。而且,O2·−很容易通过一系列自由基反应如类芬顿反应转化为其他活性氧物种[39]。因此,在本研究中,反应体系中活性氧物种的形成与Mn(Ⅲ)紧密相关,其可归因于如下反应过程:
| $ {{\text{O}}_2} + {\text{Mn}}({\text{III}}) \to {{\text{O}}_2} - {\text{Mn(III)}} $ | (1) |
| $ {{\text{O}}_2} - {\text{Mn}}({\text{III}}) \to {\text{O}}_2^{ \cdot - } + {\text{Mn}}({\text{IV}}) $ | (2) |
| $ 2{\text{O}}_2^{ \cdot - } + 2{{\text{H}}^ + } \to {{\text{H}}_2}{{\text{O}}_2} + {{\text{O}}_2} $ | (3) |
| $ {\text{O}}_2^{ \cdot - } + {{\text{H}}_2}{{\text{O}}_2} \to {{\text{O}}_2} + \cdot {\text{OH + O}}{{\text{H}}^ - } $ | (4) |
| $ {{\text{H}}_2}{{\text{O}}_2} + {\text{Mn}}({\text{III}}) \to {\text{Mn}}({\text{IV}}) + \cdot {\text{OH + O}}{{\text{H}}^ - } $ | (5) |
二氧化锰具有较高的氧化还原电位,Mn(Ⅳ)O2/Mn2+的标准电极电位(1.23 V)与O2/H2O(1.229 V)的标准电极电位接近。但由于二氧化锰的吸附能力较强、表面活性高,因此其较氧气更易参与环境中的氧化还原反应,是土壤中较强的固体氧化剂[35]。除了由Mn(Ⅳ)介导的直接氧化作用外,Mn(Ⅲ)和活性氧物种的存在还使得二氧化锰具有优异的催化氧化活性。特别是氧空位的存在有利于Mn(Ⅲ)的暴露,可为蛋白胨转化提供更多的活性位点;同时其对二氧化锰表面生成活性氧物种发挥着关键作用。在本研究中,用XPS对反应后γ-MnO2的表面组成进行了表征,反应60 h后高价态Mn(Mn(Ⅳ)/Mn(Ⅲ))含量有所降低,Mn(Ⅱ)形态的Mn含量明显增加,且混合体系中Mn(Ⅱ)形态的Mn含量高于γ-MnO2单一体系(图 2和图 5)。该结果可归因于Mn(Ⅲ)在γ-MnO2与蛋白胨相互反应过程中接受了来自蛋白胨的电子并还原为Mn(Ⅱ)[40]。
Mn(Ⅲ)也可提供电子被O2捕获形成O2·−。在此过程中,γ-MnO2中的氧空位有利于O2在矿物表面吸附,进一步促进O2·−的形成。同时,O2·−可转化为稳定性更强、氧化还原电位(2.8 V)更高的·OH。最新研究发现,在二氧化锰促进溶解性有机物矿化过程中,不同结晶度γ-MnO2产生的活性氧物种对矿化贡献率大约为23.7%~64.8%[41]。综上所述,吸附在γ-MnO2表面的蛋白胨的氮矿化过程可归因于Mn(Ⅳ)和Mn(Ⅲ)直接氧化以及与表面生成活性氧物种催化氧化的共同作用,各个(催化)氧化作用对蛋白胨非生物氮矿化过程的贡献需在未来进一步研究。
4 结论通过建立模拟矿化实验体系,利用多种原子/分子尺度表征技术与活性中间产物定性与定量检测技术,探究了在近中性环境中γ-MnO2对蛋白胨氮矿化过程的影响,初步阐明了蛋白胨非生物矿化反应过程及活性中间产物的生成与作用机制。在γ-MnO2与蛋白胨相互作用过程中,γ-MnO2能够促使蛋白胨发生非生物氮矿化,向环境中释放NH4+-N和NO3–-N,且形成的无机态氮以NH4+-N为主。蛋白胨(0.25 g∙L–1)的非生物氮矿化速率随着初始加入γ-MnO2浓度(0~2.0 g∙L–1)的提高先增加而后趋于平衡。除了γ-MnO2矿物中Mn(Ⅳ)对蛋白胨的直接氧化作用机制外,活性中间体Mn(Ⅲ)和活性氧物种(O2·−、·OH和H2O2)是蛋白胨非生物氮矿化的主要氧化剂。上述研究结果为理解农田土壤有机氮非生物矿化机理提供了新的视角。
| [1] |
Jiang Z Q, Peng H. Review on the progress of soil nitrogen mineralization based on bibliometrics analysis (In Chinese)[J]. Chinese Journal of Soil Science, 2021, 52(4): 975-987. DOI:10.19336/j.cnki.trtb.2020102101 [蒋竹青, 彭辉. 基于文献计量学分析土壤氮素矿化研究进展[J]. 土壤通报, 2021, 52(4): 975-987.]
(  0) 0) |
| [2] |
Xu L Q, Li J J, Chang X, et al. The mechanism of soil nitrogen mineralization: Research progress (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2022, 38(34): 97-101. [徐翎清, 李佳佳, 常晓, 等. 土壤氮矿化相关机理的研究进展[J]. 中国农学通报, 2022, 38(34): 97-101.]
(  0) 0) |
| [3] |
Lavallee J M, Soong J L, Cotrufo M F. Conceptualizing soil organic matter into particulate and mineral-associated forms to address global change in the 21st century[J]. Global Change Biology, 2020, 26(1): 261-273.
(  0) 0) |
| [4] |
Tian Z, Wang T, Tunlid A, et al. Proteolysis of iron oxide-associated bovine serum albumin[J]. Environmental Science & Technology, 2020, 54(8): 5121-5130.
(  0) 0) |
| [5] |
Turner S, Meyer-Stüve S, Schippers A, et al. Microbial utilization of mineral-associated nitrogen in soils[J]. Soil Biology and Biochemistry, 2017, 104: 185-196.
(  0) 0) |
| [6] |
Jilling A, Keiluweit M, Contosta A R, et al. Minerals in the rhizosphere: Overlooked mediators of soil nitrogen availability to plants and microbes[J]. Biogeochemistry, 2018, 139(2): 103-122.
(  0) 0) |
| [7] |
Jiang Z H, Liu Y Z, Yang J P, et al. Rhizosphere priming regulates soil organic carbon and nitrogen mineralization: The significance of abiotic mechanisms[J]. Geoderma, 2021, 385: 114877.
(  0) 0) |
| [8] |
Kleber M, Bourg I C, Coward E K, et al. Dynamic interactions at the mineral–organic matter interface[J]. Nature Reviews Earth & Environment, 2021, 2(6): 402-421.
(  0) 0) |
| [9] |
Wang Z, Jia H, Zhao H, et al. Oxygen limitation accelerates regeneration of active sites on a MnO2 surface: Promoting transformation of organic matter and carbon preservation[J]. Environmental Science & Technology, 2022, 56(13): 9806-9815.
(  0) 0) |
| [10] |
Aponte C, García L V, Marañón T. Tree species effect on litter decomposition and nutrient release in Mediterranean oak forests changes over time[J]. Ecosystems, 2012, 15(7): 1204-1218.
(  0) 0) |
| [11] |
Berg B, Erhagen B, Johansson M B, et al. Manganese in the litter fall-forest floor continuum of boreal and temperate pine and spruce forest ecosystems–A review[J]. Forest Ecology and Management, 2015, 358: 248-260.
(  0) 0) |
| [12] |
Jones M E, Nico P S, Ying S, et al. Manganese-driven carbon oxidation at oxic-anoxic interfaces[J]. Environmental Science & Technology, 2018, 52(21): 12349-12357.
(  0) 0) |
| [13] |
Jones M E, LaCroix R E, Zeigler J, et al. Enzymes, manganese, or iron? Drivers of oxidative organic matter decomposition in soils[J]. Environmental Science & Technology, 2020, 54(21): 14114-14123.
(  0) 0) |
| [14] |
Andersen A, Reardon P N, Chacon S S, et al. Protein-mineral interactions: Molecular dynamics simulations capture importance of variations in mineral surface composition and structure[J]. Langmuir, 2016, 32(24): 6194-6209.
(  0) 0) |
| [15] |
Chacon S S, Reardon P N, Burgess C J, et al. Mineral surfaces as agents of environmental proteolysis: Mechanisms and controls[J]. Environmental Science & Technology, 2019, 53(6): 3018-3026.
(  0) 0) |
| [16] |
Reardon P N, Chacon S S, Walter E D, et al. Abiotic protein fragmentation by manganese oxide: Implications for a mechanism to supply soil biota with oligopeptides[J]. Environmental Science & Technology, 2016, 50(7): 3486-3493.
(  0) 0) |
| [17] |
Riedel T, Zak D, Biester H, et al. Iron traps terrestrially derived dissolved organic matter at redox interfaces[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(25): 10101-10105.
(  0) 0) |
| [18] |
Li Q, Huang X, Su G, et al. The regular/persistent free radicals and associated reaction mechanism for the degradation of 1, 2, 4-trichlorobenzene over different MnO2 polymorphs[J]. Environmental Science & Technology, 2018, 52(22): 13351-13360.
(  0) 0) |
| [19] |
Hong J, Liu L H, Zhang Z W, et al. Sulfate-accelerated photochemical oxidation of arsenopyrite in acidic systems under oxic conditions: Formation and function of schwertmannite[J]. Journal of Hazardous Materials, 2022, 433: 128716.
(  0) 0) |
| [20] |
Butterfield C N, Soldatova A V, Lee S W, et al. Mn(Ⅱ, Ⅲ) oxidation and MnO2 mineralization by an expressed bacterial multicopper oxidase[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(29): 11731-11735.
(  0) 0) |
| [21] |
Zhang Y X, Yao T, Wang G J, et al. Characteristics of vegetation and soil inorganic nitrogen concentrations under different disturbed habitats in a weak alpine ecosystem (In Chinese)[J]. Acta Prataculturae Sinica, 2014, 23(4): 245-252. [张玉霞, 姚拓, 王国基, 等. 高寒生态脆弱区不同扰动生境草地植被及土壤无机氮变化特征[J]. 草业学报, 2014, 23(4): 245-252.]
(  0) 0) |
| [22] |
Lee H, Choi W. Photocatalytic oxidation of arsenite in TiO2 suspension: Kinetics and mechanisms[J]. Environmental Science & Technology, 2002, 36(17): 3872-3878.
(  0) 0) |
| [23] |
Yuan A B, Wang X L, Wang Y Q, et al. Comparison of nano-MnO2 derived from different manganese sources and influence of active material weight ratio on performance of nano-MnO2/activated carbon supercapacitor[J]. Energy Conversion and Management, 2010, 51(12): 2588-2594.
(  0) 0) |
| [24] |
Sivakumar S, Prabu L N. Synthesis and characterization of α-MnO2 nanoparticles for supercapacitor application[J]. Materials Today: Proceedings, 2021, 47: 52-55.
(  0) 0) |
| [25] |
Yang R Z, Wang Z X, Dai L, et al. Synthesis and characterization of single-crystalline nanorods of α-MnO2 and γ-MnOOH[J]. Materials Chemistry and Physics, 2005, 93(1): 149-153.
(  0) 0) |
| [26] |
Liu L H, Luo Y, Tan W F, et al. Facile synthesis of birnessite-type manganese oxide nanoparticles as supercapacitor electrode materials[J]. Journal of Colloid and Interface Science, 2016, 482: 183-192.
(  0) 0) |
| [27] |
Wang Z Q, Jia H Z, Liu Z W, et al. Greatly enhanced oxidative activity of δ-MnO2 to degrade organic pollutants driven by dominantly exposed {-111} facets[J]. Journal of Hazardous Materials, 2021, 413(7): 125285.
(  0) 0) |
| [28] |
Zhang S H, Lv J T, Han R X, et al. Sustained production of superoxide radicals by manganese oxides under ambient dark conditions[J]. Water Research, 2021, 196: 117034.
(  0) 0) |
| [29] |
Wang Z Q, Jia H Z, Zheng T, et al. Promoted catalytic transformation of polycyclic aromatic hydrocarbons by MnO2 polymorphs: Synergistic effects of Mn3+ and oxygen vacancies[J]. Applied Catalysis B: Environmental, 2020, 272: 119030.
(  0) 0) |
| [30] |
Luo Y. Transformation and crystal growth mechanisms of hausmannite and manganite[D]. Wuhan: Huazhong Agricultural University, 2020.[罗瑶. 黑锰矿和水锰矿的转化和晶体生长机理[D]. 武汉: 华中农业大学, 2020.]
(  0) 0) |
| [31] |
Gao Z H, Zhang Y H, Fang B, et al. The effects of thermal-acid treatment and crosslinking on the water resistance of soybean protein[J]. Industrial Crops and Products, 2015, 74(11): 122-131.
(  0) 0) |
| [32] |
Ahimou F, Boonaert C J P, Adriaensen Y, et al. XPS analysis of chemical functions at the surface of Bacillus subtilis[J]. Journal of Colloid and Interface Science, 2007, 309(1): 49-55.
(  0) 0) |
| [33] |
Remucal C K, Ginder-Vogel M. A critical review of the reactivity of manganese oxides with organic contaminants[J]. Environmental Science: Processes & Impacts, 2014, 16(6): 1247-1266.
(  0) 0) |
| [34] |
Stone A T. Reductive dissolution of manganese (Ⅲ/Ⅳ) oxides by substituted phenols[J]. Environmental Science & Technology, 1987, 21(10): 979-988.
(  0) 0) |
| [35] |
Feng X H. Synthesis, transformation, and surface chemical properties of some common manganese oxide minerals[D]. Wuhan: Huazhong Agricultural University, 2004.[冯雄汉. 几种常见氧化锰矿物的合成、转化及表面化学性质[D]. 武汉: 华中农业大学, 2004.]
(  0) 0) |
| [36] |
Chen W R, Liu C, Boyd S A, et al. Reduction of carbadox mediated by reaction of Mn(Ⅲ) with oxalic acid[J]. Environmental Science & Technology, 2013, 47(3): 1357-1364.
(  0) 0) |
| [37] |
Huang J, Zhong S, Dai Y, et al. Effect of MnO2 phase structure on the oxidative reactivity toward bisphenol a degradation[J]. Environmental Science & Technology, 2018, 52(19): 11309-11318.
(  0) 0) |
| [38] |
Wang F, Dai H, Deng J, et al. Manganese oxides with rod-, wire-, tube-, and flower-like morphologies: Highly effective catalysts for the removal of toluene[J]. Environmental Science & Technology, 2012, 46(7): 4034-4041.
(  0) 0) |
| [39] |
Kim E J, Oh D, Lee C S, et al. Manganese oxide nanorods as a robust Fenton-like catalyst at neutral pH: Crystal phase-dependent behavior[J]. Catalysis Today, 2017, 282: 71-76.
(  0) 0) |
| [40] |
Xia D, Xu W, Wang Y, et al. Enhanced performance and conversion pathway for catalytic ozonation of methyl mercaptan on single-atom Ag deposited three-dimensional ordered mesoporous MnO2[J]. Environmental Science & Technology, 2018, 52(22): 13399-13409.
(  0) 0) |
| [41] |
Wang Z, Zhao H, Shi Z, et al. Manganese dioxides induce the transformation and protection of dissolved organic matter simultaneously: A significance of crystallinity[J]. Environmental Science & Technology, 2025, 59(2): 1222-1231.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


