2. 中国科学院大学, 北京 100049;
3. 中国科学院大学南京学院, 南京 211135
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. University of Chinese Academy of Sciences, Nanjing, Nanjing 211135, China
禾谷镰刀菌(Fusarium graminearum,Fg)是一种广泛存在于小麦、大麦和玉米等禾谷类作物及其残体中的致病真菌,通过粘附、侵入、游走或定殖等多种途径侵染谷物作物的茎、叶、胚乳等部位,导致作物患穗腐病、茎腐病、叶枯病等[1-2]。以Fg为优势致病菌的小麦赤霉病是全球范围内小麦生产面临的重要病害之一,该病菌在侵染过程中会产生多种真菌毒素如脱氧雪腐镰刀菌烯醇(Deoxynivalenol),不仅会降低作物的品质,也会导致人和牲畜中毒[3]。
秸秆还田能提高土壤有机质及各类养分含量,缓解土壤酸化现象,提升土壤肥力[4]。前茬作物秸秆及其衍生的各类有机残体通常是Fg在田间生长的主要基质[5]。Fg一般以菌丝体或子囊壳的形式在前茬作物秸秆上进行越冬[6],翌年春天,温暖潮湿的气候条件有利于其分生孢子和子囊壳的发育和成熟[7],待小麦抽穗扬花时,从子囊壳排出的成熟子囊孢子作为初侵染源会通过风、雨或昆虫等途径传播[8-9],进一步侵染小麦穗部。目前,随着秸秆还田的大面积推广,全球范围内小麦赤霉病的流行日益严重[10]。乔玉强等[11]研究发现小麦赤霉病的病穗率和病情指数随着秸秆还田年限和还田量的增加均呈递增趋势。一方面这是由于前茬作物秸秆自身携带的Fg会扩大土壤中Fg的初侵染源基数,另一方面是由于外源秸秆的投入不仅为Fg的存活提供了物理庇护场所,也为Fg后续的生长和繁殖提供了充足的营养物质。Leplat等[12]基于培育试验对5种不同作物残留物禾谷镰刀菌含量进行了测定,发现耐分解的玉米、小麦和油菜秸秆能显著促进禾谷镰刀菌的定殖和存活。众所周知,前茬作物秸秆进入土壤后会在微生物作用下发生分解,而分解过程中残留秸秆碳及养分含量的变化及其驱动的微生物群落组成的变化均有可能影响秸秆携带的Fg含量变化,但有关秸秆分解过程中Fg含量变化及其机制挖掘方面的研究甚少。
生物质炭是由植物等生物质材料在完全或部分缺氧的情况下经热解炭化产生的一类高度芳香化难熔性固态物质[13],因其具有含碳量高、难于分解、比表面积大、疏松多孔等特性,通常被作为土壤改良剂用于增加土壤养分、改善酸性土壤、提高土壤离子交换量、保持土壤水分、降低土壤容重及促进作物生长等[14-17]。已有大量研究表明土壤中施加生物炭也可以有效降低作物病害的发生。例如,Jaiswal等[18]研究发现添加由桉树和辣椒秸秆制成的生物炭均能显著降低番茄根腐病的严重程度及其致病菌尖孢镰刀菌在土壤中的存活数量。刘悦等[19]基于田间试验发现,施用由水稻秸秆制成的生物炭后能显著降低小麦穗层赤霉病菌孢子的数量和赤霉病病情指数;刘春来等[20]则基于盆栽试验探究了不同基质材料的生物炭对玉米茎腐病防控效果的影响,发现稻壳炭和竹制炭处理显著降低了茎腐病病原菌的侵染危害,控害效果分别达到52.00 %和55.99 %。然而,现有利用生物炭防治由Fg引起的植物病害的报道均忽视了Fg含量随生物炭等有机物料分解进程的动态变化特征,有关秸秆和生物炭的交互作用对Fg的影响也仍是未知。
为系统比较秸秆及其来源生物炭在分解过程中对Fg含量的影响,本研究基于室内培育实验,在模拟田间Fg菌源充足的接种条件下,施用碳当量相同的秸秆、生物炭及其混合物,研究随着秸秆或生物炭等有机物料分解进程的Fg含量动态变化。本研究主要研究目的包括:(1)明确施用不同有机物料后Fg含量随着培育时间的变化规律,(2)明确不同有机物料分解过程中残留有机物料的全碳及养分含量变化、真菌群落组成变化规律,(3)评估Fg含量与残留有机物料性质之间的潜在关系。
1 材料与方法 1.1 供试材料供试秸秆为玉米秸秆,于2017年10月采自中国科学院封丘农业生态试验站(35°00′N,114°24′E)。将采集到的新鲜玉米秸秆洗净后于65 ℃烘干至恒重,经粉碎机粉碎后过60目筛备用。秸秆全碳415.75 g·kg-1、全氮10.17 g·kg-1、全磷1.24 g·kg-1、全钾15.87 g·kg-1。供试禾谷镰刀菌(Fg,菌株编号为CGMCC3.4598)购自中国普通微生物菌种保藏中心。
供试玉米生物炭的制备如下:以上述玉米秸秆为原料,采用厌氧慢热解工艺(专利号:zl200920232 191.9)制备生物炭。该设施为容积1 m3(1m × 1m × 1m)的电炉反应器,外置电加热器。将玉米秸秆放入电炉内加热,以8.5 ℃·min–1的速度提高温度至400 ℃,并保持约8~10 h,直至通风管道无烟排出。得到的玉米秸秆源生物炭的pH为9.1、全碳533.7 g·kg–1、全氮19.6 g·kg–1、全磷3.7 g·kg–1、全钾29.5 g·kg–1。
1.2 试验设计试验设计4组处理:(1)仅添加玉米秸秆(S),(2)生物炭+禾谷镰刀菌(BF),(3)玉米秸秆+禾谷镰刀菌(SF),(4)生物炭+玉米秸秆+禾谷镰刀菌(BSF),其中生物炭与玉米秸秆均折合成纯碳进行等质量添加。具体步骤如下:准备一批1 000 mL的无菌塑料瓶进行为期70 d的室内培育试验,先向S、SF和BSF处理组的瓶内分别加入10.0 g烘干的玉米秸秆,再分别向BF和BSF处理组加入7.79 g生物炭,向SF、BF和BSF处理组加入2.3×105 CFU·g–1的禾谷镰刀菌分生孢子悬液,补充无菌水至有机物料饱和吸水。将上述已添加有机物料和菌液的塑料瓶分成两批,一批直接加盖密封以待7、21、42和70 d时破坏性取样,每个处理在每个采样时期均设置3个重复,共计48个瓶子;另外一批则将盛有15 mL 1 mol·L–1 NaOH溶液的25 mL吸收杯小心悬挂于其中后再加盖密封,连续培育70 d用于CO2释放量测定,每个处理3个重复,共计12个瓶子。试验在25 ℃条件下恒温避光培养,培养期间及时补充无菌水以维持瓶内有机物料处于田间持水量。
1.3 样品采集与测定 1.3.1 CO2释放量测定培育过程中CO2释放量采用碱液吸收法测定,分别在培养的1~14 d(每天一次)及19、24、29、34、39、42、51、59、70 d取出盛有碱液的吸收杯,用浓度为1 mol·L–1 HCl标准溶液进行滴定,计算CO2释放量及其释放速率。
| $ \begin{array}{c} & \text { 有机物料 } \mathrm{CO}_2 \text { 释放量 }\left(\mathrm{g} \cdot \mathrm{~kg}^{-1}\right)=\left(V_0-V_1\right) \\ & \times C_{\mathrm{HCl}} / 2 \times 44 / m / 1000 \end{array} $ |
式中,V0为空白滴定消耗的标准盐酸体积(mL);V1为样品滴定消耗的标准盐酸体积(mL);CHCl为标准盐酸浓度(mol·L–1),m为烘干有机物料的质量(g)。
通过一级动力学方程(Ct= C0(1–e–kt)+ C1))对有机物料的CO2累计释放量与培养天数之间的动态变化进行拟合,其中Ct为t时间的CO2累计释放量(g·kg–1),t为从培育起始开始计算的时间(d),C0为潜在可矿化碳量(g·kg–1),C1为易矿化碳量(g·kg–1),k为速率常数。
1.3.2 残余有机物料性质测定分别在培养7、21、42和70 d时用无菌勺将塑料瓶内残留的所有物料全部无损刮出装袋并分装成两份,一份于50 ℃条件下烘干以测定残留有机物料的养分性质,一份在–80 ℃条件下储存用于DNA提取以测定禾谷镰刀菌含量及进行扩增子测序表征真菌群落组成。
全碳含量采用重铬酸钾–外加热法测定;全量氮磷钾采用H2SO4-H2O2消煮,半微量凯氏定氮法测定全氮含量,钼锑抗比色法测定全磷含量,火焰光度计法测定全钾含量[21]。
1.3.3 真菌群落与禾谷镰刀菌数量测定DNA提取及真菌扩增子测序:残留有机物料DNA采用E.Z.N.A.® Soil DNA Kit试剂盒(Omega Bio-Tek,USA)按照说明书操作从0.5 g鲜样中提取。使用Nanodrop™ 2000分光光度计(Nanodrop Technologies,Wilmington,DE,USA)测量DNA纯度和浓度。选取真菌的ITS1区进行高通量测序,PCR扩增引物为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)/ITS2R(5′-GCTGCGTTCTTCATCGATGC3′)[22]。PCR扩增体系(25 μL)包括5× PCR反应缓冲液5 μL,5× GC缓冲液5 μL,dNTP混合溶液(2.5 μmol·L–1)2 μL,Taq DNA聚合酶(5 U·μL–1)0.25 μL,上、下游引物(10 μmol·L–1)各1 μL,DNA模板2 μL,灭菌双蒸水8.75 μL。PCR扩增条件为98 ℃预热2 min,然后98 ℃ 15 s,55 ℃ 30 s,72 ℃ 30 s,25个循环,最后72 ℃ 5 min。PCR扩增产物使用Vazyme VAHTSTM DNA Clean Beads(Vazyme,中国)进行纯化。将不同样品的PCR扩增产物等摩尔混合后,使用Illumina MiSeq平台的MiSeq Reagent Kit v3测序仪进行序列分析(委托上海派森诺生物科技股份有限公司测定)。
禾谷镰刀菌(Fg)含量测定:残留有机物料中的Fg含量采用荧光染料(SYBR Green)渗入法进行实时荧光定量PCR(qPCR)。所选用于定量Fg的特异性引物为Fg16F/Fg16R(Fg16F:5′-CTCCGG ATATGTTGCGTCAA-3′,Fg16R:5′-GGTA GGTATC CGACATGGCAA-3′)[23]。采用宝生物工程(大连)有限公司提供的SYBR Premix Ex TaqTM试剂盒,用BFX96 Real-Time PCR System扩增仪(Bio-Rad,美国)分析,每个样品平行3次。qPCR反应体系(25 μL)包括SYBR Premix Ex TaqTM 12.5 μL,上、下游引物(10 μmol·L–1)各0.3 μL,DNA模板2 μL,灭菌双蒸水9.9 μL。qPCR扩增条件为95 ℃ 2 min,然后95 ℃ 15 s,60 ℃ 30 s,72 ℃ 45 s,40个循环,于72 ℃时测定荧光值,每个循环结束后自动收集并记录荧光信号,绘制熔解曲线。qPCR标准曲线建立:从纯培养的Fg中提取菌丝基因组DNA并测定其浓度(ng·μL–1),将菌丝基因组DNA样品按10倍比稀释制作7个浓度梯度(10~10–5 ng·μL–1)系列标准样品,标准样品与待测样品在相同反应条件下进行实时荧光定量PCR扩增,根据标准样品Ct值与浓度梯度构建标准曲线。最后将得到的待测样品Ct值代入标准曲线,计算Fg含量。
1.4 数据处理基于SPSS 21.0先对所有数据进行正态性检验和方差齐性检验,将符合上述条件的数据采用单因素方差分析(One-way ANOVA)和邓肯(Duncan)法多重比较,对不满足正态性和方差齐性的数据则采用Kruskal-Wallis秩和检验,均比较不同处理在P < 0.05水平的显著性差异。采用Origin 9.0进行作图。扩增子测序所得序列(BioProject登录号:PRJNA1184167)按照以下步骤进行分析:使用QIIME 2(2023.11)处理测序数据,使用demux插件对原始序列数据进行样本拆分,然后使用cutadapt插件切除引物,使用DADA2插件对数据进行去噪、拼接及去除嵌合体,之后将扩增子序列变异(ASVs)进行比对。采用Blast方法用UNITE数据库(8.3)对真菌注释。真菌按照样品中最低序列数进行抽平,抽平后的序列用来进行微生物多样性指数的分析以及后续的分析。使用R 4.2.2软件的vegan包(2.6-4)进行α多样性指数分析、主坐标分析(Principal coordinate analysis,PCoA)、典范对应分析(Canonical correspondence analysis,CCA);基于多元响应置换分析判断不同处理间真菌群落结构的差异,使用蒙特卡洛置换检验(Monte Carlo permutation test,999 permutations)对影响真菌群落组成的环境因子进行显著性检验。使用randomForest包(4.7-1.2)进行随机森林重要性预测,使用生科云平台(https://bioincloud.tech)绘制热图。
2 结果 2.1 残留有机物料中的禾谷镰刀菌(Fg)含量及其动态变化图 1结果显示,S处理中的Fg含量在整个培育期内均低于检测限;其余三个处理在4个采样时间的Fg含量的平均值大小顺序为:BF > SF > BSF,其中BSF处理分别较BF和SF处理降低84.07%和69.11%。不同时间段各处理的Fg含量差异有所不同,BF处理培养7 d时的Fg含量分别为SF和BSF处理的20.49倍和5.68倍,70 d时分别为SF和BSF处理的5.75倍和7.26倍;而在21 d和42 d时BF处理的Fg含量则分别较BSF处理高84.51%和81.39%,较SF处理低5.47%和46.33%。
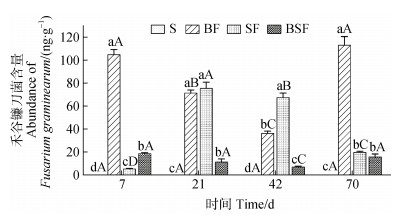
|
注:S、BF、SF和BSF分别表示秸秆、生物炭+禾谷镰刀菌、秸秆+禾谷镰刀菌、生物炭+秸秆+禾谷镰刀菌;误差线表示标准差。同一培育时期不同小写字母表示不同处理之间差异显著(P < 0.05);同一处理不同大写字母表示不同培育时期之间差异显著(P < 0.05)。下同。 Note:S,BF,SF,and BSF represents maize straw,biochar plus Fusarium graminearum(Fg),maize straw plus Fg,and biochar plus maize straw plus Fg,respectively;The error lines on the bars represent standard deviations. Different lowercase letters under the same cultivation time indicate a significant difference between treatments,while different uppercase letters under the same treatment indicate a significant difference between cultivation times(P < 0.05). The same below. 图 1 禾谷镰刀菌含量随培育时间的动态变化 Fig. 1 The dynamic changes of Fusarium graminearum abundance with cultivation time |
总体而言,随着培育时间的增加,BF处理的Fg含量在42 d显著下降至最低水平36.12 ng·g–1,然后70 d时显著升高至其第7天的水平,为112.93 ng·g–1;SF处理的Fg含量先在21 d时升至75.54 ng·g–1,然后随着培育时间到70 d时降至19.65 ng·g–1;BSF处理的Fg含量在整个培育时期内变化不大,其四个采样时间点的均值为12.94 ng·g–1。
2.2 培育过程中CO2累计释放量及释放速率图 2结果显示,随着培育时间的推移,CO2的累计释放量增幅逐渐降低;四个处理70 d内的CO2累计释放量的大小顺序为BF < S < SF≈BSF。与S处理相比,BF处理70 d的CO2累计释放量降低了93.86%,而SF和BSF处理则分别平均增加了7.14%和6.96%。此外,在整个培育周期内,各处理的CO2释放速率随着培育时间的增加呈下降趋势。根据释放速率下降的趋势可将S、SF和BSF处理的培养阶段分为培养初期(0~27 d)和培养后期(27~70 d)。在培养初期,S、SF和BSF处理的CO2释放速率下降明显,以1~7 d的变化幅度最大,呈断崖式下降趋势,其在第7天的CO2释放速率较第1天分别依次降低了72.03%、69.10%和65.94%。在培养后期,S、SF和BSF处理的CO2释放速率则缓慢下降直至趋于稳定。BF处理的CO2释放速率在整个培养时期内变化均不明显,整体呈缓慢降低直至趋于平稳的趋势。
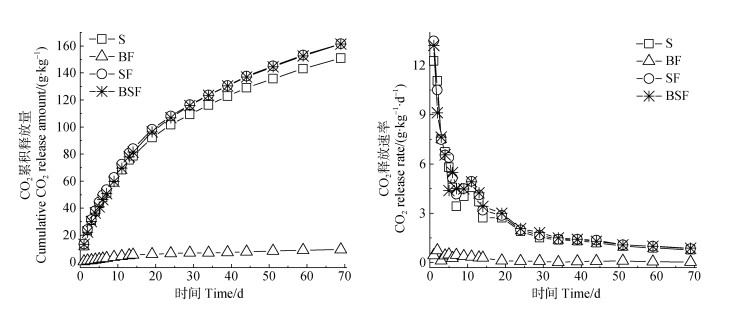
|
图 2 CO2累计释放量及其释放速率 Fig. 2 The cumulative release amount and the release rate of CO2 |
为进一步探究有机物料分解过程中碳组分含量变化,采用一级动力学方程对有机物料的CO2累计显示(表 1),C0在四个处理之间的变化与CO2累积释放量基本类似,呈BF < S≤SF≤BSF的变化规律,释放量与培养天数之间的动态变化进行拟合。结果其中BSF处理的C0含较S处理显著增加了10.78%,而BF处理的C0较S、SF和BSF处理分别降低了93.46%、93.96%和94.10%。C1在不同处理之间呈现BF < BSF < S≈SF的变化规律,其中,BF和BSF处理与S处理相比分别降低了99.23%和14.65%。
|
|
表 1 有机物料碳矿化的一级动力学参数 Table 1 Carbon mineralization parameters of organic materials estimated by the first-order kinetic equation |
表 2结果显示,四个采样时期残留有机物料的全碳(TC)、全氮(TN)、全磷(TP)和全钾(TK)含量均以BF处理最高,其次为BSF处理,SF和S处理含量则在所有处理中处于最低水平。与S处理相比,SF处理在各个时期的TC含量均无显著变化,而TN含量则平均降低了26.43%,TP含量平均增加了30.07%。进一步分析不同处理各养分参数随培育时间的动态变化规律,发现添加生物炭处理的BF和BSF的TN、TP和TK含量随培育时间均未发生显著变化;而S处理的TN含量随培育时间增加而升高,其在70 d时的含量为17.27 g·kg–1,是其余三个时期的1.21倍~1.39倍。
|
|
表 2 残留有机物料的全碳及养分含量 Table 2 The content of total carbon and other nutrients in residual organic materials |
表 3的相关性分析结果显示,在7 d和70 d时,Fg含量与残留有机物料的TC、TN、TP和TK显著正相关(P < 0.01),而与C0和C1显著负相关(P < 0.01)。在21 d和42 d时,Fg含量与残留有机物料的全碳及养分含量基本上没有显著相关性(P > 0.05)(除42 d与TN显著负相关之外)。
|
|
表 3 禾谷镰刀菌含量与残留有机物料性质的相关性(n = 12) Table 3 Correlation analysis between the abundance of Fusarium graminearum and the properties of residual organic materials |
α多样性用Chao1指数表征,其值越大,表明种群丰富度越高(图 3)。从整个培育周期来看,BF处理的Chao1指数随着培养时间无显著变化,而SF和BSF处理的Chao1指数均在第7天最高,然后随着培养时间增加而显著降低并保持平稳。就同一时期不同处理间的差异而言,BSF处理在四个采样时期基本上均处于最高水平,而S处理则为最低水平。
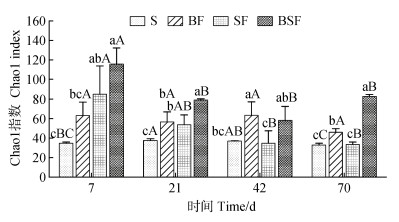
|
图 3 不同处理真菌群落α多样性 Fig. 3 α Diversity of fungal communities under different treatments |
基于Bray-Curtis距离对四个采样时期的真菌群落进行PCoA分析,并利用CCA分析研究Fg和有机物料性质对真菌群落组成的影响。结果显示(图 4),在第7天,PCoA1轴和PCoA2轴分别解释了48.84%和36.37%的真菌群落组成变异,多元响应置换分析表明各处理的真菌群落组成两两差异显著(P < 0.01);蒙特卡洛置换检验结果进一步显示,C1、Fg、TP、C0、TK、TC和TN依次是显著驱动该时期不同有机物料中真菌群落组成变化的主要环境因子。在第21天,PCoA1轴和PCoA2轴分别解释了31.10%和19.84%的真菌群落组成变异,且各处理的真菌群落组成两两差异显著(P < 0.01);蒙特卡洛置换检验表明,TP和Fg依次是显著驱动该时期不同有机物料中真菌群落组成变化的主要环境因子。在第42天,PCoA1轴和PCoA2轴分别解释了26.38%和23.33%的真菌群落组成变异,且组间群落两两差异显著(P < 0.01);TK、C1、TC、C0、TN、TP和Fg依次是显著驱动该时期不同有机物料中真菌群落结构变化的主要环境因子。在第70天,PCoA1轴和PCoA2轴分别解释了23.34%和16.88%的真菌群落组成变异,四个处理之间的真菌群落组成差异显著(P < 0.01);TC、TK、TP和Fg依次是显著驱动该时期不同有机物料中真菌群落结构变化的主要环境因子。以上结果表明残留有机物料中Fg含量的动态变化与真菌群落组成显著相关,且残留有机物料的全碳及养分含量是驱动各个培育时间真菌群落组成差异的决定因子。
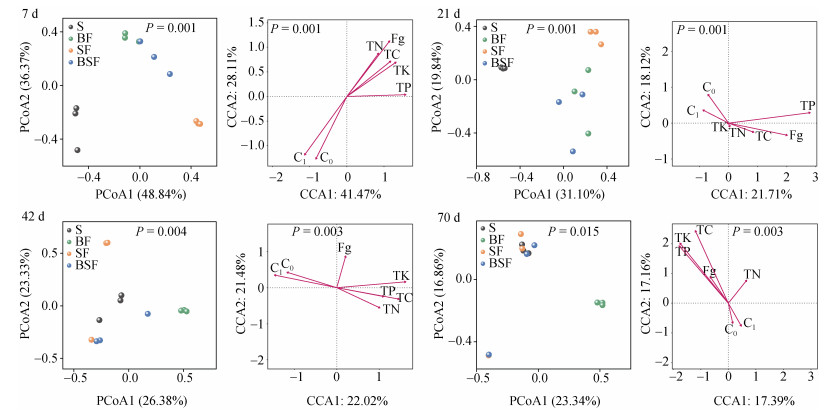
|
图 4 有机物料真菌群落的主坐标分析及其与全碳和养分性质的典范相关分析 Fig. 4 Principal coordinate analysis(PCoA)of fungal communities of organic material under different treatments and canonical correspondence analysis(CCA)of the fungal communities with total carbon and other properties of organic materials |
筛选出相对丰度排在前50的ASVs,其累计相对丰度占总相对丰度的93.57%,并将其视为影响真菌群落组成的优势ASVs。进一步对这50个优势ASVs进行属水平上的归类得到16个优势属,并通过随机森林分析评估了这些优势属对Fg含量变化的重要性(图 5),结果发现有5个属的重要性达到显著水平,其中镰刀菌属(Fusarium)是影响Fg含量变化最重要的因素,其次分别为帚枝霉属(Sarocladium)、Dirkmeia、腐质霉属(Humicola)和外瓶霉属(Exophiala)。
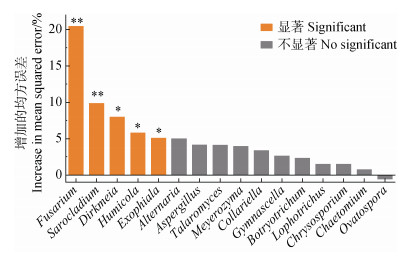
|
图 5 随机森林评估真菌优势属对禾谷镰刀菌含量变化的重要性 Fig. 5 Random forest estimating the importance of fungal dominant genera on variations of Fusarium graminearum abundance |
进一步利用热图展示这5个优势属在不同培育时期各个处理之间的分布差异(图 6)。结果表明,与Fg含量变化相似,S处理的镰刀菌属(Fusarium)在整个培育期的平均相对丰度最低。与S处理相比,SF、BF和BSF处理均不同程度地富集了镰刀菌属(Fusarium),其中以BF处理的富集最为明显,其次为SF处理和BSF处理。此外,BF处理在21、42和70 d时相较于SF和BSF处理均明显富集了外瓶霉属(Exophiala),在7 d和21 d则显著富集了Dirkmeia。BSF处理在四个采样时期均明显富集了帚枝霉属(Sarocladium)。
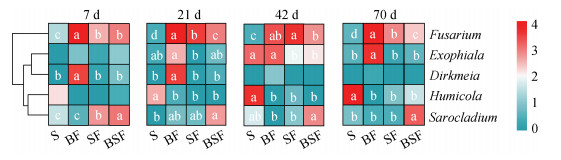
|
注:图中颜色越趋近红色表示对应处理的该物种丰度越高,越趋近绿色表示对应处理的该物种丰度越低。同一聚类树表示丰度分布相似。热图中相同时期同一行不同小写字母表示不同处理之间差异显著(P < 0.05),未标记字母的表示不同处理之间两两差异不显著(P>0.05)。 Note:In this figure,the closer the color to red,the higher the relative abundance of fungal genus in the corresponding treatment,and the closer the color to green,the lower the relative abundance of fungal genus in the corresponding treatment. The same cluster tree indicates similar abundance distribution. In the heatmap,different lowercase letters in the same row at the same period indicate significant differences among the treatments(P < 0.05),while unmarked lowercase letters in the same row indicate no significant differences between the treatments(P>0.05). 图 6 不同处理下真菌优势属的丰度差异 Fig. 6 Differences in the relative abundance of fungal dominant genera under different treatments |
当秸秆中没有添加外源禾谷镰刀菌(Fg)时,70 d的培育过程均未监测到Fg的存在(图 1),说明本研究所施用的玉米秸秆自身不含Fg。比较起始添加相同浓度Fg到玉米秸秆(SF)、生物炭(BF)、玉米秸秆和生物炭混合有机物料(BSF)中时,从4个监测时间的平均值来看,Fg含量在BF处理中最高,而在BSF处理中最低,SF处理中的Fg含量则介于上述两处理之间。这说明与单施玉米秸秆相比,单施生物炭表现了促进Fg生长的效应,而在生物炭与秸秆混合培养后,则显示抑制了禾谷镰刀菌生长的效应。进一步相关性分析发现(表 3),Fg含量与残留有机物料的TC、TN、TP和TK显著正相关,与潜在可矿化碳(C0)和易矿化碳(C1)显著负相关;而CCA结果(图 4)显示Fg和有机物料碳及养分性质是驱动真菌群落组成变化的关键因子,暗示有机物料分解过程中Fg含量的动态变化可能同时受制于残留有机物料的性质及其驱动的真菌群落组成变化的影响。本研究发现BF处理的TC、TN、TP和TK在所有处理中最高(表 2),但C0和C1则显示最低(表 1),分别仅有2.45 g·kg–1和0.03 g·kg–1,说明生物炭中有机碳的矿化进行得非常缓慢,暗示其对Fg生长的促进效果可能并非来自TC所提供的可利用碳源。而尽管BSF处理的TC、TN、TP和TK含量显著高于SF处理,但其Fg含量则小于SF处理,暗示其他因素,即真菌群落组成变化,对BSF处理中Fg生长的影响可能超过残留有机物料中碳及养分含量变化的影响。
3.1 残留有机物料碳和养分含量对Fg含量的影响已有大量研究表明,养分含量的增加促进病害菌的生长。刘东海等[24]发现,在黄棕壤中施用氮磷钾+常量有机肥后,土壤中的碱解氮、速效磷、速效钾和有机质含量均显著提高,而土壤中的病理营养型真菌丰度也随之增多。Lekberg等[25]认为单施高量化学氮肥使植物病原体丰度升高,易引起作物病害发生。冯雷等[26]指出,核桃腐烂病病害植株的韧皮部分全碳和速效氮含量大于健康植株,病斑面积与枝条的氮钾比显著正相关。作为一种常见的土传或气传病原真菌,Fg能根据环境条件表现为活体营养型和腐生营养型,其在寄主上形成菌丝体和分生孢子作为吸器吸收营养物质;同时,Fg也是一种r策略型微生物,通常会在资源充足的条件下表现出喜好利用易获取的养分来最大化自身内在增长率的特点[27]。因此,有理由认为残余有机物料分解过程中的性质变化很可能会影响Fg生长所需养分的供给水平,最终影响其生长。
本研究中,尽管BF处理于四个采样时期的残留有机物料的TC、TN、TP和TK含量均表现最高,但其对Fg生长的促进效果可能并非来自TC所提供的可利用碳源,因为该处理的潜在可矿化碳和易利用碳含量处于极低水平,说明生物炭在整个培育时期降解得极为缓慢,其有机碳很难被微生物矿化,这主要是由于生物炭芳香结构的高稳定性使其大部分的碳无法被微生物直接利用所致[28]。因此,BF处理增加Fg含量的潜在机制可能涉及到两个层面:(1)高碳水平促成更多适合微生物生长繁殖的微孔结构的形成。有研究报道生物炭具有的独特多孔结构能充当庇护所为多种微生物提供栖息空间[29],而其微孔结构的促成又被认为与高有机碳含量密切相关[30]。因此,BF处理增加Fg含量可能是由于其高碳水平促成的更多微孔结构形成所产生的物理庇护所致。(2)矿质养分元素的增多。不少研究发现生物炭在制作过程中会产生大量灰分,即矿质元素组成的氧化物或无机盐类物质,这些灰分被认为能作为微生物稳定代谢的驱动力为其生长提供各种无机营养基质,促进微生物群落的增殖[31]。所以,BF处理增加Fg含量或许也与生物炭提供了更多的N、P、K等无机养分有关。
3.2 残留有机物料真菌群落组成对Fg含量的影响与S处理相比,添加Fg的BF、SF和BSF处理均不同程度提高了真菌群落的α多样性(图 3),表明Fg与残留有机物料的真菌群落产生了互作关系。基于PCoA的β多样性分析和CCA分析结果显示(图 4),在四个培育时期内,Fg含量均是驱动真菌群落组成变化的重要因子之一,即真菌群落组成与Fg含量变化显著相关。基于随机森林分析(图 5),本研究最终筛选出了显著影响Fg含量变化的5个优势属:镰刀菌属(Fusarium)、帚枝霉属(Sarocladium)、Dirkmeia、腐质霉属(Humicola)和外瓶霉属(Exophiala)。
与其余处理相比(图 6),S处理在培养21、42和70 d时均显著富集了腐质霉属(Humicola),且其相对丰度有随着培育时间增加而升高的趋势。腐质霉属是一类秸秆促腐菌,来自该属的大部分物种已被报道能够产生纤维素/半纤维酶、木聚糖酶等来加速秸秆等有机物料的分解[32-34]。而BSF处理在整个培养时期内则显著富集了帚枝霉属(Sarocladium)。诸多研究表明帚枝霉属能够分泌多种抗真菌活性物质来抑制植物病原菌真菌的生长。Potshangbam等[35]研究发现从水稻和玉米植株中分离的内生菌株帚枝霉属能有效抑制禾谷镰刀菌和黄色镰刀菌等真菌的生长。Tian等[36]强调了帚枝霉属通常是镰刀菌属病原体的真菌拮抗剂。Maia等[37]发现来自帚枝霉属的物种具有抑制植物病原真菌的生防潜力,并将其鉴定为真菌病原体的拮抗剂之一,这些内生微生物被寄主植物招募并产生能促进植物生长和诱导植物抗病的生物活性化合物[38]。因此,BSF处理中较低水平的Fg含量很可能与其富集的帚枝霉属所产生的拮抗效应有关。而BSF处理又表现出较高水平的潜在可矿化碳含量(C0)(表 1);潜在可矿化碳在本研究中指有机物料中能被分解利用的总有机碳,常用来表征生物有效性碳库的大小[39]。帚枝霉属隶属于子囊菌门,在碳利用营养策略上属于富营养型微生物,通常具有生长迅速且偏好利用富含活性碳源和其他养分的底物的特点[40-41]。因此,BSF处理中较高水平的潜在可矿化碳很可能为具有生防潜力的帚枝霉菌提供了充足的可利用碳源,促进其生长繁殖,最终表现出抑制Fg生长的效应。本研究进一步发现BF处理在7 d和21 d时均明显富集了Dirkmeia属。也有研究发现Dirkmeia在火龙果茎溃病中的丰度明显高于健康植株[42],且Dirkmeia属中的Ustilgo maydis被报道能引起玉米黑腐病[43],表明BF处理在培养初期也富集了除Fg之外的其他潜在致病菌。Abdullah等[44]曾指出病原菌能相互产生对发病机制至关重要的生化信号或者交换生存资源进行功能互补从而发挥协同作用。Seybold等[45]也认为一些病原菌能够协同互作,其中一种病原菌的存在可能会增强另一种病原体的丰度和/或毒性。因此,推测BF处理在7 d和21 d时表现出较高水平的Fg含量可能与其富集的Dirkmeia属所产生的互利效应有关。此外,本研究发现BF处理在21、42和70 d时也明显富集了外瓶霉属(Exophiala)。有研究报道外瓶霉属的大部分物种能导致人类、动物和植物患病[46],也是一类潜在的致病性真菌。袁毅等[47]研究指出外瓶霉属具有较强的降解能力,能分解多种酚类化合物,其在BF处理中的富集可能有利于将生物炭中难利用的碳组分强力分解为一定数量的可利用碳,从为后续Fg的营养生长提供了条件。综上所述,BF处理在各个时期较高水平的Fg含量除了与残余有机物料丰富的养分性质有关,还可能是由于Fg与该处理富集的Dirkmeia和Exophiala等潜在致病菌所产生的协同效应有关。
实际上,禾谷镰刀菌在田间的生长基质主要为秸秆,前茬作物秸秆携带的病菌子囊壳或分生孢子通常是来年小麦赤霉病爆发的初侵染源[5,10]。而农业中小麦赤霉病的爆发往往具有较为严格的时间性,一般集中在每年的4月和5月,尤其以小麦的扬花期最为严重[48]。当环境温度和湿度达到最适条件时,小麦赤霉病发病率及病情指数往往与田间携带菌源数量有着极显著的正向关系[49-50],因此在病害高发期之前将田间菌源数量降低到一定水平即可有效防控小麦赤霉病。本研究为期70 d的室内培育试验结果显示,与BF和SF处理相比,BSF处理显著降低禾谷镰刀菌含量分别达84.07%和69.11%,说明秸秆还田基础上施用生物炭在降低田间菌源水平上具有较好的潜力。换言之,如果在小麦抽穗扬花期之前及时向存留大量前茬作物秸秆的田地施用一定量的生物炭,或许有利于减轻小麦赤霉病的爆发,而根据本文禾谷镰刀菌含量随时间的动态变化规律,初步建议生物炭投入田间的最佳时间应设定在小麦扬花期前的一到两个月。最后,尽管本研究结果为从小麦赤霉病防治角度合理选择适宜的有机物料进行土壤培肥提供了新视角,但仍亟需将土壤这一复杂因素继续纳入研究,借助室内培育试验、盆栽试验以及大田试验等手段加以验证。
4 结论本研究基于为期70 d的室内培育试验发现,单施生物炭(BF)显著提高了Fg含量,秸秆和生物炭混施(BFS)则显著降低了Fg含量,而单施秸秆(SF)处理的Fg含量介于两者之间。BF处理较高的Fg含量不仅与其更高水平的TC引起的生长环境改变,及升高的养分含量有关,还可能与它们驱动富集了与植物病害相关的Dirkmeia和外瓶霉属(Exophiala)有关。而BSF处理Fg含量主要受制于真菌群落变化的影响,其较低水平的Fg含量可能与其富集的具有潜在拮抗效应的帚枝霉属(Sarocladium)有关。
| [1] |
Munkvold G P. Epidemiology of Fusarium diseases and their mycotoxins in maize ears[J]. European Journal of Plant Pathology, 2003, 109(7): 705-713. DOI:10.1023/A:1026078324268
(  0) 0) |
| [2] |
Goswami R S, Corby Kistler H. Heading for disaster: Fusarium graminearum on cereal crops[J]. Molecular Plant Pathology, 2004, 5(6): 515-525. DOI:10.1111/j.1364-3703.2004.00252.x
(  0) 0) |
| [3] |
Bal G, Shaner G. Scab of wheat: Prospects for control[J]. Plant Disease, 1994, 78(8): 760-766. DOI:10.1094/PD-78-0760
(  0) 0) |
| [4] |
Niu W J. Physicochemical composition and energy potential of main crop straw and stalk[D]. Beijing: China Agricultural University, 2015.[牛文娟. 主要农作物秸秆组成成分和能源利用潜力[D]. 北京: 中国农业大学, 2015.]
(  0) 0) |
| [5] |
Zhou Y P, Zhou T T, Zhao W H, et al. Dynamic analysis on antagonistic Streptomyces against growth and decline of Fusarium graminearum during straw degradation (In Chinese)[J]. Soils, 2022, 54(1): 32-39. [周云鹏, 周谈坛, 赵文慧, 等. 秸秆降解过程中拮抗链霉菌对禾谷镰刀菌消长动态的影响[J]. 土壤, 2022, 54(1): 32-39.]
(  0) 0) |
| [6] |
Ma H X, Zhang X, Yao J B, et al. Breeding for the resistance to Fusarium head blight of wheat in China[J]. Frontiers of Agricultural Science and Engineering, 2019, 6(3): 251-264. DOI:10.15302/J-FASE-2019262
(  0) 0) |
| [7] |
Markell S G, Francl L J. Fusarium head blight inoculum: Species prevalence and Gibberella zeae spore type[J]. Plant Disease, 2003, 87(7): 814-820. DOI:10.1094/PDIS.2003.87.7.814
(  0) 0) |
| [8] |
Parry D W, Jenkinson P, McLeod L. Fusarium ear blight(scab)in small grain cereals—A review[J]. Plant Pathology, 1995, 44(2): 207-238. DOI:10.1111/j.1365-3059.1995.tb02773.x
(  0) 0) |
| [9] |
Sutton J C. Epidemiology of wheat head blight and maize ear rot caused by Fusarium graminearum[J]. Canadian Journal of Plant Pathology, 1982, 4(2): 195-209. DOI:10.1080/07060668209501326
(  0) 0) |
| [10] |
Chen A H, Islam T, Ma Z H. An integrated pest management program for managing fusarium head blight disease in cereals[J]. Journal of Integrative Agriculture, 2022, 21(12): 3434-3444. DOI:10.1016/j.jia.2022.08.053
(  0) 0) |
| [11] |
Qiao Y Q, Cao C F, Zhao Z, et al. Effects of straw- returning and N-fertilizer application on yield, quality and occurrence of Fusarium head blight of wheat (In Chinese)[J]. Journal of Triticeae Crops, 2013, 33(4): 727-731. [乔玉强, 曹承富, 赵竹, 等. 秸秆还田与施氮量对小麦产量和品质及赤霉病发生的影响[J]. 麦类作物学报, 2013, 33(4): 727-731.]
(  0) 0) |
| [12] |
Leplat J, Heraud C, Gautheron E, et al. Colonization dynamic of various crop residues by Fusarium graminearum monitored through real-time PCR measurements[J]. Journal of Applied Microbiology, 2016, 121(5): 1394-1405. DOI:10.1111/jam.13259
(  0) 0) |
| [13] |
Wang Z G, Ma Y Y, Wang X N, et al. Effects of biochar input on soil organic carbon and maize growth (In Chinese)[J]. Xinjiang Agricultural Sciences, 2022, 59(4): 818-826. DOI:10.6048/j.issn.1001-4330.2022.04.005 [汪振国, 马媛媛, 王西娜, 等. 生物炭输入对土壤有机碳和玉米生长的影响[J]. 新疆农业科学, 2022, 59(4): 818-826.]
(  0) 0) |
| [14] |
Silber A, Levkovitch I, Graber E R. pH-dependent mineral release and surface properties of cornstraw biochar: Agronomic implications[J]. Environmental Science & Technology, 2010, 44(24): 9318-9323.
(  0) 0) |
| [15] |
Liu Q, Liu B J, Zhang Y H, et al. Biochar application as a tool to decrease soil nitrogen losses(NH3 volatilization, N2O emissions, and N leaching)from croplands: Options and mitigation strength in a global perspective[J]. Global Change Biology, 2019, 25(6): 2077-2093. DOI:10.1111/gcb.14613
(  0) 0) |
| [16] |
Liang B, Lehmann J, Solomon D, et al. Black carbon increases cation exchange capacity in soils[J]. Soil Science Society of America Journal, 2006, 70(5): 1719-1730. DOI:10.2136/sssaj2005.0383
(  0) 0) |
| [17] |
Chen J H, Chen D, Xu Q F, et al. Organic carbon quality, composition of main microbial groups, enzyme activities, and temperature sensitivity of soil respiration of an acid paddy soil treated with biochar[J]. Biology and Fertility of Soils, 2019, 55(2): 185-197. DOI:10.1007/s00374-018-1333-2
(  0) 0) |
| [18] |
Jaiswal A K, Elad Y, Paudel I, et al. Linking the belowground microbial composition, diversity and activity to soilborne disease suppression and growth promotion of tomato amended with biochar[J]. Scientific Reports, 2017, 7: 44382. DOI:10.1038/srep44382
(  0) 0) |
| [19] |
Liu Y, Shi W Q, Zeng F S, et al. Effect of biochar on controlling wheat Fusarium head blight and yield (In Chinese)[J]. Plant Protection, 2020, 46(4): 270—274, 281. [刘悦, 史文琦, 曾凡松, 等. 生物炭对小麦赤霉病的防治效果及产量的影响[J]. 植物保护, 2020, 46(4): 270—274, 281.]
(  0) 0) |
| [20] |
Liu C L, Wang S, Yang F, et al. Effect of biochar treatments on Fusarium graminearum suppression and plant growth promotion in maize (In Chinese)[J]. Heilongjiang Agricultural Sciences, 2018(9): 51-54. [刘春来, 王爽, 杨帆, 等. 生物碳对玉米茎腐病控害作用及植株生长的影响[J]. 黑龙江农业科学, 2018(9): 51-54.]
(  0) 0) |
| [21] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [22] |
Gu W J, Lu Y S, Tan Z Y, et al. Fungi diversity from different depths and times in chicken manure waste static aerobic composting[J]. Bioresource Technology, 2017, 239: 447-453. DOI:10.1016/j.biortech.2017.04.047
(  0) 0) |
| [23] |
Dyer R B, Kendra D F, Brown D W. Real-time PCR assay to quantify Fusarium graminearum wild-type and recombinant mutant DNA in plant material[J]. Journal of Microbiological Methods, 2006, 67(3): 534-542. DOI:10.1016/j.mimet.2006.05.011
(  0) 0) |
| [24] |
Liu D H, Zhang Z, Qiao Y, et al. Response of soil fungal community structure to long-term fertilization in yellow-brown paddy soil (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2023, 29(6): 1112-1124. [刘东海, 张智, 乔艳, 等. 长期施肥对黄棕壤水稻土真菌群落结构的影响[J]. 植物营养与肥料学报, 2023, 29(6): 1112-1124.]
(  0) 0) |
| [25] |
Lekberg Y, Arnillas C A, Borer E T, et al. Nitrogen and phosphorus fertilization consistently favor pathogenic over mutualistic fungi in grassland soils[J]. Nature Communications, 2021, 12(1): 3484. DOI:10.1038/s41467-021-23605-y
(  0) 0) |
| [26] |
Feng L, Xu W L, Xue Q H, et al. Effects of mineral elements on harm degree of Juglans regia canker (In Chinese)[J]. Nonwood Forest Research, 2017, 35(4): 49-56. [冯雷, 徐万里, 薛权宏, 等. 矿质元素对核桃腐烂病病害程度的影响[J]. 经济林研究, 2017, 35(4): 49-56.]
(  0) 0) |
| [27] |
Leplat J, Friberg H, Abid M, et al. Survival of Fusarium graminearum, the causal agent of Fusarium head blight. A review[J]. Agronomy for Sustainable Development, 2013, 33(1): 97-111. DOI:10.1007/s13593-012-0098-5
(  0) 0) |
| [28] |
Bai Y, Su X F, Gu X, et al. Progress of research on the effect of biochar addition on soil microorganisms (In Chinese)[J]. Environmental Science, 2025, 46(4): 2600-2610. [白艳, 苏小粉, 顾欣, 等. 生物炭影响耕地土壤微生物的研究进展[J]. 环境科学, 2025, 46(4): 2600-2610.]
(  0) 0) |
| [29] |
Liu J L, Zhang Y R, Wang Y G, et al. Research progress on the effects of biochar on soil microorganisms (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2023, 39(26): 60-66. DOI:10.11924/j.issn.1000-6850.casb2023-0204 [刘金灵, 张亚茹, 王宇光, 等. 生物炭对土壤微生物影响的研究进展[J]. 中国农学通报, 2023, 39(26): 60-66.]
(  0) 0) |
| [30] |
Leng L J, Xiong Q, Yang L H, et al. An overview on engineering the surface area and porosity of biochar[J]. Science of the Total Environment, 2021, 763: 144204. DOI:10.1016/j.scitotenv.2020.144204
(  0) 0) |
| [31] |
Dai Z M, Xiong X Q, Zhu H, et al. Association of biochar properties with changes in soil bacterial, fungal and fauna communities and nutrient cycling processes[J]. Biochar, 2021, 3: 239-254. DOI:10.1007/s42773-021-00099-x
(  0) 0) |
| [32] |
Cintra L C, Fernandes A G, de Oliveira I C M, et al. Characterization of a recombinant xylose tolerant β-xylosidase from Humicola grisea var. Thermoidea and its use in sugarcane bagasse hydrolysis[J]. International Journal of Biological Macromolecules, 2017, 105: 262-271. DOI:10.1016/j.ijbiomac.2017.07.039
(  0) 0) |
| [33] |
Wang Z Y, Xu B, Luo H Y, et al. Production pectin oligosaccharides using Humicola insolens Y1-derived unusual pectate lyase[J]. Journal of Bioscience and Bioengineering, 2020, 129(1): 16-22. DOI:10.1016/j.jbiosc.2019.07.005
(  0) 0) |
| [34] |
Oliveira G S, Ulhoa C J, Silveira M L, et al. An alkaline thermostable recombinant Humicola grisea var. Thermoidea cellobiohydrolase presents bifunctional(endo/exoglucanase)activity on cellulosic substrates[J]. World Journal of Microbiology & Biotechnology, 2013, 29(1): 19-26.
(  0) 0) |
| [35] |
Potshangbam M, Indira Devi S, Sahoo D, et al. Functional characterization of endophytic fungal community associated with Oryza sativa L. and Zea mays L.[J]. Frontiers in Microbiology, 2017, 8: 325.
(  0) 0) |
| [36] |
Tian Y, Tan Y L, Liu N, et al. Functional agents to biologically control deoxynivalenol contamination in cereal grains[J]. Frontiers in Microbiology, 2016, 7: 395.
(  0) 0) |
| [37] |
da Costa Maia N, da Costa Souza P N, Godinho B T V, et al. Fungal endophytes of Panicum maximum and Pennisetum purpureum: Isolation, identification, and determination of antifungal potential[J]. Revista Brasileira de Zootecnia, 2018, 47: e20170183.
(  0) 0) |
| [38] |
Segaran G, Sathiavelu M. Fungal endophytes: A potent biocontrol agent and a bioactive metabolites reservoir[J]. Biocatalysis and Agricultural Biotechnology, 2019, 21: 101284. DOI:10.1016/j.bcab.2019.101284
(  0) 0) |
| [39] |
Gao F, Lin W, Cui X Y. Seasonal dynamics of soil organic carbon mineralization for two forest types in Xiaoxing'an Mountains, China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2016, 27(1): 9-16. [高菲, 林维, 崔晓阳. 小兴安岭两种森林类型土壤有机碳矿化的季节动态[J]. 应用生态学报, 2016, 27(1): 9-16.]
(  0) 0) |
| [40] |
Chen X, Luo M, Liu Y X, et al. Linking carbon-degrading enzyme activity to microbial carbon-use trophic strategy under salinization in a subtropical tidal wetland[J]. Applied Soil Ecology, 2022, 174: 104421. DOI:10.1016/j.apsoil.2022.104421
(  0) 0) |
| [41] |
Fierer N, Bradford M A, Jackson R B. Toward an ecological classification of soil bacteria[J]. Ecology, 2007, 88(6): 1354-1364. DOI:10.1890/05-1839
(  0) 0) |
| [42] |
Yao Z T, Xian X Y, Li R F, et al. Characteristics of fungal community in stems of pitaya with canker disease (In Chinese)[J]. Journal of Southern Agriculture, 2023, 54(5): 1283-1292. DOI:10.3969/j.issn.2095-1191.2023.05.002 [姚姿婷, 贤小勇, 李瑞芳, 等. 火龙果茎溃疡病植株茎组织真菌群落特征分析[J]. 南方农业学报, 2023, 54(5): 1283-1292.]
(  0) 0) |
| [43] |
van der Klei I, Veenhuis M, Brul S, et al. Cytology, cell walls and septa: A summary of yeast cell biology from a phylogenetic perspective//Kurtzman C P, Fell J W, Boekhout T. The yeasts[M]. Amsterdam: Elsevier, 2011: 111—128.
(  0) 0) |
| [44] |
Abdullah A S, Moffat C S, Lopez-Ruiz F J, et al. Host-multi-pathogen warfare: Pathogen interactions in co-infected plants[J]. Frontiers in Plant Science, 2017, 8: 1806. DOI:10.3389/fpls.2017.01806
(  0) 0) |
| [45] |
Seybold H, Demetrowitsch T J, Hassani M A, et al. A fungal pathogen induces systemic susceptibility and systemic shifts in wheat metabolome and microbiome composition[J]. Nature Communications, 2020, 11(1): 1910. DOI:10.1038/s41467-020-15633-x
(  0) 0) |
| [46] |
Ren P P, Jiang Y L. A new recorded species of Exophiala in China (In Chinese)[J]. Journal of Mountain Agriculture and Biology, 2019, 38(5): 84-88. [任朋朋, 姜于兰. 外瓶霉属Exophiala一中国新记录种[J]. 山地农业生物学报, 2019, 38(5): 84-88.]
(  0) 0) |
| [47] |
Yuan Y, Chen Z Z, Yin Q Y, et al. Tolerance and degradation of the Exophiala isolates to creosote, PCP, copper naphthenate and CCA-c (In Chinese)[J]. Acta Mycologica Sinica, 1996, 15(1): 70-77. [袁毅, 陈宗泽, 殷勤燕, 等. 外瓶霉属真菌耐药性和降解能力的研究[J]. 菌物学报, 1996, 15(1): 70-77.]
(  0) 0) |
| [48] |
Chen Y, Wang J Q, Yang R M, et al. Current situation and management strategies of Fusarium head blight in China (In Chinese)[J]. Plant Protection, 2017, 43(5): 11-17. [陈云, 王建强, 杨荣明, 等. 小麦赤霉病发生危害形势及防控对策[J]. 植物保护, 2017, 43(5): 11-17.]
(  0) 0) |
| [49] |
Zhou Y P, Zhou T T, Li Z Q, et al. Soil Fusarium graminearum is inhibited by combined application of crop residues and an organic stimulant[J]. Applied Soil Ecology, 2024, 203: 105643.
(  0) 0) |
| [50] |
Li Z Q, Ma L, Zhang Y, et al. Effect of wheat cultivars with different resistance to Fusarium head blight on rhizosphere Fusarium graminearum abundance and microbial community composition[J]. Plant and Soil, 2020, 448(1): 383-397.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


