2. 土壤与农业可持续发全国重点实验室(中国科学院南京土壤研究所), 南京 211135
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China
塑料制品强度高、耐腐蚀、价格低廉,已成为人类日常生活及生产中不可或缺的一部分。2022年,全球塑料产量超过4亿t,其中我国塑料产量占全球总产量的32%[1]。然而,传统塑料在自然环境中极难降解,其广泛应用及不当的处理方式导致大量塑料长期残留在环境中,造成了严重的环境污染[2]。特别是在农业生产中,大量废弃的地膜、棚膜等塑料制品因回收率低而进入土壤环境,其不仅能够破坏土壤结构、降低土壤肥力,而且会对土壤动物、植物、微生物产生危害,严重威胁土壤生态系统健康[3]。
近年来,生物可降解塑料逐渐成为解决塑料污染问题的重要途径。2020年、2021年我国相继发布了《关于进一步加强塑料污染治理的意见》和《“十四五”塑料污染治理行动方案》,明确提出积极推广可循环、易回收、可降解塑料替代产品,支持生物可降解塑料的生产和应用。2023年国家发展和改革委员会修订发布的《产业结构调整指导目录(2024年本)》继续鼓励生物可降解塑料及其系列产品开发、生产与应用。因此,加快对生物可降解塑料的科学研究,推动生物可降解塑料的发展与应用,已成为我国塑料污染治理与生态可持续健康发展的重大科技需求。
作为传统塑料的替代品,生物可降解塑料既需要具备传统塑料优良的加工性能与使用性能,同时又必须在废弃后能够被特定环境中的微生物完全降解,不可对生态环境造成危害。土壤是各类生物可降解塑料废弃物的重要归趋,因此,本文重点关注土壤中生物可降解塑料的生态效应及微生物降解,以期为评价生物可降解塑料在土壤生态系统中应用的安全性提供科学依据,同时为生物可降解塑料的微生物降解研究提供参考。
1 生物可降解塑料的定义与分类生物可降解塑料是一类可在微生物作用下发生降解且最终转化为二氧化碳或(和)甲烷、水等物质的高分子聚合物[4]。虽然国内外对于生物可降解塑料已有多年的研究,但目前尚未形成统一的检测标准和认证评价体系,人们对于生物可降解塑料的认识仍存在一些误区。例如,将生物基塑料、可堆肥塑料等同于生物可降解塑料。生物基塑料是指以可再生生物质资源(如淀粉、纤维素等)为原料的塑料[5],其强调的是生产原料的可再生性和生物来源性,而生物可降解塑料则是根据塑料的生物降解性来定义的,二者是两个截然不同的概念。可堆肥塑料是指在堆肥条件下最终产物为二氧化碳、水和所含元素的矿化无机盐及生物质,且最终堆肥在重金属含量、生态毒性、残留碎片等方面符合相关标准的塑料,其对降解环境和最终产物的要求较生物可降解塑料更为明确和严格。此外,“生物可降解”不等于在任何环境中均可被快速降解,仅在特定的环境条件下(如合适的温度、湿度、微生物特征等),经过一定的降解周期,生物可降解塑料才能被完全降解。因此,使用生物可降解塑料并非意味着其废弃后可被随意丢弃,而应根据其降解特性选择适宜的处置条件进行妥善处理。
按照原料来源不同,生物可降解塑料可分为生物基生物可降解塑料和石油基生物可降解塑料[6]。生物基生物可降解塑料的生产原料是可再生材料,包括天然材料、微生物合成材料、微生物发酵结合化学合成材料和共混材料。目前研究较多的有聚羟基脂肪酸酯类聚合物(PHAs)、聚乳酸(PLA)、再生纤维素、热塑性淀粉等,其中PHAs类生物可降解塑料主要包括聚3-羟基丁酸酯(PHB)、3-羟基丁酸酯和3-羟基戊酸酯的共聚物(PHBV)以及3-羟基丁酸酯和3-羟基己酸酯的共聚物(PHBH)。石油基生物可降解塑料的生产原料为不可再生的石化资源,主要指聚酯类聚合物,包括聚己内酯(PCL)、聚乙醇酸(PGA)、聚碳酸亚内酯(PPC)以及二元酸二元醇共聚酯,例如,聚对苯二甲酸/丁二酸丁二酯(PBST)、聚丁二酸丁二醇酯(PBS)、聚己二酸/对苯二甲酸丁二醇酯(PBAT)和聚己二酸/丁二酸丁二醇酯(PBSA)等。
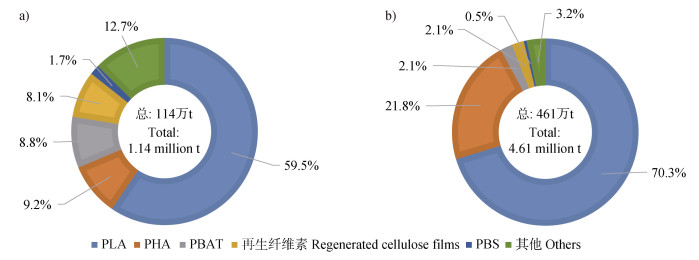
根据欧洲生物塑料协会统计,PLA是目前全球产能最高的生物可降解塑料,约占全球生物可降解塑料总产能的59.5%,其他生物可降解塑料,如PHA(9.2%)和PBAT(8.8%),也均能大规模工业化生产(图 1)。随着市场需求的不断增长以及应用领域的多样化,生物可降解塑料的全球产能将以较高的增长率持续增加。预计至2028年,生物可降解塑料的全球产能将从2023年的114万t增加至461万t[7]。
|
注:PLA,聚乳酸;PHA,聚羟基脂肪酸酯;PBAT,聚己二酸/对苯二甲酸丁二醇酯;PBS,聚丁二酸丁二醇酯。下同。 Note:PLA,Poly(lactic acid);PHA,Poly(hydroxyalkanoate);PBAT,Poly(butylene adipate-co-terephthalate);PBS,Poly(butylene succinate). The same below. 图 1 生物可降解塑料的全球年产能(a. 2023年;b. 2028年)(数据来源于European Bioplastics(https://www.european-bioplastics.org/market/))[7] Fig. 1 Global production capacities of biodegradable plastics(a. in 2023;b. in 2028)(data derived from European Bioplastics(https://www.european-bioplastics.org/market/))[7] |
残留在土壤中的传统塑料碎片因其密度较土壤颗粒小,会直接影响土壤密度,导致土壤容重降低[8]。传统塑料碎片或微塑料也可参与土壤团聚体的形成,影响土壤团聚体的组成、周转与稳定性[9],导致土壤通透性和孔隙度发生变化,破坏土壤结构[10],影响土壤中水分和养分的运移。与传统塑料类似,生物可降解塑料作为一种物理输入也会影响土壤容重、团聚体结构、渗透性、持水能力等土壤物理性质。但是,由于生物可降解塑料在物理性质、化学结构及生物降解性能方面与传统塑料存在较大差别,其对土壤物理性质的影响可能不同于传统塑料。Zhao等[11]通过田间填埋试验发现低密度聚乙烯(LDPE)显著降低了土壤大团聚体(> 0.25 mm)的比例而增加了微团聚体(0.25~0.1 mm)的比例,生物可降解塑料显著降低了土壤大团聚体的比例而增加了黏粒/粉粒(< 0.1 mm)的比例,表明LDPE和生物可降解塑料对土壤团聚体结构组成的影响存在显著差异。Qi等[12]研究表明,不同尺寸(约5 mm和小于1 mm)的LDPE和淀粉基生物可降解塑料碎片均对土壤容重、孔隙度、饱和导水率、田间持水量和土壤憎水性产生了显著影响,但其影响与塑料碎片的类型、尺寸大小和浓度密切相关。
相较于传统塑料,生物可降解塑料易被土壤微生物降解,因此,进入土壤环境的生物可降解塑料不但是一种物理输入,更是一种化学输入。生物可降解塑料本身是一种生物可利用的有机碳,其降解过程本质上是一种碳转化过程,与土壤中碳、氮等重要生源要素的生物地球化学循环存在复杂的耦合关系[13]。因此,生物可降解塑料的输入可能引起土壤养分循环的变化,进而导致土壤养分失衡。Chen等[13]研究了PBAT微塑料对土壤有机碳氮库组分的影响,结果发现添加5%~10%的PBAT微塑料可使土壤全碳、颗粒态有机质-碳、溶解性有机质-碳和矿物结合态有机质-碳分别增加116.0%~191.1%、546.9%~697.8%、54.2%~90.3%和13.7%~18.9%,而使溶解性有机质-氮减少46.9%~84.3%,表明PBAT可导致土壤碳富集和不稳定氮流失。Meng等[14]研究发现不可降解的聚乙烯(PE)微塑料对土壤有机碳、氮循环无显著影响,而2.0%和2.5%的生物可降解微塑料在培养第46和105天显著提高了土壤溶解性有机碳、溶解性有机氮含量,在第46天降低了土壤速效氮(硝态氮和氨态氮)含量,表明生物可降解微塑料对土壤有机碳、氮的影响较不可降解的PE微塑料更强。Zhou等[15]研究发现添加PHBV显著降低了土壤中的可溶性有机氮,而增加了土壤微生物生物量氮,表明PHBV较高的C:N可导致微生物同化固定土壤中可利用的氮,进而影响土壤中的氮素周转。与实验室内高剂量添加试验相比,在基于实际低水平添加量的田间试验中,生物可降解塑料对土壤理化特性的不良影响较小[16]。因此,未来应根据田间实际残留量开展长期暴露试验,以评估生物可降解塑料对土壤生态系统构成的现实风险。总体而言,目前有关生物可降解塑料对土壤性质影响的研究仍然较少,关于生物可降解塑料与土壤组分的相互作用及其改变土壤理化性质的效应与潜在机制仍需进一步深入探讨。
2.2 生物可降解塑料对土壤微生物的影响生物可降解塑料不但可作为碳源直接影响微生物的生长繁殖,也可通过改变土壤理化性质对微生物群落组成与功能产生间接影响。此外,生物可降解塑料还能释放增塑剂等物质对土壤微生物产生毒理效应。已有研究表明,埋藏在土壤中的生物可降解塑料能够导致微生物生物量、酶活性以及土壤微生物群落结构发生显著变化[17-18]。特别值得注意的是,作为一种异质性外源物质,生物可降解塑料进入土壤后可为土壤微生物提供独特的生态位,形成不同于周围土壤环境的“塑料际”。研究显示,土壤塑料际是潜在病原菌赋存的热点区域。Ju等[19]研究了土壤中附着在PE、PBAT、PLA及PBAT/PLA混合物薄膜上的微生物群落特征,结果发现与PE相比,与动植物病原相关的功能在四种生物可降解塑料薄膜上的富集程度更高。Li等[20]的研究同样发现PBAT/PLA塑料际动植物病原菌的相对丰度显著高于PE,表明生物可降解塑料的塑料际微生物群落具有较高的致病性。Juncheed等[21]评估了PBSA在田间条件下作为病原微生物载体的潜在风险,结果显示PBSA薄膜表面能够富集多种机会性人类病原菌和植物病原菌,表明土壤环境中生物可降解塑料的存在可能会对人类与作物健康产生潜在致病威胁。目前已开展的研究不仅利用高通量测序技术从基因水平上证实了土壤塑料际微生物的致病潜力,更有研究从塑料际分离筛选出了特定的植物致病菌。例如,Pang等[22]从塑料废弃物表面分离出239株具有PCL降解活性的菌株,其中包括镰刀菌属、新赤壳菌属以及链孢菌属在内的14个属均属于植物病原真菌。经过长期进化,植物病原菌已具备较强的植物表面定殖能力且能够通过分泌纤维素酶、角质酶、蛋白酶等破坏植物表皮角质层,以达到侵染植物的目的。生物可降解塑料与植物表皮角质层在结构组成上具有一定的相似性,它们均为由碳-碳或碳-氧键组成的高分子聚合物,这可能是某些植物病原菌能够在生物可降解塑料表面富集并表现出降解能力的重要原因。
土壤环境中生物可降解塑料会在生物与非生物等各种因素作用下发生破碎,形成小的塑料颗粒或碎片,即生物可降解微塑料。生物可降解微塑料可能会与传统微塑料相同,对土壤微生物群落结构、多样性及稳定性产生影响[23-24],进而危害土壤生态系统健康。Li等[25]研究发现PBAT微塑料对细菌群落的影响存在剂量效应,PBAT微塑料添加量较低时,土壤细菌群落多样性增加,而当PBAT微塑料添加量较高时,土壤细菌群落丰富度和多样性则显著降低。Sun等[26]通过60 d的微宇宙培养试验发现相较于传统微塑料(PE和聚苯乙烯(PS)),生物可降解微塑料(PBS和PLA)能够显著提高土壤细菌群落的演替速率及网络的复杂性与稳定性,PBS和PLA处理的土壤微生物群落网络规模、连接度、平均聚类系数更高且关键物种数更多,这可能是由于生物可降解微塑料作为生物可利用的碳源刺激了土壤微生物的生长繁殖,进而影响了物种间的互作关系。生物可降解微塑料不但能够影响土壤微生物群落组成与结构,还会通过碳源输入提高微生物活性和养分周转速率,进一步影响土壤微生物群落的生物地球化学循环功能[27]。目前有关生物可降解塑料对土壤微生物影响的研究尚处于起步阶段,已有的研究大多基于短期培养试验,且研究内容大多仅停留在土壤微生物群落组成与多样性的变化上,不同类型以及残留水平下生物可降解(微)塑料对不同类型土壤中微生物群落结构组成、代谢活性、生态功能的长期影响尚需进一步探究。
2.3 生物可降解塑料对植物生长发育的影响植物是陆地生态系统的重要组成部分,了解生物可降解塑料对陆生植物的影响对于评估生物可降解塑料在土壤环境中应用的安全性至关重要。目前,生物可降解塑料对植物生长发育的影响逐渐受到研究者的关注。部分研究发现生物可降解塑料不会对植物产生不利影响。例如,Chu等[28]研究表明,在田间试验条件下,不同形状(粉末状和纤维状)的PLA微塑料对燕麦和大豆生长均未产生显著影响,与对照土壤相比,添加PLA微塑料的处理土壤中植物的根系特征、植物生物量及作物产量均未发生明显变化。然而,有更多的研究表明生物可降解塑料会对植物产生一定的毒性效应。Brown等[29]研究显示,PHBV的存在不仅显著抑制玉米植株的生长,还会干扰玉米叶片代谢功能。Yu等[30]研究了PBAT微塑料对大豆和玉米根系特征的影响,结果表明土壤中PBAT微塑料的积累会显著抑制植物根系生长,PBAT微塑料导致收获期大豆总根长、总根表面积和根生物量分别降低了34%~58%、34%~54%和25%~40%,导致玉米总根长、总根表面积和根生物量分别降低了37%~71%、33%~71%和24%~64%。Zhou等[15]研究发现高浓度的PHBV微塑料具有强烈的植物毒性,PHBV微塑料的添加导致小麦在25 d后死亡。生物可降解塑料的植物毒性与塑料本身特征(类型、形态、尺寸、剂量)、供试植物种类、实验条件及评价终点等密切相关,而在不同研究中上述条件均不统一,从而导致不同研究得出的结论不尽相同。尽管如此,已有多项研究表明,生物可降解微塑料对植物造成的不利影响较传统微塑料更为严重[31-33]。对于生物可降解微塑料而言,其不仅能够像传统塑料那样在植物根部吸附积累并被植物吸收转运,给植物生长带来压力,而且可能产生对植物具有毒性效应的降解产物,进一步影响植物的生长发育。同时,生物可降解微塑料还能改变植物根际微环境,包括根际土壤理化和微生物特性,进而干扰植物生长。此外,生物可降解微塑料可能沿着食物链转移和积累,从而对人类健康构成直接威胁。虽然目前有关生物可降解塑料对植物的毒性效应研究已有开展,但相关报道仍较少且不够深入,大多研究未提供塑料降解产物具体成分的信息,对于生物可降解微塑料的生态毒性效应及机制的认识十分有限。研究导致生物可降解塑料植物毒性的具体产物信息及其毒性机制,能够为设计和生产安全无害的新型生物可降解塑料提供理论指导,此方面仍需大量研究加以支撑。
2.4 生物可降解塑料对土壤动物的影响蚯蚓在土壤生态系统中分布广泛且作用巨大,能够改善土壤结构、促进养分循环,进而促进植物生长发育。而且,由于蚯蚓对土壤环境变化极其敏感,已被广泛用作土壤中生物可降解塑料毒性效应的指示物。Holzinger等[34]研究发现,生物可降解塑料PLLA(聚L-乳酸)和PCL提高了赤子爱胜蚓的繁殖成功率,与对照相比,PLLA和PCL处理中赤子爱胜蚓产茧的数量分别提高了135%和54%,且这两种聚合物增加了孵化出的幼体数量,改变了肠道微生物群落β多样性,并增加了短链脂肪酸乳酸的含量。与之相反,Boots等[35]研究显示0.1%(w/w)的PLA微塑料虽然不会引起蚯蚓死亡,但导致蚯蚓生物量降低。Baihetiyaer等[36-37]研究发现PLA和杀虫剂吡虫啉(IMI)单独或联合暴露均能导致蚯蚓的氧化应激、DNA损伤和基因表达,并抑制蚯蚓生长、导致蚯蚓死亡率增加,同时造成表皮组织损伤及肠道微生物菌群失衡,对蚯蚓具有明显的毒性效应。除了蚯蚓,也有研究利用其他模式动物来测试生物可降解塑料的生态毒性。Schöpfer等[38]研究了LDPE和PLA/PBAT微塑料对秀丽隐杆线虫的毒性效应,结果发现LDPE和PLA/PBAT微塑料显著抑制了线虫的生长繁殖,且其抑制作用表现出明显的剂量效应,微塑料浓度越高抑制作用越强。现有研究大多使用蚯蚓等模式动物来评价生物可降解塑料的生态毒性,然而,不同物种的敏感性存在差异,不同类型生物可降解塑料对不同物种的毒理效应及机制尚需进一步探究。此外,基于动物个体的研究结果无法准确反映生物可降解塑料在群落、生态系统等更高水平上的毒性效应,生物可降解塑料对土壤动物的影响尚需从种群—群落—生态系统等各层级水平上进行耦合分析,以综合评价生物可降解塑料的动物毒性。
3 土壤中生物可降解塑料的微生物降解 3.1 土壤中生物可降解塑料的降解机制及影响因素生物可降解塑料可通过多种途径进入土壤环境,并在微生物作用下发生降解。土壤中生物可降解塑料的微生物降解过程较为复杂,通常需要经过定殖、解聚、同化或矿化等多个步骤才能彻底降解[39]。微生物在塑料表面吸附定殖是微生物降解生物可降解塑料的先决条件。研究表明,许多细菌和真菌类群能够在生物可降解塑料表面定殖并富集,形成在多样性、组成及功能上明显有别于周围土壤且具有塑料降解潜能的独特微生物群落[40]。第二步,定殖的具有生物可降解塑料降解能力的微生物分泌胞外水解酶,通过催化聚合物结构中可水解的化学键(如酯键)断裂,生成分子量较低的低聚物和单体。相较于高分子量聚合物,微生物对构成聚合物的单体或低聚物的降解速率要快得多[41],表明胞外水解酶催化的聚合物解聚是生物可降解塑料降解过程的限速步骤。最后,微生物将解聚产生的低聚物或单体转运至体内进一步降解代谢,经过β-氧化途径和三羧酸循环,最终矿化生成CO2、CH4和H2O或同化为微生物自身生物量。已有研究利用13C稳定同位素标记和纳米二次离子质谱等技术手段证明了生物可降解塑料的确能够被土壤微生物降解利用,13C标记的生物可降解塑料最终被矿化为13C-CO2及同化形成13C-微生物自身生物量[41-42]。
虽然生物可降解塑料是一种可降解材料,但是在实际土壤环境中的降解速率较为缓慢,很难在预期的时间内完全降解[43-44]。生物可降解塑料的可降解性与其本身的性质(如结构组成、表面亲疏水性、分子量、结晶度等)直接相关。一般而言,聚合物的表面疏水性越强、分子量越大、结晶度及熔融温度越高,越难以降解[45-46]。此外,材料的形状也是影响其降解的重要因素,材料的比表面积越大越有利于微生物的附着,其降解速率则越快。除了材料本身的性质,生物可降解塑料的降解速度也会受到温度、湿度、pH和微生物等多种环境因素的影响[47-48]。微生物是生物可降解塑料降解的核心驱动力,微生物特征是决定土壤中生物可降解塑料降解速率的关键因素。笔者前期通过灭菌土壤试验证实了土壤中PBAT的降解是由微生物介导的,而且发现不同类型土壤中PBAT降解速率的差异主要是由于土壤微生物群落差异导致的[49],具体而言,潜在降解微生物的富集程度越高,土壤对PBAT的降解能力越强。范森等[50]研究表明,PLA材料在沼泽地、芒果林地和稻田土壤中降解情况的差异与土壤微生物群落丰富度和多样性有关,微生物群落丰富度与多样性越高,PLA材料的降解效果越好。Yamamoto-Tamura等[51]研究发现PBSA在11种农田土壤中的降解速率存在显著差异,其在酯酶活性高、降解真菌数量大的土壤中降解较快。
目前关于生物可降解塑料在土壤环境中的降解性能研究大多是在受控实验室条件下进行的,然而,由于受到光照、气温、降水等气候因素的影响[52-53],生物可降解塑料在实际室外土壤中的降解行为可能不同于实验室条件。因此,需要进一步在实际环境中开展生物降解试验,这样才能更准确地反映材料的降解特性。同时,应结合影响生物可降解塑料降解的关键因素,深入探究土壤中生物可降解塑料的微生物降解机制,为合理调控生物可降解塑料在原位土壤环境中的降解速率、实现其高效降解提供理论依据,为研发性能优异的新型生物可降解塑料产品提供指导。
3.2 降解微生物微生物降解是土壤中生物可降解塑料降解的主要途径。目前已从农田土壤、森林土壤、垃圾填埋场土壤、活性污泥土壤等多种土壤环境中分离出大量具有生物可降解塑料降解能力的细菌和真菌(表 1),其中细菌主要来自放线菌门Actinobacteria,变形菌门Proteobacteria和厚壁菌门Firmicutes,真菌主要来自子囊菌门Ascomycota和接合菌亚门Zygomycotina。Chien等[54]从农田土壤中筛选出两株能够降解PBSA的真菌菌株Aspergillus fumigatus L30和Aspergillus terreus HC,培养30 d后分别导致PBSA薄膜质量损失30.2%和27.5%。刘佳茜等[55]从垃圾填埋场下层土壤中分离到6种潜在的PBAT降解细菌,其中Pseudomonas sp. RD1-3和Pseudomonas sp. N1-2的降解效率较高,28 ℃培养8周,二者对PBAT的降解率分别为6.88 % ± 0.06%和6.49% ± 0.01%。除了常见的典型土壤环境,生物可降解塑料降解微生物在极端土壤环境中也普遍存在。Urbanek等[56]从北极地区52个土壤样品中分离出121种具有生物可降解塑料降解活性的微生物(细菌113株,真菌8株),其中116、73、102和56种微生物分别能在PBSA、PBS、PCL和PLA平板上形成透明圈,菌株16G(Clonostachys rosea)表现出较高生物降解能力,在摇瓶试验中,该菌株在30 d内能将淀粉薄膜完全降解,PCL薄膜质量损失52.91%。
|
|
表 1 土壤中生物可降解塑料降解微生物 Table 1 Biodegradable plastics degrading microbes in soils |
相比于单一菌株,由多种微生物菌株构成的共培养体系或微生物菌群的降解效率可能更高。在共培养体系或微生物菌群中,具有不同遗传背景的菌株其功能通常具有协同互补性,它们可通过代谢分工、物质与能量交换等方式相互协作以实现生物可降解塑料的高效降解。据报道,单一的Stenotrophomonas maltophilia YB-6不能降解PBS,但将其与Fusarium solani WF-6进行混合培养则增强了菌株WF-6对PBS的降解能力[67],这可能是由于菌株YB-6能够代谢菌株WF-6降解PBS产生的中间产物,从而促进了PBS的生物降解。在另一项研究中,由菌株SUST B1、SUST B2和SUST B3组成的共培养体系对PBAT的降解效果明显优于单一菌株,培养6 d后导致PBAT薄膜质量损失26.1%[68],表明3种菌株对PBAT的降解过程存在协同作用。Jia等[69]报道了由Pseudomonas mendocina和Actinomucor elegans组成的共培养体系对PLA/PBAT的降解作用,该体系在5 d内对PLA/PBAT的降解率为18.95%,显著高于单一菌株的培养体系(P. mendocina(12.94%),A. elegans(9.27%)),进一步分析表明共培养体系中P. mendocina和A. elegans通过编码表达不同的酶发挥不同的功能,其中P. mendocina分泌蛋白酶催化PLA/PBAT中PLA酯键的水解断裂,A. elegans分泌的脂肪酶催化PBAT酯键的水解断裂,以实现PLA/PBAT的协同降解。
尽管越来越多的微生物被发现具有生物可降解塑料降解活性,但是目前对这些菌株的研究大多是在纯培养体系中进行的,很少被应用于实际土壤环境中,其在土壤中的降解效果会受到土壤温度、湿度、pH、土著微生物等多种因素的综合影响,可能难以达到理想的降解效果。此外,虽然微生物菌群在生物可降解塑料降解方面的作用正逐步受到关注,但关于降解菌群的合成构建、协同降解机制及强化修复研究尚十分有限。因此,未来需要在深入挖掘高效降解菌资源的基础上,设计构建高效降解菌群并解析其降解机制,进一步加强高效降解菌(群)对土壤环境中生物可降解塑料废弃物强化修复方面的研究,开发针对土壤中生物可降解塑料的微生物降解技术。
3.3 降解酶微生物降解生物可降解塑料是由一系列酶促反应完成的,其中催化聚合物解聚的酶是整个降解过程的限速酶。具有聚酯降解活性的酶主要为脂肪酶(EC 3.1.1.3)、酯酶(EC 3.1.1.1)和角质酶(EC 3.1.1.74)等丝氨酸水解酶[70-71],目前关于聚酯水解酶的基因克隆、异源表达、分离纯化及酶学性质已有大量文献报道[57,72-76]。Biundo等[72]对来源于菌株Pelosinus fermentans DSM 17108的脂肪酶PfL1进行了重组表达和酶学性质分析,结果显示PfL1能够降解PBAT,其分子量为43.9 kDa,最适反应温度为50 ℃,最适pH为7.5,序列比对、酶学性质及三维结构分析表明该酶属于I.5脂肪酶家族。Shah等[73]从菌株Roseateles depolymerans strain TB-87中分离出两种酯酶Est-H和Est-L,分子量分别为31和27 kDa,二者最适反应条件相同(最适温度为30 ℃,最适pH为9.0),且对PBSTIL(聚丁二酸/对苯二甲酸/间苯二甲酸/乳酸丁二醇酯)、PBS、PBSA和PCL等多种脂肪族聚酯和脂肪族-芳香族共聚酯均具有降解活性。Santos-Beneit等[76]测试了三种酶(角质酶FsCut、酯酶AbEst和芳基酯酶PsEst)对一系列生物可降解塑料(PBS、PBAT、PHB、PHBH、PHBV、PCL、PLA和PLA/PCL)的降解活性,结果发现角质酶FsCut能够降解多种生物可降解塑料,其对PBAT、PBS和PCL的降解活性最高,且该酶在较高的温度条件下(55 ℃和60 ℃)表现出较高的活性。
随着研究的深入,聚酯水解酶的三维结构与催化机制也得到了广泛的研究。所有的聚酯水解酶均属于α/β水解酶超家族,含有经典的α/β水解酶折叠催化结构域以及由丝氨酸(Ser)-组氨酸(His)-天冬氨酸(Asp)或谷氨酸(Glu)组成的催化三联体。Perz等[74]报道了来源于Clostridium hathewayi DSM-13479的酯酶Chath_Est1能够降解PBAT,通过晶体结构解析证实了该酶属于α/β水解酶,其含有由Ser200-His416-Glu323组成的催化三联体,并进一步通过底物对接和三维结构模拟分析了该酶的催化机制。Hajighasemi等[75]从90种纯化的微生物源α/β水解酶中筛选出2种对PLA、PCL及其他聚酯具有降解活性的酶(ABO2449和RPA1511),通过对RPA1511的晶体结构解析发现该酶含有典型的α/β-水解酶折叠结构和由Ser114-His270-Asp242组成的催化三联体,定点突变试验进一步证实催化三联体对聚酯和单酯底物的水解均至关重要,同时还在ABO2449和RPA1511中分别鉴定出对PLA水解也很关键的几个氨基酸残基(ABO2449中的Phe38和Leu152,RPA1511中的Gln172、Leu212、Met215、Trp218和Leu220)。此外,也有通过分子改造来提高聚酯水解酶催化效率和热稳定性的相关报道。Yang等[77]利用双突变策略增强了来源于Thermobifida fusca的角质酶TfCut对PBAT的降解效率,并通过晶体结构解析比较了野生型TfCut(WT TfCut)及其突变体(TfCut-DM)的底物结合特征,结果表明TfCut-DM底物结合口袋柔性增加可能是导致其降解效率提高的重要原因。
鉴于聚酯水解酶在生物可降解塑料降解过程中的关键作用,近年来研究者在聚酯水解酶的挖掘、功能验证、结构解析及分子改造等方面开展了一系列研究工作。目前聚酯水解酶的基因资源已较为丰富,且多种酶的生化性质也已被表征,但是现有的酶活性普遍偏低且稳定性较差,难以直接应用于土壤环境中生物可降解塑料废弃物的处理。因此,应继续筛选不同来源的高效降解酶,寻找具有工业化应用价值的新酶。同时,尚需进一步深入研究酶的构效关系,对已有的降解酶进行理性设计和定向改造以提高其活性与稳定性,为生物可降解塑料的原位高效降解提供更多的酶资源。
4 研究展望随着我国塑料污染治理政策的逐步完善与落实,发展生物可降解塑料已成为解决塑料污染问题的重要途径。深入研究生物可降解塑料在土壤环境中的生态效应与微生物降解机制,不仅能够深化对生物可降解塑料生态安全性的认识,还能够为实现生物可降解塑料在土壤中的高效可控降解提供理论指导,对于促进生物可降解塑料的推广应用、推动我国塑料污染治理与生态环境可持续发展具有重要意义。基于当前研究现状,对生物可降解塑料相关研究提出以下展望:
(1)需明确生物可降解塑料的环境影响来源与机制。生物可降解塑料制品成分复杂,在生产制造过程中通常会添加增塑剂、抗氧化剂、染料等添加剂,因此,需要研究这些添加剂的生态毒理效应。此外,在生物可降解塑料降解过程中产生的中间产物以及微生物代谢产物对土壤生态系统造成的影响尚未得到充分研究,只有明确生物可降解塑料的环境影响是来自聚合物本身、添加剂还是降解产物,深入了解生物可降解塑料对土壤健康的影响机制,从多角度全面评价生物可降解塑料的生态安全性,才能为生物可降解塑料的推广与合理应用提供科学指导。
(2)需加强生物可降解微塑料的生态效应研究。进入土壤中的生物可降解塑料,在被完全降解之前也会像传统塑料一样破碎形成微塑料。已有大量研究表明传统塑料形成的微塑料会对土壤动物、植物和微生物的产生危害,但目前关于生物可降解微塑料对土壤生态系统的影响尚未引起足够重视,相关研究较少。因此,需要加强生物可降解微塑料生态效应的研究,评估生物可降解微塑料对土壤生态系统的毒性效应及其通过食物链富集效应等途径对人类健康造成的潜在风险。
(3)需探究生物可降解塑料在原位土壤中的长期环境行为。基于室内培养的短期试验无法准确反映生物可降解塑料在实际土壤中的降解行为与生态效应,难以揭示生物可降解塑料对土壤生态环境的慢性累积毒性效应,其在原位土壤中的长期环境行为和潜在影响机制尚需深入探究。
(4)需挖掘高效降解菌(群)和功能酶,开展生物强化研究。虽然目前已筛选到多种具有生物可降解塑料降解功能的菌株与酶,但是已报道的菌株和酶降解效率普遍较低且其降解机制尚不明确。而且,关于降解菌和降解酶的研究多是在实验室纯培养体系中进行的,而对于其在实际土壤环境中的应用效果与强化机制研究较少。因此,需要进一步挖掘高效降解菌和功能酶资源,深入探究其降解机制,同时构建高效可控的合成微生物群落、利用蛋白质工程提高功能酶的活性和稳定性,在此基础上开展土壤环境中降解菌株(群)和功能酶的生物强化研究,通过生物强化实现土壤中生物可降解塑料的高效降解。
(5)需深入探讨土壤中生物可降解塑料的微生物降解机理。在实际土壤环境中生物可降解塑料的降解过程会受到多种内因(结构组成、分子量、结晶度等塑料自身性质)和外因(土壤温度、湿度、微生物群落特征等环境因素)的共同影响,导致不同种类生物可降解塑料在不同土壤环境中的降解周期存在不确定性,难以保障在合理的时间内彻底降解。因此,在未来研究中,应深入探讨土壤中生物可降解塑料的微生物降解机理,明确影响塑料降解过程的关键因素及其影响机制,为实现土壤中生物可降解塑料的高效可控降解提供理论指导。
(6)需加强技术攻关,健全标准体系,规范行业秩序。生物可降解塑料已逐步在农用地膜、食品包装、手术医疗等领域得到应用,但是目前尚处于初步探索阶段,除了存在生态效应不清和降解机制不明问题,生物可降解塑料应用中还面临其他诸多挑战。例如,相较于传统塑料,生物可降解塑料生产成本较高,加工性能与机械性能不足;生物可降解塑料的定义不明确,检测标准和认证评价体系不完善,相关制品鱼龙混杂;公众认识不足,回收处理方式不当,缺乏相应的分类回收处理配套设施,流入环境后也可能因无法完全降解而造成环境污染。因此,未来应加强生物可降解塑料关键技术研发,提升产品性能,降低产品价格;完善标准体系,建立健全生物可降解塑料认证体系,避免假冒伪劣产品进入市场;加大宣传力度,明确后端处置方式,建立有效的生物可降解塑料废弃物管理系统,推动生物可降解塑料的合理应用。
| [1] |
Plastics Europe. Plastics – the fast Facts 2023[OL]. https://plasticseurope.org/media/plastics-europe-launches-the-plastics-the-fast-facts-2023/. [2024-05-20].
(  0) 0) |
| [2] |
MacLeod M, Arp H P H, Tekman M B, et al. The global threat from plastic pollution[J]. Science, 2021, 373(6550): 61-65. DOI:10.1126/science.abg5433
(  0) 0) |
| [3] |
Zhu Y G, Zhu D, Xu T, et al. Impacts of(micro)plastics on soil ecosystem: Progress and perspective (In Chinese)[J]. Journal of Agro-Environment Science, 2019, 38(1): 1-6. [朱永官, 朱冬, 许通, 等. (微)塑料污染对土壤生态系统的影响: 进展与思考[J]. 农业环境科学学报, 2019, 38(1): 1-6.]
(  0) 0) |
| [4] |
Rai P, Mehrotra S, Priya S, et al. Recent advances in the sustainable design and applications of biodegradable polymers[J]. Bioresource Technology, 2021, 325: 124739. DOI:10.1016/j.biortech.2021.124739
(  0) 0) |
| [5] |
Lackner M, Mukherjee A, Koller M. What are "bioplastics"? Defining renewability, biosynthesis, biodegradability, and biocompatibility[J]. Polymers, 2023, 15(24): 4695. DOI:10.3390/polym15244695
(  0) 0) |
| [6] |
Liu J F, Zhe D M, Yang Y, et al. Research progress on classification and application of biodegradable plastics (In Chinese)[J]. Plastics Science and Technology, 2024, 52(1): 117-123. [刘金凤, 者东梅, 杨勇, 等. 生物降解塑料的分类和应用研究进展[J]. 塑料科技, 2024, 52(1): 117-123.]
(  0) 0) |
| [7] |
European Bioplastics. Bioplastics Market Data, 2023[OL]. https://www.european-bioplastics.org/market/. [2024-05-20].
(  0) 0) |
| [8] |
Ma R J, Xu Z N, Sun J Y, et al. Microplastics affect C, N, and P cycling in natural environments: Highlighting the driver of soil hydraulic properties[J]. Journal of Hazardous Materials, 2023, 459: 132326. DOI:10.1016/j.jhazmat.2023.132326
(  0) 0) |
| [9] |
Li X D, Wang R Y, Dai W, et al. Aging microplastics and coupling of "microplastic-electric fields" can affect soil water-stable aggregates' stability[J]. Journal of Hazardous Materials, 2024, 469: 134048. DOI:10.1016/j.jhazmat.2024.134048
(  0) 0) |
| [10] |
Wang Z C, Li W L, Li W P, et al. Effects of microplastics on the water characteristic curve of soils with different textures[J]. Chemosphere, 2023, 317: 137762. DOI:10.1016/j.chemosphere.2023.137762
(  0) 0) |
| [11] |
Zhao Z Y, Wang P Y, Wang Y B, et al. Fate of plastic film residues in agro-ecosystem and its effects on aggregate-associated soil carbon and nitrogen stocks[J]. Journal of Hazardous Materials, 2021, 416: 125954. DOI:10.1016/j.jhazmat.2021.125954
(  0) 0) |
| [12] |
Qi Y L, Beriot N, Gort G, et al. Impact of plastic mulch film debris on soil physicochemical and hydrological properties[J]. Environmental Pollution, 2020, 266: 115097. DOI:10.1016/j.envpol.2020.115097
(  0) 0) |
| [13] |
Chen M, Cao M, Zhang W, et al. Effect of biodegradable PBAT microplastics on the C and N accumulation of functional organic pools in tropical latosol[J]. Environment International, 2024, 183: 108393. DOI:10.1016/j.envint.2023.108393
(  0) 0) |
| [14] |
Meng F R, Yang X M, Riksen M, et al. Effect of different polymers of microplastics on soil organic carbon and nitrogen–A mesocosm experiment[J]. Environmental Research, 2022, 204: 111938. DOI:10.1016/j.envres.2021.111938
(  0) 0) |
| [15] |
Zhou J, Gui H, Banfield C C, et al. The microplastisphere: Biodegradable microplastics addition alters soil microbial community structure and function[J]. Soil Biology and Biochemistry, 2021, 156: 108211. DOI:10.1016/j.soilbio.2021.108211
(  0) 0) |
| [16] |
Greenfield L M, Graf M, Rengaraj S, et al. Field response of N2O emissions, microbial communities, soil biochemical processes and winter barley growth to the addition of conventional and biodegradable microplastics[J]. Agriculture, Ecosystems & Environment, 2022, 336: 108023.
(  0) 0) |
| [17] |
Šerá J, Huynh F, Ly F, et al. Biodegradable polyesters and low molecular weight polyethylene in soil: Interrelations of material properties, soil organic matter substances, and microbial community[J]. International Journal of Molecular Sciences, 2022, 23(24): 15976. DOI:10.3390/ijms232415976
(  0) 0) |
| [18] |
Meng K, Ren W J, Teng Y, et al. Application of biodegradable seedling trays in paddy fields: Impacts on the microbial community[J]. Science of the Total Environment, 2019, 656: 750-759. DOI:10.1016/j.scitotenv.2018.11.438
(  0) 0) |
| [19] |
Ju Z C, Du X F, Feng K, et al. The succession of bacterial community attached on biodegradable plastic mulches during the degradation in soil[J]. Frontiers in Microbiology, 2021, 12: 785737. DOI:10.3389/fmicb.2021.785737
(  0) 0) |
| [20] |
Li K, Xu L B, Bai X Y, et al. Differential fungal assemblages and functions between the plastisphere of biodegradable and conventional microplastics in farmland[J]. Science of the Total Environment, 2024, 906: 167478. DOI:10.1016/j.scitotenv.2023.167478
(  0) 0) |
| [21] |
Juncheed K, Tanunchai B, Wahdan S F M, et al. Dark side of a bio-based and biodegradable plastic? Assessment of pathogenic microbes associated with poly(butylene succinate-co-adipate)under ambient and future climates using next-generation sequencing[J]. Frontiers in Plant Science, 2022, 13: 966363. DOI:10.3389/fpls.2022.966363
(  0) 0) |
| [22] |
Pang G, Li X S, Ding M Y, et al. The distinct plastisphere microbiome in the terrestrial-marine ecotone is a reservoir for putative degraders of petroleum-based polymers[J]. Journal of Hazardous Materials, 2023, 453: 131399. DOI:10.1016/j.jhazmat.2023.131399
(  0) 0) |
| [23] |
Han L F, Chen L Y, Feng Y F, et al. Microplastics alter soil structure and microbial community composition[J]. Environment International, 2024, 185: 108508. DOI:10.1016/j.envint.2024.108508
(  0) 0) |
| [24] |
Zhang Z Y, Wang W F, Liu J P, et al. Discrepant responses of bacterial community and enzyme activities to conventional and biodegradable microplastics in paddy soil[J]. Science of the Total Environment, 2024, 909: 168513. DOI:10.1016/j.scitotenv.2023.168513
(  0) 0) |
| [25] |
Li C T, Cui Q, Li Y, et al. Effect of LDPE and biodegradable PBAT primary microplastics on bacterial community after four months of soil incubation[J]. Journal of Hazardous Materials, 2022, 429: 128353. DOI:10.1016/j.jhazmat.2022.128353
(  0) 0) |
| [26] |
Sun Y Z, Li X F, Cao N, et al. Biodegradable microplastics enhance soil microbial network complexity and ecological stochasticity[J]. Journal of Hazardous Materials, 2022, 439: 129610. DOI:10.1016/j.jhazmat.2022.129610
(  0) 0) |
| [27] |
Sun Y Z, Duan C X, Cao N, et al. Biodegradable and conventional microplastics exhibit distinct microbiome, functionality, and metabolome changes in soil[J]. Journal of Hazardous Materials, 2022, 424: 127282. DOI:10.1016/j.jhazmat.2021.127282
(  0) 0) |
| [28] |
Chu J C, Zhou J, Wang Y, et al. Field application of biodegradable microplastics has no significant effect on plant and soil health in the short term[J]. Environmental Pollution, 2023, 316: 120556. DOI:10.1016/j.envpol.2022.120556
(  0) 0) |
| [29] |
Brown R W, Chadwick D R, Zang H D, et al. Bioplastic(PHBV)addition to soil alters microbial community structure and negatively affects plant-microbial metabolic functioning in maize[J]. Journal of Hazardous Materials, 2023, 441: 129959. DOI:10.1016/j.jhazmat.2022.129959
(  0) 0) |
| [30] |
Yu Y, Chen Y H, Wang Y, et al. Response of soybean and maize roots and soil enzyme activities to biodegradable microplastics contaminated soil[J]. Ecotoxicology and Environmental Safety, 2023, 262: 115129. DOI:10.1016/j.ecoenv.2023.115129
(  0) 0) |
| [31] |
Song T J, Liu J X, Han S Q, et al. Effect of conventional and biodegradable microplastics on the soil-soybean system: A perspective on rhizosphere microbial community and soil element cycling[J]. Environment International, 2024, 190: 108781. DOI:10.1016/j.envint.2024.108781
(  0) 0) |
| [32] |
Han Y J, Teng Y, Wang X, et al. Biodegradable PBAT microplastics adversely affect pakchoi(Brassica chinensis L.)growth and the rhizosphere ecology: Focusing on rhizosphere microbial community composition, element metabolic potential, and root exudates[J]. Science of the Total Environment, 2024, 912: 169048. DOI:10.1016/j.scitotenv.2023.169048
(  0) 0) |
| [33] |
Zantis L J, Adamczyk S, Velmala S M, et al. Comparing the impact of microplastics derived from a biodegradable and a conventional plastic mulch on plant performance[J]. Science of the Total Environment, 2024, 935: 173265. DOI:10.1016/j.scitotenv.2024.173265
(  0) 0) |
| [34] |
Holzinger A, Hink L, Sehl E, et al. Biodegradable polymers boost reproduction in the earthworm Eisenia fetida[J]. Science of the Total Environment, 2023, 892: 164670. DOI:10.1016/j.scitotenv.2023.164670
(  0) 0) |
| [35] |
Boots B, Russell C W, Green D S. Effects of microplastics in soil ecosystems: Above and below ground[J]. Environmental Science & Technology, 2019, 53(19): 11496-11506.
(  0) 0) |
| [36] |
Baihetiyaer B, Jiang N, Li X X, et al. Oxidative stress and gene expression induced by biodegradable microplastics and imidacloprid in earthworms(Eisenia fetida)at environmentally relevant concentrations[J]. Environmental Pollution, 2023, 323: 121285. DOI:10.1016/j.envpol.2023.121285
(  0) 0) |
| [37] |
Baihetiyaer B, Jiang N, Li X X, et al. Exploring the toxicity of biodegradable microplastics and imidacloprid to earthworms(Eisenia fetida)from morphological and gut microbial perspectives[J]. Environmental Pollution, 2023, 337: 122547. DOI:10.1016/j.envpol.2023.122547
(  0) 0) |
| [38] |
Schöpfer L, Menzel R, Schnepf U, et al. Microplastics effects on reproduction and body length of the soil-dwelling nematode Caenorhabditis elegans[J]. Frontiers in Environmental Science, 2020, 8: 00041. DOI:10.3389/fenvs.2020.00041
(  0) 0) |
| [39] |
Sander M. Biodegradation of polymeric mulch films in agricultural soils: Concepts, knowledge gaps, and future research directions[J]. Environmental Science & Technology, 2019, 53(5): 2304-2315.
(  0) 0) |
| [40] |
Rüthi J, Rast B M, Qi W H, et al. The plastisphere microbiome in alpine soils alters the microbial genetic potential for plastic degradation and biogeochemical cycling[J]. Journal of Hazardous Materials, 2023, 441: 129941. DOI:10.1016/j.jhazmat.2022.129941
(  0) 0) |
| [41] |
Zumstein M T, Schintlmeister A, Nelson T F, et al. Biodegradation of synthetic polymers in soils: Tracking carbon into CO2 and microbial biomass[J]. Science Advances, 2018, 4(7): eaas9024. DOI:10.1126/sciadv.aas9024
(  0) 0) |
| [42] |
Nelson T F, Baumgartner R, Jaggi M, et al. Biodegradation of poly(butylene succinate)in soil laboratory incubations assessed by stable carbon isotope labelling[J]. Nature Communications, 2022, 13(1): 5691. DOI:10.1038/s41467-022-33064-8
(  0) 0) |
| [43] |
Szymanek I, Cvek M, Rogacz D, et al. Degradation of polylactic acid/polypropylene carbonate films in soil and phosphate buffer and their potential usefulness in agriculture and agrochemistry[J]. International Journal of Molecular Sciences, 2024, 25(1): 653. DOI:10.3390/ijms25010653
(  0) 0) |
| [44] |
Griffin-LaHue D, Ghimire S, Yu Y X, et al. In-field degradation of soil-biodegradable plastic mulch films in a Mediterranean climate[J]. Science of the Total Environment, 2022, 806: 150238. DOI:10.1016/j.scitotenv.2021.150238
(  0) 0) |
| [45] |
Li X Y, Liu Z M, Xue R Z, et al. Biodegradation of typical plastics and its mechanisms (In Chinese)[J]. Chinese Science Bulletin, 2021, 66(20): 2573-2589. [李昕玥, 刘卓苗, 薛润泽, 等. 典型塑料的生物降解及其降解机理[J]. 科学通报, 2021, 66(20): 2573-2589.]
(  0) 0) |
| [46] |
Gan M F, Zhang Y, Shi P, et al. Research progress on microbial degradation mechanism of plastics (In Chinese)[J]. Asian Journal of Ecotoxicology, 2023, 18(6): 140-155. [干牧凡, 张妍, 时鹏, 等. 塑料的微生物降解机理研究进展[J]. 生态毒理学报, 2023, 18(6): 140-155.]
(  0) 0) |
| [47] |
Kim J, Gupta N S, Bezek L B, et al. Biodegradation studies of polyhydroxybutyrate and polyhydroxybutyrate-co-polyhydroxyvalerate films in soil[J]. International Journal of Molecular Sciences, 2023, 24(8): 7638. DOI:10.3390/ijms24087638
(  0) 0) |
| [48] |
Sintim H Y, Bary A I, Hayes D G, et al. In situ degradation of biodegradable plastic mulch films in compost and agricultural soils[J]. Science of the Total Environment, 2020, 727: 138668. DOI:10.1016/j.scitotenv.2020.138668
(  0) 0) |
| [49] |
Han Y J, Teng Y, Wang X, et al. Soil type driven change in microbial community affects poly(butylene adipate-co-terephthalate)degradation potential[J]. Environmental Science & Technology, 2021, 55(8): 4648-4657.
(  0) 0) |
| [50] |
Fan S, Duan M J, Liu Y L, et al. Microbial diversity and community structure in biodegradation of poly(lactic)acid(PLA)in different soil environments (In Chinese)[J]. Microbiology China, 2017, 44(10): 2321-2329. [范森, 段梦洁, 刘亚兰, 等. 聚乳酸材料在不同土壤环境中生物降解的菌群结构分析[J]. 微生物学通报, 2017, 44(10): 2321-2329.]
(  0) 0) |
| [51] |
Yamamoto-Tamura K, Hiradate S, Watanabe T, et al. Contribution of soil esterase to biodegradation of aliphatic polyester agricultural mulch film in cultivated soils[J]. AMB Express, 2015, 5(1): 10. DOI:10.1186/s13568-014-0088-x
(  0) 0) |
| [52] |
De Hoe G X, Zumstein M T, Getzinger G J, et al. Photochemical transformation of poly(butylene adipate-co-terephthalate)and its effects on enzymatic hydrolyzability[J]. Environmental Science & Technology, 2019, 53(5): 2472-2481.
(  0) 0) |
| [53] |
Martín-Closas L, Costa J, Cirujeda A, et al. Above-soil and in-soil degradation of oxo- and bio-degradable mulches: A qualitative approach[J]. Soil Research, 2016, 54(2): 225. DOI:10.1071/SR15133
(  0) 0) |
| [54] |
Chien H L, Tsai Y T, Tseng W S, et al. Biodegradation of PBSA films by elite Aspergillus isolates and farmland soil[J]. Polymers, 2022, 14(7): 1320. DOI:10.3390/polym14071320
(  0) 0) |
| [55] |
Liu J X, Hou L J, Liu T T, et al. Isolation of PBAT plastic-degrading bacteria and their degradation characteristics (In Chinese)[J]. Journal of Agro-Environment Science, 2021, 40(1): 129-136. [刘佳茜, 侯丽君, 刘婷婷, 等. PBAT地膜降解菌的筛选及其降解特性研究[J]. 农业环境科学学报, 2021, 40(1): 129-136.]
(  0) 0) |
| [56] |
Urbanek A K, Rymowicz W, Strzelecki M C, et al. Isolation and characterization of Arctic microorganisms decomposing bioplastics[J]. AMB Express, 2017, 7(1): 148. DOI:10.1186/s13568-017-0448-4
(  0) 0) |
| [57] |
Muroi F, Tachibana Y, Soulenthone P, et al. Characterization of a poly(butylene adipate-co-terephthalate)hydrolase from the aerobic mesophilic bacterium Bacillus pumilus[J]. Polymer Degradation and Stability, 2017, 137: 11-22. DOI:10.1016/j.polymdegradstab.2017.01.006
(  0) 0) |
| [58] |
Budkum J, Thammasittirong S N R, Thammasittirong A. High poly ε-caprolactone biodegradation activity by a new Acinetobacter seifertii isolate[J]. Folia Microbiologica, 2022, 67(4): 659-669. DOI:10.1007/s12223-022-00964-7
(  0) 0) |
| [59] |
Tseng W S, Lee M J, Wu J A, et al. Poly(butylene adipate-co-terephthalate)biodegradation by Purpureocillium lilacinum strain BA1S[J]. Applied Microbiology and Biotechnology, 2023, 107(19): 6057-6070. DOI:10.1007/s00253-023-12704-z
(  0) 0) |
| [60] |
Yoon Y G, Park H J, An S H, et al. Bacterial degradation kinetics of poly(Ɛ-caprolactone)(PCL)film by Aquabacterium sp. CY2-9 isolated from plastic-contaminated landfill[J]. Journal of Environmental Management, 2023, 335: 117493. DOI:10.1016/j.jenvman.2023.117493
(  0) 0) |
| [61] |
Hanphakphoom S, Maneewong N, Sukkhum S, et al. Characterization of poly(L-lactide)-degrading enzyme produced by thermophilic filamentous bacteria Laceyella sacchari LP175[J]. The Journal of General and Applied Microbiology, 2014, 60(1): 13-22. DOI:10.2323/jgam.60.13
(  0) 0) |
| [62] |
Lee S H, Kim M N. Isolation of bacteria degrading poly(butylene succinate-co-butylene adipate)and their lip A gene[J]. International Biodeterioration & Biodegradation, 2010, 64(3): 184-190.
(  0) 0) |
| [63] |
Wufuer R, Li W F, Wang S Z, et al. Isolation and degradation characteristics of PBAT film degrading bacteria[J]. International Journal of Environmental Research and Public Health, 2022, 19(24): 17087. DOI:10.3390/ijerph192417087
(  0) 0) |
| [64] |
Jia H, Zhang M, Weng Y X, et al. Degradation of poly(butylene adipate-co-terephthalate)by Stenotrophomonas sp. YCJ1 isolated from farmland soil[J]. Journal of Environmental Sciences, 2021, 103: 50-58. DOI:10.1016/j.jes.2020.10.001
(  0) 0) |
| [65] |
Wang Y J, Hu T, Zhang W T, et al. Biodegradation of polylactic acid by a mesophilic bacteria Bacillus safensis[J]. Chemosphere, 2023, 318: 137991. DOI:10.1016/j.chemosphere.2023.137991
(  0) 0) |
| [66] |
Urbanek A K, Strzelecki M C, Mirończuk A M. The potential of cold-adapted microorganisms for biodegradation of bioplastics[J]. Waste Management, 2021, 119: 72-81. DOI:10.1016/j.wasman.2020.09.031
(  0) 0) |
| [67] |
Abe M, Kobayashi K, Honma N, et al. Microbial degradation of poly(butylene succinate)by Fusarium solani in soil environments[J]. Polymer Degradation and Stability, 2010, 95(2): 138-143. DOI:10.1016/j.polymdegradstab.2009.11.042
(  0) 0) |
| [68] |
Kanwal A, Zhang M, Sharaf F. Synergistic degradation of PBAT poly(butylene adipate-co-terephthalate)co-polyesters using a bacterial co-culture system[J]. Polymer Bulletin, 2024, 81(3): 2741-2755. DOI:10.1007/s00289-023-04849-8
(  0) 0) |
| [69] |
Jia H, Zhang M, Weng Y X, et al. Degradation of polylactic acid/polybutylene adipate-co-terephthalate by coculture of Pseudomonas mendocina and Actinomucor elegans[J]. Journal of Hazardous Materials, 2021, 403: 123679. DOI:10.1016/j.jhazmat.2020.123679
(  0) 0) |
| [70] |
Jin Y, Cai F F, Wang L G, et al. Advance in the degradation of biodegradable plastics in different environments (In Chinese)[J]. Chinese Journal of Biotechnology, 2022, 38(5): 1784-1808. [金琰, 蔡凡凡, 王立功, 等. 生物可降解塑料在不同环境条件下的降解研究进展[J]. 生物工程学报, 2022, 38(5): 1784-1808.]
(  0) 0) |
| [71] |
Urbanek A K, Mirończuk A M, García-Martín A, et al. Biochemical properties and biotechnological applications of microbial enzymes involved in the degradation of polyester-type plastics[J]. Biochimica et Biophysica Acta: BBA - Proteins and Proteomics, 2020, 1868: 140315. DOI:10.1016/j.bbapap.2019.140315
(  0) 0) |
| [72] |
Biundo A, Hromic A, Pavkov-Keller T, et al. Characterization of a poly(butylene adipate-co-terephthalate)-hydrolyzing lipase from Pelosinus fermentans[J]. Applied Microbiology and Biotechnology, 2016, 100(4): 1753-1764. DOI:10.1007/s00253-015-7031-1
(  0) 0) |
| [73] |
Shah A A, Eguchi T, Mayumi D, et al. Purification and properties of novel aliphatic-aromatic co-polyesters degrading enzymes from newly isolated Roseateles depolymerans strain TB-87[J]. Polymer Degradation and Stability, 2013, 98(2): 609-618. DOI:10.1016/j.polymdegradstab.2012.11.013
(  0) 0) |
| [74] |
Perz V, Hromic A, Baumschlager A, et al. An esterase from anaerobic Clostridium hathewayi can hydrolyze aliphatic-aromatic polyesters[J]. Environmental Science & Technology, 2016, 50(6): 2899-2907.
(  0) 0) |
| [75] |
Hajighasemi M, Nocek B P, Tchigvintsev A, et al. Biochemical and structural insights into enzymatic depolymerization of polylactic acid and other polyesters by microbial carboxylesterases[J]. Biomacromolecules, 2016, 17(6): 2027-2039. DOI:10.1021/acs.biomac.6b00223
(  0) 0) |
| [76] |
Santos-Beneit F, Chen L M, Bordel S, et al. Screening enzymes that can depolymerize commercial biodegradable polymers: Heterologous expression of Fusarium solani cutinase in Escherichia coli[J]. Microorganisms, 2023, 11(2): 328. DOI:10.3390/microorganisms11020328
(  0) 0) |
| [77] |
Yang Y, Min J, Xue T, et al. Complete bio-degradation of poly(butylene adipate-co-terephthalate)via engineered cutinases[J]. Nature Communications, 2023, 14(1): 1645. DOI:10.1038/s41467-023-37374-3
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


