2. 安徽农业大学林学与园林学院, 合肥 230036;
3. 山东农业大学林学院, 泰安 271018
2. College of Forestry and Landscape Architecture, Anhui Agricultural University, Hefei 230036, China;
3. College of Forestry, Shandong Agricultural University, Taian, Shandong 271018, China
世界森林生态系统的碳(C)储量估计为(861±66)Pg C,其中44%储存在土壤中[1]。因此,森林土壤有机碳的微小变化可能对气候产生重大影响。土壤有机碳(SOC)主要来源于凋落物,包括地上枯枝落叶和地下的根系及其分泌物等[2]。近期有研究认为,植物凋落物可以通过微生物的“体内周转”和“体外修饰”途径转化为SOC[3]。其中,由微生物“体内周转”途径形成的有机碳被称为微生物源有机碳,即微生物残体碳;“体外修饰”过程是土壤微生物通过分泌胞外酶来分解或转化植物残体,导致不易被微生物利用的植物源有机碳积累的过程,即植物源碳。微生物源有机碳和植物源有机碳是土壤稳定有机碳的两个重要组成部分[4],共同促进土壤有机碳库的积累。越来越多的研究表明,大部分植物凋落物经过微生物转化为微生物残体并且贡献了高达50%的SOC[5]。因此,微生物残体碳可能对有机碳在土壤中的长期固存发挥关键作用[6]。
微生物残体作为SOC的重要来源持续积聚在土壤中,在长期土壤碳动态中发挥着关键作用[7]。氨基糖是广泛使用表征微生物残体碳的生物标志物[8],目前土壤中能够被准确测定的氨基糖:包括有氨基葡萄糖(Glucosamine)、胞壁酸(Muramic acid)、氨基半乳糖(Galactosamine)和氨基甘露糖(Mannosamine)。其中胞壁酸和氨基葡萄糖分别对细菌和真菌具有高度异源性[9]。Glucosamine/Muramic acid可以表征真菌和细菌对土壤有机碳积累的相对贡献[10]。木质素酚在植物细胞壁中含量较高,约占生物量干重的15%~30%,包括肉桂基酚类(Cinnamyl-based)、紫丁香基酚类(Syringyl-based)、香草基酚类(Vanillyl-based)共8类单体,作为植物源有机碳的生物标志物[11]。
植被覆盖[12]、凋落物的输入[13]和土壤理化性质等[14]是影响微生物源和植物源有机碳积累的主要因素,其中,前两者直接与植被类型有关,且植被类型变化还会影响土壤理化性质[15]。不同植被类型会向土壤中输入不同凋落物,对木质素的输入也有着不同影响[16],从而导致土壤微生物残体碳和木质素酚含量的差异。但土壤微生物分解利用不同植被类型输入的有机物的“碳泵”能效尚不明晰,因此,探究不同植被类型输入的有机物转化为土壤微生物和植物源有机碳对土壤有机碳的贡献及其影响因子,对研究土壤有机碳的形成和稳定至关重要。
温带森林面积占森林生态系统的40%[17]。然而,关于温带森林土壤微生物和植物源有机碳在土壤中的积累及其的影响机理尚不明晰。因此,本文选择三种典型温带森林土壤为研究对象,采用氨基糖和木质素酚分别作为微生物源有机碳和植物源有机碳的生物标志物,比较三种温带森林土壤微生物和植物源有机碳的差异,揭示其控制机理,丰富对微生物介导的土壤有机碳形成和稳定过程的认识,研究结果可以为森林植被恢复和管理提供数据和理论支撑。
1 材料与方法 1.1 研究区概况研究区位于山东省泰安市(36°15'21"—36°17'50" N,117°04'30"—117°05'44" E),三种典型温带森林类型分别为赤松(Pinus densiflora)林、刺槐(Robinia pseudoacacia)林和麻栎(Quercus acutissima)林。该地属于温带大陆性半湿润季风气候区,四季分明,雨热同季。全年平均气温13 ℃,平均年降水量700~800 mm,年内无霜期200多天。林分基本概况见表 1。
|
|
表 1 三种林分基本情况 Table 1 Basic characteristics of three forests |
每种林型分别设置6个10 m×10 m的样地,每个样地之间的距离不低于100 m。采用S形取样法在各样地内随机选取5个位置,用内径为5 cm土钻采集表层0~10 cm的土壤,将5个点采集的土壤样品混合均匀为一个样品后装入无菌自封袋带回室内。将这3个林型下的6个样地内取的18个土壤样品过2 mm土壤筛后,一部分在室内将土壤样品风干用于氨基糖、木质素酚及土壤基本理化性质的测定,另一部分在–20 ℃下保存用于测定土壤微生物群落结构及酶活性。
用pH计测定土壤pH(土水比1∶2.5)。采用元素分析仪测定土壤有机碳(SOC)和全氮(TN)含量测定前先用1 mol·L–1稀盐酸多次酸洗土壤以去除无机碳。用全自动间断化学分析仪测定土壤NH4+-N和NO3–-N和有效磷(AP)含量。采用氯仿熏蒸0.5 mol·L–1—硫酸钾浸提法测定土壤微生物生物量碳(MBC)含量。结果见表 2。
|
|
表 2 三种温带森林土壤基本性质 Table 2 Basic properties of three temperate forest soils |
氨基糖的提取和测定 [18]:将土壤样品(相当于0.3 mg N)加入10 mL浓度为6 mol·L–1的HCL在105 ℃下水解8 h,水解液中加入100 µL肌醇,过滤后调整pH至6.6~6.8。氨基糖衍生物在甲醇中再溶解,使用气相色谱仪进行分离。测定的4种氨基糖衍生物为氨基葡萄糖(Glucosamine)、胞壁酸(Muramic acid)、氨基半乳糖(Galactosamine)和氨基甘露糖(Mannosamine)。
真菌、细菌残体碳分别由氨基葡萄糖和胞壁酸通过计算转换得到,微生物残体碳为真菌和细菌残体碳的总和,计算公式如下:
| $ \mathrm{FR}=(\mathrm{GluN} / 179.17-2 \times \mathrm{MurA} / 251.23) \times 179.17 \times 9 $ | (1) |
| $ \mathrm{BR}=\mathrm{MurA} \times 45$ | (2) |
| $\mathrm{MR}=\mathrm{FR}+\mathrm{BR} $ | (3) |
式中,FR、BR、MR、GluN和MurA分别为真菌残体碳、细菌残体碳、微生物残体碳、氨基葡萄糖和胞壁酸(mg·kg–1);179.17和251.23分别是氨基葡萄糖和胞壁酸的分子量;9是氨基葡萄糖到真菌残体碳的转换值;氨基葡萄糖中的细菌来源的部分与胞壁酸的比例是2︰1;45是胞壁酸到细菌残体碳的转换值。
1.4 植物源有机碳的测定木质素酚的提取和测定[19]:将500 mg土样放于消解罐中,依次加入100 mg六水合硫酸亚铁铵、500 mg氧化铜和50 mg葡萄糖,随后加入0.4 mL100 μg·mL–1的乙基香草醛溶液,15 mL浓度为2 mol·L–1的氢氧化钠溶液,密封加热搅拌2 h,将上清液pH调整至1.8~2.2,向瓶中加入0.5 mL苯乙酸溶液、0.1 mL双三氟乙酰胺和0.05 mL吡啶,60 ℃衍生10 min,冷却至室温后使用气相色谱仪进行测定。其中V类(香草基)、S类(丁香基)和C类(肉桂基)单体的总和用来表征木质素的含量。同时计算V类和S类的酸/醛比值((Ad/Al)v和(Ad/Al)s),用于估计木质素降解程度。
1.5 微生物群落结构及酶活性土壤微生物群落组成采用磷脂脂肪酸法进行分析[20]。取3 g冻干土壤样品,加入20 mL提取试剂(氯仿︰甲醇︰柠檬酸=1︰2︰0.8)提取两次,并将上清液混合,然后用氮吹仪37 ℃吹至1 mL;再分别用氯仿、丙酮和甲醇洗脱,利用0.2 mol·L–1的KOH甲醇溶液甲基化磷脂以形成脂肪酸甲酯。使用配有MIDI Sherlock微生物鉴定系统的气相色谱仪(Agilent 6890N,USA)测定。
采用96微孔板荧光法测定土壤的五种微生物胞外酶活性,包括β-1,4-葡萄糖苷酶(βG)、木聚糖酶(XYL)、β-1,4-N-乙酰氨基葡萄糖苷酶(NAG)、亮氨酸氨基肽酶(LAP)和磷酸酶(Phos)。微生物胞外酶提取和活性测定参照文献[21]的方法。酶活性计算公式为:
| $ \mathrm{V}=\mathrm{V}_{\max }[\mathrm{S}] /\left(\mathrm{K}_{\mathrm{m}}+[\mathrm{S}]\right) $ | (4) |
式中,V为酶活性(nmol·g–1·h–1);S为底物浓度;Vmax为最大酶活性;Km为半饱和常数。Vmax和Km在GraphPad Prism 9.3软件中利用七个梯度下0~1 h或者1~2 h的荧光值差值计算得到。
1.6 数据处理林型之间的差异使用SPSS中的单因素方差分析,对数据进行方差齐性检验和邓肯(Duncan)分析法检验进行多重比较,采用Pearson相关性和随机森林预测方法对土壤理化性质微生物结构及功能与微生和植物源有机碳的相关关系和相对重要性进行分析。随机森林模型采用R(4.3.1)语言中的“randomForest”和“rfPermute”程序包进行分析。基于结构方程模型(Struc-tural equation modelling,SEM)分析土壤变量和微生物属性影响微生物残体碳和木质素酚含量的相对重要性。P < 0.05为显著性水平。数据以平均值±标准误(n = 6)的方式表示。
2 结果 2.1 微生物残体碳刺槐林、麻栎林和赤松林土壤中氨基葡萄糖、氨基半乳糖和胞壁酸的含量差异显著。赤松林土壤中氨基葡萄糖、氨基半乳糖和胞壁酸的含量分别为523.6、233.5和12.2 mg·kg–1,分别是刺槐林土壤的44.9%、36.9%和31.6%,是麻栎林土壤的54.1%、47.8%和27.2%,赤松林土壤中总氨基糖的含量显著低于刺槐林和麻栎林(图 1a)。赤松林中氨基葡萄糖与氨基半乳糖的比值显著高于其他两种森林类型,其趋势表现为赤松林高于麻栎林高于刺槐林,在三种森林中氨基葡萄糖与胞壁酸的比值有显著差异(图 1b)。刺槐林土壤中微生物残体碳、真菌残体碳含量显著高于其他两种森林类型,分别是麻栎林和赤松林的1.2倍、2.3倍和1.2倍、2.2倍,赤松林细菌残体碳的含量显著低于其他两种森林类型,其趋势表现为麻栎林高于刺槐林高于赤松林(图 1c)。三种森林类型微生物、真菌和细菌残体碳对有机碳的贡献为52.5%~57.4%、45.6%~48.5%和5.7%~11.8%。麻栎林中细菌残体碳与有机碳的比值显著高于刺槐林和赤松林,在三种森林类型中微生物残体碳与有机碳和真菌残体碳与有机碳的比值没有显著差异(图 1d)。
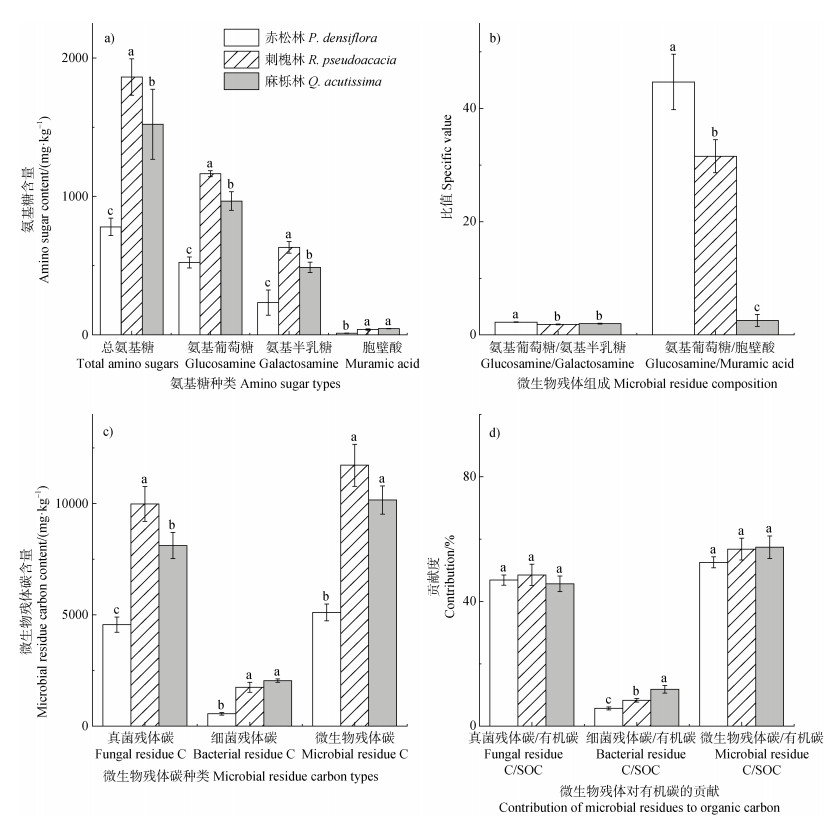
|
注:不同小写字母表示在各林型间在0.05水平上差异显著。 Note: Different letters indicate significant differences among forest types at the 0.05 level. 图 1 不同林型下氨基糖含量(a)、微生物残体组成(b)、微生物残体碳含量(c)和微生物残体对有机碳的贡献(d)的变化 Fig. 1 Changes in amino sugars content (a), microbial residue composition (b), microbial residue carbon content (c), and contribution of microbial residues to organic carbon (d) in different forest types |
赤松林中香草基、紫丁香基和肉桂基酚类的含量分别为65.9、16.9和16.7 mg·kg–1,分别是刺槐林土壤的36.9%、19.3%和47.9%,是麻栎林土壤的40.5%、19.6%和53.1%。刺槐林和麻栎林中总木质素酚的含量显著高于赤松林,分别为赤松林的3倍和2.8倍,其趋势表现为刺槐林高于麻栎林高于赤松林(图 2a)。赤松林、刺槐林和麻栎林中(Ad/Al)V的值分别为0.79、1.07、0.77,(Ad/Al)S的值分别为0.81、1和0.77。刺槐林(Ad/Al)V和(Ad/Al)S的值显著高于赤松林和麻栎林,且在赤松林和麻栎林中没有显著差异(图 2b)。赤松林中紫丁香基酚类对SOC的贡献显著低于刺槐林和麻栎林,在三种森林类型中香草基酚类和肉桂基酚类对SOC的贡献没有显著差异(图 2c)。
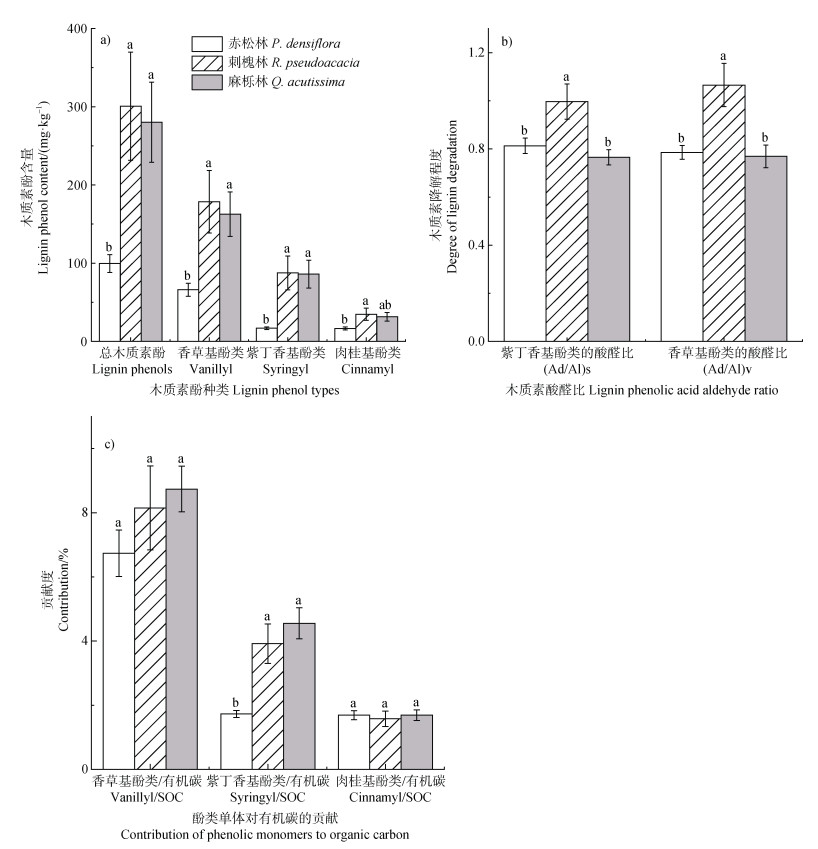
|
注:不同小写字母表示在各林型间在0.05水平上差异显著。 Note: Different lowercase letters indicate significant differences among forest types at the 0.05 level. 图 2 不同林型下木质素酚含量(a)、木质素降解程度(b)和酚类单体对有机碳的贡献(c)的变化 Fig. 2 Changes in lignin phenol content (a), degree of lignin degradation (b), and contribution of phenolic monomers to SOC (c) in different forest types |
微生物残体碳(MR)、真菌残体碳(FR)和细菌残体碳(BR)与pH呈显著负相关,与木聚糖酶(XYL)、磷酸酶(Phos)、β-1,4-N-乙酰氨基葡萄糖苷酶(NAG)、β-1,4-葡萄糖苷酶(βG)、土壤有机碳(SOC)、全氮(TN)、全磷(TP)、细菌(Bacteria)、真菌(fungi)呈显著正相关(P < 0.05,图 3a)。总木质素酚(VSC)与pH呈显著负相关,与XYL、SOC、TN、TP、Bacteria、fungi、Phos、βG和LAP呈显著正相关(P < 0.05,图 3b)。
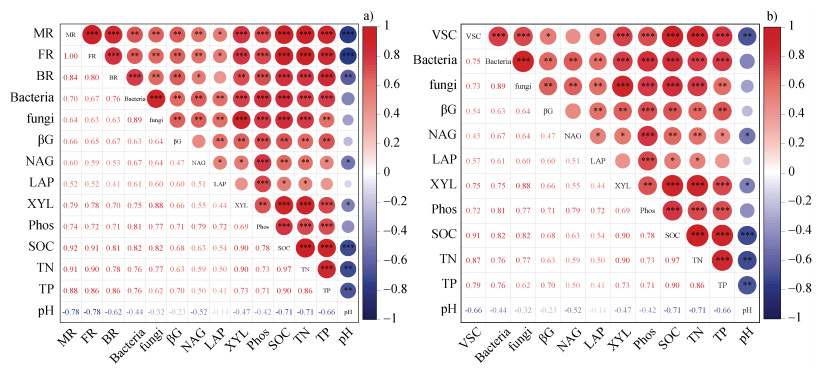
|
注:*、**和***分别在0.05、0.01和0.001水平上表示显著差异。Bacteria,fungi,βG,XYL,NAG,LAP,Phos,MR,FR,BR,VSC,SOC,TN,TP分别表示细菌、真菌、β-1,4-葡萄糖苷酶、木聚糖酶、β-1,4-N-乙酰氨基葡萄糖苷酶、亮氨酸氨基肽酶、磷酸酶、微生物残体碳、真菌残体碳、细菌残体碳、总木质素酚、土壤有机碳、全氮和全磷。下同。 Note: *, **, and *** denote significant differences at 0.05, 0.01, and 0.001 levels, respectively. Bacteria, fungi, βG, XYL, NAG, LAP, and Phos denote bacterial, fungal, β-1, 4-glucosidase, xylanase, β-1, 4-N-acetylamino-glucosidase, leucine aminopeptidase, and phosphatase, microbial residue carbon, fungal residue carbon, bacterial residue carbon, total lignin phenols, soil organic carbon, total nitrogen, total phosphorus. The same below. 图 3 微生物残体碳(a)和植物源有机碳(b)与重要因子的Pearson相关系数矩阵 Fig. 3 Matrix of Pearson correlation coefficients of microbial residue carbon (a) and plant-derived organic carbon (b) with significant factors |
BR的含量主要受TP、TN、SOC的含量及XYL活性的影响,相对重要性分别为23.63、22.68、22.56和16.02%(图 4a)。FR的含量主要受TN、SOC、pH和XYL活性的影响,相对重要性分别为29.37、24.99、24.22和19.02%(图 4b)。MR的含量主要受TN、SOC、pH、TP的含量影响,相对重要性分别为30.28、24.61、20.84和20.84%(图 4c)。VSC的含量主要受SOC、TN、pH、TP含量的影响,相对重要性分别为30.79、19.74、14.09和14.06%(图 4d)。
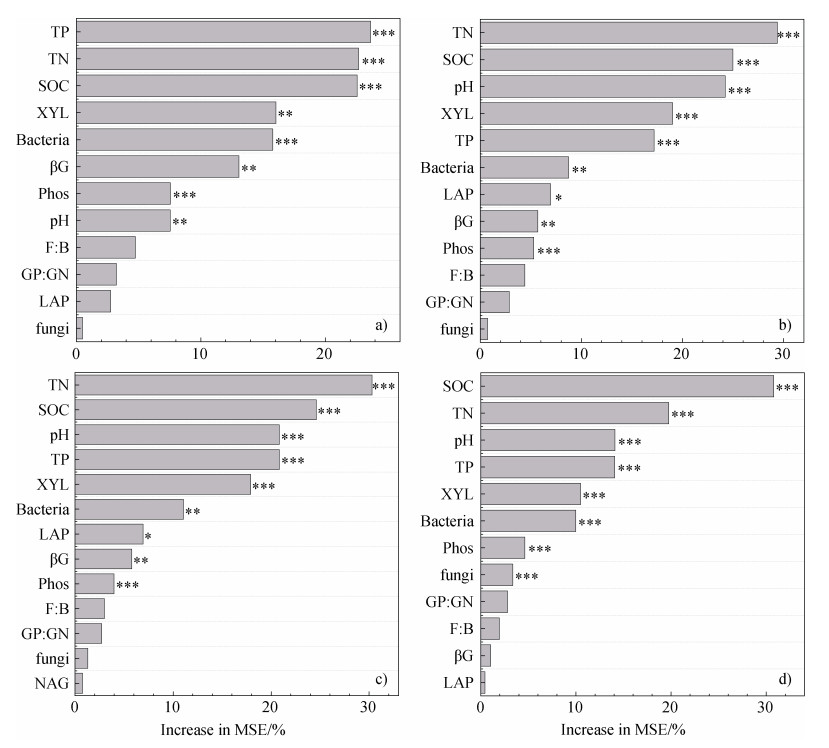
|
图 4 土壤理化性质对细菌残体碳(a)、真菌残体碳(b)、微生物残体碳(c)和植物源有机碳(d)影响的随机森林模型 Fig. 4 Random forest modeling of the effects of soil physicochemical properties on bacterial residue carbon (a), fungal residue carbon (b), microbial residue carbon (c), and plant-derived organic carbon (d) |
SEM模型结果显示(图 5),XYL酶活性与pH间有正影响,路径系数为0.33;与MR和VSC间均有负影响,路径系数分别为–0.16和–0.33;SOC与GP:GN间有正影响,路径系数为0.18;与MR和VSC间有正影响,路径系数分别为1.05和1.23;MBC与G+/G–间有负影响,路径系数为–0.57,与MR有负影响,路径系数为–0.03,与VSC间有正影响,路径系数为0.17。根据路径可知SOC是MR和VSC最重要的影响因子。
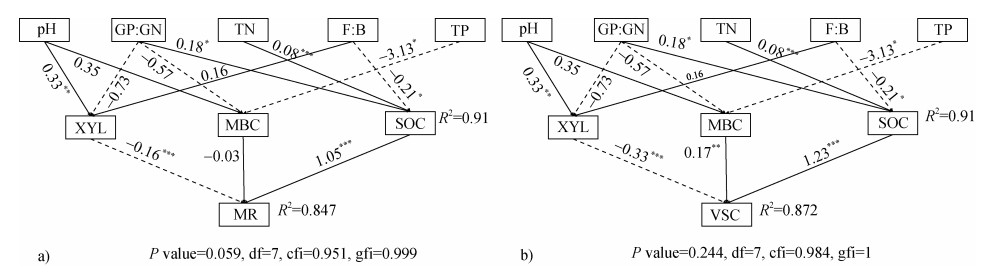
|
图 5 微生物残体碳(a)和植物源有机碳(b)影响因素的结构方程模型 Fig. 5 Structural equation model analyses of the factors affecting microbial residue carbon contents (a) and plant-derived organic carbon (b) |
本研究中土壤微生物残体碳的含量受森林类型影响显著。刺槐林土壤微生物残体碳、真菌残体碳含量显著高于其他两种森林类型,分别是麻栎林和赤松林的1.2倍、2.3倍和1.2倍、2.2倍,这是因为植被类型由阔叶林到针叶林地的变化使得凋落物和根系分泌物等有机物输入增加,而有机物输入的增加会使微生物活性和“微生物碳泵”的效率[22-23]提高,进而促进了土壤微生物残体碳的积累[24];另一方面,植被类型的差异也会影响微生物残体的稳定和分解,导致微生物残体碳积累的差异[25-26]。所有森林类型中土壤真菌残体碳的含量及其对有机碳积累的贡献远大于细菌残体碳(图 1d),表明微生物参与的有机碳积累过程主要由真菌主导,这与以往的研究结果相似[27],相比于细菌残体碳,真菌残体碳通常能增加SOC库的稳定性[28]。因此,真菌残体碳对SOC的贡献可指示和预测SOC库的稳定性。在本研究中,土壤pH与微生物残体碳呈显著负相关(图 3a),这与以往的研究结果一致[29],当pH降低时,微生物活性下降,其分解有机碳的能力降低,从而促进了微生物残体的积累。全氮、木聚糖酶活性和有机碳的含量与细菌和真菌残体碳的含量直接相关(图 3a)。本研究随机森林模型预测结果显示,全磷和全氮分别是细菌和真菌残体碳最主要的影响因子,pH、土壤有机碳和全氮是微生物残体碳积累过程中的重要影响因素(图 4)。相关研究表明,全氮、土壤有机碳、pH是微生物残体碳积累过程中的重要非生物影响因素[30],进而影响微生物残体碳的积累和分解[31]。SEM结果显示,SOC是对土壤微生物残体碳含量影响较大的土壤因子(图 5a)。综上,森林植被类型的不同和土壤理化性质的变化共同调控了微生物残体碳的形成,最终影响土壤微生物源有机碳的积累。
3.2 植被类型对土壤植物源有机碳的影响本研究中土壤木质素酚的含量受森林类型影响显著。刺槐林和麻栎林中总木质素酚的含量显著高于赤松林,分别是赤松林的3倍和2.8倍。赤松林中香草基酚、紫丁香基酚和肉桂基酚类的含量分别是刺槐林土壤的36.9%、19.3%和47.9%,麻栎林土壤的40.5%、19.6%和53.1%。由于麻栎林和刺槐林的植被类型为阔叶林而赤松林的植被类型为针叶林,植被类型的不同使得凋落物输入的质量和数量增加,而凋落物中含有木质素、单宁等顽固的化学组分难以被微生物利用[32],所以导致这一结果的出现,并且也表明刺槐林土壤中木质素的积累能力最强。土壤中(Ad/Al)v和(Ad/Al)s的比值高,则表示土壤木质素的降解程度高[33]。在本研究中,刺槐中林(Ad/Al)v和(Ad/Al)s的比值显著高于赤松林和麻栎林(图 2b),说明在刺槐林土壤中木质素的降解程度最高。土壤中木质素酚的含量是植物木质素输入与土壤氧化分解之间达到平衡的结果,在本研究中,细菌、真菌、β-1,4-葡萄糖苷酶活性、木聚糖酶活性与木质素酚呈正相关关系(图 3b),这与以往结果一致[34]。随机森林模型预测结果显示,土壤有机碳、全氮和pH是木质素酚积累过程中的重要影响因素(图 4d),土壤化学性质是对木质素酚含量影响较大的潜变量。相关研究表明,微生物群落构成以及酶活性均能对土壤木质素分布造成不同程度的影响,而一些调节微生物活性的环境因子同样会影响土壤木质素酚的动态特征。SEM结果显示,SOC和MBC是对土壤木质素酚含量影响较大的土壤因子(图 5b)。此外,pH的变化很大程度上主导微生物群落和胞外酶活性变化从而间接调控土壤中木质素酚的动态特征[35],尤其是酸性环境下微生物群落中真菌比例增加导致更高的木质素酚的降解程度。综上,森林植被类型的不同和土壤理化性质的变化共同调控了植物源有机碳的形成,最终影响土壤植物源有机碳的积累。
4 结论土壤微生物源和植物源有机碳的含量受森林类型显著影响,刺槐林、麻栎林到赤松林,土壤微生物源和植物源有机碳的含量逐渐显著增加,主要归因于凋落物输入的质量和数量不同。三种森林类型微生物残体碳对有机碳的贡献均超过50%,表明微生物残体碳在土壤中长期碳封存的重要性,并且真菌残体碳对有机碳积累的贡献远大于细菌残体碳,即微生物参与的有机碳积累过程主要由真菌主导。同时,刺槐林土壤中木质素的分解程度更高,而赤松林土壤中木质素的分解程度最低。SEM分析表明土壤理化学性质和微生物性质是对土壤微生物残体碳和木质素含量影响较大的潜变量,在温带森林经营中,可通过提高土壤养分和微生物性质来促进微生物的生长,并且提高微生物和植物源有机碳的含量及对SOC库的贡献,进而最大程度地发挥其固碳的潜力。
| [1] |
Pan Y D, Birdsey R A, Fang J Y, et al. A large and persistent carbon sink in the world's forests[J]. Science, 2011, 333(6045): 988-993. DOI:10.1126/science.1201609
(  0) 0) |
| [2] |
Schmidt M W I, Torn M S, Abiven S, et al. Persistence of soil organic matter as an ecosystem property[J]. Nature, 2011, 478(7367): 49-56. DOI:10.1038/nature10386
(  0) 0) |
| [3] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2: 17105. DOI:10.1038/nmicrobiol.2017.105
(  0) 0) |
| [4] |
Ma T, Zhu S S, Wang Z H, et al. Divergent accumulation of microbial necromass and plant lignin components in grassland soils[J]. Nature Communications, 2018, 9(1): 3480. DOI:10.1038/s41467-018-05891-1
(  0) 0) |
| [5] |
Simpson A J, Simpson M J, Smith E, et al. Microbially derived inputs to soil organic matter: Are current estimates too low?[J]. Environmental Science & Technology, 2007, 41(23): 8070-8076.
(  0) 0) |
| [6] |
Liang C, Balser T C. Microbial production of recalcitrant organic matter in global soils: Implications for productivity and climate policy[J]. Nature Reviews Microbiology, 2011, 9(1): 75.
(  0) 0) |
| [7] |
Liang C, Amelung W, Lehmann J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology, 2019, 25(11): 3578-3590. DOI:10.1111/gcb.14781
(  0) 0) |
| [8] |
Feng X J, Simpson M J. Temperature and substrate controls on microbial phospholipid fatty acid composition during incubation of grassland soils contrasting in organic matter quality[J]. Soil Biology & Biochemistry, 2009, 41(4): 804-812.
(  0) 0) |
| [9] |
Joergensen R G. Amino sugars as specific indices for fungal and bacterial residues in soil[J]. Biology and Fertility of Soils, 2018, 54(5): 559-568. DOI:10.1007/s00374-018-1288-3
(  0) 0) |
| [10] |
Zhang B, Chen Q, Ding X L, et al. Research progress on accumulation, turnover and stabilization of microbial residues in soil (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(6): 1479-1491. DOI:10.11766/trxb202012270705 [张彬, 陈奇, 丁雪丽, 等. 微生物残体在土壤中的积累转化过程与稳定机理研究进展[J]. 土壤学报, 2022, 59(6): 1479-1491.]
(  0) 0) |
| [11] |
Bahri H, Dignac M F, Rumpel C, et al. Lignin turnover kinetics in an agricultural soil is monomer specific[J]. Soil Biology & Biochemistry, 2006, 38(7): 1977-1988.
(  0) 0) |
| [12] |
Yi Z G, Yi W M, Zhou L X, et al. Soil microbial biomass of the main forests in Dinghushan Biosphere Reserve (In Chinese)[J]. Ecology and Environmental Sciences, 2005, 14(5): 727-729. [易志刚, 蚁伟民, 周丽霞, 等. 鼎湖山主要植被类型土壤微生物生物量研究[J]. 生态环境, 2005, 14(5): 727-729.]
(  0) 0) |
| [13] |
Ni X Y, Liao S, Tan S Y, et al. A quantitative assessment of amino sugars in soil profiles[J]. Soil Biology & Biochemistry, 2020, 143: 107762.
(  0) 0) |
| [14] |
Zhang M L, Che R X, Cheng Z B, et al. Decades of reforestation significantly change microbial necromass, glomalin, and their contributions to soil organic carbon[J]. Agriculture, Ecosystems & Environment, 2023, 346: 108362.
(  0) 0) |
| [15] |
Deng L, Liu Y L, Li J W, et al. Effect of vegetation restoration on soil carbon sequestration: Dynamics and its driving mechanisms (In Chinese)[J]. Journal of Soil and Water Conservation, 2023, 37(2): 1-10. [邓蕾, 刘玉林, 李继伟, 等. 植被恢复的土壤固碳效应: 动态与驱动机制[J]. 水土保持学报, 2023, 37(2): 1-10.]
(  0) 0) |
| [16] |
Beidler K V, Phillips R P, Andrews E, et al. Substrate quality drives fungal necromass decay and decomposer community structure under contrasting vegetation types[J]. Journal of Ecology, 2020, 108(5): 1845-1859. DOI:10.1111/1365-2745.13385
(  0) 0) |
| [17] |
Bond-Lamberty B, Thomson A. Temperature-associated increases in the global soil respiration record[J]. Nature, 2010, 464(7288): 579-582. DOI:10.1038/nature08930
(  0) 0) |
| [18] |
Zhang X D, Amelung W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils[J]. Soil Biology & Biochemistry, 1996, 28(9): 1201-1206.
(  0) 0) |
| [19] |
Hedges J I, Ertel J R. Characterization of lignin by gas capillary chromatography of cupric oxide oxidation products[J]. Analytical Chemistry, 1982, 54(2): 174-178. DOI:10.1021/ac00239a007
(  0) 0) |
| [20] |
Zhang Q, Deng H M, Yu J J, et al. Grain growth enhancing through preheating treatment of a sputtered stacked metallic precursor for Cu (In, Al) Se2 thin film solar cells application[J]. Materials Science and Engineering: B, 2019, 242: 31-36. DOI:10.1016/j.mseb.2019.03.008
(  0) 0) |
| [21] |
German D P, Chacon S S, Allison S D. Substrate concentration and enzyme allocation can affect rates of microbial decomposition[J]. Ecology, 2011, 92(7): 1471-1480. DOI:10.1890/10-2028.1
(  0) 0) |
| [22] |
Chen Z H, Zhang H D, Wang B S, et al. Studies on biomass and its allocation of the evergreen broadleaved forest in Heishiding, Guangdong (In Chinese)[J]. Acta Phytoecologica et Geobotanica Sinica, 1993, 17(4): 289-298. [陈章和, 张宏达, 王伯荪, 等. 广东黑石顶常绿阔叶林生物量及其分配的研究[J]. 植物生态学与地植物学学报, 1993, 17(4): 289-298.]
(  0) 0) |
| [23] |
Wang B R, Huang Y M, Li N, et al. Initial soil formation by biocrusts: Nitrogen demand and clay protection control microbial necromass accrual and recycling[J]. Soil Biology & Biochemistry, 2022, 167: 108607.
(  0) 0) |
| [24] |
Zhu X F, Jackson R D, DeLucia E H, et al. The soil microbial carbon pump: From conceptual insights to empirical assessments[J]. Global Change Biology, 2020, 26(11): 6032-6039. DOI:10.1111/gcb.15319
(  0) 0) |
| [25] |
Feng X J, Wang S M. Plant influences on soil microbial carbon pump efficiency[J]. Global Change Biology, 2023, 29(14): 3854-3856. DOI:10.1111/gcb.16728
(  0) 0) |
| [26] |
Shao S, Zhao Y, Zhang W, et al. Linkage of microbial residue dynamics with soil organic carbon accumulation during subtropical forest succession[J]. Soil Biology & Biochemistry, 2017, 114: 114-120.
(  0) 0) |
| [27] |
Gao W T, Wang Q T, Zhu X M, et al. The vertical distribution pattern of microbial- and plant-derived carbon in the rhizosphere in alpine coniferous forests[J]. Rhizosphere, 2021, 20: 100436. DOI:10.1016/j.rhisph.2021.100436
(  0) 0) |
| [28] |
Liu L, Gunina A, Zhang F S, et al. Fungal necromass increases soil aggregation and organic matter chemical stability under improved cropland management and natural restoration[J]. Science of the Total Environment, 2023, 858: 159953. DOI:10.1016/j.scitotenv.2022.159953
(  0) 0) |
| [29] |
Cui Y X, Wang X, Zhang X C, et al. Soil moisture mediates microbial carbon and phosphorus metabolism during vegetation succession in a semiarid region[J]. Soil Biology & Biochemistry, 2020, 147: 107814.
(  0) 0) |
| [30] |
Miltner A, Bombach P, Schmidt-Brücken B, et al. SOM genesis: Microbial biomass as a significant source[J]. Biogeochemistry, 2012, 111(1): 41-55.
(  0) 0) |
| [31] |
Zhang W, Cui Y H, Lu X K, et al. High nitrogen deposition decreases the contribution of fungal residues to soil carbon pools in a tropical forest ecosystem[J]. Soil Biology & Biochemistry, 2016, 97: 211-214.
(  0) 0) |
| [32] |
Berg B. Litter decomposition and organic matter turnover in northern forest soils[J]. Forest Ecology and Management, 2000, 133(1/2): 13-22.
(  0) 0) |
| [33] |
Guggenberger G, Zech W, Thomas R J. Lignin and carbohydrate alteration in particle-size separates of an oxisol under tropical pastures following native savanna[J]. Soil Biology & Biochemistry, 1995, 27(12): 1629-1638.
(  0) 0) |
| [34] |
Thevenot M, Dignac M F, Rumpel C. Fate of lignins in soils: A review[J]. Soil Biology & Biochemistry, 2010, 42(8): 1200-1211.
(  0) 0) |
| [35] |
Zhou X Q, Guo Z Y, Chen C R, et al. Soil microbial community structure and diversity are largely influenced by soil pH and nutrient quality in 78-year-old tree plantations[J]. Biogeosciences, 2017, 14(8): 2101-2111. DOI:10.5194/bg-14-2101-2017
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


