微生物是土壤中最活跃的固相组分,广泛参与调节土壤的物质循环、养分转换、能量流动和污染物控制等物理化学过程[1]。在土壤环境中,微生物极少以单一物种或游离态形式存在,而是会附着在生物或非生物介质表面混合共生形成包含微生物自身及其胞外聚合物(Extracellular polymeric substances,EPS)的稳定三维结构体,即多物种生物膜[2]。多物种生物膜内各物种之间会发生竞争、合作、信号传递等相互作用[3],如细菌与细菌[4]、细菌与真菌[5]以及细菌与古菌[6]等。当土壤生态环境和营养条件等发生变化时,生物膜内菌群间的相互作用也会发生变化。有的物种之间通过共代谢、生物膜诱导或增强抗性等机制促进合作关系的形成[7],有的通过资源竞争或产生抑制化合物形成相互对抗的竞争关系[7-9],还有些则呈现出互不影响的中性效应[7,10]。生物膜内的细菌可以通过复杂的信号交流和相互作用在不断变化的环境中保持适应性,膜内细菌种间互作会导致生物膜的结构、组成和功能等发生改变[11]。细菌物种间的各种互作类型对微生物群落结构和多样性、生态稳定性以及作物生产力等均具有显著的影响[12]。
土壤矿物质不仅是土壤中营养元素的重要来源,还构成了土壤的骨骼,包括普遍存在的硅酸盐矿物高岭石、蒙脱石和铁氧化物针铁矿等[13]。土壤矿物与微生物间的相互作用是地球上广泛存在的地质作用[14],微生物可以通过分解有机酸、铁载体或者利用氧化还原作用去溶解、转化及沉淀矿物[15-16]。同样,土壤微生物的活性及表面特性也会受到矿物的影响,尤其是在农业土壤中,其有机质、矿物质、有机-无机复合体含量丰富,不仅有利于微生物黏附,增加微生物自身的稳定性,也有利于诱导多物种生物膜的形成[17-18],如有研究表明,氧化亚铁硫杆菌与赤铁矿发生协同作用,促进了细菌代谢、有效强化细菌对污染物或有毒物质的净化能力和耐受性[19]。此外,土壤微生物-矿物互作还可以通过促进土壤根际大团聚体的形成和增加微生物多样性,加速土壤有机质的分解和养分循环,从而改善土壤结构和耕性,对于维持土壤肥力和促进植物生长至关重要[20]。因此,深入探究微生物与矿物的相互作用机制,可以更好地理解地球环境的演化过程,为资源开发利用、污染治理和生态环境保护提供理论依据[21]。然而,目前的相关研究大多聚焦于已知单菌与单一矿物类型的互作,针对土壤矿物如何影响细菌多物种生物膜的形成及生物膜内菌群间相互作用关系的研究还鲜有报道。
因此,本研究从湖南省典型母质-紫色页岩风化物发育的酸紫泥田中提取生物膜初始接种液,纯化培养获得单一菌株,再两两混合单一菌株得到混合菌群,利用微孔板法培养多物种生物膜,通过结晶紫染色法测定生物膜生物量,借助激光共聚焦扫描显微镜(Confocal laser scanning microscopy,CLSM)并结合荧光染色技术原位监测多物种生物膜形成、结构及膜内细菌的存活状况,以阐明3种土壤常见矿物(蒙脱石、高岭石、针铁矿)对多物种生物膜形成的影响,揭示土壤矿物介导前后多物种生物膜内细菌种间相互作用关系的变化。研究结果可为深刻理解土壤组分的微生物效应和土壤生物过程,以及对进一步挖掘土壤生物资源提供一定的理论指导价值。
1 材料与方法 1.1 试验材料供试土壤为紫色页岩发育的酸紫泥田水稻土,2021年7月采集于湖南省株洲市石板桥村宋家湾组(27°53′N,113°18′E)。采样时根据“S”型路线随机确定样点,采集0~20 cm表层土壤样品充分混合,去除水稻根系、砾石等土壤杂质后分成两份装入无菌自封袋中,一部分自然风干供土壤理化性质测试,另一部份保存于−80 ℃,用于多物种细菌生物膜初始接种液的提取。土壤基础理化性质为:pH5.68、土壤有机质(SOM)44.49 g·kg–1、可溶性有机碳(DOC)321.2 mg·kg–1、有效磷(AP)52.02 mg·kg–1、全磷(TP)0.43 g·kg–1、速效钾(AK)277.7 mg·kg–1。
供试矿物有蒙脱石、高岭石和针铁矿3种。其中蒙脱石和高岭石购买自美国Sigma公司。针铁矿根据Atkinson等[22]方法合成,合成物质经X射线衍射(X-ray diffraction,XRD)表征并与标准卡片PDF#81-0462比对分析,证实合成矿物确为针铁矿(图 1)。本试验体系的pH在无特殊注明的情况下均为7.0,蒙脱石、高岭石、针铁矿的zeta电位分别为:−18.24±0.32、−13.10±0.16和15.50±0.41 mV(由zeta电位仪测定)。
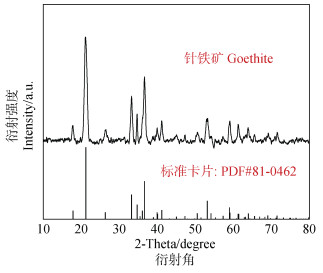
|
图 1 针铁矿的X射线衍射(XRD)图谱 Fig. 1 X−ray diffraction (XRD)pattern of goethite |
土壤多物种细菌生物膜的初始接种液是参照Burmolle等[2]方法进行提取。将过2 mm筛的150 g鲜土与300 mL无菌水混合,25 ℃、30 r·min–1恒温震荡培养12 h,使土壤微生物充分暴露在悬液中。接着将带有固体培养基的载玻片置于与烧杯连接的支架上,使载玻片既能浸入上层的土壤悬液里,又不会扰动下层泥浆,继续在25 ℃振荡器中(30 r·min–1)孵育7 d。将附着在玻片上的生物膜转移到无菌离心管中,并用适量磷酸盐缓冲溶液清洗生物膜,生物膜初始接种液与80%甘油按照1∶1的比例充分混合均匀,保存于−80 ℃备用。
1.2.2 土壤单一菌株的获取将土壤多物种细菌生物膜初始接种液经过活化、扩大培养、调OD600=1以及梯度稀释后,用无菌三角玻璃棒涂布在平板上筛选得到具有不同成膜能力的单一菌株,将单一菌株鉴定后扩大培养得到单一菌落,并从所有挑取的单一菌株中选择长势较良好的前15种菌株进行微观培养,根据其生物膜生物量由大到小标记为S-x(x为自然数,表示菌株序号),标记后于−80 ℃保存备用。
1.2.3 生物膜生物量测定将菌株扩大培养至指数中期后(OD600=1),以1%的接种量接种至含有200 µL Luria-Bertani培养基(LB培养基)96孔板中,静置于25 ℃恒温箱中培养24 h。无菌水清洗两遍以去除游离态的细菌,利用1%结晶紫染液染色15 min,清洗两遍后晾干,加入200 μL无水乙醇脱色5 min,酶标仪测定波长为595 nm的光密度(Optical Density,OD),用含菌微孔的读数减去空白微孔读数的平均值来表示生物膜生物量。
1.2.4 多物种生物膜内菌株种间互作试验从15种不同成膜能力的菌株中挑选出2种成膜能力最强,2种成膜能力最弱和1种成膜能力居中的菌株,并对这5种菌株进行鉴定发现,S-1属于假单胞菌属(Caulobacterales),S-8为肠杆菌属(Enterobacterales),S-2、S-14和S-15均为杆菌属(Bacillales)。将这5种菌株分别进行两两混合,得到10组混合菌群并置同一条件下培养,通过1.2.3所述方法测定多物种生物膜的生物量。10组混合菌群组合模式参考表 1。
|
|
表 1 混合菌群间的相互作用关系 Table 1 The interaction relationship between mixed microbial communities |
为探究不同环境下此5种菌株间的相互作用关系,从以上5种菌株中选择成膜能力最强的菌株(S-1)与其他4种菌株分别组合为4组多物种菌株初始液,将4组混合菌群分别与蒙脱石、高岭石、针铁矿3种矿物共培养。共培养参照Ma等[23]的方法,将已灭菌的150 μL LB培养基、30 μL矿物悬液和1%多物种生物膜初始接种液加入无菌的96孔板,静置在25 ℃下黑暗培养24 h,结合结晶紫染色法测定生物膜生物量,生物膜生物量利用矿物与菌共培养时的光密度减去矿物本身的光密度表示。矿物悬液浓度为1 mg·L–1,使用前超声震荡15 min使其均匀分散,并于121 ℃湿热灭菌30 min后使用。
1.2.6 激光共聚焦扫描显微镜观察湿热灭菌的矿物悬液滴在无菌的细胞爬片上晾干,将爬片、LB培养液和1%生物膜初始接种液共同置于6孔板中,25 ℃培养24 h后,收集培养的生物膜爬片并平铺于载玻片上。使用2.5 μmol·L–1 LIVE/ DEADTM BacLightTM细菌死活染料对收集的多物种生物膜样品进行染色,死活染料试剂由荧光核酸染液STYO9(激发波长为480~500 nm,激发荧光为绿色)和碘化丙啶PI(激发长为490~635 nm,激发荧光为红色)组成。避光染色15 min左右,利用激光共聚焦扫描显微镜对多物种生物膜样品进行成像观察。
1.3 统计分析所有试验均进行3次重复,数据以平均值±标准差表示。数据在SPSS 26.0中使用单因素方差分析(ANOVA)分析了各组的显著性差异(P < 0.05),并用Origin 2021版本绘图,利用ZEN 3.8、Imaris 10.0.1和Image J-win64对激光共聚焦扫描显微镜图片分析处理,针铁矿使用MDI Jade 6中的标准卡片进行比对分析。
2 结果 2.1 可培养菌株成膜能力图 2所示是从酸紫泥田水稻土中挑选出的长势较好的前15种菌株形成的生物膜生物量。生物膜成膜能力最强的两种菌株分别是假单胞菌属(Caulobacterales)S-1和杆菌属(Bacillales)S-2,其生物膜生物量分别为3.51±0.07(OD595)和2.81±0.09(OD595)。肠杆菌属(Enterobacterales)S-8的生物膜生物量(OD595:1.85±0.11)居中,生物膜生物量最小的两种菌株分别为S-14(OD595:1.45±0.06)和S-15(OD595:1.43±0.11)。对此5种选定菌株生物膜生物量作统计分析,发现成膜能力最强的假单胞菌属S-1与其余四种菌株之间均存在显著差异(P < 0.05),且以假单胞菌属S-1与杆菌属S-15之间生物膜生物量差异最大,两菌株间生物膜生物量相差59.21%,但两种杆菌属S-15和S-14间的生物膜生物量无明显差异,表明土壤中同一菌属但不同种的菌株之间会表现出不同的成膜能力,这属于菌株的特异性与菌株类别和来源无关[24]。
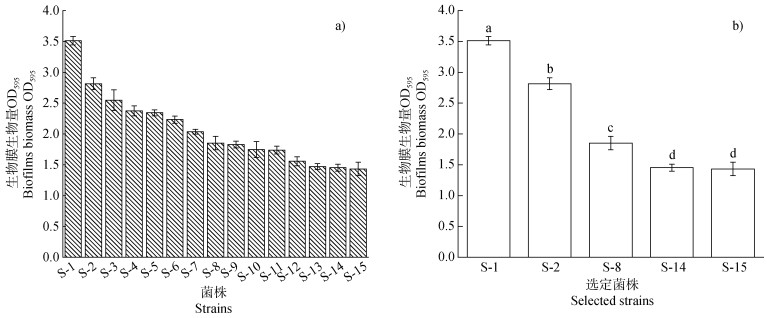
|
注:图中误差线为标准差(n=3),字母不同表示菌株间生物膜生物量存在显著差异(P < 0.05)。 Note:Error bars represent the standard deviations(n=3)in the figure,different letters indicate significant differences in biofilm biomass among different strains at 0.05 level. 图 2 水稻土中筛选出的不同菌株生物膜生物量 Fig. 2 Biofilm biomass of different strains screened in paddy soil |
微生物各物种之间的相互作用关系包括中立、协作、共生及拮抗等,而在多物种生物膜内的细菌与细菌之间同样也存在这些互作类型[25]。当混合菌群的生物膜生物量减去标准差的值大于单一菌株中最大生物量加上标准差的值时,混合菌株间的互作关系为协同作用;反之,若共培养时的生物膜生物量加上标准差小于单独培养时的最小生物量减去标准差,混合菌株间的互作关系则为拮抗作用[26],其余为中立关系[10]。
图 3为菌种单独培养和共培养时的生物膜生物量。成膜能力最强的菌株组合(S-1+S-2)、成膜能力最弱的菌株组合(S-14+S-15)以及S-2+S-14组合所形成的生物膜生物量均显著高于各自组合内成膜能力较强的单菌(分别为S-1、S-2和S-14)生物膜生物量,其生物膜生物量分别提高了20.43%、36.43%和15.39%,组合内混合菌株的相互作用关系表现为协同作用(表 1),且以S-14+S-15组合菌株间相互促进的协同效应最为显著。与组合中成膜能
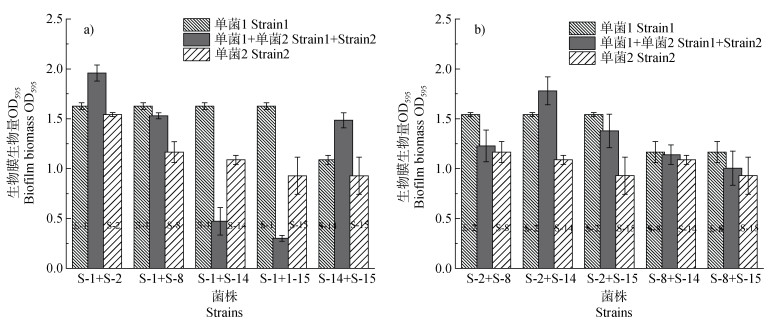
|
图 3 单一菌株与混合菌群生物膜生物量对比 Fig. 3 Comparison of biofilm biomass between monoculture and co-culture strains |
力较弱的单菌S-14和S-15生物膜生物量相比,S-1+S-14和S-1+S-15这2个组合的菌株混合培养后显著抑制了多物种生物膜的形成,其所形成的生物膜生物量分别降低了65.38%和60.55%,组合内菌株间的互作关系表现为拮抗作用(表 1)。剩余5组两两混合菌株(S-1+S-8、S-2+S-8、S-2+S-15、S-8+ S-14和S-8+S-15)共培养后,其生物膜生物量与单一菌株生物膜生物量相比并无显著差异,种间互作关系为中立。说明多物种生物膜的形成过程中生物膜细菌间存在不同相互作用类型。相较于其他菌株,假单胞菌属S-1与另外四种菌株组合后其相互作用类型更为丰富,包括协同、拮抗及中立三种,故选用S-1+S-2、S-1+S-8、S-1+S-14和S-1+S-15四组混合菌群进行后续研究。
2.3 矿物介导下多物种生物膜的形成图 4为四组混合菌群添加矿物前后的生物膜成膜能力对比。与纯菌体系相比,添加针铁矿显著促进了多菌混合体系中生物膜的形成。在针铁矿处理体系中,S-1+S-2、S-1+S-8、S-1+S-14和S-1+S-15四组混合菌群的生物膜生物量分别增加了16.56%、8.49%、46.45%和12.07%。而在添加了高岭石和蒙脱石的多菌混合体系中,多物种生物膜的形成均受到不同程度的抑制,且以高岭石处理对混合菌群生物膜形成的抑制效果更为显著。相较纯菌培养体系,高岭石处理使得S-1+S-2、S-1+S-8、S-1+S-14和S-1+S-15四组混合菌群的生物膜生物量分别降低了27.16%、39.38%、42.57%和17.64%。
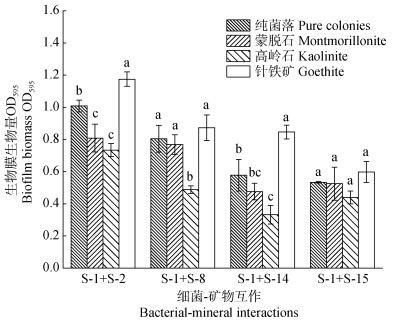
|
注:图中误差线为标准差(n=3),不同字母表示不同组合生物膜生物量存在显著差异(P < 0.05)。 Note:Error bars represent the standard deviations(n=3)in the figure,and different letters indicate significant differences in biofilm biomass among different combinations at 0.05 level. 图 4 土壤矿物介导下的混合菌群生物膜生物量 Fig. 4 Multi-species biofilm biomass mediated by soil minerals |
根据多物种生物膜种间相互作用类型定义[26]对混合菌落与矿物互作机制进行分析(图 5)。在混合菌落体系中添加土壤矿物悬后,若测得的多物种生物膜生物量最小值高于任意单一菌株生物膜生物量的最大值,则视为协同作用;反之,则视为拮抗作用。
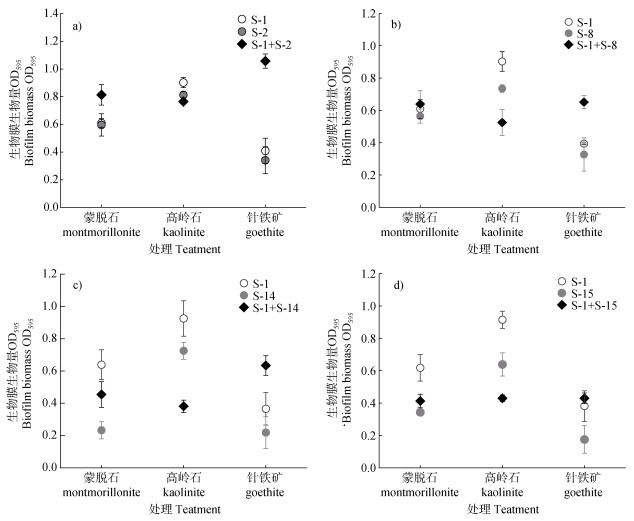
|
图 5 不同矿物体系中单菌和混合菌群的生物膜生物量对比 Fig. 5 Comparison of biofilm biomass of monoculture and co-culture strains in different mineral systems |
对比矿物添加后单菌与多菌的生物膜生物量(图 5),在蒙脱石处理体系中,蒙脱石并未改变S-1+ S-2组合的原协同作用,以及S-1+S-8组合的原中立作用,但添加蒙脱石后缓解了S-1+S-14和S-1+S-15组合间的拮抗作用,菌株间的相互作用关系转变为中立。在高岭石处理体系中,S-1+S-2组合由纯菌体系中的协同作用(图 3a)转变为中立作用(图 5a),S-1+S-8组合由中立转为拮抗互作,其余两组混合菌群仍呈现拮抗作用。在针铁矿处理体系中,除S-1+S-15组合由原拮抗作用(图 3a)调整为中立作用以外,其余三组均表现为协同作用。针铁矿处理显著增强了S-1+S-2混合菌群体系的协同效应,使得S-1+S-8和S-1+S-14组合中菌群间的互作效应由原本的中立和拮抗作用(图 3a)转变为协同作用(图 5b、c)。
2.5 多物种生物膜形貌观测针铁矿处理前后借助CLSM原位监测生物膜形貌结构和生物量的变化(图 6)。往体系中加入针铁矿后,其生物膜生物量显著高于纯菌对照体系,S-1+S-2、S-1+S-8、S-1+S-14、S-1+S-15四组菌群的生物膜厚度分别增加了13.14、0.94、7.99、5.13 μm,针铁矿促进了多物种生物膜的形成。对比多物种生物膜内活菌数量(图 7)发现,针铁矿处理体系中的活菌(绿色)数量占比显著高于纯菌体系。S-1+ S-2、S-1+S-8、S-1+S-14和S-1+S-15四组混合菌群的生物膜厚度和活菌数量依次减少,且以针铁矿处理体系中S-1+S-2组合的生物膜生物量最大,其生物膜总体厚度达到43.97 μm(图 6),活菌占比达95.46%(图 7)。S-1+S-15组合生物膜的成膜能力最弱,混合培养时其生物膜厚度仅为3.67 μm,活菌占比为85.45%。本试验结果进一步验证了针铁矿具有促进多物种生物膜形成的作用,且使原组合菌株间相互作用类型向协同合作转化。
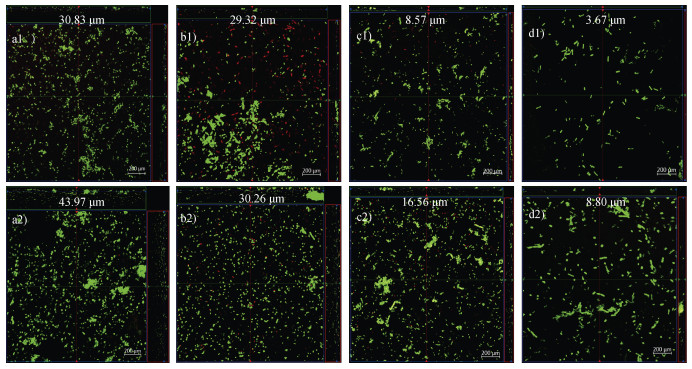
|
注:a)b)c)d)依次为S-1+S-2、S-1+S-8、S-1+S-14、S-1+S-15组合,其中a1)b1)c1)d1)为未添加针铁矿的纯菌体系,a2)b2)c2)d2)为针铁矿添加体系,图中标注的数字为生物膜的厚度。 Note:a)b)c)d)in order of combination S-1+S-2,S-1+S-8,S-1+S-14,S-1+S-15,a1)b1)c1)d1)is a pure bacterial system without goethite added,a2)b2)c2)d2)is a goethite addition system,the numbers indicated are the thickness of the biofilm in the figure. 图 6 不同体系下多物种生物膜的激光共聚焦扫描显微镜(CLSM)图 Fig. 6 Confocal laser scanning microscopy images of multi-species biofilms under different systems. |
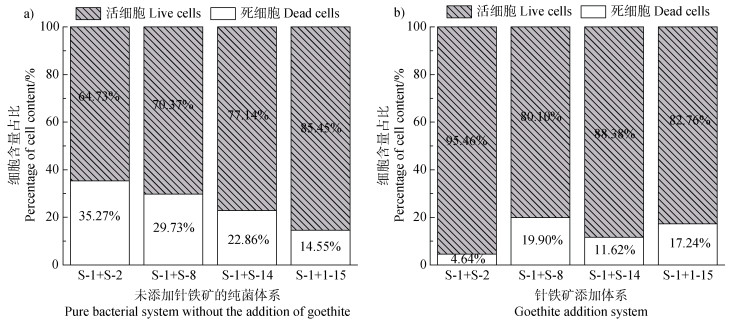
|
图 7 不同体系下多物种生物膜内死活细胞的占比 Fig. 7 Proportion of dead and alive cells in multi-species biofilms under different systems |
土壤矿物与细菌的相互作用是个双向选择的过程。细菌可以通过分泌酸性物质、与矿物中的离子发生络合反应或者形成生物膜等方式使矿质离子释放到土壤环境中,同样,土壤矿物也会通过自身的理化特性对细菌的生理活性产生影响[27]。本研究发现蒙脱石和高岭石均显著抑制了多物种生物膜的形成,且以高岭石处理体系的抑制效果更明显,而针铁矿显著促进了多物种生物膜的形成(图 4)。蒙脱石属于2∶1型层状硅酸盐矿物,由两个硅氧四面体和一个铝氧八面体组成[28],其表面带有负电荷(−18.24 mV),与带负电的细菌细胞间会产生静电斥力,减弱了细菌细胞在矿物表面的初始黏附,从而对生物膜的形成产生抑制作用。高岭石为1∶1型层状硅酸盐矿物,含有一个硅氧四面体和一个铝氧八面体。有报道指出,高岭石在与细菌共培养过程中,可能会通过层间阳离子交换或部分结构溶解释放出溶解态Al3+,而Al3+对细菌有较强的毒害作用,通过影响细菌信号分子和转运蛋白的合成,抑制QS的表达和破坏生物膜功能的完整性,最终抑制生物膜的形成[29]。针铁矿一般带正电荷,可与带负电荷的细菌细胞发生紧密吸附。但由于针铁矿形状呈现为针状,当细胞大量黏附在针铁矿上时,针铁矿有可能会将细胞穿破引发细胞死亡[30]。因黏附针铁矿而损坏、受伤或死亡的细胞会释放AI-2信号分子,刺激QS基因的表达,且凋亡的细菌细胞可以为活细胞提供养分,从而会促进生物膜的形成[31]。
3.2 土壤矿物介导下生物膜内菌株间互作关系转变分析菌株间的相互作用一般是为了竞争有利的资源和空间,以使物种在群落中获得更强的竞争优势。微生物的竞争包括两种主要类型,一种是剥削性竞争,即一个种群迅速的消耗另外一个种群的有限资源,使两种群间没有直接的相互作用;二是干扰性竞争,微生物通过分泌代谢产物干扰或抑制其余微生物的存活[32]。
多物种生物膜内菌群间存在多种相互作用形式,且菌群之间的相互作用关系会受到土壤矿物的影响而发生改变。在本研究中,两两混合菌株间的相互作用关系以中性作用占比较多。
比对蒙脱石处理前后单一菌株的生物膜生物量发现,假单胞菌属S-1的生物膜生物量由1.63(图 3)下降至0.61(图 5),S-14和S-15菌株的生物膜生物量分别降低了0.86和0.59;而蒙脱石添加前后S-1+S-14和S-1+S-15两组混合菌株的生物膜生物量变化不大,且S-1+S-14和S-1+S-15组合的相互作用关系由原拮抗作用转为中立,说明蒙脱石缓解了S-1+S-14和S-1+S-15组合菌群间的竞争关系。在纯菌培养体系中(图 3),S-1+S-8混合培养生物膜生物量高于单独培养时的S-8菌株,低于S-1菌株,两菌株间互作呈现为中立作用;而在蒙脱石处理体系,虽然与S-1单菌株相比,蒙脱石的参与使S-1+S-8组合的生物膜生物量增加了0.03,但提升效果不显著(图 5),并未改变S-1+S-8组合的中立关系。这一研究结果表明蒙脱石与细菌细胞的静电斥力作用对于混合菌株间的互作影响较大。当静电斥力存在时,会影响细生物膜内EPS组分的重新分布,改善菌株间的聚集状态,导致细菌群落结构发生变化[33-34],从而缓解了混合菌株间的竞争关系(拮抗作用)。
高岭石添加使混合菌种之间原合作关系(图 3)向竞争性相互作用转变(图 5)。大量研究表明,高岭石在与细菌相互作用过程中会溶解出Al3+,且溶解出的Al3+会对细菌造成毒害作用并抑制细菌的存活[35-36]。在本研究中,高岭石添加使混合菌种之间原合作关系向竞争性相互作用转变(图 5),其原因可能是因为菌株-高岭石相互作用过程中释放出的Al3+杀死了部分细菌,死亡的细菌细胞可以为活细胞提供新养分,微环境条件得到改善;而当微环境中出现新的营养物质时,两菌株间对限制性养分和生态位的竞争会增强,其合作互作将会消失并不断地向负相互作用转化[12],因而高岭石处理使S-1+S-2组合由原协同作用转为中立,使S-1+S-8组合由中立调整为拮抗互作。
不同类别的细菌具有不同的黏附能力[37]。在针铁矿添加体系中,首先黏附于针铁矿表面的物种最先受到伤害或死亡并处于弱势状态,而另一物种就会通过剥削性竞争迅速消耗其余弱势物种并不断利用其死亡后提供的营养资源[23],成为体系中占据更多有利资源与空间的优势物种,因此两物种间的拮抗作用会逐渐减弱,且其相互作用类型会不断地向协同合作转化。这一结果与吴颖等[38]的研究类似,即由于一部分细菌黏附死亡后导致两物种间的配比不一致,从而增强了细菌间的正向相互作用。
4 结论蒙脱石和高岭石均显著抑制了多物种菌群的生物膜成膜能力,而针铁矿的参与显著增加了四组混合菌群生物膜生物量。蒙脱石添加缓解了S-1+S-14和S-1+S-15组合菌株之间的拮抗作用,其相互作用关系转变为中立,但并未改变其余两组菌群(S-1+S-2和S-1+S-8)之间的相互作用关系;在高岭石处理体系中,除S-1+S-2组合由原协同效应调整为中立以外,其余三组均表现为拮抗作用;针铁矿处理使S-1+S-15组合由原拮抗作用调整为中立作用,使S-1+S-8和S-1+S-14组合均转为协同作用。相关研究结果可为进一步揭示多物种生物膜与土壤组分的互作机制提供新思路和科学理论依据。
| [1] |
Kong Y L, Qin H, Zhu C Q, et al. Research progress on the mechanism by which soil microorganisms affect soil health (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(2): 331-347. DOI:10.11766/trxb202301200448 [孔亚丽, 秦华, 朱春权, 等. 土壤微生物影响土壤健康的作用机制研究进展[J]. 土壤学报, 2024, 61(2): 331-347.]
(  0) 0) |
| [2] |
Burmølle M, Hansen L H, Sørensen S J. Establishment and early succession of a multispecies biofilm composed of soil bacteria[J]. Microbial Ecology, 2007, 54(2): 352-362. DOI:10.1007/s00248-007-9222-5
(  0) 0) |
| [3] |
Rendueles O, Ghigo J M. Multi-species biofilms: How to avoid unfriendly neighbors[J]. FEMS Microbiology Reviews, 2012, 36(5): 972-989.
(  0) 0) |
| [4] |
Cesa-Luna C, Geudens N, Girard L, et al. Charting the lipopeptidome of nonpathogenic Pseudomonas[J]. mSystems, 2023, 8(1): e0098822.
(  0) 0) |
| [5] |
Seelbinder B, Chen J R, Brunke S, et al. Antibiotics create a shift from mutualism to competition in human gut communities with a longer-lasting impact on fungi than bacteria[J]. Microbiome, 2020, 8(1): 133. DOI:10.1186/s40168-020-00899-6
(  0) 0) |
| [6] |
Li L Y, Zhang W T, Zhang S J, et al. Bacteria and archaea synergistically convert glycine betaine to biogenic methane in the Formosa cold seep of the South China Sea[J]. mSystems, 2021, 6(5): e0070321.
(  0) 0) |
| [7] |
Zhu Z B, Shan L L, Li X S, et al. Effects of interspecific interactions on biofilm formation potential and chlorine resistance: Evaluation of dual-species biofilm observed in drinking water distribution systems[J]. Journal of Water Process Engineering, 2020, 38: 101564.
(  0) 0) |
| [8] |
Corre M H, Delafont V, Legrand A, et al. Exploiting the richness of environmental waterborne bacterial species to find natural Legionella pneumophila competitors[J]. Frontiers in Microbiology, 2019, 9: 3360.
(  0) 0) |
| [9] |
Maes S, De Reu K, Van Weyenberg S, et al. Pseudomonas putida as a potential biocontrol agent against Salmonella java biofilm formation in the drinking water system of broiler houses[J]. BMC Microbiology, 2020, 20(1): 373. DOI:10.1186/s12866-020-02046-5
(  0) 0) |
| [10] |
Simões L C, Simões M, Vieira M J. Biofilm interactions between distinct bacterial genera isolated from drinking water[J]. Applied and Environmental Microbiology, 2007, 73(19): 6192-6200.
(  0) 0) |
| [11] |
Afonso A C, Gomes I B, Saavedra M J, et al. Bacterial coaggregation in aquatic systems[J]. Water Research, 2021, 196: 117037.
(  0) 0) |
| [12] |
Palmer J D, Foster K R. Bacterial species rarely work together[J]. Science, 2022, 376(6593): 581-582. DOI:10.1126/science.abn5093
(  0) 0) |
| [13] |
Wu Q T. Environmental pedology (In Chinese). Beijing: China Agriculture Press, 2011. [吴启堂. 环境土壤学[M]. 北京: 中国农业出版社, 2011.]
(  0) 0) |
| [14] |
Ehrlich H L. How microbes influence mineral growth and dissolution[J]. Chemical Geology, 1996, 132: 5-9.
(  0) 0) |
| [15] |
Liu B R, Jia G M, Chen J, et al. A review of methods for studying microbial diversity in soils[J]. Pedosphere, 2006, 16(1): 18-24. DOI:10.1016/S1002-0160(06)60021-0
(  0) 0) |
| [16] |
Sun Y, Wang Y L, Li L, et al. Distinct biotite-weathering activities of Arthrobacter pascens F74 under different contact conditions[J]. Journal of Basic Microbiology, 2020, 60(4): 362-371.
(  0) 0) |
| [17] |
Xu S Z, Xing Y H, Liu S, et al. Co-effect of minerals and Cd(Ⅱ)promoted the formation of bacterial biofilm and consequently enhanced the sorption of Cd(Ⅱ)[J]. Environment Pollution, 2020, 258: 113774.
(  0) 0) |
| [18] |
Nannipieri P, Ascher J, Ceccherini M T, et al. Microbial diversity and soil functions[J]. European Journal of Soil Science, 2017, 68(1): 12-26.
(  0) 0) |
| [19] |
Cheng H, Jing Z H, Yang L, et al. Sunlight-triggered synergy of hematite and Shewanella oneidensis MR-1 in Cr(Ⅵ)removal[J]. Geochimica et Cosmochimica Acta, 2021, 305: 19-32.
(  0) 0) |
| [20] |
Jeewani P H, Luo Y, Yu G H, et al. Arbuscular mycorrhizal fungi and goethite promote carbon sequestration via hyphal- aggregate mineral interactions[J]. Soil Biology & Biochemistry, 2021, 162: 108417.
(  0) 0) |
| [21] |
Liu X, Laipan M W, Zhang M, et al. Microbe-mineral interactions: Mechanisms and immobilization effect toward heavy metals (In Chinese)[J]. Environmental Chemistry, 2024, 43(2): 377-392. [刘洵, 赖潘民旺, 张敏, 等. 微生物-矿物相互作用: 机制与重金属固定效应[J]. 环境化学, 2024, 43(2): 377-392.]
(  0) 0) |
| [22] |
Atkinson R J, Posner A M, Quirk J P. Adsorption of potential-determining ions at the ferric oxide-aqueous electrolyte interface[J]. The Journal of Physical Chemistry, 1967, 71(3): 550-558.
(  0) 0) |
| [23] |
Ma W T, Peng D H, Walker S L, et al. Bacillus subtilis biofilm development in the presence of soil clay minerals and iron oxides[J]. NPJ Biofilms and Microbiomes, 2017, 3: 4.
(  0) 0) |
| [24] |
Yin Y T. Research on regulation of Lactobacillus biofilm formation and their characteristics[D]. Wuxi, Jiangsu: Jiangnan University, 2019.[尹一婷. 乳杆菌生物膜成膜规律及其特性研究[D]. 江苏无锡: 江南大学, 2019.]
(  0) 0) |
| [25] |
Makovcova J, Babak V, Kulich P, et al. Dynamics of mono- and dual-species biofilm formation and interactions between Staphylococcus aureus and Gram-negative bacteria[J]. Microbial Biotechnology, 2017, 10(4): 819-832.
(  0) 0) |
| [26] |
Xiong Z H, Zheng J W, Sun H R, et al. Biofilm- overproducing Bacillus amyloliquefaciens P29ΔsinR decreases Pb availability and uptake in lettuce in Pb-polluted soil[J]. Journal of Environmental Management, 2022, 302: 114016.
(  0) 0) |
| [27] |
Feng W L, Lin Z Y, Li Y Y, et al. Interaction between bacteria and soil minerals and application of bacterial-mineral composites in remediation of heavy metals polluted soil (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(4): 851-861. DOI:10.11766/trxb202007280143 [俸文玲, 林芷昀, 李雅莹, 等. 细菌-矿物互作及其复合体在重金属修复中的应用[J]. 土壤学报, 2021, 58(4): 851-861.]
(  0) 0) |
| [28] |
Tang H M, Wang W Z, Peng D Y, et al. Experimental study on reaction of montmorillonite with CO2 aqueous solufion (In Chinese)[J]. Oilfield Chemistry, 2022, 39(3): 455-460. [唐洪明, 王文卓, 彭东宇, 等. 蒙脱石-CO2溶液反应实验研究[J]. 油田化学, 2022, 39(3): 455-460.]
(  0) 0) |
| [29] |
Yang S S, Qu C C, Mukherjee M, et al. Soil phyllosilicate and iron oxide inhibit the quorum sensing of Chromobacterium violaceum[J]. Soil Ecology Letters, 2021, 3(1): 22-31.
(  0) 0) |
| [30] |
Cai P, Huang Q Y, Walker S L. Deposition and survival of Escherichia coli O157: H7 on clay minerals in a parallel plate flow system[J]. Environmental Science & Technology, 2013, 47(4): 1896-1903.
(  0) 0) |
| [31] |
Cai P, Liu X, Ji D D, et al. Impact of soil clay minerals on growth, biofilm formation, and virulence gene expression of Escherichia coli O157: H7[J]. Environmental Pollution, 2018, 243: 953-960.
(  0) 0) |
| [32] |
Yang C L, Dong Y, Friman V P, et al. Carbon resource richness shapes bacterial competitive interactions by alleviating growth-antibiosis trade-off[J]. Functional Ecology, 2019, 33(5): 868-875.
(  0) 0) |
| [33] |
Li Y L, Lu Y M, Han Z M, et al. Bacterial biofilm: Composition, regulation and association with plant (In Chinese)[J]. Microbiology China, 2017, 44(6): 1491-1499. [李昱龙, 陆一鸣, 韩正敏, 等. 细菌菌膜的成分、调控及其与植物的关系[J]. 微生物学通报, 2017, 44(6): 1491-1499.]
(  0) 0) |
| [34] |
Bai A Z, Li R Y, Wang X Y, et al. Biological effects of high voltage electrostatic field on E. coli (In Chinese)[J]. High Voltage Engineering, 2016, 42(8): 2534-2539. [白爱枝, 李瑞云, 王新雨, 等. 高压静电场对大肠杆菌的生物学效应[J]. 高电压技术, 2016, 42(8): 2534-2539.]
(  0) 0) |
| [35] |
Sun D S, Zhang Q. Research on growth of silicate bacteria and their leaching and dissolution of silicon and aluminium in silicate minerals (In Chinese)[J]. Metal Mine, 2005(9): 38—40, 58. [孙德四, 张强. 硅酸盐细菌生长及对硅酸盐矿物中硅铝的浸溶[J]. 金属矿山, 2005(9): 38—40, 58.]
(  0) 0) |
| [36] |
Zhou Y F, Wang R C, Lu X C. Anorthite dissolution promoted by bacterial adhesion: Direct evidence from dialytic experiment[J]. Science China Earth Sciences, 2011, 54(2): 204-211.
(  0) 0) |
| [37] |
Zhang R Y, Zhang Y T, Neu T R, et al. Initial attachment and biofilm formation of a novel crenarchaeote on mineral sulfides[J]. Advanced Materials Research, 2015, 1130: 127-130.
(  0) 0) |
| [38] |
Wu Y, Hou L D, Zhang J. Antagonistic effect of bacterial strains in complex microbial inoculants and the screening of their culture condition (In Chinese)[J]. Acta Agriculturae Zhejiangensis, 2016, 28(5): 820-827. [吴颖, 侯潞丹, 张杰. 复合微生物菌剂中各菌株间的拮抗试验及培养条件的筛选[J]. 浙江农业学报, 2016, 28(5): 820-827.]
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


