2. 江西省农业科学院水稻研究所, 南昌 330200;
3. 江西省红壤及种质资源研究所, 耕地改良与质量提升江西省重点实验室, 南昌 330046
2. Rice Research Institute, Jiangxi Academy of Agricultural Sciences, Nanchang 330200, China;
3. Key Laboratory of Arable Land Improvement and Quality Improvement of Jiangxi Province, Jiangxi Institute of Red Soil and Germplasm Resources, Nanchang 330046, China
稻田土壤是我国最重要的农田土壤类型之一,其中约60%分布在我国亚热带地区。研究表明,我国稻田土壤固碳潜力明显高于相同生境下的旱地土壤[1-2]。红壤是我国亚热带主要的土壤类型之一,总面积约204万km2,是我国南方水稻生产中重要的土壤资源[3]。然而,由于强烈风化和利用不当,红壤存在土质较差、有机质含量低、土壤肥力较低等一系列问题[4]。因此,提高红壤有机碳固存对于提高土壤肥力和作物产量至关重要。水稻秸秆还田作为外源有机质输入稻田土壤的重要途径之一,被证实能够提高稻田土壤有机碳(SOC)库含量,改良土壤结构,增强土壤肥力,提高水稻产量,是实现土壤可持续利用的重要的农田管理措施[5–7]。土壤微生物作为外源有机质转化和固存过程的关键因子,在水稻秸秆还田中发挥着重要作用。微生物通过同化作用将外源秸秆合成自身组分,并伴随自身生长、繁殖、死亡,最终以微生物残体形式稳定固存在土壤中。这部分稳定微生物源有机碳占SOC库的一半以上[8]。尽管活体微生物生物量对SOC的贡献不到5%,但其生长速率及群落结构变化直接影响着死亡微生物残体的生成和稳定[9]。
由于水稻秸秆较高的C/N、C/P,通常情况下秸秆还田常常伴随着氮磷养分的相对缺乏,微生物对外源秸秆的转化过程与SOC的固存也受到土壤养分可利用性的制约[10]。营养胁迫条件下,微生物调节自身代谢功能以维持元素化学计量,挖掘SOC来获取自身生长所需养分[11-12]。因此,土壤中的氮磷养分作为微生物生长繁殖的驱动因子直接影响着微生物群落生长和微生物残体的形成。秸秆还田配施氮磷能够一定程度上维持土壤元素化学计量平衡,对微生物群落结构及合成代谢外源有机质的微生物过程起到积极调控作用[13]。研究表明,与单独秸秆添加相比,同时配合施肥能够促进秸秆分解,改变微生物的群落结构,促进微生物生物量的增加和残体的生成[14–16]。Bei等[17]通过56 d的室内培养试验发现,单独添加秸秆和秸秆联合氮肥添加处理下三种不同土地利用方式的土壤微生物生物量碳均未改变,但微生物生物量的响应却不同,秸秆联合氮肥添加显著提高了施有机肥土壤中的真菌细菌比值,其比值在废弃农田和未施肥农田中没有显著变化。秸秆降解需要微生物许多代谢步骤,秸秆长时间分解可能会引发微生物复杂的微生物互作等造成其群落结构改变。因此,前人研究中微生物对秸秆耦合养分添加响应的差异可能与不同土壤的养分含量、土壤中微生物群落结构和不同秸秆的分解特性等有关,这也体现了外源有机质添加后微生物对其分解利用和自身周转的复杂性[18]。同时,微生物残体的积累和转化与微生物群落组成紧密相关。活体微生物的群落组成和不同的生活史策略会对其后续微生物量的合成和同化代谢产物的生成与积累造成影响。外源植物残体和养分输入会影响不同生长效率微生物类群的碳源利用效率[19–21],这直接影响了微生物残体碳的形成积累和对SOC的贡献。目前关于秸秆与氮磷配施如何影响稻田土壤微生物群落组成及最终残体的积累动态尚不清楚,活体微生物量与微生物残体之间的内在关联性研究仍非常有限。开展这方面研究有助于深入认识秸秆还田影响稻田SOC动态的内在微生物作用机制。
因此,本研究以亚热带红壤水稻土为研究对象,基于为期300 d的室内模拟培养实验,探讨秸秆及其耦合氮磷添加对微生物生物量、群落组成及死亡残体积累动态的影响,解析活体微生物与死亡残体含量变化之间的内在关联,探讨秸秆输入驱动SOC形成的微生物贡献机制及氮磷调控效应,以期为优化秸秆及肥料施用提供理论支持和参考依据。主要提出两点科学问题:(1)外源秸秆添加后微生物群落和微生物残体的变化及氮磷调控机制。(2)秸秆及其耦合氮磷添加后如何通过影响活体微生物从而影响微生物残体的变化。本研究假设:(1)秸秆及其耦合氮磷添加会改变微生物群落结构,且各类微生物生物量会随培养时间延长而发生变化,而秸秆耦合氮磷养分添加会使微生物群落结构加速转变为真菌和革兰氏阴性菌为主的群落。(2)与单独添加秸秆相比,秸秆耦合氮磷添加能够提高微生物残体碳及其占有机碳的比例,且微生物残体碳受微生物群落结构的显著影响。
1 材料与方法 1.1 供试材料供试土壤采自位于江西省南昌市进贤县张公镇的江西省红壤及种质资源研究所(28°15′N,116°20′E)。该地属于亚热带季风湿润气候,年平均气温18.1 ℃,年平均降雨量1 537 mm。试验田土壤为第四纪黏土母质发育的潴育性红壤,近3年种植制度为油菜-旱稻轮作。土样采集于水稻收获后秋冬季节田面完全落干水分时进行。使用五点混合采样法对0~15 cm深度的耕层土壤进行采集,剔除可见根系和石砾等,过2 mm筛,一部分于4 ℃冰箱冷藏保存,一部分自然风干用于后续培养试验。采集土样的基本理化性质如下:土壤pH5.29,有机质含量14.1 g·kg–1,水解氮含量102 mg·kg–1,有效磷含量26.9 mg·kg–1。
1.2 试验设计室内培养试验设置3个处理:空白对照(CK)、单独添加秸秆(S)、秸秆耦合氮磷添加(S + NP),每个处理重复3次。其中水稻秸秆采集自南京信息工程大学农田试验站(32°13′ N,118°43′ E),于水稻成熟期收获,水稻秸秆的添加量为11.6 g·kg–1土(C 5 mg·g–1土,过0.5 mm筛)。配施的无机氮磷养分分别为硫酸铵((NH4)2SO4)和磷酸二氢钾(KH2PO4),氮磷添加量分别为N 125 mg·kg–1土和P 30 mg·kg–1土。首先称取20 g风干土于培养瓶中,在培养箱中25 ℃恒温避光预培养一周,土样含水量保持在70%田间持水量。正式培养根据处理一次性加入秸秆及氮磷,之后同样保持恒温25 ℃避光培养,土壤样品湿度控制在田间持水量的70%,使用称重法补充水分,水分含量波动的控制范围小于2%。培养周期为300 d,土壤样品共取样3次,分别在第30、105、300天进行破坏性取样,测定土壤基本理化性质、磷脂脂肪酸和土壤氨基糖的含量。
1.3 土壤理化性质及微生物生物量的测定SOC和土壤全氮(TN)使用元素分析仪(Elementar Analysensysteme GmbH,Germany)进行测定。土壤铵态氮和硝态氮通过KCl浸提后使用连续流动分析仪(Skalar SAN++ System,Skalar Analytical B.V.,Breda,Netherlands)测定二者浓度,铵态氮和硝态氮的总和为土壤无机氮(IN)[22]。土壤有效磷(AP)含量采用钼锑抗比色法进行测定[23]。土壤微生物生物量的测定采用磷脂脂肪酸(PLFA)进行表征。土壤样品冻干后,采用Bligh-Dyer法[24],通过提取脂类、分离磷脂和甲醇酯化来提取土壤微生物的PLFA。然后将加入正己烷溶解氮吹后的磷脂脂肪酸甲酯,使用MIDI全自动微生物鉴定系统(MIDI Inc.,Newark,DE,USA)和气相色谱仪(Agilent 7890B,Agilent,Palo Alto,CA,USA)检测微生物PLFA。根据各组分的出峰时间和保留时间,与系统谱库中的标准值匹配来鉴定PLFA的种类。根据表 1对土壤PLFA进行归类[25]。革兰氏阳性菌(G+)为放线菌门和厚壁菌门的总和;G+和革兰氏阴性菌(G–)的总和为细菌生物量;真菌生物量为丛枝菌根真菌和腐生真菌的总和;总微生物PLFA为真菌、细菌和非特异性PLFA的总和。
|
|
表 1 土壤微生物PLFA归类 Table 1 Species of soil microbial PLFAs |
微生物残体碳使用土壤氨基糖来表征[26]。根据Zhang和Amelung[27]的糖腈乙酰酯衍生气相色谱法来测定土壤样品中氨基糖的含量。样品经过盐酸水解后,通过离心、纯化、衍生得到氨基糖衍生化产物,使用气相色谱仪(Agilent 7890B GC,Agilent Technologies,Santa Clara,CA,USA)进行测定。然后根据内标法计算氨基糖的含量[27],计算公式如下:
| $ {C_{\text{x}}} = {C_{\text{i}}} \times {A_{\text{x}}} \times {R_{\text{f}}}/{A_{\text{i}}} $ | (1) |
式中,Cx为氨基糖的含量(mg·kg–1);Ci为内标肌醇的浓度(mg·kg–1);Ax和Ai分别为氨基糖和样品测定中肌醇的峰面积(mV·min–1);Rf为每种氨基糖的相对矫正因子,利用标准样品中氨基糖和肌醇的校正因子进行计算。
将氨基糖含量进行数据转换可以得到微生物残体碳的数据[28-29],公式如下:
| $ 细菌残体碳=胞壁酸含量×45 $ | (2) |
| $ \begin{array}{c} \text { 真菌残体碳 }=(\text { 氨基葡萄糖含量 } / 179-12 \times \text { 胞壁酸含量 } \\ \qquad / 251) \times 179 \times 9 \end{array} $ | (3) |
| $ 总微生物残体碳=真菌残体碳+细菌残体碳 $ | (4) |
式中,微生物残体碳和氨基糖单位均为mg·kg–1,45是将胞壁酸含量转化为细菌残体碳的转化系数,氨基葡萄糖转化为真菌残体碳的转化系数为9,179和251分别是氨基葡萄糖和胞壁酸的分子量。
1.5 数据处理利用IBM SPSS Statistics 25和R 4.2.2进行数据分析,Origin 2021进行绘图。采用双因素方差分析和LSD多重比较法进行差异显著性检验,显著性检验水平为0.05。基于Spearman相关系数来评价不同指标之间的相关性。
2 结果 2.1 土壤微生物群落结构的变化秸秆及秸秆耦合氮磷养分添加下土壤微生物群落结构变化如图 1所示。秸秆及秸秆耦合氮磷均显著改变了土壤微生物群落结构。与对照(CK)相比,单独秸秆添加处理(S)和秸秆耦合氮磷(S+NP)下各微生物和总微生物的生物量显著提高,其中真菌生物量的增幅最大,S和S+NP处理相较于对照分别增加46.0%~127.7%和65.1%~130.1%。培养初期(前30天)内各处理间差异不显著,然而随着培养时间延长,氮磷养分添加作用开始明显。培养结束时,相较于单独秸秆添加,S+NP处理显著增加了总微生物生物量(9.3%)和真菌生物量(8.9%)(图 1f和图 1a)。细菌生物量随培养时间的变化与真菌有所不同,表现为先升高后降低,培养后期S+NP处理中细菌生物量略高于S处理(图 1d)。与对照相比,秸秆和秸秆配施氮磷均显著增加了真菌与细菌的比值(图 1e)。此外,G+和G–的含量动态随培养时间变化不同,G+生物量在培养中期(30~105 d)升高后保持平稳,而G–含量先升高后降低(图 1b和图 1c)。
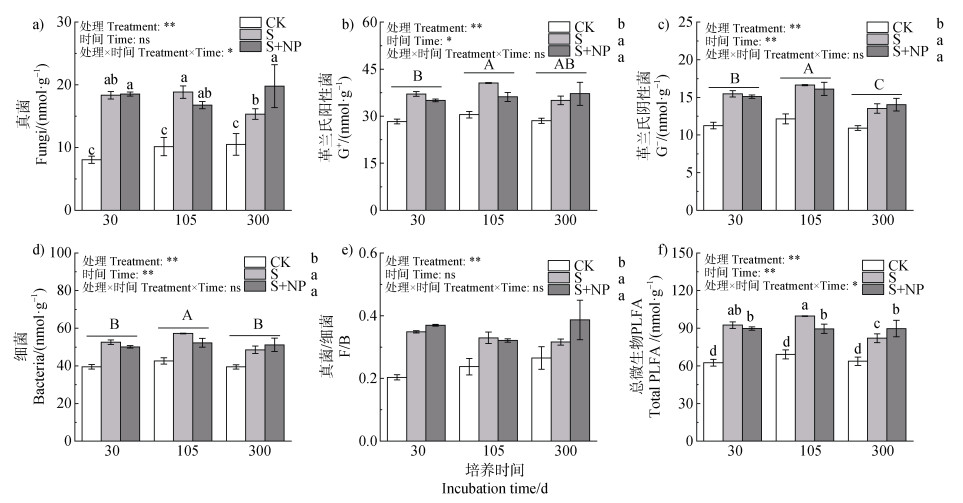
|
注:CK:对照;S:单独秸秆添加;S+NP:秸秆耦合氮磷添加;G+:革兰氏阳性菌;G–:革兰氏阴性菌;F/B:真菌/细菌。图中数据为平均值±标准差(n=3),左上角为双因素方差分析结果,“处理×时间”表示二者的交互效应,“*”为0.05水平上显著,“**”为0.01水平上显著,“ns”为不显著。交互效应显著时,小写字母表示所有处理之间的差异。交互效应不显著主效应显著时,大写字母表示时间之间的差异,小写字母表示处理之间的差异。下同。 Note: CK: Control; S: Straw addition; S+NP: Straw addition with nitrogen and phosphorus; G+: Gram-positive bacteria; G–: Gram-negative bacteria; F/B: fungi/bacteria. Data are expressed as means ± standard deviation (n=3), the results of the two-way ANOVA are shown in the upper left corner, and "treatment × time" indicates the interaction effect. "*" is significant at the level of 0.05, and "**" is significant at the level of 0.01, "ns" is no significant. When the interaction effect is significant, lowercase letters indicate significant differences among all treatments. When the interaction effect is not significant and the main effect is significant, uppercase letters represent significant differences among three times and lowercase letters represent significant differences among three treatments. The same below. 图 1 秸秆及秸秆耦合氮磷添加后土壤微生物群落结构的动态 Fig. 1 Dynamic changes of microbial community structure after addition of straw with nitrogen and phosphorus |
秸秆及秸秆耦合氮磷添加显著增加了土壤微生物残体碳含量,但真菌残体碳和细菌残体碳的积累动态在不同处理下有所不同(图 2)。由图 2可知,各微生物残体碳及比值均没有处理和时间的交互作用,处理主效应和时间主效应均显著。与CK相比,S和S+NP处理真菌残体碳含量在各培养时间显著提高12.8%~31.3%(图 2b)。总微生物残体碳含量的变化与真菌残体碳有着相似的规律,S和S+NP处理总微生物残体碳含量提高10.9%~26.1%(图 2a)。细菌残体碳的含量与真菌残体碳和总微生物残体碳变化动态不同,氮磷添加对细菌残体碳的影响更为显著。秸秆添加条件下,氮磷配施显著降低了细菌残体碳的含量。此外,细菌残体碳在培养中期显著提高,随培养时间的延长细菌残体碳的含量有所下降,其中S+NP处理细菌残体碳降幅最大。在培养结束时,与培养期间最高值相比,降幅达13.1%(图 2c)。同时,秸秆和秸秆配施氮磷对真菌残体与细菌残体比值的影响有所不同,秸秆配施氮磷对真细菌残体比值的增加有明显的促进作用,培养结束时真菌与细菌残体比值较对照处理高28.1%(图 2d)。
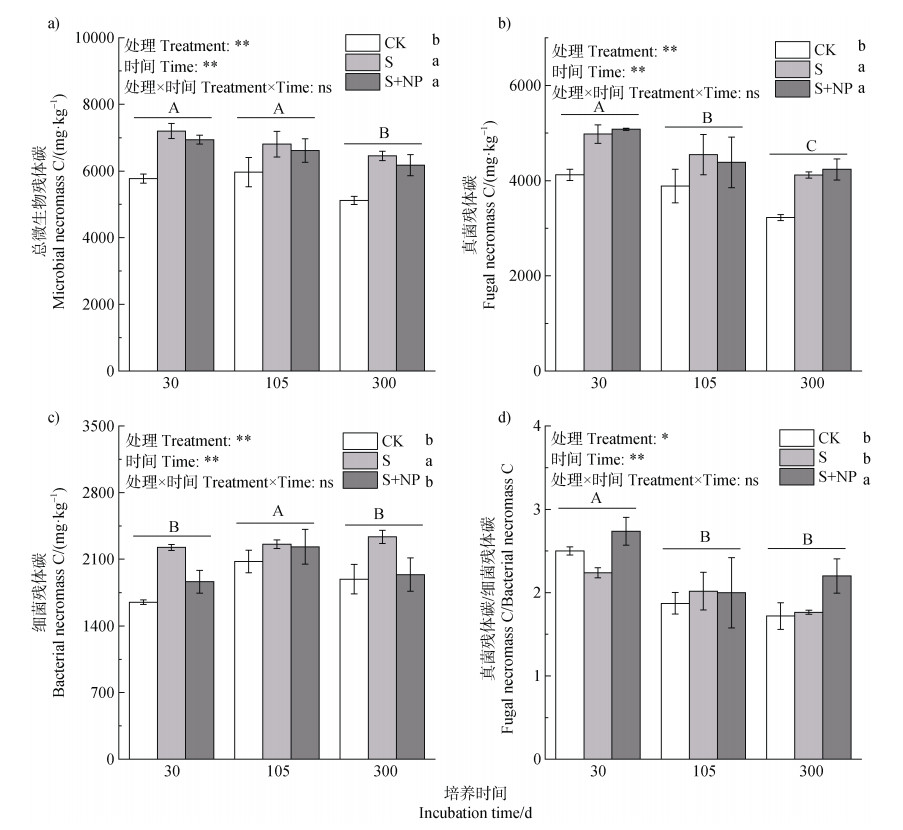
|
图 2 秸秆及秸秆耦合氮磷添加后土壤微生物残体碳的动态 Fig. 2 Dynamic changes of microbial necromass carbon after addition of straw with nitrogen and phosphorus |
秸秆及秸秆耦合氮磷添加下SOC含量的变化和微生物残体碳对SOC相对贡献的动态如图 3所示。SOC含量在秸秆和秸秆耦合氮磷处理下显著提高,S处理在30、105和300 d分别较CK显著提高33.0%、31.7%和26.6%,S+NP处理分别较CK提高36.4%、36.4%和34.2%,亦显著高于S处理(图 3a)。总微生物残体碳与SOC的比值和真菌残体碳与SOC的比值随培养时间下降,且S和S+NP处理均使总微生物残体碳占SOC的比例下降,降幅分别为0.4%~13.3%和10.1%~18.5%,但各处理对真菌残体碳占SOC的比例没有显著影响(图 3b和图 3c)。此外,S+NP处理下细菌残体与SOC的比值显著降低,培养300 d时,细菌残体碳与SOC的比值在S+NP处理下相较于S处理显著降低了21.8%(图 3d)。
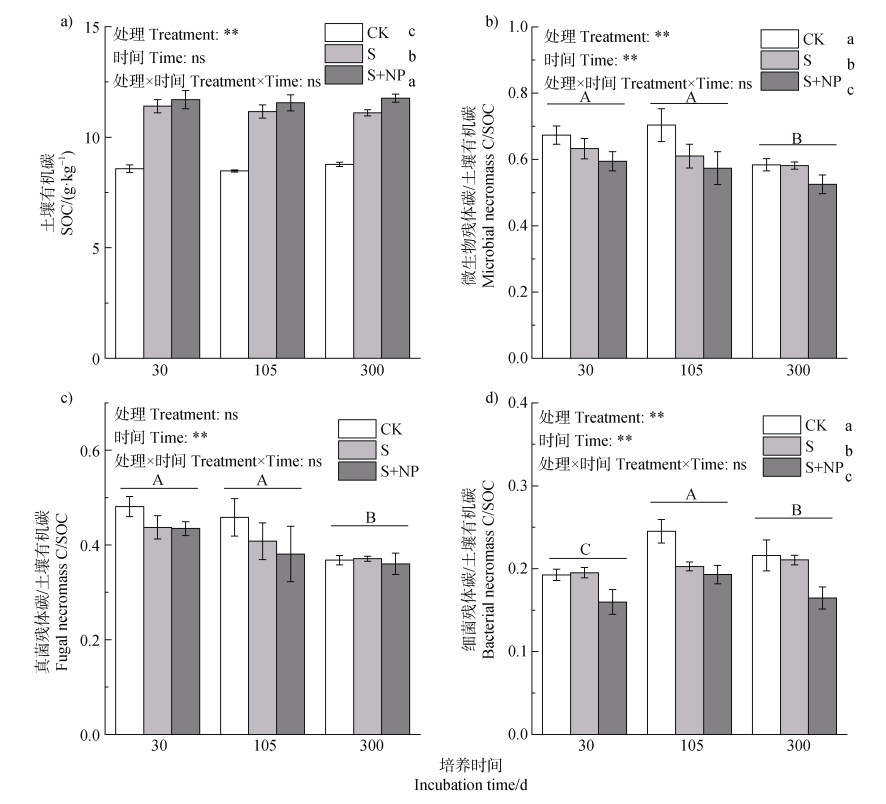
|
图 3 秸秆及秸秆耦合氮磷添加后微生物残体碳对SOC贡献的动态 Fig. 3 Dynamic changes in the contribution of microbial necromass carbon to soil organic carbon after addition of straw with nitrogen and phosphorus |
将微生物残体指标与SOC、TN及微生物群落指标进行相关性分析,如图 4所示。可以看出,微生物残体和细菌、真菌、G+、G–、F/B及总微生物生物量均显著正相关。同时,各微生物生物量也与SOC、TN和土壤C/N呈显著正相关。此外,总微生物残体也与SOC、TN和土壤C/N显著正相关,而真菌残体碳与SOC和土壤TN显著正相关,并且细菌残体碳与SOC的相关性小于真菌残体。
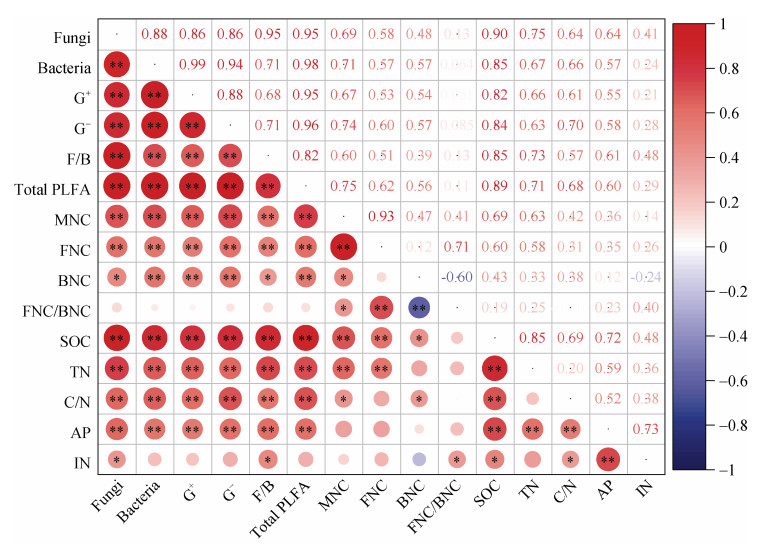
|
注:MNC:微生物残体碳;BNC:细菌残体碳;FNC:真菌残体碳;AP:有效磷;IN:无机氮。 Note: MNC: microbial necromass carbon; BNC: bacterial necromass carbon; FNC: fungal necromass carbon; AP: available phosphorus; IN: inorganic nitrogen. 图 4 秸秆及秸秆耦合氮磷添加下土壤理化性质与土壤微生物的相关性热图 Fig. 4 Heatmap of the correlation between soil properties and soil microorganisms after addition of straw with nitrogen and phosphorus |
本研究结果表明,秸秆输入及其耦合氮磷养分添加会显著影响土壤微生物生物量及其群落结构,这与前人的结果一致[30-31](图 1)。秸秆及其耦合氮磷添加为土壤带来了大量的易分解碳源及养分,促进了各类微生物生长繁殖[10,32],同时SOC和TN与各微生物生物量的显著正相关关系也证明了土壤养分的增加提高了微生物生物量(图 4)。然而,相较于单独秸秆添加,在培养前期,秸秆耦合氮磷添加没有显著增加微生物生物量(图 1)。这可能主要与两方面因素有关:一方面由于原始红壤有机碳含量较低,土壤中微生物生长繁殖主要受到碳限制,氮磷相较于碳不是微生物生长的限制因子,秸秆降解初期,易利用碳源的释放会被微生物迅速利用并进行生长繁殖[33]。另一方面,秸秆中的氮磷能够暂时满足秸秆分解初期相关微生物的生长繁殖。而微生物对氮磷养分的响应在培养后期开始明显,秸秆耦合氮磷养分添加使真菌、细菌、G+、G–和总微生物生物量均有所增加(尽管有些在统计学上不显著)(图 1)。可能是由于培养后期秸秆中易分解物质逐渐消耗殆尽,剩下一些难分解组分如木质素、纤维素等分解缓慢,而施肥处理对纤维素分解有显著的促进作用,胞外酶的合成和分泌需要额外的养分[34]。因此,秸秆耦合氮磷的长期施用可能促进了培养后期与纤维素等碳水化合物分解相关的碳获取酶活性的增加,微生物代谢能力增强的同时也有利于秸秆后期分解释放更多的养分供微生物生长[35]。
单独秸秆添加和秸秆及氮磷耦合添加对真菌生物量影响最大。真菌化学计量比较高,能够迅速利用外源秸秆带来的大量碳源,在秸秆添加后真菌生物量显著大幅度增加,同时真菌也是秸秆分解的主要参与者,真菌的大量富集反过来又促进秸秆分解形成正反馈,提高了秸秆的利用效率[36](图 1a)。此外,真菌在控制土壤酶方面起重要作用,在秸秆分解早期分泌合成大量的土壤氧化酶,对秸秆解聚和再加工起主要作用,因此其活性在秸秆添加早期显著增加[37-38]。在培养300 d时,S+NP处理中真菌生物量显著高于S处理,细菌生物量也有所增加(尽管在统计学上不显著)(图 1)。说明秸秆还田的条件下,适量的氮磷配施有利于微生物的生长及较高的生物量维持,尤其是真菌。真菌相较于细菌化学计量比较高,对养分需求较低,也有着更高的碳源利用率和养分利用效率,真菌可以通过菌丝进行碳源和养分的传递与运输,能够更加高效地利用和截获外源底物的碳源和养分中的氮磷,在秸秆耦合氮磷添加处理后期更加快速地周转[39]。此外,真菌对于难分解底物利用能力较强,秸秆分解后期易分解底物逐渐减少,真菌相较于细菌更加活跃,生长繁殖加快[40],因此秸秆耦合氮磷添加后期,细菌的增幅低于真菌,二者的比值显著增加(图 1e)。同时,真菌与细菌的比值(F/B)反映土壤肥力与健康状况,其比值越高土壤可能拥有更高的生态缓冲能力和更高的土地持续利用能力[41],因此培养后期S+NP处理下F/B比值的增高表明秸秆耦合氮磷能够在较长时间尺度上促进稻田生态系统的稳定。此外,不同微生物类群的生长与周转会受到底物质量的影响。G+喜欢利用较难分解的底物,而G–则善于利用较为新鲜的植物残体[42],因此培养前期G–增幅大于G+,而培养后期秸秆进入难分解阶段时G–的生物量降低(图 1d)。
3.2 秸秆耦合氮磷添加对微生物残体的影响与主控因素分析秸秆及其耦合氮磷改变了土壤微生物残体碳含量及其占SOC的比例,但其对处理的响应有所不相同。在各培养时间S和S+NP均显著提高了真菌残体碳含量(图 2)。但真菌残体碳占SOC的比例对秸秆及其耦合氮磷的响应与真菌残体碳不同,培养结束时各处理间真菌残体碳占SOC比例没有显著差异(图 3)。相关性分析表明真菌残体碳与真菌生物量有着显著正相关关系(图 4),秸秆耦合氮磷添加下真菌快速生长导致土壤真菌生物量大量增加(图 1)。这可能是由于外源植物残体和养分的输入提高了微生物的碳利用效率,能够有效地积累土壤微生物生物量,并随着微生物死亡将生物量转化为微生物残体,促进了活体微生物周转,加速微生物死亡残体的形成[43]。一般来说,真菌主导的微生物群落结构碳源利用效率较高,秸秆和氮磷添加带来了丰富的碳源和养分,同时也促进了微生物分解外源植物残体碳进行自身合成与生长繁殖的速率,导致微生物细胞生长-繁殖-死亡产生的微生物残体快速连续迭代积累,有利于外源有机碳向SOC的转化[8]。同时,微生物残体的稳定性与土壤矿物相互作用和土壤团聚体的物理保护紧密相关,真菌残体可以通过土壤团聚体的物理保护和矿物吸附进一步保存,而真菌更活跃的生长反过来可以刺激土壤团聚体的形成又加强了微生物残体在土壤中的积累稳定[44]。
然而值得注意的是,在秸秆添加的条件下,氮磷配施在培养后期反而使细菌残体碳显著降低(图 2c)。Liang等[45]通过室内培养实验发现底物添加数量在较短时间内影响微生物残体的积累,而较长时间范围内外源碳转化的微生物过程主要受到底物组成和质量的影响。细菌对可利用底物的响应更强烈,氮磷的添加能够降低底物的碳氮比使化学计量趋于平衡,使细菌快速利用外源养分,分解底物合成自身生物量[46],加快其代谢率和生物量周转,在培养前期和中期能够使细菌生物量及死亡残体快速积累(图 1和图 2)。然而细菌残体碳在秸秆耦合氮磷处理下后期显著减少,可能是由于细菌更快的生命周期和更快的周转率,导致S+NP处理相较于S处理秸秆分解和养分利用更快,培养后期微生物易获取氮源等养分减少,较不稳定的细菌残体可能会被微生物作为氮源分解来维持其生长代谢[47]。同时,培养后期S+NP下细菌残体碳的降低也与细菌残体对土壤中养分含量变化更加敏感有关。细菌的碳氮比更低,在土壤中分布更分散,其残体也更容易被活体微生物和土壤酶接触并快速分解[48]。Meng等[14]的研究也证实了这一点,与真菌残体相比,细菌残体与氮获取酶(β-1,4-N-乙酰氨基葡萄糖苷酶)活性的相关性更高。本研究中培养后期S+NP条件下细菌生物量显著高于对照,但S+NP并没有改变细菌残体碳含量(图 1和图 2)。同样的,S+NP使细菌残体碳与SOC的比例有所降低,使其对SOC的贡献显著低于CK和S(图 3)。细菌残体碳含量及其对有机碳贡献的动态都进一步支持了我们的猜测,培养后期养分的添加导致氮源相对不足,细菌残体先合成后被微生物偏好性分解利用。
SOC的积累与微生物同化代谢固碳密切相关,有机碳含量与微生物生物量和残体积累均呈显著正相关(图 4),表明外源植物残体和养分添加通过促进微生物生物量的形成和残体积累,加强了稻田土壤中微生物在维持高有机碳库中的作用[19]。同时,微生物残体碳含量增加而其占SOC的比值降低可能是由于秸秆的加入使土壤中植物源碳增加[49]。土壤中无机氮和有效磷的含量可能是微生物生物量和残体变化的重要因素,例如Zhao等[30]研究表明,秸秆添加通过降低土壤中硝态氮含量改变了细菌和真菌的群落结构,其结构在培养前期受SOC调控,而培养后期则受铵态氮调控。此外,细菌残体更容易受到外源碳和养分的影响,培养后期秸秆和氮磷添加条件下细菌残体碳的下降导致真菌残体碳和细菌残体碳的比值在培养结束时显著高于对照和单独秸秆添加(图 3)。由于真菌残体较高的稳定性,其在土壤中留存时间较长,意味着秸秆还田条件下,氮磷养分的添加更有利于SOC中微生物源碳的长期固存。
4 结论稻田秸秆还田能够通过改变土壤微生物群落结构来显著促进其残体积累,进而影响稻田SOC积累,这一过程受到外源氮磷养分添加的影响。秸秆添加显著增加了稻田土壤微生物生物量,并且随着培养时间的增加,微生物群落结构逐渐转为真菌为主导,在氮磷耦合添加条件下总微生物量及真菌生物量显著增高,说明秸秆耦合氮磷添加有助于在较长时间尺度上维持较高的土壤微生物生物量。值得注意的是,秸秆配施氮磷后期细菌残体积累数量相较于单施秸秆显著降低,表明细菌残体在养分缺乏条件下会发生分解转化,进而在一定程度上调节土壤碳氮元素的供给和平衡;而秸秆耦合氮磷添加更有利于真菌残体的积累。考虑到真菌残体比较稳定,本研究结果表明随着群落结构向真菌为主导的转化,在较长时间尺度上更有利于SOC的截获。相关分析结果进一步表明活体微生量与死亡残体和SOC之间均有显著正相关,说明秸秆输入驱动稻田SOC的转化动态与微生物过程密切相关,主要表现为秸秆添加下氮磷在长时间尺度上通过促进真菌生物量来促进真菌残体碳积累。
| [1] |
Wu J S, Li Y, Tong C L, et al. The key geo-biochemical processes of the long-term carbon sequestration and its mechanisms in the subtropical paddy soils (In Chinese)[J]. Research of Agricultural Modernization, 2018, 39(6): 895-906. [吴金水, 李勇, 童成立, 等. 亚热带水稻土碳循环的生物地球化学特点与长期固碳效应[J]. 农业现代化研究, 2018, 39(6): 895-906.]
(  0) 0) |
| [2] |
Wu J. Carbon accumulation in paddy ecosystems in subtropical China: Evidence from landscape studies[J]. European Journal of Soil Science, 2011, 62(1): 29-34. DOI:10.1111/j.1365-2389.2010.01325.x
(  0) 0) |
| [3] |
Huang S, Peng X X, Huang Q R, et al. Soil aggregation and organic carbon fractions affected by long-term fertilization in a red soil of subtropical China[J]. Geoderma, 2010, 154(3/4): 364-369.
(  0) 0) |
| [4] |
Guo Q K, Liang G Q, Zhou W, et al. Microbiological mechanism of long-term organic fertilization on improving soil biological properties and double rice yields in red paddy soil (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2020, 26(3): 492-501. [郭乾坤, 梁国庆, 周卫, 等. 长期有机培肥提高红壤性水稻土生物学特性及水稻产量的微生物学机制[J]. 植物营养与肥料学报, 2020, 26(3): 492-501.]
(  0) 0) |
| [5] |
Li X Y, Li B, Wang C Q, et al. Effects of long-term straw returning on organic carbon and extracellular enzymes in paddy soil aggregates (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(1): 235-246. DOI:10.11766/trxb202206170325 [李新悦, 李冰, 王昌全, 等. 长期秸秆还田对水稻土团聚体有机碳及胞外酶的影响[J]. 土壤学报, 2024, 61(1): 235-246.]
(  0) 0) |
| [6] |
Li S, Zhang S R, Pu Y L, et al. Dynamics of soil labile organic carbon fractions and C-cycle enzyme activities under straw mulch in Chengdu Plain[J]. Soil & Tillage Research, 2016, 155: 289-297.
(  0) 0) |
| [7] |
Wang J K, Xu Y D, Ding F, et al. Process of plant residue transforming into soil organic matter and mechanism of its stabilization: A review (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(3): 528-540. DOI:10.11766/trxb201811140559 [汪景宽, 徐英德, 丁凡, 等. 植物残体向土壤有机质转化过程及其稳定机制的研究进展[J]. 土壤学报, 2019, 56(3): 528-540.]
(  0) 0) |
| [8] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2: 17105. DOI:10.1038/nmicrobiol.2017.105
(  0) 0) |
| [9] |
Angst G, Angst Š, Frouz J, et al. Stabilized microbial necromass in soil is more strongly coupled with microbial diversity than the bioavailability of plant inputs[J]. Soil Biology & Biochemistry, 2024, 190: 109323.
(  0) 0) |
| [10] |
Mo F, Yang D Y, Wang X K, et al. Nutrient limitation of soil organic carbon stocks under straw return[J]. Soil Biology & Biochemistry, 2024, 192: 109360.
(  0) 0) |
| [11] |
Heuck C, Weig A, Spohn M. Soil microbial biomass C: N: P stoichiometry and microbial use of organic phosphorus[J]. Soil Biology & Biochemistry, 2015, 85: 119-129.
(  0) 0) |
| [12] |
Hu Y T, Zheng Q, Noll L, et al. Direct measurement of the in situ decomposition of microbial-derived soil organic matter[J]. Soil Biology & Biochemistry, 2020, 141: 107660.
(  0) 0) |
| [13] |
Guo Z B, Wan S X, Hua K K, et al. Fertilization regime has a greater effect on soil microbial community structure than crop rotation and growth stage in an agroecosystem[J]. Applied Soil Ecology, 2020, 149: 103510. DOI:10.1016/j.apsoil.2020.103510
(  0) 0) |
| [14] |
Meng X T, Zhang X C, Li Y N, et al. Nitrogen fertilizer builds soil organic carbon under straw return mainly via microbial necromass formation[J]. Soil Biology & Biochemistry, 2024, 188: 109223.
(  0) 0) |
| [15] |
Zhou Z J, Guo S, Chen K, et al. Long-term straw mulching affects rice and wheat yields, soil nitrogen fractions, and microbial community under a no-till system (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(4): 1148-1159. DOI:10.11766/trxb202011190522 [周子军, 郭松, 陈琨, 等. 长期秸秆覆盖对免耕稻-麦产量、土壤氮组分及微生物群落的影响[J]. 土壤学报, 2022, 59(4): 1148-1159.]
(  0) 0) |
| [16] |
Kirkby C A, Richardson A E, Wade L J, et al. Carbon-nutrient stoichiometry to increase soil carbon sequestration[J]. Soil Biology & Biochemistry, 2013, 60: 77-86.
(  0) 0) |
| [17] |
Bei S K, Li X, Kuyper T W, et al. Nitrogen availability mediates the priming effect of soil organic matter by preferentially altering the straw carbon-assimilating microbial community[J]. Science of the Total Environment, 2022, 815: 152882.
(  0) 0) |
| [18] |
Zhan Y S, Liu W J, Bao Y Y, et al. Fertilization shapes a well-organized community of bacterial decomposers for accelerated paddy straw degradation[J]. Scientific Reports, 2018, 8(1): 7981.
(  0) 0) |
| [19] |
Chen X B, Xia Y H, Rui Y C, et al. Microbial carbon use efficiency, biomass turnover, and necromass accumulation in paddy soil depending on fertilization[J]. Agriculture, Ecosystems & Environment, 2020, 292: 106816.
(  0) 0) |
| [20] |
Anthony M A, Crowther T W, Maynard D S, et al. Distinct assembly processes and microbial communities constrain soil organic carbon formation[J]. One Earth, 2020, 2(4): 349-360.
(  0) 0) |
| [21] |
Lyu F Z, Yang Y L, Bao X L, et al. Effects of no-tillage and different stover mulching amounts on soil microbial community and microbial residue in the Mollisols of China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2023, 34(4): 903-912. [吕付泽, 杨雅丽, 鲍雪莲, 等. 免耕不同秸秆覆盖量对黑土微生物群落及其残留物的影响[J]. 应用生态学报, 2023, 34(4): 903-912.]
(  0) 0) |
| [22] |
Hood-Nowotny R, Umana N H N, Inselbacher E, et al. Alternative methods for measuring inorganic, organic, and total dissolved nitrogen in soil[J]. Soil Science Society of America Journal, 2010, 74(3): 1018-1027.
(  0) 0) |
| [23] |
Olsen S R. Estimation of available phosphorus in soils by extraction with sodium bicarbonate . Washington DC: US Department of Agriculture, 1954.
(  0) 0) |
| [24] |
Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917.
(  0) 0) |
| [25] |
Joergensen R G. Phospholipid fatty acids in soil—drawbacks and future prospects[J]. Biology and Fertility of Soils, 2022, 58(1): 1-6.
(  0) 0) |
| [26] |
Joergensen R G. Amino sugars as specific indices for fungal and bacterial residues in soil[J]. Biology and Fertility of Soils, 2018, 54(5): 559-568.
(  0) 0) |
| [27] |
Zhang X D, Amelung W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils[J]. Soil Biology & Biochemistry, 1996, 28(9): 1201-1206.
(  0) 0) |
| [28] |
Appuhn A, Joergensen R G. Microbial colonisation of roots as a function of plant species[J]. Soil Biology & Biochemistry, 2006, 38(5): 1040-1051.
(  0) 0) |
| [29] |
Engelking B, Flessa H, Joergensen R G. Shifts in amino sugar and ergosterol contents after addition of sucrose and cellulose to soil[J]. Soil Biology & Biochemistry, 2007, 39(8): 2111-2118.
(  0) 0) |
| [30] |
Zhao S C, Qiu S J, Xu X P, et al. Change in straw decomposition rate and soil microbial community composition after straw addition in different long-term fertilization soils[J]. Applied Soil Ecology, 2019, 138: 123-133.
(  0) 0) |
| [31] |
Xia Y H, Chen X B, Zheng S M, et al. Manure application accumulates more nitrogen in paddy soils than rice straw but less from fungal necromass[J]. Agriculture, Ecosystems & Environment, 2021, 319: 107575.
(  0) 0) |
| [32] |
Fu M, Hao M M, Hu H Y, et al. Responses of soil organic carbon and microbial community structure to different tillage patterns and straw returning for multiple years (In Chinese)[J]. Chinese Journal of Applied Ecology, 2019, 30(9): 3183-3194. [傅敏, 郝敏敏, 胡恒宇, 等. 土壤有机碳和微生物群落结构对多年不同耕作方式与秸秆还田的响应[J]. 应用生态学报, 2019, 30(9): 3183-3194.]
(  0) 0) |
| [33] |
Jin H Y, Yan Y Q, Zhang D Q, et al. Effects of different topdressing nitrogen rates on soil fungal community structure and ecological network in wheat field under crop residue retention (In Chinese)[J]. Environmental Science, 2023, 44(2): 1085-1094. [靳海洋, 闫雅倩, 张德奇, 等. 秸秆还田下不同追氮量对麦田土壤真菌群落结构和生态网络的影响[J]. 环境科学, 2023, 44(2): 1085-1094.]
(  0) 0) |
| [34] |
Li Z Q, Song M, Li D D, et al. Effect of long-term fertilization on decomposition of crop residues and their incorporation into microbial communities of 6-year stored soils[J]. Biology and Fertility of Soils, 2020, 56(1): 25-37.
(  0) 0) |
| [35] |
Sinsabaugh R L, Carreiro M M, Repert D A. Allocation of extracellular enzymatic activity in relation to litter composition, N deposition, and mass loss[J]. Biogeochemistry, 2002, 60(1): 1-24.
(  0) 0) |
| [36] |
Six J, Frey S D, Thiet R K, et al. Bacterial and fungal contributions to carbon sequestration in agroecosystems[J]. Soil Science Society of America Journal, 2006, 70(2): 555-569.
(  0) 0) |
| [37] |
Li P, Li Y C, Zheng X Q, et al. Rice straw decomposition affects diversity and dynamics of soil fungal community, but not bacteria[J]. Journal of Soils and Sediments, 2018, 18(1): 248-258.
(  0) 0) |
| [38] |
Sinsabaugh R L. Phenol oxidase, peroxidase and organic matter dynamics of soil[J]. Soil Biology & Biochemistry, 2010, 42(3): 391-404.
(  0) 0) |
| [39] |
Chen X B, Xia Y H, Hu Y J, et al. Effect of nitrogen fertilization on the fate of rice residue-C in paddy soil depending on depth: 13C amino sugar analysis[J]. Biology and Fertility of Soils, 2018, 54(4): 523-531.
(  0) 0) |
| [40] |
Wang X X, Zhang W, Zhou F, et al. Distinct regulation of microbial processes in the immobilization of labile carbon in different soils[J]. Soil Biology & Biochemistry, 2020, 142: 107723.
(  0) 0) |
| [41] |
de Vries F T, Hoffland E, van Eekeren N, et al. Fungal/bacterial ratios in grasslands with contrasting nitrogen management[J]. Soil Biology & Biochemistry, 2006, 38(8): 2092-2103.
(  0) 0) |
| [42] |
Bai Z, Liang C, Bodé S, et al. Phospholipid 13C stable isotopic probing during decomposition of wheat residues[J]. Applied Soil Ecology, 2016, 98: 65-74.
(  0) 0) |
| [43] |
Cotrufo M F, Wallenstein M D, Boot C M, et al. The Microbial Efficiency-Matrix Stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter?[J]. Global Change Biology, 2013, 19(4): 988-995.
(  0) 0) |
| [44] |
Li L D, Wilson C B, He H B, et al. Physical, biochemical, and microbial controls on amino sugar accumulation in soils under long-term cover cropping and no-tillage farming[J]. Soil Biology & Biochemistry, 2019, 135: 369-378.
(  0) 0) |
| [45] |
Liang C, Zhang X D, Balser T C. Net microbial amino sugar accumulation process in soil as influenced by different plant material inputs[J]. Biology and Fertility of Soils, 2007, 44(1): 1-7.
(  0) 0) |
| [46] |
Ma N, An T T, Zhang J M, et al. Effects of maize shoot and root residues added on microbial residue carbon and nitrogen in different fertility levels of black soil (In Chinese)[J]. Scientia Agricultura Sinica, 2023, 56(4): 686-696. [马南, 安婷婷, 张久明, 等. 添加玉米秸秆和根茬对不同肥力黑土微生物残体碳氮的影响[J]. 中国农业科学, 2023, 56(4): 686-696.]
(  0) 0) |
| [47] |
Zhang B, Chen Q, Ding X L, et al. Research progress on accumulation, turnover and stabilization of microbial residues in soil (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(6): 1479-1491. DOI:10.11766/trxb202012270705 [张彬, 陈奇, 丁雪丽, 等. 微生物残体在土壤中的积累转化过程与稳定机理研究进展[J]. 土壤学报, 2022, 59(6): 1479-1491.]
(  0) 0) |
| [48] |
Hartmann M, Six J. Soil structure and microbiome functions in agroecosystems[J]. Nature Reviews Earth & Environment, 2023, 4: 4-18.
(  0) 0) |
| [49] |
Liang C, Gutknecht J L M, Balser T C. Microbial lipid and amino sugar responses to long-term simulated global environmental changes in a California annual grassland[J]. Frontiers in Microbiology, 2015, 6: 385.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


