2. 中国科学院南京土壤研究所, 南京 211135;
3. 江西省农业科学院土壤肥料与资源环境研究所, 南昌 330200;
4. 中国科学院东北地理与农业生态研究所, 长春 130102
2. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China;
3. Soil and Fertilizer & Resources and Environment Institute, Jiangxi Academy of Agricultural Sciences, Nanchang 330200, China;
4. Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Changchun 130102, China
钾(K)作为植物生长必需元素之一,既是酶活化剂,又能参与植物光合与呼吸过程,提高植物抗逆性,促进植物生长[1]。我国土壤富含钾元素,但植物能直接吸收利用的钾素仅为全钾的1%~2%[2]。农业上往往依赖施用化学钾肥缓解这一矛盾,但长期过度施用化学肥料给人类健康和生态环境带来潜在风险[3]。解钾细菌肥的研究和应用为我国农业可持续发展提供了新思路。解钾细菌是一类植物根际促生菌[4],可以转化土壤中稳定的含钾矿物,提高土壤速效钾含量[5-6]。通过筛选高效解钾细菌,向土壤施用解钾细菌肥,有助于促进植物健康生长,减少化学钾肥使用,降低环境污染[5]。
在筛选土壤解钾细菌的众多研究中,传统固体培养法(如平板培养法)仅对微生物群落进行定性描述,缺少定量评估,尤其是在连续传代富集培养并分离过程中解钾细菌群落多样性的演变规律鲜有报道;同时,传统固体培养基对解钾细菌的富集分离,严重依赖对单个菌落的筛选与纯化,一些肉眼难以分辨的解钾细菌菌落可能会被遗漏,因此无法准确获得环境解钾细菌群落的全部信息[7]。而在利用液体培养法进行富集分离时,养分能够通过扩散来满足微生物自身生长需求[8],但与氧气的接触限制可能会不利于某些好氧微生物生长。而固体平板培养,微生物生长更易获取氧气,且固体培养基本身为微生物生长提供了附着界面,能够影响微生物的一些生理生化过程,例如群体感应机制、生物膜的形成[9],是液体培养基所不具备的,这也可能成为微生物选择性富集的重要原因。
其他富集培养条件(培养基成分、传代次数等)的不同,也可能导致特定解钾细菌的偏好性生长,进而遗漏一些在环境中发挥重要功能的微生物,无法全面准确评估土壤解钾细菌群落组成全貌。少量研究表明,在连续传代培养过程中,液体和固体培养基中优势菌和稀有菌的比例均保持相对稳定,随着传代次数增加,丰度较低的稀有菌由于竞争力不足,往往会被生长迅速的优势菌所淘汰[7]。此外,与土壤本底微生物多样性相比,在连续传代富集过程中,不同成分培养基可能选择特定的微生物类群,尤其是第一代次富集的微生物类群,但在传代过程中这些被富集的微生物是随机出现或是稳定连续生长等尚不明确。
高通量测序技术为研究土壤微生物群落变化提供了强大的技术支持,该技术一次性能读取几十万乃至上百万条DNA分子序列,为揭示微生物群落组成提供便利[10]。例如,利用高通量测序技术对特殊培养基富集的固氮菌进行筛选发现,传统分离方法会遗漏高达95.2%的固氮菌属,这意味着在连续传代过程中,大量尚未获得分离的固氮菌可能会被选择性遗漏[7,11]。目前各国学者已从土壤中分离出众多纯培养解钾细菌菌株[12-15],可据此建立已知解钾细菌数据库,为识别和评估土壤解钾细菌多样性提供有力支撑。
群落构建过程决定微生物群落多样性和组成,与群落功能密切相关,一直是微生物生态学研究的热点和难点之一。在不同生态系统[16]、不同生境条件[17]以及不同研究尺度[18]下,微生物群落构建过程中确定过程和随机过程的相对重要性有所不同。而传代富集培养技术可为微生物生长提供一个连续稳定的培养环境,体系变量明确,利用该体系进行微域尺度下的群落构建理论研究,可以进一步验证宏观生态系统中得出的结论,为理论的普适性推广提供更多线索。
综上,本研究利用解钾细菌富集培养基(KM)对解钾细菌进行专性富集培养,并以细菌富集培养基(BM)富集土壤可培养细菌作为参照,对比分析以凸显解钾细菌独特的生理特性和富集效果。同时,采用液体与固体两种培养基,进行连续三次传代培养,结合高通量测序分析技术,进一步与已知解钾细菌数据库进行比较,以期精确定量土壤可培养解钾细菌的多样性、比例及富集规律,再利用零模型反演连续传代富集培养过程中细菌群落构建过程,揭示不同富集策略(培养基成分、培养基形态及传代次数)对土壤可培养解钾细菌群落特征的影响。
1 材料与方法 1.1 供试土壤描述土壤于2019年11月采自江西新余市渝水区罗坊镇(27°47′N,115°7′E),为冲积性水稻土。采用五点交叉取样法,用土钻采集耕作层土壤,清除石块和植物残体,过2 mm筛,混匀组成代表性土样约1 kg,4 ℃保存。土壤pH 5.89,有机碳含量20.78 g·kg–1,碱解氮含量173.95 mg·kg–1,速效钾含量108.67 mg·kg–1。
1.2 土壤细菌和解钾细菌的富集策略 1.2.1 培养基类型分别采用以下四种传统培养基进行细菌富集。固体细菌富集培养基(S-BM)主要成分包括:牛肉膏3.0 g、蛋白胨10.0 g、NaCl 5.0 g、琼脂18.0 g,加水定容至1 000 mL,加适量NaOH溶液调节pH至7.2~7.4。液体细菌富集培养基(L-BM)除不加入琼脂外,其余配方与上述固体培养基相同。
固体解钾细菌富集培养基(S-KM)主要成分[19]:蔗糖10.0 g、磷酸氢二钠1.0 g、硫酸铵0.5 g、硫酸镁1.0 g、酵母膏0.2 g、硫酸亚铁0.03 g、碳酸钙2.5 g、钾长石粉10.0 g、琼脂18.0 g,加蒸馏水定容至1 000 mL,pH调节到7.0~7.5。液体解钾细菌富集培养基(L-KM)主要成分:蔗糖10.0 g、七水硫酸镁0.5 g、硫酸铵0.2 g、氯化钠0.1 g、碳酸钙0.1 g、钾长石粉5.0 g,加水定容至1 000 mL,pH调节至7.0~7.5。最后将所有配置好的培养基置于高压灭菌锅中,115 ℃灭菌30 min。待固体培养基稍冷却后,在超净台进行无菌平板制备。待液体培养基稍冷却后,在超净台进行分装。
1.2.2 土壤细菌和解钾细菌连续传代富集本研究涉及的可培养细菌,特指在培养基中生长的细菌菌落或菌体集合,可被认为是“潜在”可分离的纯培养菌株,也是可利用人工配方营养的细菌富集物。其中,BM富集的“潜在”可培养细菌,可能包含部分“潜在”可培养解钾细菌,而KM更有针对性地富集大部分“潜在”可培养解钾细菌。具体操作如下:称取土壤样品1.0 g,加入100 mL无菌水,于三角瓶中溶解,加入5.0 g玻璃珠,在200 r·min–1和30 ℃下震荡0.5 h,制备土壤悬浮液作为接种液。
利用固体(S)培养基富集培养步骤:吸取100 μL土壤悬浮液,均匀涂布在培养基表面,然后在30 ℃培养箱中倒置培养5 d,再将平板取出。在超净台里,采用10 mL无菌水分多次洗脱培养基表面菌落细胞至15 mL无菌离心管(借助酒精灼过的涂布棒刮除培养基表面菌体),制成了第一代混合菌液(1st),保存于–20 ℃。然后,再吸取上述100 μL菌液,再次使用平板涂布法接种传代培养,培育5 d,将第二代菌落细胞冲洗脱到15 mL无菌试管中,制成了第二代混合菌液(2nd)。利用上述方法,制成第三代混合菌液(3rd)。每代设置四次生物学重复。
利用液体(L)培养基富集培养步骤:吸取100 μL土壤悬浮液接种至100 mL无菌液体培养基,将培养瓶放入30 ℃培养箱中,震荡培养7 d,将菌液以4 000×g离心10 min,弃上清液,加入10 mL无菌水振荡混匀,浓缩为10 mL第一代混合菌液。稍后,吸取上述100 μL菌液,接种至新的100 mL液体培养基中,传代培养7 d,采用上述相同方法浓缩为10 mL第二代混合菌液,第三代混合菌液制备方法同上。收集的混合菌液均保存于–20 ℃。每代设置三次生物学重复。
1.3 细菌群落特征分析 1.3.1 土壤本底细菌DNA提取采用FastDNA® Spin Kit for Soil(MP Bio)试剂盒提取土壤DNA,具体操作如下:称取0.5 g土壤于2 mL离心管中,再加入SPB和MT缓冲液后,利用Fast Prep核酸提取仪以6.0 m·s–1的平均速度振荡45 s,14 000×g离心15 min。将离心后的上清液转移至新2 mL离心管中,以PPS沉淀蛋白溶液,Binding Matrix结合DNA,SEWS-M洗涤过滤后,将DNA溶解于50 mL DES缓冲液。设置三次重复。
1.3.2 可培养细菌富集物DNA提取采用E.Z.N.A.® Bacterial DNA Kit(Omega)试剂盒进行提取可培养细菌富集物DNA,具体操作如下:将1 mL富集菌液4 000×g离心10 min,去除上清,加入100 μL TE缓冲液重悬,分别利用溶菌酶、蛋白酶K溶液和核糖核酸酶A裂解细胞,去除蛋白质和RNA,100% DNA洗涤缓冲液洗涤过滤后,加入50 μL洗脱液,过滤收集DNA,保存于–20 ℃。
1.3.3 IIIumina NovaSeq高通量测序及物种注释由上海派森诺生物科技股份有限公司扩增土壤和富集菌液中细菌16S rRNA基因(引物515F/907R),在Illumina NovaSeq测序系统上对其双端测序。根据barcode信息划分样本,通过QIIME2流程进行质控、去燥、拼接、去嵌合体:使用dada2 denoise-single插件进行质控和特征序列ASV提取(--p-trim-left0--p-trunc-len350),获取ASVs丰度表;再将ASVs用classify-consensus-blast插件按照默认参数,以Greengenes数据库(Release 13.8,http://greengenes.secondgenome.com)为参考对物种进行注释,分析样本所获序列在各分类水平的物种分类信息(包括分类单元数及其对应的相对丰度)。高通量测序概况如表 1所示。测序原始数据上传至NCBI数据库,序列号PRJNA1108644。
|
|
表 1 土壤细菌的高通量测序结果 Table 1 High throughput sequencing results of soil bacteria |
细菌群落α多样性采用香农指数和辛普森指数表征[20]。通过基于Bray-Curtis距离算法的主坐标分析(Principal co-ordinates analysis,PCoA)确定细菌群落β多样性及结构差异性。
细菌群落构建过程受确定性过程和随机性过程影响。利用零模型反演细菌群落构建过程,用βNTI(最近种间亲缘关系指数)来评估不同时空尺度下微生物群落聚集机制[21]。
1.5 可培养细菌比例计算可培养细菌比例=富集物中细菌分类单元数量/土壤中所有细菌分类单元总数
其中,土壤中所有细菌分类单元总数通过提取土壤DNA,高通量测序细菌16S rRNA基因,并在门、纲、目、科、属水平进行注释,获得土壤中所有细菌的系统发育分类信息;富集物中细菌分类单元数量根据前述分析方法,分别获得液体与固体培养基中第一代、第二代和第三代所有富集物的细菌或解钾细菌的分类信息。
1.6 已知解钾细菌数据库的构建针对以往文献[12-15]报道的已分离可培养解钾微生物进行检索并整理,共汇总到104属解钾细菌(真菌除外),见表 2,作为本研究的参考数据库。
|
|
表 2 本研究构建的已知解钾细菌数据库 Table 2 The constructed database of "known potassium-solubilizing bacteria" from previous literature |
运用SPSS 24.0进行数据统计分析,使用Origin 2024作图。Venn图通过在线工具(https://bioinformatics.psb.ugent.be/webtools/)生成。
2 结果 2.1 可培养细菌群落多样性与群落构建机制基于ASV水平的分析结果显示:不同富集策略下,土壤本底细菌α多样性显著高于KM,而KM富集细菌α多样性显著高于BM(P < 0.05)。培养基BM富集的细菌香农指数在0.31~1.82之间,KM富集的解钾细菌香农指数在0.91~3.15之间,而土壤本底香农指数高达7.70。在连续三次传代培养过程中,固体培养基S-BM和S-KM富集的细菌香农指数均呈下降趋势,S-BM-1st和S-KM-1st中细菌香农指数最高,分别为1.61和3.20。液体培养基L-BM富集的细菌香农指数在代际间无显著差异,而L-KM富集的解钾细菌香农指数为先下降后升高,但L-KM-1st与L-KM-3rd无显著差异(图 1a)。
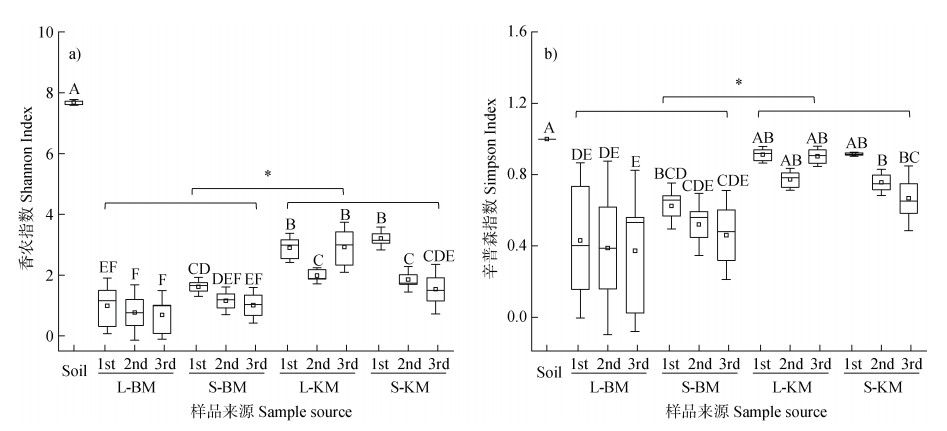
|
注:Soil代表土壤本底;BM和KM分别代表细菌富集培养基和解钾细菌富集培养基;L和S分别代表固体和液体培养基;1st、2nd和3rd代表传代培养的第一代、第二代和第三代。图中大写字母代表不同培养基与代次间差异显著性,*代表细菌与解钾细菌间差异显著性(P < 0.05)。下同。 Note: Soil represents the soil background; BM and KM represent enrichment media for bacteria and Potassium Solubilizers respectively; L and S represent for liquid and solid media respectively; 1st, 2nd and 3rd represent for the first, second, and third generations during the serial passages. In the figure, the uppercase letters represent the significance of differences between different media and passages, and the asterisks (*) represent the significance of differences between bacteria and potassium-solubilizing bacteria (P < 0.05). The same below. 图 1 基于ASV水平下土壤本底和培养富集物中细菌的香农指数(a)和辛普森指数(b) Fig. 1 The Shannon index (a) and Simpson index (b) of bacteria in the soil background and culture enrichment samples, based on the ASV level |
与香农指数变化规律相似,土壤本底辛普森指数显著高于KM,而KM高于BM(P < 0.05)。培养基BM富集的细菌辛普森指数在0.40~0.63之间,而KM富集的解钾细菌辛普森指数在0.60~0.92之间。在连续三次传代培养过程中,无论液体还是固体培养基,代际间辛普森指数无显著性差异(图 1b)。
采用PCoA主坐标分析评估土壤可培养细菌群落β多样性。无论液体还是固体培养基,BM与KM富集物样品均与土壤本底相距较远,即与土壤本底细菌群落结构相比,富集细菌群落呈现明显差异;同时,BM与KM之间也表现出较大差异,在L-BM和S-BM间差异不显著,而在L-KM和S-KM之间差异较大(图 2a)。
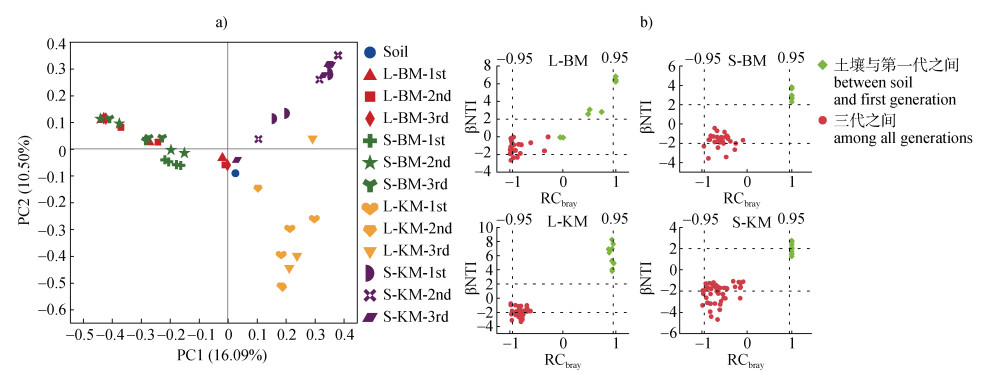
|
注:图 2b中,土壤与第一代之间代表土壤本底与第一次传代培养的群落构建差异,三代之间代表第一次传代、第二次传代、第三次传代培养之间的群落构建差异。 Note: In Fig. 2b, between the soil and the first generation represent the differences in community construction between the soil background and the first subculture, while among the three generations represent the differences in community construction between the first, second and third passages of the subculture. 图 2 不同富集策略下细菌群落结构(a)及群落构建过程(b)差异 Fig. 2 Differences of bacterial community structure (a) and assembly processes (b) under different enrichment strategies |
培养基L-BM富集的细菌,土壤与第一代之间βNTI多数大于2,确定性过程为主,三次传代之间βNTI主要集中在–2~2之间,随机性过程为主,其中基于Bray-Curtis的Raup-Crick(RCbray)主要集中在–0.95处,即随机性过程主要为均质扩散和遗传漂变;培养基S-BM富集的细菌,土壤与第一代之间βNTI全部大于2,确定性过程为主,三次传代之间βNTI主要集中在–2~2之间,随机性过程为主,其中RCbray主要集中在–0.95~0.95之间,即随机性过程主要为遗传漂变。培养基L-KM富集的解钾细菌,土壤与第一代之间βNTI全部大于2,确定性过程为主,三次传代之间βNTI主要集中在–2分界线处,半数以上位于–2~2之间,大部分随机性过程为主,其中RCbray主要集中在–0.95~0.95之间,即随机性过程主要为遗传漂变;培养基S-KM富集的解钾细菌,土壤与第一代之间βNTI一半大于2,一半在–2~2之间,确定性过程和随机性过程各参半,三次传代之间βNTI大部分在–2~2之间,随机性过程为主,RCbray主要集中在–0.95~0.95之间,即随机性过程主要为遗传漂变(图 2b)。
2.2 各分类水平上可培养解钾细菌比例在各分类水平,供试土壤本底检测到的细菌分类单元数均高于可培养细菌(图 3a)。不同代次来源L-KM和S-KM共检测到17门、38纲、91目、145科和267属细菌(图 3c),在门、纲、目、科和属水平分别占土壤本底细菌的29.31%、23.75%、24.40%、25.22%和27.27%(图 3d),其中L-KM共检测到17门、38纲、85目、132科和209属(图 3c),分别占土壤本底细菌的29.31%、23.75%、22.79%、22.96%和21.35%(图 3d);S-KM富集的不同代次来源的解钾细菌共检测到6门、8纲、27目、45科和106属(图 3c),分别占土壤本底细菌的10.34%、5.00%、7.24%、7.83%和10.83%(图 3d)。
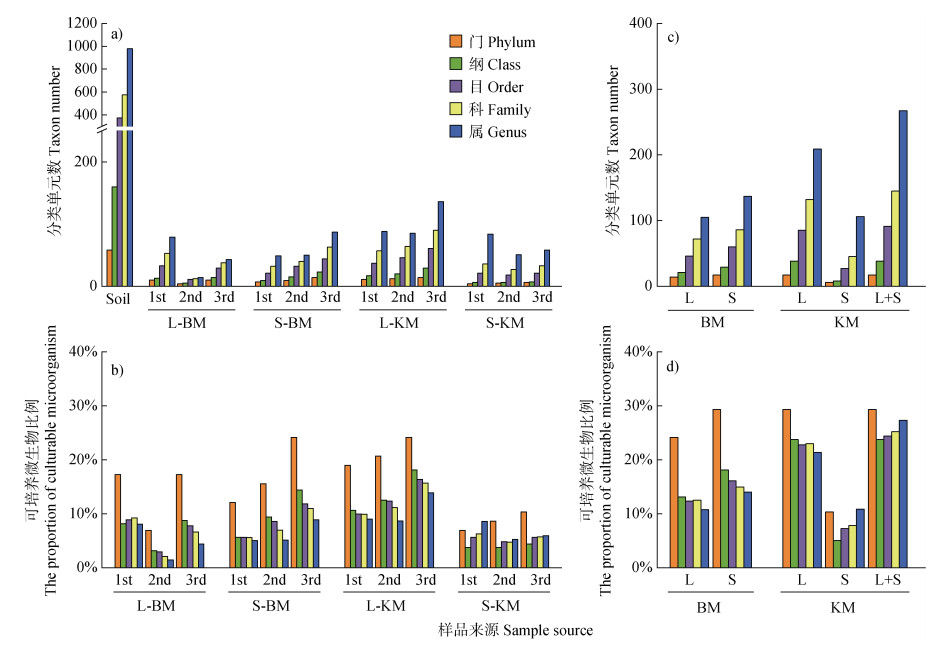
|
注:分组样品的细菌分类单元数,由组内样品检测到的共有和特有细菌分类单元数求和得到。 Note: The bacterial taxon number of group samples was obtained by summing the number of shared and specific bacterial taxa detected in samples in the group. 图 3 在各分类水平上,土壤本底和富集物中细菌分类单元数(a,c)和可培养比例(b,d) Fig. 3 At various taxonomic levels, the number of bacterial taxonomic units (a, c) and the cultivable proportion (b, d) in soil background and enrichment samples |
在相同分类水平下,连续三次传代培养过程中,L-BM富集的细菌种类(即在门、纲、目、科、属水平)均呈现先下降再升高的趋势,S-BM为逐渐上升趋势;培养基L-KM与S-KM富集的解钾细菌种类均呈现上升趋势,但L-KM富集的解钾细菌种类明显高于S-KM(图 3b)。培养基BM和KM富集的细菌均在门水平上可培养比例较高,在液体培养基中分别为24.14%和29.31%,在固体培养基中分别为29.31%和10.34%,总体而言,四种培养基富集可培养细菌种类高低排序大致为:L-KM > S-BM > L-BM > S-KM(图 3d)。
2.3 可培养细菌门、属共现规律在门水平,S-KM富集的6个细菌门均能在L-KM中找到,L-KM共富集17个细菌门,其中14门在BM中也有所富集(图 4a)。在属水平,L-BM和S-BM分别富集了105和137个属,其中有54个相同属;培养基L-KM和S-KM分别富集了209和106个属,其中只有48个属在两种培养基中同时富集。L-KM中富集的76个属在BM中也有所富集,S-KM中的49个属同样也出现在BM中(图 4a)。
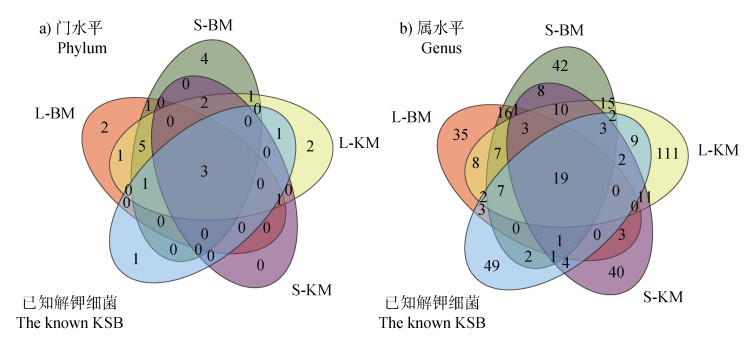
|
图 4 在门(a)与属(b)分类水平上,可培养细菌、解钾细菌、已知解钾细菌数据库之间多样性的比较 Fig. 4 Comparison of the diversity of cultivable bacteria, potassium-solubilizing bacteria, and known potassium-solubilizing bacteria databases at the genus taxonomic level in the phylum (a) and genus (b) classification level |
以已知解钾细菌数据库为参考,实验富集了已知解钾细菌7个门中的6个、104属中的55个,占比52.38%,仍有49个属未富集。培养基BM富集的细菌中,检测到有40个已知解钾细菌属;而KM富集的解钾细菌中,检测到有50个属和数据库中相同,但还有217个未知属,占KM富集的解钾细菌的81%以上,L-KM富集的209个属中,已知解钾细菌有44个属(21.05%),S-KM富集的106个属中,已知解钾细菌有30个属(28.30%)(图 4b)。
2.4 可培养细菌群落组成比较在门水平,土壤本底优势细菌从高到低主要为:Proteobacteria(27.45%) > Acidobacteriota(15.38%) > Chloroflexi(11.9%) > Actinobacteriota(6.40%) > Bacteroidota(6.14%) > Planctomycetota(5.68%) > Nitrospirota(4.98%),以上七大类群总共占土壤本底总细菌群落的77.93%(图 5a)。在BM连续三次传代培养过程中,富集物优势菌门是Actinobacteriota、Firmicutes和Proteobacteria,其中L-BM富集的第一代优势菌门为Firmicutes和Proteobacteria,二者之和达99.45%,第二、第三代优势门均为Firmicutes,所占比例分别为99.92%和99.66%;培养基S-BM第一代富集的优势菌门为Actinobacteriota和Firmicutes,二者之和达99.90%,第二和第三代优势菌门均为Firmicutes,所占比例分别为99.65%、99.20%。在KM连续三次传代培养过程中,富集物中优势解钾细菌门也是Actinobacteriota、Firmicutes和Proteobacteria,其中L-KM富集的第一代优势解钾细菌门为Firmicutes和Proteobacteria,二者之和达98.88%,第二、第三代优势菌门均为Proteobacteria,占比分别为96.70%和91.34%;培养基S-KM第一代富集的优势解钾细菌门为Actinobacteriota和Proteobacteria,二者之和达98.43%,第二、第三代优势菌门为Proteobacteria,占比分别为98.84%和97.63%(图 5a)。
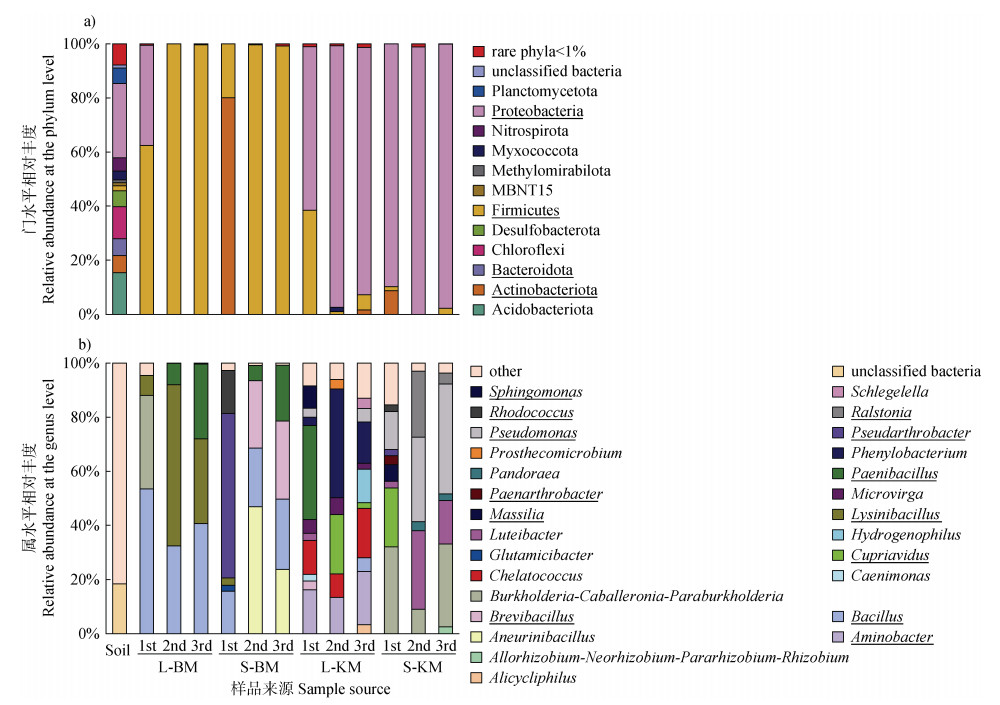
|
注:下划线表示该门或属为已知解钾细菌门或属。 Note: Underline indicates that the phylum or genus is a known solution for KSB. 图 5 土壤本底和培养基富集的细菌在门水平(a)和属水平(b)的相对丰度 Fig. 5 Relative abundance of bacteria enriched in soil background and medium at the phylum (a) and genus level (b) |
图 5b为富集的优势细菌属(相对丰度 > 2%)。在BM富集的细菌中,L-BM主要优势属为Bacillus、Burkholderia、Lysinibacillus和Paenibacillus,其中在三次传代过程中,优势属Burkholderia被Lysinibacillus和Paenibacillus取代;S-BM优势属同样包含Bacillus和Paenibacillus,除此外还有Aneurinibacillus、Brevibacillus、Pseudarthrobacter和Rhodococcus等,三次传代过程中,Pseudarthrobacter和Rhodococcus相对丰度下降,Aneurinibacillus和Paenibacillus相对丰度上升。对KM富集的解钾细菌而言,L-KM中优势属较多,主要为Aminobacter、Chelatococcus、Cupriavidus、Hydrogenophilus、Microvirga、Paenibacillus和Phenylobacterium等;培养基S-KM富集的优势属与L-KM差异很大,仅有Cupriavidus为共有属,其他优势属主要是Burkholderia、Luteibacter、Massilia、Pseudomonas和Ralstonia等。
2.5 不同培养基中的优势菌属与丰度在门水平下,Actinobacteriota仅在S-BM第一代中大量富集,在其他培养基中富集较少,且随传代丰度锐减(图 6a);Firmicutes在L-BM、S-BM、L-KM中均有一定富集,并在L-BM与S-BM中随传代丰度明显增加,在L-KM中却随传代丰度降低,最后几乎接近于0(图 6b);Proteobacteria富集情况与Firmicutes相反,其在L-KM与S-KM培养基中大量富集,且丰度随传代增加,L-BM也能富集一些Proteobacteria,但随传代丰度降低,而在S-BM中并未有Proteobacteria富集(图 6c)。
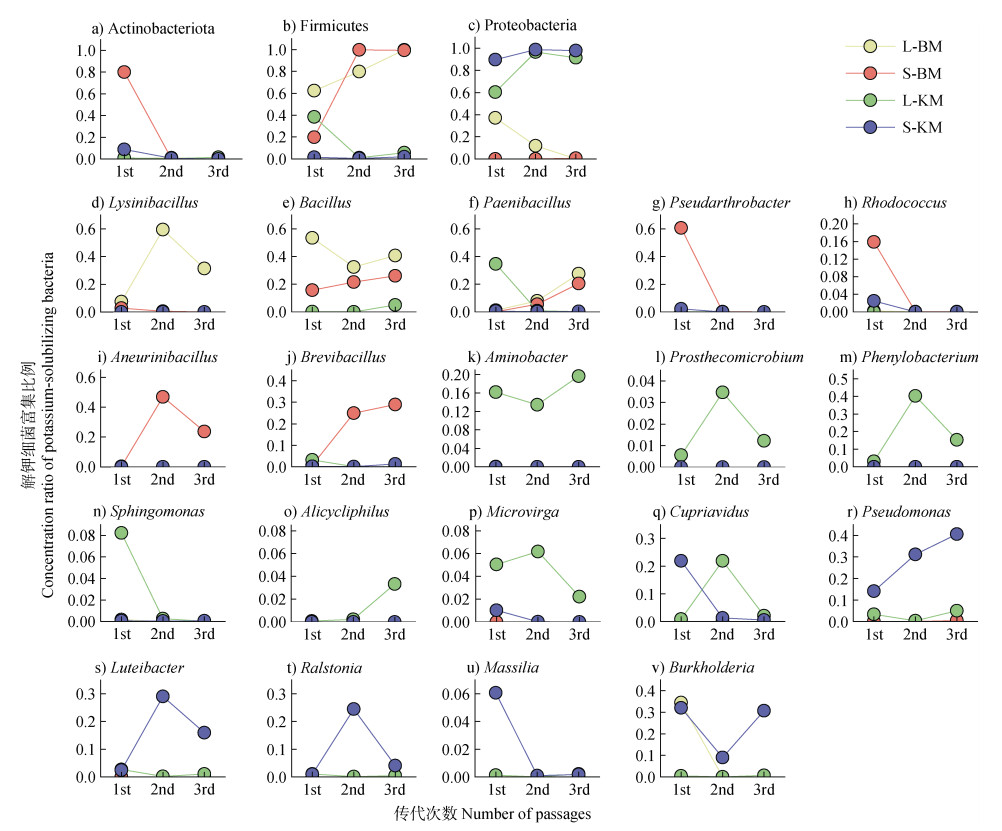
|
注:a-c图为在门水平不同细菌相对丰度随传代次数的变化;d-v图为在属水平不同细菌的相对丰度随传代次数的变化。 Note: Fig. a-c shows the relative abundance of different bacteria at the phylum level; Fig. d-v shows the relative abundance of different bacteria with the number of passages at the genus level. 图 6 不同培养基类型和传代次数可培养细菌相对丰度的变化 Fig. 6 Changes in the relative abundance of culturable bacteria for different media types and passages |
在属水平下,不同富集策略各属细菌的相对丰度变化规律变化趋势差异较大。Bacillus、Burkholderia、Lysinibacillus和Paenibacillus在L-BM中富集比例明显高于其他培养基,其中Bacillus和Lysinibacillus在传代三次情况下,富集比例依旧较高,相对丰度达到40%以上(图 6d-f,图 6v);在S-BM中,主要富集了Bacillus、Paenibacillus、Pseudarthrobacter、Rhodococcus、Aneurinibacillus和Brevibacillus,其中Bacillus、Paenibacillus和Brevibacillus随传代丰度逐渐增加,Pseudarthrobacter和Rhodococcus随传代丰度急剧下降,Aneurinibacillus随传代丰度表现为先升高后降低(图 6e-j)。培养基L-KM中富集了Aminobacter、Prosthecomicrobium、Phenylobacterium、Sphingomonas、Alicycliphilus、Microvirga和Cupriavidus,还有BM富集的细菌中出现的Paenibacillus也有所富集,其中除了Aminobacter、Cupriavidus、Paenibacillus和Phenylobacterium在培养基中出现过高丰度外,其他属很少富集,相对丰度不到8%(图 6f,图 6k-q)。Cupriavidus和Burkholderia在S-KM中也有富集,S-KM还富集了Pseudomonas、Luteibacter、Ralstonia和Massilia,其中Cupriavidus和Massilia随着传代丰度下降,Luteibacter和Ralstonia表现为先增加后下降,Burkholderia表现为先下降后增加,只有Pseudomonas随传代丰度不断增加(图 6q-v)。
3 讨论在连续传代富集中,确定性过程主导了细菌从土壤悬液至培养基的第一代次细菌群落构建过程,而以遗传漂变为主的随机性过程则控制了代际间的细菌群落构建。原因在于:在进行第一代次培养时,微生物从土壤转移至培养基,由于用以模拟微生物生长环境的培养基的生长空间、营养物质、理化性质等与土壤原位环境差异较大[22],环境选择压力在群落构建中占据主导,导致培养富集物中微生物多样性显著降低。而随着连续传代的进行,培养基保持不变,外部环境条件趋于稳定,此时,微生物之间的作用,例如:微生物群落区域扩张先后、微生物之间交互喂养和群体感应、微生物的代谢物质等[9],这些高随机性过程,由于目前无法阐明其中具体的机理,进而将这些随机过程归纳为生态漂变。当外部环境条件趋于稳定时,生态漂变对群落构建的作用增大,导致随机性主导的不同代际间富集出了明显差异的解钾细菌类群[23],例如,L-KM-1st的优势属为Aminobacter、Chelatococcus和Paenibacillus,而L-KM-2nd的优势属为Aminobacter、Cupriavidus和Phenylobacterium。
本研究中,环境选择压力主要表现为不同培养基类型,在BM富集策略下,碳源和能源较为充足,细菌对碳源和能源的竞争和利用易形成绝对优势,因此,快生长菌“数强独大”,慢生长菌被“竞争排除”,致使群落多样性大大降低;而KM培养基提供的是一个“寡营养”环境,其中细菌的生长不仅受到钾源利用的限制,同时可利用的碳源和能源也极度缺乏,细菌更倾向于通过“抱团合作”来缓解资源限制、维持生命过程,致使KM富集的解钾细菌多样性和均匀度高于BM,进一步验证了最新提出的“饥饿游戏(hunger games)”假说[24]。此外,与液体培养中微生物悬浮生长相比,固体平板培养为微生物生物膜的形成提供了界面附着环境,因不同培养基类型而形成独特微生物空间组织模式,通过微生物代谢产物和养分不均匀分布共同塑造培养基的异质性分布特征,影响微生物相互作用,从而驱动了不同微生物群落的构建[9]。然而,由于微生物群落的复杂性以及研究方法的局限性,微生物空间组织模式的形成和协同机制研究目前仍然处于起步阶段。
连续三次传代过程中,KM富集的解钾细菌,主要来自Actinobacteriota、Firmicutes和Proteobacteria三门,这与Divjot等[15]的研究相同,说明本实验有效富集了土壤优势细菌与解钾细菌,为解钾细菌多样性评估提供了可靠的数据支持。但不同富集策略下可培养的细菌菌属组成差异明显,连续传代富集未导致群落结构同质化和单一化。解钾细菌的解钾作用是通过释放有机酸或无机酸,一方面降低土壤的pH,释放可交换性钾,提高土壤速效钾含量[5,25];另一方面,有机酸具有羟基和羧基官能团,可以与矿物中的金属离子产生络合反应,破坏矿物结构,促进钾释放[26]。不同类群解钾细菌分泌物成分与活性差异自然较大,行使解钾功能所需外部条件也大不相同,受培养基中氧气含量、营养物质等影响[7],不同培养基中富集出的解钾细菌也有明显差异,例如,在属水平下,L-KM中有较高丰度的Aminobacter、Chelatococcus和Phenylobacterium,而S-KM中Burkholderia、Luteibacter、Pseudomonas和Ralstonia丰度较高,这些因素也可用于解释BM中细菌群落的差异。并且有研究发现微生物面临不利环境条件时会进入休眠状态,休眠后的复苏受诸多因素调控,这些因素的相互作用导致微生物复苏的时机和程度难以预测,休眠后的复苏也就成了一个随机过程,因而传代过程中发生了优势微生物群的更替、新微生物群的出现[27],如L-KM-1st中优势属Paenibacillus在L-KM-2nd中极少富集,L-KM-2nd中出现了新的属Cupriavidus。
在KM连续三次传代培养过程中,富集更多的优势解钾细菌属。在L-KM中,Aminobacter、Paenibacillus和Phenylobacterium相对丰度较高,其中,Aminobacter是已报道的一类解钾细菌[28],Artuso等[29]研究表明,Aminobacter菌株均具有广泛的同化和分解代谢能力,而在KM中Aminobacter大量富集,恰好也印证了这一点。赵诗佳等[30]研究发现,Paenibacillus同时具有解磷、解钾能力,但解钾能力处于中等水平,因而Paenibacillus在培养基中第一代丰度较高,但在第二代、第三代的相对丰度却不到1%,可能由于Paenibacillus在传代过程与其他微细菌的竞争中并不占优。Phenylobacterium也是KM培养基中丰度较高的细菌属,但在过去报道中Phenylobacterium多被定义为固氮菌[31],而本实验Phenylobacterium在KM中大量富集,表明其具有潜在解钾功能,作为一类尚未被证实的解钾细菌仍有待进一步纯化研究。培养基S-KM富集的优势解钾细菌属也较多,如:Burkholderia、Luteibacter、Ralstonia和Pseudomonas,除了Luteibacter外,其他三个属均已被证实具有解钾能力[12,32-33],其中Pseudomonas专性好氧,所以在S-KM中大量富集,在L-KM富集较少[7]。然而Luteibacter的报道很少,Feng等[34]研究发现Luteibacter能够有效降解乙草胺,Guglielmetti等[35]将其归为一类植物根系促生细菌,而Luteibacter在KM中大量富集则说明它也可能是一种未知解钾细菌。Cupriavidus具有解钾和固氮能力[13,36],其在L-KM与S-KM中为唯一富集的共有解钾细菌属,表明Cupriavidus能同时适应液体和固体富集策略。笔者研究发现仅有Paenibacillus这一属在BM和KM培养基中均大量富集,印证了Paenibacillus具有较强生存能力,能够在不同培养条件下依然保持显著生长优势[7-8,11],可能更适合作为解钾细菌肥的候选菌种。
尽管本研究将所有在解钾培养基(KM)中富集的细菌定义为可培养“潜在”解钾细菌,但混菌培养时细菌间的相互作用不可避免,可培养“解钾细菌”的生长策略可能存在差异。在KM富集的细菌中,有的解钾细菌能独立生长并分解钾长石获取钾源,例如,胥婷等[37]筛选出的Pseudomonas能分解培养基中的钾长石;有的解钾细菌可能不能单独解钾,但能通过其他方式获得钾源,如Ge等[38]报道的一对交叉互养的土壤细菌,它们单独生长极差,但通过互利共生,提高了双方竞争力,在培养基中也许存在相互协作的两种或多种微生物,通过特殊的共生关系,让它们能够利用钾长石获取钾源;当然微生物不一定需要分解钾长石才能存活,有研究发现某些微生物能作为作弊者享受其他合作者的成果[39],不直接分解钾长石,但窃取利用其他微生物分解产生的钾而繁殖。对比已报道的104个解钾细菌属[12-15],KM富集到的267个属中仅有50个已知属,217个属于未知解钾细菌属,这些未知解钾细菌是否具有直接解钾活性及其生长策略,需要进一步分离验证。
4 结论不同富集策略影响土壤可培养解钾细菌的群落特征。培养基类型是可培养细菌群落产生差异的主要原因,但代际间的细菌群落结构也未趋于同质化和单一化。培养基KM富集的解钾细菌主要优势门为Firmicutes和Proteobacteria。与已知解钾细菌数据库比对,KM中富集到267个潜在解钾细菌属中仅有50个已知属,表明至少80.28%的未知解钾细菌有待被分离纯化并验证,例如,KM成功富集了优势菌属Phenylobacterium和Luteibacter,但二者尚未被报道具有解钾功能,有望成为后续解钾细菌筛选的新菌属。此外,Paenibacillus在多种培养策略下均展现出良好生长优势,表明其具有较强的适应性和生存能力,因此该属可能作为解钾细菌肥的候选菌属,具有潜在的应用价值。
| [1] |
Chen L, Li K K, Mi G H, et al. Screening and identification of potassium-solubilizing bacteria and their promoting effects on maize in black soil of Northeast China (In Chinese)[J]. Microbiology China, 2021, 48(5): 1560-1570. [陈腊, 李可可, 米国华, 等. 解钾促生菌的筛选鉴定及对东北黑土区玉米的促生效应[J]. 微生物学通报, 2021, 48(5): 1560-1570.]
(  0) 0) |
| [2] |
Li C J, Li T, Li L L, et al. Effects of potassium-solubilizing bacteria loaded biochar on soil enzyme activity and microbial community structure (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(5): 1531-1542. DOI:10.11766/trxb202206030294 [李昌骏, 李婷, 李露露, 等. 生物质炭负载解钾菌对土壤酶活性与微生物群落结构的影响[J]. 土壤学报, 2023, 60(5): 1531-1542.]
(  0) 0) |
| [3] |
Li D P, Wu Z J. Impact of chemical fertilizers application on soil ecological environment (In Chinese)[J]. Chinese Journal of Applied Ecology, 2008, 19(5): 1158-1165. [李东坡, 武志杰. 化学肥料的土壤生态环境效应[J]. 应用生态学报, 2008, 19(5): 1158-1165.]
(  0) 0) |
| [4] |
Zhou Y F, Bai Y S, Yue T, et al. Research progress on the growth-promoting characteristics of plant growth-promoting rhizobacteria (In Chinese)[J]. Microbiology China, 2023, 50(2): 644-666. [周益帆, 白寅霜, 岳童, 等. 植物根际促生菌促生特性研究进展[J]. 微生物学通报, 2023, 50(2): 644-666.]
(  0) 0) |
| [5] |
Han M, Zhu X Y, Chen G W, et al. Advances on potassium-solubilizing bacteria and their microscopic potassium solubilizing mechanisms (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(2): 334-348. DOI:10.11766/trxb202011270525 [韩苗, 朱晓艳, 陈国炜, 等. 解钾菌及其释钾微观机制的研究进展[J]. 土壤学报, 2022, 59(2): 334-348.]
(  0) 0) |
| [6] |
Wang Y J, Yan X Y, Su M, et al. Isolation of potassium solubilizing bacteria in soil and preparation of liquid bacteria fertilizer from food wastewater[J]. Biochemical Engineering Journal, 2022, 181: 108378. DOI:10.1016/j.bej.2022.108378
(  0) 0) |
| [7] |
Wen C L, Cao W W, Tang X L, et al. High-throughput sequencing technology based research on the changes of culturable bacteria communities in soil during serial enrichment (In Chinese)[J]. Journal of Ecology and Rural Environment, 2023, 39(1): 123-135. [文昌丽, 曹伟伟, 唐雪莲, 等. 基于高通量测序的连续传代富集土壤可培养菌菌群变化规律研究[J]. 生态与农村环境学报, 2023, 39(1): 123-135.]
(  0) 0) |
| [8] |
Xia W W, Zhang Z L, Zou M M, et al. Culture media and generations influence diversity assessment of soil culturable phosphate-solubilizing bacteria (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(6): 1680-1693. DOI:10.11766/trxb202306130113 [夏围围, 张泽霖, 邹萌萌, 等. 培养基和代次影响土壤可培养解磷菌多样性评估[J]. 土壤学报, 2024, 61(6): 1680-1693.]
(  0) 0) |
| [9] |
Han M, Ruan C J, Han Z, et al. Spatial organization patterns: Rules of "game" for microbial community assembly (In Chinese)[J]. Microbiology China, 2022, 49(10): 4391-4411. [韩苗, 阮楚晋, 韩峥, 等. 空间组织模式: 微生物群落组装的"游戏" 规则[J]. 微生物学通报, 2022, 49(10): 4391-4411.]
(  0) 0) |
| [10] |
Qiu D Y, Zhang B, Yang Y F, et al. History, current status and the prospects of taxol biosynthesis research (In Chinese)[J]. Biotechnology Bulletin, 2015, 31(4): 56-64. [邱德有, 张彬, 杨艳芳, 等. 紫杉醇生物合成研究历史、现状及展望[J]. 生物技术通报, 2015, 31(4): 56-64.]
(  0) 0) |
| [11] |
Yang L J, Jia Z J. History and definition of the "99% unculturability paradigm": Case analysis with nitrogen-fixing bacteria (In Chinese)[J]. Acta Microbiologica Sinica, 2021, 61(4): 903-922. [杨丽洁, 贾仲君. "99%难培养" 微生物的概念与初步评价: 以固氮菌为例[J]. 微生物学报, 2021, 61(4): 903-922.]
(  0) 0) |
| [12] |
Sun F, Ou Q J, Wang N, et al. Isolation and identification of potassium-solubilizing bacteria from Mikania micrantha rhizospheric soil and their effect on M. micrantha plants[J]. Global Ecology and Conservation, 2020, 23: e01141. DOI:10.1016/j.gecco.2020.e01141
(  0) 0) |
| [13] |
Yan Y N, Ye X Q, Wu M, et al. Diversity and potassium-solubilizing activity of rhizosphere potassium-solubilizing bacteria of invasive Solidago canadensis (In Chinese)[J]. Chinese Journal of Plant Ecology, 2019, 43(6): 543-556. [闫雅楠, 叶小齐, 吴明, 等. 入侵植物加拿大一枝黄花根际解钾菌多样性及解钾活性[J]. 植物生态学报, 2019, 43(6): 543-556.]
(  0) 0) |
| [14] |
Zhang L H, Liu Y J, Zhang H, et al. Potassium conversion and cycling in rhizosphere microecosystems (In Chinese)[J]. Shandong Agricultural Sciences, 2023, 55(3): 166-172. [张丽红, 刘英杰, 张宏, 等. 根际微生态系统中钾素转化与循环研究进展[J]. 山东农业科学, 2023, 55(3): 166-172.]
(  0) 0) |
| [15] |
Divjot K, Kusam L R, Tanvir K, et al. New and future developments in microbial biotechnology and bioengineering . Amsterdam: Elsevier, 2020: 177-202.
(  0) 0) |
| [16] |
Cao Y, Chai Y F, Jiao S, et al. Bacterial and fungal community assembly in relation to soil nutrients and plant growth across different ecoregions of shrubland in Shaanxi, Northwestern China[J]. Applied Soil Ecology, 2022, 173: 104385. DOI:10.1016/j.apsoil.2022.104385
(  0) 0) |
| [17] |
Zhao P Y, Liu J X, Jia T, et al. Environmental filtering drives bacterial community structure and function in a subalpine area of northern China[J]. Journal of Basic Microbiology, 2019, 59(3): 337-347. DOI:10.1002/jobm.201800314
(  0) 0) |
| [18] |
Wang P D, Li S P, Yang X, et al. Mechanisms of soil bacterial and fungal community assembly differ among and within islands[J]. Environmental Microbiology, 2020, 22(4): 1559-1571. DOI:10.1111/1462-2920.14864
(  0) 0) |
| [19] |
Wang Y, Chen Y Q, Wen S H, et al. Isolation, screening and identification of a strain of bacteria with ability of phosphate-solubilizing and potassium-solubilizing (In Chinese)[J]. Journal of Anhui Agricultural Sciences, 2019, 47(10): 5-9. [王勇, 陈燕琼, 温书恒, 等. 一株溶磷解钾菌的分离筛选与鉴定[J]. 安徽农业科学, 2019, 47(10): 5-9.]
(  0) 0) |
| [20] |
Wang Y H, Li H G, Zhu A M, et al. Effects of stocking rate and nitrogen addition on plant diversity of Stipa breviflora desert steppe (In Chinese)[J]. Chinese Journal of Grassland, 2023, 45(7): 144-150. [王悦骅, 李海港, 朱爱民, 等. 载畜率和氮素添加对短花针茅荒漠草原植物多样性的影响[J]. 中国草地学报, 2023, 45(7): 144-150.]
(  0) 0) |
| [21] |
Zhou J Z, Ning D L. Stochastic community assembly: Does it matter in microbial ecology?[J]. Microbiology and Molecular Biology Reviews, 2017, 81(4): e00002-17.
(  0) 0) |
| [22] |
Li K K, Cao W W, Wen C L, et al. Assessment of differences between high-throughput sequencing and plate-dilution method for microbial ecology study of soils under distinct land use scenarios (In Chinese)[J]. Acta Microbiologica Sinica, 2022, 62(11): 4447-4464. [李凯凯, 曹伟伟, 文昌丽, 等. 基于高通量测序的稀释平板计数细菌群落变化研究[J]. 微生物学报, 2022, 62(11): 4447-4464.]
(  0) 0) |
| [23] |
Gao C, Guo L D. Progress on microbial species diversity, community assembly and functional traits (In Chinese)[J]. Biodiversity Science, 2022, 30(10): 168-180. [高程, 郭良栋. 微生物物种多样性、群落构建与功能性状研究进展[J]. 生物多样性, 2022, 30(10): 168-180.]
(  0) 0) |
| [24] |
Dai T J, Wen D H, Bates C T, et al. Nutrient supply controls the linkage between species abundance and ecological interactions in marine bacterial communities[J]. Nature Communications, 2022, 13: 175. DOI:10.1038/s41467-021-27857-6
(  0) 0) |
| [25] |
Sheng X F, He L Y. Solubilization of potassium-bearing minerals by a wild-type strain of Bacillus edaphicus and its mutants and increased potassium uptake by wheat[J]. Canadian Journal of Microbiology, 2006, 52(1): 66-72. DOI:10.1139/w05-117
(  0) 0) |
| [26] |
Wang J, Li X K, Lu J W, et al. Effects of different low-molecular weight organic acids and cations on release of potassium from potassium-bearing minerals (In Chinese)[J]. Journal of Huazhong Agricultural University, 2013, 32(3): 67-71. [王瑾, 李小坤, 鲁剑巍, 等. 小分子有机酸和阳离子对含钾矿物钾素释放的影响[J]. 华中农业大学学报, 2013, 32(3): 67-71.]
(  0) 0) |
| [27] |
Li B B, Wu D N, Nie G X, et al. Isolation and culture techniques of uncultured microorganisms: Challenges and opportunities (In Chinese)[J]. Microbiology China, 2023, 50(2): 832-844. [李斌斌, 吴丹妮, 聂国兴, 等. 未/难培养微生物可培养策略研究: 机遇与挑战[J]. 微生物学通报, 2023, 50(2): 832-844.]
(  0) 0) |
| [28] |
Sattar A, Naveed M, Ali M, et al. Perspectives of potassium solubilizing microbes in sustainable food production system: A review[J]. Applied Soil Ecology, 2019, 133: 146-159. DOI:10.1016/j.apsoil.2018.09.012
(  0) 0) |
| [29] |
Artuso I, Turrini P, Pirolo M, et al. Phylogenomic reconstruction and metabolic potential of the genus Aminobacter[J]. Microorganisms, 2021, 9(6): 1332. DOI:10.3390/microorganisms9061332
(  0) 0) |
| [30] |
Zhao S J, Guo X N, Wang Y P, et al. Isolation and identification of microorganisms in Nitraria tangutorum bobr. rhizosphere in Lanzhou (In Chinese)[J]. Acta Microbiologica Sinica, 2022, 62(7): 2582-2593. [赵诗佳, 郭晓农, 王银平, 等. 兰州唐古特白刺根际微生物分离鉴定[J]. 微生物学报, 2022, 62(7): 2582-2593.]
(  0) 0) |
| [31] |
Qian Y L, Liang Z T, Cao Q, et al. Effects of grass-planting on soil bacterial community composition of apple orchard in Longdong arid region (In Chinese)[J]. Chinese Journal of Ecology, 2018, 37(10): 3010-3017. [钱雅丽, 梁志婷, 曹铨, 等. 陇东旱作果园生草对土壤细菌群落组成的影响[J]. 生态学杂志, 2018, 37(10): 3010-3017.]
(  0) 0) |
| [32] |
Sarikhani M R, Oustan S, Ebrahimi M, et al. Isolation and identification of potassium-releasing bacteria in soil and assessment of their ability to release potassium for plants[J]. European Journal of Soil Science, 2018, 69(6): 1078-1086. DOI:10.1111/ejss.12708
(  0) 0) |
| [33] |
Khuong N Q, Sakpirom J, Oanh T O, et al. Isolation and characterization of novel potassium-solubilizing purple nonsulfur bacteria from acidic paddy soils using culture-dependent and culture-independent techniques[J]. Brazilian Journal of Microbiology, 2023, 54(3): 2333-2348. DOI:10.1007/s42770-023-01069-0
(  0) 0) |
| [34] |
Feng J Y, Sun J T, Xu J L, et al. Degradation of acetochlor in soil by adding organic fertilizers with different conditioners[J]. Soil and Tillage Research, 2023, 228: 105651. DOI:10.1016/j.still.2023.105651
(  0) 0) |
| [35] |
Guglielmetti S, Basilico R, Taverniti V, et al. Luteibacter rhizovicinus MIMR1 promotes root development in barley (Hordeum vulgare L.) under laboratory conditions[J]. World Journal of Microbiology & Biotechnology, 2013, 29(11): 2025-2032.
(  0) 0) |
| [36] |
Liu L, Zhan Q C, Peng W Z. Advances in biogeography of rhizobia (In Chinese)[J]. Acta Microbiologica Sinica, 2018, 58(2): 202-208. [刘璐, 詹庆才, 彭伟正. 根瘤菌生物地理学的研究进展[J]. 微生物学报, 2018, 58(2): 202-208.]
(  0) 0) |
| [37] |
Xu T, Yang L Q, Song Y, et al. Endophytic bacterial community structure and function of Stipa roots from different types of steppes in northern China (In Chinese)[J]. Chinese Journal of Ecology, 2015, 34(11): 3101-3110. [胥婷, 杨丽强, 宋宇, 等. 不同草原类型针茅根部可培养内生细菌群落结构及其功能[J]. 生态学杂志, 2015, 34(11): 3101-3110.]
(  0) 0) |
| [38] |
Ge Z B, Zhai Z Q, Xie W Y, et al. Two-tiered mutualism improves survival and competitiveness of cross-feeding soil bacteria[J]. The ISME Journal, 2023, 17(11): 2090-2102.[39]. DOI:10.1038/s41396-023-01519-5
(  0) 0) |
| [39] |
Luo N, Lu J, Şimşek E, et al. The collapse of cooperation during range expansion of Pseudomonas aeruginosa[J]. Nature Microbiology, 2024, 9(5): 1220-1230. DOI:10.1038/s41564-024-01627-8
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


