土壤有机质矿化导致CO2的排放和土壤有机碳的损失[1],是影响土壤有机碳固存和气候变化的重要过程之一。农作物秸秆是典型的农业生产副产物。秸秆在土壤中的分解可以释放养分,也是土壤有机质的重要来源[2-3]。因此,秸秆还田是一种传统的农田土壤管理方式。添加秸秆腐熟剂加速农作物秸秆的分解是目前农作物秸秆利用的常用手段。已有的研究还发现,秸秆热解产生的生物质炭也能有效改善土壤质量[4-6],秸秆生物炭的应用为农作物秸秆的利用提供了另一种途径。因此,作物秸秆可以直接还田,也可以经腐解和热解后在土壤中应用。秸秆材料进入土壤后会发生矿化[2]。外源植物残体本身特性和土壤微生物是影响植物残体矿化的重要因素[7-9]。简单的结构和高比例的烷氧碳有利于有机质的矿化[10-11]。微生物对不同化学组成的植物残体的利用偏好也影响植物残体的分解和矿化[9,12]。尽管热解秸秆在土壤中的矿化已有较多研究,但腐解、热解和原秸秆在土壤中矿化的差异及潜在机制尚不清楚。
秸秆材料还可以增加或减少土壤原有有机碳的矿化,产生激发效应。秸秆还田导致土壤原有有机碳的分解普遍存在,激发强度随秸秆添加量的增加而增大,但是秸秆输入过高容易导致微生物受到氮限制,减少激发效应强度[13-14]。热解秸秆添加也产生激发效应,其方向和大小受其本身性质和土壤性质影响[6,15]。秸秆与腐熟剂联合应用能够提高作物产量和土壤有机碳固存,但是其激发效应如何尚不清楚[16-17]。土壤有机碳的正激发效应一般归因于土壤养分含量的增加,以及对土壤微生物丰度和活性的刺激[18-19]。可溶性组分含量高的有机物分解速度相对较快,可以释放养分,刺激微生物生长,产生正激发效应[20]。某些有机材料如生物炭可产生负激发效应。土壤原有有机碳、胞外酶在添加的有机物质上的吸附和/或聚集以及添加的有机物质中有毒污染物的释放被认为是负激发效应的潜在机制[18-19,21-23]。然而,迄今为止,腐解秸秆、热解秸秆和原秸秆对土壤原有有机碳矿化作用的差异尚不清楚。
本研究以常年种植小麦(C3植物)的土壤和玉米(C4植物)秸秆为研究对象,采用室内培养实验结合自然丰度法,通过分析热解秸秆、腐解秸秆和原秸秆在土壤中的碳矿化量及原有土壤有机碳的矿化量,结合不同预处理秸秆的特性和添加秸秆材料培养后土壤水溶性有机碳结构变化及微生物群落变化,研究预处理方式对秸秆在土壤中的矿化及激发效应的影响差异,为有效应用农作物秸秆促进土壤有机碳固存提供科学依据。
1 材料与方法 1.1 供试材料制备与表征供试土壤样品(δ13C:–27.30‰)采集于中国湖北省钟祥市一处常年种植小麦的农田,土壤类型为黄棕壤,质地为黏壤土。小麦收获后,采用五点取样法采集0~20 cm土壤样品,采集的土壤样品去除可见的作物残体和砾石后混匀,然后过2 mm尼龙筛备用。
在土壤采样点周边农地收集玉米秸秆(δ13C:–10.45‰)。将收集的玉米秸秆在室温下风干,然后通过2 mm尼龙筛。将粉碎的秸秆彻底混合,然后分成三部分。一部分与秸秆腐熟剂(1%)混合,在60%持水量下好氧培养120 d,最终产物风干记为腐解秸秆(BS);一部分在缺氧条件下,在500 ℃的马弗炉中热解2 h,最终产物记为热解秸秆(PS);未经任何处理的部分记为原秸秆(RS)。供试秸秆材料的pH在固水比为1∶20的条件下测定,灰分含量采用马弗炉灼烧测定(750 ℃),元素组成采用元素分析仪进行分析。供试秸秆材料中有机碳的化学结构采用固态核磁共振(13C-NMR)进行分析,并对核磁共振谱积分计算烷基碳(δ=0~45,Alkyl C)、烷氧碳(δ=45~110,O-Alkyl C)、芳香碳(δ=110~160,Aromatic C)和羰基碳(δ=160~220,Carbonyl C)的相对含量[24]。供试秸秆材料中的水溶性有机质(DOM)采用去离子蒸馏水以1∶100的固水比提取,DOM的含量用TOC分析仪(Vario TOC,Elementar,德国)测定,化学结构采用荧光分光光度计(Jasco,FP-6500,日本)分析,荧光光谱激发波长范围为200~450 nm,发射波长范围为300~550 nm。
1.2 试验设计及理化性质分析采用室内培养实验探究供试秸秆材料在土壤中的矿化作用和激发效应。将100 g土壤样品与相应秸秆材料在培养瓶中充分混合,不同秸秆材料的添加量相当于C 8 mg·g–1土壤。不添加任何秸秆材料的处理为对照处理(CK)。准备不含土壤和秸秆材料的空白培养瓶用于有机碳同位素质量校正。每个处理设置三个重复。所有处理在相同条件下预培养7 d后,在25 ℃的黑暗环境中以60%的持水量进行好氧培养60 d。通过定期添加去离子蒸馏水来保持土壤持水量恒定。在正式培养过程中,分别在1、3、5、15、30、60 d采集各处理的顶空气体。在气体取样日,密封培养瓶1 h,在密封培养瓶后0和1 h,用气密注射器从瓶子顶空收集气体样本。采完样后,培养瓶保持打开。采用气相色谱(Agilent,G7890A)和稳定同位素质谱仪(Isoprime100)分别分析各处理密封前后CO2的浓度和δ13C[25-26]。
在培养结束时,每个样品被分成三部分。一部分保存在–80 ℃用于微生物群落分析,一部分保存在4 ℃冰箱用于有机碳水解酶活性测定,其余部分自然风干用于土壤基本理化性质分析。土壤DOM采用去离子蒸馏水以固水比为1∶5提取。土壤微生物生物量碳(MBC)采用氯仿熏蒸萃取法分析[27]。土壤DOM和MBC的含量采用TOC分析仪测定。土壤DOM的化学结构如1.1节应用荧光光谱法分析。土壤pH在土水比为1∶2.5的条件下测定。土壤有机碳和全氮分别采用重铬酸钾氧化外加热法和半微凯氏定氮法测定[28]。
1.3 土壤微生物群落与土壤酶活性分析土壤微生物群落采用高通量测序技术分析[29]。采用MoBio Power soil DNA Isolation Kit对相应样品进行土壤微生物DNA的提取,采用NanoDrop2000 UV-vis检测DNA的浓度和纯度。以基因组DNA为模板,扩增338F-806R和ITS1F-2043R引物进行PCR扩增。利用Illumina MiSeq平台对纯化的扩增子进行测序。采用Trimmomatic软件和FLASH软件进行质量控制和装配。然后,使用UPARSE软件按照97%的相似度进行OTU聚类。比较Sliva和Unite数据库,用RDP分类器对序列进行注释分类。采用mother程序计算Chao和Shannon指数评价细菌和真菌的α多样性。
土壤β-葡萄糖苷酶活性采用硝基酚比色法测定[30],土壤纤维素酶活性采用硝基水杨酸比色法测定[31]。
1.4 数据处理对照土壤、秸秆材料与土壤混合物中CO2-C的含量和δ13C值参照Lenka等[32]方法计算:
| $ {{\text{Q}}_{{\text{cs}}}}{\text{ = }}{{\text{Q}}_{{\text{tcs}}}} - {{\text{Q}}_{{\text{blank}}}} $ |
| $ {{\mathsf{δ}}_{{\text{cs}}}}{\text{ = }}\frac{{{\text{ (}}{{\text{Q}}_{{\text{tcs}}}} \times {{\mathsf{δ}}_{{\text{tcs}}}}{\text{ }} - {\text{ }}{{\text{Q}}_{{\text{blank}}}} \times {{\mathsf{δ}}_{{\text{blank}}}}{\text{) }}}}{{{\text{ }}{{\text{Q}}_{{\text{cs}}}}}} $ |
| $ {{\text{Q}}_{{\text{ms }}}}{\text{ = }}{{\text{Q}}_{{\text{tms}}}} - {{\text{Q}}_{{\text{blank}}}} $ |
| $ {{\mathsf{δ}}_{{\rm{ms}}}}{\rm{ = }}\frac{{\left( {{{\rm{Q}}_{{\rm{tms}}}}{\rm{ \times }}{{\mathsf{δ}}_{{\rm{tms}}}}{\rm{ - }}{{\rm{Q}}_{{\rm{blank }}}}{\rm{ \times }}{{\mathsf{δ}}_{{\rm{blank }}}}} \right)}}{{{{\rm{Q}}_{{\rm{ms}}}}}} $ |
式中,Qcs、Qms分别为对照土壤、秸秆材料和土壤混合物产生的CO2-C量,Qtcs、Qtms分别为对照处理、秸秆材料处理中测定的CO2-C总量(包含空白大气CO2- C)。δcs、δms分别为对照土壤、秸秆材料和土壤混合物产生的CO2-C的δ13C值,δtcs、δtms分别为对照处理、秸秆材料处理中测定的CO2-C总δ13C值。Qblank和δblank为空白大气中CO2- C的含量和δ13C值。
在每一种秸秆材料处理中,源自秸秆材料(Qm)和土壤原有有机碳(Qs)的CO2-C量计算如下[26]:
| $ {{\text{Q}}_{\text{m}}}{\text{ = }}{{\text{Q}}_{{\text{ms}}}} \times \frac{{{{\mathsf{δ}}_{{\text{ms}}}} - {{\mathsf{δ}}_{{\text{cs}}}}}}{{{{\mathsf{δ}}_{\text{m}}} - {{\mathsf{δ}}_{{\text{cs}}}}}} $ |
| $ {{\text{Q}}_{\text{s}}}{\text{ = }}{{\text{Q}}_{{\text{ms}}}} - {{\text{Q}}_{\text{m}}} $ |
式中,δm为秸秆材料的δ13C值。
秸秆材料激发土壤有机碳矿化量(Qpr)和激发效应(PE)计算如下:
| $ {{\text{Q}}_{{\text{pr}}}}{\text{ = }}{{\text{Q}}_{\text{s}}} - {{\text{Q}}_{{\text{cs}}}} $ |
| $ \operatorname{PE}(\%)=\frac{\mathrm{Q}_{\mathrm{pr}}}{\mathrm{Q}_{\mathrm{cs}}} \times 100 $ |
秸秆材料累积碳矿化量、土壤原有有机碳累积碳矿化量、和累积激发碳矿化量均根据上述公式将每个时间段单独计算后再累积。
土壤参数的统计差异采用单因素方差分析,处理间的显著性采用Duncan检验。采用Pearson相关分析土壤指数与CO2含量的关系。以上统计分析均采用SPSS软件进行。
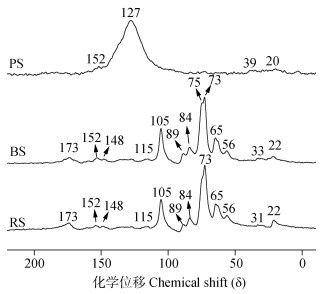
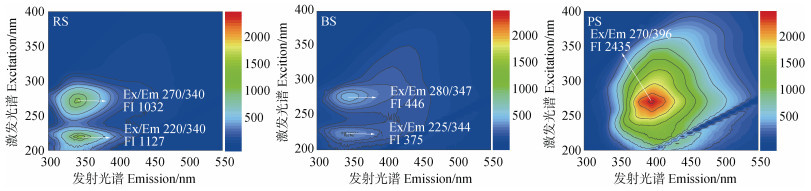
2 结果 2.1 秸秆材料的组成及有机碳结构供试秸秆材料的元素组成见表 1。PS中碳、灰分的比例最高,氧、氢的比例最低。BS的灰分比例较原秸秆略高,氧的比例略低。核磁共振光谱显示,烷氧碳是RS和BS的主要碳组分,而芳香碳是PS的主要碳组分(图 1)。BS和PS的烷基碳和羰基碳比例略低于RS(表 2)。BS的烷氧碳和芳香碳比例略高于RS(表 2)。秸秆材料的DOM含量由高到低依次为RS、BS、PS(表 1)。RS和BS的DOM的荧光峰分别位于270~280ex/340~347em和220~225ex/340~344em(图 2),意味着存在类可溶性微生物副产物和芳香蛋白[33],BS的DOM荧光强度较RS的DOM低(图 2)。PS的DOM荧光峰位于270ex/396em,表明存在类胡敏酸物质[34]。荧光强度越低,DOM的结构越复杂。类胡敏酸物质是DOM中结构较复杂的部分。这些结果表明,秸秆的腐解和热解降低了秸秆材料中DOM的含量,但增加了DOM的结构复杂性。
|
|
表 1 不同秸秆材料的元素组成、DOM含量和pH Table 1 Elemental composition, DOM content, and pH of different straw materials |
|
注:RS,原秸秆;BS,腐解秸秆;PS,热解秸秆。下同。 Note:RS,raw straw;BS,biodegraded straw;PS,pyrolyzed straw. The same below. 图 1 不同秸秆材料的13C NMR图谱 Fig. 1 13C NMR spectra of the different straw materials |
|
|
表 2 不同秸秆材料中含碳化学基团的分布 Table 2 Distribution of C chemical groups in different straw materials(%) |
|
图 2 不同秸秆材料的DOM的荧光光谱 Fig. 2 Fluorescence excitation-emission matrices of DOM from the different straw materials |
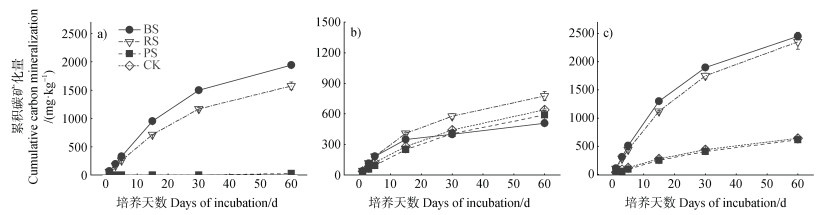
经过60 d培养,土壤中秸秆材料矿化产生的CO2累积释放量由高到低依次为BS(1 945 mg·kg–1)、RS(1 576 mg·kg–1)、PS(27 mg·kg–1)(图 3a)。这一结果说明BS的累积碳矿化量显著大于RS(P < 0.05),PS的累积碳矿化量极低,显著低于BS和RS(P < 0.05)。
|
图 3 不同处理中源于秸秆(a)、土壤原有有机碳(b)和秸秆及土壤原有有机碳(c)的累积碳矿化量 Fig. 3 The cumulative carbon mineralization from straw (a), native soil organic carbon (b), straw and native soil organic carbon (c)under different treatments |
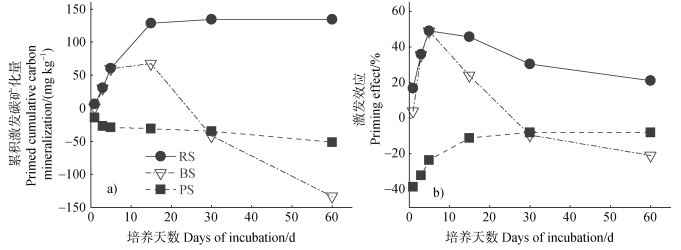
土壤原有有机碳60 d内矿化产生的CO2累积释放量由高到低依次为RS处理(775 mg·kg–1)、CK处理(640 mg·kg–1)、PS处理(589 mg·kg–1)、BS处理(507 mg·kg–1)(图 3b)。因此,RS对土壤原有有机碳矿化呈正向累积激发效应,而PS和BS,尤其是后者,具有负累积激发效应(图 4)。但需要指出的是,在培养期内,RS的累积正激发效应和PS秸秆的累积负激发效应是持续存在的。而BS的累积激发效应在培养初期为正,培养后期为负(图 4)。
|
图 4 不同处理中累积激发碳矿化量(a)和激发效应(b) Fig. 4 Primed cumulative carbon mineralization (a)and priming effect (b)under different treatments |
60 d内各处理中土壤总CO2累积释放量由高到低依次为BS处理(2 452 mg·kg–1)、RS处理(2 350 mg·kg–1)、CK处理(640 mg·kg–1)、PS处理(615 mg·kg–1)(图 3c),施用BS和RS显著提高了处理中总有机碳的矿化量(P < 0.05),而添加PS对处理中总有机碳的矿化影响不显著。RS、BS和PS对相应处理中总有机碳矿化的累积贡献率分别为67%、79%和4%,而相应处理中土壤原有有机碳对总有机碳矿化的累积贡献率分别为33%、21%和96%。可见,秸秆材料的贡献越大,处理中总有机碳的矿化量越高,说明秸秆材料的矿化能力是调节处理中总有机碳矿化的重要因素。
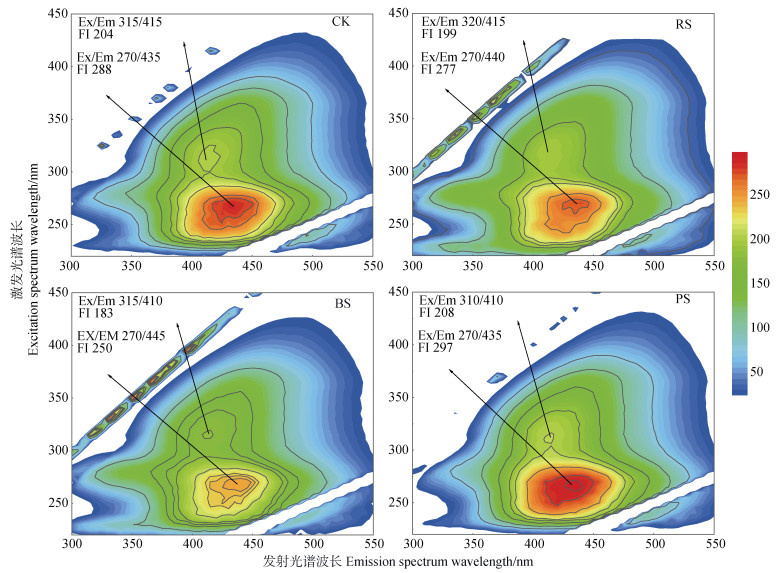
2.3 处理中DOM含量及结构添加RS和BS,尤其是后者,显著增加了处理中DOM的含量(P < 0.05)(表 3)。秸秆热解对处理中DOM含量的影响不显著(表 3)。在所有处理中,DOM的荧光峰均为310~320ex/410~415em和270ex/435~445em(图 5),这两个峰均为类胡敏酸物质[33]。BS和RS的添加降低了处理中DOM的荧光强度,而PS的添加提高了处理中DOM的荧光强度(图 5),说明PS和RS增加了处理中DOM的结构复杂性,而PS降低了处理中DOM的结构复杂性。
|
|
表 3 不同处理的pH、土壤有机碳、全氮、DOM、MBC含量及β-葡萄糖苷酶和纤维素酶活性 Table 3 The pH, content of soil organic C, total N, DOM, MBC, and activity of β-glucosidase and cellulase under different treatments |
|
图 5 不同处理中DOM的荧光光谱 Fig. 5 Fluorescence excitation-emission matrices of DOM under different treatments |
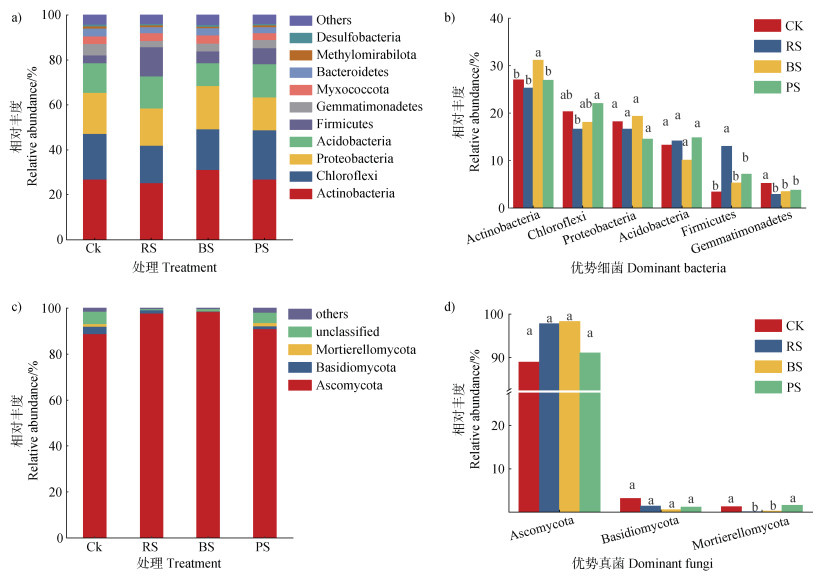
供试秸秆材料均显著增加了处理中的细菌丰度(P < 0.05),尤其是RS。RS和BS同时显著增加了处理中的真菌丰度(P < 0.05)(表 4)。然而,RS显著降低了真菌群落的多样性(表 4)。放线菌门(Actinobacteria)、绿杆菌门(Chloroflexi)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、芽单胞杆菌门(Gemmatimonadetes)是所有处理的主要细菌门类,占细菌序列的85%以上(图 6a)。BS显著提高了处理中放线菌门的相对丰度,RS显著提高了处理中厚壁菌门的相对丰度(P < 0.05)(图 6b)。然而,所有供试秸秆材料均显著降低了芽单胞杆菌门的相对丰度(P < 0.05)(图 6b)。子囊菌门(Ascomycota)、担子菌(Basidiomycota)和被孢霉门(Mortierellomycota)占真菌序列的90%以上,是所有处理的主要真菌门类(图 6c)。RS和BS倾向于增加子囊菌门的相对丰度,显著降低被孢霉门的相对丰度(图 6d)。
|
|
表 4 不同处理中微生物群落丰度和多样性 Table 4 Abundance and diversity of the microbial community under different treatments |
|
注:同一微生物的不同小写字母表示差异显著P < 0.05(b,d)。 Note:The different letters within the same microbial phylum were statistically different at P < 0.05(b,d). 图 6 不同处理中细菌(a)和真菌(c)门相对丰度以及优势细菌(b)和真菌(d)门 Fig. 6 Relative abundance of bacterial (a)and fungal (c)phyla, and the dominant bacterial (b)and fungal (d)phyla under different treatments |
RS和BS,尤其是BS,显著提高了处理中β-葡萄糖苷酶和纤维素酶的活性(P < 0.05),而热解秸秆对处理中β-葡萄糖苷酶和纤维素酶的活性影响不显著(表 3)。
3 讨论 3.1 原秸秆、腐解秸秆和热解秸秆在土壤中的矿化本研究结果表明,腐解秸秆的累积碳矿化量大于原秸秆,而腐解秸秆和原秸秆的碳矿化量均远高于热解秸秆(P < 0.05)。这一现象可归因于以下因素:首先,烷氧碳是原秸秆和腐解秸秆中的主要碳组分,热解秸秆中烷氧碳的比例远低于腐解秸秆和原秸秆(表 2),同时,各秸秆材料的疏水性呈现出与烷氧碳百分比相反的规律(表 2)。烷氧碳被认为是不耐微生物分解的不稳定有机碳组分[11]。有机物的亲水组分可以保护不稳定的有机碳免受微生物的进一步降解[34-35]。秸秆材料的累积碳矿化量与其烷氧碳百分比呈显著正相关(r = 0.992,P < 0.001),而与其疏水性呈显著负相关(r = –0.982,P < 0.001),说明秸秆材料的矿化主要受其本身的结构和性质控制。其次,β-葡萄糖苷酶和纤维素酶的活性由高到低依次为腐解秸秆处理、原秸秆处理、热解秸秆处理(表 3)。β-葡萄糖苷酶和纤维素酶是降解有机物的重要有机碳水解酶[30,36]。秸秆材料的累积碳矿化量与处理中β-葡萄糖苷酶活性(r = 0.921,P < 0.001)和纤维素酶活性(r = 0.825,P = 0.006)呈显著正相关,说明秸秆矿化还受其对处理中水解酶活性的调节。
3.2 原秸秆、腐解秸秆和热解秸秆对土壤原有有机碳矿化的激发效应本研究发现,原秸秆和热解秸秆对土壤原有有机碳矿化的激发效应分别是持续的正激发效应和负激发效应。本研究中,原秸秆持续的正激发效应可归因于其对细菌和真菌丰度、微生物生物量和土壤水解活性的促进作用(表 3、表 4)[18-19]。同时,原秸秆中DOC进入土壤,促使微生物量激增,导致C/N失衡,迫使微生物利用土壤有机质获取氮元素来满足生长,导致土壤原有有机碳矿化,厚壁菌门通过“氮矿化”导致正激发也可能是潜在的机制(表 1和图 6b)[12-13]。尽管秸秆添加后土壤pH未发生显著的变化,但是秸秆本身pH明显低于土壤,其分解过程释放的有机酸使矿物结合的有机碳失稳化,可能也是导致正激发效应的原因之一(表 1、表 3)[37]。本研究中的热解秸秆为生物炭,以往的研究提出生物炭的负激发效应可归因于生物炭吸附胞外酶和/或土壤原有DOM,生物炭对土壤团聚体形成的促进作用,以及生物炭中污染物对土壤微生物代谢的毒性[18-19,21,38]。在本研究中,热解秸秆显著增加了处理中的细菌丰度,略增加了处理中的真菌丰度和DOM含量(表 3、表 4)。热解秸秆仅使处理中微生物生物量和纤维素活性略有下降,但差异不显著(表 3)。因此,本研究中热解秸秆的负激发效应可能是通过促进团聚体的形成,进而增强对土壤原有有机碳的物理保护作用。
本研究中,腐解秸秆的激发效应由培养初期的正效应转变为培养后期的负效应。土壤原有有机碳的分解受到基质可利用性和微生物活性的直接控制[19]。土壤原有有机碳的不稳定组分在培养初期作为土壤微生物的能量来源,可以刺激微生物的活动,产生正激发效应[22]。然而,土壤原有有机碳的不稳定部分可能会随着培养过程而耗尽[21]。此外,本研究结果表明,腐解秸秆在培养结束时增加了土壤DOM结构的复杂性(图 5),这可能是由于简单的天然有机分子优先渗透并随后吸附到腐解秸秆的孔隙中[21]。秸秆腐解过程中微生物摄取能量用于构建自身生物量,产生微生物代谢产物,微生物体C/N相对较低,该部分秸秆源微生物代谢产物可能较土壤活性有机碳更容易被其他类群微生物优先利用[39]。这些过程会限制土壤有机质的可利用性,诱发负激发效应。微生物从富营养型种群向贫营养型种群的转变也被认为是负激发效应的可能机制[38-41]。培养结束时,腐解秸秆处理中贫营养门(酸杆菌门和绿弯菌门)的相对丰度低于CK土壤,而富营养门(放线菌门和变形菌门)的相对丰度高于CK土壤(图 6b)。这表明微生物群落转变可能不是腐解秸秆在培养后期产生负激发效应的主要机制。
4 结论腐解秸秆的累积碳矿化量大于原秸秆,热解秸秆的累积碳矿化量很低,远低于腐解秸秆和原秸秆。秸秆材料的碳矿化受其自身结构(烷氧碳)和水解酶活性(β-葡萄糖苷酶和纤维素酶)的主导。原秸秆和热解秸秆对土壤原有有机碳矿化的激发效应分别为持续的正激发效应和负激发效应。腐解秸秆的激发效应由培养初期的正效应转变为培养后期的负效应。原秸秆持续的正激发效应可归因于其对细菌和真菌丰度、微生物生物量和土壤水解活性的促进作用。添加腐解秸秆和原秸秆显著提高了土壤总有机碳的累积碳矿化量,而添加热解秸秆对土壤总有机碳的累积矿化量影响不显著。
| [1] |
Liu J, Jiang B, Shen J, et al. Contrasting effects of straw and straw-derived biochar applications on soil carbon accumulation and nitrogen use efficiency in double-rice cropping systems[J]. Agriculture, Ecosystems and Environment, 2021, 311: 107286. DOI:10.1016/j.agee.2020.107286
(  0) 0) |
| [2] |
Dou S
. Soil organic matter (In Chinese). Beijing: Science Press, 2010. [窦森
. 土壤有机质[M]. 北京: 科学出版社, 2010.]
(  0) 0) |
| [3] |
Sarker J R, Singh B P, Fang Y, et al. Tillage history and crop residue input enhanced native carbon mineralisation and nutrient supply in contrasting soils under long-term farming systems[J]. Soil & Tillage Research, 2019, 193: 71-84.
(  0) 0) |
| [4] |
Purakayastha T J, Das K C, Gaskin J, et al. Effect of pyrolysis temperatures on stability and priming effects of C3 and C4 biochars applied to two different soils[J]. Soil & Tillage Research, 2016, 155: 107-115.
(  0) 0) |
| [5] |
El-Naggar A, Lee S S, Awad Y M, et al. Influence of soil properties and feedstocks on biochar potential for carbon mineralization and improvement of infertile soils[J]. Geoderma, 2018, 332: 100-108. DOI:10.1016/j.geoderma.2018.06.017
(  0) 0) |
| [6] |
Shaaban M, Zwieten L V, Bashir S, et al. A concise review of biochar application to agricultural soils to improve soil conditions and fight pollution[J]. Journal of Environmental Management, 2018, 228: 429-440.
(  0) 0) |
| [7] |
Lian T X, Wang G H, Yu Z, et al. Carbon input from 13C-labelled soybean residues in particulate organic carbon fractions in a Mollisol[J]. Biology and Fertility of Soils, 2016, 52(3): 331-339. DOI:10.1007/s00374-015-1080-6
(  0) 0) |
| [8] |
Pingthaisong W, Blagodatsky S, Vityakon P, et al. Mixing plant residues of different quality reduces priming effect and contributes to soil carbon retention[J]. Soil Biology & Biochemistry, 2024, 188: 109242.
(  0) 0) |
| [9] |
Qiu QY, Wang H, Zhang QF, et al. Negative priming effect from tree leaf and root residues with contrasting chemical composition[J]. Geoderma, 2022, 427: 116118. DOI:10.1016/j.geoderma.2022.116118
(  0) 0) |
| [10] |
Jiang L, Zhu J, Qi Y, et al. Increasing molecular structural complexity and decreasing nitrogen availability depress the mineralization of organic matter in subtropical forest soils[J]. Soil Biology & Biochemistry, 2017, 108: 91-100.
(  0) 0) |
| [11] |
Chiu C Y, Tian G. Chemical structure of humic acids in biosolids-amended soils as revealed by NMR spectroscopy[J]. Applied Soil Ecology, 2011, 49: 76-80. DOI:10.1016/j.apsoil.2011.06.013
(  0) 0) |
| [12] |
Fu X H, Song Q L, Li S Q et al. Dynamic changes in bacterial community structure are associated with distinct priming effect patterns[J]. Soil Biology & Biochemistry, 2022, 169: 108671.
(  0) 0) |
| [13] |
Zhang Y, Mo F, Han J, et al. Research progress on the native soil carbon priming after straw addition (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(6): 1381-1392. DOI:10.11766/trxb202006260259 [张叶叶, 莫非, 韩娟, 等. 秸秆还田下土壤有机质激发效应研究进展[J]. 土壤学报, 2021, 58(6): 1381-1392.]
(  0) 0) |
| [14] |
Xu S W, Delgado-Baquerizo M, Kuzyakov Y, et al. Positive soil priming effects are the rule at a global scale[J]. Global Change Biology, 2024, 30(9): e17502. DOI:10.1111/gcb.17502
(  0) 0) |
| [15] |
Chen Y, Liu Y X, Chen C J, et al. Priming effect of biochar on the minerialization of native soil organic carbon and the mechanisms: A review (In Chinese)[J]. Chinese Journal of Applied Ecology, 2018, 29(1): 314-320. [陈颖, 刘玉学, 陈重军, 等. 生物炭对土壤有机碳矿化的激发效应及其机理研究进展[J]. 应用生态学报, 2018, 29(1): 314-320.]
(  0) 0) |
| [16] |
Ji C, Wang J D, Xu C, et al. Amendment of straw with decomposing inoculants benefits the ecosystem carbon budget and carbon footprint in a subtropical wheat cropping field[J]. Science of the Total Environment, 2024, 923: 171419. DOI:10.1016/j.scitotenv.2024.171419
(  0) 0) |
| [17] |
He Y W, He Y D, Al-Dhabi N A, et al. Effects of exogenous thermophilic bacteria and ripening agent on greenhouse gas emissions, enzyme activity and microbial community during straw composting[J]. Bioresource Technology, 2024, 407: 131114. DOI:10.1016/j.biortech.2024.131114
(  0) 0) |
| [18] |
Zimmerman A R, Gao B, Ahn M Y. Positive and negative carbon mineralization priming effects among a variety of biochar-amended soils[J]. Soil Biology & Biochemistry, 2011, 43(6): 1169-1179.
(  0) 0) |
| [19] |
Lu W, Ding W, Zhang J, et al. Biochar suppressed the decomposition of organic carbon in a cultivated sandy loam soil: A negative priming effect[J]. Soil Biology & Biochemistry, 2014, 76: 12-21.
(  0) 0) |
| [20] |
Schmatz R, Recous S, Aita C, et al. Crop residue quality and soil type influence the priming effect but not the fate of crop residue C[J]. Plant and Soil, 2017, 414(1): 229-245.
(  0) 0) |
| [21] |
Ding F, van Zwieten L, Zhang W D, et al. A meta- analysis and critical evaluation of influencing factors on soil carbon priming following biochar amendment[J]. Journal of Soils and Sediments, 2018, 18(4): 1507-1517. DOI:10.1007/s11368-017-1899-6
(  0) 0) |
| [22] |
Rittl T F, Novotny E H, Balieiro F C, et al. Negative priming of native soil organic carbon mineralization by oilseed biochars of contrasting quality[J]. European Journal of Soil Science, 2015, 66(4): 714-721. DOI:10.1111/ejss.12257
(  0) 0) |
| [23] |
Yu Z, Ling L, Singh B P, et al. Gain in carbon: Deciphering the abiotic and biotic mechanisms of biochar-induced negative priming effects in contrasting soils[J]. Science of the Total Environment, 2020, 746: 141057. DOI:10.1016/j.scitotenv.2020.141057
(  0) 0) |
| [24] |
Li N, Sheng M, You M Y, et al. Advancement in research on application of 13C NMR techniques to exploration of chemical structure of soil organic matter (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(4): 796-812. DOI:10.11766/trxb201805150160 [李娜, 盛明, 尤孟阳, 等. 应用13C核磁共振技术研究土壤有机质化学结构进展[J]. 土壤学报, 2019, 56(4): 796-812.]
(  0) 0) |
| [25] |
Wu Y P, Shaaban M, Peng Q, et al. Impacts of earthworm activity on the fate of straw carbon in soil: A microcosm experiment[J]. Environmental Science and Pollution Research, 2018, 25(11): 11054-11062. DOI:10.1007/s11356-018-1397-4
(  0) 0) |
| [26] |
ZHANG Y T, XU W H, WANG Q K, et al
. Effects of iron oxides on the priming effect of topsoil and subsoil carbon decomposition in a subtropical forest (In Chinese)[J]. Acta Pedologica Sinica, 2025, 62(2): 504-516. DOI:10.11766/trxb202401030009 [张雨婷, 胥文昊, 王清奎, 等
. 铁氧化物对亚热带森林表层和亚表层土壤碳激发效应的影响[J]. 土壤学报, 2025, 62(2): 504-516.]
(  0) 0) |
| [27] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology & Biochemistry, 1987, 19: 703-707.
(  0) 0) |
| [28] |
Lu R K
. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤
. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [29] |
Xu P D, Liu Y R, Zhu J, et al. Influence mechanisms of long-term fertilizations on the mineralization of organic matter in Ultisol[J]. Soil & Tillage Research, 2020, 201: 104594.
(  0) 0) |
| [30] |
Eivazi F, Tabatabai M A. Glucosidases and galactosidases in soils[J]. Soil Biology & Biochemistry, 1988, 20: 601-606.
(  0) 0) |
| [31] |
Dick R P. Soil enzyme activities as indicators of soil quality[J]. Soil Science Society of America Journal, 1994, 35: 107-124.
(  0) 0) |
| [32] |
Lenka S, Trivedi P, Singh B, et al. Effect of crop residue addition on soil organic carbon priming as influenced by temperature and soil properties[J]. Geoderma, 2019, 347: 70-79. DOI:10.1016/j.geoderma.2019.03.039
(  0) 0) |
| [33] |
Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(24): 5701-5710.
(  0) 0) |
| [34] |
Spaccini R, Piccolo A, Conte P, et al. Increased soil organic carbon sequestration through hydrophobic protection by humic substances[J]. Soil Biology & Biochemistry, 2002, 34(12): 1839-1851.
(  0) 0) |
| [35] |
Spaccini R, Piccolo A, Haberhauer G, et al. Transformation of organic matter from maize residues into labile and humic fractions of three European soils as revealed by 13C distribution and CPMAS-NMR spectra[J]. European Journal of Soil Science, 2000, 51: 583-594.
(  0) 0) |
| [36] |
Xu P D, Zhu J, Wang H, et al. Regulation of soil aggregate size under different fertilizations on dissolved organic matter, cellobiose hydrolyzing microbial community and their roles in organic matter mineralization[J]. Science of the Total Environment, 2021, 755: 142595. DOI:10.1016/j.scitotenv.2020.142595
(  0) 0) |
| [37] |
Wang C Q, Kuzyakov Y. Soil organic matter priming: The pH effects[J]. Global Change Biology, 2024, 30: e17349. DOI:10.1111/gcb.17349
(  0) 0) |
| [38] |
Wang H T, Zhang W, Chen L J, et al. Biochar induced negative priming effect on soil organic carbon mineralisation by changing the microbial community structure across plant growth stages[J]. Journal of Soils and Sediments, 2020, 20(9): 3340-3350. DOI:10.1007/s11368-020-02662-8
(  0) 0) |
| [39] |
Shahbaz M, Kuzyakov Y, Sanaullah M, et al. Microbial decomposition of soil organic matter is mediated by quality and quantity of crop residues: Mechanisms and thresholds[J]. Biology and Fertility of Soils, 2017, 53(3): 287-301. DOI:10.1007/s00374-016-1174-9
(  0) 0) |
| [40] |
Su P, Lou J, Brookes P C, et al. Taxon-specific responses of soil microbial communities to different soil priming effects induced by addition of plant residues and their biochars[J]. Journal of Soils and Sediments, 2017, 17(3): 674-684. DOI:10.1007/s11368-015-1238-8
(  0) 0) |
| [41] |
Yu Z, Chen L, Pan S, et al. Feedstock determines biochar-induced soil priming effects by stimulating the activity of specific microorganisms[J]. European Journal of Soil Science, 2018, 69(3): 521-534. DOI:10.1111/ejss.12542
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


