2. 中国科学院大学资源与环境学院, 北京 100049
2. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100049, China
东北黑土区土地肥沃,生产力高,黑土有机质含量约为黄土的10倍[1]。由于东北黑土区特殊的气候和自然地理环境以及人类活动的影响,水土流失问题日益严重。研究表明,近二十年来黑土区的土壤有机质含量每年下降1.35%,直接导致粮食产量下降[2-3]。黑土区土壤侵蚀类型多样且过程复杂,其中水力侵蚀是东北黑土区的主要土壤侵蚀类型,东北典型黑土区降雨侵蚀量占全年侵蚀量的70%[4]。
水力侵蚀会导致土壤中有机碳和矿物质发生迁移转化,在侵蚀区发生有机碳损耗,在沉积区发生有机碳累积[5]。同时,土壤微生物作为关键的生态功能群,在碳矿化、氮循环等土壤生物地球化学循环中发挥重要作用[6]。其中,细菌和真菌在维持土壤健康和保持土壤肥力中扮演重要角色[7]。土壤微生物多样性反映了微生物群落的丰富度和稳定性,也体现了微生物群体对土壤生态胁迫的适应水平[8]。
土壤微生物菌群的组成、结构、功能对水力侵蚀导致的环境变化十分敏感[9],进而影响土壤微生物特性,并逐渐受到关注[10]。已有研究表明,土壤微生物多样性与土壤理化性质[11]、气候变化、立地植物及人为因素密切相关,土壤孔隙结构、粒径组成和土层深度均会影响土壤微生物量[12]。土壤微生物(细菌、真菌)的种群数量和丰富度在侵蚀区和沉积区存在差异[10]。水力侵蚀过程可降低土壤细菌的Alpha多样性,削弱其群落结构复杂性,而沉积过程则会使二者数量增加[13]。对于土壤真菌,侵蚀和沉积过程[13]均可能降低其Alpha多样性和群落结构复杂性。长期降雨侵蚀通过改变土壤有机质分布和团聚体稳定性而显著影响土壤细菌和真菌群落[14]。降雨强度与降雨频率直接影响土壤颗粒分布、径流特征及泥沙迁移,进而改变土壤微生物多样性和群落结构[15]。然而,目前研究多集中于降雨侵蚀对土壤理化性质及微生物群落的长期影响,而单次降雨事件是否会显著改变土壤微生物多样性和微生物群落及单次降雨事件如何通过土壤微生物群落而影响土壤碳氮循环和土壤养分流失等问题尚无明确答案[16]。
本研究在东北漫川漫岗黑土区选取试验坡耕地,布置裸地、大豆和玉米径流观测小区,通过人工模拟降雨试验和高通量测序技术,分析模拟降雨前后不同径流小区土壤细菌和真菌多样性和群落结构变化,探讨次降雨事件对土壤微生物群落多样性和结构的影响,旨在从关键土壤微生物的角度揭示单次降雨事件对土壤碳氮循环和土壤养分流失的潜在影响,可深化理解东北漫川漫岗黑土区坡耕地水力侵蚀的生态环境效应,为东北漫川漫岗黑土区坡耕地土壤侵蚀精准防控提供数据和理论基础。
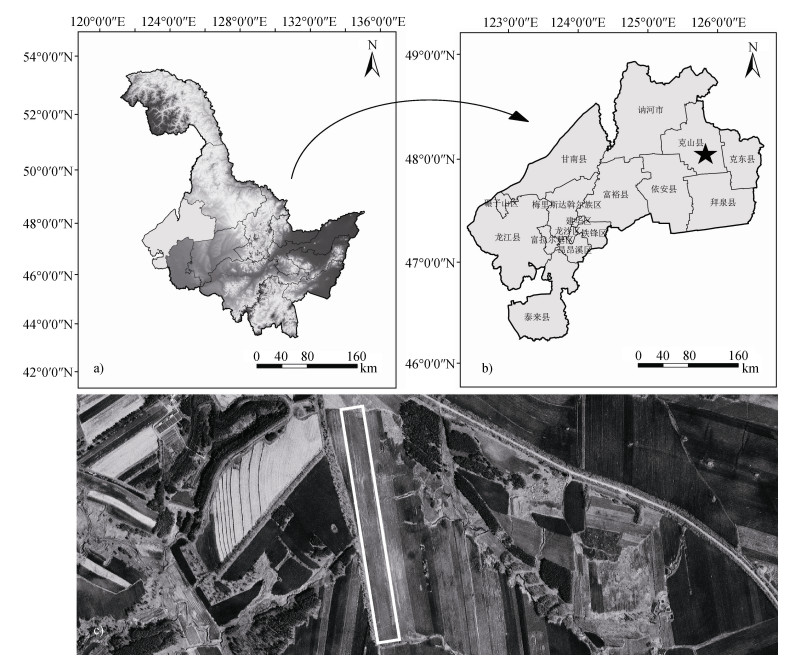
1 材料与方法 1.1 研究区概况在黑龙江省齐齐哈尔市克山县粮食沟小流域(48°03′20″N,125°49′20″E)选取试验坡耕地(图 1),位于小兴安岭西南缘和松嫩平原的东北部地带,地势东北高西南低,属于典型的漫川漫岗区。气候为寒温带大陆季风气候,年平均气温为2.4 ℃,雨热同季,降雨主要集中在6—8月,年平均降雨量约为500 mm,以玉米和大豆为主要种植作物。
|
图 1 研究区地理位置(a. 黑龙江省位置;b. 克山县位置;c. 试验坡耕地位置) Fig. 1 Location of the study area(a. Location of Heilongjiang Province; b. Location of Keshan County; c. Location of the hillslope cropland for the experiment) |
在克山试验坡耕地的坡下位置布设5 m×1 m径流小区,采用300 L径流桶收集径流小区的径流量和泥沙量。鉴于玉米和大豆为克山县的主要种植农作物,构建3类径流观测小区,每类径流观测小区建设2个重复小区(图 2),包括裸地径流小区(CK1/CK2)、大豆径流小区(Soya1/Soya2)和玉米径流小区(Corn1/Corn2)。各径流小区基本概况见表 1,所构建径流小区坡度范围为3.25°~4°,降雨前土壤容重为1.16~1.24 g· cm–3,为保证植被截流效果,在玉米和大豆径流小区的植被覆盖率为100%时进行试验。

|
注:CK:裸地观测小区;Soya:大豆观测小区;Corn:玉米观测小区。下同。 Note:CK:bare land plot;Soya:soybean plot;Corn:corn plot. The same as below. 图 2 试验坡耕地水蚀径流观测小区 Fig. 2 Runoff plots on the hillslope cropland for the experiment |
|
|
表 1 三种类型径流小区概况和人工模拟降雨条件 Table 1 Conditions of the three types of runoff plot and the simulated artificial rainfall events |
采用便携式人工模拟降雨器进行野外人工模拟降雨试验(图 3),并通过多次降雨率定以提高人工模拟降雨器的均匀性(> 80%)和稳定性(> 80%)。已有研究中东北黑土区人工模拟降雨试验的降雨强度范围为50~100 mm·h–1 [17-19],故本次试验降雨强度设定为75 mm·h–1,压力稳定在1.25 Pa。各径流小区人工模拟降雨条件见表 1,降雨前各小区土壤含水率变化范围为26.5%~34.8%。基于各小区植被覆盖情况设定降雨历时。裸地因无植被覆盖,渗透速率快,故设定短历时(24.9 min);大豆和玉米径流小区因植被截留作用延缓产流,分别延长至40.1和35.8 min(见表 1)。所有小区降雨持续至产流稳定,未中途停止。本研究设置不同降雨历时条件验证单次降雨事件对土壤微生物群落影响的规律,而不探讨不同径流小区间的差异。

|
图 3 三种径流小区人工模拟降雨试验(a. 裸地;b. 大豆;c. 玉米) Fig. 3 The simulated artificial rainfall experiments in three types of plot(a. Bare land plot; b. Soya plot; c. Corn plot) |
人工模拟降雨试验开始前在三种径流观测小区内坡中位置进行采样,每种径流小区选取三个采样点用直径为3 cm的土钻采集深度为0~20 cm的土壤样品。为保证降雨后土壤微生物变化趋于稳定,在人工模拟降雨试验结束后48 h采用同样的方法再次进行采样,共采集18个土壤样品。采集的土样用灭菌的镊子除去明显可见根系及石子杂质,过2 mm筛,分别装入密封袋做好标记,放入便携式冰箱带回试验室于–80℃冰箱中冷冻保存。
通过细菌16S rRNA和真菌ITS第三代高通量基因测序,确定所采集土壤样品的微生物种群,分析单次降雨事件对土壤微生物群落结构的影响。总基因组DNA提取采用MagaBio土壤基因组DNA纯化试剂盒进行抽提。PCR扩增以基因组DNA为模板,真菌ITS1采用BD-ITS1F(5′-CTTGGTCATTT AGAGGAAGTAA-3′)和BD-ITS2(5′-GCTGCGTT CTTCATCGATGC-3′)引物进行扩增,细菌16S rRNA采用515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′)为引物扩增细菌高通量V4V5区[20]。PCR产物用E.Z.N.A.® GelExtraction Kit凝胶回收试剂盒进行回收,按照NEBNext® Ultra™ DNA Library Prep Kit for Illumina®标准流程进行建库,在Hisep平台进行测序分析,委托广东美格基因科技有限公司完成测序。
通过97%相似性阈值的OTUs(Operational Taxonomic Unit)聚类分析,研究土壤样品的物种组成及多样性信息。对所有样品拼接过滤后的clean tags进行聚类,生成OTU,同时去除嵌合体。选取OTUs的代表性序列,与数据库进行比对获得物种注释信息。采用Shannon指数、ACE指数和Chao 1指数反映模拟降雨前后三种径流小区土壤细菌和真菌的群落Alpha多样性。
1.5 数据分析统计分析均采用IBM SPSS(Statistics 27.0)软件完成。因降雨前期各径流小区土壤含水率、降雨历时以及土壤容重和坡度不同,未对不同径流小区间的细菌、真菌群落组成进行对比分析。利用成对T检验对同一径流小区降雨前后土壤微生物(细菌、真菌)群落Alpha多样性、土壤微生物相对丰度进行显著性差异分析,可信度设定为95%(P < 0.05)。所有作图均使用Origin(2024b)绘制。
2 结果对各径流小区的产流特征进行观测,其中裸地径流小区(CK1、CK2)具有最快的产流响应,开始产流时间分别为8.2、12.9 min,产流时长分别为17.7、13.1 min。大豆径流小区(Soya1、Soya2)开始产流时间分别为19.4、22.8 min,产流时长分别为21.6、18.5 min;玉米径流小区(Corn1、Corn2)开始产流时间分别为22.2、13.3 min,产流时长分别为14.3、23.6 min。
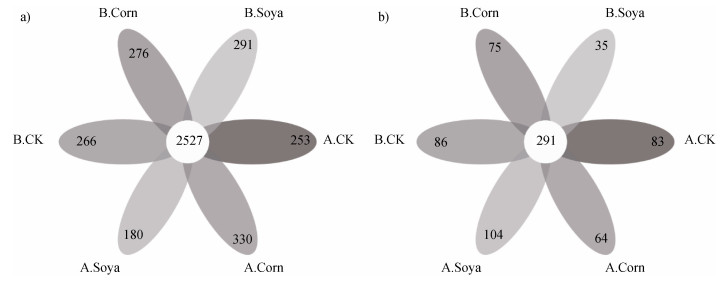
2.1 次降雨对土壤微生物多样性的影响 2.1.1 降雨前后土壤微生物聚类分析人工模拟降雨前后三种径流小区土壤细菌共有的OTUs为2 527个,其中降雨前裸地径流小区(B.CK)特有的OTUs为266个,模拟降雨后裸地径流小区(A.CK)特有的OTUs为253个,减少了13个;模拟降雨前大豆径流小区(B.Soya)特有的OTUs为291个,模拟降雨后大豆径流小区(A.Soya)特有的OTUs为180个,减少了111个;模拟降雨前玉米径流小区(B.Corn)特有的OTUs为276个,模拟降雨后玉米径流小区(A.Corn)特有的OTUs为330个,增加了54个(图 4a)。
|
注:A.CK—模拟降雨后裸地径流小区,B.CK—模拟降雨前裸地径流小区,A.Soya—模拟降雨后大豆径流小区,B. Soya—模拟降雨前大豆径流小区,A.Corn—模拟降雨后玉米径流小区,B.Corn—模拟降雨前玉米径流小区。下同。 Note:A.CK—bare ground runoff plot after the simulated rainfall event,B.CK—bare ground runoff plot before the simulated rainfall event,A.Soya—soybean runoff plot after the simulated rainfall event,B.Soya—soybean runoff plot before the simulated rainfall event,A.Corn—corn runoff plot after the simulated rainfall event,B.Corn—corn runoff plot before the simulated rainfall event. The same as below. 图 4 人工模拟降雨前后不同径流小区土壤微生物OTUs图(a. 细菌;b.真菌) Fig. 4 OTUs of soil microbial compositions in different types of runoff plot before and after the simulated rainfall event(a. Bacteria; b. Fungi) |
人工模拟降雨前后三种径流小区土壤真菌所共有的OTUs为291个,其中B.CK特有的OTUs为86个,A.CK特有的OTUs为83个,减少了3个;B.Corn特有的OTUs为75个,A.Corn特有的OTUs为64个,减少了11个;B.Soya特有的OTUs为35个,A.Soya特有的OTUs为104个,增加了69个(图 4b)。
2.1.2 降雨前后土壤微生物Alpha多样性指数由表 2可知,在模拟降雨作用下,裸地径流小区细菌和真菌的Shannon指数、ACE指数和Chao 1指数均增加。玉米径流小区细菌和真菌的Shannon指数、ACE指数和Chao 1指数均降低。大豆径流小区细菌的Shannon指数、ACE指数和Chao 1指数均降低,而真菌的Shannon指数、ACE指数和Chao 1指数均增加,其中,Chao 1指数差异显著(P < 0.05)。
|
|
表 2 模拟降雨前后三种径流小区土壤细菌和真菌的Alpha多样性指数 Table 2 Alpha diversity of soil bacteria and fungi in three types of runoff plot before and after the simulated rainfall event |
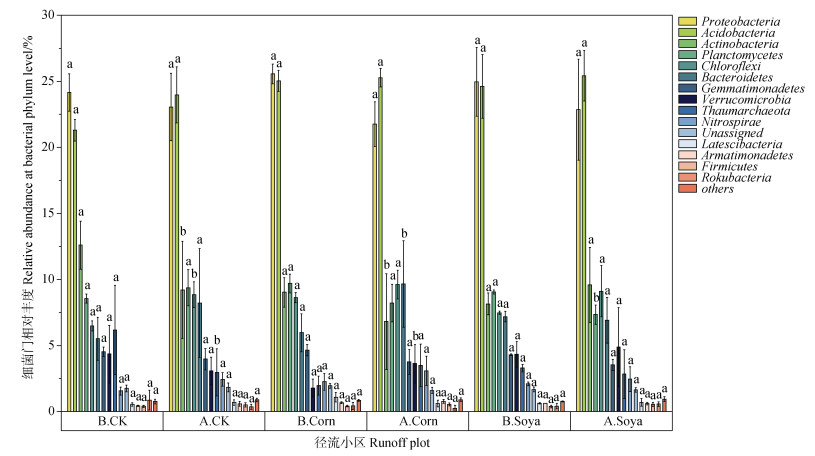
如图 5所示,在门分类水平,模拟降雨前裸地径流小区土壤细菌前10位的优势细菌门相对丰度从高到低依次为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、奇古菌门(Thaumarchaeota)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)和硝化螺旋菌门(Nitrospirae)。模拟降雨后裸地径流小区土壤细菌前10位的优势细菌门种类未发生改变,但部分优势细菌门的相对丰度发生了改变(变化趋势 > 1%)。Acidobacteria、Chloroflexi和Bacteroidetes的相对丰度在降雨后升高,其中Chloroflexi变化显著(P < 0.05);Proteobacteria、Actinobacteria、Verrucomicrobia和Thaumarchaeota的相对丰度在降雨后降低,其中Actinobacteria和Thaumarchaeota变化显著(P < 0.05)。
|
注:不同小写字母表示同一径流小区的土壤细菌群落相对丰度在模拟降雨前后差异显著(P < 0.05)。 Note:Different lowercase letters indicate significant differences in the relative abundance of soil bacterial communities in the same runoff plots before and after simulated rainfall(P < 0.05). 图 5 模拟降雨前后三种径流小区土壤细菌门水平相对丰度 Fig. 5 Relative abundance of soil bacterial species in phylum level in three types of plot before and after the simulated rainfall event |
如图 5所示,在门分类水平,模拟降雨前大豆径流小区前10位的优势细菌门相对丰度从高到低依次为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)、奇古菌门(Thaumarchaeota)和疣微菌门(Verrucomicrobia)。模拟降雨后大豆径流小区土壤细菌前10位的优势细菌门种类未发生改变,但部分优势细菌门的相对丰度发生了改变(变化趋势 > 1%)。Chloroflexi、Bacteroidetes、Verrucomicrobia和Thaumarchaeota的相对丰度在降雨后升高,其中Bacteroidetes和Verrucomicrobia变化显著(P < 0.05);Proteobacteria、Actinobacteria和Planctomycetes的相对丰度在降雨后降低,其中Actinobacteria变化显著(P < 0.05)。
如图 5所示,在门分类水平,模拟降雨前玉米径流小区前10位的优势细菌门相对丰度从高到低依次为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、芽单胞菌门(Gemmatimonadetes)、奇古菌门(Thaumarchaeota)、硝化螺旋菌门(Nitrospirae)。模拟降雨后玉米径流小区土壤细菌前10位的优势细菌门种类未发生改变,但部分优势细菌门的相对丰度发生了改变(变化趋势 > 1%)。Actinobacteria和Chloroflexi的相对丰度在降雨后升高;Proteobacteria和Planctomycetes的相对丰度在降雨后降低,其中Planctomycetes变化显著(P < 0.05)。
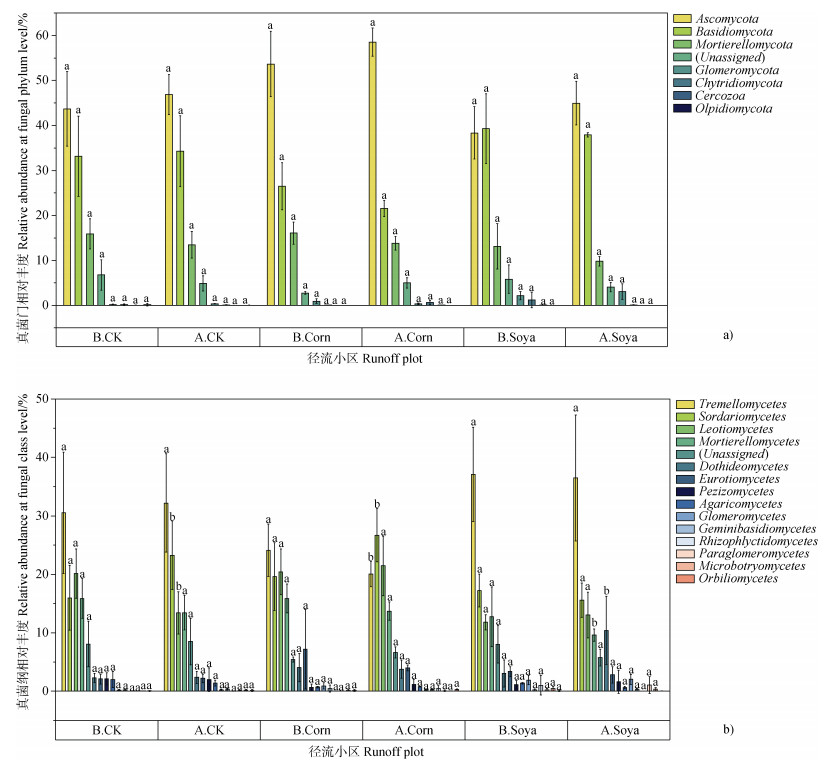
2.2.2 次降雨对土壤真菌种类及相对丰度的影响如图 6a所示,在门分类水平,三种径流小区模拟降雨前后前7位的优势真菌门种类相同,为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)、丝足虫门(Cercozoa)、油壶菌门(Olpidiomycota),但部分优势真菌门的相对丰度在降雨后发生了改变(变化趋势 > 1%)。三种径流小区Ascomycota的相对丰度在降雨后均升高,而Mortierellomycota的相对丰度在降雨后均降低。Basidiomycota的相对丰度在降雨后裸地径流小区中呈增加趋势,但在降雨后玉米和大豆径流小区中呈减少趋势。此外,Chytridiomycota的相对丰度虽然在降雨后发生了改变(变化趋势 > 1%),但该改变仅发生在玉米径流小区中,降雨后Chytridiomycota相对丰度降低了1.08%。
|
注:不同小写字母表示同一径流小区的土壤真菌群落相对丰度在模拟降雨前后差异显著(P < 0.05)。 Note:Different lowercase letters indicate significant differences in the relative abundance of soil fungal communities in the same runoff plots before and after simulated rainfall(P < 0.05). 图 6 人工模拟降雨前后三种径流小区土壤真菌群落相对丰度(a.门水平;b. 纲水平) Fig. 6 Relative abundance of soil fungal species in three types of plot before and after the simulated rainfall event(a. At phylum level; b. At class level) |
如图 6b所示,在纲分类水平,模拟降雨前裸地径流小区前7位的优势真菌纲相对丰度从高到低依次为银耳纲(Tremellomycetes)、锤舌菌纲(Leotiomycetes)、粪壳菌纲(Sordariomycetes)、被孢霉纲(Mortierellomycetes)、座囊菌纲(Dothideomycetes)、盘菌纲(Pezizomycetes)和散囊菌纲(Eurotiomycetes)。模拟降雨后裸地径流小区土壤真菌前7位的优势真菌纲种类未发生改变,但部分优势真菌纲的相对丰度发生了改变(变化趋势 > 1%)。Tremellomycetes和Sordariomycetes的相对丰度在降雨后升高,其中Sordariomycetes变化显著(P < 0.05);Leotiomycetes和Mortierellomycetes的相对丰度在降雨后降低,其中Leotiomycetes变化显著(P < 0.05)。
在纲分类水平,模拟降雨前大豆径流小区前7位的优势真菌纲相对丰度从高到低依次为银耳纲(Tremellomycetes)、锤舌菌纲(Leotiomycetes)、粪壳菌纲(Sordariomycetes)、被孢霉纲(Mortierellomycetes)、散囊菌纲(Eurotiomycetes)、座囊菌纲(Dothideomycetes)和球囊菌纲(Glomeromycetes)。模拟降雨后大豆径流小区土壤真菌前7位的优势真菌纲种类发生改变,其中Glomeromycetes被Pezizomycetes所取代。部分优势真菌纲的相对丰度发生了改变(变化趋势 > 1%),Sordariomycetes和Leotiomycetes的相对丰度在降雨后升高,其中Sordariomycetes变化显著(P < 0.05);Tremellomycetes、Mortierellomycetes和Eurotiomycetes的相对丰度在降雨后降低,其中Tremellomycetes变化显著(P < 0.05)。
在纲分类水平,模拟降雨前玉米径流小区前7位的优势真菌纲相对丰度从高到低依次为银耳纲(Tremellomycetes)、锤舌菌纲(Leotiomycetes)、粪壳菌纲(Sordariomycetes)、被孢霉纲(Mortierellomycetes)、散囊菌纲(Eurotiomycetes)、座囊菌纲(Dothideomycetes)和球囊菌纲(Glomeromycetes)。模拟降雨后玉米径流小区前7位的优势真菌纲种类未发生改变,但部分优势真菌纲的相对丰度发生了改变(变化趋势 > 1%)。Leotiomycetes和Dothideomycetes的相对丰度在降雨后升高,其中Dothideomycetes变化显著(P < 0.05);Sordariomycetes和Mortierellomycetes的相对丰度在降雨后降低,其中Mortierellomycetes变化显著(P < 0.05)。
3 讨论 3.1 次降雨对土壤微生物Alpha多样性的影响本研究发现单次降雨事件可增加裸地径流小区细菌和真菌的Alpha多样性,但未显示统计学显著差异(P < 0.05)。已有研究表明降雨会导致团聚体的稳定和重新聚集,导致土壤孔隙度增加[21]。这一过程有助于氧气和营养物质渗透,为细菌和真菌提供更多生存空间和物质来源,从而增加土壤细菌和真菌的Alpha多样性。
单次降雨事件可降低玉米径流小区细菌和真菌的Alpha多样性,但未显示统计学显著差异(P < 0.05)。玉米径流小区的植被覆盖减少了降雨对土壤的击溅冲击,表层土壤颗粒黏结和表土压实,更容易形成土壤结皮,阻碍水分进一步渗透[22]。表土结皮会阻碍土壤表面氧气交换和营养物质扩散,限制表层土壤微生物的活动,导致玉米径流小区土壤细菌和真菌的Alpha多样性在降雨后降低。
单次降雨事件导致大豆径流小区细菌Alpha多样性下降而真菌Alpha多样性增加,但除了Chao 1指数外未显示统计学显著差异(P < 0.05)。大豆根系分泌物有利于丛枝菌根真菌(AMF)或根腐真菌等与植物共生的真菌群落生长[23],这会导致单次降雨事件后土壤真菌的Alpha多样性增加。
3.2 次降雨对土壤细菌群落结构的影响本研究中,单次降雨前后三种径流小区土壤细菌的主要优势菌门均为变形菌门(Proteobacteria)和放线菌门(Actinobacteria),与前人研究一致[24]。降雨后,Proteobacteria的相对丰度均下降(图 5),可能因降雨淋溶导致表层易分解有机碳流失,削弱了依赖该碳源的Proteobacteria的代谢活性[25]。由于Proteobacteria携带碳循环基因,其丰度下降可能减缓土壤碳循环速率。同时,Actinobacteria的相对丰度降低可能抑制其固氮功能,进而削弱土壤氮循环强度[26]。
裸地径流小区中,7种优势菌门的相对丰度变化超过1%,其中绿弯菌门(Chloroflexi)的相对丰度显著增加(P < 0.05),而Actinobacteria和奇古菌门(Thaumarchaeota)的相对丰度显著下降(P < 0.05)。Chloroflexi偏好贫瘠土壤,其丰度增加可能与降雨提供的水分和溶解养分促进低能量碳源利用有关[12]。Thaumarchaeota的减少则削弱了土壤微生物的氨氧化功能,导致土壤硝化过程减缓,进一步影响氮循环[27]。大豆径流小区中,7种优势菌门的相对丰度变化超过1%,其中拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)的相对丰度显著增加(P < 0.05),而Actinobacteria的相对丰度显著下降(P < 0.05)。Bacteroidetes在降解高分子有机化合物中起到重要作用[28],降雨后大豆根系释放的多糖可能为其提供了丰富底物,促进其增殖并提升土壤腐殖化水平。然而,Actinobacteria的减少可能削弱土壤固氮能力,加剧养分流失风险。玉米径流小区中,4种优势菌门的相对丰度变化超过1%,其中浮霉菌门(Planctomycetes)的相对丰度显著下降(P < 0.05)。Planctomycetes携带氮循环基因,在厌氧氨氧化中起关键作用[29],其丰度降低可能减缓土壤氮循环速率,削弱养分供应能力。
3.3 次降雨对土壤真菌群落结构的影响本研究中,单次降雨前后三种径流小区土壤真菌的优势菌门均为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota),三者相对丰度之和超过80%,与前人研究一致[30-31]。降雨后,三种径流小区中Ascomycota的相对丰度均增加,可能因土壤湿度上升促进其增殖,进而增强土壤分解有机质的能力,维持土壤肥力[32]。裸地径流小区中,Basidiomycota的相对丰度增加,而玉米和大豆径流小区中其丰度下降。Basidiomycota对纤维素的分解能力被抑制,可能削弱土壤固碳功能[33]。此外,三种小区中Mortierellomycetes的相对丰度均下降,可能因降雨导致有机质流失,削弱了其在碳循环和养分转化中的作用[34]。
裸地径流小区中,5种优势菌纲的相对丰度变化超过1%,其中粪壳菌纲(Sordariomycetes)的相对丰度显著增加(P < 0.05),而锤舌菌纲(Leotiomycetes)的相对丰度显著下降(P < 0.05)。Sordariomycetes通过产生水解酶参与有机质分解,其丰度增加可能增强土壤碳矿化活性[35]。Leotiomycetes的减少则可能影响次生代谢产物的生成,进而降低土壤腐殖质含量[36]。大豆径流小区中,5种优势菌纲的相对丰度变化超过1%,其中Sordariomycetes的相对丰度显著增加(P < 0.05),而银耳纲(Tremellomycetes)的相对丰度显著下降(P < 0.05)。Tremellomycetes的减少可能与降雨后土壤湿度上升不利于其寄生生长有关[37],建议通过增加地表覆盖(如残茬还田)改善其生存环境。玉米径流小区中,4种优势菌纲的相对丰度变化超过1%,其中座囊菌纲(Dothideomycetes)的相对丰度显著增加(P < 0.05),而被孢霉纲的相对丰度(Mortierellomycetes)显著下降(P < 0.05)。Dothideomycetes包含多种植物病原菌,降雨可通过水膜促进其传播,增加玉米感染风险[38]。Mortierellomycetes的减少则可能削弱土壤碳循环和养分转化功能,建议通过增施有机肥等措施弥补养分流失。
4 结论本研究揭示了单次降雨通过调控关键微生物群落(如Chloroflexi、Sordariomycetes)影响土壤碳氮循环及养分贮存的机制,可为精准调控漫川漫岗黑土区坡耕地土壤侵蚀生态环境效应提供数据和理论依据。然而本文并未就次降雨导致的土壤结构和养分变化及其对微生物多样性和群落结构的影响机理进行深入研究,次降雨对土壤微生物多样性和群落结构的具体影响机理和影响路径仍需在后续研究中进一步探讨,如何通过关键微生物群落的调控而减缓东北漫川漫岗黑土区不同类型作物坡耕地土壤侵蚀的危害也有待进一步研究。
| [1] |
Lei G P, Dai L, Song G. Evaluation of soil ecological environment quality of typical black soils in Heilongjiang Province (In Chinese)[J]. Transactions of the Chinese Society of Agricultural Engineering, 2009, 25(7): 243-248. DOI:10.3969/j.issn.1002-6819.2009.07.044 [雷国平, 代路, 宋戈. 黑龙江省典型黑土区土壤生态环境质量评价[J]. 农业工程学报, 2009, 25(7): 243-248.]
(  0) 0) |
| [2] |
Zhang S L, Zhang X Y, Liu X B, et al. Tillage effect on soil erosion in typical black soil region (In Chinese)[J]. Journal of Soil and Water Conservation, 2009, 23(3): 11-15. [张少良, 张兴义, 刘晓冰, 等. 典型黑土侵蚀区不同耕作措施的水土保持功效研究[J]. 水土保持学报, 2009, 23(3): 11-15.]
(  0) 0) |
| [3] |
Wang Z Q, Liu B Y, Wang X Y, et al. Experimental study on the influence of soil erosion on land productivity in black soil area of Northeast China (In Chinese)[J]. Science in China: Series D: Earth Sciences, 2009, 39(10): 1397-1412. [王志强, 刘宝元, 王旭艳, 等. 东北黑土区土壤侵蚀对土地生产力影响试验研究[J]. 中国科学: D辑: 地球科学, 2009, 39(10): 1397-1412.]
(  0) 0) |
| [4] |
Fan H M, Cai Q G, Wang H S. Condition of soil erosion in phaeozem region of Northeast China (In Chinese)[J]. Journal of Soil Water Conservation, 2004, 18(2): 66-70. [范昊明, 蔡强国, 王红闪. 中国东北黑土区土壤侵蚀环境[J]. 水土保持学报, 2004, 18(2): 66-70.]
(  0) 0) |
| [5] |
Yang W B, Liu N, Cai Q G, et al. Research progress on the effects of hydraulic erosion on soil carbon cycle and soil microbial diversity (In Chinese)[J]. Journal of Soil and Water Conservation, 2024, 38(1): 14—21, 2. [杨文博, 刘娜, 蔡强国, 等. 水力侵蚀对土壤碳循环及土壤微生物多样性影响的研究进展[J]. 水土保持学报, 2024, 38(1): 14—21, 2.]
(  0) 0) |
| [6] |
Philippot L, Chenu C, Kappler A, et al. The interplay between microbial communities and soil properties[J]. Nature Reviews Microbiology, 2024, 22(4): 226-239. DOI:10.1038/s41579-023-00980-5
(  0) 0) |
| [7] |
Kang X H, Liu X, Liu S S, et al. Distribution patterns and drivers of soil microbial communities at different spatiotemporal scales: A review (In Chinese)[J]. Soils, 2024, 56(4): 689-696. [康小虎, 刘鑫, 刘姗姗, 等. 不同时空尺度下土壤微生物群落分布及驱动因素研究进展[J]. 土壤, 2024, 56(4): 689-696.]
(  0) 0) |
| [8] |
Wang P Y, Zhang X, Yuan W J, et al. Soil microbial diversity and its influencing factors (In Chinese)[J]. Journal of Green Science and Technology, 2021, 23(8): 163—164, 167. [王佩瑶, 张璇, 袁文娟, 等. 土壤微生物多样性及其影响因素[J]. 绿色科技, 2021, 23(8): 163—164, 167.]
(  0) 0) |
| [9] |
Guo X, Feng J J, Shi Z, et al. Climate warming leads to divergent succession of grassland microbial communities[J]. Nature Climate Change, 2018, 8(9): 813-818.
(  0) 0) |
| [10] |
Kong W B, Su F Y, Zhang Q, et al. Erosion and deposition divergently affect the structure of soil bacterial communities and functionality[J]. Catena, 2022, 209: 105805.
(  0) 0) |
| [11] |
Mo S H, Zheng F L, Feng Z Z, et al. Effects of soil erosion and deposition on the spatial distribution of soil microbial quantity in Mollisol area of Northeast China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2022, 33(3): 685-693. [莫帅豪, 郑粉莉, 冯志珍, 等. 典型黑土区侵蚀-沉积对土壤微生物数量空间分布的影响[J]. 应用生态学报, 2022, 33(3): 685-693.]
(  0) 0) |
| [12] |
Zhang Q, Wang C, Sun Z S, et al. Research progress on influencing factors of soil microbial biomass and diversity (In Chinese)[J]. Northern Horticulture, 2022(8): 116-121. [张青, 王辰, 孙宗湜, 等. 土壤微生物生物量及多样性影响因素研究进展[J]. 北方园艺, 2022(8): 116-121.]
(  0) 0) |
| [13] |
Hao W L, Xia B, Xu M X. Erosion-deposition positively reconstruct the bacterial community and negatively weaken the fungal community[J]. Catena, 2022, 217: 106471.
(  0) 0) |
| [14] |
Yang Q S, Yang W, Peng J, et al. Response of soil microbial diversity and community structure to erosion-deposition in slope farmland in typical black soil area of Northeast China (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(6): 1741-1754. DOI:10.11766/trxb202308150325 [杨青松, 杨伟, 彭珏, 等. 典型黑土区坡耕地土壤微生物多样性及群落结构对侵蚀–沉积的响应[J]. 土壤学报, 2024, 61(6): 1741-1754.]
(  0) 0) |
| [15] |
Yang Y F, Wu L W, Lin Q Y, et al. Responses of the functional structure of soil microbial community to livestock grazing in the Tibetan alpine grassland[J]. Global Change Biology, 2013, 19(2): 637-648.
(  0) 0) |
| [16] |
Zhang X F. Effects of interaction between rainfall and grassland management model on soil physical and chemical properties and soil microorganisms in typical grassland areas of Inner Mongolia[D]. Hohhot: Inner Mongolia Agricultural University, 2023.[张晓馥. 降雨与草地管理模式交互作用对内蒙古典型草原区土壤理化性质和土壤微生物的影响[D]. 呼和浩特: 内蒙古农业大学, 2023.]
(  0) 0) |
| [17] |
Lu J, Zheng F L, An J, et al. Soil aggregate movement in black soil region of NorthEast China (In Chinese)[J]. Bulletin of Soil and Water Conservation, 2012, 32(6): 6-10. [卢嘉, 郑粉莉, 安娟, 等. 东北黑土区土壤团聚体迁移特征的模拟降雨试验研究[J]. 水土保持通报, 2012, 32(6): 6-10.]
(  0) 0) |
| [18] |
Zhao Y J, Zheng F L, An X B, et al. Compound erosion effect of snowmelt, wind, and rainfall on sloping farmlands of Chinese typical Mollisol region (In Chinese)[J]. Chinese Journal of Applied Ecology, 2023, 34(9): 2421-2428. [赵娅君, 郑粉莉, 安小兵, 等. 典型黑土区坡耕地融雪、风力、降雨复合侵蚀效应[J]. 应用生态学报, 2023, 34(9): 2421-2428.]
(  0) 0) |
| [19] |
Zheng F L, Bian F, Lu J, et al. Effects of rainfall patterns on hillslope erosion with longitudinal ridge in typical black soil region of NorthEast China (In Chinese)[J]. Transactions of the Chinese Society for Agricultural Machinery, 2016, 47(2): 90-97. [郑粉莉, 边锋, 卢嘉, 等. 雨型对东北典型黑土区顺坡垄作坡面土壤侵蚀的影响[J]. 农业机械学报, 2016, 47(2): 90-97.]
(  0) 0) |
| [20] |
Qiu L P, Zhang Q, Zhu H S, et al. Erosion reduces soil microbial diversity, network complexity and multifunctionality[J]. The ISME Journal, 2021, 15(8): 2474-2489.
(  0) 0) |
| [21] |
Liu J N, Du F Y, Cheng X K, et al. Impacts of rainfall characteristics and slope on splash detachment and transport of loess soil[J]. Land, 2024, 13(2): 189.
(  0) 0) |
| [22] |
Torri D, Ciampalini R, Gil P A. The role of soil aggregates in soil erosion processes[M]//Modelling Soil Erosion by Water. Berlin, Heidelberg: Springer Berlin Heidelberg, 1998: 247—257.
(  0) 0) |
| [23] |
Bakker M G, Manter D K, Sheflin A M, et al. Harnessing the rhizosphere microbiome through plant breeding and agricultural management[J]. Plant and Soil, 2012, 360(1): 1-13.
(  0) 0) |
| [24] |
Huang M K, Chai L W, Jiang D L, et al. Increasing aridity affects soil archaeal communities by mediating soil niches in semi-arid regions[J]. Science of the Total Environment, 2019, 647: 699-707.
(  0) 0) |
| [25] |
Yu Y, Liu L, Zhao J N, et al. The diversity of soil bacteria and fungi under altered nitrogen and rainfall patterns in a temperate steppe[J]. Frontiers in Microbiology, 2022, 13: 906818.
(  0) 0) |
| [26] |
Naligama K N, Weerasinghe K E, Halmillawewa A P. Characterization of bioactive actinomycetes isolated from kadolkele mangrove sediments, Sri Lanka[J]. Polish Journal of Microbiology, 2022, 71(2): 191-204.
(  0) 0) |
| [27] |
Gubry-Rangin C, Nicol G W, Prosser J I. Archaea rather than bacteria control nitrification in two agricultural acidic soils[J]. FEMS Microbiology Ecology, 2010, 74(3): 566-574.
(  0) 0) |
| [28] |
Chen X N, Mi Q, Xu X F. Soil microbial community construction processes and its driving factors in wheat field at local-scale (In Chinese)[J]. Soils, 2023, 55(4): 812-820. [陈鲜妮, 米倩, 徐晓峰. 局域尺度麦田土壤微生物群落构建过程及其驱动因素[J]. 土壤, 2023, 55(4): 812-820.]
(  0) 0) |
| [29] |
Fuerst J A, Sagulenko E. Beyond the bacterium: Planctomycetes challenge our concepts of microbial structure and function[J]. Nature Reviews Microbiology, 2011, 9(6): 403-413.
(  0) 0) |
| [30] |
Du Y, Wu J N, Anane P S, et al. Effects of different biochars on PhysicochemicalProperties and fungal communitiesof black soil[J]. Polish Journal of Environmental Studies, 2019, 28(5): 3125-3132.
(  0) 0) |
| [31] |
Zhao Z B, He J Z, Quan Z, et al. Fertilization changes soil microbiome functioning, especially phagotrophic protists[J]. Soil Biology & Biochemistry, 2020, 148: 107863.
(  0) 0) |
| [32] |
Fierer N, Jackson R B. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626-631.
(  0) 0) |
| [33] |
Zhou H M, Peng H, Xu Z Y, et al. Effects of forest vegetation type changes on the structure of soil fungal community (In Chinese)[J]. Journal of Central South University of Forestry & Technology, 2022, 42(7): 20-27. [周红敏, 彭辉, 徐肇友, 等. 林地植被类型变化对土壤真菌群落结构的影响[J]. 中南林业科技大学学报, 2022, 42(7): 20-27.]
(  0) 0) |
| [34] |
Ning Q, Chen L, Li F, et al. Effects of Mortierella on nutrient availability and straw decomposition in soil (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(1): 206-217. DOI:10.11766/trxb202006020213 [宁琪, 陈林, 李芳, 等. 被孢霉对土壤养分有效性和秸秆降解的影响[J]. 土壤学报, 2022, 59(1): 206-217.]
(  0) 0) |
| [35] |
Chen L, Xu J M, Feng Y Z, et al. Responses of soil microeukaryotic communities to short-term fumigation-incubation revealed by MiSeq amplicon sequencing[J]. Frontiers in Microbiology, 2015, 6: 1149.
(  0) 0) |
| [36] |
Barreto G G, Bezerra J D P, Costa-Rezende D H, et al. A multigene phylogeny of Umbellidion revealed a novel lineage in Leotiomycetes[J]. Mycological Progress, 2023, 22(7): 48.
(  0) 0) |
| [37] |
Fell J W, Boekhout T, Fonseca A, et al. Biodiversity and systematics of basidiomycetous yeasts as determined by large-subunit rDNA D1/D2 domain sequence analysis[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(3): 1351-1371.
(  0) 0) |
| [38] |
Röhrig L, Dussart F. Does abiotic host stress favour dothideomycete-induced disease development[J]. Plants, 2022, 11(12): 1615.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


