2. 长江上游森林资源保育与生态安全国家林业和草原局重点实验室/长江上游林业生态工程四川省重点实验室, 四川农业大学, 成都 611130;
3. 四川省林业和草原调查规划院, 成都 610081;
4. 宁夏林业调查规划院, 银川 750001;
5. 四川峨眉山森林生态系统国家定位观测研究站, 四川乐山 614200
2. National Forestry and Grassland Administration Key Laboratory of Forest Resources Conservation and Ecological Safety on the Upper Reaches of the Yangtze River/ Forestry Ecological Engineering in the Upper Reaches of the Yangtze River Key Laboratory of Sichuan Province, Sichuan Agricultural University, Chengdu 611130, China;
3. Sichuan Provincial Institute of Forestry and Grassland Inventory and Planning, Chengdu 610081, China;
4. Ningxia Forestry Investigation and Planning Institute, Yinchuan 750001, China;
5. Sichuan Mt. Emei Forest Ecosystem National Observation and Research Station, Leshan, Sichuan 614200, China
土壤胞外酶是指在细胞内合成后穿过细胞质膜的一类酶,主要源自土壤中的微生物活动、植物根系代谢以及相关残体的分解过程,是推动土壤养分循环和能量流动的关键动力[1]。与碳(C)、氮(N)、磷(P)循环相关的土壤胞外酶活性的相对比值称为酶化学计量,该比值能够反映土壤微生物群落代谢及养分需求与环境中养分有效性之间的生物地球化学平衡模式,可用来表征土壤微生物的养分限制状况[2-3]。因此,探讨土壤胞外酶及其化学计量对厘清陆地生态系统生物地球化学循环机理具有重要意义。
人工纯林转换为混交林可提高人工林生态系统服务功能,被认为是实现人工林可持续发展的重要途径[4-5]。相比于纯林,混交林不仅能高效地利用林地资源,提升林分抗御灾害的能力,还能优化土壤养分结构,促进林木生长,从而全面提高林分的综合效益[6-7]。目前,森林转换对生态系统影响的研究更加关注土壤养分、碳储存、木材生产和森林景观质量等方面[4,7-9]。然而,人工纯林转换为混交林后对土壤胞外酶及化学计量的影响却少有报道,而且仅有的一些研究结果也并不一致。如:在杉木(Cunninghamia lanceolata)人工纯林中引入乡土树种提高了土壤酸性磷酸单酯酶(AP)活性[10]。相反,在马尾松(Pinus massoniana)人工纯林采伐迹地上营建混交林显著提高了土壤亮氨酸氨基肽酶(LAP)活性,但显著降低了土壤β-1,4-葡糖苷酶(BG)和AP活性,并在一定程度上缓解了土壤微生物磷的限制[11]。上述不一致的响应可能是森林类型的转换会改变物种组成、植物群落结构和根系分泌物,并导致土壤养分、微生物群落结构和生物量的变化,进而影响土壤胞外酶活性[12-13]。尽管如此,人工纯林转换为混交林对土壤胞外酶及其化学计量的影响机制仍不明确。
桉树(Eucalyptus)作为典型速生树种,具有丰产、用途广泛、经济价值高等优势,已成为我国热带和亚热带地区重要的造林树种,目前全国种植面积已达546万hm2[14]。当前桉树人工林普遍采用短轮伐期(5~7年)、多代连作和单一树种的经营方式,导致了林地生物多样性下降、土壤肥力衰退及生态系统服务功能减弱等一系列生态问题的发生,受到了社会的广泛关注[9,14]。研究发现,将桉树人工纯林皆伐后营造桉树+乡土树种的混交林,显著提高了林下植被的物种丰富度,维持了较高的灌草生物量,并有改善土壤质量、提高养分含量等作用[15-16]。然而,在桉树人工纯林皆伐迹地上营造无桉树树种的混交林对土壤胞外酶及化学计量的影响尚不清楚。因此,本研究以巨桉(E. grandis)人工纯林皆伐迹地营建的巨桉纯林和3种无巨桉树种的混交林为对象,测定了不同林分类型的土壤理化性质、微生物生物量和胞外酶活性,分析了土壤胞外酶及化学计量与各土壤因子之间的相关关系,并探讨了影响土壤胞外酶及化学计量变化的主控因子,旨在揭示巨桉皆伐迹地营造不同混交林类型对土壤胞外酶活性和微生物养分限制的影响,进而为巨桉人工林的改造和可持续经营管理提供科学参考。
1 材料与方法 1.1 试验地概况试验地位于四川省沙湾区巨桉人工林近自然改造示范点(29°26′N,103°35′E)。示范点为典型的丘陵地貌,海拔在420~451 m之间,地处亚热带湿润季风气候区,具有以下特征:气候温和,年均温在16.5~18.0 ℃之间;雨量充沛,年均降水量在800~1 600 mm之间,降水主要集中于夏季(6—8月)。试验地土壤为典型黄壤,呈酸性,深度约为100 cm。试验地主要包含巨桉纯林、常绿针阔混交林和落叶阔叶混交林三种林分类型。乔木层优势种以巨桉、红叶碧桃(Prunus persica ‘Atropurpurea’)、西府海棠(Malu × micromalus)、杉木(Cunninghamia lanceolata)、桢楠(Phoebe zhennan)、香樟(Cinnamomum camphora)和水杉(Metasequoia glyptostroboides)等为主;灌木层以盐肤木(Rhus chinensis)、楤木(Aralia elata)和山茶(Camellia japonica)等为主;草本层则以蕨(Pteridium aquilinum)、雾水葛(Pouzolzia zeylanica)和蚊母草(Veronica peregrina)等为主[15]。
2016年春季,将巨桉人工纯林皆伐后采用植苗造林的方式营建了红叶碧桃+西府海棠(MPM,简称红叶碧桃混交林)、杉木+桢楠+红叶碧桃(MCPP,简称杉木混交林)和香樟+水杉(MCM,简称香樟混交林)3种混交林,并营建巨桉纯林为对照(CK),共4种林分类型,记为试验处理,每种林分类型的面积均超过100亩(6.67 hm2)。
1.2 标准地设置与调查2021年5月,分别在4种林分类型中,设置立地条件基本一致、面积为400 m2(20 m × 20 m)的标准地。每种林分类型3个重复,共计12个标准地。标准地间相互独立,互不干扰,间距大于100 m。对各标准地的地形和植被进行调查,统计出各林分的基本情况,结果见表 1。
|
|
表 1 各林分的基本情况 Table 1 General situation of stand types |
于2021年7月(生长季)和2022年1月(非生长季)在每个标准地内按照梅花形五点取样法设置5个土壤剖面,每个剖面按0~20 cm和20~40 cm两个土层取样。在去除林下灌木、草本和枯枝落叶后分层采集土壤样品和100 cm3环刀样品。同一标准地土壤样品分层混合,共计48个土壤样品和240个环刀样品。随后立即将土壤样品放置于冰盒(< 4 ℃),并快速运回实验室。除去土壤中的杂物和细根,部分土样过2 mm筛,置于4 ℃冰箱中储存,用于测定土壤微生物生物量和胞外酶活性;另一部分土样自然风干磨细用于测定土壤pH、有机碳、全氮和全磷。100 cm3环刀样品用于测定土壤含水量。
1.4 样品测定与分析参照《土壤农化分析》[17]中的相关方法:使用pH计(PHS-3C,PUCHUN,中国)和玻璃电极在质量比为1︰2.5的土壤-水悬浮液中测定土壤pH;使用环刀法测定土壤含水量;使用重铬酸钾氧化—外加热法测定土壤有机碳;采用改进的Kjeldhal's方法,用自动分析仪(UDK-149,VELP Scientifica,意大利)测定土壤全氮;使用氢氧化钠熔融—钼锑比色法测定土壤全磷;使用改进的经典氯仿熏蒸法测定土壤微生物生物量碳和微生物生物量氮[18]。
根据Dick[19]和Nannipieri等[20]研究中报告的标准程序,用微孔板荧光法测定土壤BG、β-1,4-N-乙酰氨基葡糖苷酶(NAG)、LAP和AP活性,并计算了胞外酶化学计量和胞外酶矢量度量。简要步骤为:将4 g新鲜土壤放入200 mL烧杯中,加入40 mL醋酸缓冲液(50 mol·L–1,pH=5.0)并用磁力搅拌器混合均匀,制备成土壤悬浮液。用多通道移液管将100 μL样品悬浮液和150 μL底物溶液注入96孔酶标板。在25 ℃的黑暗条件下培养后,向每个孔中加入10 μL的1 mol·L–1的氢氧化钠溶液以终止反应。然后,使用多功能酶标仪(Spark 10M,Tecan,瑞士)在365 nm激发波长和450 nm发射波长下测量荧光,并根据土壤干物质量和反应时间来计算酶活性。所使用的酶底物和培养时间详见表 2[2]。
|
|
表 2 土壤胞外酶名称、编号、简称、底物和培养时间[2] Table 2 Name, enzyme commission number, abbrev, substrate, and culture time of extracellular soil enzyme [2] |
碳(BG)、氮(NAG+LAP)和磷(AP)循环的土壤胞外酶化学计量用酶活性的对数比值来计算[2]。即:酶C︰N=Ln(BG/nmol·g–1·h–1)︰Ln [(NAG+LAP)/nmol·g–1·h–1];酶C︰P=Ln(BG/nmol·g–1·h–1)︰Ln(AP/nmol·g–1·h–1);酶N︰P=Ln [(NAG+LAP)/nmol·g–1·h–1]︰/Ln(AP/nmol·g–1·h–1)。胞外酶矢量用矢量长度和矢量角度来计算。即:矢量长度L=SQRT(x2+y2);矢量角度A=DEGREES(ATAN2(x,y)),式中:x=BG/(BG+AP);y=BG/(BG+LAP+NAG)。矢量长度代表土壤微生物受到相对的碳限制,矢量角度代表土壤微生物受到相对的氮或磷限制[21]。根据最新的土壤微生物养分限制阈值[22],矢量长度大于0.61说明受到较强的微生物碳限制,矢量长度越长表明微生物碳限制越强;矢量角度大于55°说明微生物存在磷限制,而小于55°说明微生物存在氮限制。
1.5 数据处理与分析使用SPSS 22.0对所有测定数据进行统计分析。首先,进行方差齐性检验。当方差齐时,利用最小显著性差异法(LSD)进行差异显著性检验(P < 0.05);当方差不齐时,利用邓尼特T3法(Dunnett T3)进行差异显著性检验(P < 0.05)。其次,采用线性混合效应模型(LMM)检验林分类型、土壤深度和采样时间的主效应及其交互作用对土壤理化性质、土壤碳氮磷及化学计量比、微生物生物量碳氮及化学计量比、胞外酶活性及化学计量的影响。在分析中,将标准地编号作为随机因子,林分类型、土壤深度和采样时间作为固定因子。再者,利用LSD法对不同土壤深度和采样时间下各林分类型指标的估计均值(EMM)进行了多重比较分析。估计均值是指通过样本数据平均值计算的总体平均值,用于更准确地评估各林分类型指标的差异。所有的数据均以“平均值±标准差”表示。最后,使用皮尔森(Pearson)相关性分析确定土壤因子与土壤胞外酶及化学计量的相关关系;并对土壤胞外酶及化学计量与土壤因子之间的相关性进行冗余分析(RDA)。
2 结果 2.1 混交林的土壤理化性质及养分化学计量特征由图 1a~图 1e可知,4种林分类型在各采样时间和各土层的土壤pH、含水量、有机碳、全氮和全磷分别介于3.49~5.44、287.4~433.7 g·kg–1、10.43~25.92 g·kg–1、0.77~2.10 g·kg–1和0.26~1.21 g·kg–1。与巨桉纯林相比,3种混交林均显著提高了土壤pH、有机碳、全氮和全磷含量的估计均值(P < 0.05,图 1a,图 1c~图 1e),仅香樟混交林显著提高了土壤含水量的估计均值(P < 0.05,图 1b)。

|
注:图中不同小写字母表示相同时间相同土层不同林分类型间差异显著(P < 0.05)。*、**和***分别表示在P < 0.05、P < 0.01和P < 0.001的水平上有显著的差异。图中的缩写如下:ST,林分类型;SD,土壤深度;T,采样时间。SMC,土壤含水量;SOC,土壤有机碳;TN,土壤全氮;TP,土壤全磷。SOC:TN、SOC:TP和TN:TP分别为土壤C:N、C:P和N:P。下同。 Note: Different lowercase letters in the table indicate significant differences between stand types(P < 0.05). *, **, and *** indicate statistical significance at P < 0.05, P < 0.01, and P < 0.001, respectively. ST is the stand type, SD is the soil depth, and T is the sampling time. SMC, SOC, TN, and TP represent soil moisture content, organic carbon, total nitrogen, and total phosphorus, respectively. SOC: TN, SOC: TP, and TN: TP are soil C: N, C: P, and N: P ratios, respectively. The same below. 图 1 不同人工林分类型的土壤理化性质(a. pH,b. SMC,c. SOC,d.TN,e.TP)及养分化学计量特征(f. SOC:TN,g. SOC:TP,h. TN:TP) Fig. 1 Physic-chemical properties(a. pH, b. SMC, c. SOC, d. TN, e. TP)and stoichiometric ratios of C, N, and P(f. SOC: TN, g. SOC: TP, h. TN: TP)in the four forest plantation soils |
由图 1f~图 1h可知,4种林分类型的土壤C︰N、C︰P和N:P分别介于11.02~14.11、13.15~56.26和1.14~3.98。3种混交林均显著降低了土壤N:P的估计均值(P < 0.05,图 1h),但对土壤C︰N估计均值影响不显著(图 1f)。此外,红叶碧桃和杉木混交林显著降低了土壤C︰P的估计均值(P < 0.05),但香樟混交林对土壤C︰P的估计均值影响不显著(图 1g)。在3种混交林中,香樟混交林土壤C︰P和N︰P的估计均值均显著大于杉木混交林和红叶碧桃混交林(P < 0.05,图 1g,图 1h),但3种混交林土壤C︰N估计均值差异不显著(图 2d)。
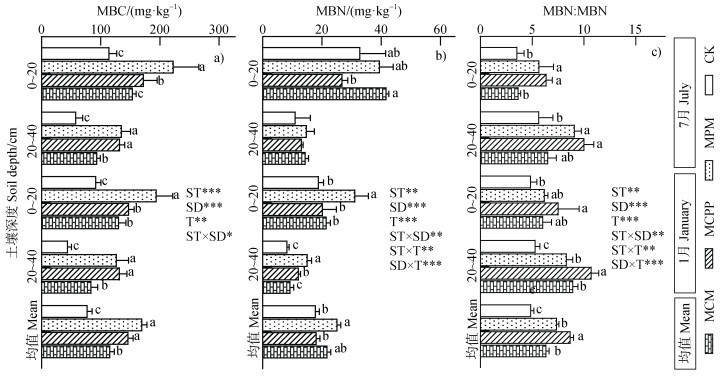
|
注:MBC,土壤微生物生物量碳;MBN,土壤微生物生物量氮。MBC:MBN为土壤微生物生物量C:N。下同。 Note: MBC and MBN represent microbial biomass carbon and nitrogen in soil, respectively. MBC : MBN is microbial biomass C: N ratio in the soil. The same below. 图 2 不同林分类型的土壤微生物生物量碳氮及化学计量特征(a.MBC,b.MBN,c.MBC:MBN) Fig. 2 Microbial biomass carbon and nitrogen and stoichiometric ratio in the four forest plantation soils(a. MBC, b. MBN, c. MBC : MBN) |
由图 2a~图 2c可知,4种林分类型的土壤微生物生物量碳和微生物生物量氮分别介于44.8~223.2 mg·kg–1和11.14~41.82 mg·kg–1;土壤微生物生物量C:N介于3.59~10.76。与巨桉纯林相比,3种混交林均显著提高了土壤微生物生物量碳和微生物生物量C:N的估计均值(P < 0.05,图 2a,图 2c)。在3种混交林中,红叶碧桃混交林和杉木混交林土壤微生物生物量碳的估计均值显著大于香樟混交林;红叶碧桃混交林土壤微生物生物量氮的估计均值显著大于杉木混交林和香樟混交林;杉木混交林土壤微生物生物量C:N的估计均值显著大于红叶碧桃混交林和香樟混交林(P < 0.05,图 2a~图 2c)。
2.3 混交林的土壤胞外酶活性、酶化学计量特征及微生物养分限制情况由图 3a~图 3d可知,4种林分类型的土壤BG、NAG、LAP和AP活性分别介于145.3~454.8 nmol·g–1·h–1、28.4~192.2 nmol·g–1·h–1、3.86~13.82 nmol·g–1·h–1和845~2 232 nmol·g–1·h–1。与巨桉纯林相比,3种混交林均显著提高了土壤NAG活性的估计均值,显著降低了土壤AP活性的估计均值(P < 0.05,图 3b,图 3d),但对土壤BG和LAP活性的估计均值影响不显著(图 3a,图 3c);在3种混交林中,除红叶碧桃混交林土壤NAG活性的估计均值显著大于杉木混交林和香樟混交林外(P < 0.05,图 3b),其他土壤胞外酶活性的估计均值差异均不显著(图 3a,图 3c~图 3d)。
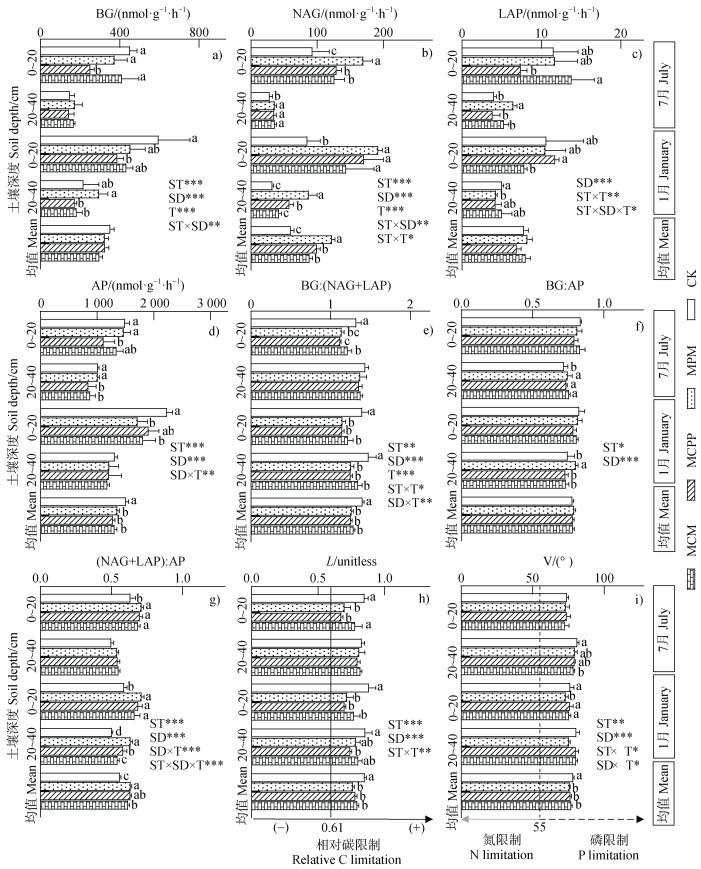
|
注:BG,土壤β-1,4-葡糖苷酶;NAG,土壤β-1,4-N-乙酰氨基葡糖苷酶;LAP,土壤亮氨酸氨基肽酶;AP,土壤酸性磷酸单酯酶;L,矢量长度;A,矢量角度。BG:(NAG+LAP)、BG:AP和(NAG+LAP):AP分别为土壤胞外酶C:N、C:P和N:P。下同。 Note: BG is soil β-1, 4-Glucosidase; NAG is soil β-1, 4-N-acetylglucosaminidase; LAP is soil leucine aminopeptidase; AP is the soil acid phosphatase; L, vector length of soil extracellular enzymes; A, vector angle of soil extracellular enzymes. BG: (NAG+LAP), BG: AP, and(NAG+LAP): AP are extracellular enzymes C: N, C: P, and N: P ratios in soil, respectively. The same below. 图 3 不同林分类型的土壤微生物胞外酶活性(a. BG,b. NAG,c. LAP,d. AP)、酶化学计量比(e. BG:(NAG+LAP),f. BG:AP,g.(NAG+LAP):AP)及微生物养分限制状况(h. L,i. A) Fig. 3 Extracellular enzyme activities(a. BG, b. NAG, c. LAP, d. AP), extracellular enzyme stoichiometry(e. BG: (NAG+LAP), f. BG: AP, g.(NAG+LAP): AP), and microbial nutrition limitation status(h. L, i. A)in the four forest plantation soils |
由图 3e~图 3g可知,4种林分类型的土壤胞外酶C︰N、C︰P和N︰P分别介于1.12~1.47、0.72~0.84和0.50~0.71。3种混交林均显著提高了土壤胞外酶N︰P的估计均值,显著降低了土壤胞外酶C︰N估计均值(P < 0.05,图 3e,图 3g),但对土壤胞外酶C︰P的估计均值影响不显著(图 3f);在3种混交林中,除红叶碧桃混交林土壤胞外酶N︰P的估计均值显著大于香樟混交林外(P < 0.05,图 3g),其他类型混交林土壤胞外酶化学计量的估计均值均无显著差异(图 3e~图 3f)。
由图 3h~图 3i可知,4种林分类型的土壤胞外酶矢量长度和矢量角度分别介于0.68~0.88和72.59°~81.18°。与巨桉纯林相比,3种混交林均显著降低了土壤胞外酶矢量长度和矢量角度的估计均值(P < 0.05,图 3h~图 3i);3种混交林间的差异不显著,但红叶碧桃混交林的酶矢量长度和矢量角度的估计均值相对较低(图 3h~图 3i)。
2.4 土壤胞外酶活性、化学计量特征与土壤因子的关系皮尔森相关性分析表明(表 3),土壤4种胞外酶活性均与土壤有机碳、全氮和微生物生物量氮呈极显著正相关关系(P < 0.01),均与土壤微生物生物量C︰N呈显著负相关(P < 0.05)。此外,土壤胞外酶C︰N、胞外酶矢量长度和矢量角度均与土壤有机碳、全氮和微生物生物量碳氮呈极显著负相关(P < 0.01);土壤胞外酶C︰P和N︰P均与土壤有机碳、全氮和微生物生物量碳氮呈极显著正相关(P < 0.01)。
|
|
表 3 土壤胞外酶活性、化学计量特征与土壤因子的相关性 Table 3 Correlation between soil extracellular enzyme activities and stoichiometry and soil factors |
冗余分析结果表明,对土壤胞外酶活性影响显著的因子是土壤全氮、微生物生物量氮、微生物生物量C︰N和土壤C︰N,解释度分别为71.9%、12.2%、5.2%和4.5%(图 4a,图 4c)。对土壤胞外酶化学计量影响显著的因子是土壤微生物生物量氮、微生物生物量碳和土壤全氮,解释度分别为66.6%、18.3%和6.6%(图 4b,图 4d)。
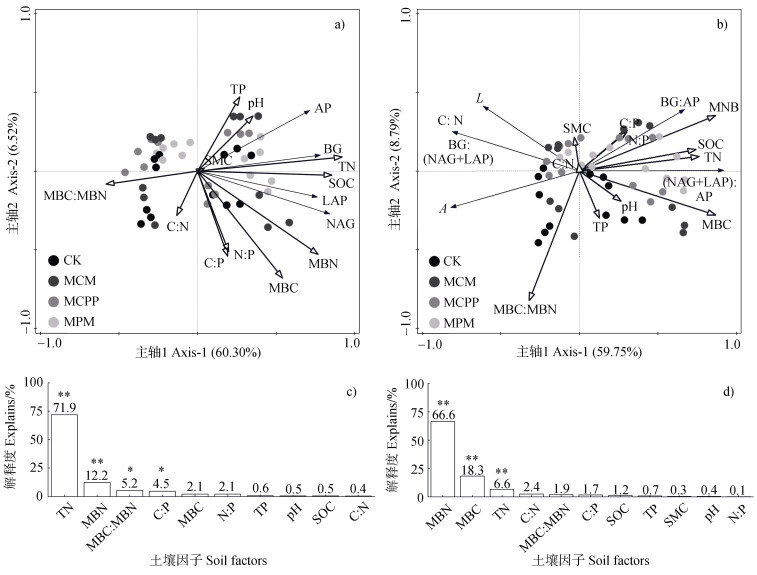
|
注:*表示显著贡献(P < 0.05),**表示极显著贡献(P < 0.01)。 Note: * indicates significant contribution(P < 0.05), ** indicates extremely significant contribution(P < 0.01). 图 4 不同林分类型的土壤胞外酶活性、酶化学计量特征与土壤因子的冗余分析(a.土壤胞外酶活性与土壤因子的冗余分析,b.土壤胞外酶化学计量与土壤因子的冗余分析,c.土壤胞外酶活性影响因子的重要性排序,d.土壤胞外酶化学计量影响因子的重要性排序) Fig. 4 Redundancy analysis of extracellular enzyme activities and stoichiometry and soil factors for the four plantations(a. Redundancy analysis of soil extracellular enzyme activity and soil factors, b. Redundancy analysis of the soil extracellular enzyme stoichiometry and soil factors, c. Ranking of importance of influencing factors of soil extracellular enzyme activity, d. Ranking of the importance of influencing factors of soil extracellular enzyme stoichiometry) |
巨桉纯林转换为混交林后土壤pH的估计均值显著上升(P < 0.05,图 1a)。这可能与混交林输入土壤的酸性物质减少有关。与巨桉纯林相比,混交林可能会减少根系分泌的次生代谢类物质(如,有机酸、酚类和酮类等)和叶片凋落物中的酸性化合物(如,木质素和单宁等)向土壤的输入,从而导致土壤pH上升[23-24]。此外,混交林中多种凋落物可能会促进微生物对有机质的矿化作用,消耗更多的氢离子,从而增加土壤pH[9,25]。本研究还发现,3种混交林土壤有机碳、全氮和全磷含量的估计均值均显著大于巨桉纯林(P < 0.05,图 1c~图 1e)。一方面,巨桉纯林因长期的单一栽培而造成土壤养分的耗竭,而混交林通过树种的互补作用,有助于维持和提升土壤养分水平[9]。另一方面,相较于纯林,混交林乔木树种、林下灌木和草本植物多样性较高,凋落物输入量和种类丰富,可能使土壤养分的归还量更充足,提高了土壤养分含量[15]。
土壤C︰P和N︰P能够衡量土壤磷的有效性[26]。土壤C︰P和N︰P较低表明土壤磷有效性通常较高,微生物对磷元素的固持力较弱或土壤母质释放磷元素的能力较强[27]。本研究结果与Chen等[28]研究相似,营建混交林总体上降低了土壤C︰P和N︰P的估计均值,表明混交林有提高土壤磷有效性的趋势(图 1g~图 1h)。原因主要有以下两方面,首先,相较于纯林,混交林中较高的物种多样性可能支持植物群落中更多的磷动员物种,从而提高土壤磷的有效性[28]。其次,混交林土壤pH值较高,促进了基质的运动和可及性,从而有利于提升土壤磷的有效性[25,29]。此外,土壤C︰N是判断森林土壤有机质分解状况的关键指标[30]。与许窕孜等[31]研究结果一致,在巨桉纯林和3种混交林中土壤C︰N的估计均值差异均不显著(图 1f)。这可能是因为土壤有机碳和全氮含量的内稳态,有机物质的形成需要一定量的氮和其他养分元素以相对固定的比例与土壤有机碳结合,从而导致土壤C︰N差异不显著[32]。
3.2 混交林对土壤微生物生物量碳氮及化学计量的影响与巨桉纯林相比,3种混交林均显著提高了土壤微生物生物量碳及微生物生物量C︰N的估计均值(P < 0.05,图 2a,图 2c),总体上提高了土壤微生物生物量氮的估计均值(图 2b)。原因有以下两个方面:一是巨桉属于速生树种,生长快,对养分的需求量大,加之缺乏施肥等经营措施,导致巨桉纯林土壤养分持续亏缺[9]。而混交林由于林下凋落物种类更加丰富,有助于凋落物的分解和养分回归,为土壤微生物提供了更充足的代谢底物,从而促进了土壤微生物的繁殖,提高了土壤微生物的活性[15]。二是混交林多树种的根系分泌物为土壤微生物提供了丰富多样的能源物质,有助于促进土壤微生物的生长和活性[33]。此外,在不同混交林间,土壤微生物生物量碳及微生物生物量C︰N的估计均值差异显著,且阔叶树种占比较高的林分具有更高的土壤微生物生物量(表 1,图 2a,图 2c)。这可能因为阔叶树种相比于针叶树种具有较高的凋落物质量(即高的C︰N),高质量的凋落物更容易分解,能为土壤输送更丰富的养分,进而提高土壤微生物的数量[34]。
3.3 混交林对土壤胞外酶活性、化学计量及微生物养分限制的影响本研究表明,各林分类型的土壤胞外酶矢量长度介于0.68~0.88,土壤胞外酶矢量角度介于72.59°~81.18°(图 3h~图 3i)。这表明4种林分类型土壤微生物均受到碳和磷的共同限制。这与Wu等[35]对中亚热带地区森林土壤微生物养分限制状况的研究结果一致。一方面,这可能是土壤磷素主要来自于成土母质、矿物岩石的风化和降水淋溶,因而土壤磷的有效性较低[36]。另一方面,由于人工林处于早期演替阶段,土壤微生物可用的有机质通常较少[15]。本研究还表明,与巨桉纯林相比,3种混交林均显著降低了土壤AP活性的估计均值(P < 0.05,图 3d),土壤BG活性的估计均值有下降的趋势(图 3a)。这与土壤微生物养分限制有关。根据资源分配理论,土壤微生物通过调节酶合成过程中的资源分配,增强对限制养分分解酶的分配,以维持自身的生长和代谢[2]。因此,在土壤微生物的碳和磷限制较低的混交林中,土壤AP和BG活性的估计均值较低(图 3)。本研究中,3种混交林间的土壤BG和AP活性的估计均值差异不显著(图 3a,图 3d),这与3种混交林的土壤微生物养分限制状况和土壤养分含量基本相同(图 3h~图 3i,图 1c~图 1e)有关。
与巨桉纯林相比,3种混交林均显著提高了土壤NAG活性的估计均值(P < 0.05,图 3b),土壤LAP活性的估计均值总体上呈现出上升趋势(图 3c)。这与混交林土壤全氮含量以及pH值大小有关。第一,相关性分析与冗余分析均表明,土壤NAG和LAP活性与全氮含量呈显著正相关(表 3,图 4a)。由于土壤全氮是影响土壤胞外酶活性的主要因素之一,解释度为71.9%(图 4b)。因此,推测土壤全氮含量的增加促进了NAG和LAP反应底物的累积,进而加速了酶促反应[37]。第二,土壤pH通过直接影响基质中酶的构象和稳定性来影响酶的活性,随着pH的增加,酶的空间构象可能趋于稳定,使酶活性增加[37]。本研究结果表明,3种混交林均显著提高了土壤pH的估计均值,且土壤pH与NAG和LAP活性呈正相关,这表明3种混交林可能通过提高土壤pH来增强土壤NAG和LAP活性(表 3)。第三,土壤pH还能通过影响土壤微生物的生长和代谢,间接增加它们分泌NAG和LAP的能力[2-3]。此外,在3种混交林中,红叶碧桃混交林的土壤NAG活性显著高于杉木混交林和香樟混交林,这与红叶碧桃混交林的土壤全氮含量更高(图 3b)有关。
3种混交林土壤胞外酶C:N和矢量长度的估计均值均显著低于巨桉纯林(P < 0.05,图 3e,图 3h)。这表明巨桉纯林皆伐后营建的3种混交林均缓解了土壤微生物的碳限制。这与混交林土壤有机碳含量、微生物生物量C:N和pH值大小有关。第一,土壤有机碳含量越高,土壤碳的供应能力越强,从而缓解微生物的碳限制[21]。相关性分析结果表明,土壤胞外酶矢量长度与土壤有机碳含量之间呈显著负相关(P < 0.05,表 3),这表明3种混交林通过提高土壤有机碳含量缓解了土壤微生物的碳限制。其次,土壤微生物生物量C:N反映了土壤中真菌与细菌的相对比例[32]。在相同的土壤环境中,真菌较细菌通常更不易受到碳的限制[38]。该比率越高,土壤微生物群落中真菌群落占比越大[38]。本研究中3种混交林均显著提高了土壤微生物生物量C:N的估计均值(P < 0.05,图 2c),表明混交林可能通过增加土壤微生物群落中的真菌占比来缓解微生物的碳限制。此外,土壤pH会通过调节微生物生物量及其群落组成、酶蛋白的空间构象及其与土壤胶体的结合状态,进而调控土壤胞外酶及化学计量[25,35]。相关性分析显示,土壤胞外酶C:N与土壤pH之间呈显著负相关(P < 0.05,表 3),这表明混交林通过提高土壤pH缓解了土壤微生物的碳限制。
3种混交林土壤胞外酶N:P的估计均值显著升高,而酶矢量角度的估计均值则显著降低(P < 0.05,图 3g,图 3i)。这表明,3种混交林缓解了土壤微生物的磷限制,这与邵文哲等[11]的研究结果一致。其原因可能与混交林土壤全磷、有机碳含量和pH值大小有关。本研究中,3种混交林显著提高了土壤全磷含量的估计均值(P < 0.05,图 1j)。土壤全磷含量越高,土壤磷的供应能力则越强,从而缓解微生物的磷限制[37]。其次,土壤有机碳含量的增加可能会降低土壤对磷的吸附潜力,导致土壤磷有效性增加,从而缓解微生物的磷限制[29]。相关性分析表明,土壤胞外酶C:P与土壤有机碳含量之间呈显著正相关,而酶矢量角度与土壤有机碳含量之间呈显著负相关(P < 0.05,表 3)。这表明,3种混交林通过提高土壤有机碳含量缓解了土壤微生物的磷限制。此外,本研究区域属于亚热带地区,土壤中铁、铝含量较高[12],提高土壤pH有助于促进酸性土壤中铁铝氧化物沉淀,减少对磷的吸附,使稳定的闭蓄态磷逐渐转化为活跃的水溶性磷,从而提高土壤磷的有效性[25,29]。3种混交林的土壤pH均高于巨桉纯林(图 1a),从而缓解了土壤微生物的磷限制。
本研究中,3种混交林之间的土壤胞外酶化学计量、酶矢量角度和矢量长度的估计均值均无显著差异(图 3e~图 3i),这可能与混交林营建时间较短有关[15]。但是红叶碧桃混交林的酶矢量角度和矢量长度的估计均值相对较低(图 3h~图 3i),这可能是因为其阔叶树种占比高,提供了高质量的凋落物,能为微生物提供较为充足的代谢底物,从而有助于缓解微生物碳和磷的限制[33]。
4 结论巨桉人工纯林皆伐后营建的红叶碧桃、杉木和香樟3种混交林均提高了土壤NAG和LAP活性,但降低了土壤BG和AP活性。3种混交林均通过提高土壤养分有效性、微生物生物量C︰N以及降低土壤C︰P和N︰P缓解了土壤微生物的碳和磷限制。土壤全氮和微生物生物量氮分别是影响土壤胞外酶活性和酶化学计量的主控因子。此外,虽然营造的3种混交林在初期均缓解了土壤微生物的碳和磷限制,但仍受到碳和磷的共同限制。因此,在研究区混交林营建初期可施加有机肥和磷肥来缓解土壤微生物的养分限制。考虑到土壤胞外酶及化学计量特征受植被、土壤因子以及微环境因子的相互作用,未来研究应从植物多样性(包括乔木和林下植物)和林下微环境等方面进一步研究混交林营造对土壤胞外酶及化学计量特征的影响。
| [1] |
Zuccarini P, Sardans J, Asensio L, et al. Altered activities of extracellular soil enzymes by the interacting global environmental changes[J]. Global Change Biology, 2023, 29(8): 2067-2091. DOI:10.1111/gcb.16604
(  0) 0) |
| [2] |
Sinsabaugh R L, Hill B H, Follstad Shah J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment[J]. Nature, 2009, 462(7274): 795-798. DOI:10.1038/nature08632
(  0) 0) |
| [3] |
Sinsabaugh R L, Shah J J F. Ecoenzymatic stoichiometry and ecological theory[J]. Annual Review of Ecology, Evolution, and Systematics, 2012, 43(1): 313-343. DOI:10.1146/annurev-ecolsys-071112-124414
(  0) 0) |
| [4] |
Amazonas N T, Forrester D I, Silva C C, et al. High diversity mixed plantations of Eucalyptus and native trees: An interface between production and restoration for the tropics[J]. Forest Ecology and Management, 2018, 417: 247-256. DOI:10.1016/j.foreco.2018.03.015
(  0) 0) |
| [5] |
Ye X D, Luan J W, Wang H, et al. Tree species richness and N-fixing tree species enhance the chemical stability of soil organic carbon in subtropical plantations[J]. Soil Biology & Biochemistry, 2022, 174: 108828.
(  0) 0) |
| [6] |
Guo D Q, Lu L F, Deng Z Y, et al. Research progress on mixed Eucalyptus plantations in China (In Chinese)[J]. Eucalypt Science and Technology, 2018, 35(4): 27-32. [郭东强, 卢陆峰, 邓紫宇, 等. 我国桉树混交林研究进展[J]. 桉树科技, 2018, 35(4): 27-32.]
(  0) 0) |
| [7] |
Santos F M, Chaer G M, Diniz A R, et al. Nutrient cycling over five years of mixed-species plantations of Eucalyptus and Acacia on a sandy tropical soil[J]. Forest Ecology and Management, 2017, 384: 110-121. DOI:10.1016/j.foreco.2016.10.041
(  0) 0) |
| [8] |
Zhang H, Guan D S, Song M W. Biomass and carbon storage of Eucalyptus and Acacia plantations in the Pearl River Delta, South China[J]. Forest Ecology and Management, 2012, 277: 90-97. DOI:10.1016/j.foreco.2012.04.016
(  0) 0) |
| [9] |
Liu C H, Li F Q, Liao Y W K, et al. Research progress on effects and regulation of plantation on soil fertility (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(3): 644-656. DOI:10.11766/trxb202112020653 [刘超华, 李凤巧, 廖杨文科, 等. 人工林对土壤地力的影响过程及其调控研究进展[J]. 土壤学报, 2023, 60(3): 644-656.]
(  0) 0) |
| [10] |
Xu G, Long Z J, Ren P, et al. Differential responses of soil hydrolytic and oxidative enzyme activities to the natural forest conversion[J]. Science of the Total Environment, 2020, 716: 136414. DOI:10.1016/j.scitotenv.2019.136414
(  0) 0) |
| [11] |
Shao W Z, Zhou X G, Wen Y G. Effects of mixing Eucalyptus and Castanopsis hystrix on soil hydrolytie enzyme activities and ecoenzymatic stoichiometry (In Chinese)[J]. Guihaia, 2022, 42(4): 543-555. [邵文哲, 周晓果, 温远光, 等. 桉树与红锥混交对土壤水解酶活性及其化学计量特征的影响[J]. 广西植物, 2022, 42(4): 543-555.]
(  0) 0) |
| [12] |
Xu Y X, Li C, Wang Z C, et al. Rational eucalypt logging site management patterns enhance soil phosphorus bioavailability and reshape phoD-harboring bacterial community structure[J]. Forest Ecology and Management, 2025, 578: 122434. DOI:10.1016/j.foreco.2024.122434
(  0) 0) |
| [13] |
Zeng H H, Wu J N, Zhu X A, et al. Jungle rubber facilitates the restoration of degraded soil of an existing rubber plantation[J]. Journal of Environmental Management, 2021, 281: 111959. DOI:10.1016/j.jenvman.2021.111959
(  0) 0) |
| [14] |
Wen Y G, Zhou X G, Yu S F, et al. The predicament and countermeasures of development of global Eucalyptus plantations (In Chinese)[J]. Guangxi Sciences, 2018, 25(2): 107-116. [温远光, 周晓果, 喻素芳, 等. 全球桉树人工林发展面临的困境与对策[J]. 广西科学, 2018, 25(2): 107-116.]
(  0) 0) |
| [15] |
Jiang L, Zhang P F, Wang J, et al. Effects of constructing mixed forests on understory shrub and herb species diversity after clear-cutting of Eucalyptus grandis pure forest (In Chinese)[J]. Chinese Journal of Applied and Environmental Biology, 2024, 30(3): 477-484. [蒋璐, 张辟芳, 王军, 等. 巨桉纯林皆伐迹地营建混交林对林下灌草物种多样性的影响[J]. 应用与环境生物学报, 2024, 30(3): 477-484.]
(  0) 0) |
| [16] |
Wang L, Wen Y G, Zhou X G, et al. Effects of mixing Eucalyptus urophylla × E. grandis with Castanopsis hystrix on understory vegetation and soil properties (In Chinese)[J]. Ecology and Environmental Sciences, 2022, 31(7): 1340-1349. [王磊, 温远光, 周晓果, 等. 尾巨桉与红锥混交对林下植被和土壤性质的影响[J]. 生态环境学报, 2022, 31(7): 1340-1349.]
(  0) 0) |
| [17] |
Bao S D. Soil and agricultural chemistry analysis (In Chinese). 3rd ed[M]. Beijing: China Agriculture Press, 2000. [鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [18] |
Witt C, Gaunt J L, Galicia C C, et al. A rapid chloroform-fumigation extraction method for measuring soil microbial biomass carbon and nitrogen in flooded rice soils[J]. Biology and Fertility of Soils, 2000, 30(5/6): 510-519.
(  0) 0) |
| [19] |
Dick W A. Development of a soil enzyme reaction assay[M] //Dick R P. Methods of soil enzymology. Soil Science Society of America, Madison, WI, 2011.
(  0) 0) |
| [20] |
Nannipieri P, Trasar-Cepeda C, Dick R P. Soil enzyme activity: A brief history and biochemistry as a basis for appropriate interpretations and meta-analysis[J]. Biology and Fertility of Soils, 2018, 54(1): 11-19.
(  0) 0) |
| [21] |
Cui Y X, Moorhead D L, Guo X B, et al. Stoichiometric models of microbial metabolic limitation in soil systems[J]. Global Ecology and Biogeography, 2021, 30(11): 2297-2311.
(  0) 0) |
| [22] |
Cui Y X, Moorhead D L, Peng S S, et al. Predicting microbial nutrient limitations from a stoichiometry-based threshold framework[J]. The Innovation Geoscience, 2024, 2(1): 100048.
(  0) 0) |
| [23] |
Chu C J, Mortimer P E, Wang H C, et al. Allelopathic effects of Eucalyptus on native and introduced tree species[J]. Forest Ecology and Management, 2014, 323: 79-84.
(  0) 0) |
| [24] |
Chen H, Tang H Z, Guo J H, et al. Root exudates' roles and analytical techniques progress (In Chinese)[J]. Soils, 2023, 55(2): 225-233. [陈虹, 唐昊冶, 郭家欢, 等. 根系分泌物主要作用及解析技术进展[J]. 土壤, 2023, 55(2): 225-233.]
(  0) 0) |
| [25] |
Zhao X Q, Pan X Z, Ma H Y, et al. Scientific issues and strategies of acid soil use in China (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(5): 1248-1263. DOI:10.11766/trxb202307250290 [赵学强, 潘贤章, 马海艺, 等. 中国酸性土壤利用的科学问题与策略[J]. 土壤学报, 2023, 60(5): 1248-1263.]
(  0) 0) |
| [26] |
Wang S Q, Yu G R. Ecological stoichiometry characteristics of ecosystem carbon, nitrogen and phosphorus elements (In Chinese)[J]. Acta Ecologica Sinica, 2008, 28(8): 3937-3947. [王绍强, 于贵瑞. 生态系统碳氮磷元素的生态化学计量学特征[J]. 生态学报, 2008, 28(8): 3937-3947.]
(  0) 0) |
| [27] |
Wu Y L, Min X, Sai S, et al. Soil C, N and P contents and their stoichiometry under different artificial vegetation types in agro-pastoral zone of northern China: A case study of Wuchuan County (In Chinese)[J]. Soils, 2024, 56(4): 873-878. [吴叶礼, 闵雪, 赛硕, 等. 北方农牧交错带不同人工植被类型土壤碳氮磷及其化学计量特征——以武川县为例[J]. 土壤, 2024, 56(4): 873-878.]
(  0) 0) |
| [28] |
Chen X, Chen H Y H, Chang S X. Meta-analysis shows that plant mixtures increase soil phosphorus availability and plant productivity in diverse ecosystems[J]. Nature Ecology & Evolution, 2022, 6(8): 1112-1121.
(  0) 0) |
| [29] |
Zhang W N, Yang Z, Yan Y P, et al. Research progress on soil organic phosphorus mineralization and its regulation (In Chinese)[J]. Acta Pedologica Sinica, 2025, 62(2): 334-347. DOI:10.11766/trxb202404140154 [张万年, 杨子, 严玉鹏, 等. 土壤有机磷的矿化及其调控研究进展[J]. 土壤学报, 2025, 62(2): 334-347.]
(  0) 0) |
| [30] |
Zhang H, Ouyang Z C, Jiang P H, et al. Spatial distribution patterns and influencing factors of soil carbon, phosphorus, and C: P ratio on farmlands in southeastern China[J]. Catena, 2022, 216: 106409.
(  0) 0) |
| [31] |
Xu Z Z, Ye C H, Zhang G, et al. Soil C, N and P stoichiometry in different forest stand types in the middle and lower reaches of the Beijiang River, China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2023, 34(4): 962-968. [许窕孜, 叶彩红, 张耕, 等. 北江中下游不同林分类型土壤C、N、P生态化学计量特征[J]. 应用生态学报, 2023, 34(4): 962-968.]
(  0) 0) |
| [32] |
Cleveland C C, Liptzin D. C: N: P stoichiometry in soil: Is there a"Redfield ratio"for the microbial biomass?[J]. Biogeochemistry, 2007, 85(3): 235-252.
(  0) 0) |
| [33] |
Chen F L, Zhang K, Xiang D, et al. Impacts of litter decomposition of Eucalyptus on soil microbial community: A microcosm study (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(2): 432-442. DOI:10.11766/trxb201804200092 [陈法霖, 张凯, 向丹, 等. 桉树凋落物对土壤微生物群落的影响: 基于控制实验研究[J]. 土壤学报, 2019, 56(2): 432-442.]
(  0) 0) |
| [34] |
Cotrufo M F, Wallenstein M D, Boot C M, et al. The Microbial Efficiency-Matrix Stabilization(MEMS)framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter?[J]. Global Change Biology, 2013, 19(4): 988-995.
(  0) 0) |
| [35] |
Wu L F, Zou B Z, Wang S R, et al. Effects of multispecies restoration on soil extracellular enzyme activity stoichiometry in Pinus massoniana plantations of subtropical China[J]. Soil Biology & Biochemistry, 2023, 178: 108967.
(  0) 0) |
| [36] |
Turner B L, Lambers H, Wen Z H, et al. Microbial nutrient limitation along a 2-million-year dune chronosequence[J]. Soil Biology & Biochemistry, 2024, 192: 109385.
(  0) 0) |
| [37] |
Wallenius K, Rita H, Mikkonen A, et al. Effects of land use on the level, variation and spatial structure of soil enzyme activities and bacterial communities[J]. Soil Biology & Biochemistry, 2011, 43(7): 1464-1473.
(  0) 0) |
| [38] |
Wang C Q, Kuzyakov Y. Rhizosphere engineering for soil carbon sequestration[J]. Trends in Plant Science, 2024, 29(4): 447-468.
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


