2. 安庆师范大学资源环境学院, 安庆 246133;
3. 中国科学院大学, 北京 100049
2. College of Resources and Environment, Anqing Normal University, Anqing 246011, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
土壤pH可能是评估土壤特性中最具信息量的单一测量指标[1],它直接影响土壤中营养元素的生物有效性和利用率、污染物质在土壤中的迁移转化,以及土壤动物和微生物的活性[2-3]等。土壤的自然酸化是一个长期持续的过程,在没有人为扰动的情况下,土壤pH下降一个单位需要上百万年[4]。然而,近年来我国农田土壤酸化速度加快,强酸性土壤的面积大幅增加,严重制约了我国农业的发展[5-7]。在耕地土壤改良和污染土壤修复过程中,往往需要对土壤pH进行准确、实时的监测,以便定量评估目标土壤的肥力和健康状况。然而,至今为止,各类pH电极在土壤中的稳定性仍未得到充分研究。
测定土壤pH的标准方法是将风干并过筛后的土壤与去CO₂水或CaCl₂溶液混合,制成土壤悬液后,采用电位法进行测量[1]。已有许多研究证明,原位(或接近原位条件)下测定的土壤pH与实验室标准方法的结果存在差异,实验室测定的酸性土壤pH通常会较原位测定高0.5~0.8个pH单位[8-9]。究其原因可能是土壤样品在干燥、研磨和再润湿过程中,会释放出土壤腐殖质、动植物残体和微生物中的缓冲离子[10]。此外,由于植物根系呼吸和有机物的分解作用,土壤中CO2的分压通常较大气中高10倍~100倍,仅CO2的损失就能产生高达1~2个pH单位的偏差[11]。因此,实验室标准方法测定的土壤pH可能会导致对土壤酸碱度状况的误判,而原位测定的土壤pH则能够更准确地反映土壤的真实酸碱度[11-13]。国内外已有大量关于原位测定土壤pH的研究[8,11,14],结果表明,各种玻璃电极和Sb金属pH电极均能有效进行土壤pH的原位测定,但在长期监测过程中,电极的稳定性仍需进一步明确。
Eldeeb等[15]开发了一种基于茜素改性碳电极作为工作电极、Ag/AgCl电极作为参比电极的丝网印刷电极,并利用该电极对黏土、沙质壤土和壤土进行了为期7天的实时连续pH监测。研究结果表明,该电极的测量误差相较于传统玻璃pH电极在10%以内,表明其适用于原位土壤pH监测。Nair等[16]使用Sb金属电极对pH范围为3~8的土壤进行了为期10 d的监测。在长期监测过程中可能出现的问题包括电极校准漂移、工作电极或敏感膜周围缺乏物质循环等[17]。尽管原位pH监测存在一些明显的局限性,但在土壤介质中进行长期监测以评估土壤酸碱度状况,无疑较实验室标准方法具有显著的时效性和真实性优势。
对球泡和锥形玻璃pH复合电极以及Sb金属pH电极进行为期350天的土壤pH原位监测,以筛选适用于酸性土壤介质中pH电极的长期监测,并探究玻璃和Sb金属pH电极在这一过程中的可靠性。研究结果为数字农业(包括农业物联网、农业大数据、精准农业和智慧农业)、土壤环境污染的快速响应与污染土壤修复,以及考古和地质资源调查等领域提供参考和启示。
1 材料与方法 1.1 土壤样品采集与分析实验采用江西吉安(27.108°N,114.870°E)地区第四纪红黏土发育的红壤,采集荒坡地表层(0~20 cm)土壤,风干后研磨过20目和60目筛。分别通过电位法、低温外热重铬酸钾氧化—比色法和乙酸铵法测定土壤pH(土水比1︰2.5)、有机质含量和阳离子交换量[18],结果分别为4.89、3.6 g ·kg–1和9.01 cmol·kg–1。随后,将上述土壤按每份500 g加入6个1 L塑料桶中,并根据21%含水量(约为田间持水量的70%)补充水分。
1.2 土壤原位pH监测和测定考虑到pH电极的机械强度从低到高,分别使用了3支雷磁65-1C球泡玻璃pH复合电极(上海仪电科学仪器股份有限公司),2支锥形玻璃pH复合电极(江苏江分电分析仪器有限公司)和1支Sb金属-Ag/AgCl凝胶电极(南京思摩特传感器有限公司)。在使用pH7.00和4.01的酸碱缓冲溶液进行校准后,密封电极的内参比加液孔,以延长电极的使用寿命。最后,将6支校准后的pH电极小心埋入上述培养土壤中,并盖上盖子以减少水分蒸发,同时确保每周至少补充一次土壤水分。
在前两个月的监测期,使用Orion Star A111电位计(赛默飞世尔科技公司,美国)每周三次测定电极的电位值。待数值稳定后,改为每隔两周记录一次原位监测电位值。经过350天的监测后,将电极从供试土壤中小心取出,冲洗干净后,置于7.00和4.01缓冲溶液中再次进行校准,并记录此时的电极电位。为了保证原位监测过程中培养土壤pH的准确性、稳定性和可靠性,使用额外的锥形玻璃pH复合电极(该电极具有中等的机械强度和灵敏度)进行土壤pH状况的原位测定。在每次使用pH缓冲液校准后,前200天监测原位pH,并同时测定土壤pH;此后,每个月测定一次。在开始监测前以及取出并清洗电极后,使用圣创专业级4K数字显微镜(广州市骐峰科技发展有限公司)对球泡玻璃、锥形玻璃电极的敏感膜和金属电极的H+敏感表面进行33倍、120倍和270倍的放大观察,并分别进行显微拍摄。
1.3 数据处理由于长期监测过程中电极埋入土壤后无法进行再次校准,在电极埋入前和到期取出后分别进行电极电位的校准。结果发现,部分电极的两次校准曲线差异较大(表 1)。为了更准确地描述原位监测土壤pH的变化情况,本研究假定在350天的监测期间电极电位变化是均匀的,因此得出了随时间变化的电极动态校准公式(式(1))。随后,将每次测定得到的电位值代入该校准公式,进而计算出原位监测土壤pH的动态变化。
| $ {\text{p}}{{\text{H}}_i} = \frac{{{V_i} - {b_i}}}{{{S_i}}} = \frac{{{V_i} - \left( {{b_F} + \left( {{b_L} - {b_F}} \right)/350 \times i} \right)}}{{\left( {{S_F} + \left( {{S_L} - {S_F}} \right)/350 \times i} \right)}} $ | (1) |
|
|
表 1 供试pH电极埋土前后校准与电位–pH斜率变化 Table 1 Calibration and sensitivity changes of pH electrodes before and after embedding in the soil matrix |
式中,pHi、Vi、bi和Si分别表示第i天时的土壤pH、电极电位、电极校准公式中的截距和斜率;bF、bL、SF和SL分别表示第一次和最后一次电极校准公式中的截距和斜率。
采用Pearson相关分析研究埋土球泡和锥形玻璃电极、Sb金属pH电极的原位监测结果与原位测定土壤pH之间的相关性。变异系数(Coefficient of Variation,CV)用于衡量观测值的变异程度,其中CV<10%、10%~100%和>100%分别代表弱、中等和强变异性[14]。
| $ \begin{array}{l}\text{CV}=\frac{标准偏差SD}{平均值\overline{x}}\times 100\%=\\ \sqrt{\frac{1}{n-1}{\displaystyle \sum }_{i=1}^{n}{\left({x}_{i}-\overline{x}\right)}^{2} }/\overline{x}\times 100\%\end{array} $ | (2) |
埋土前后,分别使用pH=7.00和4.01的缓冲溶液进行电极校准,测得6支电极在缓冲溶液中的电位和斜率(表 1)。结果表明,埋土前3支球泡玻璃电极的斜率为–58.86––58.46 mV/pH,接近标准能斯特斜率–59.16 mV/pH[20];而锥形玻璃电极的斜率为–55.65~–53.65 mV/pH,低于标准能斯特斜率,这可能是由于其H+敏感膜的表面积较小所致。
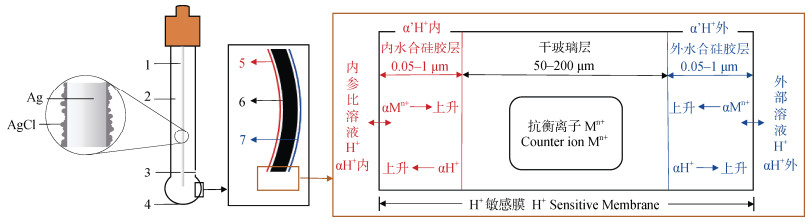
玻璃电极测定土壤pH的理论示意图如图 1所示。图中,球泡玻璃和锥形玻璃指示电极的H+敏感玻璃膜在样品中形成溶胀水合硅胶层,膜内Si-O骨架带负电荷,H+与表面碱金属离子Mn+交换,形成SiO-H+。膜内外溶液pH的差异会影响电荷的重新分布,Mn+与水中的H+发生交换,建立电荷平衡并形成膜电位(图 1)。玻璃敏感膜上的电位随pH的变化而变化。通过将玻璃指示电极与电位固定、受待测液组成变化影响较小且温度系数较小的参比电极(常见参比电极为Ag-AgCl电极和甘汞电极)配合使用,借助电位计将两支电极的电位差转化为电信号,从而准确测定溶液的酸碱度[19-20]。根据能斯特方程,膜电位与H+活度的对数成正比,因此敏感膜上的电位会随pH的变化而变化:
| $ {E_g} = {E_0} - 2.303RT/Z{\text{F}}pH $ | (3) |
|
注:1. Ag/AgCl参比电极,2. 内参比溶液,3. 参比电极孔,4. H+敏感膜,5. 内水合硅酸层,6. 干玻璃层,7. 外水合硅酸层 Note:1. Ag/AgCl reference electrode,2. Internal reference solution,3. Reference electrode hole,4. H+ sensitive membrane,5. Internal hydrated silicone layer,6. Dry glass layer,7. External hydrated silicone layer 图 1 玻璃pH复合电极原理图 Fig. 1 Schematic diagram of the glass combined pH electrode |
式中,Eg和E0分别为玻璃膜电位和标准电极电位,R为气体常数8.315 J· mol–1 ·K–1,T为绝对温度K,Z为离子电荷数,F为法拉第常数96 485 C·mol–1。因此,在25℃条件下,玻璃电极的能斯特斜率为59.16 mV/pH[20]。
当金属Sb电极与待测溶液接触时,Sb金属表面会被氧化生成不同的氧化物(如Sb2O3、SbO2、Sb2O5等)。这些氧化物的解离与溶液中OH–离子的活度相关,因此Sb电极的电势直接与溶液的pH有关,可以通过式(4)描述[20]:
| $ \mathsf{Sb_{2}O_{3}+3H_{2}O \rightleftharpoons 2Sb(OH)_{3} \rightleftharpoons 2Sb^{3+}+6OH^{–}} $ | (4) |
因此,Sb电极电位随溶液pH的变化而发生变化:
| $ \begin{gathered} {E_{{{\text{S}}_{\text{b}}}}} = {E^0}_{{{\text{S}}_{\text{b}}}} + 2.303RT/Z{\text{F}}lg\left( {{K_{\text{s}}}/{K_{\text{w}}}^3} \right) - \hfill \\ 2.303RT/Z{\text{FpH}} \hfill \\ \end{gathered} $ | (5) |
式中,ESb和ESb0分别为Sb电极电位和标准电极电位,Ks和Kw分别为Sb(OH)3的溶度积和水的离子积。
表 1的结果表明,Sb金属电极在埋土前的斜率为–34.38 mV/pH,这与Nair等[16]观测到的Sb电极斜率(–38.2 mV/pH)相似。一般而言,金属Sb电极的斜率较低[16,21],意味着该电极对土壤pH变化的灵敏度较低。这可能主要是由于Sb电极存在不同的氧化态(三价、四价和五价),因此在不同溶液组成和pH范围内,能斯特斜率(2.303RT/ZF)并非严格的常数[20]。因此,玻璃pH电极对介质中H+浓度变化的响应更加灵敏和稳定。通过比较电极电位–pH校准斜率,3种电极性能表现为:球泡玻璃电极>锥形玻璃电极>金属pH电极。
在原位监测过程中,3号球泡玻璃电极不慎碰到电极杆而损坏,说明球泡玻璃电极的机械强度较差。经过350天原位监测,未损坏的两支球泡玻璃电极的斜率分别变化了–0.46和1.8 mV/pH,表现出良好的一致性,证明了球泡玻璃电极在长期监测过程中的稳定性。相比之下,锥形玻璃电极的斜率分别变化了–2.61和–4.89 mV/pH,表现出低于球泡玻璃电极的稳定性。这可能是因为污染物和沉淀物质更容易在电极尖端聚集,而且在非均匀或非流动的液体环境中,锥形玻璃电极的局部电位梯度更大,导致测定结果的一致性降低[22- 23]。虽然金属电极的斜率仅变化了0.64 mV/pH,但考虑到其电位–pH校准斜率低于玻璃电极,本研究认为,在长期监测过程中,3种电极均保持了较好的校准稳定性,但相对而言,球泡玻璃电极>金属pH电极>锥形玻璃电极。
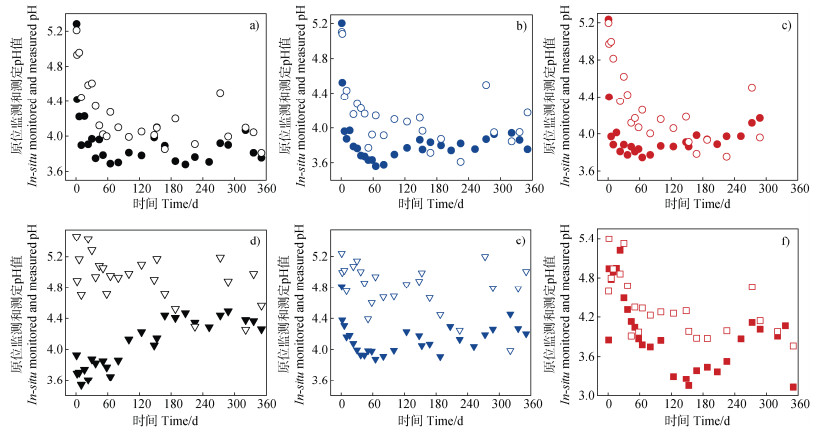
2.2 原位监测与测定土壤pH状况分析电极性能通过电极动态校准公式(式(1)),本研究得到了原位监测和土壤pH测定状况(图 2a–图 2f)。结果表明,3支球泡玻璃电极、2支锥形玻璃电极和1支金属pH电极在原位监测土壤pH时的变异系数分别为8.36%、8.39%、9.63%、9.12%、4.96%和14.85%,均处于弱和中等变异范围[14],说明在整个监测过程中,土壤pH处于相对稳定的状态。金属pH电极在120天后pH大幅降低,随后至240天又逐渐回升并维持稳定。这一现象一方面可能是由于土壤中的氧化还原性物质(如溶解氧、Fe2+、S2–等)、CO2以及各种表面官能团(如羟基、羧基、酚羟基)的存在,影响了Sb金属与H+的反应[20],从而影响电极电位。Pavlov等[24]指出,Sb电极表面同时发生两个相反过程:氧含量的增加倾向于产生较大的正电位,而高级氧化物的还原则会导致更大的负电位。因此,尽管Sb金属对H+具有较好的选择性,但其电位仍然受到多种因素的干扰[20]。
|
注:图中实心和空心符号分别代表原位监测和测定土壤pH。 Note:The solid and hollow symbols represent in situ monitored and measured soil pH values,respectively. 图 2 球泡玻璃电极(a–c)、锥状玻璃电极(d、e)和Sb电极(f)监测与额外锥形玻璃电极原位测定的土壤pH变化 Fig. 2 Changes in soil pH obtained from embedded monitoring spherical(a–c)and conical(d,e)glass combined pH electrodes,and an antimony(Sb)metal pH electrode(f),compared to in situ reference measurements from an additional conical glass electrode |
Eldeeb等[15]进行的一项为期7天的原位土壤研究表明,丝网印刷电极(以Ag/AgCl作参比电极)动态监测土壤pH的误差率低于10%。但需要注意的是,即使是十分之一或百分之一pH单位的变化,也可能是至关重要的。例如,pH降低0.2、0.5甚至1.0个单位时,H +离子活度分别提高了1.58倍、3.16倍和10倍。更为关键的是,0.1单位pH变化导致的H+活度变化在不同的初始pH水平上并不一致。当土壤pH从5.1降至5.0和从4.1降至4.0时,H+活度的变化量相差10倍,分别为2.06×10–6和2.06×10–5 mol·L–1。
进一步采用额外的锥形玻璃电极原位测定土壤pH,得到的变异系数分别为8.73%、8.83%、7.63%、6.31%、6.33%和10.58%(图 2),与原位监测土壤pH的变异范围相似。同时,原位监测和测定得到的红壤pH(除1号锥形玻璃电极监测数据外)均表现为在培养初期(60天内)先下降,随后逐步维持稳定。官鹏等[25]也发现,将风干红壤培养45天后pH降低了0.55个pH单位,并将其归因于有机物分解时产生有机酸,此外,微生物的代谢过程也会产生酸性物质[26]。
将原位监测与同时测定的土壤pH进行比较后发现,球泡玻璃电极、锥形玻璃电极和Sb金属电极在最大pH上的差异分别为0.73、0.63、1.02、2.06、1.14和1.04个pH单位,最小差异分别为0.005、0.02、0.005、0.11、0.12和0.02个pH单位。此外,在大多数情况下,原位监测得到的pH低于测定结果,这可能主要由于参比电极孔或陶瓷片渗漏、污染物与沉淀物质在电极表面聚集[22],以及工作电极或敏感膜周围缺乏物质循环[17]等因素所致。以上信息为合理解读土壤长期原位监测pH数据提供了重要参考。
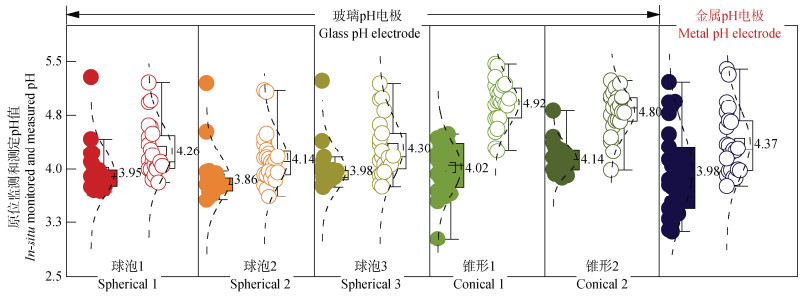
为了更直观地展示三种pH电极原位监测和测定土壤pH的状况,本研究统计了不同pH电极原位监测与额外锥形玻璃pH电极测定得到的土壤pH(图 3)。结果表明,原位监测得到的土壤平均pH分别为3.95、3.86、3.98、4.02、4.12和3.98,而原位测定得到的土壤平均pH分别为4.26、4.14、4.30、4.92、4.80和4.37,均高于原位监测得到的土壤pH。
|
图 3 不同pH电极原位监测(实心)与额外锥形玻璃pH电极测定(空心)值的箱式图 Fig. 3 Box plot comparing in situ monitored soil pH(left)using various pH electrodes and measured soil pH(right)using an additional conical glass pH electrode |
在整个观测期间,两种方法获得的土壤原位pH平均值相差分别为0.30、0.28、0.37、0.92、0.67和0.41个pH单位。由于土壤的异质性,两种观察方式得到的pH可能来源于不同酸碱度的土壤位置,因此无法采集到完全相同的土壤样品。然而,从原位监测与原位测定两种方式得到的土壤pH差异情况来看,三种电极的性能大致表现为:球泡玻璃电极>金属pH电极>锥形玻璃电极。
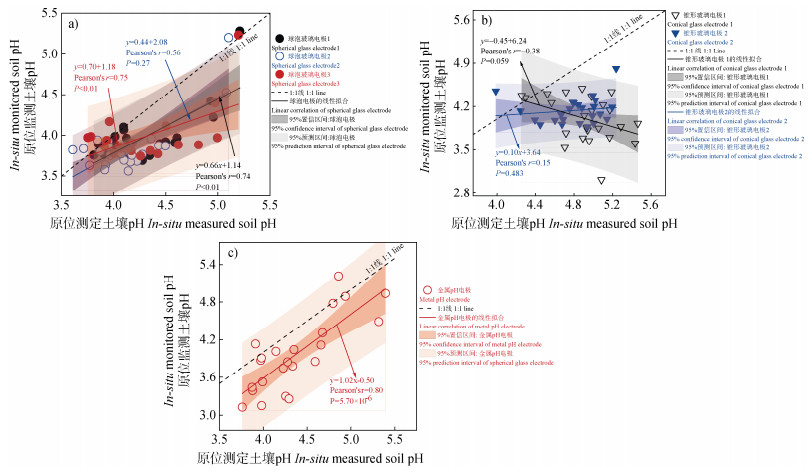
进一步研究三种电极原位监测与测定土壤pH之间的相关性。图 4的结果表明,1–3号球泡玻璃电极和金属pH电极的原位监测与测定pH之间具有极显著相关,皮尔逊相关系数r分别为0.74、0.75、0.56和0.80(P<0.01),而锥形玻璃电极两种方法获得的pH之间无显著相关性,r分别为-0.38和0.15(P>0.05)。因此,针对两种方法获得的土壤pH相关性,三种电极的性能表现为:金属pH电极>球泡玻璃电极>>锥形玻璃电极。考虑到原位监测与测定土壤的异质性、电极校准漂移、工作电极或敏感膜周围缺乏物质循环等因素,通过图 4所建立的原位监测pH与测定pH之间的直线方程,可以进一步提高原位监测红壤酸度状况的准确性。
|
图 4 埋土球泡玻璃电极(a)、锥形玻璃电极(b)和金属pH电极(c)原位监测与额外锥形玻璃电极原位测定土壤pH之间的相关性 Fig. 4 Correlation between soil pH obtained from embedded monitoring electrodes(a,b,and c,representing spherical glass electrodes,conical glass electrodes,and the metal pH electrode,respectively),and in situ measurements using an additional conical glass pH electrode |
将埋土前后电极外观通过数码显微镜放大观察,结果如图 5所示,经过350天的长期埋藏,球泡玻璃电极和锥形玻璃电极表面出现了少量机械损伤痕迹,但整体电极结构保持完好。而Sb金属电极在埋土前表面平滑且具有金属光泽,存在部分氧化现象;然而,在埋土取出后,原本平滑的Sb电极表面被严重腐蚀,金属光泽消失,表面呈现浅灰色(Sb2O3)、白色(Sb2O4)和黄色(Sb2O5)的混合物质。需要注意的是,球泡玻璃电极敏感膜非常薄,在储存、运输和使用中更容易受到损伤,这可能导致电极失效或测定误差的增加。而锥形玻璃电极由于底端的敏感膜接触面积较小,且膜的厚度大于球泡玻璃电极[27],从而更好地保证了电极的机械强度和稳定性。因此,从电极机械强度和H+敏感表面稳定性角度来看,锥形玻璃电极>金属pH电极>球泡玻璃电极。

|
图 5 三种电极埋土前后H+敏感表面变化 Fig. 5 Changes in H+-sensitive surfaces of three types of electrodes before and after embedding them in the soil matrix |
需要注意的是,无论玻璃电极还是Sb金属电极,均需要参比电极配对进行测定。参比电极为pH指示电极提供一个稳定的参比电位,通过与被测溶液的电势差来确定溶液的pH或H+离子浓度[20]。然而,参比电极的内参比溶液在长期埋土过程中会通过参比电极孔或陶瓷片渗漏。因此,将参比溶液制成凝胶状形式会更适用于长期土壤酸碱状况的原位监测。
从以上结果可以看出,球泡玻璃电极和锥状玻璃电极具有较高的灵敏度,确保了长期监测过程中数据的稳定性和准确性[28]。此外,玻璃电极的反应速率较快,提升了实验效率和数据获取的及时性[29]。然而,玻璃电极通常由硅酸钠、氧化钙、稀土氧化物等煅烧制成,在使用过程中容易受到物理损坏,因此在原位监测中建议加装保护装置。而Sb金属电极则具有较高的机械强度,不易损坏,但其灵敏度较差,反应速率较慢[20]。因此,建议在要求高精度pH原位监测的实验中使用加装保护装置的球泡玻璃电极作为指示电极,而在需要进行更长期监测的实验中,则可考虑使用Sb金属电极作为指示电极。
3 结论本研究利用三种pH电极对酸性红壤进行为期350天的pH原位监测,同时原位测定培养土壤pH,结果表明:电极校准斜率和斜率稳定性、原位监测与测定pH差异方面,球泡玻璃电极表现优越;而在电极机械强度、原位监测与测定pH相关性方面,Sb金属电极表现优越。未来可将原位监测技术与智能化和自动化技术相结合,实现土壤pH与其他土壤参数(如水分、温度、盐分、氧化还原电位、溶解氧等)的同步在线监测、数据实时传输和智能分析,以获得更全面准确的土壤参数。此外,还可以考察更多土壤类型,通过土壤传递函数和原位pH变化机理模型进一步提高土壤原位pH监测的精度。
| [1] |
Thomas G W. Soil pH and soil acidity . Madison, WI: Soil Science Society of America, 1996.
(  0) 0) |
| [2] |
Cui J Q, Jiang J, Chang E, et al. Underlying reasons and factors associated with changes in earthworm activities in response to biochar amendment: A review[J]. Biochar, 2023, 5(1): 79. DOI:10.1007/s42773-023-00287-x
(  0) 0) |
| [3] |
Hu Z K, Delgado-Baquerizo M, Fanin N, et al. Nutrient-induced acidification modulates soil biodiversity-function relationships[J]. Nature Communications, 2024, 15(1): 2858. DOI:10.1038/s41467-024-47323-3
(  0) 0) |
| [4] |
Jiang J, Xu R K, Zhao A Z. Surface chemical properties and pedogenesis of tropical soils derived from basalts with different ages in Hainan, China[J]. Catena, 2011, 87(3): 334-340. DOI:10.1016/j.catena.2011.06.016
(  0) 0) |
| [5] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010. DOI:10.1126/science.1182570
(  0) 0) |
| [6] |
Xu R K, Li J Y, Zhou S W, et al. Scientific issues and controlling strategies of soil acidification of croplands in China (In Chinese)[J]. Bulletin of Chinese Academy of Sciences, 2018, 33(2): 160-167. [徐仁扣, 李九玉, 周世伟, 等. 我国农田土壤酸化调控的科学问题与技术措施[J]. 中国科学院院刊, 2018, 33(2): 160-167.]
(  0) 0) |
| [7] |
Zhu Q C, de Vries W, Liu X J, et al. Enhanced acidification in Chinese croplands as derived from element budgets in the period 1980–2010[J]. Science of the Total Environment, 2018, 618: 1497-1505. DOI:10.1016/j.scitotenv.2017.09.289
(  0) 0) |
| [8] |
Nielsen K E, Irizar A, Nielsen L P, et al. In situ measurements reveal extremely low pH in soil[J]. Soil Biology & Biochemistry, 2017, 115: 63-65.
(  0) 0) |
| [9] |
Xu R K, Zhao A Z, Li Q M, et al. Acidity regime of the Red Soils in a subtropical region of Southern China under field conditions[J]. Geoderma, 2003, 115(1/2): 75-84.
(  0) 0) |
| [10] |
Ding C F, Du S Y, Ma Y B, et al. Changes in the pH of paddy soils after flooding and drainage: Modeling and validation[J]. Geoderma, 2019, 337: 511-513. DOI:10.1016/j.geoderma.2018.10.012
(  0) 0) |
| [11] |
Matthiesen H. In situ measurement of soil pH[J]. Journal of Archaeological Science, 2004, 31(10): 1373-1381. DOI:10.1016/j.jas.2004.03.005
(  0) 0) |
| [12] |
Elberling B, Matthiesen H. Methodologically controlled variations in laboratory and field pH measurements in waterlogged soils[J]. European Journal of Soil Science, 2007, 58(1): 207-214. DOI:10.1111/j.1365-2389.2006.00828.x
(  0) 0) |
| [13] |
Merl T, Rasmussen M R, Koch L R, et al. Measuring soil pH at in situ like conditions using optical pH sensors(pH-optodes)[J]. Soil Biology &Biochemistry, 2022, 175: 108862.
(  0) 0) |
| [14] |
Zhang F, Hu W Y, Wang L L, et al. Quick acquisition of black soil pH values from northeast China by portable soil multi-parameter rapid detection instrument (In Chinese)[J]. Acta Pedologica Sinica, 2024, 61(6): 1568-1576. DOI:10.11766/trxb202304200157 [张凤, 胡文友, 王亮亮, 等. 便携式土壤多参数快速检测仪原位测量东北黑土pH[J]. 土壤学报, 2024, 61(6): 1568-1576.]
(  0) 0) |
| [15] |
Eldeeb M A, Dhamu V N, Paul A, et al. Espial: Electrochemical soil pH sensor for in situ real-time monitoring[J]. Micromachines, 2023, 14(12): 2188. DOI:10.3390/mi14122188
(  0) 0) |
| [16] |
Nair N, Akshaya A V, Joseph J. An in situ soil pH sensor with solid electrodes[J]. IEEE Sensors Letters, 2022, 6(8): 2000104.
(  0) 0) |
| [17] |
Unger I M, Muzika R M, Motavalli P P, et al. Evaluation of continuous in situ monitoring of soil changes with varying flooding regimes[J]. Communications in Soil Science and Plant Analysis, 2008, 39(11/12): 1600-1619.
(  0) 0) |
| [18] |
Lu R K. Methods of soil agrochemical analysis (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [19] |
Baucke F G K. The modern understanding of the glass electrode response[J]. Fresenius' Journal of Analytical Chemistry, 1994, 349(8): 582-596.
(  0) 0) |
| [20] |
Yu T R. Electrochemical properties of soil and its research method (In Chinese). 2nd ed[M]. Beijing: Science Press, 1976. [于天仁. 土壤的电化学性质及其研究法[M]. 2版. 北京: 科学出版社, 1976.]
(  0) 0) |
| [21] |
Conkling B L, Blanchar R W. A comparison of pH measurements using the antimony microelectrode and glass electrode[J]. Agronomy Journal, 1988, 80(2): 275-278. DOI:10.2134/agronj1988.00021962008000020025x
(  0) 0) |
| [22] |
Sokirko A V, Oldham K B. The voltammetric response of a conical electrode[J]. Journal of Electroanalytical Chemistry, 1997, 430(1/2): 15-24.
(  0) 0) |
| [23] |
Yang C R, Wu J W, Chang L Y. Design and implementation of a novel conical electrode for fast anodic bonding[J]. Journal of Micromechanics and Microengineering, 2014, 24(10): 105003. DOI:10.1088/0960-1317/24/10/105003
(  0) 0) |
| [24] |
Pavlov D, Bojinov M, Laitinen T, et al. Electrochemical behaviour of the antimony electrode in sulphuric acid solutions—I. Corrosion processes and anodic dissolution of antimony[J]. Electrochimica Acta, 1991, 36(14): 2081-2086. DOI:10.1016/0013-4686(91)85213-Q
(  0) 0) |
| [25] |
Guan P, Wang R H, Shi R Y, et al. Inhibition mechanisms of acidification induced by urea application using organic carbon sources with different availability for microorganisms in Ultisol (In Chinese)[J]. Acta Pedologica Sinica, 2025, 62(1): 81-91. DOI:10.11766/trxb202308140323 [[官鹏, 王如海, 时仁勇, 等. 微生物利用性不同的有机碳源阻控尿素诱导红壤酸化的作用机制[J]. 土壤学报, 2025, 62(1): 81-91.]
(  0) 0) |
| [26] |
Wang C, Yu Q Y, Ji N N, et al. Bacterial genome size and gene functional diversity negatively correlate with taxonomic diversity along a pH gradient[J]. Nature Communications, 2023, 14(1): 7437. DOI:10.1038/s41467-023-43297-w
(  0) 0) |
| [27] |
Yang L, Huang X H. The influence of electrode geometry on mass sensitivity of quartz crystal microbalance[C]//Advances in Computer Science Research. May 29—31, 2015. Jinan, China. Atlantis Press, 2015.
(  0) 0) |
| [28] |
Nussbaum R, Jeanneret S, Bakker E. Increasing the sensitivity of pH glass electrodes with constant potential coulometry at zero current[J]. Analytical Chemistry, 2024, 96(16): 6436-6443. DOI:10.1021/acs.analchem.4c00592
(  0) 0) |
| [29] |
Uchiyama A, Morimoto T, Yoshimura H. Continuous recording of blood pH and its radiotelemetry[J]. The Japanese Journal of Physiology, 1964, 14(6): 630-637. DOI:10.2170/jjphysiol.14.630
(  0) 0) |
 2025, Vol. 62
2025, Vol. 62


