2. 中国科学院大学, 北京 100049;
3. 云南大学农学院, 昆明 650504;
4. 中国林业科学研究院高原林业研究所, 昆明 650233;
5. 云南元谋干热河谷生态系统国家定位观测研究站, 昆明 650233;
6. 云南农业大学热带作物学院, 云南普洱 665000
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. School of Agriculture, Yunnan University, Kunming 650504, China;
4. Institute of Highland Forest Science, Chinese Academy of Forestry, Kunming 650233, China;
5. Yuanmou Desert Ecosystem Research Station, Kunming 650233, China;
6. College of Tropical Crops, Yunnan Agricultural University, Pu'er, Yunnan 665000, China
金沙江干热河谷是我国西南典型的生态环境脆弱区,该区因特殊的地理位置和地形条件形成了全年无冬、高温、少雨且集中的干燥气候。同时,由于地质构造脆弱、土层浅薄,并伴随人类活动的强烈干扰以及水土资源的过度开发等因素,导致土壤暴露和水土流失问题十分严重,极大地阻碍了该区域的社会经济发展[1]。因此,保护和改善当地土壤生态环境具有重要的现实意义。
人工和天然植被恢复一直以来是退化生态系统修复和水土流失综合治理的重要措施[2]。由于不同植被恢复措施在物种种类、种植环境以及地上地下生物量等方面存在差异,所以其对土壤质量和土壤生物的影响具有明显的异质性。通常,自然植被恢复相较于人工恢复能带来更大的生态效益,包括碳储存、水土保持和生物多样性增加等[3]。然而,少数研究却发现合理配置的人工恢复模式对土壤养分累积和酶活性的促进作用显著优于自然植被恢复[4]。这些表明人工和自然植被恢复之间的权衡要充分考虑生态系统功能和生物多样性。在干热河谷地区,根据气候相似性原理选择适宜的树种改善土壤条件已被证实较为有效,如新银合欢(Leucaena leucocephala)、大叶相思(Acacia auriculiformis)和坡柳(Dodonaea viscosa)适合作为改良退化土壤的先锋树种[1,5]。天然植被恢复则以稀树灌草丛的自然演替(即封山育林)为主[2,6]。无论何种植被恢复措施,均会显著影响干热河谷植被群落结构、土壤肥力和水土保持特征,且这种变化存在一定的海拔梯度效应[1,7]。近期研究发现,干热河谷植被会随海拔升高从稀树灌草丛向人工林和天然林逐渐过渡,从而增强植物群落多样性以及土壤孔隙度、养分含量和酶活性等土壤质量状况[6-7]。
线虫是土壤生物群落的主要组成部分,也是地球上迄今为止最丰富的后生动物,约占陆地所有动物数量的4/5[8]。作为评估土壤生态系统健康状况、生态系统演替和受环境干扰程度的指示生物[9],线虫的群落组成、营养类群及生态指数有助于揭示复杂的地下生态系统过程和食物网功能[10-11]。研究表明,人工和天然植被恢复过程会对土壤线虫数量和结构产生差异化影响,且其依赖于水热条件、植物生长和人类干扰等因素[12-14]。例如,自然恢复草地线虫数量显著低于柠条人工林[15],但与天然草地相比,一年生禾本科燕麦人工恢复草地显著增加了线虫群落的数量和多样性[16]。总体而言,土壤线虫的多样性和丰度随植被恢复年限的延长而增加。同时,线虫也可以通过植物-土壤负反馈、改变根际微生物群落和促进养分循环来影响自然植被的生态性能[17]。从全球和区域尺度来看,干旱地区生态系统具有最低的线虫密度,这主要归因于相对较低的土壤水分和养分有效性[9,12,18]。尽管针对干热河谷地区不同植被恢复生态效益已进行了广泛研究[1-2,5-7],但目前关于该区域人工和天然植被恢复过程对土壤线虫群落的影响及其驱动机制尚不明确,尤其是基于不同海拔梯度的研究鲜见报道。
本研究以金沙江干热河谷不同海拔的新银合欢人工林、余甘子(Phyllanthus emblica)天然灌草丛以及清香木(Pistacia weinmannifolia)+ 滇榄仁(Terminalia franchetii)混合天然灌草丛为研究对象,探究人工和天然植被恢复措施对不同海拔土壤线虫群落结构的影响及其主要驱动因子,并比较土壤健康恢复程度,旨在为该区退化土壤生态系统恢复以及植被的可持续经营提供科学依据。
1 材料与方法 1.1 研究区概况研究区位于云南省金沙江干热河谷元谋和永仁段(25°23′—26°06′ N,101°35′—102°06′ E),是该流域干热河谷的典型代表区域。该区为南亚热带干热季风气候,光热资源充足,干湿季分明,年均气温为22 ℃,年均降水量642 mm,年均蒸发量3 911 mm,年日照时数约2 670 h。气候类型与萨王纳稀树草原较为相似。土壤类型以燥红土为主,零星有紫色土和水稻土分布。该区存在典型的天然灌草丛群落,其中优势灌丛为余甘子、滇榄仁、车桑子(Dodonaea viscosa)、华西小石积(Osteomeles schwerinae)和岩柿(Diospyros dumetorum);优势草本为扭黄茅(Heteropogon contortus)、拟金茅(Eulaliopsis binate)、孔颖草(Bothriochloa pertusa)和橘草(Cymbopogon goeringii)。人工植被主要为新银合欢、大叶相思和桉树(Eucalyptus)。干热河谷地区营造新银合欢人工林后,由于其繁殖体快速传播特性,新银合欢逸生种群不断侵入天然灌草丛群落,导致原生植被破碎化以及景观完整性降低[19]。
1.2 试验设置与样品采集选择该区域内低(1 150~1 200 m)、中(1 350~1 400 m)、高(1 550~1 600 m)3个海拔梯度的新银合欢人工林(L,10年生)、余甘子天然灌草丛(P)以及清香木+滇榄仁混合天然灌草丛(TP)为研究对象。每种植被类型设置5个面积为20 m × 20 m的样地,在每个样地的中心和四角分别设置5个2 m × 2 m的土壤样品采集点位。在样方内随机选取3个样点采集0~20 cm的土壤样品,最后将5个样方内共计15个点的土壤混合为一个样品,去除石砾、动植物残体及杂质后,无菌冷藏保存并迅速带回实验室,立即称取鲜样进行线虫的分离,剩余样品进行土壤理化性质测定。同时,在5个样方内进行林下草本群落单位面积地上生物量、地下生物量及凋落物量等的测定。
1.3 线虫的分离和鉴定土壤线虫采用贝尔曼(Baermann)湿漏斗法分离。每个样品称取50 g鲜土,分离的线虫用4 %热福尔马林溶液杀死固定,然后在显微镜下计数并换算为100 g干土中线虫的数量。每个样品随机取100条线虫,参照文献[20]在光学显微镜下进行形态学分类鉴定至属,如果样品中线虫不足100条,则需全部鉴定。依据线虫的头部形态特征及其食性将其划分为4种营养类群:食细菌线虫(Bacterivores,Ba)、食真菌线虫(Fungivores,Fu)、植物寄生线虫(Plant-parasites,Pp)和捕食/杂食线虫(Omnivores-predators,Op),并根据线虫不同属的生活史策略赋予相应的c-p值(1-5)。同时,根据线虫个体数占总数量的比例,将其分为稀有类群(< 1%)、常见类群(1%~10%)和优势类群(> 10%)。
1.4 线虫多样性与生态功能指数计算多样性指数包括Shannon多样性指数(Shannon-Wiener index,H)、均匀度指数(Evenness index,J)、优势度指数(Dominance index,λ)及丰富度指数(Richness index,R),计算如下:
| $ H = –∑P_{i} × \ln P_{i} $ |
| $ J = H/\ln S $ |
| $ λ = ∑P_{i}^{2} $ |
| $ R=(S–1)/\ln N $ |
式中,S为鉴定线虫的属数,N为鉴定的线虫总数,Pi为第i个属线虫所占总数的比例。
生态功能指数包括总成熟度指数(Maturity index,MMI)、植物寄生线虫成熟度指数(Plant parasites index,PPI)、结构指数(Structure index,SI)、富集指数(Enrichment index,EI)、瓦斯乐卡指数(Wasilewska index,WI)、线虫通路比值(Nematode channel ratio,NCR)及线虫代谢足迹(Nematode metabolic footprint,NMF),计算如下:
| $\begin{gathered} \mathrm{MMI}=\sum\left(v_i \times f_i+v_i \times f_i^{\prime}\right) \\ \mathrm{PPI}=\sum v_i \times f_I^{\prime} \\ \mathrm{SI}=100 \times[s /(s+b)] \\ \mathrm{EI}=100 \times[e /(e+b)] \\ \mathrm{WI}=(B+F) / P \\ \mathrm{NCR}=B /(B+F) \\ \mathrm{NMF}=\sum\left\{N_t\left[0.1\left(W_t / m_t\right)+0.273\left(W_t^{0.75}\right)\right]\right\} \end{gathered}$ |
式中,vi表示土壤线虫i类群的c-p值,fi表示自由生活线虫的i类群个体数占群落总个体数的百分比,f´i表示植物寄生线虫的i类群个体数占群落总个体数的百分比。b、e和s对应的值分别为∑kbnb、∑kene和∑ksns,其中kb、ke和ks为各类群所对应的加权数(其值在0.8-5.0之间),而nb、ne和ns则为各类群的相对多度。B和F分别为食细菌和食真菌线虫数量,P为植物寄生线虫数量。Nt是指第t个属的个体数量,Wt和mt分别为第t个属的个体生物量和c-p值。数据来源于加州大学戴维斯分校Ferris建立的网页http://Nemaplex.ucdavis.edu中列出的线虫生物量。
1.5 土壤理化指标测定土壤含水量(SMC)采用烘干法测定。pH采用pH计(FE28-Standard,Mettler-Toledo,中国)测定(水土比2.5︰1)。全碳(TC)和全氮(TN)采用元素分析仪(Vario MAX CN,Elementar,德国)测定。全磷(TP)经HClO4-HF消解后,使用ICP-AES(iCAP6300,Thermo Fisher Scientific,美国)测定。铵态氮(NH4+-N)和硝态氮(NO3–-N)经1 mol·L–1 KCl浸提后用连续流动分析仪(Auto Analyzer 3,SEAL Analytical GmbH,德国)测定。有效磷(Available phosphorus,AP)经0.03 mol·L–1 NH4F-0.025 mol·L–1 HCl提取后,使用连续流动分析仪测定。
1.6 统计分析采用IBM SPSS 20.0、Origin 2018以及Canoco for Windows 5软件进行数据处理与分析。使用单因素方差分析(ANOVA)和多重比较(LSD法,P < 0.05)对线虫多度、营养类群及多样性和生态功能指数等差异进行显著性分析。利用主成分分析法(Principal component analysis,PCA)对不同恢复措施的线虫群落进行排序;采用冗余分析(Redundancy analysis,RDA)解析线虫优势属与植物和环境因子的关系;并用Pearson相关性分析检验植物特征、土壤理化性质与线虫多样性和功能指数的相关性。图表中数据为平均值±标准差。
2 结果 2.1 土壤线虫丰度及营养类群结构特征不同植被类型平均每100 g干土可分离的线虫数量存在差异(图 1)。在低海拔区域,新银合欢人工林(L)具有最高的线虫丰度,可达50 ind·100 g–1干土,而滇榄仁+清香木混合天然草灌丛(TP)线虫丰度最低为10 ind·100 g–1干土。在中高海拔区域,三种植被恢复类型线虫丰度无明显差异。此外,L的线虫丰度在低海拔地区显著高于中海拔,而TP和余甘子天然灌草丛(P)的线虫丰度均无海拔梯度差异。
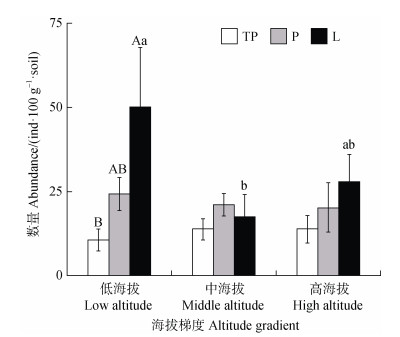
|
注:TP,清香木+滇榄仁混合天然草灌丛;P,余甘子天然灌草丛;L,新银合欢人工林。不同大写字母表示相同海拔不同植被类型之间差异显著,不同小写字母表示同一植被类型不同海拔之间差异显著,无字母标记的表示差异不显著。下同。 Note: Different capital letters indicate significant differences among different vegetation types within the same altitude. Different small letters indicate significant differences among different altitudes within the same vegetation type. No letter marking indicates no significant difference. The same below. 图 1 不同植被类型下土壤线虫丰度 Fig. 1 Abundance of soil nematodes under different vegetation types |
实验共捕获食细菌线虫(Ba)17个属,数量占总数的37.3%;食真菌线虫(Fu)4个属,数量占总数的2.5%;植物寄生线虫(Pp)7个属,数量占总数的7.0%;捕食/杂食线虫(Op)21个属,数量占总数的53.2%(图 2)。不同海拔梯度下各植被类型的土壤线虫营养类群均以食细菌和捕食/杂食线虫为主,食真菌和植物寄生线虫占比较少。在低中海拔区域,L的食细菌线虫比例显著高于TP和P,但捕食/杂食线虫则呈相反趋势。同时,L的捕食/杂食线虫比例随着海拔上升而增加,食细菌线虫则相应减少。
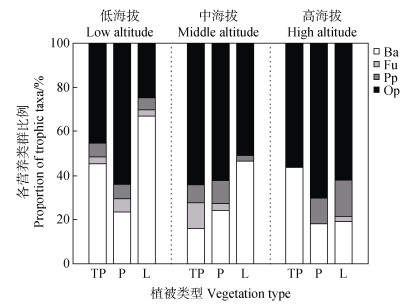
|
注:Ba,食细菌线虫;Fu,食真菌线虫;Pp,植物寄生线虫;Op,捕食/杂食线虫。 Note: Ba, Bacterivores; Fu, Fungivores; Pp, Plant-parasites; Op, Omnivores-predators. 图 2 不同植被类型下土壤线虫各营养类群的比例 Fig. 2 Proportion of nematode trophic taxa under different vegetation types |
不同海拔梯度下各植被类型的土壤线虫生活史比例发生了显著变化(图 3)。三种植被类型的线虫生活史策略组成均以cp-2(14.0%~66.7%)和cp-4(11.6%~61.9%)类群为主。在低海拔区域,各植被类型生活史的占比较为相似;在中海拔P和L的cp-4占比上升,TP的cp-2占比上升;而高海拔P以cp-5为主,L则以cp-2为主。
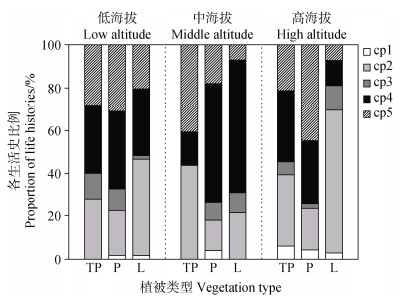
|
图 3 不同植被类型下土壤线虫生活史特征 Fig. 3 Characteristics of nematode life history under different vegetation types |
不同海拔梯度和植被类型均对土壤线虫群落组成结构产生了显著影响(图 4)。PCA分析表明,在低海拔地区TP与P和L存在明显差异,且随着海拔上升差异减小,并在高海拔趋于相似。此外,P的线虫群落组成存在明显的海拔差异;TP的低海拔与中高海拔间差异显著;L的中海拔与高海拔间呈现显著差异。在PC1和PC2轴上,影响线虫群落组成结构的重要属随海拔上升而变化。
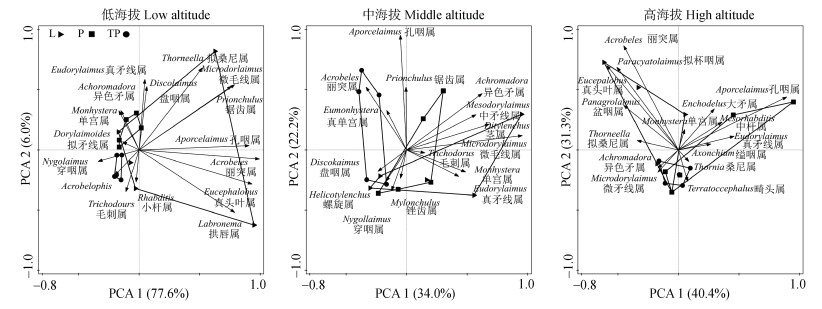
|
图 4 不同植被类型下土壤线虫群落排序 Fig. 4 PCA on nematode community among different vegetation types |
多样性指数(H)和丰富度指数(R)均较高时,表示生态系统具有丰富多样的线虫种属。在低海拔区域,P和L的多样性和丰富度指数显著高于TP(表 1)。随着海拔升高,TP的多样性和丰富度指数逐渐增加,但P则相反。低海拔的L具有较高的多样性和丰富度指数,且显著高于中海拔。
|
|
表 1 不同植被类型土壤线虫多样性和生态功能指数 Table 1 Diversity and ecological function indices of nematodes under different vegetation types |
均匀度指数(J)用来表示线虫的多样性特征,当均匀度指数接近1时,表示各个物种的分布相对均匀。在低中海拔区域,P和L的线虫群落分布较为均匀,但高海拔的TP则呈现最为均匀的分布。优势度指数(λ)用来描述生态系统中某一物种相对于其他物种的相对丰度或优势地位的指标,其值越小表示该区域内线虫分布越均匀,这与均匀度指数表现一致。在低高海拔区域,L呈现出较低的优势度和均匀度指数,而在中海拔区域,较大的优势度指数对应较高的均匀度指数,这可能意味着该区域生态稳定性较差。
成熟度指数(MMI、PPI)范围为0~4,总成熟度指数越大,植物寄生线虫成熟度指数越小,表明土壤线虫的健康状况越好,环境受干扰强度越小,线虫群落更为稳定。在不同海拔区域,L的总成熟度指数均较低于TP和P,尤其是高海拔,其稳定性较差。同时,植食性线虫捕获数量较少,不同海拔各植被类型均呈现出较低的植物寄生线虫成熟度指数。在高海拔区域,TP的植物寄生线虫成熟度指数显著高于P和L,且显著大于中低海拔。
线虫通道指数(NCR) > 0.5,瓦斯乐斯卡指数(WI) > 1,表明该地呈相对健康的状态,且腐屑食物网的分解途径主要依靠细菌。在高海拔区域,各植被类型均符合上述条件,表明该区土壤线虫类群整体以食细菌线虫为主,矿化途径主要由食细菌真菌线虫参与。
2.4 土壤线虫区系分析和代谢足迹基于土壤线虫功能团划分的象限可以分析线虫食物网所受干扰程度和土壤的健康状况。A功能区线虫受干扰程度高,食物网不稳定;B功能区线虫不受环境干扰,土壤健康状况良好,食物网稳定;C功能区线虫受干扰程度低或中等,使得食物网较为稳定;D功能区土壤养分贫乏,养分枯竭,线虫群落受到胁迫,导致食物网退化。不同海拔植被类型的线虫区系均位于C象限(图 5),表明受干扰程度低,土壤食物网结构较为稳定,且中海拔区域的P位于B、C象限交界,相较于其余区域,土壤食物网更为稳定。
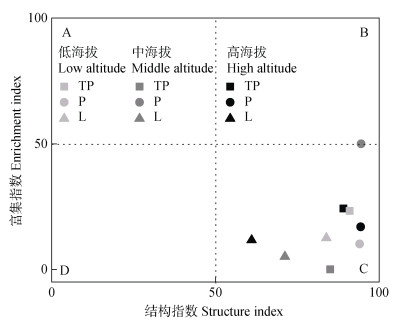
|
图 5 不同植被类型的土壤线虫食物网结构富集图 Fig. 5 Enrichment diagram of nematode food web structure under different vegetation types |
各植被类型均以捕食/杂食和食细菌线虫代谢足迹为主(图 6)。在低海拔区域,L的食细菌线虫代谢足迹显著高于P和TP,而中海拔区域,P的食细菌和捕食/杂食线虫代谢足迹均显著高于L。此外,TP的捕食/杂食线虫代谢足迹呈现随海拔增加而降低,而食细菌线虫代谢足迹则表现相反。P低中海拔的捕食/杂食线虫代谢足迹显著高于高海拔。低海拔的L捕食/杂食线虫和食细菌线虫代谢足迹最高,分别为8.6 μg·100 g–1和6.0 μg·100 g–1,且显著高于中高海拔。
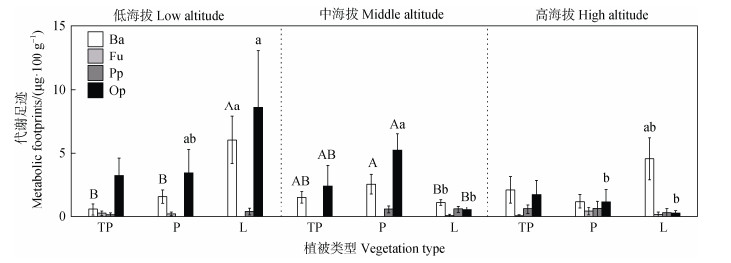
|
图 6 不同植被类型各营养类群线虫代谢足迹 Fig. 6 Metabolic footprints of nematode under different vegetation types |
RDA分析表明,土壤理化性质对线虫群落组成有着显著影响,其中NO3–-N(贡献为25.2%)、AP(15.1%)及含水量(14.1%)是影响线虫群落组成的主要因素(图 7)。NO3–-N与优势线虫丽突属、真头叶属、锯齿属正相关;AP与丽突属、中矛线属、孔咽属正相关。Pearson相关分析表明,土壤和植物特性对线虫群落结构和生态指数也有一定影响(图 8)。NO3–-N与线虫丰度、属数、多样性指数、丰富度指数及总代谢足迹呈显著正相关,但与总成熟度指数呈显著负相关。TC与线虫数量和多样性指数呈显著负相关。此外,凋落物量与均匀度指数和线虫通道指数呈显著负相关。
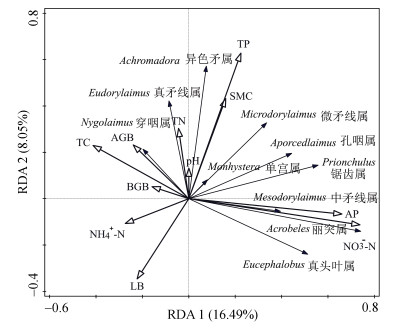
|
注:SMC,土壤含水量;TC,全碳;TN,全氮;TP,全磷;NH4+-N,铵态氮;NO3–-N,硝态氮;AP,有效磷;AGB,地上生物量;BGB,地下生物量;LB,凋落物量。下同。 Note: SMC, Soil moisture content; TC, total carbon; TN, total nitrogen; TP, total phosphorus; NH4+-N, ammonium nitrogen; NO3–-N, nitrate nitrogen; AP, available phosphorus; AGB, aboveground biomass; BGB, belowground biomass; LB, litter biomass. The same below. 图 7 土壤线虫群落与土壤和植物特性的冗余分析 Fig. 7 RDA of soil nematode communities and soil and plant characteristics |
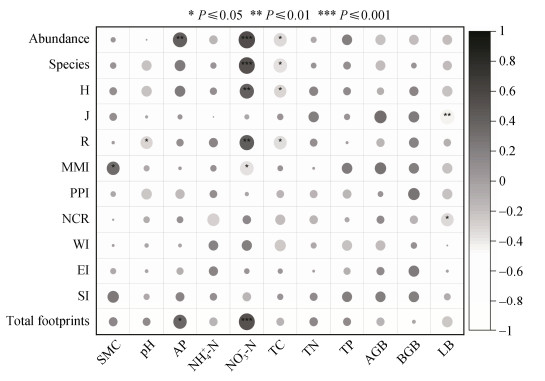
|
图 8 土壤线虫生态指数与植物和土壤特性的相关性 Fig. 8 Correlation between ecological indices of soil nematode and soil and plant characteristics |
总体而言,金沙江干热河谷土壤线虫群落的优势属为孔咽属(Aporcelaimus)、丽突属(Acrobeles)和微矛线属(Microdorylaimus),常见属为真头叶属(Eucephalobus)、单宫属(Monhystera)、真矛线属(Eudorylaimus)和锯齿属(Prionchulus)。人工植被和不同天然灌草丛的土壤线虫营养类群结构存在差异,表明树种特性对线虫营养类型结构具有显著影响[15,21]。同时,真矛线属、孔咽属、单宫属在低、中、高海拔区域均有分布,说明这些属的生命周期特征(即长寿命和低繁殖率)及其生存策略能够适应干热河谷土壤环境[22]。
在低海拔区域,新银合欢人工林(L)的线虫丰度最高(图 1),这一现象与造林扰动会降低线虫丰富度和多样性的结果不一致[23]。这可能是由于在干热河谷采取的粗放式人为管理促进了线虫的繁殖生长。养分和水分有效性及适宜温度通常是控制线虫丰度和分布的重要因素[8-10]。新银合欢作为典型的豆科固氮植物,其发达的根系不仅具有土壤固定效应和结构改良作用[19],还会增加该地区线虫的丰度。然而,余甘子灌草丛(P)土壤无机氮较为缺乏,而氮添加能够显著提高线虫丰度和多样性,并增加食真菌线虫的比例[24],这解释了为何P区线虫丰度低于L。此外,清香木是干热河谷植被恢复过程中的先锋树种,常伴生于疏序黄荆(Vitexnegundof Laxipaniclata)+滇榄仁群落。前期研究表明,清香木群落是植被演替早期阶段[6],而线虫的丰度和多样性一般会随演替或植被恢复进程而相应增加[13]。因此,在清香木+滇榄仁灌草丛(TP)的三种海拔梯度中线虫丰度普遍较低。
食细菌线虫和捕食/杂食线虫是干热河谷地区线虫的主要营养类群(图 2)。食细菌线虫可通过取食活动加速微生物周转,并释放微生物所固持的养分,从而促进植物生长[25]。捕食/杂食线虫通常出现在未受干扰的环境中,且在三种植被类型中占比均较高。这表明土壤线虫食物网具有较多的营养层次,且土壤环境相对稳定。随着海拔的升高,L中捕食/杂食线虫逐步增加,而食细菌线虫则逐步减少。这主要因为海拔越高土壤养分含量和酶活性也随之增强[1,7],导致更多的无机氮被植物吸收,从而抑制细菌分解途径的发展,直接造成了食细菌线虫的数量显著下降。此外,根茎是影响植物健康的重要因素,而植物寄生线虫会引起根部损伤,导致病原体定植[25-26]。在高海拔区域,TP未发现植物寄生线虫,这表明该区域土壤环境最为稳定;而L出现最高的植物寄生线虫分布,也进一步证实其系统稳定性低于中低海拔地区。
3.2 不同植被类型对线虫生态功能的影响不同植被类型和海拔梯度下的线虫多样性和生态功能指数能够有效反映其群落结构和生活史多样性的变化,并表征土壤食物网的结构和功能特征,为综合评价土壤生态系统的恢复状况提供依据[10,14]。随着海拔升高,TP的线虫多样性指数逐渐增加(表 1),说明该类型在高海拔具有丰富的群落结构,更适于干热河谷高海拔。相反,P的线虫多样性指数随海拔升高而下降,说明以余甘子为主的天然灌草丛更适于干热河谷低海拔。此外,L的线虫多样性指数总体呈以中海拔为最低的“V”型变化趋势,这与该区域较高的水分和养分含量密切相关。尽管植物物种的增加和温湿度上升会提高线虫类群丰富度[8,12],但干热河谷天然灌草丛在极端高温条件下情况并非如此,所以需要进一步探索不同恢复措施和海拔的交互效应引起的温湿度差异对线虫群落的影响。
cp值作为描述线虫群落特征和生活史策略的指数,代表不同的繁殖能力以及对外界干扰的敏感程度。cp1-2类群偏向于r-对策者,cp3-5类群偏向于k-对策者;cp-1类群对外界的抗压能力最强,繁殖周期最短,cp-5类群对外界干扰最为敏感,且世代周期最长[8,14]。本研究捕获的线虫以cp-2、cp-4和cp-5为优势类群(图 3),说明干热河谷偏向适应稳定环境和竞争力强的k-对策者。在低海拔区域的TP及中海拔的L和P具有较高的k-对策者比例,反映线虫群落在食物网中连接更多的节点。然而,在高海拔区域,L则偏向于r-对策者(以cp值较低的丽突属、真头叶属和单宫属为主),说明该地区土壤生态系统稳定性较差,这也被最低的总成熟度指数所印证。植物寄生线虫成熟度指数则指示植物寄生线虫r-选择和k-选择的比例,反映植物寄生线虫的抗干扰能力和繁殖能力。在高海拔区域,TP具有最高的植物寄生线虫成熟度指数(表 1),表明植物寄生线虫在土壤食物网中的危害较大,食物网的结构和功能不稳定,抗外界干扰能力变弱,土壤生态环境逐渐退化[12,15,26]。
3.3 不同植被类型对线虫代谢足迹的影响线虫的代谢足迹反映了其在生物量增长和呼吸过程中所消耗的碳量,为土壤食物网中碳和能流的大小等提供了重要信息,并表征了线虫对土壤生态系统功能和服务程度的贡献[27]。具体而言,食细菌、食真菌和植物寄生线虫代谢足迹分别指示通过细菌、真菌和植物通道进入土壤食物网的碳与能量,而捕食/杂食线虫代谢足迹则为进入较高营养级的捕食杂食性线虫类群的碳与能量。总体而言,不同海拔区域各植被类型的土壤食物网碳和能量均以食细菌和捕食杂食通道为主(图 6),表明随着生态系统资源输入引发的上行效应使得被捕食者的生产力和代谢活动增强,从而维持了系统的代谢平衡[24]。低海拔区域的L、中海拔的P以及高海拔的TP均表现出最高的总代谢足迹,说明这些植被覆盖区内线虫群落对碳资源利用率更高,其调控食物网以及维持栖息地中被捕食者与捕食者种群间代谢平衡关系的能力更强。另一方面,干热河谷不同植被类型的凋落物积累会为土壤动物创造多样的小气候条件。同时,由于海拔梯度驱动的温湿度等环境因素波动,使得资源的可利用性在时空上呈现出更大的差异,从而促进了线虫群落代谢足迹的变化[13]。
3.4 线虫群落的主要驱动因素土壤资源的有效性会对线虫群落组成产生重要影响,并引起土壤食物网的结构和功能的变化[8,28]。在干热河谷三种植被恢复过程中,土壤含水量、NO3–-N和AP是影响土壤线虫群落组成与结构的关键因子(图 7和图 8)。线虫通常栖息在土壤间隙的水膜中,所以其对土壤水分的变化非常敏感,尤其是处于较高营养级的捕食/杂食线虫类群[12]。同时,土壤水分对两种捕食/杂食优势属(孔咽属和锯齿属)产生正向影响,而对食细菌常见属(真头叶属)则产生负向影响。后者作为被捕食者受到捕食/杂食类群的调控,这与半干旱地区人工植被恢复对线虫群落特征的影响研究结果相一致[28]。土壤含水量与总成熟度指数的正相关关系也印证了这一点。因此,在干热河谷长期干旱的土壤环境中[19],线虫群落结构更容易受到水分胁迫的影响。此外,土壤NO3–-N和AP作为该区极度匮乏的养分[1,7],正向调节线虫丰度和多样性以及丽突属和真头叶属,但TC则呈现相反趋势,表明线虫的数量和多样性可以有效指示干热河谷地区土壤养分的有效性,从而间接影响植被的生产力水平[17,29]。这一结果也说明,干热河谷地区有效养分的缺乏对线虫群落的驱动作用要强于丰富的全量养分。相比之下,部分研究发现,土壤NH4+-N和可溶性有机碳是影响不同人工恢复年限和次生演替过程中线虫群落变化的主要因素[30]。随着海拔升高,各植被类型中NH4+-N的适量增加在一定程度上促进了细菌优势菌群繁殖,从而提高了捕食/杂食线虫的比例(图 1)。然而,NH4+-N的富集及其引发的土壤酸化通常会对线虫群落产生不利影响[30],且这种负面效应不依赖于氮素形态和植物生长阶段[31-32]。总体而言,在不同植被恢复过程中,土壤资源有效性的协同变化(尤其是相对含量最低的水分和养分—即最小资源限制)通过影响微生物群落,改变不同营养类群线虫的食物资源状况,从而决定了线虫食物网的稳定性。
4 结论金沙江干热河谷土壤线虫群落结构特征及其代谢足迹在海拔梯度上呈现显著分异规律,人工恢复与天然恢复植被类型在土壤健康和稳定状况上存在明显差异。不同海拔各植被类型土壤线虫营养类群均以捕食/杂食和食细菌线虫为主,而植物寄生和食真菌线虫丰度较低,且类群倾向于k-对策者。随着海拔升高,TP线虫群落的多样性和稳定性逐渐增加,而P线虫群落呈现相反趋势,L则为以中海拔达到最低的“V”字形变化。同时,三种植被类型,尤其是低海拔区域的人工植被恢复,有助于增强食细菌和捕食/杂食线虫的代谢足迹,食物网处于较为稳定的代谢平衡状态。此外,土壤水分、NO3–-N和AP是影响该区线虫群落组成的重要因素。因此,在后续干热河谷植被恢复过程中,应优先考虑低海拔地区以新银合欢的人工恢复为主,同时加强中、高海拔单一和混合天然灌草丛的保护,以防止土壤生态系统逐渐退化。
| [1] |
Ruan C M, Tang G Y, Du S K, et al. Stoichiometry of soil carbon, nitrogen, phosphorus and enzyme activities at various elevations in the dry-hot valley of the Jinsha River (In Chinese)[J]. Southwest China Journal of Agricultural Sciences, 2023, 36(11): 2464-2472. [阮长明, 唐国勇, 杜寿康, 等. 金沙江干热河谷不同海拔土壤碳氮磷化学计量和酶活性研究[J]. 西南农业学报, 2023, 36(11): 2464-2472.]
(  0) 0) |
| [2] |
Pei J, Yang W, Cai Y P, et al. Relationship between vegetation and environment in an arid-hot valley in southwestern China[J]. Sustainability, 2018, 10(12): 4774. DOI:10.3390/su10124774
(  0) 0) |
| [3] |
Hua F Y, Bruijnzeel L A, Meli P, et al. The biodiversity and ecosystem service contributions and trade-offs of forest restoration approaches[J]. Science, 2022, 376(6595): 839-844. DOI:10.1126/science.abl4649
(  0) 0) |
| [4] |
Jin Z, Li X R, Wang Y Q, et al. Comparing watershed black locust afforestation and natural revegetation impacts on soil nitrogen on the Loess Plateau of China[J]. Scientific Reports, 2016, 6: 25048. DOI:10.1038/srep25048
(  0) 0) |
| [5] |
Gao C J, Li K, Tang G Y, et al. Nutrient accumulation and cycling in pure and mixed plantations of Azadirachta indica and Acacia auriculiformis in a dry-hot valley, Yunnan Province, southwest China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2014, 25(7): 1889-1897. [高成杰, 李昆, 唐国勇, 等. 云南干热河谷印楝和大叶相思人工纯林与混交林养分循环特征[J]. 应用生态学报, 2014, 25(7): 1889-1897.]
(  0) 0) |
| [6] |
Yu J E, Si H M, Wu X T, et al. Characteristics of plant communities in Yuanmou dry-hot valley under different elevation gradients (In Chinese)[J]. Ecology and Environmental Sciences, 2018, 27(11): 2017-2022. [余娇娥, 司宏敏, 吴雪涛, 等. 海拔梯度下元谋干热河谷植物群落特征[J]. 生态环境学报, 2018, 27(11): 2017-2022.]
(  0) 0) |
| [7] |
Ruan C M, Wang M, Sun Y Y, et al. Characteristics of soil fertility and the influencing factors in the hot-dry valley of Jinsha River (In Chinese)[J]. Chinese Journal of Soil Science, 2024, 55(1): 93-101. [阮长明, 王猛, 孙永玉, 等. 金沙江流域干热河谷土壤肥力特征及其影响因素[J]. 土壤通报, 2024, 55(1): 93-101.]
(  0) 0) |
| [8] |
van den Hoogen J, Geisen S, Routh D, et al. Soil nematode abundance and functional group composition at a global scale[J]. Nature, 2019, 572(7768): 194-198. DOI:10.1038/s41586-019-1418-6
(  0) 0) |
| [9] |
Zhou J, Wu J P, Huang J X, et al. A synthesis of soil nematode responses to global change factors[J]. Soil Biology & Biochemistry, 2022, 165: 108538.
(  0) 0) |
| [10] |
Liang S W, Liu X T, Li Y B, et al. Recent research progress of soil nematode ecology in China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2024, 35(8): 2282-2290. [梁思维, 刘笑彤, 李英滨, 等. 我国土壤线虫生态研究新进展[J]. 应用生态学报, 2024, 35(8): 2282-2290.]
(  0) 0) |
| [11] |
Deng J J, Fang S, Fang X M, et al. Forest understory vegetation study: Current status and future trends[J]. Forestry Research, 2023, 3: 6.
(  0) 0) |
| [12] |
Song D G, Pan K W, Tariq A, et al. Large-scale patterns of distribution and diversity of terrestrial nematodes[J]. Applied Soil Ecology, 2017, 114: 161-169. DOI:10.1016/j.apsoil.2017.02.013
(  0) 0) |
| [13] |
Shao Y H, Wang Z Y, Liu T, et al. Drivers of nematode diversity in forest soils across climatic zones[J]. Proceedings of the Royal Society B: Biological Sciences, 2023, 290(1994): 20230107. DOI:10.1098/rspb.2023.0107
(  0) 0) |
| [14] |
Biswal D. Nematodes as ghosts of land use past: Elucidating the roles of soil nematode community studies as indicators of soil health and land management practices[J]. Applied Biochemistry and Biotechnology, 2022, 194(5): 2357-2417. DOI:10.1007/s12010-022-03808-9
(  0) 0) |
| [15] |
Wang N, Huang J H, Huo N, et al. Characteristics of soil nematode community under different vegetation restoration approaches in the mountainous region of southern Ningxia: A comparative study based on morphological identification and high-throughput sequencing methods (In Chinese)[J]. Biodiversity Science, 2021, 29(11): 1513-1529. [王楠, 黄菁华, 霍娜, 等. 宁南山区不同植被恢复方式下土壤线虫群落特征: 形态学鉴定与高通量测序法比较[J]. 生物多样性, 2021, 29(11): 1513-1529.]
(  0) 0) |
| [16] |
Wei X, Li Y, Wu P F. Effects of artificial grasslands with different forage species on soil nematode communities on the Qinghai-Tibetan Plateau (In Chinese)[J]. Acta Ecologica Sinica, 2022, 42(3): 1071-1087. [魏雪, 李雨, 吴鹏飞. 青藏高原不同牧草人工草地对土壤线虫群落的影响[J]. 生态学报, 2022, 42(3): 1071-1087.]
(  0) 0) |
| [17] |
Wilschut R A, Geisen S. Nematodes as drivers of plant performance in natural systems[J]. Trends in Plant Science, 2021, 26(3): 237-247. DOI:10.1016/j.tplants.2020.10.006
(  0) 0) |
| [18] |
Lu L L, Li G, He N P, et al. Drought shifts soil nematodes to smaller size across biological scales[J]. Soil Biology & Biochemistry, 2023, 184: 109099.
(  0) 0) |
| [19] |
Luo M M, Mao J Y, Shi R, et al. Characteristics of particulate organic carbon and nitrogen in soil of Leucaena leucocephala plantation in the dry-hot valley (In Chinese)[J]. Forest Research, 2022, 35(1): 40-47. [罗明没, 毛姣艳, 师睿, 等. 干热河谷新银合欢人工林土壤颗粒态有机碳氮特征[J]. 林业科学研究, 2022, 35(1): 40-47.]
(  0) 0) |
| [20] |
Yin W Y. Pictorical keys to soil animals of China[M]. Beijing: Science Press, 1998.
(  0) 0) |
| [21] |
Tu C W, Zhang A J, Luo R Y, et al. Linking nematode trophic diversity to plantation identity and soil nutrient cycling[J]. Geoderma, 2024, 448: 116945. DOI:10.1016/j.geoderma.2024.116945
(  0) 0) |
| [22] |
Simmons B L, Wall D H, Adams B J, et al. Long-term experimental warming reduces soil nematode populations in the McMurdo Dry Valleys, Antarctica[J]. Soil Biology & Biochemistry, 2009, 41(10): 2052-2060.
(  0) 0) |
| [23] |
de Lima da Silva J V C, Hirschfeld M N C, Cares J E, et al. Land use, soil properties and climate variables influence the nematode communities in the Caatinga dry forest[J]. Applied Soil Ecology, 2020, 150: 103474. DOI:10.1016/j.apsoil.2019.103474
(  0) 0) |
| [24] |
Kou Z Y, Li C Y, Xiao F J, et al. Effects of nitrogen and phosphorus addition on soil nematode communities and energy structure in Loess Plateau farmland (In Chinese)[J]. Acta Ecologica Sinica, 2024, 44(5): 1962-1971. [寇钊阳, 李春越, 肖凤娇, 等. 氮磷添加对黄土旱塬农田土壤线虫群落及能量结构的影响[J]. 生态学报, 2024, 44(5): 1962-1971.]
(  0) 0) |
| [25] |
Zhang C Z, Wright I J, Nielsen U N, et al. Linking nematodes and ecosystem function: A trait-based framework[J]. Trends in Ecology & Evolution, 2024, 39(7): 644-653.
(  0) 0) |
| [26] |
Li G, Liu T, Whalen J K, et al. Nematodes: An overlooked tiny engineer of plant health[J]. Trends in Plant Science, 2024, 29(1): 52-63. DOI:10.1016/j.tplants.2023.06.022
(  0) 0) |
| [27] |
Ferris H. Form and function: Metabolic footprints of nematodes in the soil food web[J]. European Journal of Soil Biology, 2010, 46(2): 97-104. DOI:10.1016/j.ejsobi.2010.01.003
(  0) 0) |
| [28] |
Wang N, Huang J H, Huo N, et al. Characteristics of soil nematode communities in Caragana korshinskii plantations with different stand ages in semi-arid region of Loess Plateau, Northwest China (In Chinese)[J]. Chinese Journal of Ecology, 2022, 41(2): 236-245. [王楠, 黄菁华, 霍娜, 等. 黄土高原半干旱区不同林龄柠条人工林土壤线虫群落特征[J]. 生态学杂志, 2022, 41(2): 236-245.]
(  0) 0) |
| [29] |
Li Y J, Yang G P, Neher D A, et al. Status of soil nematode communities during natural regeneration of a subtropical forest in southwestern China[J]. Nematology, 2015, 17(1): 79-90. DOI:10.1163/15685411-00002853
(  0) 0) |
| [30] |
Xing W, Lu X M, Geng S B, et al. Mechanisms underlying the negative effects of nitrogen addition on soil nematode communities in global grassland ecosystems[J]. Geoderma, 2023, 436: 116564. DOI:10.1016/j.geoderma.2023.116564
(  0) 0) |
| [31] |
Asiedu O, Kwoseh C K, Melakeberhan H, et al. Nematode distribution in cultivated and undisturbed soils of Guinea Savannah and Semi-deciduous Forest zones of Ghana[J]. Geoscience Frontiers, 2019, 10(2): 381-387. DOI:10.1016/j.gsf.2017.07.010
(  0) 0) |
| [32] |
Pan K W, Gong P M, Wang J C, et al. Applications of nitrate and ammonium fertilizers alter soil nematode food webs in a continuous cucumber cropping system in Southwestern Sichuan, China[J]. Eurasian Journal of Soil Science, 2015, 4(4): 287-300.
(  0) 0) |
 2026, Vol. 63
2026, Vol. 63


