自20世纪以来,全球平均气温升高超过1.1 ℃[1]。气候变暖已成为当前面临的重要气候变化挑战,会对陆地生态系统碳循环过程和碳汇功能产生深刻影响。根据模型预测,气温升高会引起土壤有机碳(Soil Organic Carbon,SOC)的净损失[2],当SOC在增温2 ℃条件下达到稳定状态时,全球SOC库存将平均下降4%(约80 Pg)[3]。在全球变暖背景下,SOC循环的动态变化不仅揭示了生态系统中碳的流动与储存状况,还反映了生态系统对全球气候变化的敏感度和适应能力[4]。在SOC的转化过程中,微生物扮演着“双重角色”,一方面作为“分解者”促进SOC分解,释放CO2到大气中;另一方面作为“贡献者”通过同化固持碳素促进SOC的形成和积累[5]。越来越多的研究表明,微生物同化代谢介导的细胞残体迭代积累(即微生物碳泵机制)在SOC形成和长期截获过程中发挥重要作用[6]。Liang等[7]研究表明在温带生态系统中微生物残体对SOC的贡献超过50%。最近,宋文婕等[8]结合Wang等[9]的全球范围数据分析发现,在全球尺度上微生物残体占SOC的比例高达46.47%。因此,明确气候变暖对土壤微生物残体积累及其对有机碳截获贡献的影响对揭示微生物调控生态系统固碳过程和机制至关重要。
微生物残体积累及其对SOC库的贡献受到生物和非生物因素的综合调节,包括植物残体输入的数量和质量[10]、微生物特性及土壤理化性质[9]。温度升高会引起地上和地下植物碳输入及土壤环境因子的改变[11],从而影响微生物的生长、群落结构和代谢活性,并导致微生物残体积累效率和数量变化[12],最终对微生物调控的土壤碳截获过程产生深刻影响。关于气候变暖背景下,不同生态系统中微生物残体积累动态及其影响因素的研究受到了广泛学者关注。例如,Zeng等[13]通过研究青藏高原和神农架山地系统中不同温度梯度下微生物残体对SOC的贡献,发现局部增温会促进微生物残体分解,进而减少土壤碳储量。Liang等[14]研究表明在干旱草原生态系统中,气候变暖通过减少土壤含水量和引起热胁迫来削弱微生物残体的合成和积累。相反,Ding等[15]发现升温会促进高寒草甸生态系统中微生物残体对有机碳积累的贡献。可见,由于研究地所在气候区、植被及土壤生物特性等方面的差异,气候变暖对微生物残体的积累及其对有机碳库贡献的影响程度和方向存在不确定性,基于现有研究的整合分析还相对有限。Han等[16]对142项增温试验数据进行整合分析发现,变暖会促进陆地生态系统中微生物残体的积累。然而,已有关于增温对微生物残体积累影响的研究主要集中在表层土壤,而对底层土壤微生物残体对气候变化的响应规律和驱动因素尚不明确,这限制了持续气候变化背景下评估微生物对土壤碳截获的贡献及预测深层土壤碳动态的能力[17]。
底层土壤(> 20 cm)作为陆地生态系统重要的碳储库,占超过全球总碳储量的50%[18]。研究表明,与表层土壤相比,底层土壤碳库对气候变暖的响应可能更敏感[19]。由于底层土壤中植物残体和根际沉积物中输送的碳底物较少,微生物残体对SOC的贡献可能比表层土壤更为关键[20]。底层SOC含量相对较低,微生物群落以寡养菌为主,微生物从植物残体和根际沉积物中获取的可利用底物较少,更容易受到碳源和养分等基质限制[20]。Cai等[21]研究发现,气候变暖促进高寒草甸生态系统中微生物残体的积累及其对SOC的贡献,且随着土壤深度的增加残体组成逐渐从真菌残体转向细菌残体。而Liu等[22]发现,增温导致森林生态系统中土壤微生物残体的积累减少,且底层较表层土壤减少更多,但增温仅显著降低表层土壤中细菌残体对SOC的贡献。考虑到碳源可利用性、微生物群落结构和土壤性质随深度变化的不同,底层土壤中微生物同化代谢介导的残体积累和影响因素可能与表层土壤不同。目前关于气候变暖对微生物残体影响的研究,尚缺乏以整合分析手段系统探究表层和底层土壤微生物残体对增温的响应机制,这方面信息的获取将更有助于全面揭示土壤微生物碳泵介导的储碳机制与环境响应策略。
为此,本研究通过整合现有公开发表的增温试验数据(41组总氨基糖、69组氨基葡萄糖、69组胞壁酸、26组氨基半乳糖数据),利用Meta分析方法,系统分析增温对不同生态系统中表层和底层土壤微生物残体积累的影响,揭示不同生态系统中表土和底土微生物残体及其对土壤有机碳库贡献比例对增温的差异性响应规律,明确增温幅度和增温年限对不同土层微生物残体积累的影响,以期为气候变化背景下准确预测和评估土壤有机碳库对气候变化的敏感性及其反馈机制提供参考依据。
1 材料与方法 1.1 数据收集本研究在Web of Science(http://www.webofknowledge.com)和中国知网(https://www.cnki.net)数据库中以"microbial residues" or "microbial necromass" or "bacterial residues" or "bacterial necromass" or "fungal residues" or "fungal necromass"和"warming" or "temperature increas*" or "improv* temperature" or "climat* change" or "elevated temperature"和"subsoil" or "topsoil" or "soil depth" or "soil layer"为关键词进行文献搜索。按照以下标准筛选文献:(1)研究必须包括对照和增温处理(所有增温水平均高于试验对照水平),在相同的非生物和生物条件下进行的不同处理至少有三个重复。(2)研究至少包含两个土层。在本篇Meta分析工作中,若文献仅包含两个土层,则将表层土壤归为“表土”类别,而下层土壤归为“底土”类别;若超过两个土层,则将0~20 cm土层归为“表土”类别,20~40 cm土层归为“底土”类别[23]。(3)文献中至少包含氨基葡萄糖(Glucosamine,GluN)或胞壁酸(Muramic Acid,MurA)其中之一。若文献中无总氨基糖浓度,可将GluN、MurA和氨基半乳糖(Galactosamine,GalN)的浓度总和作为其值。(4)若文献中仅有真菌残体碳(Fungal Necromass Carbon,FNC)和细菌残体碳(Bacterial Necromass Carbon,BNC),无氨基糖浓度,可使用转换因子计算,公式[7]如下:
| $ {\text{FNC}} = ({\text{GluN}}/179.17 - 2 \times {\text{MurA}}/251.23) \times 179.17 \times 9 $ | (1) |
| $ \text{BNC=MurA×45} {\text{BNC}} = {\text{MureA}} \times 45 $ | (2) |
式中,179.17和251.23分别为GluN和MurA的分子量。9为GluN到FNC的转换值。45为MurA到BNC的转换值。(5)文献中必须有均值、标准差或标准误和样本量,若无标准差(SD),仅有标准误(SE),可按照以下公式来转换:
| $ {\text{SD}} = {\text{SE}} \times \sqrt n $ | (3) |
式中,n为重复次数。(6)为确保Meta分析的独立性,若多次测量氨基糖,则使用最终测量值。
本文直接获取表格数据,用Engauge Digitizer 12.1(https://digitizer.sourceforge.net)软件来提取图片数据,使用Excel 2019处理数据。根据增温幅度(≤2 ℃和 > 2 ℃)、实验持续时间(≤5 a和 > 5 a)、生态系统类型(森林、草地和农田)及采样土壤深度(表土和底土)4个因素对测量结果进行分类,最终共筛选出10篇符合要求的文献(表 1)。(截至2024年2月)
|
|
表 1 数据分析所用文献 Table 1 The list of references associated with data analysis |
本文使用自然对数响应比(lnRR)[24]来评估增温对土壤微生物残体的影响大小。
| $ {\text{lnRR}} = \ln ({X_e}/{X_c}) = \ln {X_e} - {X_c} $ | (4) |
式中,lnRR为效应值,Xe为增温组的平均值,Xc为对照组的平均值。lnRR方差(v)计算公式为:
| $ v = \frac{{S_e^2}}{{{n_e}X_e^2}} + \frac{{S_c^2}}{{{n_c}X_c^2}} $ | (5) |
式中,Se和Sc表示增温组和对照组的标准差,ne和nc表示增温组和对照组的样本量。各测量值的权重因子Wij计算公式为:
| $ {W_{ij}} = 1/v $ | (6) |
加权响应比RR++计算公式为:
| $ {\text{R}}{{\text{R}}_{ + + }} = \frac{{\sum\nolimits_{i = 1}^m {\sum\nolimits_{j = 1}^{ni} {{W_{ij}}\ln {\text{R}}{{\text{R}}_{ij}}} } }}{{\sum\nolimits_{i = 1}^m {\sum\nolimits_{j = 1}^{ni} {{W_{ij}}} } }} $ | (7) |
加权平均响应S(RR++)计算公式为:
| $ {\text{S}}\left( {{\text{R}}{{\text{R}}_{ + + }}} \right) = \sqrt {\frac{1}{{\sum\nolimits_{i = 1}^m {\sum\nolimits_{j = 1}^{ni} {{W_{ij}}} } }}} $ | (8) |
95%置信区间95%CI计算公式为:
| $ 95{\text{%CI}} = R{R_{ + + }} \pm 1.96{\text{S}}({\text{R}}{{\text{R}}_{ + + }}) $ | (9) |
式中,i=1,2,3,…,m;j=1,2,3,…,n,m为组数,n为各组的总比较对数。当RR++ > 0时为正效应,当RR++ < 0时为负效应。95%CI包含0时,说明增温组与对照组差异不显著(P≥0.05),95%CI与0不相交且均大于0时,说明增温有显著的正效应(P < 0.05),反之则说明增温有显著的负效应(P < 0.05)。本文使用Metawin 3进行分类分析,将总异质性(Qt)分为组间异质性(Qb)和组内异质性(Qw),以确定不同分类中变量对增温的差异性,若P值小于0.05,则表示变量类别间的效应大小具有显著的异质性。使用IBM SPSS Statistics 27对微生物源碳效应值与主要影响因子进行相关性分析。使用OriginPro 2021绘制不同土壤微生物源碳效应值对增温的响应。
2 结果 2.1 表层和底层土壤微生物残体积累对增温的响应整体而言,增温会促进表层和底层土壤中微生物残体的积累数量,但不同土层间的响应幅度有所不同(图 1a)。表层土壤微生物残体碳(Microbial Necromass Carbon,MNC)的增加幅度(14.3%)高于底层土壤(2.9%)。增温对FNC的积累具有显著的正效应,尤其对表层FNC的促进作用更明显(表层7.9%,底层3.5%),表明真菌对升温的响应更为敏感。增温对表层土壤中BNC的积累没有显著影响,但显著增加底层BNC的积累数量(1.9%)。
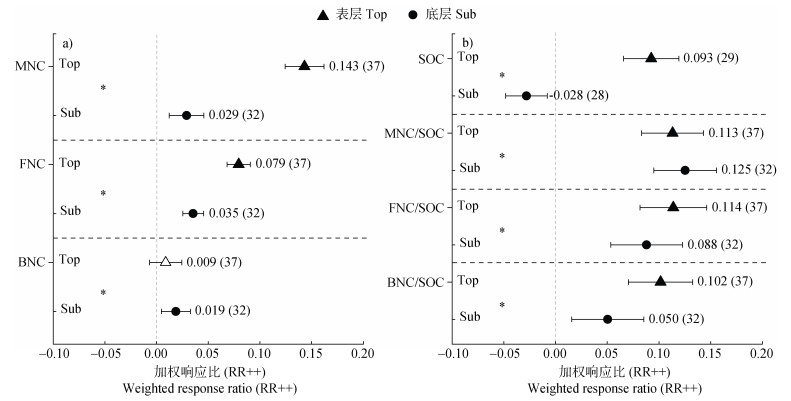
|
注:若95%置信区间(CI)与横坐标0不重叠,表明变量在0.05水平上显著,用实心表示,反之用空心表示。CI右侧数字表示加权响应比,括号内数字表示样本量。“*”表示不同分类间具有显著异质性。Top:表土;Sub:底土;MNC:微生物残体碳;SOC:土壤有机碳;BNC/SOC:细菌残体碳与土壤有机碳占比;FNC/SOC:真菌残体碳与土壤有机碳占比;MNC/SOC:微生物残体碳与土壤有机碳占比。下同。 Note: If the 95% confidence interval(CI)did not overlap with 0, it indicates that it is significant at the level of 0.05, which is expressed by a solid core, and vice versa by a hollow. The number on the right side of the CI represents the weighted response ratio, and the number in parentheses represents the sample size. "*" indicates significant heterogeneity between different classes. Top: topsoil; Sub: subsoil; MNC: microbial necromass carbon; SOC: soil organic carbon; BNC/SOC: bacterial necromass carbon to SOC; FNC/SOC: fungal necromass carbon to SOC; MNC/SOC: microbial necromass carbon to SOC. The same below. 图 1 增温对不同土层微生物残体碳的影响(a)及其对SOC的贡献(b) Fig. 1 Effect of warming conditions on microbial necromass carbon in different soil layers(a)and its contribution to SOC(b) |
增温对表层和底层SOC库的影响不同(图 1b),表现为表层SOC显著增加(9.3%),而底层SOC显著降低(-2.8%)。增温背景下,微生物残体对碳库的贡献比例与单位土壤重量微生物残体的积累数量变化特征有所不同。整体上,增温显著增加表层和底层土壤中MNC对有机碳库的贡献比例,但不同土层之间的响应程度不同。其中增温对底层土壤MNC占SOC比例的促进效应(12.5%)高于表层土壤(11.3%)。真细菌残体对SOC贡献比例的变化也表现为随增温有不同程度的增加。在表层土壤中,FNC和BNC对SOC的贡献分别较底层土壤高2.6%、5.2%;在底层土壤中,增温对FNC占有机碳的贡献比例的促进作用要高于BNC。
2.2 不同生态系统中表层和底层土壤微生物残体积累对增温的响应在不同的生态系统中,增温对表层和底层土壤微生物残体积累的影响效应具有生态系统特异性(图 2)。具体而言,在森林生态系统中,增温对表层和底层土壤残体积累均有显著的促进作用,而且对底层土壤的促进作用高于表层土壤。在草地生态系统中,表层MNC在增温条件下显著累积(13.4%),而底层土壤中则无显著变化。增温显著促进FNC在各土层中的积累,且表层的响应(7.3%)大于底层土壤(2.9%),BNC在增温条件下并无显著变化。在农田生态系统中,增温显著提升了表层土壤微生物残体的积累数量,MNC、FNC和BNC分别增加17.6%、27.1%和17.7%。在表层土壤中,农田相较于森林和草地生态系统具有MNC及组分积累量的相对优势;而森林中底层MNC、FNC和BNC积累量显著高于草地和农田生态系统(图 2a)。
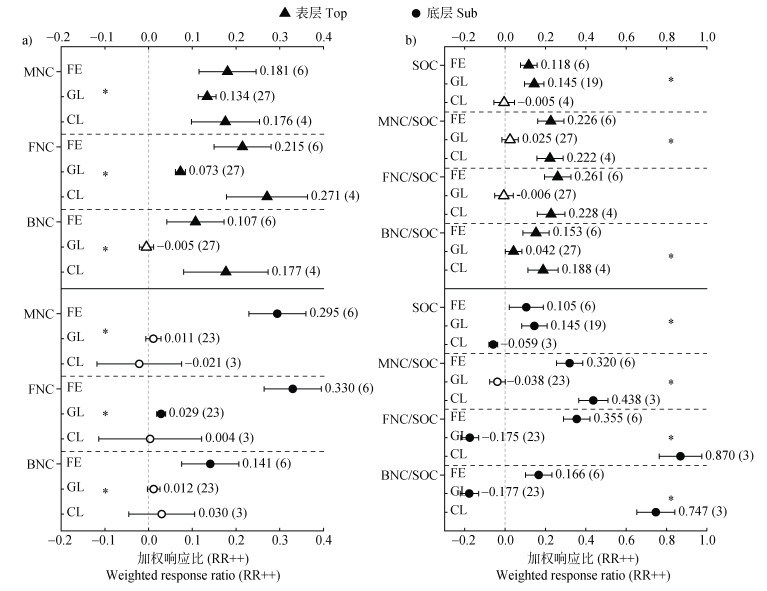
|
注:FE:森林;GL:草地;CL:农田。Note:FE:forest;GL:grassland;CL:cropland. 图 2 生态系统对不同土层微生物残体碳的影响(a)及其对SOC的贡献(b) Fig. 2 Effects of ecosystems on microbial necromass carbon in different soil layers(a)and its contribution to SOC(b) |
增温对森林和草地生态系统各土层SOC的固持有显著正效应,而农田生态系统则相反(图 2b)。在森林生态系统中,增温促进MNC在不同土层中对SOC的占比,且底土大于表土。与BNC相比,FNC对SOC的贡献比例更大,其在表层和底层土壤中分别为26.1%、35.5%。在草地生态系统中,增温显著削弱底层土壤中FNC和BNC对SOC的贡献,分别减少17.5%、17.7%。在农田生态系统中,由于SOC数量的下降,使残体占SOC的比例有所增加,且底层土壤中的MNC的贡献显著高于表层土壤。
2.3 表层和底层土壤微生物残体积累对增温幅度和增温年限的响应不同增温幅度下土壤微生物残体的积累不同,且与所在土层密切相关(图 3a)。与较高的增温幅度(> 2 ℃)相比,较低的增温幅度(≤2 ℃)对表层土壤MNC积累的促进作用更明显(前者增加10.9%,后者为17.2%),尤其是FNC,而BNC无明显变化。在底层土壤中,> 2 ℃的增温对MNC积累的促进作用更大(3.8% > 2.7%),主要是促进FNC的积累。≤2 ℃的增温促进底层BNC的积累(2.5%),> 2 ℃的增温则没有引起BNC的显著变化。
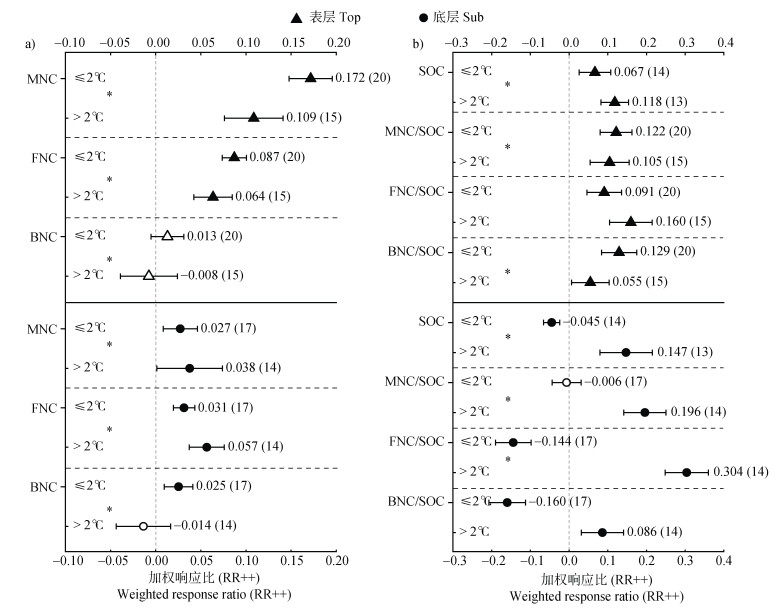
|
图 3 增温幅度对不同土层微生物残体碳的影响(a)及其对SOC的贡献(b) Fig. 3 Effect of warming amplitude on microbial necromass carbon in different soil layers(a)and its contribution to SOC(b) |
增温幅度会显著影响不同土层SOC的积累及MNC对SOC的贡献比例(图 3b)。≤2 ℃的增温会促进表层SOC的积累(6.7%),而降低底层SOC的积累(–4.5%)。> 2 ℃的增温对表层和底层SOC积累均有明显的促进作用。不同土层中SOC和残体积累对增温幅度的非同步响应,使残体占SOC的比例也有明显的土层差异。在表层土壤中,不同幅度的增温均促进MNC对SOC的贡献,但对FNC和BNC占SOC比例的影响有所不同。当增温幅度≤2 ℃时,增温主要提高表层BNC在SOC中的比例(12.9%);而 > 2 ℃时,主要增加表层FNC对有机碳库的贡献(16%)。在底层土壤中,整体表现为低增温幅度对MNC及组分占SOC的贡献比例为负效应;而高增温幅度对真细菌残体及总残体占SOC的比例有明显的正效应,尤其是FNC对SOC的贡献更大(30.4%)(图 3b)。
本文将各研究的增温年限划分为短期增温(≤5 a)和长期增温(> 5 a),结果表明增温年限对表层和底层土壤MNC积累的影响不同(图 4a)。长期增温相较于短期增温更为显著地促进MNC积累,且这一增幅在表层土壤更明显。不同土层中真细菌残体对增温时间尺度的响应也有显著差异(图 4a)。具体表现为:表层土壤中,短期增温显著促进FNC(8.1%)和BNC(9.5%)的积累,随着增温年限的增加,仅FNC仍有正积累效应(8.0%);底层土壤中,短期增温促进FNC积累,但长期增温使FNC的积累效应从4.3%减弱到3.4%,而BNC在底层土壤中的积累有所增加(2.1%)。
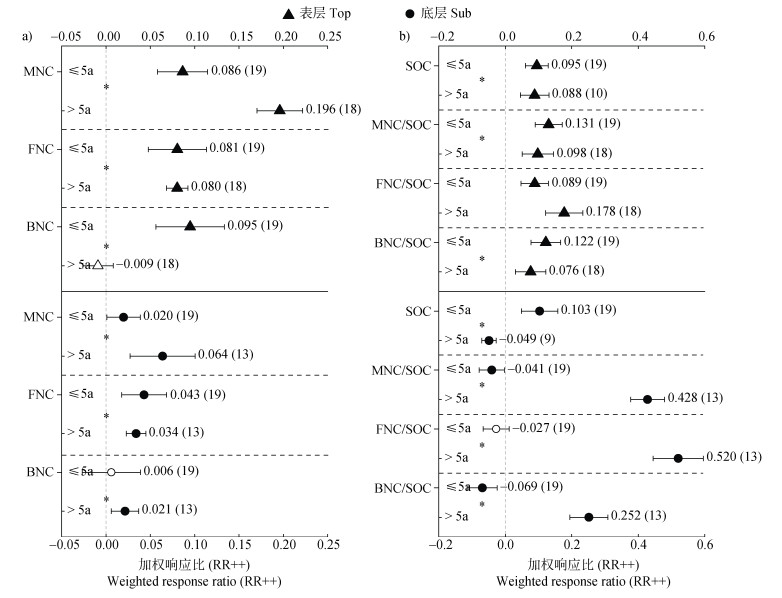
|
图 4 增温年限对不同土层微生物残体碳的影响(a)及其对SOC的贡献(b) Fig. 4 Effect of warming years on microbial necromass carbon in different soil layers(a)and its contribution to SOC(b) |
增温年限对SOC在不同土层中的累积量有显著影响(图 4b)。短期增温显著促进表层(9.5%)和底层土壤(10.3%)中SOC累积,而长期增温对不同土层SOC含量的作用相反,其中显著削弱底层SOC(–4.9%)。表层土壤中,不同增温年限均促进MNC对SOC的贡献,但各增温年限对真细菌残体在SOC中占比的影响不同。短期增温主要提升表层BNC在SOC中的比例(12.2%);而长期增温主要增加表层FNC对有机碳库的贡献比例(17.8%)。底层土壤中,短期增温虽促进SOC积累,但对MNC、FNC和BNC占SOC的比例表现为负效应;而长期增温对MNC占SOC比例的影响表现为显著正效应,其中FNC对SOC的贡献最大(52.0%)。
2.4 表层和底层土壤微生物残体积累与主要影响因子的相关性分别将表层和底层土壤中微生物残体与土壤基本理化指标进行相关性分析(表 2,表 3),结果表明表层和底层土壤中影响残体积累的因素不同。表层土壤MNC与微生物生物量(MBC)呈显著正相关(r=0.78,P=0.02)。FNC与铵态氮(NH4+-N)、土壤含水量(SM)和MBC存在正相关关系(r=0.79,P=0.04;r=0.59,P=0.04;r=0.79,P=0.02),与硝态氮(NO3–-N)呈显著负相关(r=–0.82,P=0.03)。BNC与生物和非生物因子均不存在相关(P≥0.05)。此外,MNC与SOC、全氮(TN)、pH相关关系不显著(P≥0.05)。底层土壤微生物残体与土壤理化指标之间的相关性与表层土壤类似,但统计上未达显著水平。
|
|
表 2 表土微生物残体与生物和非生物因子的相关性 Table 2 Correlation between topsoil microbial-derived carbon with biotic and abiotic factors |
|
|
表 3 底土微生物残体与生物和非生物因子的相关性 Table 3 Correlation between subsoil microbial-derived carbon with biotic and abiotic factors |
本研究采用Meta分析法,综合分析增温对表层和底层土壤微生物残体积累及其对有机碳库贡献的影响,证实增温能够不同程度促进微生物残体的积累,且对表层土壤MNC的促进作用更明显(图 1a)。这可能与增温背景下表层和底层土壤中植物来源碳输入的差异和剖面土壤微生物性质的差异有关[9-10]。增温通常会促进地上和地下植物碳的输入[11],而表层土壤具有持续接受大量植物碳输入和较高微生物活性的特点[32],因而增温使表层土壤中的微生物能更有效地利用的植物凋落物和根系分泌物,加速代谢过程,从而提高同化代谢产物的积累速率[33]。与表层不同,底层土壤微生物更易受基质限制处于“碳饥饿”状态,因能量不足而休眠[20]。气候变暖会增加植物根系来源碳(根系生物量、分泌物及根际沉积物)向土壤的输送,并促进根系向底层土壤生长[34]。这种外源碳输入的增加不仅可能激活底层“碳受限”的微生物[35],提升其代谢活性来促进MNC在底层土壤积累[17],还可能会“唤醒”底层原来处于休眠状态的微生物,加剧微生物和植物间的养分竞争,尤其是氮素限制[36]。而在养分受限条件下,微生物更倾向于将碳源用于分解代谢而非合成代谢,从而减少MNC的生成数量[37],最终影响底层土壤MNC的积累量。此外,增温对FNC的正效应大于BNC,尤其是在表层土壤中(图 1a)。在表层土壤中,新增的植物碳输入为真菌的代谢与周转提供了有利条件,进而促进FNC积累[38]。而在深层土壤中,由于细菌兼性厌氧的特性,微生物群落结构逐渐转向以细菌为主导[39]。本研究结果说明气候变化通过调节植物源碳输入,直接或间接调节表层和深层土壤中微生物残体的积累与转化,也进一步表明在评价气候变化对微生物介导土壤有机碳积累过程的影响时,需要区分表层和底层土壤的非同步响应特性。
整合结果表明,增温背景下微生物残体对不同土层有机碳库的贡献比较均有显著增加,其中表层土壤中残体积累与有机碳库积累的同步增加,表明气候变化背景下以微生物残体为代表的微生物源有机碳对陆地生态系统SOC截获的贡献不容忽视。同时,底层土壤中MNC占有机碳的比例增加可能与底层SOC的显著下降有关(图 1b)。这说明底层SOC对气候变化具有高度敏感性和脆弱性[40],也意味着气候变暖背景下MNC在维持深层SOC截获过程中的重要性。MNC对底层SOC贡献的增加还可能与碳源输入增加后微生物合成代谢作用加强有关。同时,由于MNC易积聚在黏土矿物表面,所以另一个可能的原因是底土中的矿物和铁铝氧化物对微生物来源碳的保护作用[41]。此外,增温背景下,FNC对SOC的贡献在表层和底层土壤中均超过BNC(图 1b)。这可能是由于真菌细胞壁较细菌更具顽固性使得FNC较BNC更稳定,且真菌可利用菌丝促使土壤团聚体的形成[42]。与FNC相比,微生物更倾向利用碳氮比偏低的BNC提供更为丰富的氮资源[43],因而FNC在SOC长期截获过程中具有重要意义。这种变化也可能与增温会诱导微生物群落结构的改变有关[44]。以上结果说明气候变化会影响土壤有机碳库的库容和组成,也使不同微生物来源碳的相对贡献发生变化,这将会对土壤碳库功能产生深刻影响。
不同生态系统中,增温对微生物残体在表层和底层土壤中积累模式的影响不同。在森林生态系统中,增温主要促进微生物残体在底层土壤积累。而草地和农田生态系统则表现为残体碳在表层土壤中的积累更多(图 2a)。这可能是因为与草和农作物相比,森林树木的根系能够深入底层土壤,增温促使其产生更多根系分泌物和生物量为底层土壤微生物提供植物源碳[45],促进微生物合成代谢,使残体积累。同时,底层土壤由于粒径较小,易形成需要较大能量才能破坏的小团聚体结构,这种结构利于微生物栖息与残体长期保存[46]。相比之下,增温能提高草地表层土壤的溶解性有机碳和养分的可利用性,使土壤有效养分随着土壤深度减少,表层较多的营养物质加速微生物生物量周转,导致表层土壤中的残体含量较底层更多[41]。而在农田生态系统中,添加的肥料等有机物大多集中于表层土壤,会影响微生物在土壤各层的分布和活性[47]。值得注意的是,除了农田生态系统外,森林和草地生态系统的SOC积累均因增温而得到促进(图 2b)。尽管有文献[48]指出,农田土壤在温度上升时,其有机碳含量有所提升。但亦有研究[49]表明增温可能加速农田SOC的矿化,其碳库的增长主要依靠农作物产量增加带来的外源碳输入增加[50]。鉴于本文中农田生态系统的样本量有限,可能不足以全面揭示增温对其SOC含量的具体影响。在增温条件下,所有生态系统中MNC对SOC的贡献在表层土壤中均呈正效应。其中森林和农田生态系统中MNC对SOC的贡献随着土壤深度增加(图 2b),这可能与森林底层土壤的微生物周转率较高或微生物被选择性保存为有机矿物复合体有关[51]。而农田生态系统中微生物残体对SOC贡献比例的增加主要是增温诱导了底层SOC损失加剧。以上结果表明增温会诱导不同生态系统中微生物残体的差异性响应,进而影响微生物介导的土壤有机碳积累和稳定过程,因此在探究气候变化对陆地生态系统土壤碳循环和转化过程的影响时要考虑生态系统的特异性及其深度依赖性。
3.2 表层和底层土壤微生物残体对不同增温幅度和增温年限的响应及主要影响因素分析本研究发现,增温幅度显著影响不同土层微生物残体积累及其对有机碳库的贡献。无论是低幅度增温(≤2 ℃)还是高幅度增温(> 2 ℃)均显著促进了表层土壤MNC的积累,而≤2 ℃的增温对表层土壤微生物残体碳积累的效果更为显著(图 3a)。说明低增温幅度会促进微生物合成代谢,使微生物生物量增加[52],导致细胞残体的积累量有所增加。这与表层土壤中微生物残体与活体微生物量呈显著正相关的结果一致,意味着增温可加速微生物群落的生长、繁殖以及死亡这一迭代过程,使MNC不断产生并逐渐在土壤中积累[53]。然而,随着增温幅度的增加(> 2 ℃),增温对残体积累的正效应有所减弱。这可能与较高的增温背景下,表层土壤水分容易散失,引起土壤干旱或者热胁迫,使微生物的生长受限[54],进而削弱MNC的合成和积累过程,尤其是FNC。这与相关分析中FNC效应值与土壤含水量呈显著正相关的结果一致。与表层土壤相反,> 2 ℃的增温能促进底层土壤MNC积累,尤其是FNC(图 3a)。表层和底层土壤中微生物残体的这种差异性响应可能与土壤厚度和结构对温度变化的敏感性不同有关。在气候变化背景下,受土壤热传导率和土壤厚度等因素的交互影响,底层土壤的温度变动相较于表层土壤呈现出一定的滞后效应[55]。FNC在表层和底层土壤中的显著积累,说明真菌对环境温度变化有较强的适应性[56]。鉴于表层土壤含氧量高,能促进微生物活性,使稳定性不如FNC的BNC在表层土壤更易分解[21]。另一方面,细菌的耐热性不及真菌,且更喜厌氧环境[39],因此在低增温幅度条件下,底层土壤的温度变化较为温和,该环境下BNC才有所积累。值得注意的是,不同增温幅度会引起表层和底层微生物残体对有机碳贡献的非同步性变化。表层土壤中增温对残体占SOC的比例影响均表现为正效应;而底层土壤中,> 2 ℃的增温增加残体对有机碳库的贡献,低幅度增温的响应与之相反(图 3b)。以上结果说明,未来气候增温幅度的大小会显著影响不同土层微生物介导的土壤碳截获过程。因此,评价气候变化背景下,微生物碳泵对SOC贡献需要同时考虑表层和底层土壤的非同步响应。
通过整合分析发现,增温年限对表层和底层土壤微生物残体积累的影响强度不同。随着增温时间的延长,表层MNC积累显著增加,而对BNC的正效应逐渐减弱;在底层土壤中,MNC和BNC均随着增温时间的延长而增加(图 4a)。该现象与Bai等[57]的研究结果相同,这可能与细菌对长时间增温表现出的适应性有关,这种适应性可提升细菌群落的多样性,进而促进BNC累积。此外,无论是短期还是长期增温,均对表层SOC的积累产生了积极的促进作用(图 4b)。这与Zhang等[58]基于广岛超过10年的土壤增温显著提升表层SOC含量相吻合。有趣的是,短期和长期增温均显著促进表层土壤MNC对SOC的贡献,而在底层土壤中,短期增温减少MNC对SOC的贡献,长期增温显著增加该贡献(图 4b)。这与不同增温年限引起底层SOC含量变化密切相关。短期增温时,底层SOC的积累速度快于微生物残体形成和积累速度,其主要是植物源碳的贡献[16]。而长期增温或将耗尽不稳定碳库[55],迫使微生物转向分解和利用原有更稳定的碳库来维持其生长与繁殖,这将导致底层SOC损失,残体碳作为较稳定的有机碳组分逐渐积累,并在SOC总量中的贡献比例增大。因此,从时间尺度来看,短期增温以植物源碳为主,长期增温则因微生物活动模式的转变,使微生物残体碳的贡献逐渐增强。尽管底层土壤中微生物残体对有机碳的贡献随着增温年限有增加的趋势,但总有机碳库显著下降,说明底层土壤对气候变化的敏感性更大[19]。表层和底层土壤之间碳库和残体积累特征的变化,充分说明底土微生物残体对气候变化的响应规律和影响因素与表土不同[37]。因此,在气候变暖背景下,底层土壤微生物残体作为碳循环的重要参与者,其贡献不容忽视,为更好地理解和预测未来气候变化下微生物介导的土壤有机碳转化过程及其环境响应策略,未来研究应更加关注不同土壤深度中微生物残体的响应性差异及内在驱动机制。
4 结论整体上,增温能不同程度地促进微生物残体在表土和底土中的积累,但增温对表层MNC积累的正效应大于底层土壤,且不同微生物来源残体(FNC和BNC)对增温的响应方向和强度有明显的土层差异。同时,增温会引起不同土层MNC及其对SOC贡献比例的非同步性响应,尽管增温能更大程度地促进MNC在表层土壤中积累,但MNC对SOC的贡献比例却为底层土壤的增加幅度大于表层。伴随增温后底层SOC的显著下降,本研究结果暗示底层土壤碳库对温度升高的敏感性高于表层土壤,也反应增温背景下微生物来源有机碳组分在维持底层SOC固持中的作用会进一步加强。此外,增温对不同土层MNC积累的影响与增温幅度和增温年限密切相关,且具有明显的生态系统特异性。需要指出的是,目前关于增温背景下同时探究表层和深层土壤微生物残体对气候变化响应规律的研究有限,这在一定程度上限制了本文所用文献的数量和数据的提取范围。因此,在探究未来气候变化背景下微生物介导的土壤固碳过程和机制时,需要考虑土层深度的依赖性及生态系统的特异性。
| [1] |
Doblas-Reyes F J, Sörensson A A, Almazroui M, et al. Linking global to regional climate change[M]// MassonDelmotte V P, Zhai P, Pirani S L, et al. IPCC, 2021: Summary for policymakers. New York, USA: Cambridge University Press, 2021: 1363—1512.
(  0) 0) |
| [2] |
Crowther T W, Todd-Brown K E O, Rowe C W, et al. Quantifying global soil carbon losses in response to warming[J]. Nature, 2016, 540(7631): 104-108. DOI:10.1038/nature20150
(  0) 0) |
| [3] |
Luo Z K, Luo Y Q, Wang G C, et al. Warming-induced global soil carbon loss attenuated by downward carbon movement[J]. Global Change Biology, 2020, 26(12): 7242-7254. DOI:10.1111/gcb.15370
(  0) 0) |
| [4] |
Ge T D, Luo Y, He X H. Quantitative and mechanistic insights into the key process in the rhizodeposited carbon stabilization, transformation and utilization of carbon, nitrogen and phosphorus in paddy soil[J]. Plant and Soil, 2019, 445(1/2): 1-5.
(  0) 0) |
| [5] |
Miltner A, Bombach P, Schmidt-Brücken B, et al. SOM genesis: Microbial biomass as a significant source[J]. Biogeochemistry, 2012, 111(1): 41-55.
(  0) 0) |
| [6] |
Simpson A J, Simpson M J, Smith E, et al. Microbially derived inputs to soil organic matter: Are current estimates too low?[J]. Environmental Science & Technology, 2007, 41(23): 8070-8076.
(  0) 0) |
| [7] |
Liang C, Amelung W, Lehmann J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology, 2019, 25(11): 3578-3590. DOI:10.1111/gcb.14781
(  0) 0) |
| [8] |
Song W J, Liang Y Z, Tao Z, et al. Advances on soil organic carbon dynamics mediated by microorganisms (In Chinese)[J]. Advances in Earth Science, 2023, 38(12): 1213-1223. [宋文婕, 梁誉正, 陶贞, 等. 微生物介导的土壤有机碳动态研究进展[J]. 地球科学进展, 2023, 38(12): 1213-1223.]
(  0) 0) |
| [9] |
Wang B R, An S S, Liang C, et al. Microbial necromass as the source of soil organic carbon in global ecosystems[J]. Soil Biology & Biochemistry, 2021, 162: 108422.
(  0) 0) |
| [10] |
Xu X, Shi Z, Li D J, et al. Plant community structure regulates responses of prairie soil respiration to decadal experimental warming[J]. Global Change Biology, 2015, 21(10): 3846-3853. DOI:10.1111/gcb.12940
(  0) 0) |
| [11] |
Mou Z J, Kuang L H, Zhang J, et al. Nutrient availability and stoichiometry mediate microbial effects on soil carbon sequestration in tropical forests[J]. Soil Biology & Biochemistry, 2023, 186: 109186.
(  0) 0) |
| [12] |
Jia J, Feng X J, He J S, et al. Comparing microbial carbon sequestration and priming in the subsoil versus topsoil of a Qinghai-Tibetan alpine grassland[J]. Soil Biology & Biochemistry, 2017, 104: 141-151.
(  0) 0) |
| [13] |
Zeng X M, Feng J, Yu D L, et al. Local temperature increases reduce soil microbial residues and carbon stocks[J]. Global Change Biology, 2022, 28(21): 6433-6445. DOI:10.1111/gcb.16347
(  0) 0) |
| [14] |
Liang C, Gutknecht J L M, Balser T C. Microbial lipid and amino sugar responses to long-term simulated global environmental changes in a California annual grassland[J]. Frontiers in Microbiology, 2015, 6: 385.
(  0) 0) |
| [15] |
Ding X L, Chen S Y, Zhang B, et al. Warming yields distinct accumulation patterns of microbial residues in dry and wet alpine grasslands on the Qinghai-Tibetan Plateau[J]. Biology and Fertility of Soils, 2020, 56(7): 881-892. DOI:10.1007/s00374-020-01474-9
(  0) 0) |
| [16] |
Han H, Li C J, Liu R, et al. Warming promotes accumulation of microbial- and plant-derived carbon in terrestrial ecosystems[J]. Science of the Total Environment, 2023, 905: 166977. DOI:10.1016/j.scitotenv.2023.166977
(  0) 0) |
| [17] |
He M, Fang K, Chen L Y, et al. Depth-dependent drivers of soil microbial necromass carbon across Tibetan alpine grasslands[J]. Global Change Biology, 2022, 28(3): 936-949. DOI:10.1111/gcb.15969
(  0) 0) |
| [18] |
Rumpel C, Chabbi A, Marschner B. Carbon storage and sequestration in subsoil horizons: Knowledge, gaps and potentials[M]//Lal R, Lorenz K, Hüttl R F, et al. Recarbonization of the biosphere. Dordrecht: Springer Netherlands, 2012: 445—464.
(  0) 0) |
| [19] |
Zosso C U, Ofiti N O E, Torn M S, et al. Rapid loss of complex polymers and pyrogenic carbon in subsoils under whole-soil warming[J]. Nature Geoscience, 2023, 16(4): 344-348. DOI:10.1038/s41561-023-01142-1
(  0) 0) |
| [20] |
Button E S, Pett-Ridge J, Murphy D V, et al. Deep-C storage: Biological, chemical and physical strategies to enhance carbon stocks in agricultural subsoils[J]. Soil Biology & Biochemistry, 2022, 170: 108697.
(  0) 0) |
| [21] |
Cai M K, Zhao G, Zhao B, et al. Climate warming alters the relative importance of plant root and microbial community in regulating the accumulation of soil microbial necromass carbon in a Tibetan alpine meadow[J]. Global Change Biology, 2023, 29(11): 3193-3204. DOI:10.1111/gcb.16660
(  0) 0) |
| [22] |
Liu X F, Tian Y, Heinzle J, et al. Long-term soil warming decreases soil microbial necromass carbon by adversely affecting its production and decomposition[J]. Global Change Biology, 2024, 30(6): e17379. DOI:10.1111/gcb.17379
(  0) 0) |
| [23] |
Cheng L, Zhang N F, Yuan M T, et al. Warming enhances old organic carbon decomposition through altering functional microbial communities[J]. The ISME Journal, 2017, 11(8): 1825-1835. DOI:10.1038/ismej.2017.48
(  0) 0) |
| [24] |
Hedges L V, Gurevitch J, Curtis P S. The meta-analysis of response ratios in experimental ecology[J]. Ecology, 1999, 80(4): 1150-1156. DOI:10.1890/0012-9658(1999)080[1150:TMAORR]2.0.CO;2
(  0) 0) |
| [25] |
Chang R Y, Liu S G, Chen L Y, et al. Soil organic carbon becomes newer under warming at a permafrost site on the Tibetan Plateau[J]. Soil Biology & Biochemistry, 2021, 152: 108074.
(  0) 0) |
| [26] |
Zhu E X, Cao Z J, Jia J, et al. Inactive and inefficient: Warming and drought effect on microbial carbon processing in alpine grassland at depth[J]. Global Change Biology, 2021, 27(10): 2241-2253. DOI:10.1111/gcb.15541
(  0) 0) |
| [27] |
Ding X L, Chen S Y, Zhang B, et al. Warming increases microbial residue contribution to soil organic carbon in an alpine meadow[J]. Soil Biology & Biochemistry, 2019, 135: 13-19.
(  0) 0) |
| [28] |
Chong B Y. Effects of warming and fencing on soil organic carbon components in alpine grassland[D]. Lanzhou: Lanzhou Jiatong University, 2023.[种碧莹. 增温和围栏封育对高寒草原土壤有机碳组分的影响[D]. 兰州: 兰州交通大学, 2023.]
(  0) 0) |
| [29] |
Ma L X, Ju Z Q, Fang Y Y, et al. Soil warming and nitrogen addition facilitates lignin and microbial residues accrual in temperate agroecosystems[J]. Soil Biology & Biochemistry, 2022, 170: 108693.
(  0) 0) |
| [30] |
Xu W H. Effects of warming on surface and deep soil organic carbon components of Chinese fir plantations[D]. Hefei: Anhui Agricultural University, 2023.[胥文昊. 增温对杉木人工林表层和深层土壤有机碳组分的影响[D]. 合肥: 安徽农业大学, 2023.]
(  0) 0) |
| [31] |
Li Y. Effects of warming and nitrogen deposition onsoil amino sugar and lignin of Cunninghamia lanceolata in mid-subtropical[D]. Fuzhou: Fujian Normal University, 2019.[李艳. 增温和氮沉降对中亚热带杉木林土壤氨基糖和木质素的影响[D]. 福州: 福建师范大学, 2019.]
(  0) 0) |
| [32] |
Qian Z Y, Li Y N, Du H, et al. Increasing plant species diversity enhances microbial necromass carbon content but does not alter its contribution to soil organic carbon pool in a subtropical forest[J]. Soil Biology & Biochemistry, 2023, 187: 109183.
(  0) 0) |
| [33] |
Jiang J, Song M H. Review of the roles of plants and soil microorganisms in regulating ecosystem nutrient cycling (In Chinese)[J]. Chinese Journal of Plant Ecology, 2010, 34(8): 979-988. [蒋婧, 宋明华. 植物与土壤微生物在调控生态系统养分循环中的作用[J]. 植物生态学报, 2010, 34(8): 979-988.]
(  0) 0) |
| [34] |
Liu Z W, Liu X X, Wu X L, et al. Long-term elevated CO2 and warming enhance microbial necromass carbon accumulation in a paddy soil[J]. Biology and Fertility of Soils, 2021, 57(5): 673-684. DOI:10.1007/s00374-021-01557-1
(  0) 0) |
| [35] |
Fontaine S, Barot S, Barré P, et al. Stability of organic carbon in deep soil layers controlled by fresh carbon supply[J]. Nature, 2007, 450(7167): 277-280. DOI:10.1038/nature06275
(  0) 0) |
| [36] |
Qin S P, Yuan H J, Hu C S, et al. Anthropogenic N input increases global warming potential by awakening the "sleeping" ancient C in deep critical zones[J]. Science Advances, 2023, 9(6): eadd0041. DOI:10.1126/sciadv.add0041
(  0) 0) |
| [37] |
Cui J, Zhu Z K, Xu X L, et al. Carbon and nitrogen recycling from microbial necromass to cope with C: N stoichiometric imbalance by priming[J]. Soil Biology & Biochemistry, 2020, 142: 107720.
(  0) 0) |
| [38] |
Feng J G, He K Y, Zhang Q F, et al. Changes in plant inputs alter soil carbon and microbial communities in forest ecosystems[J]. Global Change Biology, 2022, 28(10): 3426-3440. DOI:10.1111/gcb.16107
(  0) 0) |
| [39] |
de Vries F T, Shade A. Controls on soil microbial community stability under climate change[J]. Frontiers in Microbiology, 2013, 4: 265.
(  0) 0) |
| [40] |
Chen J, Luo Y Q, Sinsabaugh R L. Subsoil carbon loss[J]. Nature Geoscience, 2023, 16: 284-285. DOI:10.1038/s41561-023-01164-9
(  0) 0) |
| [41] |
Ni X Y, Liao S, Tan S Y, et al. A quantitative assessment of amino sugars in soil profiles[J]. Soil Biology & Biochemistry, 2020, 143: 107762.
(  0) 0) |
| [42] |
Li N, Xu Y Z, Han X Z, et al. Fungi contribute more than bacteria to soil organic matter through necromass accumulation under different agricultural practices during the early pedogenesis of a Mollisol[J]. European Journal of Soil Biology, 2015, 67: 51-58. DOI:10.1016/j.ejsobi.2015.02.002
(  0) 0) |
| [43] |
Sinsabaugh R L, Turner B L, Talbot J M, et al. Stoichiometry of microbial carbon use efficiency in soils[J]. Ecological Monographs, 2016, 86(2): 172-189. DOI:10.1890/15-2110.1
(  0) 0) |
| [44] |
Rijkers R, Rousk J, Aerts R, et al. Optimal growth temperature of Arctic soil bacterial communities increases under experimental warming[J]. Global Change Biology, 2022, 28(20): 6050-6064. DOI:10.1111/gcb.16342
(  0) 0) |
| [45] |
Kwatcho Kengdo S, Peršoh D, Schindlbacher A, et al. Long-term soil warming alters fine root dynamics and morphology, and their ectomycorrhizal fungal community in a temperate forest soil[J]. Global Change Biology, 2022, 28(10): 3441-3458. DOI:10.1111/gcb.16155
(  0) 0) |
| [46] |
Hemingway J D, Rothman D H, Grant K E, et al. Mineral protection regulates long-term global preservation of natural organic carbon[J]. Nature, 2019, 570(7760): 228-231. DOI:10.1038/s41586-019-1280-6
(  0) 0) |
| [47] |
Liu S B, Wang J Y, Pu S Y, et al. Impact of manure on soil biochemical properties: A global synthesis[J]. Science of the Total Environment, 2020, 745: 141003. DOI:10.1016/j.scitotenv.2020.141003
(  0) 0) |
| [48] |
Yan X Y, Cai Z C, Wang S W, et al. Direct measurement of soil organic carbon content change in the croplands of China[J]. Global Change Biology, 2011, 17(3): 1487-1496. DOI:10.1111/j.1365-2486.2010.02286.x
(  0) 0) |
| [49] |
Zhang D D, Zhang J J, Li C L, et al. Effects of experimental warming on organic carbon mineralization and humus composition in farmland soils (In Chinese)[J]. Journal of Jilin Agricultural University, 2019, 41(5): 569-576. [张丹丹, 张晋京, 李翠兰, 等. 模拟增温对农田土壤有机碳矿化及腐殖质组成的影响[J]. 吉林农业大学学报, 2019, 41(5): 569-576.]
(  0) 0) |
| [50] |
Xia L L, Yan X Y, Cai Z C. Research progress and prospect of greenhouse gas mitigation and soil carbon sequestration in croplands of China (In Chinese)[J]. Journal of Agro-Environment Science, 2020, 39(4): 834-841. [夏龙龙, 颜晓元, 蔡祖聪. 我国农田土壤温室气体减排和有机碳固定的研究进展及展望[J]. 农业环境科学学报, 2020, 39(4): 834-841.]
(  0) 0) |
| [51] |
Rumpel C, Kögel-Knabner I. Deep soil organic matter—A key but poorly understood component of terrestrial C cycle[J]. Plant and Soil, 2011, 338(1/2): 143-158.
(  0) 0) |
| [52] |
Hagerty S B, van Groenigen K J, Allison S D, et al. Accelerated microbial turnover but constant growth efficiency with warming in soil[J]. Nature Climate Change, 2014, 4: 903-906. DOI:10.1038/nclimate2361
(  0) 0) |
| [53] |
Liang C, Zhu X F. The soil Microbial Carbon Pump as a new concept for terrestrial carbon sequestration[J]. Science China Earth Sciences, 2021, 64(4): 545-558. DOI:10.1007/s11430-020-9705-9
(  0) 0) |
| [54] |
Bárcenas-moreno G, Gómez-brandón M, Rousk J, et al. Adaptation of soil microbial communities to temperature: Comparison of fungi and bacteria in a laboratory experiment[J]. Global Change Biology, 2009, 15(12): 2950-2957. DOI:10.1111/j.1365-2486.2009.01882.x
(  0) 0) |
| [55] |
Xiao J, Yu F J, Zhu W Y, et al. Comment on "The whole-soil carbon flux in response to warming"[J]. Science, 2018, 359(6378): eaao0218. DOI:10.1126/science.aao0218
(  0) 0) |
| [56] |
Luo Y, Xiao M L, Yuan H Z, et al. Rice rhizodeposition promotes the build-up of organic carbon in soil via fungal necromass[J]. Soil Biology & Biochemistry, 2021, 160: 108345.
(  0) 0) |
| [57] |
Bai T S, Wang P, Qiu Y P, et al. Nitrogen availability mediates soil carbon cycling response to climate warming: A meta-analysis[J]. Global Change Biology, 2023, 29(9): 2608-2626. DOI:10.1111/gcb.16627
(  0) 0) |
| [58] |
Zhang J, Kuang L H, Mou Z J, et al. Ten years of warming increased plant-derived carbon accumulation in an East Asian monsoon forest[J]. Plant and Soil, 2022, 481(1/2): 349-365.
(  0) 0) |
 2026, Vol. 63
2026, Vol. 63


